INTRODUCCIÓN
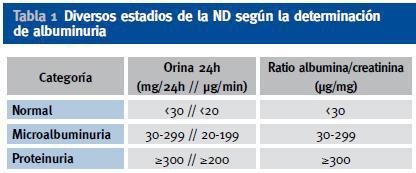
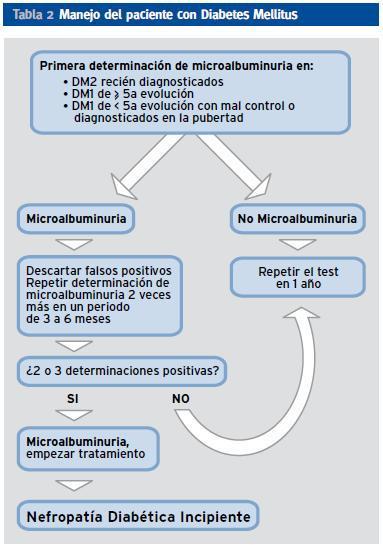
La nefropatía diabética (ND) es una grave complicación que afecta a un tercio de los pacientes con ambos tipos de la diabetes mellitus (DM)1,2,3 aunque afortunadamente se esta reduciendo por la mejoría del tratamiento médico4-6. La ND se presenta en diferentes estadios. Se inicia a los 10-15 años del inicio de la DM, inicialmente con microalbuminuria (MAL) y, si a los 25 años el paciente no presenta proteinuria, posiblemente permanecerá libre de la ND en el futuro1. La evolución de la nefropatía es similar en ambos tipos de DM, especialmente una vez aparecida la proteinuria7. (Tabla 1 y 2)
Un primer aspecto de interés es el hecho que la ND ¿sólo¿ se observa en un tercio de los pacientes con DM, al contrario de lo que ocurre con la DM experimental, existiendo unos factores de riesgo genéticos y/o ambientales que predisponen a su aparición. En este artículo solo comentaremos, por razones obvias, los más relevantes.
ASPECTOS GENÉTICOS
Uno de los factores de riesgo fundamentales de presentar una ND es la susceptibilidad genética8-12. Existen claros ejemplos de agregación familiar o alta prevalencia en determinada razas, pero además la susceptibilidad genética determina tambien la gravedad de la ND. Pero la elección de un gen o genes candidatos es siempre difícil. Así, un aspecto controvertido se produce por ejemplo al estudiar el gen de la ACE. El polimorfismo DD asociado a la presencia de ND no se confirmo en todas las poblaciones14. El problema fundamental de los estudios genéticos está en que precisan un número amplio de pacientes y que existen interacciones entre los diferentes genes candidatos11,12. Es de esperar que en un futuro próximo podamos conocer aquellos pacientes en exceso de riesgo genético para actuar tempranamente y prevenir la complicación renal. Mientras ello no sea posible debemos centrarnos en los factores de riesgo modificables que podemos tratar y prevenir.
CONTROL DE LA GLUCEMIA
El primer aspecto es la hiperglucemia en si misma. No existe, obviamente, ND sin DM. El trasplante de riñones sanos a pacientes con DM reproduce la ND en los riñones trasplantados13 y a la inversa el trasplante de riñones con lesiones diabéticas incipientes a un paciente no diabético normaliza la estructura glomerular14. Asimismo los pacientes con buen control metabólico de su diabetes presentan una prevalencia de ND baja15-19, pero es difícil de explicar el porcentaje no despreciable de sujetos diabéticos con mal control metabólico que no desarrollan ND. Nuevamente necesitaríamos recurrir a los factores genéticos determinantes.20.
La normalización de la glucemia mediante un trasplante exitoso de páncreas reduce la hipertrofia glomerular, la hipertrofia mesangial, lesión glomerular y la albuminuria21. Igualmente el control estricto de la glucemia disminuye la hiperfiltración glomerular, especialmente en pacientes normotensos22,23.
La hiperglucemia provoca numerosas alteraciones responsables de la ND mediante cambios hemodinámicos y activación de péptidos, kinasas, citocinas y factores de crecimiento que provocan una importante alteración de la ultraestructura glomerular con aumento de la permeselectividad del poro de la membrana glomerular y una alteración fenotípica de los podocitos24-28.
CONTROL DE LA TENSIÓN ARTERIAL. SISTEMA RAA
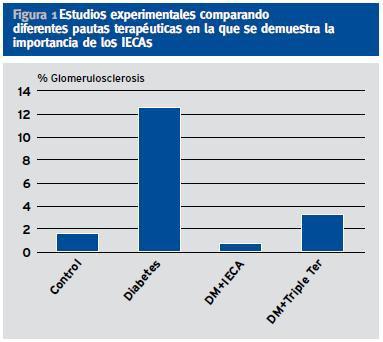
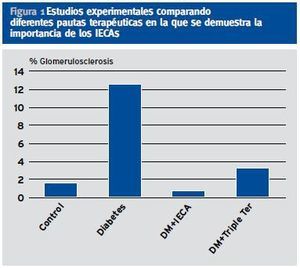
Un segundo factor de riesgo es la presencia de hipertensión arterial sistémica (HTA) y glomerular. El aumento de flujo y la hipertensión glomerular fueron puestos de manifiesto en los años 80 mediante brillantes estudios experimentales20-31, si bien la metodología empleada fue posteriormente criticada basándose en defectos en la detección de la presión arteria (PA) y que las mediciones eran exvivo y puntuales32,33. (Fi gura 1)
En prácticamente todos los estudios clínicos se observa una clara asociación entre el nivel de la PA y la evolución de la ND34,35. Pero desde hace años, importantes estudios demostraron que los fármacos que bloquean el sistema renina angiotensina aldosterona (SRAA) presentan efectos adicionales renoprotectores en pacientes con ND35-41. Estos estudios fueron realizados en pacientes con ND en diferentes estadios evolutivos demostraron que el control de la PA con fármacos que bloquean el SRAA se acompaña de una mayor reducción del riesgo evolutivo (entre el 25 y 40%) que el tratamiento hipotensor convencional. Es importante anotar que siempre existió una diferencia tensional de 2-4 mm de Hg a favor de los tratados con IECA o ARAII. Pero, sin duda y con los conocimientos actuales es obligado introducir estos fármacos en el primer escalón terapéutico.
Recientemente, se han publicado algunos trabajos comparativos entre IECAs y ARA II. En un estudio se comparó el efecto renoprotector del telmisartan y del enalapril en pacientes con DM tipo 2 (estudio DETAIL). Se estudiaron 250 pacientes con DM tipo 2 y ND incipiente definida como MAL (82%) o albuminuria inferior a 1.4 gramos /24 horas. El FG basal era de 93 ml/min por 1,73 m2. Los objetivos principales fueron los cambios en el FG y los secundarios los cambios anuales del FG, la excreción de albuminuria, en la creatinina sérica, PA y eventos cardiovasculares. El seguimiento fue de 5 años. Los resultados demostraron un comportamiento similar de ambos fármacos en relación con el de FG, creatinina sérica y de excreción urinaria de albúmina. Desgraciadamente en este estudio un 33% de los pacientes abandonaron el seguimiento. Mas recientemente se realizó el estudio AMADEO en 850 pacientes con DM tipo 2 y PA > a 120/80 mm de Hg o en tratamiento hipotensor, creatinina < 3 mg o 3,2 según el genero y proteinuria > a 700 mg/g de creatinina. El estudio prospectivo y doble ciego comparo losartan y telmisartan. El objetivo primario fue la valoración de los cambios en la proteinuria, y como objetivos secundarios los cambios en el e-GFR, el cociente sodio/creatinina, duplicar la creatinina sérica, presentar IRC y mortalidad. El telmisartan redujo en mayor medida la proteinuria que el losartan (8% versus 21,4%, p <0,03) sin diferencias significativas de la PA, Sí se observaron diferencias significativas en eventos cardiovasculares a favor del telmisartan si bien el número de episodios fue reducido43.
Últimamente, se ha estudiado el efecto renoprotector en la ND del aliskiren, que es un inhibidor directo de la renina. Se incluyeron 599 pacientes que se trataron con aliskiren y losartan, asociación que redujo un 20% más la proteinuria que el losartan y placebo. En el grupo tratado con akiskiren un 25% de los pacientes redujo la proteinuria en más de un 50%. No hubo diferencias significativas de PA entre ambos grupos44.
Así pués, queda claro la importancia de la utilización de fármacos que bloquean el SRAA, pero conviene insistir en la necesidad de reducir la PA ya que con independencia del fármaco utilizado un mayor descenso de la PA se asoció a una mayor reducción de la proteinuria especialmente en los pacientes con DM tipo145-48. En el UKPDS35 por cada 10 mm de Hg de descenso de la PA sistólica se asoció a una disminución de 12 % de las complicaciones diabéticas, La administración de ARA II en los estudios INDT y RENAAL demostraron efectos similares41,49, aunque quizás el descenso de la PAS < 120 mm Hg se siguió de un aumento de mortalidad por otras causas49. Otro aspecto relevante es que el descenso de más del 50% de la albuminuria en los 6 primeros meses de tratamiento se acompañó de un descenso de un 18% de eventos cardiovasculares y de un mejor pronóstico renal50,51.
Actualmente se estan realizando algunos estudios de prevención previos a la presencia de cualquier tipo de alteración renal. El estudio BENEDICT fue realizado en pacientes con DM tipo 2 sin MAL. El objetivo principal fue determinar el tiempo de aparición de la MAL persistente y se observó que el tratamiento con trandolapril previno en más de un 50% la aparición de la MAL. El IECA fue especialmente eficaz en los pacientes con la PA mal controlada52. La utilidad practica de asociar 2 ó más fármacos que bloqueen el SRAA necesita de futuros trabajos amplios y específicos.53.
A pesar todo lo anteriormente expuesto existen algunas discrepancias que ponen en duda la superioridad de los fármacos que interfieren el SRAA sobre otros hipotensores y explican todo el efecto renoprotector por el descenso de la PA54. Este metanálisis presenta el inconveniente que incluyeron estudios no diseñados específicamente para evaluar la renoproteción lo que dificulta su interpretación, pero también en la ultima revisión sistemática realizada por el Cochrane Renal Group se insiste en la necesidad de más estudios que definan no solamente su efecto sobre la ND sino también y especialmente su efecto sobre la supervivencia renal y general55. No existen estudios consistentes realizados con otros fármacos hipotensores y que presenten un efecto antiproteinurico independiente de la reducción de la PA.
Así pues considerando estos dos factores de riesgo (Hiperglucemia e HTA) como esenciales, entraremos en otros factores que en la actualidad no son tan claramente básicos de prevención de la ND o quizás son de más difícil demostración, pero si entran plenamente en el tratamiento general de estos pacientes.
OTROS FACTORES IMPORTANTES
La presencia de hiperfiltración glomerular es otro factor de riesgo ligado a la presencia de una DM mal controlada desde el punto de vista metabólico. Es claro en la DM tipo 1 puesto que el 50% de los pacientes con hiperfiltración glomerular evolucionaron a ND, es menos evidente en la DM tipo 2, aunque en estudios en los que se siguió una población diabética desde el inicio de su enfermedad se observó hiperfiltración en una proporción similar56,57. En general esta hiperfiltración suele estar precedida por una importante hipertrofia renal58. En la patogenia, además de la hiperglucemia, por si misma, o a través de hormonas, péptidos y citocinas, existen numerosos factores que podrían estar implicados59-62. Pero, independientemente de cuales sean los mecanismos patogénicos, la conclusión mas relevante es la intima relación entre hiperglucemia e hiperfiltración y por lo tanto es imprescindible el control metabólico estricto y continuado.63. La disminución de la hiperfiltración reduce también la proteinuria y por lo tanto mejora el pronóstico renal, como claramente quedo demostrado tanto en estudios experimentales como en humanos18,22,29-31,64.
El tabaquismo es un importante factor de riesgo cardiovascular y recientes estudios demostraron que es causa de importantes alteraciones renales65-67. Por ello es obligado en todo paciente diabético (y no) impulsar la supresión del hábito tabaquito por los efectos beneficiosos renales, cardiovasculares, metabólicos y de todo orden.
La obesidad es frecuente en pacientes con DM tipo 2 y por si misma produce lesión renal, especialmente glomeruloesclerosis y favorece su evolución hacia insuficiencia renal y la hiperfiltración glomerular. Además la reducción de peso mejora el control de la DM, se asocia a una disminución de la proteinuria, del síndrome metabólico, de la PA, la hiperfiltración glomerular y de algunas adipocitoquinas como la leptina que pueden asociarse a la glomerulosclerosis,69-72.
La dislipemia es muy frecuente en los pacientes con diabetes, especialmente si presentan proteinuria. Sus efectos sobre el riñón se basan en estudios experimentales, epidemiológicos y algunos estudios clínicos. En algunos trabajos se observó que es un factor de riesgo independiente de lesión renal73-76. Concentraciones superiores a 220 mg/dl de colesterol total son un factor claro de riesgo, especialmente asociadas a presiones diastólicas superiores a 85 mm de Hg.77. El efecto beneficioso de su tratamiento hipolipemiante sobre la evolución de la función renal no esta demostrado fehacientemente. En algunos estudios en pacientes tratados con hipolipemiantes se apreciaron efectos beneficiosos sobre la función renal y la albuminuria77-79. Como ocurre con el tabaquismo, la discusión puede ser exclusivamente académica ya que su tratamiento es imprescindible para la prevención de cardiovascular, por lo tanto no requiere una especial discusión como indicación para la prevención renal80.
Otro factor secundario de progresión de la ND es la proteinuria. La proteinuria en si misma es un excelente marcador de lesión renal y contribuye a su progresión incluso cuando esta presente en cantidades mínimas. La proteinuria se inicia por una alteración de la barrera glomerular, inicialmente los podocitos, pero también participan las células endoteliales y mesangiales con alteración de la membrana basal glomerular. Los mecanismos propuestos han sido publicados en excelentes revisiones, cuya lectura atenta es recomendable81,82. La consecuencia final es la glomerulosclerosis y la fibrosis intersticial. Es posible que la MAL conduzca ya desde sus inicios a la lesión renal, a través de una activación celular tubular que provoque lesión intersticial que condicione la evolución de la nefropatía hacia la insuficiencia renal.83,84. Conviene recordar que es el grado de lesión intersticiales el mejor predictor de evolución de la función renal85,86 y como hemos comentado ampliamente existen fármacos que bloquean el SRAA y reducen la proteinuria independientemente de la disminución de la PA.
CONCLUSIONES PRACTICAS
Como conclusión de todo lo anteriormente expuesto el abordaje del paciente diabético seria:
Prevención de la ND:
1.- Prevención primaria: es decir pacientes con DM con ausencia de clínica o analítica de lesión renal con el objetivo mantener función renal normal y ausencia de albuminuria.
2.- P revención secundaria: en pacientes con microalbuminuria, el objetivo esta en evitar la progresión de microalbuminura a proteinuria.
3.- P revención terciaria: en pacientes con proteinuria y/o descenso de la función renal. La prevención se dirige a enlentecer o evitar la progresión hacia la insuficiencia renal.
El marcador más importante de ND incipiente es la presencia de albuminuria en ambos tipos de DM y es útil como control de eficacia terapéutica87,88. Basándose en estos datos y siguiendo las recomendaciones de las sociedades científicas87,88 es claro que debemos utilizar una serie de medidas terapéuticas para intentar prevenir la aparición de una ND. Debemos considerar especialmente aquellos pacientes con riesgo aumentado como son los que presentan antecedentes familiares de ND o IRC o historia familiar de HTA y realizar en ellos un seguimiento más intensivo. El control de la hiperglucemia es esencial tanto en la prevención primaria como en la prevención secundaria. Estudios realizados con grupos poblacionales amplios como el DCCT16,17 y recientemente en el estudio EDIC19 en DM tipo 1, como con el UKPDS o el estudio ADVANCE15, 18 en DM tipo 2, demostraron claramente su eficacia. En la DM tipo 1 el tratamiento intensivo de la glucemia redujo la aparición de MAL en un 39% y de albuminuria en un 54% . Resultados similares se obtuvieron en el UKPDS en pacientes con DM tipo 2, si bien en este último estudio por su especial diseño estos objetivos fueron más difíciles de interpretar. En el estudio ADVANCE se puso claramente de manifiesto que los pacientes con control estricto de la glucemia presentaron un 21% de reducción de la ND. Además la optimización de la glucemia reduce la hiperfiltración glomerular17, 19 ,89 y corrige las alteraciones estructurales renales14,21. Por lo tanto, como no podía ser de otra manera, el principal objetivo terapéutico pasa necesariamente por un control óptimo de la alteración metabólica, tanto en la prevención primaria como secundaria.
Como comentamos previamente tan importante como el control de la glucemia es el control de la PA necesariamente incluyendo fármacos que bloqueen el SRAA5,6,34-41,54,73,87,88. Así podríamos remarcar que los fármacos que interfieren el SRAA44 tienen efectos similares sobre la ND en ambos tipos de DM y lo que quizás es más novedoso es que (estudio BENEDICT) la utilización de un IECA en sujetos normoalbuminuricos redujo la presencia de MAL ¿de novo¿. Así pues el bloqueo del SRAA es útil en todos los estadios tanto en la prevención primaria como secundaria como terciaria. E incluso en presencia de alteración renal puede ser más importante que el mismísimo control glucémico35-40,53. El tratamiento agresivo de la PA puede incluso hacer regresar la ND45-48.
Además de la utilización de los fármacos hipotensores para reducir la PA nos interesa resaltar su utilidad para reducir la albuminuria. En trabajos experimentales la albuminuria se correlaciona íntimamente con la glomerulosclerosis y la lesión intersticial28-33 y que los fármacos que bloquean el SRAA reducen específicamente la albuminuria y el deterioro de la función renal36-40,42,44,51,52.
Otros factores de riesgo renal, como la restricción proteica, la hipercolesterolemia, la obesidad, el tratamiento con fármacos que disminuyen la adherencia de las plaquetas, son tratamientos más empíricos y es difícil de demostrar su utilidad renoprotectora, pero están indicados para la prevención cardiovascular. No parece necesario insistir en la necesidad de evitar el tabaquismo por razones evidentes. La reducción de la ingesta proteica es eficaz en estudios experimentales y humanos, pero su utilidad clínica es objeto de discusión por la dificultad de su seguimiento89,90. Una reducción moderada podría ser recomendable (<0.8-0.6 gr/Kg de peso/ día). Una discusión similar se podría realizar con la presencia de dislipemia que fue objeto de algunos estudios experimentales y clínicos91-4. Las recientes recomendaciones de las sociedades científicas internacionales involucradas en el riesgo cardiovascular referentes a la prevención primaria y secundaria de la hipercolesterolemia dificultan de manera notable conocer la importancia del colesterol y su tratamiento sobre la función renal, puesto que no seria ético mantener pacientes con hipercolesterolemia de forma prolongada con el objetivo de conocer si producen daño renal. Existen estudios experimentales y epidemiológicos demostrativos de la importancia del colesterol como agentes lesivos sobre el glomérulo73,74,95-97. Por lo tanto el tratamiento con hipolipemiantes se impone en este grupo de pacientes en alto grado de riesgo cardiovascular98.
Un último aspecto es la reducción de peso. La obesidad se acompaña de una mayor incidencia de DM tipo 2, peor control metabólico, hiperfiltración glomerular, de HTA y en obesos no diabéticos presencia de albuminuria y de glomerulosclerosis. La reducción de peso se acompaña de un descenso marcado de la proteinuria69,71 por ello la reducción objetiva de peso debería ser una de los objetivos básico de un tratamiento bien planificado.
Así pues en la prevención primaria en pacientes diabéticos sin signos ni síntomas de enfermedad renal es obligado el estricto control metabólico además del control de la PA con inhibidores o bloqueadores del SRAA. Recomendaciones generales del estilo de vida como: no fumar, ejercicio físico, reducción de peso o ingesta moderada de proteínas así como el control de otras enfermedades metabólicas son imprescindibles.
La prevención secundaria en aquellos pacientes con presencia de MAL para evitar su progresión a la proteinuria e incluso su regresión precisa de un tratamiento intenso de todos los factores de riesgo, también aquí el control metabólico y sobre todo hipotensor es importantísimo, incluyendo fármacos que bloqueen el SRAA.
En presencia de proteinuria y/o insuficiencia renal, la prevención terciaria se dirigirá a evitar la progresión de la insuficiencia renal esencialmente mediante un control de la PA, dislipemia, la anemia, la alteración del metabolismo fosfocalcico como se ha demostrado en los pacientes no diabéticos. El control glucémico en presencia de insuficiencia renal es menos relevante, pero sigue siendo importante para reducir el riesgo cardiovascular.
Basándose en todo lo anteriormente expuesto y siguiendo las recomendaciones de las sociedades científicas resumimos los objetivos terapéuticos de la ND.
PUNTOS CLAVE
¿ Objetivos terapéuticos hipotensores: El principal objetivo terapéutico es reducir la PA por debajo de 130/80 mm Hg. incluyendo como tratamiento de base un IECA o ARA II. Para ello habitualmente es obligado la utilización de más de 2 fármacos99. En presencia de proteinuria la recomendación seria reducir la PA a valores inferiores a 120/75 mm de Hg.100. El nivel más alto de reducción de riesgo se observo cuando la presión sistólica se descendió por debajo de 120/mm de Hg.101.
¿ Los objetivos terapéuticos metabólicos esenciales serian: una hemoglobina glicada < 7% o inferior ( 6%) en pacientes de alto riesgo sin hipoglucemias. Los ingresos calóricos ajustados a su peso. La ingesta de grasas saturadas no debe exceder el 7% de las calorías totales. Se recomendará actividad física de al menos 150 minutos semana. La PA debería ser en todo caso inferior a 130/80 mm Hg., y se recomienda tratamiento hipolipemiantes y modificaciones dietéticas y del estilo de vida con el objetivo de conseguir un LDL colesterol < 100 mg/dl ( < 70 mg/dl si presentan patología cardiovascular), los triglicéridos < 150 mg/dl.
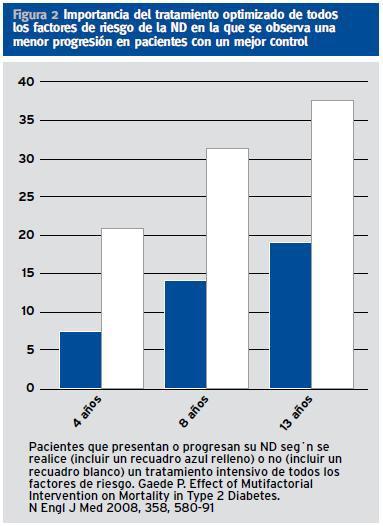
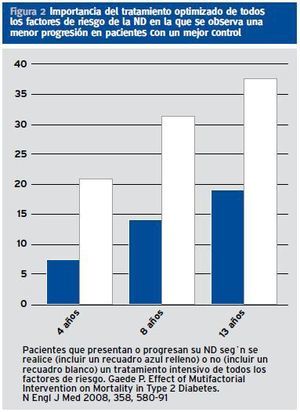
¿ El tratamiento múltiple de los factores de riesgo de desarrollar una ND y para reducir el riesgo cardiovascular son esenciales como demostró Gaede (Figura 2). Evidente para optimizar los resultados es precisa una aproximación multidisciplinar que incluya además la formación de los pacientes.
Tabla 1. Diversos estadios de la ND según la determinación de albuminuria
Tabla 2. Manejo del paciente con Diabetes Mellitus
Figura 1. Estudios experimentales comparando diferentes pautas terapéuticas en la que se demuestra la importancia de los IECAs
Figura 2. Importancia del tratamiento optimizado de todos los factores de riesgo de la ND en la que se observa una menor progresión en pacientes con un mejor control