INTRODUCCIÓN
En la siguiente revisión se describen los artículos publicados a lo largo del año 2008 que a nuestro entender han sido más relevantes. Es imposible citarlos todos y por lo tanto sólo se hace mención a los que particularmente nos han llamado la atención (tabla 1).
El modo de presentación de la glomerulonefritis (GN) es muy variado. Algunos pacientes con GN serán asintomáticos y serán diagnosticados por alteraciones en la orina, como proteinuria o hematuria en diversos grados; a veces se asociará hipertensión; algunos desarrollarán síndrome nefrótico asociado o no a deterioro de la función renal que puede ser rápidamente progresivo en días o semanas o bien ser gradual, en meses o incluso muchos años. Las GN están clasificadas a partir de criterios morfológicos de la biopsia renal en asociación con el cuadro clínico, cuando quizás sería mejor clasificarlas a partir de su preciso mecanismo patogénico, pero incluso el conocimiento de su etiopatogenia es limitado. Cuando la GN obedece a un agente causal (p. ej., drogas, infección, neoplasia), el tratamiento irá encaminado a tratar la causa específica. En esta revisión se abordarán diferentes aspectos de las GN primarias o idiopáticas, siendo por tanto desconocido el agente causal y el tratamiento, en gran medida empírico. Muchos de los tratamientos actuales se basan en fármacos de más de 30 años, como los corticoesteroides o la ciclofosfamida. Curiosamente, las nuevas estrategias terapéuticas han venido de la mano de fármacos inmunosupresores desarrollados más específicamente en la prevención del rechazo y manejo del trasplante renal que en el campo de las GN. Sin embargo, la investigación continúa, y por ejemplo, un nuevo campo emergente como el tratamiento con agentes biológicos ofrecerá nuevas perspectivas y ampliará los conocimientos sobre estas fascinantes entidades.
NEFROPATÍA IgA
La patogénesis de la nefropatía IgA (NIgA) es aún desconocida. Actualmente hay suficientes líneas de evidencia que muestran que los depósitos mesangiales en la NIgA son originados por inmunocomplejos circulantes que contienen IgA1. La IgA1 en estos inmunocomplejos, así como la de los depósitos mesangiales, está aberrantemente O-glucosilada, siendo deficitaria en residuos de galactosa.
Suzuki et al.1 estudian las bases moleculares de la alteración de la O-glucosilación de la IgA1. Para ello, seleccionaron a 57 pacientes con NIgA, usando como grupo control a 10 pacientes con nefropatía lúpica y a 63 controles sanos. Aislando linfocitos B periféricos capaces de sintetizar IgA1 y posteriormente inmortalizados con el virus de Epstein-Barr, observaron una anormal O-glucosilación en los pacientes con NIgA frente al grupo control que era normal. Estos pacientes presentaban un déficit de unión de galactosa unida a los O-glucanos con una sialización precoz de la N-acetilgalactosamina. Esta sialización precoz impediría la posterior unión de la galactosa, resultando así unas cadenas truncadas. Estos autores confirman que la prematura sialización es debida a un aumento de la actividad de la enzima ST6GalNAcII (sialización), y a un descenso de la actividad de la C1GalT1 y su chaperona Cosmc (encargada de insertar la galactosa). Estas anormalidades tienen implicaciones considerables en la generación de nefropatía, ya que la O-glucosilación en la IgA1 está situada cerca de la porción que actúa como ligando para los receptores Fc (fracción cristalizable de la inmunoglobulina). Los cambios en esta zona afectarían a las interacciones con sus receptores conduciendo a alteraciones en los mecanismos de aclaramiento de los inmunocomplejos y, por tanto, contribuyendo al depósito mesangial. Además, la ausencia de galactosa favorecería la exposición de epítopos que normalmente no son expresados en la IgA1, provocando la formación de autoanticuerpos con especificidad «antiglucanos», formando inmunocomplejos. Los autores sostienen que una inhibición de la actividad de la enzima ST6GalNAcII sería una poten- cial diana terapéutica para el desarrollo de nuevos fármacos en el tratamiento de la nefropatía IgA.
La larga evolución de la enfermedad, y el no tener predictores en estadios tempranos que permitan discernir qué pacientes se van a beneficiar de tratamientos más agresivos, ha hecho que los investigadores estén en permanente búsqueda de marcadores predictivos. Estos estudios son importantes, ya que permitirían diferenciar entre los pacientes en estadios iniciales (función renal normal) que progresarán a insuficiencia renal, facilitando una intervención terapéutica temprana, y aquellos en los que la función renal permanecerá estable, evitando tratamientos inmunosupresores innecesarios. Este problema se ha abordado desde varias vertientes. Así, Van Es et al.2, en un estudio retrospectivo y con seguimiento de 18 años de 50 pacientes diagnosticados de NIgA, analizan la histología renal y realizan un análisis inmunohistoquímico frente a un panel de marcadores de superficie leucocitarios. Encuentran el infiltrado intersticial de CD20+ (linf B) y la presencia tubular del GMP-17+/CD8+ (linf T) como predictores precoces de progresión en pacientes con función renal normal inicial. Estos marcadores presentaron un valor predictivo positivo y negativo superior a los convencionales, como la proteinuria, la fibrosis intersticial, la atrofia tubular y el infiltrado intersticial. Así, la presencia del marcador GMP-17/CD8+ en los túbulos renales intactos predice la progresión en el 86% de los pacientes, mientras que su ausencia predice una función renal estable en el 94% de los pacientes.
Por otra parte y mediante el estudio de citocinas en orina, Torres et al.3 demuestran que el cociente EGF (epidermal growth factor) y MCP-1 (monocyte chemotactic peptide-1) puede ser usado como marcador pronóstico de enfermedad renal. Cuantificando sus valores en orina y dividiéndolos en terciles, observan cómo el tercil más bajo tiene una significativa peor supervivencia renal, mientras que los pacientes en el tercer tercil mantienen una supervivencia renal del 100% a los 48 y 84 meses de seguimiento. El cociente EFG/MCP-1 se mostró como factor pronóstico independiente y su valor predictivo fue significativamente mayor que el grado de afectación histológica, el aclaramiento de creatinina o la proteinuria.
Está bien establecido, en la actualidad, y a falta de otros marcadores, que la proteinuria es un factor de riesgo independiente de progresión en la NIgA. Unos valores de proteinuria superiores a 1 g/día aumentarían el riesgo de progresión a enfermedad renal crónica (ERC) un 20-30% a los 20 años. Por ello, uno de los pilares más importantes del tratamiento de la NIgA se sustenta en la disminución de la proteinuria, siendo el bloqueo del sistema renina-angiotensina la opción de elección. Catapano et al.4 analizan este aspecto y mediante un metaanálisis, que incluye 13 trabajos y 425 pacientes, concluyen que el bloqueo dual (inhibidor de la enzima de conversión de angiotensina [IECA] y bloqueador del receptor de la angiotensina [ARB]) provoca un descenso significativo de la proteinuria superior a los IECAo ARB en monoterapia en los pacientes con glomerulopatías primarias, incluida la NIgA. Además, observan que la eficacia de esta combinación se relaciona con los valores iniciales de proteinuria, siendo más eficaz cuanto más altos son aquéllos. Sin embargo, también observaron un ligero incremento de las cifras séricas de potasio, 0,1 mEq/l frente a IECA y 0,9 mEq/l frente a ARB, no apreciándose alteraciones en el filtrado glomerular renal (GFR). Queda por investigar su uso y riesgo/beneficio en poblaciones ancianas con ERC avanzada.
Sin embargo, no siempre el bloqueo del sistema renina-angiotensina consigue una adecuada disminución de la proteinuria. Por ello se ha investigado la posibilidad de asociar otros tratamientos que lograran dicho objetivo. Si bien el papel de los ácidos grasos poliinsaturados (AGP) en la NIgA es algo controvertido, no es menos cierto que su seguridad y tolerancia contrarrestarían su limitada eficacia. Ferraro et al.5, basándose en los potenciales efectos antiinflamatorios e inmunorreguladores de los AGP, demuestran que su uso en dosis de 3 g/día (eicosapentaenoico 85% y docosahexaenoico) en asociación con bloqueo dual (ramipril e ibersartán) provoca una reducción importante y significativa de la proteinuria frente al grupo control tratado únicamente con bloqueo dual. El estudio fue realizado en 30 pacientes y a 6 meses. El porcentaje de reducción de la proteinuria fue del 73% en el grupo tratado con AGP frente al 11,3% en el grupo control (p >0,001). No se observaron cambios en los valores de la función renal, la presión arterial, los triglicéridos ni en la hiperpotasemia (K >5,5 mEq/l). Szeto et al.6, por otra parte, ensayan una vía totalmente diferente. En 10 pacientes tratados con IECA o ARB con proteinuria persistente >1 g, normotensos y con Crp de 1,7 ± 1,32 mg/dl, prueban la asociación de calcitriol 0,5 µg dos veces por semana. Se basan en el potencial efecto inhibidor del calcitriol sobre el factor transformador del crecimiento beta (TGF-β) y la angiotensina II. A las 12 semanas comprobaron un descenso modesto pero significativo de la proteinuria (1,98 ± 0,74 a 1,48 ± 0,81 g/día, p <0,001). Además, observaron que los niveles de TGF-β disminuyen, no así los de angiotensina II. La función renal no se modificó y hubo un caso de ligera hipercalcemia que se corrigió reduciendo la dosis de calcitriol. Según los autores, un estudio a 12 meses y con una muestra de 156 pacientes permitiría clarificar el potencial beneficio de este tratamiento.
El tratamiento óptimo de la NIgA de alto riesgo (deterioro ligero y progresivo de la función renal, proteinuria >1 g/24 h) aún no está del todo establecido. Si bien los trabajos de Pozzi demuestran que el tratamiento con corticoesteroides disminuye la proteinuria y retrasa la progresión del deterioro renal, el uso combinado de corticoesteroides e IECA no ha sido valorado. Lv et al.7, en un estudio aleatorizado, controlado y prospectivo, con un seguimiento a 48 meses, analizaron en 63 pacientes la eficacia de un tratamiento combinado de corticoesteroides junto con cilazapril (n = 33) frente a tratamiento concilazapril solo (n = 30). La Crp inicial fue similar en ambos grupos (1,1 ± 0,3 mg/dl), mientras que la proteinuria fue de 2 ± 0,8 g/día en el grupo con IECA y de 2,5 ± 0,9 g/día en el grupo de IECA y corticoesteroides. El riesgo de progresión, estimado sobre la base de un 50% de aumento en la concentración de creatinina sérica basal, fue significativamente menor con la terapia de combinación que con la inhibición de la ECA sola. A los 24 meses, la supervivencia renal fue del 96,6% en el grupo de tratamiento combinado frente al 75,7% en el grupo con IECA sola, siendo a los 36 meses del 96 frente al 66,2%, respectivamente (log-rank p = 0,006). La proteinuria disminuyó significativamente en el grupo de tratamiento combinado en comparación con el grupo tratado únicamente con IECA, apreciándose una reducción superior al 50% en el 81% de los pacientes en tratamiento combinado, frente al 58% de los que recibieron solo IECA. Sin embargo, este artículo ha sido criticado por Strippoli et al.8, quienes, entre otras consideraciones, razonan que el tamaño muestral debería haber sido notoriamente mayor, así como el periodo de seguimiento, y concluyen que deberían realizarse estudios confirmatorios antes de sacar conclusiones, exponiendo cómo deberían realizarse y los patrones de calidad que tendrían que cumplir.
La tonsilectomía ha sido propuesta por varios autores, fundamentalmente japoneses, como opción terapéutica en los pacientes con NIgA. El hecho de que sea un proceso quirúrgico, que no exista un trabajo controlado y que la aleatorización sería muy difícil ha hecho que no sea un tratamiento generalizado. Komatsu et al.9 estudiaron la eficacia terapéutica de la tonsilectomía junto con tratamiento con corticoesteroides y la compararon frente a pacientes que solo recibieron tratamiento con corticoesteroides. La efectividad del tratamiento se valora a partir de la remisión de las alteraciones en el sedimento urinario y de los hallazgos histológicos. El estudio prospectivo, controlado y con seguimiento de 54 meses, incluyó a 55 pacientes. A 35 se les realizó amigdalectomía tras la cual recibieron 3 bolos de 0,5 g de metilprednisolona consecutivos y, posteriormente, prednisona oral 0,5 mg/kg/día en pauta descendente hasta completar 18 meses. El grupo control no amigdalectomizado siguió tratamiento únicamente con corticoesteroides según la pauta descrita; los IECA fueron administrados cuando las cifras de presión arterial ≥130/80 mmHg. Dieciocho pacientes (11 del grupo amigdalectomizado) fueron rebiopsiados 23 meses más tarde. Los pacientes amigdalectomizados presentaron a los 24 meses una tasa de desaparición de proteinuria y microhematuria significativamente mayor, que se mantuvo hasta el final de seguimiento. La posterior biopsia mostró una reducción de la proliferación mesangial y menor depósito de IgA en el grupo amigdalectomizado en comparación con el grupo control. El análisis de regresión de Cox reveló que el tratamiento combinado (amigdalectomía y corticoesteroides) fue seis veces más efectivo en provocar la desaparición de la proteinuria que el tratamiento esteroideo (hazard ratio [HR] 6,20; IC 95%: 1,98-19,5; p = 0,002). Los autores describen que la tonsilectomía, eliminando el estímulo antigénico, junto con los corticoesteroides modulando la respuesta inflamatoria, serían las razones que explicarían la efectividad de este tratamiento.
Hasta la fecha, cuatro trabajos10-13 han valorado el uso del micofenolato en el tratamiento de la NIgA. Curiosamente dos de ellos, realizados en pacientes chinos, parecen ser efectivos10,13, mientras que otros dos, uno realizado en EE.UU. y otro en Europa, no mostraron efectividad11,12. Tres metaanálisis analizaron esta cuestión y todos ellos concluyen que la evidencia actual no sostiene el uso sistemático del micofenolato en el tratamiento de la NIgA14-16.
Otro tema de debate es el manejo de los pacientes con enfermedad renal progresiva y aclaramiento de creatinina (ClCr) bajo. Parece existir acuerdo en que un ClCr inferior a 30 l/min/1,73 m2 y con cambios crónicos en la biopsia renal sería un punto de no retorno o irreversible, y estaría indicada únicamente la adopción de medidas de contención. Existen algunas opiniones enfrentadas, que van desde el nihilismo terapéutico al tratamiento inmunosupresor agresivo en el abordaje del paciente con deterioro importante y progresivo de la función renal. En este sentido, son escasos los trabajos, alguno con resultados prometedores17, si bien también hay detractores, siendo este tema materia de debate18. Este año sale a la luz un ambicioso estudio que ayudará a aclarar esta cuestión. Eitner y Floege19, en un estudio a 3 años, valorarán la eficacia del tratamiento inmunosupresor (basado en corticoesteroides solo o bien en corticoesteroides, ciclofosfamida y azatioprina) frente a medidas de soporte en los pacientes con NIgA progresiva.
GLOMERULONEFRITIS MEMBRANOSA
El tratamiento inmunosupresor en la glomerulonefritis membranosa (GNM) no está establecido, siendo diferentes los tratamientos según el estado de la función renal y el tiempo transcurrido desde el diagnóstico. Wetzels et al.20, usando un tratamiento restrictivo inmunosupresor, lograron disminuir en su zona de influencia un 70% el número de pacientes que iniciaron tratamiento sustitutivo por esta nefropatía. Los autores inician tratamiento con ciclofosfamida y corticoesteroides sólo en aquellos pacientes con deterioro progresivo de la función renal Crp 135 µmol (Crp 1,5 mg/dl), incremento de la creatinina superior a un 50%, o bien ante un síndrome nefrótico que produce importante menoscabo a pesar de tratamiento médico. Con esta estrategia logran reducir un 70% el número de pacientes que inician tratamiento sustitutivo, evitando de este modo el uso innecesario de inmunosupresores en pacientes que probablemente no los hubieran necesitado, dada la tasa de remisiones espontáneas de esta entidad.
El uso del micofenolato mofetilo (MMF) en la GNM es muy discutido, siendo los resultados de los estudios muy controvertidos. Dussol et al.21, en un estudio controlado, aleatorizado y prospectivo, de 1 año de duración, estudiaron a 36 pacientes diagnosticados de GNM con menos de 6 meses de evolución, función renal normal y proteinuria entre 5 y 10 g/día. Diecinueve pacientes fueron tratados con micofenolato en monoterapia en dosis de 2 g/24 h durante 12 meses, y como grupo control 17 pacientes recibieron tratamiento sintomático. Se obtuvo remisión completa en 3 pacientes (1 en el grupo de MMF, 2 en el grupo control; p = 0,5) y remisión parcial en 11 pacientes (6 en el grupo MMF, 5 en el grupo control; p = 0,9). La probabilidad de respuesta completa o parcial no difirió entre los dos grupos después de 12 meses (RR 0,92; IC 95%: 0,48-1,75; p = 0,7). Así las cosas, el MMF, al menos en monoterapia, no mostró ser efectivo, es más, dado el diseño del estudio (inicio precoz del tratamiento), estos resultados pueden ser reflejo de la evolución natural de la enfermedad. Experimentaron efectos secundarios5 pacientes en el grupo de MMF (1 paciente carcinoma pulmonar, 1 diarrea que obligó a suspender dosis, 1 varicela-zóster costal y otro dermatitis bullosa).
Sí parece, sin embargo, que el uso combinado de MMF junto con corticoesteroides pudiera ser eficaz en el tratamiento de la GNM. Nayagam et al.22, en un estudio piloto aleatorizado, compararon la eficacia del MMF asociado a corticoesteroides frente a tratamiento convencional en dos tipos de nefropatía, la GNM y la hialinosis focal y segmentaria (HFyS). Los autores estudiaron a un total de 54 pacientes: 21 diagnosticados de GNM (11 tratados con MMF, 10 con tratamiento convencional) y 33 diagnosticados de HFyS (17 con MMF, 16 con tratamiento convencional). El MMF se pautó en dosis de 2 g/día durante 6 meses, asociándose esteroides 0,5 mg/kg/día durante 2-3 meses, tanto para la GNM como para la HFyS. El tratamiento convencional de la GNM consistió en 6 meses con ciclos de tratamiento de ciclofosfamida oral alternando con corticoesteroides, mientras que el de la HFyS fue corticoesteroides en dosis de 1 mg/kg/día durante 6 meses. Los autores no observaron diferencias en la proporción de pacientes que lograron remisión en ambos grupos (64% respuesta al MMF y 80% respuesta al tratamiento convencional en la GNM, y 70% de respuesta al tratamiento convencional y 69% al MMF en la HFyS). La frecuencia de recidivas y la incidencia de infecciones fueron también similares en ambos grupos, convencional frente a micofenolato. Los autores sugieren que la eficacia del tratamiento con el MMF, similar al convencional, pudo residir en el hecho de su asociación con corticoesteroides. Este tratamiento supondría una ventaja para poblaciones de riesgo, como niños y diabéticos, ya que la dosis administrada de corticoesteroides sería notoriamente menor comparada con la de los tratamientos convencionales. Quedaría, sin embargo, por determinar la duración del tratamiento y el impacto que pudiera tener en la preservación de la función renal a largo plazo.
Uno de los tratamientos que más interés está suscitando en la GNM es el uso de agentes biológicos, en concreto rituximab. Este anticuerpo monoclonal quimérico (murino/humano) antiCD20 actúa deplecionando los linfocitos B de sangre periférica, respetando las células plasmáticas, ya que éstas no expresan este marcador de superficie. Se ha comprobado que las lesiones de la GNM desaparecen en aquellos pacientes tratados con rituximab y que logran alcanzar una respuesta completa23. Fervenza et al.24 estudiaron la respuesta al tratamiento con rituximab en 15 pacientes, 7 de los cuales previamente no habían res-ondido a tratamientos inmunosupresores convencionales. Administraron una dosis de 1 g iv. los días 1 y 15, dosis que fue repetida 6 meses más tarde en 10 pacientes ante el incremento de los linfocitos B (CD19+ >15/µl) y la persistencia de proteinuria >3 g/día. Obtuvieron una tasa de respuesta del 60%; 2 pacientes con remisión completa y 6 pacientes con remisión parcial (proteinuria <3 g/día). También la farmacodinámica del rituximab fue estudiada, observándose niveles plasmáticos de fármaco inferiores en comparación con los de otros pacientes tratados con rituximab en la misma dosis y similar pauta de administración, pero sin proteinuria asociada (artritis reumatoide), lo que sugiere que el síndrome nefrótico provocaría un aumento de la eliminación del rituximab, si bien no se pudo confirmar este aspecto por la imposibilidad de su cuantificación urinaria. Pero quizás los resultados más alentadores son los obtenidos por los grupos de los Hospitales Vall d¿Hebron y 12 de Octubre que, asociando rituximab al tratamiento con anticalcineurínicos, permitió la suspensión temprana de éstos y obtener una remisión estable25,26.
Sin embargo, el camino por recorrer aún es largo y son más las dudas que las certezas. Se desconoce el mecanismo de acción, estando implicados múltiples vías inmunológicas efectoras, entre otras, el sistema macrofágico, la citotoxicidad mediada por complemento y la mediada por anticuerpos, y la apoptosis27. Además, la capacidad de aclaramiento de las células B periféricas no se realiza con la misma intensidad y velocidad que la de las células B residentes en tejidos periféricos, siendo éste un dato importante, ya que el grado y el fenotipo de infiltración linfocitaria observados en este proceso glomerular y otros (NIgA) parece que cada vez tiene más protagonismo en el desarrollo de la enfermedad28.
En cuanto a la dosis administrada, la pauta habitual en los diferentes estudios es la usada inicialmente por los hematólogos. En esta entidad la situación es radicalmente diferente, puesto que no es necesario aclarar una masa celular tan abundante como en el caso de los procesos linfomatosos. Se han realizado estudios en pacientes con GNM que demuestran igual eficacia con menores dosis, lo que permite reducir drásticamente el coste de este tratamiento, de 14.000 a 3.800 ¿29,30. Por otra parte, también se desconoce qué pacientes podrían beneficiarse de este tratamiento, no existiendo por el momento un marcador que prediga la ausencia de respuesta. Respecto a la eficacia a largo plazo, es un dato aún por comprobar. Actualmente está en desarrollo el ofatumumab, un nuevo monoclonal anti-CD20, humanizado y con una inusual capacidad de activar el complemento, por lo que sería más efectivo (citotoxicidad dependiente del complemento) con la potencial ventaja de ser menos inmunógeno31. No cabe duda de que la eclosión de estos nuevos tratamientos y la investigación derivada de ellos aportará nuevos conocimientos en la compresión de la nefropatía membranosa, hoy todavía por dilucidar.
HIALINOSIS FOCAL Y SEGMENTARIA
La clasificación histológica de la hialinosis focal y segmentaria (HFyS) en cinco variantes ha permitido observar una sustancial diferencia, tanto en la respuesta al tratamiento como en la evolución a ERC. Sin embargo, es muy limitada la información de la distribución de las distintas variantes en la población europea. El grupo de Wetzels32, en los Países Bajos, enfatiza la utilidad clínica de esta clasificación. Describen retrospectivamente una serie de 93 pacientes con HFyS. Y observaron que las variantes colapsante y celular fueron muy infrecuentes, a diferencia de las series americanas. La variante tip fue la más habitual, la que con más frecuencia debutó con síndrome nefrótico, la que menos daño histológico presentó y la que mejor evolucionó, presentando un alto porcentaje de remisiones espontáneas. La supervivencia renal a 5 años fue del 78% en la lesión tip, frente al 63 y 55% para las variantes NOS y perihiliar.
En lo referente al tratamiento de la HFyS, parece establecido que la prednisona sería la primera línea de tratamiento. Braun et al.33, en un reciente metaanálisis, analizaron esta cuestión. Los autores concluyen que los adultos tratados con una dosis inicial de ciclosporina de 3,5-5 mg/kg/día repartida en dos dosis en combinación con prednisona oral 0,15 mg/kg/día presentan una mayor probabilidad de lograr una remisión en comparación con el tratamiento sintomático o con la prednisona sola. Sin embargo, debería tenerse especial cuidado ante la posibilidad de deterioro de la función renal relacionada con la ciclosporina A (CsA), siendo recomendable un ensayo controlado más amplio y a largo plazo para comprobar la preservación de la función renal.
El papel del micofenolato ya se ha descrito con anterioridad22. Su uso con corticoesteroides parece ser efectivo, si bien son precisos más estudios. Un interesante trabajo realizado en pacientes con HFyS describe el papel que desempeña la osteopontina (Opn) en el desarrollo de la proteinuria. La Opn es una citocina ampliamente expresada en procesos como la inflamación y el cáncer entre otras. Mediante la activación del factor nuclear NF-κB contribuye a aumentar la movilidad de las células cancerosas, el crecimiento tumoral y, por tanto, al desarrollo de las metástasis. Recientes investigaciones han comprobado que un aumento de la expresión de Opn a nivel glomerular, en especial en los podocitos, se relaciona estrechamente con el desarrollo de proteinuria. De hecho, en modelos de ratas knoc-kout Opn (Spp1¿/¿), la ausencia de Opn protege frente al desarrollo experimental de proteinuria. Al parecer, un aumento de la expresión de Opn alteraría las señales y la motilidad podocitarias, propiciando el desarrollo de la proteinuria. Lorenzen et al.34 han demostrado que unos niveles altos de Opn en la orina de los pacientes con HFyS predice una respuesta favorable al tratamiento con corticoesteroides. Argumentan que esto es debido a que los corticoesteroides actuarían interfiriendo la vía NF-κB altamente expresada por la osteopontina. Además, proponen a la Opn como nueva diana terapéutica frente a la proteinuria, y de hecho ya se están desarrollando fármacos frente a esta proteína en otros campos, como el de la oncología, en el que se está estudiando su potencial uso frente al cáncer y el desarrollo de las metástasis.
Otros dos hallazgos sorprendentes, publicados este año, demuestran la intensa investigación básica y el alto grado de desarrollo en el campo de la biología podocitaria. Letavernier et al.35 describen el mecanismo implicado por el que el sirolimus puede afectar a la organización del citoesqueleto podocitario y las consecuencias deletéreas en la función renal y la proteinuria. Un segundo estudio, aún más sorprendente, clarifica el mecanismo de acción de los anticalcineurínicos en el tratamiento de la proteinuria. La justificación del uso de la CsA se basa en sus potenciales efectos inmunorreguladores sobre los linfocitos T. Sin embargo, Faul et al.36 demuestran que, lejos de actuar por una vía inmuno-reguladora, su efecto antiproteinúrico sería debido a una estabilización y un correcto mantenimiento del citoesqueleto podocitario. Esta estabilización dependería de la de las microfibras de actina intracelulares, lográndose mediante la unión de dos proteínas intracitoplasmáticas, la synaptopodina y la 14-3-3. Éstas, unidas con un enlace de fósforo engarzando las microfibras de actina, darían estabilidad a esta estructura. La activación de la calcineurina sería capaz de desfosforilar la synaptopodina y, por tanto, alteraría el citoesqueleto podocitario provocando proteinuria. La CsA sería capaz de bloquear esta acción de la calcineurina, impidiendo la alteración de la citoestructura podocitaria. El descubrimiento de esta señal, en la que está implicada la calcineurina, es de gran interés, ya que permitirá desarrollar en un futuro nuevos fármacos frente a la proteinuria más específicos y probablemente con menos efectos secundarios.
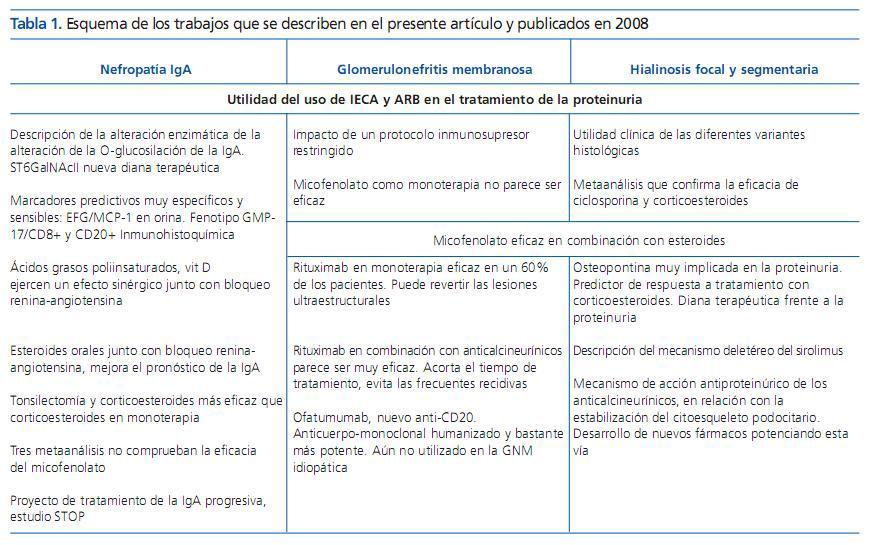
Tabla 1. Esquema de los trabajos que se describen en el presente artículo y publicados en 2008