INTRODUCCIÓN
El desarrollo de diabetes mellitus posterior al trasplante (DMPT) se asocia con una menor supervivencia del injerto y del paciente1-4. Aunque en la población general diabética se ha demostrado que con el tratamiento adecuado de la diabetes mellitus (DM) se logra una menor morbimortalidad cardiovascular y un menor desarrollo de nefropatía, no existen hoy día estudios sobre el control de la DMPT y la evolución a largo plazo del injerto y del paciente, por lo que respecto a su tratamiento, hemos de asumir las mismas directrices que para la población general. Basándonos en estas premisas, hemos realizado una revisión sistemática de la literatura sobre el tratamiento de la DMPT, cuya metodología se refleja en la tabla 1. De esta revisión se ha llegado a un consenso sobre los distintos aspectos de la prevención y tratamiento de la DMPT que exponemos a continuación. El tratamiento de la DMPT, aunque ha sido objeto de revisiones de expertos5-9, así como de la elaboración de un consenso10, no está respaldado por unas guías con criterios contrastados según la medicina basada en la evidencia, por lo que éste debe ser extrapolado de las guías de consenso elaboradas para la población general11,12 (tabla 2). No obstante, existe una revisión sistemática extensa sobre la nefropatía diabética y su tratamiento en las Guías KDOQI que, en parte, puede ser utilizada para el tratamiento de la DMPT13. En el enfoque del tratamiento de la DMPT deben distinguirse dos apartados claramente definidos: en primer lugar, la influencia y, por tanto, el manejo de la inmunosupresión en relación con la prevención y el tratamiento de la DMPT y, en segundo, el tratamiento de la DMPT en sí, tanto con la modificación del estilo de vida como el tratamiento farmacológico cuando esté indicado.
INMUNOSUPRESIÓN Y DIABETES MELLITUS POSTERIOR AL TRASPLANTE
La inmunosupresión utilizada en el paciente sometido a un trasplante interviene de una manera clara en la fisiopatología de la DMPT y, por tanto, la elección y el mantenimiento del tratamiento inmunosupresor deben tenerse en cuenta a la hora de la prevención y el tratamiento de la DMPT14,15 (tabla 2). Es opinión de nuestro grupo que en pacientes con un perfil de riesgo para el desarrollo de diabetes, la elección del tratamiento inmunosupresor debe encaminarse no sólo al control del rechazo agudo (RA) sino que debe tenerse en cuenta también el evitar en lo posible el desarrollo de DMPT (tabla 3).
Esteroides
La asociación entre el tratamiento esteroide y el desarrollo de DMPT está claramente establecida, habiéndose implicado hasta en un 46% de los casos16; su efecto diabetógeno se encuentra relacionado con la dosis y con la duración y, así, en un estudio retrospectivo con 173 receptores de trasplante renal, desarrollaron DMPT e intolerancia a la glucosa un 18%, y un 31% a las 10 semanas del trasplante renal y se comprobó que un incremento de 0,01 mg/kg/día en la dosis de prednisona se asoció con un incremento del 5% en el desarrollo de DMPT17. Este mismo grupo, en un estudio posterior, demostró que la reducción a 5 mg/día de prednisona supuso un descenso en la intolerancia a la glucosa del 55 al 35%18. Existen resultados controvertidos sobre el riesgo de un aumento en la incidencia de RA con la reducción o retirada de esteroides; así, un metaanálisis de Pascual et al. sobre siete ensayos aleatorizados de retirada de esteroides demuestra que el riesgo relativo de RA es de 2,28 (intervalo de confianza [IC] 1,65-3,16) para el grupo en el que se retiraron los esteroides19. Por el contrario, Kumar et al., en un estudio prospectivo a 3 años, comparando la retirada precoz de esteroides al segundo día frente a una dosis de mantenimiento de 5 mg/día a partir del primer mes, en grupos con anticalcineurínicos (ICN) e inhibidores de mTOR y en todos con inducción con basiliximab, encuentran una disminución en la incidencia de DMPT en el grupo de retirada precoz del 21 frente al 4% (p = 0,01), con un menor incremento del IMC (28,2 frente a 32,6; p = 0,04), siendo los resultados comparables en RA confirmado por biopsia, RA subclínico, nefropatía crónica del injerto (NCI) y supervivencia del injerto y del paciente20. El estudio Atlas, diseñado para analizar dos regímenes de inmunosupresión libres de esteroides (Tac + MMF y basiliximab + Tac) frente a un grupo de tratamiento estándar (Cort + Tac + MMF), encuentra que la terapia basada en basiliximab + Tac es la más favorable en cuanto a la prevención de desarrollo de DMPT, pero la incidencia de RA es mayor, aunque la supervivencia de injerto y receptor fue similar en los tres grupos21. Un estudio observacional a 5 años, con el objetivo de analizar la prevalencia de DMPT tras la retirada precoz de esteroides a la semana del trasplante renal y con un régimen inmunosupresor con terapia de inducción con timoglobulina, CsA y MMF, así como con un estudio añadido al año como parte del estudio de retirada de prednisona, de aleatorización de dos grupos con CsA + MMF frente a Tac + SRL, demuestra que los receptores con régimen libre de prednisona tienen menor incidencia de DMPT, un 1% al año y a los 5 años (p <0,001), sin que se hayan detectado diferencias significativas en la incidencia de RA o supervivencia del injerto22. Recientemente se han publicado los resultados a 5 años de un estudio aleatorizado y doble ciego de retirada precoz de esteroides 7 días después del trasplante en 386 pacientes, todos tratados con inducción, Tac y MMF; en 191 pacientes se mantuvo el tratamiento con prednisona a la dosis de 5 mg desde los 6 meses del trasplante renal y en 195 la prednisona fue retirada a los 7 días. No se observaron diferencias a los 5 años en la proporción de pacientes en relación con el parámetro compuesto de muerte, pérdida del injerto o RA (30/191 [15,7%]; 28/195 [14,4%]), muerte del paciente (11/191 [5,8%]; 13/195 [6,7%]), pérdida del injerto censurada por muerte (11/191 [5,8%]; 7/195 [3,6%]), RA por biopsia (34/191 [17,8%]; 21/195 [10,8%]; p = 0,058) o RA moderado/grave (15/191 [7,9%]; 12/195 [6,2%]). En el análisis mediante Kaplan-Meier de los objetivos primarios y de sus componentes tampoco se observaron diferencias, pero el RA por biopsia fue más frecuente en el grupo de retirada precoz de esteroides (p = 0,04). No se encontraron diferencias en la creatinina (1,5 ± 0,6; 1,5 ± 0,7 mg/dl) o en el filtrado glomerular medido por Cockroft-Gault (58,6 ± 19,7; 59,8 ± 20,5 ml/min). La retirada precoz de esteroides se acompañó de menor nivel de triglicéridos y de menor ganancia de peso. La DMPT fue similar en relación a la proporción de pacientes que requirieron tratamiento, 23/107 (21,5%); 18/86 (20,9%); no obstante, menos pacientes requirieron insulina y la HbA1c fue menor en el grupo de retirada precoz23. Se ha apelado al agotamiento de las células beta pancreáticas para plantearse la retirada precoz de esteroides, ya que en la retirada tardía las posibilidades de revertir la DMPT serían más bajas. Borroughs et al. estudian si el efecto diabetógeno de CsA y Tac es dosis-dependiente y/o dependiente de la dosis de esteroides en un estudio observacional retrospectivo de 8.839 receptores de un primer trasplante renal. El día 30 después del trasplante renal, los pacientes fueron divididos en seis grupos de esteroides y dosis de Tac y comparados frente al tratamiento con CsA. La incidencia acumulativa no ajustada de DMPT al primer año fue del 14,6% con CsA frente al 22,2% con Tac y al tercer año de un 23,4% con CsA frente a un 32,9% con Tac (p < 0,0001); estas diferencias se mantuvieron a los 60, 90, 120 y 180 meses. En cuanto a la relación dosis/riesgo, el riesgo de DMPT fue significativamente superior con Tac que con CsA en los seis subgrupos de Tac, incluyendo la cohorte con las dosis más bajas de Tac y esteroides (HR 1,28 [IC 1,10-1,48]; p <0,0012). Un análisis subsiguiente de los dos subgrupos de dosificación más baja demostró que dosis de Tac por debajo de 0,12 mg/kg/día no proporcionaron protección frente a la aparición de DMPT y, sin embargo, dosis de esteroides por debajo de 0,375 mg/kg/día se asociaron con menor riesgo de DMPT en el grupo de dosificación de Tac de 0,12 a 0,23 mg/kg/día, lo que indica potencialmente un efecto protector. Este estudio pone de manifiesto la necesidad del uso de bajas dosis de Tac y de la minimización de la dosis de esteroides para disminuir el riesgo de DMPT24. El estudio FREEDOM25 lleva a cabo un análisis comparativo entre tres grupos de pacientes, libres de esteroides, retirada precoz y tratamiento estándar y demuestra al año de seguimiento una mayor incidencia de RA y una menor necesidad de tratamiento antidiabético, aunque en el número de nuevos diagnósticos de DMPT no existen diferencias. Woodle et al. lideran un estudio multicéntrico de retirada de esteroides a 5 años y llegan a conclusiones similares a las del estudio FREEDOM; es importante el hecho de que los beneficios sobre los factores de riesgo cardiovascular son similares a los obtenidos con dosis de mantenimiento de 5 mg/día de prednisona26. Pascual et al. dirigen una exhaustiva revisión Cochrane sobre la retirada de esteroides y llegan a la conclusión de que, aunque no existe una importante evidencia, la retirada de esteroides, con un adecuado tratamiento de inducción e inmunosupresión basada en CsA o Tac y MMF es segura y logra beneficios respecto a una disminución en la incidencia de DMPT27. En una reciente revisión efectuada por Matas, se pone de manifiesto la importancia de la retirada precoz de esteroides, considerando ésta cuando se realiza antes de los 3 meses, en relación con el desarrollo de DMPT y que, asimismo, la terapia de inducción es necesaria para evitar el incremento de RA28. Las recomendaciones del grupo con respecto al uso de esteroides quedan resumidas en la tabla 4.
Anticalcineurínicos
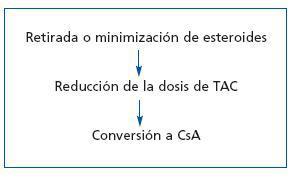
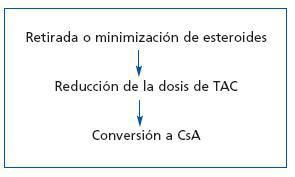
Los ICN afectan a la síntesis y secreción de insulina, y aumentan la resistencia periférica a la misma29. Son numerosos los estudios que han confirmado la relación entre DMPT y el uso de ICN, y que han comparado la incidencia de aquélla en relación con el empleo de uno u otro fármaco. Así, en un estudio observacional retrospectivo, de 21.489 trasplantes efectuados entre 1995 y 2004 y recogidos en el USRDS, se analizaron los factores de riesgo para el desarrollo de DMPT. Alos 3 años 4.105 pacientes presentaron DMPT; de estos pacientes, 2.393 (58,3%), desarrollaron una o más complicaciones achacables a la diabetes mellitus, de evolución más rápida que en la población general. La obesidad y el uso de Tac fueron los únicos factores de riesgo modificables que parecen afectar al riesgo de DMPT o sus complicaciones30. Marcén et al., en un estudio retrospectivo de 1.783 pacientes sometidos a trasplante renal sin diabetes mellitus en el momento del trasplante, analizan la incidencia de DMPT; 1.276 pacientes fueron tratados con Tac, MMF y esteroides; 507 pacientes recibieron CsA, MMF y esteroides. La incidencia de DMPT a los 6, 12 y 24 meses fue del 14,2, del 12,8 y del 13,3%, respectivamente. La incidencia acumulada fue del 21,6% y fue similar en relación con el empleo de Tac o CsA (el 22,3 frente al 19,7%; p = NS). No obstante, a los 24 meses, 14 de 50 pacientes diabéticos tratados con CsA (28%) y 74 de 161 pacientes diabéticos tratados con Tac (45,9%) estaban en tratamiento con insulina (p <0,05). Mediante el análisis de regresión de Cox, la inmunosupresión con Tac supuso un riesgo relativo de DMPT de 1,30 (IC 95%, 1,02-1,66; p <0,033)31. Webster et al. han llevado a cabo un metaanálisis de 30 ensayos en el que analizan a 4.102 pacientes que desarrollan DMPT, para comparar los efectos de la inmunosupresión inicial con CsA o Tac. A los 6 meses, la incidencia de RA fue menor en el grupo tratado con Tac (RR = 0,56 (IC 95%, 0,36-0,86), tendencia que se mantuvo al año de seguimiento, con un RR de 0,69 (IC, 0,60-0,79), efecto que persistía a los 3 años. La incidencia de DMPT con requerimiento de insulina fue mayor en el grupo de Tac (RR = 1,86; IC, 1,11-3,09). Este exceso de DMPT con Tac se vio incrementado con altas concentraciones plasmáticas del fármaco (p = 0,003)32. La mayor incidencia de DMPT con Tac se ha confirmado en un estudio prospectivo abierto, con 6 meses de seguimiento, en el que 682 pacientes con trasplante renal de novo fueron aleatorizados al grupo 1, 336 pacientes (49,26%) fueron tratados con esteroides, CsA y MMF; el grupo 2, con 346 pacientes (50,73%) fue tratado con esteroides, Tac y MMF. A los dos grupos se les realizaba terapia de inducción con basiliximab. La incidencia de DMPT o intolerancia a la glucosa fue menor con CsA que con TAC (26 frente al 33,6%; p = 0,04). No existieron diferencias respecto a la aparición de RA, pérdida del injerto o fallecimiento (12,8 frente al 9,8%; p = 0,2). Así pues, se ha demostrado que la CsA confiere un menor riesgo de DMPT e intolerancia a la glucosa y, si se desarrolla DMPT, ésta es menos grave. Esto sucede pese a que la dosis de esteroides no difiere en el grupo de tratamiento con Tac entre los que desarrollan DMPT y los que no la desarrollan33. Araki et al. han realizado un estudio retrospectivo, comparativo entre cohortes, de 528 receptores de un trasplante renal de donante vivo (49,8 %) o de cadáver (50,2 %), en un período de 8 años. Se evaluaron tres grupos: pacientes tratados con CsA (grupo 1, n = 263), pacientes tratados con Tac (grupo 2, n = 60) o pacientes tratados con SrL (grupo 3, n = 205). El período de seguimiento analizado fue de 39,2 meses. Se realizó inducción con basiliximab (63,6%), timoglobulina (25%) u OKT3 (11,4%), y la inmunosupresión de mantenimiento fue MMF, en combinación con CsA, Tac o SRL. Las incidencias de DMPT en los grupos 1, 2 y 3 fueron del 7,6, del 11,7 y del 5,9%, sin significación estadística entre grupos. Los pacientes con DMPT eran de mayor edad (p = 0,007) y tenían un mayor IMC en el momento del trasplante, así como al sexto mes y al año (p <0,001) y presentaron más episodios de RA tratados con pulsos de esteroides (p = 0,012). Con el análisis multivariante, los factores de riesgo de DMPT (definida por la necesidad de insulina) fueron: uso de Tac (HR = 3,79; p = 0,007), episodios de RA tratados con esteroides (HR = 2,49; p = 0,0115), edad (por décadas) (HR = 1,41; p = 0,0116) y el IMC (HR = 1,15; p <0,0001). En los tratados con Tac, el inicio del tratamiento con insulina fue más precoz y ocurrió con menos dosis acumuladas de esteroides34. Para valorar si influyen la concentración plasmática y la dosis de Tac en el desarrollo de DMPT, Rodrigo et al. revisan, en un análisis retrospectivo a 9 años, 578 trasplantes renales en los que 78 pacientes desarrollan DMPT según criterios de la American Diabetes Association (ADA) de 2003. La incidencia de DMPT al año del trasplante es del 27,6% (21 sujetos; IC 95%, 18-39,1%) y la incidencia de DMPT que requiere tratamiento antidiabético es de 14,4% (11 pacientes; IC 95%, 7,5-24,4). En el estudio univariante, los factores de riesgo para el desarrollo de DMPT fueron edad avanzada (>50 años), el IMC elevado y una menor ganancia de peso al primer año; no obstante, en el análisis multivariante sólo la edad superior a 50 años fue determinante del desarrollo de DMPT en el primer año del trasplante. La incidencia de disfunción renal tras el trasplante, RA, retirada y dosis acumulativa de esteroides o el uso de estatinas no se correlacionaron con el desarrollo de DMPT. El primer valor plasmático de Tac elevado fue un factor de riesgo para el desarrollo de DMPT; la relación entre el nivel valle y la dosis total del día previo de Tac continuó siendo significativamente elevada durante el primer año del trasplante en los pacientes con DMPT. Sólo el primer nivel plasmático de Tac superior a 20 ng/ml fue un determinante independiente del desarrollo de DMPT en el primer año del trasplante. Así pues, este estudio reconoce la importancia de las primeras dosis tóxicas como indicador de un riesgo en el desarrollo de la DMPT y dado que las características de la población con niveles iniciales elevados de Tac son la mayor edad y la obesidad, se debe extremar el control y quizá reducir la dosis inicial de Tac para evitar el riesgo de DMPT en este grupo de pacientes35. En este sentido, en un estudio con 139 pacientes, Maes et al. demostraron que los valores de Tac superiores a 15 ng/ml en el primer mes posterior al trasplante renal se relacionaron con un mayor riesgo de diabetes mellitus en el primer año posterior al trasplante36. En un interesante trabajo de Luan et al.37 se analiza la incidencia de DMPT y de prediabetes en una población sometida a trasplante renal antes y después de un cambio de CsA a Tac por indicación médica al cabo de 17,3 ± 17,7 meses de aquél. De un total de 704 pacientes con trasplante renal no diabéticos, 171 fueron cambiados a tratamiento con Tac (grupo 1) y 533 permanecieron en tratamiento con CsA (grupo 2). La frecuencia de DMPT y prediabetes fue del 15,2 y del 22,1% en el grupo 1 y en el grupo 2, del 15,6 y del 25,8%, respectivamente (p = 0,90 para DMPT y p = 0,38 para prediabetes). Los autores llegan a la conclusión de que una conversión relativamente tardía a Tac, en comparación con el mantenimiento de CsA, ocasiona un riesgo similar de alteración del metabolismo de la glucosa. En una revisión efectuada por Van Hooff et al. se analizan la incidencia, factores de riesgo, mecanismos, prevención y tratamiento de la DMPT inducida por Tac, y se indica un esquema de abordaje de la inmunosupresión en relación con la presencia de DMPT, que incluiría la disminución de las dosis de Tac hasta valores, tras el tercer mes, comprendidos entre 4 y 7 ng/ml, y la supresión precoz de los esteroides. Si no se conseguía un control adecuado de las glucemias y la resistencia a la insulina era normal, la sustitución de Tac por CsA o una inmunosupresión sin ICN sería una opción38. En la tabla 5 y en la figura 1 se recogen las recomendaciones respecto a la actitud a tomar en el caso de tratamiento con ICN y presencia de DMPT.
Inhibidores de mTOR
En cuanto al tratamiento con este grupo de fármacos inmunosupresores, iniciado con el ánimo de evitar los efectos tóxicos de los ICN, deben plantearse los efectos que podrían causar sobre la insulina y el metabolismo de la glucosa. Hoy día se sabe que los inhibidores mTOR modulan las señales intracelulares del sustrato a los receptotes de insulina mediante la molécula mTORC1, que es un regulador del ciclo de la célula beta, lo que puede dar lugar a un incremento en la resistencia a la insulina y al deterioro del metabolismo de la glucosa. Todo ello implica que el uso de rapamicina podría alterar la adaptación de la célula beta a la resistencia a la insulina39,40. Basándose en estos hechos, Teutonico et al. se plantearon analizar cuál sería el efecto de la retirada de los ICN y conversión a SRL sobre la resistencia a la insulina y la respuesta de las células beta. Para ello, se diseñó un estudio prospectivo abierto que analizó a tres grupos de pacientes sometidos a trasplante de novo durante 6 meses. Fueron divididos en tres grupos: grupo 1, 26 pacientes tratados con CsA y NCI convertidos a SRL; grupo 2, 15 receptores de riñones subóptimos tratados con prednisona + Tac- SRL con retirada de Tac a 3 meses, y grupo 3, 70 controles sanos. Se realizaron los tests de sobrecarga de glucosa y de resistencia a insulina en los tres grupos en el momento 0 y 6 meses después. Al inicio, el 43,9% de los pacientes presentaron glucemia en ayunas alterada y el 31,7% intolerancia a la glucosa. A los 6 meses, el porcentaje de pacientes con glucemias basales alteradas fue del 41,5%, la intolerancia a la glucosa aumentó en un 30% y el 9,75% desarrollaron DMPT. Así pues, la retirada de ICN y su sustitución por SRL no sólo no mejora el perfil glucémico, sino que también se detecta un incremento en la intolerancia a la glucosa. Dada la correlación positiva entre este aumento y el de los valores de triglicéridos tras la conversión, se indica que la hipertrigliceridemia podría desempeñar un papel en el empeoramiento del metabolismo glucídico tras la conversión a SRL41. Un estudio retrospectivo con datos del USRDS del período comprendido entre 1995 y 2003 analiza en 20.124 pacientes sometidos a trasplante sin diabetes mellitus, la asociación del empleo de SRL al tiempo del trasplante renal y DMPT en comparación con pacientes con trasplante renal tratados con CsA y MMF o Aza, y confirma que el uso de SRL se asocia de forma independiente con una mayor incidencia de DMPT. Los pacientes tratados con SRL tuvieron un mayor riesgo de desarrollar DMPT, ya usado en combinación con CsA (HR ajustado = 1,61; IC 95%, 1,36-1,90), Tac (HR ajustado = 1,66; IC 95%, 1,42-1,93), o MMF o Aza (HR ajustado = 1,36; IC 95%, 1,09-1,69). Se obtuvieron resultados similares en un subgrupo que incluyó a 16.861 pacientes a quienes no se cambió su régimen inmunosupresor en el primer año posterior al trasplante renal42. En una revisión sistemática Cochrane, se analizan 33 ensayos clínicos, 27 con sirolimus y cinco con everolimus. Cuando se convirtió a mTOR desde un ICN, no se encontraron diferencias en cuanto a RA. Cuando el tratamiento se reemplazó a antimetabolitos se redujo el RA (RR = 0,84; IC, 0,71-0,99) y se incrementó la hipercolesterolemia (RR = 1,65; IC, 1,32-2,06). No hubo diferencias en cuanto a mortalidad, pérdida de injerto o neoplasias. Es llamativo el hecho de que no se comente la incidencia de DMPT en esta revisión43. El Encuentro Internacional de Expertos que tuvo lugar el 19 de febrero de 2003 resume su posición respecto al tratamiento inmunosupresor y la DMPT en los siguientes puntos: a) individualización del tratamiento inmunosupresor según su riesgo de desarrollar diabetes mellitus; b) la dosis de esteroides debería reducirse precozmente e intentar reducir la dosis de los ICN, en los pacientes de mayor riesgo, y c) deben considerarse regímenes inmunosupresores que ahorran esteroides, como la inducción con anticuerpos que permitan la retirada precoz de esteroides10. En la tabla 6 se recogen las conclusiones de nuestro grupo en relación con la DMPT y los inhibidores de mTOR.
TRATAMIENTO DE LA DIABETES MELLITUS POSTERIOR AL TRASPLANTE RENAL
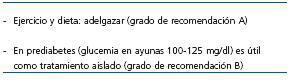
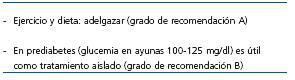
Como ya se ha comentado, no existen datos con suficiente evidencia sobre el tratamiento de la DMPT, por lo que las pautas de cambio de estilo de vida y tratamiento, ya sea con antidiabéticos orales (ADO) o con insulina deben extrapolarse de las Guías sobre el tratamiento de la DM tipo 2 en la población general (tabla 2). La ADA elabora periódicamente un estudio de opinión de expertos sobre este tema y recientemente ha actualizado las Guías sobre el tratamiento de la DM. En relación con la prevención primaria realiza las siguientes recomendaciones: los pacientes con prediabetes o con DM deben llevar un control dietético ayudados por personal cualificado. La reducción de peso (un 7% del peso corporal) se recomienda en todos aquellos sujetos con riesgo de desarrollar DM y una dieta con reducción en grasas e hidratos de carbono es eficaz al año. La actividad física regular (150 minutos a la semana) y cambios en el comportamiento son componentes importantes de los programas de pérdida de peso. Respecto a la prevención secundaria, se debe vigilar la fuente de hidratos de carbono, limitar las grasas saturadas a menos del 7% del total de las calorías y utilizar dietas bajas en colesterol (<200 mg/día). Respecto a las proteínas y en pacientes con función renal normal, no hay evidencia para indicar modificaciones sobre la ingestión proteica usual (15-20% de la energía calórica diaria). Otro apartado trata de la prevención de las complicaciones (prevención terciaria); así, una reducción de la ingestión proteica a 0,8-1 g/kg/día en sujetos en los primeros estadios de la insuficiencia renal y a 0,8 g/kg/día en los estadios avanzados, puede enlentecer la progresión de la insuficiencia renal y reducir la microalbuminuria. El control dietético también puede tener un efecto favorable sobre la retinopatía y el riesgo cardiovascular44. En la tabla 7 se refleja la opinión del grupo respecto al tratamiento del paciente con DMPT. ¿Qué ocurre en el trasplante respecto a la obesidad y la DMPT? La obesidad es muy frecuente tras el trasplante renal y sus causas son multifactoriales45. En un estudio observacional de cohortes retrospectivo de 294 receptores de trasplante renal con injerto funcionante a 6 meses, Sancho et al. estudian si los receptores con sobrepeso presentan peores tasas de supervivencia del injerto y mayor mortalidad frente a los que pacientes con un peso normal. Se analizan dos grupos según el IMC en el momento del trasplante: grupo de peso normal (NW): n = 160, IMC <25 kg/m2 y grupo con sobrepeso (OW): n = 134, IMC >25 kg/m2 y <30 kg/m2. El seguimiento medio fue de 53,4 meses y se analizó la supervivencia a 5 años. El régimen inmunosupresor fue de CsA o Tac + MMF + esteroides, con inducción con basiliximab o timoglobulina según criterio clínico. Los pacientes del grupo OW eran de mayor edad, tenían mayor prevalencia pretrasplante de HTA, HVI e hiperlipidemia. La supervivencia del injerto fue similar en ambos grupos; sin embargo, la supervivencia de pacientes a uno, 3 y 5 años fue más baja en el grupo OW: del 99, 92 y 90% frente al 99, 99 y 98% (p = 0,002), con tres muertes de causa cardiovascular en el grupo OW (p = 0,017). En el análisis de regresión se demostró que el estado OW, con un RR de 5,2 (IC, 1,1-24,6; p = 0,36) fue un factor de riesgo independiente de mortalidad. El grupo OW presentó una creatinina más elevada (p = 0,007), una proteinuria superior a 0,5 g/24 en más pacientes a los 6 meses (el 23,7 frente al 12,9%; p = 0,023) y una presión arterial sistólica mayor a los 2 años (p < 0,05). Respecto a la DMPT, fue más frecuente en el grupo OW (el 31,7 frente al 10,5%; p < 0,0001). Lo mismo ocurrió con las tasas de colesterol total y de triglicéridos46. Antes del inicio de cualquier tratamiento médico de la DMPT debe llevarse a cabo una concienciación del paciente para que cambie su estilo de vida. La importancia de este hecho se pone de manifiesto en un estudio llevado a cabo en 115 sujetos sometidos a trasplantes a quienes se les realizó un test de sobrecarga oral de glucosa (TSOG). Según el resultado de éste, los pacientes fueron estratificados en dos grupos: en el grupo 1, 28 pacientes presentaban intolerancia a la glucosa y 8 pacientes tenían DMPT. Recibieron una modificación intensiva del estilo de vida, en la que se incluían asesoramiento dietético y físico; en el grupo 2, los 79 pacientes tenían un TSOG normal y recibieron información general sobre el cambio en el estilo de vida. A ambos grupos se les repitió el TSOG a los 6 meses. La modificación del estilo de vida en el grupo 1 dio como resultado una mejoría de la glucemia posprandial en un 15% de los pacientes, mientras que en el grupo 2 empeoró en un 12% de los casos. En el grupo 1, 11 pacientes (44%) normalizaron la intolerancia a la glucosa y sólo uno desarrolló DMPT; 4 pacientes (58%) con DMPT mejoraron, dos hacia a la intolerancia a la glucosa y dos a la normalización. En el grupo 2, 10 pacientes (14%) desarrollaron intolerancia a la glucosa y 2 pacientes (3%), DMPT47. Un aspecto importante que debe tenerse en cuenta es el límite y la intensidad del control de la DM. Numerosos estudios han analizado este tema y con resultados a veces controvertidos. El estudio DCCT (Diabetes Control and Complications Trial) es un estudio aleatorizado prospectivo multicéntrico cuyo objetivo fue el de analizar si el tratamiento intensivo reducía las complicaciones de la DM. Se estudiaron un total de 1.441 pacientes con DM insulinodependiente (DMID). En la cohorte 1 se incluyeron 726 pacientes con DMID de uno a 5 años de evolución, sin retinopatía al inicio del estudio y con una albuminuria inferior a 40 mg/24 h (prevención primaria). La cohorte 2 comprendía a 715 pacientes con DMID de uno a 15 años, retinopatía moderada y albuminuria inferior a 200 mg/24 h (intervención secundaria). Ambas cohortes fueron aleatorizadas a recibir tratamiento convencional con una o dos inyecciones diarias de insulina o tratamiento intensivo con bomba de insulina o tres o más inyecciones diarias de insulina, con monitorización frecuente de la glucemia: grupo 1 (378), cohorte 1 y tratamiento convencional; grupo 2 (348), cohorte 1 y tratamiento intensivo; grupo 3 (352), cohorte 2 y tratamiento convencional, y grupo 4 (363), cohorte 2 y tratamiento intensivo. El seguimiento medio fue de 6,5 años. En el grupo 2 se redujo el riesgo medio ajustado para el desarrollo de retinopatía en un 76%, comparado con el grupo 1. En el grupo 4 se enlenteció la progresión de la retinopatía en un 54% y se redujo el desarrollo de retinopatía proliferativa o grave no proliferativa en un 47%. En las dos cohortes combinadas, el tratamiento intensivo redujo la aparición de microalbuminuria (>40 mg/24 h) en un 39%, y la de albuminuria (>300 mg/24 h) en un 54%; la incidencia de neuropatía clínica se redujo un 60%. El efecto adverso principal asociado con el tratamiento intensivo fue un aumento en dos a tres veces en la incidencia de hipoglucemia severa48. El estudio de Kumamoto es un ensayo clínico multicéntrico aleatorizado llevado a cabo en 102 pacientes japoneses con DM tipo 2 y con un diseño similar al del DCCT. Tenía como objetivo el analizar si el tratamiento intensivo con insulina prevenía las complicaciones vasculares de la DM tipo 2. Los pacientes fueron aleatorizados a dos grupos: grupo 1 sin afectación microvascular (prevención primaria), con 25 pacientes tratados con insulina estándar y 26 con dosis múltiples de insulina y grupo 2, con afectación microvascular (prevención secundaria), 25 pacientes tratados con insulina estándar y 26 con dosis múltiples de insulina. El seguimiento medio fue de 6 años. En el grupo 1, un 32% de los pacientes del grupo de terapia convencional presentó retinopatía y un 7,7% en el grupo de terapia intensiva; la nefropatía, analizada por la presencia de albuminuria, fue de un 28% frente a un 7,7%. En el grupo grupo 2, la progresión de la retinopatía se objetivó en un 44% de pacientes tratados con terapia estándar frente a un 19,2% en el grupo de terapia intensiva. La progresión de la nefropatía fue del 32% frente al 11,5%. Respecto a la neuropatía, en el grupo de terapia intensiva se detectó una mejoría significativa en la velocidad de conducción, mientras que en el grupo de terapia convencional se apreció un deterioro significativo. Los casos de hipoglucemia fueron escasos y no hubo diferencias significativas49. En el estudio UKPDS, con un objetivo similar, también en casos con DM tipo 2, 3.867 pacientes con DM tipo 2 de novo, fueron seguidos en tratamiento convencional con dieta (grupo 1, n = 1.138) o en tratamiento intensivo con sulfonilureas (clorpropamida, glibenclamida, glicazida) o con insulina (grupo 2, n = 2.729). El seguimiento fue de 10 años. Con el tratamiento intensivo se pretendía lograr cifras de glucemia inferiores a 110 mg/dl y con el tratamiento convencional el objetivo era conseguir la mejor glucemia posible con dieta (se añadió tratamiento si existían síntomas hiperglucémicos con glucemia superior a 273 mg/dl). La HbA1c fue del 7% (6,2%-8,2%) en el grupo 2 frente al 7,9% (6,9%- 8,8%) en el grupo 1 (reducción del 11% en el grupo 2). El grupo 2, en comparación con el grupo 1, tuvo una reducción del 12% (p = 0,029) en el riesgo de presentar cualquier complicación relacionada con la DM. La mayor parte de esta reducción se produjo en las complicaciones microvasculares (reducción del riesgo en un 25%, p = 0,0099). Como sucedió en el estudio DCCT, el grupo de tratamiento intensivo tuvo una mayor frecuencia de episodios hipoglucémicos (p <0,000)50. El estudio UKPDS se ha extendido a un análisis a 10 años para analizar si el tratamiento intensivo de la DM tipo 2 mantiene la disminución de la morbimortalidad cardiovascular a largo plazo. Ya sin tratamiento intensivo como objetivo, 3.277 pacientes fueron monitorizados anualmente durante 5 años en visitas a la clínica y hasta los 10 años con cuestionario, y sus datos fueron analizados según intención de tratar y mediante porcentaje de riesgo absoluto, de acuerdo con las categorías aleatorizadas en el UKPDS (terapia intensiva con sulfonilureas o insulina o metformina en obesos frente a restricción dietética). Los resultados del grupo tratado con sulfonilureas o insulina frente al grupo de terapia convencional fueron: cualquier episodio relacionado con la DM: 48,1% frente a 52,2% (p = 0,04); muerte relacionada con la DM: 14,5% frente a 17% (p = 0,01); muerte por cualquier causa: 26,8% frente a 30,3% (p = 0,007); IAM: 16,8% frente a 19,6% (p = 0,01); enfermedad microvascular: 11% frente a 14,2% (p = 0,001); ACVA y enfermedad vascular periférica (NS). En el grupo de metformina frente a terapia convencional los resultados fueron los siguientes: cualquier episodio relacionado con la DM: 45,7% frente a 53,9% (p = 0,01); muerte relacionada con la DM: 14% frente a 18,7%, (p = 0,01); muerte por cualquier causa: 25,9% frente a 33,1% (p = 0,002); IAM: 14,8% frente a 21,1% (p = 0,005); enfermedad microvascular, ACVA y enfermedad vascular periférica (NS). A pesar de una pérdida precoz de las diferencias en el control de la glucemia entre grupos, se mantienen una continua reducción en el riesgo microvascular y una incipiente reducción del riesgo para IAM y muerte por cualquier causa durante los 10 años de seguimiento posteriores al estudio. Se demuestra también un beneficio continuado tras administrar metformina en obesos51. El Estudio Steno 2 trata de demostrar en 169 pacientes con DM tipo 2 y microalbuminuria si el tratamiento intensivo y multifactorial de dicha enfermedad disminuye la mortalidad: grupo 1, terapia intensiva con dianas terapéuticas según ADA 2007 (n = 80) y grupo 2, terapia convencional según las Guías danesas de 1988 (n = 80). El seguimiento fue de 13,3 años. Grupo 1: tratamiento intensivo por objetivos: HbA1c inferior al 6,5%; colesterol total inferior a 175 mg/dl; triglicéridos inferiores a 150 mg/dl; PAS inferior a 130 mmHg, PAD inferior a 80 mmHg. Se administraron ARA2 a pesar de normotensión y 150 mg de AAS. Grupo 2: tratamiento multifactorial convencional (criterios de las Guías danesas 1988). Los resultados fueron, respecto a mortalidad global, una reducción absoluta de riesgo del 20% (p = 0,02, log-rank). HR en el grupo 1: 0,54 (IC, 0,32-0,89; p = 0,02; respecto a mortalidad cardiovascular: reducción absoluta de riesgo p = 0,03 (log-rank). Se registraron 51 episodios cardiovasculares en 25 pacientes del grupo 1 frente a 158 en 48 pacientes del grupo 2; la reducción absoluta de riesgo fue del 29% (HR = 0,41; IC, 0,25-0,67; p < 0,001). En cuanto a la nefropatía diabética, se detectó en 20 casos en el grupo 1 frente a 37 casos en el grupo 2 (RR = 0,44; IC, 0,28-0,77; p = 0,004); progresión de retinopatía diabética (RR = 0,57; IC, 0,37-0,88; p = 0,01); neuropatía, 39 frente a 53 (RR 0,53; IC, 0,34-0,81; p = 0,004). No hubo diferencias significativas en episodios de hipoglucemia (el 80% frente al 70%). Este estudio demuestra que en pacientes con DM tipo 2 en riesgo (microalbuminuria), la intervención intensiva con combinación de múltiples fármacos y modificación del estilo de vida conlleva efectos beneficiosos mantenidos con respecto a las complicaciones cardiovasculares y respecto a la mortalidad por cualquier causa y por causa cardiovascular. Existe, no obstante, un período de seguimiento tras la finalización del estudio en el que las variables tienden a converger52. Más recientemente, el estudio ADVANCE también pretende demostrar si el tratamiento intensivo de la DM tipo 2 disminuye la mortalidad cardiovascular. Analiza a 11.140 pacientes con DM tipo 2, con 5 años de seguimiento. Grupo 1: control de glucemia estándar y grupo 2: control intensivo con glicazida de liberación modificada más otros fármacos para conseguir una HbA1c ≤6,5%. El objetivo primario del estudio es la valoración de la frecuencia de muerte de causa cardiovascular, IAM no fatal o ACVA no fatal (macrovascular) y nueva nefropatía o empeoramiento de previa y retinopatía (microvascular). La HbA1c fue del 6,5% en el grupo de pacientes en tratamiento intensivo frente al 7,3% del grupo de tratamiento estándar. El tratamiento intensivo redujo la incidencia combinada de episodios macrovasculares y microvasculares (el 18,1% frente al 20,0%; HR = 0,90; p = 0,01) y los episodios microvasculares (el 9,4% frente al 10,9%; HR = 0,86; p = 0,01), principalmente por una reducción en la nefropatía (el 4,1% frente al 5,2%; HR = 0,79; p = 0,006), sin efecto sobre la retinopatía (p = 0,50). No hubo efecto significativo del tipo de control de la glucemia sobre los episodios macrovasculares (HR con tratamiento intensivo = 0,94; p = 0,32), muerte de causa cardiovascular (HR con tratamiento intensivo = 0,88; p = 0,12), o muerte de cualquier causa (HR con tratamiento intensivo = 0,93; p = 0,28). La hipoglucemia grave, aunque infrecuente, fue más común en el grupo de tratamiento intensivo (el 2,7% frente al 1,5% en el grupo de tratamiento estándar; HR = 1,86; p <0,001)53. Publicado simultáneamente, el estudio ACCORD analiza también el efecto del tratamiento intensivo de la DM tipo 2 sobre la mortalidad cardiovascular. Se ha llevado a cabo en 10.251 pacientes, con una edad media de 62,2 años, aleatorizados en dos grupos: grupo 1, con tratamiento intensivo para HbA1c inferior al 6,0% y grupo 2: con tratamiento estándar para HbA1c 7,0%-7,9%; un 35% habían tenido un episodio cardiovascular previo. El objetivo principal fue un parámetro compuesto de IAM no fatal, ACV no fatal o muerte de causa cardiovascular. El hecho de observar una mayor mortalidad en el grupo de tratamiento intensivo hizo que se suspendiera este grupo después de una media de seguimiento de 3,5 años. Al año, se consiguieron valores de HbA1c del 6,4 y del 7,5%, respectivamente, en el grupo de tratamiento intensivo y en el grupo de tratamiento estándar. El objetivo primario se produjo en 352 pacientes en el grupo de tratamiento intensivo, comparado con 371 en el grupo de tratamiento estándar (HR = 0,90; p = 0,16). Al mismo tiempo, 257 pacientes incluidos en el grupo de tratamiento intensivo fallecieron, en comparación con 203 fallecidos en el grupo de tratamiento estándar (HR = 1,22; p = 0,04). Tanto la hipoglucemia que requirió asistencia como una ganancia superior a 10 kg de peso fueron más frecuentes en el grupo de tratamiento intensivo (p < 0,001). Las conclusiones fueron que, comparado con el tratamiento estándar, el uso de tratamiento intensivo aumenta la mortalidad y no reduce significativamente los episodios cardiovasculares mayores. Estos hechos identifican un nuevo peligro derivado del tratamiento intensivo en pacientes de alto riesgo con DM tipo 254. Estos estudios, en su conjunto, refieren una mejoría relativa en las complicaciones macrovasculares y microvasculares de la DM tipo 2 pero, al mismo tiempo, indican que el tratamiento intensivo no se encuentra exento de riesgos cuando el objetivo es lograr una reducción en la HbA1c del 6,5% o menor. Una vez analizados los beneficios y los riesgos de la terapia antidiabética en la DM tipo 2 analizaremos las distintas guías, consensos y recomendaciones de expertos sobre cómo llevar a cabo la estrategia del tratamiento en este tipo de DM y, por extensión, en la DMPT. Las Guías de la ADA de 2008 indican unos estándares sobre los cuidados generales en la diabetes que incluyen, entre otros, la prevención o el retraso de la DM tipo 2, la prevención y el tratamiento de las complicaciones, la terapia educacional y las estrategias para mejorar el control de la diabetes. Se hace especial hincapié en el diagnóstico de prediabetes en los pacientes con sobrepeso y obesidad (IMC >25 kg/m2) y con otros factores asociados (inactividad física, mujeres con diabetes gestacional previa, HTA, dislipemia definida por: colesterol HDL <35 mg/dl y triglicéridos >250 mg/dl o antecedentes familiares), así como edad superior a 45 años. Si los tests son normales deben repetirse a intervalos de 3 años. Si se confirma la presencia de un estado prediabético, los tests deben realizarse cada año. Se recomienda llevar a cabo un TSOG a los pacientes con glucemia basal alterada (glucemia en ayunas de 100 mg/dl a 125 mg/dl) para definir mejor el riesgo de DM. Alos pacientes con prediabetes se les recomienda que pierdan peso y que realicen ejercicio físico diario. Los objetivos de un adecuado control de la DM son los siguientes: a) HbA1c <7,0%; b) glucemia plasmática preprandial 70-130 mg/dl, y c) glucemia capilar posprandial <180 mg/dl. La HbA1c es el mejor instrumento para el control de la glucemia. Los valores de HbA1c sirven para ajustar la pauta terapéutica. Unos niveles de HbA1c inferiores al 7% reducen las complicaciones microvasculares y neurológicas. Deben controlarse los demás factores de riesgo cardiovascular: 1) control de la presión arterial con presiones arteriales sistólicas inferiores a 130 mmHg y diastólicas inferiores a 80 mmHg, siendo los IECA los fármacos de elección; 2) control de la dislipemia: a) niveles aconsejados: LDL <100 mg/dl, pero en caso de enfermedad cardiovascular establecida conseguir LDL <70 mg/dl. Triglicéridos <150 mg/dl; b) modificaciones en el estilo de vida y estatinas como fármaco de elección; 3) tratamiento con aspirina (75-162 mg/día) como prevención secundaria en pacientes con enfermedad cardiovascular y como prevención primaria en pacientes con factores de riesgo cardiovascular (edad >40 años, HTA, dislipemia, albuminuria, antecedentes familiares de enfermedad cardiovascular), y 4) aconsejar al paciente que es necesario que no fume55. También la ADA, en 2006 y reeditadas en 2009, publica las Guías para el tratamiento de la DM tipo 2 con objetivos similares a los expuestos, reseñando varios hechos. Entre ellos que, además del objetivo general de mantener una HbA1c inferior al 7%, sobre una base individual, deben conseguirse valores de HbA1c como en los sujetos no diabéticos, de menos del 6%. Como tratamiento inicial, se debe indicar un cambio en el estilo de vida que conlleve disminución de peso, pero como esto no se mantiene en el tiempo, se recomienda asociarlo desde el principio con la administración de metformina. Se deben añadir rápidamente nuevos antidiabéticos orales (ADO) cuando la HbA1c objetivo no se logra. Por último, debe añadirse insulina cuanto antes, cuando no se cumplen los objetivos terapéuticos56,57. En la tabla 8 se indican las conclusiones del grupo en relación con las modificaciones en el estilo de vida y en la tabla 9, los objetivos del tratamiento de la DMPT.
Antidiabéticos orales
Respecto al uso de ADOs nos interesa especialmente enfocar el tratamiento en el hecho de que muchos de nuestros pacientes presentan insuficiencia renal. Varios autores analizan el tratamiento de la DMPT5-9, incluyendo el consenso de 200310. Robles et al.58 realizan una revisión exhaustiva sobre el manejo de los ADO en la insuficiencia renal crónica, que resumimos a continuación.
Secretagogos
Sulfonilureas
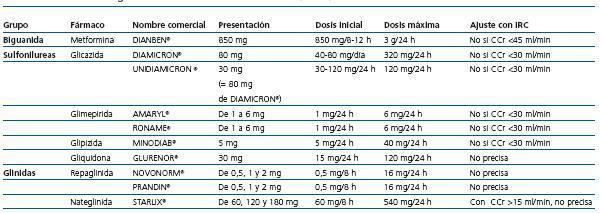
Presentan metabolización hepática; los metabolitos pueden ser activos, parcialmente activos o inactivos y se eliminan por vía renal/biliar. El de mayor eliminación biliar (95%) es la gliquidona (Glurenor®) y los de menor eliminación son gliburida, glimepirida (Amaryl®) y glipizida (Minodiab®). En la IRC estarían contraindicadas la glibenclamida (Euglucon®), la clorpropamida (Diabinese®) y la gliburida (no disponible en España) por riesgo de hipoglucemias y, en general, se deben evitar todas en IRC en estadios 4 y 5. En IRC en estadios 1 a 3, el ADO de elección sería la gliquidona y en segundo lugar la glipizida y la glimepirida.
Glinidas: repaglinida (Prandin® y Novonorm®)
No existe riesgo de hipoglucemia en la IRC por eliminación biliar y vida media muy corta. Posee un óptimo efecto sobre la glucemia en ayunas y posprandial. Su asociación con gemfibrozilo está contraindicada.
Nateglinida (Starlix®)
Se debe ajustar la dosis en estadios de IRC 3 y 4, ya que los metabolitos activos se eliminan por vía renal; estaría indicada en combinación con metformina.
Biguanidas (Metformina®)
Disminuye la neoglucogénesis y la resistencia a la insulina de los tejidos; asimismo, disminuye la oxidación de ácidos grasos y la hipertrigliceridemia; logra una estabilización del peso; se eliminan en un 90% por vía renal; estaría contraindicada por riesgo de acidosis láctica en la IRC en estadios 3 a 5, aunque podría utilizarse en IRC en estadio 3 con un control estricto. Se contraindica su empleo también en casos de insuficiencia cardíaca congestiva en tratamiento farmacológico, hepatopatía, abuso crónico de alcohol, septicemia o enfermedad que disminuya la perfusión tisular, y debe suspenderse antes de administrar contrastes radiológicos por el riesgo de precipitar la acidosis láctica en caso de deterioro de la función renal.
Inhibidores de la alfa-glucosidasa
Acarbosa (Glucobay®, Glumida®), miglitol (Diastabol®, Plumarol®)
Tienen un efecto hipoglucemiante posprandial; son supresores competitivos de las enzimas del borde «en cepillo» de los enterocitos, y retrasan la absorción de los monosacáridos. La acarbosa no se absorbe, pero sí sus metabolitos activos. El miglitol se elimina por vía renal. Estarían contraindicadas en enfermedades intestinales e insuficiencia hepática. Respecto a la IRC, la acarbosa se contraindica en estadios 3 a 5 y el miglitol en cualquier estadio de la IRC.
Glitazonas (tiazolidindionas)
Rosiglitazona (Avandia®) y pioglitazona (Actos®)
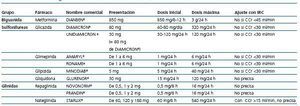
Tienen un efecto hipoglucemiante lento, alcanzando un máximo tras unas 8 semanas. Reducen la resistencia a la insulina mediado por la activación del receptor PPAR-gamma. Como efectos secundarios que deben destacarse, son hepatotóxicos con aumentos de transaminasas superiores a 2,5 veces y conllevan ganancia de peso, por lo que están contraindicadas en insuficiencia cardíaca congestiva (ICC) de grados III y IV de la New York Heart Association ( NYHA); pueden provocar anemia. No se conocen interacciones con los ICN. Si se decide su uso, respecto a la rosiglitazona existen datos limitados en IRC en estadios 4 y 5, por lo que debe utilizarse con precaución. La pioglitazona no precisa ajuste de dosis en IRC. En general, está contraindicada su asociación con insulina. Respecto al uso de ADOs en el trasplante renal existen escasos datos sobre la seguridad del empleo de glipizida y gliburida; en cuanto a las glinidas, no existen estudios prospectivos en trasplantes. La glibenclamida eleva los niveles de ICN. Existen datos sobre la utilización de la glicazida en el trasplante, sin efectos adversos y con una creatinina media de 1,54 mg/dl. En cuanto a las glitazonas, existen pequeños estudios prospectivos con ambas, rosiglitazona y pioglitazona, sin efectos secundarios ni interacciones con anticalcineurínicos58,59. Mannon lleva a cabo una revisión sobre el tratamiento de la DMPT y menciona el uso de los incretín-miméticos como el péptido agonista similar al glucagón (exenatide) y los inhibidores de la dipeptidil peptidasa 4 (sitagliptina)60. Lubowsky et al. revisan el tratamiento de la diabetes en la insuficiencia renal y respecto a los nuevos ADOs, la exenatida o la pramlintida no se recomiendan en estadios 3 y 4 de IRC. En el caso de la sitagliptina no se han establecido su eficacia y su seguridad en IRC, pero si se emplea, debe disminuirse la dosis en estadios 3 a 561,62. En las tablas 10 y 11 se indican las conclusiones de nuestro grupo y se exponen los distintos tipos de ADOs, con su ajuste de dosis en relación con el grado de IRC.
Tratamiento con insulina
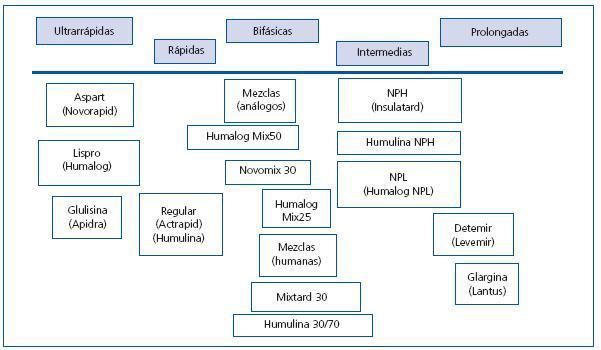
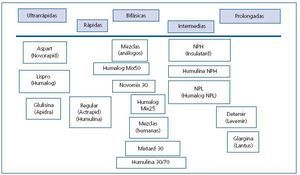
En la tabla 12 se plantea el consenso general sobre los criterios de abordaje del paciente que debe recibir tratamiento insulínico y las consideraciones generales sobre el uso de la insulina en el paciente sometido a un trasplante. Respecto al empleo de insulina sola o en combinación con ADO, resulta interesante una revisión de Wyne y Mora, sobre 155 artículos de un período comprendido entre 1975 y 2007 sobre las distintas opciones terapéuticas de la DM tipo 2 con insulina en distintas formulaciones o en combinación con ADO63. En esta revisión destaca un análisis del uso temprano de la insulina en la DM tipo 2 basado en que en la intolerancia a la glucosa existe variabilidad en la secreción insulínica ante estímulos de sobrecarga (medidos mediante el índice de sensibilidad a la insulina), y se ha demostrado una resistencia periférica y una disfunción de las células beta (déficit relativo de insulina). En este sentido, en el estudio UKPDS realizado en casos con DM tipo 2 de novo, mediante el test de HOMA, se demuestra la necesidad de insulina con el tiempo para mantener los objetivos de HbA1c. Algunos autores promueven un tratamiento combinado con agentes frente a la insulinorresistencia y secretagogos e incluso insulinización temprana para alcanzar un estado de normoglucemia que mejoraría la pendiente de disfunción de las células beta. Se ha especulado sobre el riesgo cardiovascular asociado con la insulinorresistencia y con la hiperinsulinemia, pero esto no se ha demostrado en estudios en los que se evalúa el riesgo cardiovascular en la DM tipo 2 con tratamiento insulínico (UKPDS50 y DIGAMI64), aunque la insulinización intensiva en pacientes con IAM reducía el riesgo de mortalidad. En cuanto a la obesidad, los pacientes tratados con insulina en el estudio UKPDS ganan más peso, por lo que algunos investigadores recomiendan el uso combinado de metformina más insulina en pacientes con IMC elevados. Con las nuevas insulinas ultralentas como determir (Levemir®) se ha demostrado una pérdida o una estabilización del peso, por la menor incidencia de hipoglucemia y la ingestión extra para su tratamiento. En esta revisión de Wyne y Mora, se analizan las características de las distintas preparaciones insulínicas. La insulina regular (Actrapid®, Humulina®) puede ser usada 30 minutos antes de la comida, para controlar el pico posprandial, pero puede producir hipoglucemia si la ingestión no resulta adecuada y por la vida media, si se utilizan muchas unidades, lo que conllevaría hiperinsulinemia con una mayor ingestión fuera de las comidas y un aumento de peso. Los análogos de insulina de corta acción: insulina lispro (Humalog®), aspartica (Novorapid ®) o glulisina (Apidra®), presentan menor agregabilidad y mayor rapidez de acción, con un pico a la hora y sin efecto a las 4 horas; se ajustan a los picos glucémicos postingestión con baja incidencia de hipoglucemia posprandial. Las insulinas intermedias, NPH (Insulatard ®), y lentas poseen el máximo efecto a las 4-8 horas y una duración máxima de 10-16 horas. Las ultralentas tienen una duración inferior a las 24 horas, pero una variación interdías, lo que condiciona hipoglucemias imprevisibles; la insulina glargina (Lantus®) permite un mantenimiento de insulinización basal durante 24 horas por su liberación sostenida con una sola dosis, pero esto sólo se mantiene en dosis bajas; se logra un control similar que con el conseguido con NPH, con un menor riesgo de hipoglucemia nocturna; la insulina detemir (Levemir®), por la acetilación de la molécula y la unión reversible a la albúmina, permite una liberación lenta. El tiempo de acción es similar al de la glargina, lo que permite una inyección al día; en la DM tipo 2, comparada con NPH, las hipoglucemias y la ganancia de peso fueron menores. Las insulinas inhaladas presentan rapidez de acción mayor que lispro y regular y duración de acción intermedia entre lispro y regular, pero hoy día están en desuso. En la figura 2 se exponen los tipos de in sulina según su duración de acción. Respecto a las estrategias de tratamiento, una pauta basada en la administración de insulina en una sola dosis de mantenimiento junto con insulina a demanda de corta duración o ADO para controlar los picos posprandiales sería la opción más razonable en la DMPT.
Estrategias en el uso de insulina
Concepto basal/bolo
Una regla general es que hay que adecuarse a la respuesta fisiológica durante 24 horas. Una insulinización basal (IB) debe adecuarse con las necesidades posprandiales; su función consiste en suprimir la producción hepática de glucosa posterior a la ingestión y en los períodos entre comidas. En pacientes con producción pancreática propia, la IB debe ser un 50-75% de las necesidades insulínicas. Los bolos de insulina tratarían los picos glucémicos posprandiales, y deberían constituir un 10-20% de las necesidades totales de insulina. Las distintas posibilidades de tratamiento insulínico, solas o en combinación, son las siguientes: a) IB. Como ya se ha expuesto, hoy día se preconiza el uso precoz de insulina en la DM tipo 2. Las ventajas de añadir IB a un tratamiento previo con ADO (denominada «terapia puente») es que se realiza en un solo pinchazo y que el paciente debe familiarizarse con uso de insulina para cuando se precise terapia en bolo, lo que favorece el cumplimiento; b) sulfonilureas más insulinización basal en monodosis. La combinación de sulfonilureas con insulinas de duración intermedia o alta puede mejorar el perfil en aquellos pacientes en los que comienza a fallar el tratamiento con este ADO solo; c) insulinización con insulina en bolo. Más complejo y menos atractivo para un buen cumplimiento que una sola dosis, y d) insulinización con IB más bolo. Existía la tendencia a tratar la DM tipo 2 cuando el control con ADO era inadecuado, suspendiéndolo e iniciando mezclas estables de insulina NPH y regular en proporción 70/30, aunque generalmente los controles no eran óptimos, con hiperglucemias intermitentes y mayor tendencia a hipoglucemias nocturnas. Otra situación de tratamiento sería la de añadir ADO a pacientes que ya reciben insulina: a) insulina más metformina. Consigue descensos de HbA1c comprendidos entre el 1 y el 2,5%; b) insulina más glitazonas. Este ADO consigue mejorías de la sensibilidad periférica de la insulina. Varios estudios con rosiglitazonas (4-8 mg) y pioglitazonas (15-30 mg) han demostrado, en pacientes tratados con insulina y mal controlados, descensos del 1- 1,5% de los valores de HbA1c; el edema aparecía en el 15% de los pacientes con riesgo de ICC, por lo que, como ya se ha indicado, no debe utilizarse en esta situación; c) combinación de insulina en monodosis más ADO. En casos de DM tipo 2 previamente tratada con sulfonilureas y mal controlada, el ensayo FINFAT realiza cuatro combinaciones de insulina fija (NPH nocturna) con gliburida, metformina, gliburida más metformina o insulina NPH matutina. En el grupo tratado con metformina se obtenía un mejor control, con un menor riesgo de sobrepeso e hipoglucemia, aunque hubo una tasa de abandonos del 21%65. En el ensayo Treat to Target han sido tratados pacientes con DM tipo 1 con distintas combinaciones de ADO. Se les ha suplementado NPH nocturna frente a Lantus; se obtuvieron descensos de HbA1c (del 8,6 al 6,9%), con pocos efectos secundarios y dosis nocturnas de NPH de 10 U; con la insulina Lantus se demostró una reducción del riesgo de hipoglucemia mayor del 40%66, y d) combinación de ADO más insulina premezclada en una, dos o tres dosis diarias. El ensayo INITIATE demostró que comenzar con dos dosis de 5-6 U de insulina bifásica 30/70 era superior que insulina glargina en monodosis de 12 U67. El estudio 1-2-3 comienza con dosis bajas en monodosis de 30/70 y según controles aumenta cada 3 días el número de dosis hasta tres al día, con lo que se alcanza una HbA1c inferior al 7% hasta en el 77%68.
Guías prácticas para el tratamiento insulínico
Hoy día se aboga por el uso combinado de secretagogos con metformina y/o glitazonas, así como por un uso precoz de la insulina, sobre todo con preparaciones lentas o ultralentas de administración nocturna o vespertina, con varias ventajas, entre ellas, que se administran en una sola inyección, con un control más cómodo y un efecto sinérgico con los preparados orales. Se recomienda: a) continuar con el tratamiento con ADO, y quizá descender la dosis de secretagogos; b) preparaciones de insulina con 5-10 U diarias (glargina, NPH o mezclas) de administración preferiblemente nocturna; c) ajuste de dosis semanalmente según 2-5 determinaciones en ayunas; d) aumento de dosis semanal según determinaciones capilares y siempre que las glucemias nocturnas no sean menores de 72 mg/dl, aumentando 2 U si los controles de glucemia capilar son de 100-120 mg/dl, 4 U si son de 121-140 mg/dl, 6 U si son de 141-180 mg/dl y 8 U si son superiores a 180 mg/dl; además, si los secretagogos son eliminados deben sustituirse por insulina preprandial; la metformina debe mantenerse para evitar el sobrepeso, siempre que no exista insuficiencia renal o cardíaca. Las glitazionas deben mantenerse para mejorar la sensibilidad insulínica, combinando la insulina antes de usar dosis altas para evitar el aumento de peso. Al aumentar las necesidades insulínicas se precisan estrategias más intensivas que requieren regímenes que combinen bolos con insulina basal. Para ello, si la glucemia en ayunas es de 80-120 mg/dl, pero la HbA1c es superior al 7% y/o la glucemia antes de la cena es superior a 140-180 mg/dl, convendría añadir insulinas de acción rápida; si se usa de forma basal insulina glargina, hay que añadir insulinas rápidas (lispro o aspártica) en la comida principal o en todas; si hay un uso basal de insulina NPH nocturna, hay que añadir NPH por la mañana más insulina rápida en las comidas. En una revisión no sistemática de la literatura se analizan las ventajas de un tratamiento precoz con insulina. En la DM tipo 2 la función de las células beta declina y la insulinización precoz del tratamiento exclusivamente con insulina aumenta la supervivencia y la función de las células beta, así como mejora la sensibilidad periférica a la insulina. Por el contrario, las sulfonilureas reducen la supervivencia de las células beta y, a largo plazo, poseen un efecto negativo directo sobre su capacidad secretora. Estos efectos no aparecen con las glitazonas pero, como ya hemos indicado, favorecen la retención de líquidos, por lo que uso se encuentra limitado si existen cardiopatías. Por otro lado, las hiperglucemias posprandiales, que se relacionan sobre todo con el desarrollo de complicaciones macrovasculares, se controlan mucho mejor con insulina69. Lubowsky et al., en la revisión sobre el tratamiento de la diabetes en la insuficiencia renal, respecto a las insulinas, indican que la insulina de acción intermedia (NPH) sería la de elección en hiperglucemias en ayunas y en pacientes en tratamiento con corticoides y coincidiendo con la toma de éstos; en cuanto a las insulinas de acción lenta, la insulina detemir se une a la albúmina, por lo que en situaciones de hipoalbuminemia no se recomienda su uso61. En la tabla 13 se resume el consenso sobre la aproximación al tratamiento con insulina en la DMPT, según los distintos escenarios posibles. La National Kidney Foundation publicó en febrero de 2007 las Guías de Práctica Clínica y Recomendaciones sobre la Diabetes y la Enfermedad Renal Crónica, basadas en una revisión sistemática de la literatura sobre la diabetes y la enfermedad renal, que se consideran terminológicamente como nefropatía diabética13. En nuestra revisión analizamos las siguientes Guías y recomendaciones: - Guía 1: cribado y diagnóstico. - Guía 2: tratamiento de la hiperglucemia y cuidados generales de la diabetes en la insuficiencia renal crónica (estadios 1 a 4). - Guía 3: tratamiento de la hipertensión en la diabetes e insuficiencia renal. - Guía 4: tratamiento de la hiperlipidemia en la diabetes e insuficiencia renal. - Guía 5: tratamiento nutricional en la diabetes e insuficiencia renal.
Recomendación 1: tratamiento de la albuminuria en pacientes normotensos con diabetes y albuminuria como marcador subrogado.
Recomendación 2: intervención multifactorial en la diabetes e insuficiencia renal.
Recomendación 3: diabetes e insuficiencia renal en poblaciones especiales.
Recomendación 4: cambio de comportamiento y autocuidado en la diabetes e insuficiencia renal.
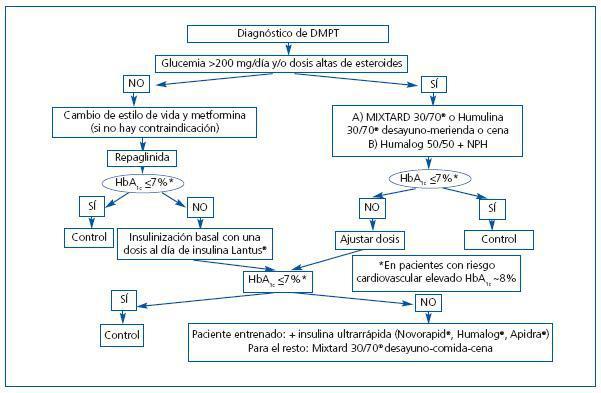
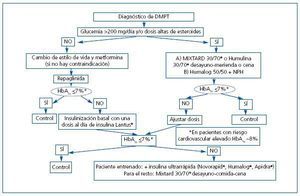
Respecto al tratamiento, analizamos aquí las Guías 2 y 5. La Guía 3 se refiere al tratamiento de la HTA (tratado en la Reunión del año pasado de Prometeo y publicado recientemente70); no difiere del consenso establecido, salvo la opinión del bloqueo de la angiotensina con normotensión y micro/macroalbuminuria. La Guía 4 trata acerca del tratamiento de la hiperlipidemia, indicando el tratamiento con estatinas y un objetivo de colesterol LDL en sujetos con diabetes e insuficiencia renal en estadios 1 a 4 de menos de 100 mg/dl, aunque una opción terapéutica es lograr el descenso hasta menos de 70 mg/dl. En la Guía 2 se menciona una HbA1c objetivo inferior al 7,0%, basándose en la evidencia de que así se logra una reducción en el desarrollo de microalbuminuria en la DM tipo 1, como se demuestra en un metaanálisis de Wang et al.71 y en el Estudio DCCT48 y en la DM tipo 2 en el estudio Kumamoto49 y de macroalbuminuria, en DM tipo 1 en el estudio DCCT48 y en la extensión a 8 años de éste, el estudio EDIC72 y en DM tipo 2 hay tres estudios de interés: el de Kumamoto49, en el UKPDS50 y en el estudio Veterans Affairs Cooperative Study on Glycemic Control and Complications in Type 2 Diabetes Feasibility Trial (VA)73. Asimismo, con el objetivo de una HbA1c inferior al 7,0%, se reduce la progresión de la IRC, como se demuestra en el estudio CSG74 y en los estudios STENO52, DCCT48, EDIC72 y UKPDS50, aunque con evidencias más débiles. Se reconoce, no obstante, el riesgo de hipoglucemia, más en la DM tipo 1 que en la tipo 2, al mantener dichos niveles de HbA1c, mayor en los estadios 3 a 5 de IRC debido a un aclaramiento disminuido de la insulina y de algunos ADOs y a una gluconeogénesis renal alterada. Respecto al uso de ADOs, mencionan lo ya referido en la revisión de Robles et al.58. Es interesante la mención a las interacciones farmacológicas. Así, el gemfibrozilo aumenta la vida media de repaglinida y rosiglitazona; la nateglinida puede incrementar los efectos de la amiodarona, fluoxetina, warfarina y fenitoína. Hay que estar alerta sobre la presencia de falsos valores menores de HbA1c en la deficiencia de hierro y aumentados en la acidosis. Los autores recomiendan el autocontrol de la glucemia al menos tres veces al día con tratamiento intensivo con insulina para evitar las hipoglucemias. En la Guía 5 se recomienda una ingestión de proteínas diarias en la DM con IRC en estadios 1 a 4 de 0,8 g/kg/día, ya que con esta medida se logra una reducción en la albuminuria y una estabilización en la función renal, como han demostrado en sendos metaanálisis Kasiske75 y Pedrini76. Como se ha mencionado al principio, existe una Guía internacional de consenso sobre el tratamiento de la DMPT, que se basa en revisión sistemática de la literatura y que fue validada en el Encuentro Internacional de Expertos realizado el 19 de febrero de 200310. Nos limitaremos aquí a comentar los aspectos del tratamiento de la DMPT, que se basan en las Guías de la ADA para el tratamiento de la DM tipo 2. No debemos olvidar llevar a cabo un cribado anual de las posibles complicaciones: retinopatía y neuropatía. La microalbuminuria se deberá monitorizar, teniendo en cuenta que su valor es relativo dado que muchos pacientes sometidos a trasplante pueden tener microalbuminuria e insuficiencia renal, sin DM debido a la nefropatía crónica del injerto. En cuanto al tratamiento no farmacológico, deben realizarse modificaciones del estilo de vida, como: a) pérdida de peso (principal medida en el paciente sometido a trasplante con IOG, para evitar el desarrollo de DM); b) actividad física, que reduce la resistencia a la insulina, el nivel de triglicéridos y de VLDL; c) abstención del tabaco, d) educación, con realización de autocontroles de glucemia capilar. Habrá que realizar tratamiento con ADO en monoterapia si con las medidas anteriores el control no es suficiente. El ADO deberá escogerse según su seguridad, potencia, duración de su acción y efectos secundarios, así como por factores específicos del paciente (edad, peso o valores de glucemia). Una revisión de estas Guías se publicó en 200577. En la figura 3 se expone un diagrama de flujo que resume el abordaje terapéutico escalonado con ADO y/o insulina para tratar la DMPT.
Tratamientos coadyuvantes
Para analizar si el tratamiento de la hepatitis C previo al trasplante es eficaz y reduce la incidencia de DMPT se llevó a cabo un estudio retrospectivo en el que se incluyeron 55 pacientes en hemodiálisis con anticuerpos anti- HCV positivos y RNA positivo para el virus de la hepatitis C, tratados con interferón alfa; 21 pacientes (38%) lograron una respuesta virológica mantenida y, de ellos, 16 (78%) fueron sometidos a trasplante, todos con PCR para el virus C negativa. Estos pacientes fueron seguidos una media de 22,5 meses; 14 pacientes recibieron terapia de inducción, 12 con anticuerpos policlonales y dos con anti-IL-2. El tratamiento inmunosupresor fue con esteroides y anticalcineurínicos, 13 con CsA y tres con Tac, y 13 con MMF y tres con AZA. Ninguno de ellos desarrolló DMPT, por lo que se ha llegado a la conclusión de que el tratamiento en hemodiálisis de los enfermos VHC positivos con interferón alfa, aparte de inducir remisiones completas y mantenidas en, al menos, el 29 % de los pacientes, sin recidivas tras el trasplante renal a pesar del tratamiento inmunosupresor, puede evitar el desarrollo posterior de DMPT, por lo que se recomienda tratar a los enfermos VHC positivos en lista de espera de trasplante renal78. Se ha estudiado si el tratamiento con estatinas reduce la incidencia de DMPT. Se realizó un estudio de co hortes retrospectivo y aleatorizado en el que se incluyeron 314 pacientes sometidos a trasplante renal no diabéticos ni con intolerancia a la glucosa; 129 fueron tratados con estatinas y 185 pacientes no lo fueron. La frecuencia de DMPT fue del 16% (n = 49). En el estudio multivariante se demostró un menor riesgo independiente de desarrollar DMPT con el uso de estatinas independiente del descenso de los lípidos (OR = 0,23; p <0,001)79.
CONCLUSIONES
La DMPT, considerada como factor independiente de riesgo para la supervivencia del paciente y del injerto, debe ser abordada tanto en la faceta preventiva tanto en la fase pretrasplante, como una vez sometido el paciente al trasplante, evitando la obesidad y el sedentarismo y planteándose un régimen inmunosupresor que equilibre el riesgo inmunológico con el riesgo de desarrollar DMPT, con una retirada precoz de esteroides como factor primordial. Una vez desarrollada la DMPT, el abordaje del tratamiento inmunosupresor debe ir encaminado a tratar de evitar los fármacos más diabetógenos e iniciar precozmente el tratamiento antidiabético adecuado, usando los ADOs en relación con el grado de insuficiencia renal del paciente y tener presente la administración precoz de insulina si no se consigue una HbA1c adecuada del 7%. Para conseguir estos objetivos, el abordaje del paciente debe ser multidisciplinar, junto con un endocrinólogo y su equipo de orientación de la diabetes mellitus.
PERSPECTIVAS
Tras la revisión sistemática, no hemos encontrado información concreta sobre el grado de control de la DMPT y su repercusión en cuanto a la mejoría de la supervivencia del paciente o del injerto, por lo que consideramos necesario el planteamiento de estudios prospectivos para aclarar este punto.
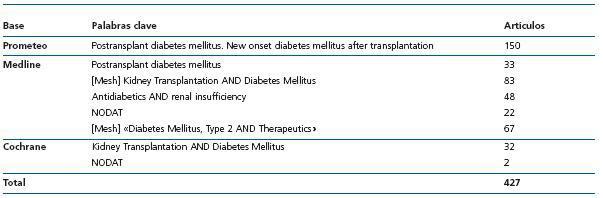
Tabla 1. Búsqueda sistemática de bibliografía
Tabla 2. Generalidades
Tabla 3. Inmunosupresión: prevención de la DMPT. Consideraciones generales
Tabla 4. Corticoides
Tabla 5. Anticalcineurínicos
Figura 1. Tratamiento de la inmunosupresión en presencia de DMPT
Tabla 6. Inhibidores mTOR
Tabla 7. Tratamiento de la DMPT. Educación y autocontrol
Tabla 8. Modificaciones del estilo de vida
Tabla 9. Objetivos del tratamiento
Tabla 10. Antidiabéticos orales (ADO)
Tabla 11. Farmacología de los antidiabéticos orales (ADO)
Tabla 12. Insulinas
Figura 2. Farmacología de las insulinas. Preparaciones clasificadas en función de la duración del efecto
Tabla 13. Insulinas: pautas de tratamiento según escenarios
Figura 3. Algoritmo para el tratamiento de la DMPT (recomendada la valoración endocrinológica)