Se ha documentado que tras la administración de vacunas de ARNm o de vectores virales del SARS-CoV-2 un porcentaje significativo de los receptores de trasplante no desarrolla una respuesta inmune efectiva. Ante esta situación, en marzo de 2022 la Agencia Europea del Medicamento aprobó el uso de tixagevimab-cilgavimab para la profilaxis de COVID-19 previa a la exposición al virus en pacientes inmunocomprometidos. El estudio que presentamos a continuación describe nuestra experiencia tras administrar tixagevimab-cilgavimab como tratamiento profiláctico en pacientes trasplantados renales.
Material y métodosSe trata de un estudio prospectivo de una cohorte de receptores de trasplante renal, en el que se incluyeron un total de 55 pacientes que presentaban títulos de anticuerpos IgG insuficientes (<260 BAU/mL) tras la administración de 4 dosis de la vacuna. A estos pacientes se les administró una única dosis de 150mg de tixagevimab y 150mg de cilgavimab entre mayo y septiembre de 2022.
ResultadosNo se observaron reacciones adversas graves e inmediatas tras la administración del fármaco ni deterioro de función renal significativo durante el seguimiento. La totalidad de los pacientes a los que se realizó una nueva determinación de anticuerpos IgG a los 3 meses de la administración del fármaco presentaba títulos positivos (>260 BAU/mL). De los 7 pacientes diagnosticados de infección por SARS-CoV-2, uno de ellos precisó ingreso hospitalario y falleció tras 5 días de ingreso con sospecha de neumonía con sobreinfección bacteriana.
ConclusionesEn nuestra experiencia, el tratamiento profiláctico con los anticuerpos monoclonales tixagevimab-cilgavimab consiguió alcanzar niveles de anticuerpos superiores a 260 BAU/mL en todos los pacientes, cumpliendo con un perfil de seguridad aceptable, sin eventos adversos significativos o irreversibles.
It has been reported that after vaccination with RNAm or viral vectors from SARS-CoV-2 a significant number of solid organ transplant recipients do not develop an effective immune response. In this scenario, the use of tixagevimab-cilgavimab was approved by the European Medicines Agency for COVID-19 prophylaxis in immunocompromised patients in March 2022. We present our experience with a group of kidney transplant recipients who received prophylactic treatment with tixagevimab-cilgavimab.
Material and methodsProspective study from a cohort of kidney transplant recipients who had been previously vaccinated with 4 doses and did not achieve a satisfactory immune response to vaccination, presenting antibody titers lower than 260 BAU/mL when measured by ELISA. A total of 55 patients who received a single dose of 150mg of tixagevimab and 150mg of cilgavimab between May and September of 2022 were included in this study.
ResultsNo immediate or severe adverse reactions, including worsening of kidney function, were observed after administering the drug or during follow up. All patients who had received the drug 3 months prior presented positive antibody titers (>260 BAU/mL). Seven patients were diagnosed with COVID, and one of those patients had to be admitted to the hospital and died 5 days later from infectious complications and a suspected diagnosis of bacterial coinfection.
ConclusionsIn our experience, all kidney transplant recipients reached antibody titers higher than 260 BAU/mL 3 months after receiving prophylactic treatment with tixagevimab-cilgavimab with no severe or irreversible adverse reactions.
La pandemia de la enfermedad por coronavirus 2019 (COVID-19) ha afectado a más de 600 millones de personas, con más de 6 millones de muertes en todo el mundo1,2.
La inmunización activa (vacunación) induce una memoria inmunitaria específica que es capaz de disminuir el riesgo de cuadros infecciosos más graves tras la exposición al coronavirus de tipo 2 causante del síndrome respiratorio agudo grave (SARS-CoV-2). La respuesta inmune puede estar comprometida en pacientes con trasplante de órgano sólido, ya que requieren tratamiento inmunosupresor de mantenimiento y presentan una mayor susceptibilidad a padecer infecciones3.
Se ha documentado que tras la administración de vacunas de ARN mensajero (ARNm) o de vectores virales del SARS-CoV-2 un porcentaje significativo de los receptores de trasplante no desarrolla una respuesta inmune efectiva4,5. Según el metaanálisis publicado por Li et al., a pesar de producirse la seroconversión en prácticamente la totalidad de la población general tras 2 dosis de la vacuna, esta solo tuvo lugar en la mitad de los pacientes inmunodeprimidos6. La ausencia de una respuesta inmune adecuada podría estar en relación con un mayor riesgo de infección sintomática, hospitalización y muerte con respecto a la población general7–10.
Ante esta situación, en marzo de 2022 la Agencia Europea del Medicamento aprobó el uso de tixagevimab-cilgavimab para la profilaxis de COVID-19 previa a la exposición al virus en pacientes mayores de 12 años11.
Tixagevimab-cilgavimab son 2 anticuerpos monoclonales tipo inmunoglobulina G (IgG1) humanos recombinantes, con sustituciones de aminoácidos en la región constante para prolongar la semivida del anticuerpo. Por su mecanismo de acción pueden unirse simultáneamente a regiones no superpuestas del dominio de unión al receptor (receptor binding domain) de la glucoproteína de la espícula viral (spike) del SARS-CoV-2, impidiendo su interacción con el receptor humano de la enzima convertidora de angiotensina 2, lo que resulta en un bloqueo de la entrada del virus al organismo12.
El estudio PROVENT, realizado en una selección de pacientes no vacunados y con alto grado de comorbilidades, demostró una reducción del 76,7% en la incidencia de infección sintomática por SARS-CoV-2 con respecto al grupo control. No obstante, la población que recibía un tratamiento inmunosupresor durante el estudio estaba escasamente representada, suponiendo tan solo un 3,3% de los participantes13.
Young-Xu et al. publicaron un estudio con pacientes inmunodeprimidos que habían recibido 2 o 3 dosis de la vacuna. Documentaron que aquellos que recibieron el fármaco presentaron tasas más bajas de infección, hospitalización y mortalidad en comparación con los que recibieron placebo14.
El estudio que presentamos a continuación describe nuestra experiencia tras administrar tixagevimab-cilgavimab como tratamiento profiláctico frente a COVID-19 a 55 pacientes trasplantados renales.
Material y métodosTipo de estudioEstudio de carácter prospectivo de una cohorte de pacientes receptores de trasplante renal a los que se propuso la administración de una única dosis intramuscular de 150mg de tixagevimab y 150mg de cilgavimab entre el 1 de mayo y el 30 de septiembre de 2022. De los 58 pacientes candidatos a recibir el fármaco, 55 dieron su consentimiento para administrarles el tratamiento y fueron incluidos en el estudio. Todos los pacientes dieron su consentimiento para la recopilación de datos y análisis de resultados.
Criterios de inclusión/exclusiónTodos los pacientes habían sido vacunados previamente con 4 dosis de la vacuna y presentaban títulos de anticuerpos IgG frente a SARS-CoV-2 indetectables o en concentraciones insuficientes como para considerar satisfactoria la respuesta inmunitaria, es decir, inferiores a 260 binding antibody units (BAU)/mL. No se administró el fármaco a pacientes que tuvieran historia previa de infección por SARS-CoV-2, independientemente del tiempo transcurrido desde el episodio, ni tampoco a aquellos que presentaban infección activa.
Variables a estudioSe registraron variables clínicas (antropométricas, comorbilidades, tratamiento inmunosupresor, etc.) y analíticas (función renal, pruebas de función hepática, anticuerpos frente a SARS-CoV-2, etc.). El filtrado glomerular (FG) se estimó mediante la ecuación de la Chronic Kidney Disease Epidemiology Collaboration. Se definió como deterioro significativo de la función renal la presencia de un descenso del FG mayor a un 25% con respecto a su valor basal y/o que motivase la realización de una biopsia renal.
Determinación serológicaTres meses después de administrar el fármaco, se llevó a cabo otra determinación del título de anticuerpos IgG contra la proteína de la espícula de membrana del virus SARS-CoV-2 (Ig S1) mediante el ensayo comercial LIAISON® SARS-CoV-2 TrimericS IgG.
Seguimiento de reacciones adversas tras la administración del fármacoLos pacientes permanecieron en la consulta médica durante al menos 15min tras la administración del fármaco para monitorizar reacciones adversas inmediatas. Se realizó seguimiento telefónico los días posteriores para detectar posibles efectos secundarios.
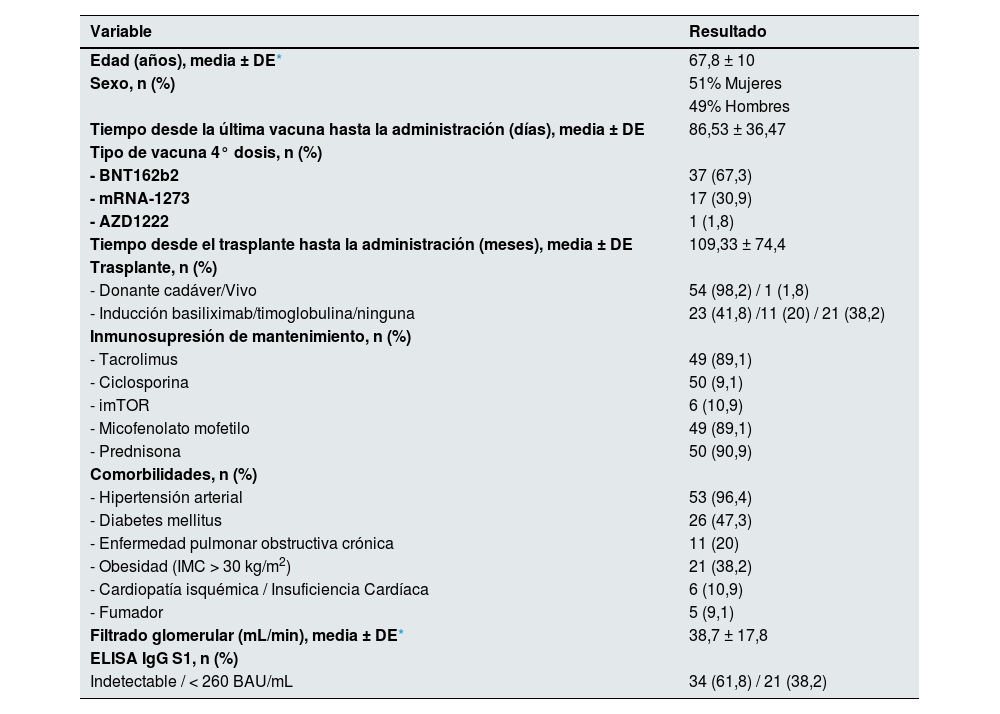
ResultadosPreviamente a la administración del fármaco todos los pacientes habían recibido una pauta de vacunación con 4 dosis y en la práctica totalidad de los casos se emplearon vacunas de ARNm en la última dosis (un 67,3% vacuna BNT162b2 y un 30,9% mRNA-1273). Solo un paciente fue vacunado por cuarta vez con la vacuna AZD1222.
Tras la vacunación, un 61,8% de la muestra no presentaba anticuerpos detectables, mientras que el 38,2% restante presentaba títulos inferiores a 260 BAU/mL, por lo que se consideraba una respuesta inmunológica insuficiente.
La media de edad fue de 67,8±10 años y un 51% eran mujeres. Nuestros pacientes presentaban una alta prevalencia de ciertas comorbilidades, entre las que se incluyeron la hipertensión arterial (96,4%), la diabetes mellitus (47,3%), la enfermedad pulmonar obstructiva crónica (20%), la cardiopatía isquémica o insuficiencia cardíaca (10%) y la obesidad (38%), definida como un índice de masa corporal>30kg/m2. El FG basal medio fue de 38,7±17,8mL/min y aproximadamente un 40% de los pacientes presentaba un FG inferior o igual a 30mL/min en el momento de la administración del fármaco. No se detectó en ningún paciente un deterioro de la función renal significativo durante el seguimiento.
La mediana de meses transcurridos desde el trasplante hasta la administración del fármaco fue de 90 meses. Con respecto al tratamiento inmunosupresor, la mayoría de los pacientes seguía un esquema de tacrolimus, micofenolato mofetilo y prednisona (89,1%), un 10% recibía tratamiento con inhibidores de la enzima mTOR y un 9,1% con ciclosporina. Solo uno de los pacientes era receptor de trasplante renal de donante vivo (tabla 1). Ninguno de los sujetos había presentado episodios de rechazo agudo del injerto los 6 meses previos a la administración. Tres meses antes de su inclusión en el estudio, una paciente había sido diagnosticada de rechazo humoral crónico activo y había recibido tratamiento con tocilizumab, suspendido 2 meses antes del inicio del estudio por complicaciones infecciosas graves.
Características basales
| Variable | Resultado |
|---|---|
| Edad (años), media ± DE* | 67,8 ± 10 |
| Sexo, n (%) | 51% Mujeres |
| 49% Hombres | |
| Tiempo desde la última vacuna hasta la administración (días), media ± DE | 86,53 ± 36,47 |
| Tipo de vacuna 4° dosis, n (%) | |
| - BNT162b2 | 37 (67,3) |
| - mRNA-1273 | 17 (30,9) |
| - AZD1222 | 1 (1,8) |
| Tiempo desde el trasplante hasta la administración (meses), media ± DE | 109,33 ± 74,4 |
| Trasplante, n (%) | |
| - Donante cadáver/Vivo | 54 (98,2) / 1 (1,8) |
| - Inducción basiliximab/timoglobulina/ninguna | 23 (41,8) /11 (20) / 21 (38,2) |
| Inmunosupresión de mantenimiento, n (%) | |
| - Tacrolimus | 49 (89,1) |
| - Ciclosporina | 50 (9,1) |
| - imTOR | 6 (10,9) |
| - Micofenolato mofetilo | 49 (89,1) |
| - Prednisona | 50 (90,9) |
| Comorbilidades, n (%) | |
| - Hipertensión arterial | 53 (96,4) |
| - Diabetes mellitus | 26 (47,3) |
| - Enfermedad pulmonar obstructiva crónica | 11 (20) |
| - Obesidad (IMC > 30 kg/m2) | 21 (38,2) |
| - Cardiopatía isquémica / Insuficiencia Cardíaca | 6 (10,9) |
| - Fumador | 5 (9,1) |
| Filtrado glomerular (mL/min), media ± DE* | 38,7 ± 17,8 |
| ELISA IgG S1, n (%) | |
| Indetectable / < 260 BAU/mL | 34 (61,8) / 21 (38,2) |
La mediana de días transcurridos desde la inoculación de la última dosis de la vacuna hasta que los pacientes recibieron el tratamiento con tixagevimab-cilgavimab fue de 83 días. La media de seguimiento fue de 143,9±31,3 días.
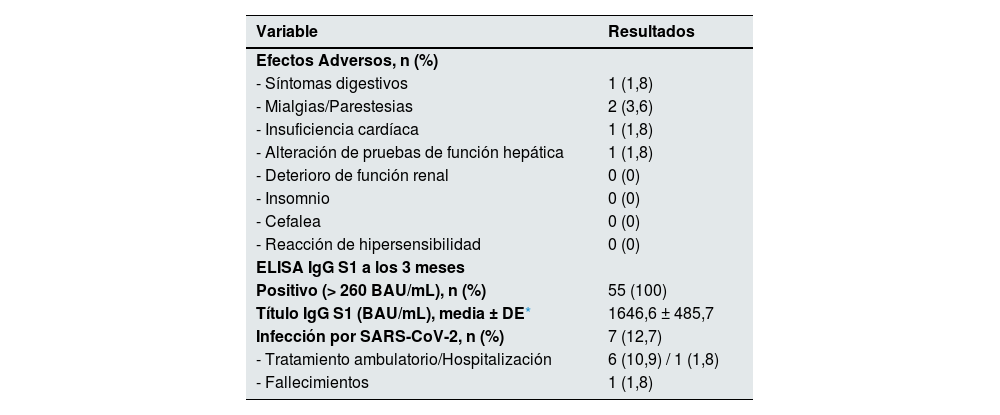
No se documentaron reacciones de hipersensibilidad tras la administración del fármaco ni efectos adversos graves inmediatos. Durante las primeras 48h de seguimiento, un paciente refirió mialgias en la zona de inyección y otro paciente presentó parestesias en la pierna derecha. Ambos síntomas cedieron espontáneamente en los días posteriores. Otro paciente presentó diarrea autolimitada 2 días después de suministrarse el tratamiento.
Cinco días después de la administración de tixagevimab-cilgavimab, un paciente precisó de ingreso hospitalario por infección respiratoria por Pneumocystis jirovecii e insuficiencia respiratoria y cardíaca. Se trataba de un paciente diagnosticado previamente de miocardiopatía hipertrófica e insuficiencia cardíaca con fracción de eyección preservada, que había ingresado en varias ocasiones por este motivo y en el que sospechamos que la infección y el compromiso respiratorio fueron los desencadenantes del cuadro, considerando poco probable que se tratase de una reacción adversa al fármaco.
Otra paciente presentó elevación de las pruebas de función hepática 3 veces por encima del límite considerado normal, 2 meses después de haber recibido el fármaco y sin presentar ningún síntoma específico ni haber realizado modificaciones en la medicación habitual. La alteración analítica se resolvió en el control realizado un mes después sin llevar a cabo ningún tipo de intervención médica.
La determinación de anticuerpos IgG S1 al tercer mes de la administración del fármaco pudo realizarse en 45 de los 55 pacientes (81,8%), presentando todos ellos títulos de anticuerpos considerados positivos (>260 BAU/mL) y siendo la media de 1.646,6±485 BAU/mL.
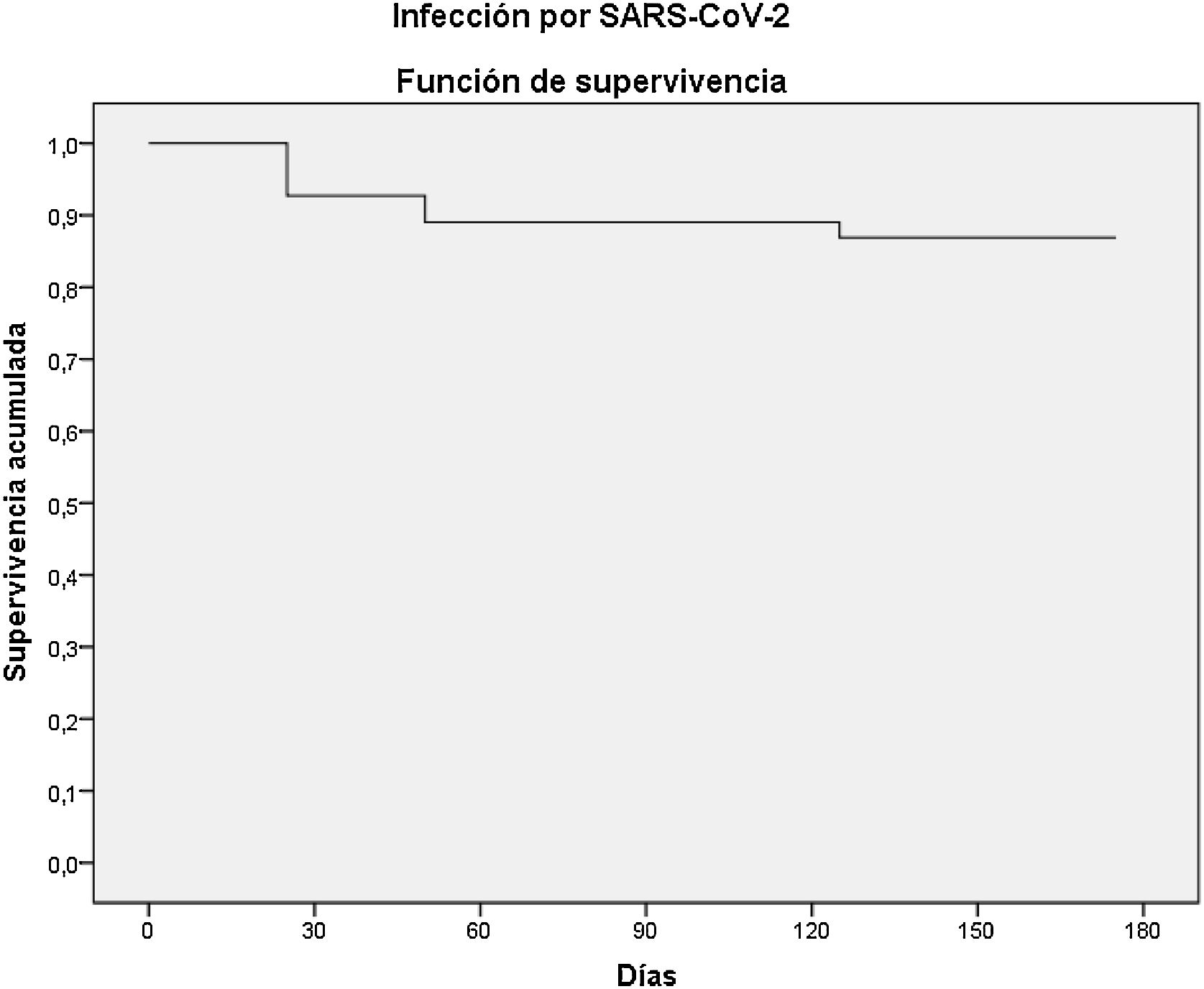
Durante el seguimiento, 7 pacientes (12,7%) fueron diagnosticados de infección por SARS-CoV-2 (fig. 1), 5 de ellos mediante la realización de test de antígeno de uso comercial aprobado, mientras que los 2 restantes fueron diagnosticados mediante la técnica de reacción en cadena de la polimerasa de muestras de exudado nasofaríngeo. Solo se identificó la variante del virus de estos últimos, detectándose en ambos casos la cepa Ómicron BA.5. La mediana del tiempo transcurrido desde que habían recibido el fármaco hasta que fueron diagnosticados fue de 24 días. Uno de esos pacientes precisó ingreso hospitalario y falleció por complicaciones derivadas de la COVID-19 y sospecha de sobreinfección bacteriana (tabla 2). Se trataba de un hombre de 88 años, sin enfermedad pulmonar conocida previa, trasplantado renal y cardíaco de largo tiempo de evolución y con disfunción crónica de ambos injertos.
Efectos adversos y resultados
| Variable | Resultados |
|---|---|
| Efectos Adversos, n (%) | |
| - Síntomas digestivos | 1 (1,8) |
| - Mialgias/Parestesias | 2 (3,6) |
| - Insuficiencia cardíaca | 1 (1,8) |
| - Alteración de pruebas de función hepática | 1 (1,8) |
| - Deterioro de función renal | 0 (0) |
| - Insomnio | 0 (0) |
| - Cefalea | 0 (0) |
| - Reacción de hipersensibilidad | 0 (0) |
| ELISA IgG S1 a los 3 meses | |
| Positivo (> 260 BAU/mL), n (%) | 55 (100) |
| Título IgG S1 (BAU/mL), media ± DE* | 1646,6 ± 485,7 |
| Infección por SARS-CoV-2, n (%) | 7 (12,7) |
| - Tratamiento ambulatorio/Hospitalización | 6 (10,9) / 1 (1,8) |
| - Fallecimientos | 1 (1,8) |
Presentamos una serie de 55 pacientes receptores de trasplante renal, que presentaban títulos indetectables o insuficientes de IgG S1 tras recibir 4 dosis de la vacuna y que recibieron profilaxis preexposición con tixagevimab-cilgavimab.
La mayoría de los pacientes presentaba varias comorbilidades, siendo las más prevalentes la hipertensión arterial y la diabetes mellitus, que suponían una situación de riesgo añadido a la condición de inmunosupresión.
No se objetivaron reacciones adversas graves e inmediatas tras la administración del fármaco, ni deterioro significativo de la función del injerto en controles posteriores.
Durante el seguimiento solamente se detectó un episodio de insuficiencia cardíaca grave que requirió ingreso hospitalario, aunque consideramos baja la probabilidad de que pudiera deberse a un efecto adverso del tratamiento. En el estudio PROVENT se reportó una mayor incidencia de efectos adversos cardiovasculares, incluyendo el infarto de miocardio y la insuficiencia cardíaca, en el grupo del fármaco con respecto al grupo placebo (0,6 vs. 0,2%), si bien todos estos pacientes presentaban factores de riesgo cardiovascular y/o historia de cardiopatía previa13. Otros estudios más recientes, sin embargo, no han encontrado una mayor incidencia de eventos adversos graves en comparación con la administración de placebo, como en el estudio ACTIV-3-TICO, en el que se emplearon dosis de 300mg de tixagevimab y 300mg de cilgavimab para el tratamiento de COVID-19 en pacientes hospitalizados15.
En los controles analíticos posteriores a la administración del fármaco solamente detectamos en una paciente alteraciones de las pruebas de función hepática. En el estudio PROVENT se incluyeron 149 pacientes diagnosticados de hepatopatía crónica, y tras una media de 6 meses de seguimiento, se reportaron trastornos hepatobiliares en un 0,2% de los pacientes del grupo experimental y un 0,3% de los pacientes del grupo control13. Por otro lado, en un estudio sobre el uso de tixagevimab-cilgavimab en pacientes trasplantados de órgano sólido, de los cuales 17 eran receptores de trasplante hepático, no se objetivaron alteraciones de la función hepática tras la administración16.
De los 7 pacientes diagnosticados de infección por SARS-CoV-2, uno de ellos precisó ingreso hospitalario y falleció 5 días después. En nuestro estudio, todas las infecciones se produjeron durante la onda epidémica en la que predominaba la variante Ómicron en España, pero solo se identificaron las subvariantes en 2 pacientes, que fueron BA.4 y BA.5.
En estudios realizados tras la administración de la cuarta vacuna, aunque un porcentaje de pacientes trasplantados de órgano sólido presentó un aumento significativo del título de anticuerpos, la capacidad de neutralización de los mismos fue muy limitada para hacer frente a la variante Ómicron en comparación con la variante original y la variante Delta17. Esta variante presenta al menos 33 mutaciones en la proteína de la espícula, incluyendo 15 en el dominio de unión al receptor frente al que van dirigidos la mayoría de los tratamientos monoclonales disponibles18. Estas mutaciones pueden incrementar la evasión del virus a los diferentes fármacos disponibles19.
Al analizar la sensibilidad de las subvariantes de Ómicron a diferentes anticuerpos monoclonales empleados en la profilaxis preexposición, se ha objetivado que mientras tixagevimab no parece tener actividad frente a Ómicron BA.2, cilgavimab tiene una mayor actividad frente a BA.2 que a BA.120. En un estudio realizado con el suero de 29 pacientes inmunocomprometidos al transcurrir un mes desde la administración de tixagevimab y cilgavimab, se detectó capacidad neutralizadora frente a BA.1 y BA.2 en el suero de 19 pacientes21. Así pues, estudios in vitro realizados con suero de pacientes voluntarios vacunados estiman que se precisarían títulos de 10 a 20 veces más altos para neutralizar la variante Ómicron con respecto a variantes previas22. Por este motivo, la Food and Drug Administration aprobó en Estados Unidos en febrero de 2022 el uso de dosis de 300mg de tixagevimab y 300mg de cilgavimab para la profilaxis preexposición en pacientes inmunocomprometidos23. En diciembre de 2022 la Comisión de Salud Pública actualizó la posología del fármaco de igual manera en España.
Sin embargo, a partir de octubre de 2022 la mayoría de las cepas de Ómicron detectadas en nuestro medio pertenecen a BA.5. Aun así, la incidencia de BQ.1.1 (una subvariante de BA.5) y XBB (una subvariante de BA.2) está en aumento. Estas últimas, a diferencia de variantes previas, incluyen mutaciones adicionales en el dominio de unión al receptor de la proteína de la espícula que podrían aumentar su capacidad de evasión inmunológica y reducir la eficacia del fármaco24.
Aunque desde el segundo trimestre de 2022 hemos experimentado en nuestro centro una menor incidencia de formas graves de COVID-19, ingresos hospitalarios y fallecimientos, no podemos determinar en el momento actual el impacto clínico de tixagevimab-cilgavimab en este resultado, teniendo en cuenta la presencia de otras variables epidemiológicas, como el refuerzo vacunal y la aparición de nuevas subvariantes de Ómicron con respecto al año anterior25. Creemos necesario continuar la realización de estudios controlados en esta población de pacientes para valorar la eficacia de tixagevimab-cilgavimab en la reducción de la tasa de hospitalización y mortalidad, así como valorar su utilidad en las nuevas y futuras variantes del virus.
ConclusionesEn nuestra experiencia, el tratamiento profiláctico con los anticuerpos monoclonales tixagevimab-cilgavimab consiguió alcanzar niveles superiores a 260 BAU/mL en todos los pacientes, cumpliendo con un perfil de seguridad aceptable, sin eventos adversos significativos o irreversibles.
FinanciaciónLa realización del presente trabajo no ha contado con fuentes de financiación provenientes de entidades públicas ni privadas, de investigación ni fundaciones.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.