La diabetes mellitus es una importante enfermedad en el ámbito mundial, con una elevada prevalencia. A su vez, la diabetes mellitus es la primera causa conocida de enfermedad renal crónica. Los pacientes con diabetes mellitus y enfermedad renal crónica presentan un riesgo cardiovascular aumentado y, por consiguiente, una mayor morbimortalidad. Es por ello que el tratamiento en estos pacientes es sumamente importante. Una gran parte del arsenal terapéutico que disponemos para el control de la diabetes mellitus es complejo en los pacientes con enfermedad renal crónica, ya sea por ajuste de dosis, aumento de efectos adversos o escasa evidencia. Conviene mencionar que hasta el año 2000 el tratamiento de la diabetes mellitus en el paciente con enfermedad renal crónica avanzada se limitaba mayoritariamente a la administración de insulina subcutánea. En la última década aparecen nuevos antidiabéticos orales que pueden ser administrados en pacientes con enfermedad renal crónica. El presente documento pretende realizar un recorrido por toda la terapéutica (desde la más conocida a la más novedosa) de la cual disponemos con la finalidad de poder escoger el mejor tratamiento en cada uno de los pacientes con enfermedad renal crónica.
INTRODUCCIÓN
Epidemiología
La diabetes mellitus (DM) es uno de los problemas de salud más importantes en el ámbito mundial. Actualmente, la DM está considerada una pandemia mundial, con 415 millones de afectados en el mundo. Según las proyecciones de la International Diabetes Federation, se espera que esta cifra aumente hasta 642 millones en 2040, en su gran mayoría en países en desarrollo1. En España, entre un 6 y un 10% de la población general padece DM2.
Durante la historia natural de la DM se pueden desarrollar complicaciones cardiovasculares, con importantes consecuencias en la morbimortalidad de los pacientes que las padecen. Una de las complicaciones más importantes de la DM es el desarrollo de enfermedad renal crónica (ERC), la cual es un importante marcador pronóstico en los pacientes diabéticos3. En Cataluña, la DM es la primera causa de ERC conocida4, siendo un 17% de los casos incidentes durante el año 2015. A los 10 años del diagnóstico de DM tipo 2 (DM2), un 25% presentará microalbuminuria, un 5% presentará macroalbuminuria y un 0,8%, elevación de creatinina o insuficiencia renal avanzada5.
La presencia de ERC influye en el control glucémico, por sus efectos en la farmacocinética y farmacodinamia de los diferentes tipos de antidiabéticos orales. Así, según el grado de reducción de la función renal, se pueden producir peligrosos aumentos de valores de dichos fármacos y aumentar el riesgo de hipoglucemia6.
Objetivos de control glucémico de la diabetes mellitus
La DM es un importante factor de riesgo modificable para el desarrollo de ERC, por lo tanto es lógico pensar que si se logra un buen control glucémico se obtendrá un impacto positivo en la morbimortalidad de los pacientes3. La hemoglobina glucosilada (HbA1c) constituye el parámetro que mejor refleja la glucemia media de los 3 meses previos, y es un potente predictor de la aparición de complicaciones relacionadas con la DM7.
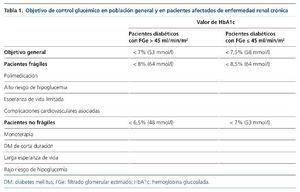
Tanto la guía clínica europea8, como las americanas9,10 y la española7, establecen los siguientes objetivos para la DM en general (tabla 1):
• Un objetivo general es la obtención de un valor de HbA1c < 7% (53 mmol/l).
• Un valor de HbA1c < 6,5% (48 mmol/l) se debe considerar en un grupo seleccionado de pacientes con riesgo bajo de padecer hipoglucemia, breve duración de la DM, DM2 tratada solo con estilos de vida o con monoterapia con metformina, larga expectativa de vida y sin ninguna enfermedad cardiovascular significativa asociada.
• Un nivel de HbA1c < 8% (64 mmol/l) en pacientes con antecedentes de hipoglucemia grave, expectativa de vida limitada, complicaciones cardiovasculares avanzadas y polimedicación asociada (incluida insulina).
Sin embargo, en el caso de los pacientes afectados de ERC hay que tener en consideración que la evidencia de que un tratamiento intensivo tenga un efecto sobre la pérdida de la tasa de filtración glomerular (FG) estimada (FGe) es escasa9. Además, la propia ERC es un factor de riesgo para padecer hipoglucemias11. Por lo que, en general, los objetivos de valores de HbA1c son más laxos, sobre todo en pacientes con antecedentes de enfermedad cardiovascular y comorbilidades elevadas10 .
Así pues, en los pacientes con FGe ≤ 45 ml/min/1,73 m2 que tengan uno de los factores de fragilidad —importante riesgo de hipoglucemia, falta de motivación, esperanza de vida limitada, complicaciones micro-/macrovasculares o enfermedad cardiovascular—, el objetivo de HbA1c será ≤ 8,5% (69 mmol/l) (tabla 1). Para los pacientes que se controlan con un fármaco o solo con medidas higienicodietéticas, el objetivo de HbA1c es ≤ 7% (53 mmol/l). Los pacientes que presenten una DM de más de 10 años de evolución, polimedicada pero sin factores de fragilidad, el objetivo de HbA1c será ≤ 8% (64 mmol/l). Para el resto de pacientes, el objetivo de HbA1c será ≤ 7,5% (58 mmol/l)12.
ANTIDIABÉTICOS ORALES*
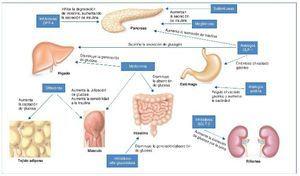
Los antidiabéticos orales son fármacos diseñados para disminuir los valores de glucemia por diversos mecanismos. A lo largo de los años se han desarrollado diferentes grupos de familias de fármacos, cada uno de las cuales tiene diferentes dianas terapéuticas. En la figura 1 se resume el mecanismo de acción de cada uno. Los inhibidores de la dipeptidil dipeptidasa 4 (DPP-4), sulfonilureas, meglitinidas y análogos del péptido similar al glucagón tipo 1 (GLP-1) promueven la liberación de insulina por parte del páncreas. La metformina y los inhibidores de la alfa-glucosidasa reducen la absorción de glucosa a nivel intestinal. Además, tanto la metformina como las glitazonas aumentan el uso de glucosa y la sensibilidad a la insulina en los tejidos periféricos. Los análogos de la amilina reducen la cantidad de glucosa ingerida, puesto que aumenta la saciedad a través de una regulación gástrica. Los inhibidores del cotransportador sodio-glucosa 2 (SGLT-2) bloquean la reabsorción de glucosa a nivel del túbulo renal aumentando su excreción por la orina6.
Figura 1. Mecanismo de acción de los diferentes tipos de antidiabéticos orales. DPP-4: dipeptidil dipeptidasa tipo 4; GLP-1: péptido similar al glucagón tipo 1; SGLT-2: cotransportador sodio-glucosa 2. Adaptado de referencia 6.
Terapias con antidiabéticos orales convencionales
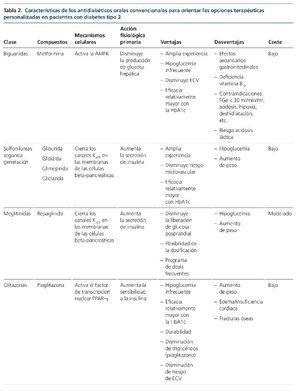
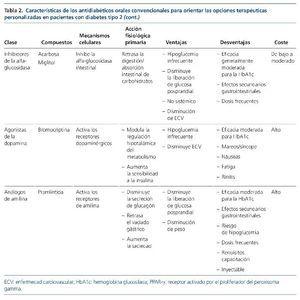
Las terapias convencionales usadas en los pacientes con DM2 incluyen metformina, sulfonilureas, tiazolidinedionas, meglitinidas, inhibidores de la alfa-glucosidasa, análogos de la amilina y agonistas dopaminérgicos. La mayoría de ellos requiere ajuste de dosis según FGe e incluso se recomienda suspensión según ficha técnica con FGe ≤ 45 o 30 ml/min/1,73 m2 , dado el riesgo de padecer hipoglucemias o acidosis láctica13. En la tabla 2 mostramos un resumen de los fármacos en cuanto a su mecanismo de acción, ventajas y desventajas clínicas y coste.
Biguanidas
La metformina es la biguanida más usada y se recomienda como tratamiento de primera elección en todas las guías clínicas de DM7-9,14. Además, su precio es bajo, tiene un buen perfil de seguridad, confiere un bajo riesgo de hipoglucemia y su uso se ha asociado a un menor desarrollo de complicaciones macrovasculares15,16.
El mecanismo de acción consiste en la activación de la proteína cinasa dependiente de AMP (AMPK), que inhibe la producción hepática de glucosa. En el hígado, la activación de AMPK suprime la gluconeogénesis y disminuye la biosíntesis de ácidos grasos y colesterol17. Además, la metformina promueve la fosforilación de los receptores de la insulina, reduce la entrada de sustratos glucogénicos (lactato y alanina) y bloquea la respiración mitocondrial. A nivel muscular, la metformina mejora la captación de insulina y glucosa mediante la estimulación de los receptores de insulina tirosincinasa y de los transportadores-4 de glucosa18. Por último, la metformina tiene un efecto intestinal más limitado disminuyendo la absorción de glucosa17.
La metformina se elimina fundamentalmente a nivel renal, mediante FG y secreción tubular, por ello requiere ajuste de dosis en pacientes afectados de ERC. Se puede utilizar con seguridad19 en pacientes incluso con FGe de 30 ml/min/1,73 m2, con ajuste de dosis en FGe de 60-30 ml/min/1,73 m2. En los pacientes con riesgo de padecer deterioro de la función renal, con lo cual están bajo tratamiento con diuréticos, antiinflamatorios no esteroideos o riesgo de deshidratación, es importante evaluar la función renal de forma periódica3.
Además de los efectos hipoglucemiantes, se han atribuido otros efectos a nivel sistémico al uso de la metformina, como son efectos antiinflamatorios, antioxidantes, reducción de peso, reducción de efectos secundarios de los antirretrovirales, anticancerígenos, etc.20. Sin embargo, son necesarios más estudios para obtener resultados más concluyentes.
Las náuseas y diarreas son los efectos secundarios más frecuentes que comporta el tratamiento con metformina. Dicho efecto se puede minimizar iniciando el tratamiento a dosis bajas, incrementándolo lentamente y hacer coincidir la toma de medicación con las comidas6. La acidosis láctica es una complicación potencialmente letal, aunque tiene una baja incidencia (5/100.000 pacientes/año), y se asocia habitualmente a situaciones de hipoxia y procesos concomitantes21. Por todo ello se recomienda la suspensión temporal en los pacientes que padezcan vómitos, diarreas u otras causas potenciales de deshidratación. De la misma forma, cuando se administren contrastes yodados o frente a una intervención quirúrgica mayor, se recomienda su suspensión 24 h antes y esperar 48 h para su reintroducción posprocedemiento3.
Sulfonilureas
La primera generación de sulfonilureas (aceohexamida, clorpropamida, tolazamida y tolbutamida) ha sido reemplazada por la segunda generación, que incluye la glicazida, glimepirida, gliquidona, glipizida y glibenclamida.
Las sulfonilureas, en general, tienen una buena tolerancia y su coste es bajo. Se unen a las células beta-pancreáticas y estimulan la liberación de insulina independientemente de los valores de glucemia6. Por ello tienen un alto riesgo de hipoglucemia, que se incrementa en los pacientes afectados de ERC dado el fallo en la neoglucogénesis renal y acumulación del fármaco22. La glimepirida y glicazida son las que tienen un menor riesgo de hipoglucemia y son de única toma diaria7. La gliquidona no requiere ajuste de dosis en los diversos estadios de ERC. La glimepirida necesita ajuste de dosis hasta ERC estadio 46, sin embargo, es recomendable que su uso se limite a pacientes3 con FGe > 60 ml/min/1,73 m2. La glibenclamida está contraindicada con FGe < 60 ml/min/1,73 m2.
Un aspecto importante de las sulfonilureas es que tienen una fuerte unión a proteínas plasmáticas (particularmente albúmina), por lo que no se pueden eliminar mediante hemodiálisis. Asimismo, es importante conocer que el tratamiento concomitante con otros fármacos (bloqueadores beta, warfarina, salicilatos, gemfibrozilo, sulfamidas y tiazidas) puede desplazar las sulfonilureas de su unión con la albúmina aumentando sus valores plasmáticos y, como consecuencia, aumenta el riesgo de hipoglucemia3.
Meglitinidas
Las meglitinidas (repaglinida y nateglinida) estimulan la secreción de insulina del páncreas mediante el cierre de los canales de KATP en la membrana de las células beta-pancreáticas. Dicho mecanismo es similar al de las sulfonilureas pero en un lugar de unión diferente. Como consecuencia, provocan una reducción en la salida de glucosa6. Su efecto secundario más importante es la hipoglucemia, sin embargo, se acepta que el riesgo de hipoglucemia es menor que el que se presenta con las sulfonilureas23. El metabolismo de las meglitinidas es hepático, con una eliminación renal del 10%, y tienen una semivida corta, por lo que requieren una dosificación más frecuente que las sulfonilureas.
La repaglinida se puede usar en cualquier estadio de ERC, incluso en diálisis, aunque se recomienda iniciar el tratamiento con una dosis baja (0,5 mg)3. La nateglinida, sin embargo, no está recomendada en la ERC avanzada, dado que tiene un metabolito activo que se elimina a nivel renal3.
Tiazolinedionas (glitazonas)
Las glitazonas aumentan la sensibilidad a la insulina: reducen la resistencia a la insulina, aumentan la captación de glucosa en los músculos y en el tejido adiposo y disminuyen la secreción de glucosa a nivel hepático. Además, preservan la función de las células beta-pancreáticas: aumentan la adipogénesis, entrada de ácidos grasos y lipogénesis y reducen la neoglucogénesis y el valor de ácidos grasos en plasma24. La única glitazona comercializada en Europa es la pioglitazona, la cual no necesita ajuste de dosis sea cuál sea el estadio de ERC, incluso en diálisis.
La pioglitazona no aumenta el riesgo de padecer hipoglucemia, mejora el perfil lipídico y ha aportado beneficios cardiovasculares y de nefroprotección en ERC25. Sin embargo, se ha evidenciado que aumenta la retención hidrosalina y con ello episodios de insuficiencia cardíaca, osteoporosis, fracturas y un posible incremento de riesgo de cáncer de vejiga26,27.
Así pues, la pioglitazona se puede utilizar en todos los estadios de ERC sin ajuste de dosis, aunque se debe evitar su indicación con FGe < 30 ml/min/1,73 m2 dado el riesgo que presenta de retención hidrosalina3.
Inhibidores de la alfa-glucosidasa
Los inhibidores de la alfa-glucosidasa (acarbosa y miglitol) bloquean a una enzima del epitelio intestinal encargada de la hidrólisis de los oligosacáridos, trisacáridos y disacáridos en la glucosa y otros monosacáridos6. Con ello se logra una disminución de la absorción de glucosa sin inducir riesgo de hipoglucemias. El efecto secundario más frecuente es la presencia de diarrea y flatulencia, así como la necesidad de una dosificación frecuente a lo largo del día. En el caso de los pacientes con ERC, se produce un acúmulo de metabolitos derivados tanto de acarbosa como de miglitol, por lo cual su uso está limitado en estos casos28. La acarbosa se podría utilizar hasta estadios de ERC con FGe < 25 ml/min/1,73 m2. El miglitol debería evitarse en cualquier estadio de ERC.
Análogos de la amilina
La pramlintida es un análogo de la amilina, la cual es una hormona neuroendocrina sintetizada y almacenada en la célula beta-pancreática y se secreta junto con insulina. La amilina regula los valores de glucosa en respuesta a la ingesta alimentaria, control en el vaciado gástrico y en la secreción de glucagón posprandial y aumenta la saciedad29. Sus efectos secundarios son básicamente gastrointestinales, tiene un alto coste y tiene una eficacia moderada para disminuir la HbA1c14. La dosis de pramlintida no debería modificarse en los estadios de ERC 2-4 y no existe una evidencia del uso de este fármaco en pacientes con ERC estadio 56.
Agonistas dopaminérgicos
Los agonistas dopaminérgicos (bromocriptina) modulan la regulación hipotalámica del metabolismo y aumentan la sensibilidad a la insulina mediante la activación de los receptores dopaminérgicos14. El riesgo de hipoglucemia es bajo y tienen un potencial efecto beneficioso cardiovascular30; sin embargo, tienen una eficacia moderada en el descenso de las cifras de HbA1c. Los principales efectos secundarios son la fatiga, náuseas, rinitis, mareos o síncopes. La eliminación renal de la bromocriptina es mínima, sin embargo, se recomienda una monitorización estrecha de la función renal en pacientes afectos de ERC13.
Terapias con nuevos antidiabéticos orales
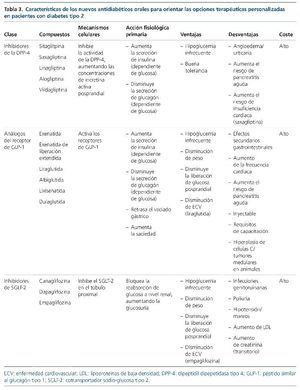
Los nuevos agentes antidiabéticos incluyen los inhibidores de DPP-4, los análogos de GLP-1 y los inhibidores de SGLT-2. En la tabla 3 se resumen las características de cada familia de estos fármacos.
Inhibidores de la dipeptidil dipeptidasa-4
El polipéptido insulinotrópico dependiente de glucosa (GDIP) y el GLP-1 son dos péptidos intestinales que se liberan en función de la cantidad de glucosa o nutrientes que están presentes en el intestino31. La función principal de estos péptidos es promover la secreción de insulina, lo que es conocido como “efecto incretina”. Además, GLP-1 suprime la liberación de glucagón. Estos péptidos se inhiben gracias a la enzima DPP-4, con lo cual se reduce su vida media de forma importante. En los pacientes afectados de DM2, la vía incretina está atenuada, lo que contribuye a la hiperglucemia posprandial. Los inhibidores selectivos de DPP-4 (sitagliptina, vildagliptina, saxagliptina, linagliptina y alogliptina) limitan la degradación de GLP-1 y GDIP, produciendo un aumento en la liberación de insulina y una diminución de la concentración de glucagón32.
El coste de estos fármacos es elevado. Dado que la secreción de insulina derivada del efecto incretina es dependiente de la glucosa, el riesgo de hipoglucemias es bajo33. Se ha asociado un aumento de riesgo de padecer pancreatitis aguda o de tumores pancreáticos34, así como un mayor riesgo de presentar episodios de insuficiencia cardíaca35.
La linagliptina tiene una eliminación hepatobiliar, por lo que no requiere ajuste de dosis en los pacientes con ERC, incluso en ERC avanzada y diálisis36. La sitagliptina, vildagliptina y saxagliptina se eliminan en su mayor parte a nivel renal, por lo que se requiere ajuste de dosis a partir de ERC con FG < 50 ml/min/m2, pudiéndose utilizar en todos los estadios de ERC37.
Agonistas del receptor del péptido-1 similar al glucagón
Los agonistas de GLP-1 tienen un efecto incretínico directo, de tal forma que promueven la secreción de insulina dependiente de glucosa por las células beta-pancreáticas, suprimen la secreción de glucagón y enlentecen el vaciado gástrico6.
El efecto adverso más frecuente es intolerancia gastrointestinal (diarreas, vómitos, náuseas), que puede ser más frecuente en pacientes con ERC. Tienen un bajo riesgo de hipoglucemia, inducen pérdida de peso y tienen un coste elevado. Los análogos de GLP-1 han demostrado beneficios en cuanto a mortalidad, control de cifras de presión arterial, reducción de HbA1c y pérdida de peso38. En el ensayo clínico LEADER39, en pacientes de alto riesgo cardiovascular se han asociado a un efecto protector frente a episodios cardiovasculares.
Los fármacos comercializados en España son exenatida, liraglutida, lixisenatida, albiglutida y dulaglutida. En general son fármacos con una experiencia limitada en ERC. La exenatida, la exenatida de acción prolongada y la lixisenatida pueden emplearse sin ajuste de dosis en pacientes con FG > 50 ml/min/1,73 m2. La exenatida puede administrarse en pacientes con FG entre 30 y 50 ml/min/1,73 m2, procediendo a una cuidadosa escalada de dosis. La lixisenatida, según su ficha técnica, también puede emplearse con precaución en estos casos7. La liraglutida puede emplearse sin ajuste de dosis hasta FG > 30 ml/min/m2 y se desaconseja su uso con filtrados más bajos.
Inhibidores del cotransportador sodio-glucosa tipo 2
Los inhibidores del SGLT-2 comercializados en España son la dapaglifozina, la canaglifozina y la empaglifozina. Estos fármacos actúan bloqueando la activación del transportador sodio-glucosa subtipo 2 a nivel del túbulo proximal, donde se reabsorbe un 90% de la glucosa filtrada en el glomérulo. Así pues, aumenta la eliminación de glucosa urinaria40 disminuyendo los valores de glucemia con un bajo riesgo de hipoglucemia. Además, se ha evidenciado una serie de efectos añadidos como son pérdida de peso, disminución de las cifras de presión arterial y una mejoría del perfil metabólico de los pacientes41. Los efectos secundarios son la aparición y/o empeoramiento de infecciones urogenitales, cansancio, deshidratación y deterioro de función renal (sobre todo en pacientes en tratamiento concomitante con diuréticos)6.
A nivel renal se han descrito efectos beneficiosos de los pacientes con nefropatía diabética como consecuencia de la disminución de la presión intraglomerular y otros mecanismos en estudio en la actualidad. Es de interés mencionar que la inhibición de SGLT-2 puede normalizar la concentración de NaCl a nivel de la mácula densa reduciendo la hiperfiltración glomerular y la albuminuria42.
La dapaglifozina es el primer fármaco comercializado en España y no está indicado en pacientes con FGe < 60 ml/min/m2. Si durante el tratamiento, la función renal se deteriora y desciende por debajo de FGe < 60 ml/min/m2, debe interrumpirse el tratamiento3. La empaglifozina es un novedoso fármaco cuyo perfil de seguridad no se ve afectado por la función renal, sin embargo, la capacidad para eliminar glucosa en la orina disminuye conforme avanza la gravedad de la ERC. Así pues, aunque en principio no se requiere ajuste de dosis en pacientes con ERC, se disminuye dosis en pacientes con FGe < 60 ml/min/m2 y no se recomienda su uso43 con FGe < 45 ml/min/m2. El estudio EMPA-REG OUTCOME44 mostró que el tratamiento con empaglifozina disminuía el riesgo de padecer infarto de miocardio, accidente vascular cerebral y muerte cardiovascular, por lo que la Food and Drug Administration agregó una nueva indicación con el fin de reducir el riesgo de muerte cardiovascular en adultos con diabetes tipo 2 y enfermedad cardiovascular. A nivel renal, en pacientes de alto riesgo cardiovascular, la empaglifozina se ha asociado a una lenta progresión de la enfermedad renal y menor tasa de eventos renales en pacientes de alto riesgo cardiovascular45. La canaglifozina es un inhibidor de SGLT-2, el cual requiere ajuste de dosis cuando FGe < 60 ml/min/m2 y no se recomienda su uso43 con FGe < 45 ml/min/m2. En el estudio CANVAS y CANVAS-R46, la canaglifozina evidenció un efecto beneficioso en los pacientes de alto riesgo cardiovascular disminuyendo los episodios cardiovasculares. Sin embargo, el grupo tratado con canaglofozina presentó un aumento de riesgo de amputación del dedo del pie o metatarso. A nivel renal, el tratamiento con canaglifozina objetivó un posible beneficio en cuanto a la evolución de la albuminuria, la evolución del FG, la necesidad de terapia renal substitutiva y muertes de causa renal. Actualmente está en marcha el ensayo CREEDENCE (clinical trials.gov, identificador: NCT02065791), que está diseñado para estudiar si el tratamiento con canaglifozina tiene un efecto renal beneficioso en cuanto a la evolución de la función renal, albuminuria y muertes de causa renal en pacientes con ERC estadios 2/3.
Elección de antidiabéticos orales en pacientes con enfermedad renal crónica
En la figura 2 se resume el ajuste de dosis de los diferentes fármacos descritos previamente según la función renal43.
Figura 2. Ajuste de dosis de los antidiabéticos orales en la enfermedad renal crónica. Se muestran las dosis máximas para administrar al día según la función renal. FGe: filtrado glomerular estimado.
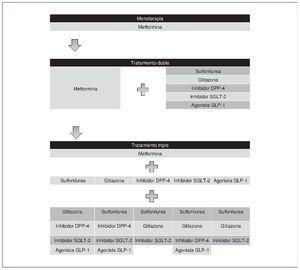
En general, en los pacientes con función renal con FGe > 60 ml/ min/m2 el inicio del tratamiento con antidiabéticos orales se recomienda con metformina (fig. 3). En caso de no alcanzarse un control glucémico correcto tras 3 meses del inicio del tratamiento, se debe añadir un segundo fármaco considerando una de las siguientes 6 opciones terapéuticas: sulfonilurea, glitazona, inhibidor de DPP-4, inhibidor de SGLT-2, agonistas del receptor de GLP-1 o insulina basal. Si todavía no se alcanza el objetivo de HbA1c después de 3 meses de tratamiento doble, se procederá a la combinación de 3 fármacos. Posteriormente, si no se alcanza el objetivo de HbA1c después de 3 meses de tratamiento triple, se procederá al tratamiento inyectable combinado14.
Figura 3. Algoritmo de elección de antidiabéticos orales en población general (función renal normal). Se muestran las posibles secuencias de tratamiento antidiabético oral; la transición habitual es vertical, de arriba abajo (aunque también es posible el movimiento horizontal dentro de los estadios de tratamiento, según las circunstancias). DPP-4: dipeptidil dipeptidasa tipo 4; GLP-1: péptido similar al glucagón tipo 1; SGLT-2: cotransportador sodio-glucosa 2. Adaptado de la guía ADA 2017.
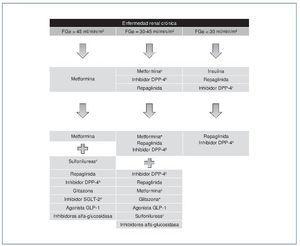
En el caso de los pacientes con ERC (fig. 4) con FGe > 45 ml/min/m2, la metformina sigue siendo el fármaco de primera línea. Si con metformina en monoterapia no se consigue el objetivo de control glucémico, se recomienda asociar un inhibidor de DPP-4 o bien repaglinida. La gliclazida puede ser otra opción por ser la sulfonilurea con menor riesgo de hipoglucemias y evidencias de protección renal. Si no se alcanzase el control adecuado, se recomienda añadir insulina basal7.
Figura 4. Algoritmo terapéutico en pacientes con diabetes mellitus tipo 2 y enfermedad renal crónica.
DPP-4: dipeptidil dipeptidasa tipo 4; FGe: filtrado glomerular estimado; GLP-1: péptido similar al glucagón tipo 1; SGLT-2: cotransportador sodio-glucosa 2.
aUso con precaución y ajuste de dosis.
bAjuste de dosis, salvo linagliptina.
cEvitar glibenclamida. Ajuste de dosis en glimepirida y glipizida.
dContraindicada dapaglifozina. Ajuste de dosis en canaglifozina y empaglifozina.
ePrecaución con retención hidrosalina.
Cuando el FG está entre 30 y 45 ml/min/1,73 m2, es recomendable reducir la dosis de metformina y monitorizar la función renal. Los inhibidores de la DPP-4 pueden utilizarse ajustando la dosis según se requiera. La repaglinida es otra alternativa, dada su eliminación por vía biliar7.
En pacientes con FG < 30 ml/min/1,73 m2 o en diálisis, la experiencia con los fármacos antidiabéticos no insulínicos es muy limitada, por lo que el tratamiento de elección debe ser la insulina. No obstante, en los pacientes con hiperglucemia no muy marcada, tanto la repaglinida como los inhibidores de DPP-4 son alternativas que se han de valorar7.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
*Incluimos en esta revisión no solo los antidiabéticos orales, sino también los análogos del péptido similar al glucagón tipo 1 (GLP-1), que se administran por vía subcutánea.
Conceptos clave
1. El tratamiento de la DM en los pacientes con ERC es un reto del profesional médico dado el alto riesgo de hipoglucemias.
2. Los objetivos de control glucémico en pacientes con ERC varían respecto a los de la población general, siendo en general más laxos.
3. La metformina es el fármaco de elección hasta un FGe de 30 ml/min/m2, requiriendo precaución en situaciones clínicas específicas y un ajuste de dosis adecuado.
4. La repaglinida es un fármaco seguro en todos los estadios de ERC avanzada, aunque su eficacia es limitada.
5. Las sulfonilureas, los inhibidores de alfa-glucosidasa y los análogos de GLP-1, en general, están contraindicados cuando el FGe desciende por debajo de 30 ml/min/m2.
6. La pioglitazona se puede utilizar en la mayoría de grados de ERC, sin que haya evidencia en pacientes en diálisis.
7. Los inhibidores de DPP-4 se pueden usar en ERC con ajuste de dosis; excepto linagliptina, que no requiere ajuste de dosis.
8. Los inhibidores de SGLT-2 en general están contraindicados cuando el FGe < 60 ml/min/m2. Sin embargo, la empaglifozina y la canaglifozina se pueden usar con ajuste de dosis hasta un FGe de 45 ml/min/m2.
Correspondencia: María José Soler
Servicio de Nefrología.
Hospital del Mar. Fundació IMIM.
Passeig Marítim, 25-29. 08003 Barcelona.
msoler@parcdesalutmar.cat