La amiloidosis AA es una complicación ampliamente descrita de enfermedades sistémicas crónicas inflamatorias, como la artritis reumatoide; sin embargo, su asociación con el lupus eritematoso sistémico es menos frecuente en la literatura. Además, los casos descritos presentan una gran variabilidad clínica en cuanto al momento y la forma de presentación. Se describe el caso de una paciente con lupus eritematoso sistémico con afectación articular y microhematuria, que desarrolla un síndrome nefrótico completo. En la biopsia se identifica depósito amiloide AA. No se identifican otras posibles causas de amiloidosis en nuestra paciente.
INTRODUCCIÓN
Se presenta el caso de una mujer de 76 años, diagnosticada de lupus eritematoso sistémico (LES) que debuta con síndrome nefrótico completo. En la biopsia renal se objetiva depósito abundante de amiloide AA sin otra afectación renal del lupus. Dada la escasa bibliografía sobre esta asociación, con este caso se quiere enfatizar que en los pacientes con LES la proteinuria nefrótica se puede deber a nefropatías no lúpicas.
CASO CLÍNICO
Mujer de 76 años. Entre los antecedentes personales cabe destacar los siguientes factores de riesgo cardiovascular: 1) hipertensión arterial en tratamiento farmacológico, con buen control; 2) diabetes mellitus tipo 2 diagnosticada en 2007 por su médico de atención primaria, sin retinopatía diabética, pero con microalbuminuria positiva desde 2008, momento en el que se intenta iniciar tratamiento con antidiabéticos orales (previamente la paciente se había negado a cualquier tratamiento farmacológico y no había cumplido las recomendaciones higienicodieteticas); en tratamiento con insulina, por mal control glucémico, en 2015; mala adherencia al tratamiento y nulo cumplimiento de la dieta recomendada, con dificultad añadida para el control glucémico por el tratamiento corticoide concurrente; 3) hipercolesterolemia en tratamiento con estatina; 4) obesidad. Asimismo está en seguimiento por neurología (desde agosto de 2016) por deterioro cognitivo de causa no filiada, con alteración inespecífica del comportamiento. Se realizó resonancia cerebral, en la que se aprecia leve atrofia corticosubcortical difusa sin atrofia significativa de la región temporal medial/ hipocampal y con carga vascular crónica grado III. Sin otra patología de base asociada. Sin antecedentes familiares de interés.
Diagnosticada en agosto de 2014 (desde entonces en seguimiento en consulta de reumatología) de LES durante el estudio de poliartralgias, que asociaba astenia, hiporexia y febrícula de duración indeterminada, dada la difícil anamnesis por las características psicosociales de la paciente. También presentaba Raynaud en 2 fases en manos. Sin aftas orales. Sin alopecia ni otra clínica dermatológica. Sin síntomas respiratorios ni digestivos.
Diagnóstico de LES por clínica y analítica compatibles, según los criterios del SLICC (Systemic Lupus International Collaborating Clinics) y el ACR (American College of Rheumatology).
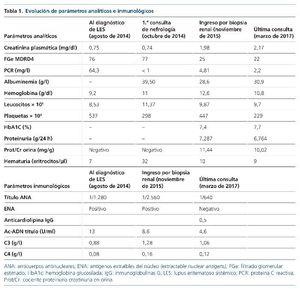
Al diagnóstico destaca (tabla 1):
• Analítica en plasma: creatinina, 0,75 mg/dl; con un filtrado glomerular estimado (FGe) por MDRD4, 76 ml/min; factor reumatoide y velocidad de sedimentación globular normales (10,9 UI/ml y 41 mm/h, respectivamente); elevación de proteína C reactiva (64 mg/l); anemia normocítica hipocrómica, con estudio de hemólisis negativo; leucocitos normales en número total, y fórmula y plaquetas normales. Proteinograma sin componente monoclonal.
• Orina: proteínas en tira reactiva, negativas; 4 hematíes/campo.
• Estudio inmunológico: antinucleares, positivos a título alto; ENA (extractable nuclear antigens), positivos; antihistonas, positivos; complementos C3 y C4, descendidos; ANCA (anticuerpos anticitoplasma de neutrófilo), positivos, sin especificidad, y anticuerpos antimembrana basal glomerular, negativos; anticardiolipina y anticoagulante lúpico, inicialmente negativos; crioglobulinas, negativas; serologías de hepatitis B y C, negativas.
Dado el diagnóstico de LES, se instaura tratamiento con prednisona vía oral. Presenta contraindicación por parte de oftalmología para el tratamiento con antipalúdicos, por atrofia macular. Posteriormente se asocia metotrexato intravenoso, con mejoría de la sintomatología articular y general.
Se remite a la consulta de nefrología en octubre de 2014 por microhematuria. Se realiza estudio completo, pero no se halla otra patología médica ni urológica asociada. Durante el curso evolutivo posterior ha presentado sedimentos no activos. Serológicamente presenta en todo momento anticuerpos antinucleares (ANA) positivos a título alto (patrón homogéneo) con ENA positivos (ver título de anticuerpos en la tabla 1); el resto, negativos. En el momento del diagnóstico, los complementos (C3 y C4) se encontraban descendidos, y se normalizaron posteriormente. Los valores séricos de amiloide AA en la paciente estaban elevados (7,6 mg/l; límite superior de la normalidad en nuestro laboratorio, 5 mg/l).
En noviembre de 2015 ingresa en nuestro hospital por síndrome nefrótico (clínico y analítico) y deterioro de la función renal, y en este momento se intensificó el tratamiento corticoide (1 mg/kg/día de metilprendisolona intravenosa).
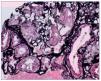
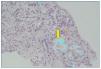
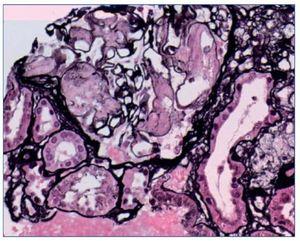
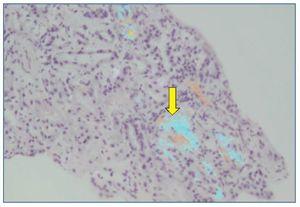
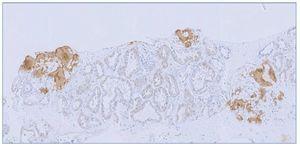
Se plantea la realización de biopsia de grasa subcutánea para descartar depósito amiloide, pero se prioriza la realización de biopsia renal, dado el contexto clínico, y se plantea el diagnóstico diferencial de presunción de nefropatía lúpica membranosa (tipo V) frente a otras nefropatías. Sin embargo, en el estudio anatomopatológico a niveles glomerular y arterial se evidencia depósito de amiloide, débilmente PAS (ácido peryódico de Schiff) positivo, negativo para plata metenamina (fig. 1) y positivo para rojo Congo (fig. 2), con birrefringencia a verde manzana con luz polarizada. El estudio inmunohistoquímico muestra positividad para amiloide A (fig. 3). No se observan imágenes que puedan justificar afectación lúpica renal asociada. En el estudio de microscopia electrónica (fig. 4) destaca la presencia de fibrillas dispuestas de forma aleatoria y con unas medidas comprendidas entre los 9-12 nm de diámetro. No se observan depósitos electrodensos. El estudio de inmunofluorescencia es negativo.
Figura 1. Marcado depósito de material amorfo a nivel glomerular sugestivo de amiloide. Técnica de plata metenamina (40×).
Figura 2. La tinción de rojo Congo muestra birrefringencia verde manzana a niveles glomerular y arterial (20×).
Figura 3. El depósito muestra positividad para amiloide A (4×).
Figura 4. Imagen de microscopia electrónica. Fibrillas de orientación aleatoria con un diámetro de 9-12 nm.
El estudio de amiloidosis se completa con resonancia magnética cardíaca, que descarta depósito de amiloide a este nivel. Asimismo, se realiza electromiograma, en el que se objetivan medidas compatibles con síndrome del túnel carpiano bilateral leve-moderado, aunque asintomático.
El metotrexato se suspende tras el alta de hospitalización, y, en este momento, la paciente presenta una función renal deteriorada respecto a la basal, con creatinina en plasma de 1,94 mg/dl (FGe MDRD4, 25 ml/min). Durante la evolución posterior en consultas se intenta un descenso de corticoides (prednisona vía oral), con ciertas dificultades por la reactivación de la clínica articular. Se decide asociar azatioprina a dosis de 100 mg/día.
DISCUSIÓN
La amiloidosis renal AA secundaria al LES es una entidad descrita en pocos casos en la bibliografía. El amiloide AA es una lipoproteína sérica; se trata de un reactante de fase aguda que se agrega en sangre a otros componentes formando fibrillas amiloideas, que se depositan en los tejidos y pueden interrumpir la estructura y la función normales.
Los pacientes diagnosticados de LES pueden presentar en la biopsia renal afectación renal no lúpica, que sin embargo puede estar asociada con la enfermedad de base. El hallazgo de nefropatía no lúpica puede presentarse de manera exclusiva o coexistente con nefritis lúpicas per se. En la serie de casos de nefritis no lúpicas en pacientes con LES recogida por el Renal Pathology Laboratory del The Methodist Hospital en Houston, publicada en Human Pathology en el año 2001, de sus 13 especímenes de biopsia renal de pacientes con LES pero sin nefropatía lúpica, tan solo 1 presentaba amiloidosis; sin embargo, en este estudio aseguran que la afectación renal no lúpica más frecuente de estos pacientes es la amiloidosis, según lo revisado en la bibliografía publicada hasta ese momento. En este mismo artículo mencionan que, según su revisión, las nefropatías no lúpicas en pacientes con LES se pueden presentar sin relación con la actividad serológica o clínica del lupus.
Por lo que hemos podido observar en los casos que hemos revisado (publicados hasta marzo de 2017 en inglés, castellano y/o portugués), existe una gran variabilidad clínica, tanto en cuanto al grado de actividad del lupus sistémico en el momento del diagnóstico de la biopsia como en la patología intercurrente. En general, los casos de amiloidosis AA secundaria a LES se presentan con síndrome nefrótico completo y con o sin deterioro de la función renal. La amiloidosis AA es una complicación relativamente frecuente de otras enfermedades inflamatorias (como la artritis reumatoide) o infecciosas crónicas, en las que el amiloide sérico AA suele estar más elevado que en los paciente con LES. Se ha descrito que, en algunos casos de LES y amiloidosis renal AA, existe una enfermedad inflamatoria no diagnosticada. En nuestra paciente, se consideró que se han descartado razonablemente otras causas de amiloidosis secundaria.
CONCLUSIÓN
Se describe el caso de una paciente con LES y síndrome nefrótico, con biopsia renal con depósito de amiloide AA, en la que se han descartado otras posibles causas de amiloidosis secundaria. Con la exposición de este caso clínico inusual, queremos remarcar la posibilidad del diagnóstico por biopsia de nefropatías no lúpicas en pacientes afectados de LES con datos clínicos de afectación renal.
Conflicto de intereses
Las autoras declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia: Amaia Begoña Osorio Montes
Servicio de Nefrología.
Hospital de Zumarraga.
Barrio Argixao, S/N. 20700 Zumarraga.
amaiabegona.osoriomontes@osakidetza.eus
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.
Referencias bibliográficas recomendadas
Al-Hoqail I, Naddaf H, Al-Rikabi A, Al-Arfaj H, Al-Arfaj A. Systemic lupus erythematosus and amyloidosis. Clin Rheumat. 1997;16:422-4.
Baranowska-Daca E, Choi YJ, Barrios R, Nassar G, Suki WN, Truong LD. Nonlupus nephritides in patients with systemic lupus erythematosus: a comprehensive clinicopathologic study and review of the literature. Hum Pathol. 2001;32:1125-35.
Ellington KT, Truong L, Olivero JJ. Renal biopsy case. Renal amyloidosis in systemic lupus erythematosus. Am J Kidney Dis. 1993;21:676-8.
Fernández Alonso J, Ramos M, Castilla J, Silva A, Wichmann I, Torres M, et al. Amiloidosis renal y lupus eritematoso sistémico sin nefropatía lúpica. Nefrologia. 1986;6:113-6.
Hebert LA, Sharma HM, Sedmak DD, Bay WH. Unexpected renal biopsy findings in a febrile systemic lupus erythematosus patient with worsening renal function and heavy proteinuria. Am J Kidney Dis. 1989; 13:504-7.
Huston DP, McAdam KP, Balow JE, Bass R, DeLellis RA. Amyloidosis in systemic lupus erythematosus. Am J Med. 1981;70:320-3.
Lachmann HJ, Goodman HJB, Gilbertson JA, Gallimore JR, Sabin CA, Gillmore JD, et al. Natural history and outcome in systemic AA amyloidosis. N Engl J Med. 2007;356:2361-71.
Monteiro P, Abrey P, Salvador MJ, Malcata A. Amiloidose secundária e lúpus eritematoso sistémico. Caso clínico. Acta Reumatol Port. 2009;34:400-4.
Orellana C, Collado A, Hernández MV, Font J, Del Olmo JA, Muñoz-Gómez J. Case report. When does amyloidosis complicate systemic lupus erythematosus? Lupus. 1995;4:415-7.
Queffeulou G, Berenbaum F, Michel C, Mougenot B, Mignon F. AA amyloidosis in systemic lupus erythematosus: an unusual complication. Nephrol Dial Transplant. 1998;13:1846-8.
Ridley MG, Maddison PJ, Tribe CR. Amyloidosis and systemic lupus erythematosus. Ann Rheum Dis. 1984;43:649-50.