INTRODUCCIÓN
La hipertensión arterial maligna (HTAM) se define por la presencia de hipertensión arterial (HTA), frecuentemente con cifras de tensión arterial (TA) diastólica mayor a 130 mmHg, y afectación vascular severa en forma de retinopatía avanzada, como la presencia de hemorragias y exudados y/o papiledema (retinopatía grados 3 o 4, respectivamente, según la clasificación de Keith-Wagener)1,2. Puede presentarse con o sin antecedentes de HTA. Describimos el caso de un paciente sin antecedentes de HTA previa, que inició un cuadro en forma de HTAM, hipopotasemia, alcalosis metabólica y disminución de los niveles de renina y aldosterona plasmática, que había estado consumiendo barritas de regaliz (20 g/día) de forma continuada durante los últimos 3 años. Para su control fueron necesarios 4 fármacos. Tras el cese de su ingesta, a los 2 meses se corrigieron los niveles de renina y aldosterona, y se controló la TA sin hipotensores.
CASO CLÍNICO
Presentamos el caso de un hombre de 60 años de edad, que consulta por disminución de la agudeza visual, presentando HTA (195/85 mmHg) con retinopatía hipertensiva grado IV, e hipopotasemia con alcalosis metabólica. No tenía antecedentes patológicos ni antecedentes familiares de HTA. No tomaba medicación de forma habitual.
En la exploración física mostraba buen aspecto general, correcto estado de hidratación, IMC de 24,76 kg/m2. Consciente y orientado. TA de 195/85 mmHg y sin signos de insuficiencia cardíaca. Auscultación cardiorrespiratoria: tonos cardíacos rítmicos, sin soplos, a 86 lat/min y murmullo vesicular conservado. Exploración abdominal normal, sin soplos vasculares. Ausencia de edemas. Exploración neurológica normal. El fondo de ojo mostró hemorragia retiniana en los cuatro cuadrantes e imagen de edema de papila bilateral compatible con retinopatía hipertensiva grado IV.
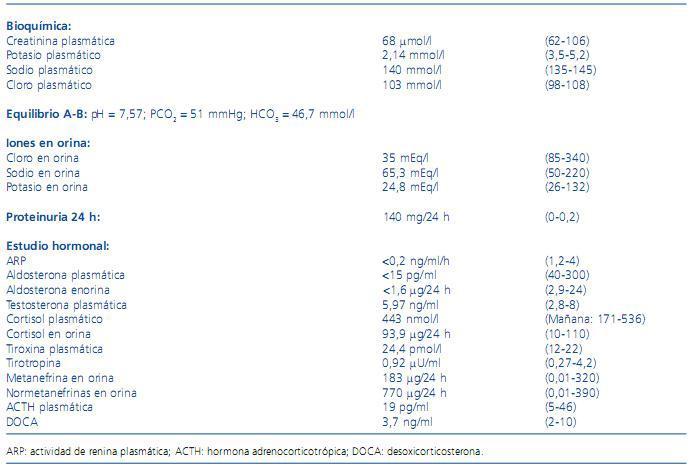
Analíticamente destacaba hemograma y bioquímica con función renal normal, hipopotasemia y alcalosis metabólica. El estudio hormonal mostró disminución de la actividad de renina plasmática (ARP) y aldosterona plasmática, con resto de estudio hormonal normal (tabla 1).
En las pruebas de imagen realizadas, una radiografía de tórax mostró cardiomegalia y elevación de hemidiafragma derecho. La ecografía abdominal fue normal, y el ecocardiograma confirmó los signos de miocardiopatía hipertrófica apreciados en el electrocardiograma.
Para un control inicial de la TA se precisaron antagonistas del calcio, betabloqueantes, inhibidores de la enzima convertidora de la angiotensina (IECA) y diuréticos, y se añadieron suplementos de potasio. Con los hallazgos analíticos y hormonales se realizó un nuevo reinterrogatorio dirigido, tras el cual el paciente confirmó un consumo crónico de 20 g/día de regaliz, desde hacía 3 años. Tras el cese del consumo de regaliz, las cifras tensionales fueron normalizándose, lo cual permitió la retirada progresiva de los fármacos hipotensores, así como de los suplementos de potasio.
En un control posterior, realizado a los 2 meses, el paciente presentaba normalización de los valores de aldosterona, y ARP (tabla 2), y se llegó a la conclusión de que el diagnóstico definitivo era de HTAM secundaria a la ingesta crónica de regaliz.
DISCUSIÓN
Nos encontramos ante un paciente con HTAM, hipopotasemia y alcalosis metabólica. La alcalosis metabólica es una entidad en la que la concentración urinaria de cloro refleja mejor el estado volumétrico del paciente que el sodio urinario3.
En función del cloro urinario se agrupan las causas de alcalosis metabólica en dos grupos (tabla 3).
Las situaciones con un cloro urinario disminuido (<25 mEq /l) reflejan una retención urinaria máxima de cloro y fundamentalmente un estado de hipovolemia (excluyendo el período de actividad del diurético, en el que encontraremos un cloro urinario elevado). En este grupo se incluyen: pérdidas digestivas de hidrogeniones, como en el caso de vómitos o aspiración nasogástrica; alcalosis posthipercapnia, efecto tardío de un diurético, o trastornos más esporádicos, como algún tipo específico de diarrea; o tras tratamientos con penicilina intravenosa o carbenicilina, que pueden llevar a una situación similar4. Ninguna de estas entidades se correspondía con nuestro paciente.
En otro grupo, tenemos aquellas causas de alcalosis metabólica que cursan con un cloro urinario elevado (>40 mEq/l). En estos casos la TA aporta mucha información. Si la TA es normal, debemos pensar en un posible efecto actual de diurético que esté provocando pérdida importante de cloro en orina, trastornos específicos tubulares, como el síndrome de Bartter o el síndrome de Gitelman, en alcalosis por realimentación o en hipopotasemias muy severas (<2 mEq/l) por desplazamiento intracelular de hidrogeniones4. Estas entidades quedaron descartadas en nuestro paciente por la presencia de HTA.
Dentro de este mismo grupo, cuando nos encontremos ante una TA elevada, debemos pensar en primer lugar en una situación de hipermineralocorticismo primario y, menos frecuentemente, en el consumo de regaliz y en el síndrome de Liddle.
En relación con el hipermineralocorticismo primario tenemos varias entidades que pueden producir un exceso primario de mineralocorticoides: hiperaldosteronismo primario (HAP), enfermedad de Cushing o hiperplasia adrenal congénita.
En el hiperaldosteronismo primario existe una hipersecreción autónoma de aldosterona como consecuencia de un adenoma, hiperplasia o carcinoma de las glándulas suprarrenales. Debido a la ligera hipervolemia existente, la ARP puede estar disminuida y cursa con niveles elevados de aldosterona5. En nuestro caso los niveles de aldosterona y ARP estaban disminuidos, por lo que se descartó esta entidad.
En la enfermedad de Cushing pueden desarrollarse hipopotasemia y alcalosis metabólica. Esto suele ocurrir en pacientes con producción ectópica de hormona adrenocorticotropina (ACTH) y una secreción de cortisol exagerada, superando la velocidad de inactivación del mismo6. El hipercortisolismo puede deberse a hipersecreción de ACTH (por un adenoma hipofisiario o un tumor no endocrino productor de ACTH), enfermedades suprarrenales primarias (adenoma o carcinoma) o tratamiento glucocorticoideo exógeno. Clásicamente presenta aumento de la cortisoluria o sus metabolitos. Cursa con ARP normal o ligeramente aumentada. Una vez se excluyó mediante el interrogatorio la ausencia de ingesta de corticoides, los niveles normales de ACTH y cortisol urinario y plasmático descartaron esta entidad como agente etiológico de HTAM.
La hiperplasia adrenal congénita se produce cuando disminuye la producción de cortisol por un déficit enzimático suprarrenal. Se elevan persistentemente la secreción de ACTH y, por lo tanto, de desoxicorticosterona (DOCA) y corticosterona, a menos que la enzima deficitaria participe en su síntesis. Esto puede observarse en dos formas de hiperplasia adrenal congénita, por déficit de CYP 11B1 (11β-hidroxilasa) y de CYP17 (17β-hidroxilasa)7. Estas entidades cursan con niveles disminuidos de renina y aldosterona, pero también de cortisol, que en el caso de nuestro paciente era normal.
Finalmente se planteó el diagnóstico diferencial entre el hiporreninismo hipoaldosterónico secundario a síndrome de Liddle o a la ingesta crónica de regaliz.
En el síndrome de Liddle se observa un cuadro clínico similar al del HAP, aunque es independiente de los mineralocorticoides. Este síndrome es una rara enfermedad autosómica dominante caracterizada por una mutación del canal del sodio del túbulo colector, lo que provoca un mayor funcionamiento del canal y por tanto aumenta la reabsorción de sodio8. Se diferencia del verdadero HAP en que tanto los niveles de renina como de aldosterona están disminuidos. El tratamiento consiste en la administración de amilorida o triamtereno, diuréticos ahorradores de potasio que cierran directamente los canales de sodio9. La espironolactona es ineficaz, ya que el aumento de la actividad del canal de sodio no está mediado por la aldosterona. Esta patología no pudo descartarse inicialmente debido a la similitud de presentación al seudo-HAP por ingesta de regaliz.
La ingestión crónica de grandes cantidades de regaliz produce un cuadro similar al HAP. Cursa con alcalosis hipopotasémica, HTA y niveles de renina y aldosterona disminuidos10.
Dados los antecedentes de ingestión crónica de regaliz en nuestro paciente, se sospechó esta entidad como causante del cuadro clínico. Tras el cese del consumo de regaliz, la TA fue normalizándose, lo que permitió la retirada progresiva del tratamiento antihipertensivo. Posteriormente se normalizaron los valores de ARP y aldosterona (tanto en plasma como en orina), y una nueva funduscopia realizada a los 2 meses mostró desaparición de los signos de retinopatía hipertensiva maligna.
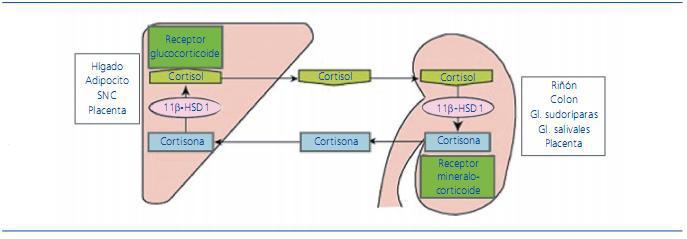
La ingesta crónica de regaliz es una causa conocida de HTA y bien descrita en la bibliografía. El ácido glicirrínico, que es un componente del regaliz, inhibe de forma competitiva la 11β-HSD2 evitando el catabolismo del cortisol a cortisona, e incrementando su vida media11,12 (figura 1). El cortisol tiene la misma afinidad para los receptores de aldosterona que la propia aldosterona, proporcionando un efecto mineralocorticoide, con retención de sodio y agua, así como con hipopotasemia. El regaliz puede producir supresión de la concentración de renina, secundaria a hipervolemia, o bien por inhibición directa de la producción de renina10,13,14. Estudios previos han constatado que el máximo aumento de la TA se alcanza después de las primeras 2 semanas de ingesta15. Otros estudios demuestran cambios hormonales inducidos a partir de la primera semana, después del inicio del consumo de 100 g diarios de regaliz10.
Con todo lo anteriormente descrito pudimos excluir un síndrome de Liddle y concluimos que nuestro paciente presentaba una HTA secundaria a la ingesta crónica de regaliz que se inició de forma excepcional en forma de HTAM. Sin embargo, y si bien la ingesta crónica de regaliz es una causa ampliamente conocida de HTA, en la bibliografía revisada no hemos encontrado referencia respecto a su comienzo en forma de HTAM como ha ocurrido en nuestro paciente.
Tabla 1. Valores analíticos al ingreso
Tabla 2. Evolución clínica y analítica
Tabla 3. Principales causas de alcalosis metabólica
Figura 1. Mecanismo de acción de mineralocorticoides. El regaliz produce una inhibición 11β-HSD2