La fibrosis retroperitoneal es una patología muy infrecuente caracterizada por la formación de un tejido fibroso e inflamatorio en el retroperitoneo, que engloba uréteres, arterias y venas, causando obstrucción al flujo urinario, insuficiencia renal y trastornos circulatorios. El seudotumor del páncreas es también un trastorno raro, usualmente originado en una pancreatitis autoinmune. En ambas afecciones, la etiología se desconoce y los hallazgos histopatológicos son muy similares, por lo que se ha sugerido un mecanismo fisiopatológico común. Comunicamos un caso de fibrosis retroperitoneal con hidronefrosis del riñón derecho, aparecida 19 meses después de un seudotumor de la cabeza del páncreas, tratado con corticoides y colchicina con rápida desaparición de los síntomas, de los parámetros inflamatorios en los exámenes de laboratorio y con una reducción significativa del volumen del tejido retroperitoneal y desaparición de la hidronefrosis.
INTRODUCCIÓN
La fibrosis retroperitoneal idiopática (FRPI) es un trastorno de escasa frecuencia que puede presentarse en forma aislada o acompañarse de otras enfermedades inflamatorias y/o esclerosantes, a menudo de etiología autoinmune. Frecuentemente la FRPI afecta a los uréteres y origina una obstrucción al flujo urinario que puede llevar a una insuficiencia renal. En su tratamiento se han utilizado con éxito, de forma aislada o combinada, corticoides, inmunosupresores, tamoxifeno y, últimamente, colchicina. Presentamos el caso de un paciente de edad avanzada con una FRPI, precedida meses antes de un seudotumor pancreático, que fue tratado con éxito con una combinación de corticoides y colchicina.
CASO CLÍNICO
Hombre de 74 años con antecedentes de hipertensión arterial, osteoporosis y artrosis de rodillas, por lo que recibía enalapril, carbonato de calcio, vitamina D y sulfato de glucosamina. Nueve años antes había sido operado de hiperplasia prostática benigna por vía transuretral.
En junio de 2006 inició dolor epigástrico irradiado al dorso asociado con moderada reducción de peso y posteriormente presentó prurito, ictericia y coluria. Tres semanas después consultó a un cirujano quien halló hepatomegalia blanda e indolora a 3 cm bajo el reborde costal. El hematocrito fue del 33,7%, hemoglobina 10,5 mg/dl, leucocitos 9.300 mm3, VHS 96 mm/hora, bilirrubina total 19,8 mg/dl, bilirrubina directa 10,5 mg/dl, fosfatasas alcalinas 430 U/l (VN: 50-300), GGTP 53 U/l (VN: <42), GOT 76 U/l (VN: <37), GPT 99 U/l (VN: <23). La ecotomografía mostró dilatación de la vía biliar extrahepática (16 mm) sin cálculos y aumento de volumen hipoecoico de la cabeza del páncreas (5,5 x 3,5 cm). El antígeno CA 19-9 fue 34 U/ml (VN: <39) y el antígeno carcinoembrionario 2,79 ng/ml (VN: <4,3). Se sospechó un cáncer pancreático y fue operado una semana después, al mes de iniciados los síntomas. Se encontró un colédoco dilatado (18 mm) y de paredes muy engrosadas, siendo infranqueable su lumen hacia distal. No había cálculos en su interior. La vesícula estaba distendida y tensa con paredes gruesas y el conducto cístico estaba dilatado, no había cálculos. El hígado aumentado de tamaño era de coloración verde oscura y no había evidencias de metástasis. La cabeza del páncreas era dura, nodular y medía 5 x 4 cm. Existían adenopatías retrocoledocoduodenales y a lo largo del trayecto de la arteria hepática. Se efectuaron colecistectomía, anastomosis coledocoduodenal látero-lateral y una punción transduodenal de la tumoración de la cabeza del páncreas para obtener citología, la cual no reveló células neoplásicas. El análisis histopatológico de la vesícula mostró una pared gruesa y fibrótica con signos de colesterolosis. Después de la operación desapareció rápidamente la ictericia y el paciente recuperó su peso habitual (57 kg), auqnue persistía el dolor epigástrico y dorsal de forma intermitente en los 3 meses siguientes hasta desaparecer. Una tomografía computarida de abdomen efectuada 3 semanas después de la operación fue normal, con excepción de aerobilia y la cabeza del páncreas aumentada de volumen con densidad radiológica heterogénea.
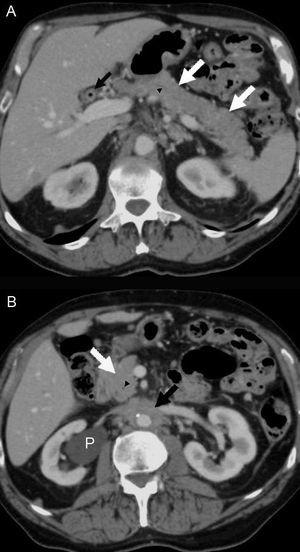
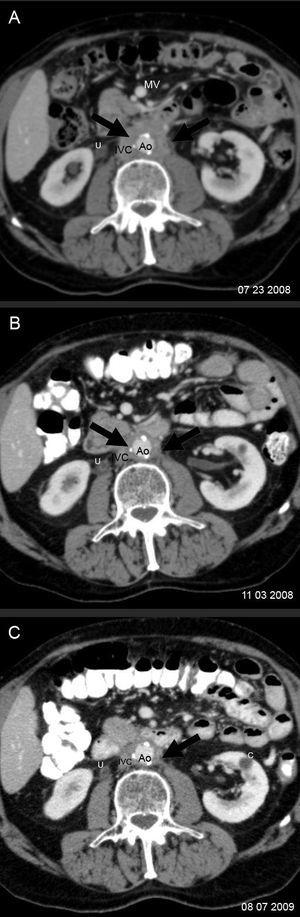
Diecinueve meses después de la cirugía, el paciente refirió un dolor lumbar de carácter sordo, edema bilateral de extremidades inferiores (+++), hidrocele bilateral y edema del pene. La ecotomografía abdominal mostró hidronefrosis derecha y una tomografía computarida de abdomen, un tejido periaórtico que comenzaba en la arteria mesentérica superior y envolvía a la aorta y a la vena cava inferior, extendiéndose hasta la bifurcación aórtica. Existían pequeñas adenopatías retroperitoneales. Los uréteres estaban libres hasta la vejiga. La imagen era indicativa de fibrosis retroperitoneal. El páncreas era radiológicamente normal (figura 1 y figura 2). Los exámenes de laboratorio mostraron anemia (Hto 35,2%, Hb 11,2 g/dl), VHS 50 mm/hora y creatinina 1,2 mg/dl. El recuento de glóbulos blancos fue 5.600 mm3, plaquetas 168.000 mm3, sedimento urinario normal, proteinuria 202 mg/24 horas, proteinemia 7,4 g/dl, albúmina 4,4 g/dl, globulinas 3,0 g/dl, uricemia 5,8 mg/dl, TSH 3,2 µU/l y APE 0,27 ng/ml. Con el diagnóstico clínico de fibrosis retroperitoneal idiopática se inició tratamiento con corticoides (deflazacort) 30 mg/día, colchicina 0,5 mg cada 12 horas y omeprazol 20 mg/día. Se eligió el deflazacort (DEF) por el antecedente de osteoporosis, dado su menor efecto sobre el metabolismo óseo. Un mes después el paciente estaba asintomático. Habían desaparecido el dolor lumbar, la anemia y el edema genital y de las extremidades inferiores. La VHS y la PCR se habían normalizado (8 mm/hora, <1 mg/l, respectivamente) y la función renal era normal. Se redujo el DEF a 22,5 mg/día, manteniendo la colchicina en 1 mg/día, enalapril, omeprazol, calcio y vitamina D. A los 2 meses de terapia se quejó de un leve dolor lumbosacro, había una discreta elevación de la VHS (18 mm/h) y de PCR (3,3 mg/l), por lo cual se aumentó el DEF a 30 mg/día. Al tercer mes estaba asintomático y la VHS y PCR se habían normalizado. Una tomografía computarida mostró una reducción del volumen del tejido retroperitoneal en un 25% (figura 2). Se redujo el DEF a 22,5 mg/dl manteniendo sin modificación los demás fármacos.
En los meses siguientes continuó asintomático y los exámenes de laboratorio no evidenciaron reactivación de la enfermedad, por lo que se redujo progresivamente la dosis de DEF hasta alcanzar los 6 mg cada 48 horas al año de iniciado el tratamiento, manteniendo la colchicina en 1 mg/día, que fue bien tolerada. La tomografía de control, efectuada a los 12 meses de iniciada la terapia, mostró desaparición de la hidronefrosis, reducción del volumen (33%) del tejido retroperitoneal (figura 2) y ausencia de alteraciones en el área pancreática. Los exámenes de laboratorio evidenciaron una función renal normal y ausencia de actividad inflamatoria o anemia. En el último control médico (a los 15 meses de iniciado el tratamiento), el paciente continuaba asintomático utilizando una dosis de mantenimiento de DEF de 6 mg en días alternos y colchicina 1 mg/día.
DISCUSIÓN
Este hombre de 74 años, sin antecedentes previos de patología abdominal ni de alcoholismo, consultó por dolor epigástrico irradiado al dorso, ictericia obstructiva y descenso de peso, síntomas acompañados de anemia, VHS elevada y una ecotomografía abdominal que mostró la cabeza del páncreas hipoecoica y aumentada de tamaño, dilatación de la vía biliar y ausencia de litiasis en vesícula y conducto biliar principal. Ello hizo plantear clínicamente la existencia de un cáncer de cabeza de páncreas, por lo que el paciente fue sometido a una laparotomía exploradora, encontrándose una tumoración dura y nodular en la cabeza del páncreas, adenopatías peripancreáticas, engrosamiento de la pared de vesícula y colédoco con vía biliar distal infranqueable. Se practicaron colecistectomía, coledocoduodenostomía paliativa y punciones con aguja fina sobre la cabeza del páncreas, para obtener citología, que no reveló la existencia de células neoplásicas. La evolución postoperatoria fue favorable, con resolución de los síntomas, reducción del tamaño de la cabeza del páncreas y marcadores tumorales persistentemente en rango normal. Esta evolución clínica, incompatible con la de un cáncer pancreático, es la habitualmente descrita desde hace décadas como «seudotumor del páncreas» o «seudotumor de la cabeza pancreática»1-13. En los casos en los que se han efectuado biopsias de la papila duodenal, de páncreas por punción o resección del órgano (operación de Whipple), se han encontrado en el análisis histopatológico fibrosis densa e infiltrado inflamatorio a expensas de linfocitos T (a veces constituyendo folículos linfoides) y células plasmáticas IgG4 (+). También se ha observado flebitis obliterativa en venas mayores o menores1,3,8,9,13-16. A esta patología se la ha denominado en la bibliografía médica con distintos nombres como pancreatitis esclerosante, esclerosis inflamatoria primaria del páncreas, pancreatitis autoinmune esclerosante, pancreatitis crónica destructiva de los ductos, pancreatitis destructiva no alcohólica y pancreatocolangitis esclerosante17. En 1995, Yoshida18 propuso el nombre de pancreatitis autoinmune (PAI), por su frecuente asociación con otras patologías autoinmunes o a autoanticuerpos, término que ha sido incorporado universalmente. La Sociedad Japonesa del Páncreas el año 2002 estableció tres criterios para el diagnóstico de la PAI: 1) crecimiento localizado o difuso del páncreas con estrechamiento segmentario o difuso del conducto pancreático principal; 2) niveles elevados de IgG, IgG4 o presencia de autoanticuerpos (p. ej., ANA, FR, ANCA, antilactoferrina y antianhidrasa carbónica II), y 3) fibrosis e inflamación linfoplasmocitaria en la biopsia pancreática. El diagnóstico se realiza con los tres criterios o con el primer criterio más el segundo o el tercero3,19. Los coreanos agregaron dos criterios adicionales: 4) respuesta clínica a los corticoides, y 5) presencia de lesiones extrapancreáticas3. En los EE.UU. se ha utilizado una clasificación propuesta por la Clínica Mayo, en que al menos debe presentarse uno de estos tres criterios: 1) histopatología característica; 2) imágenes características en la tomografía computarida y la pancreatografía asociadas con niveles séricos elevados de IgG4, y 3) respuesta a la terapia esteroidea de las manifestaciones pancreáticas/extrapancreáticas de la PAI20.
El patrón HLA DRB1*0405-DQB1*0401 a menudo se observa en pacientes con PAI2 y sirve para diferenciarla del cáncer pancreático, del cual muchas veces es difícil diferenciarlo. La PAI es responsable del 23,4% de las resecciones de Whipple practicadas en enfermedades benignas17. Esta rara patología se presenta mayoritariamente en hombres de edad media o en ancianos, como en este paciente3,21. Se requiere la realización de una biopsia pancreática para establecer el diagnóstico de certeza, aunque éste también se lleva a cabo frente a la elevación de los niveles de IgG4, los hallazgos radiológicos característicos y la respuesta a los corticoides. En este caso, si bien no se efectuó una biopsia pancreática ni determinación de autoanticuerpos o IgG o IgG4, ya que se presumió que el paciente tenía un cáncer de la cabeza del páncreas con metástasis ganglionares, es probable por los hallazgos operatorios y su evolución clínica que se haya tratado de una PAI. Los hallazgos de fibrosis en la pared de la vesícula y el conducto cístico como el engrosamiento marcado de las paredes del colédoco y el paso infranqueable hacia el lumen distal han sido descritos frecuentemente en esta afección3. Los corticoides son la terapia de elección en la PAI dada su gran eficiencia en el control de la enfermedad5, si bien en la mayoría de los casos publicados se han efectuado exploraciones quirúrgicas y procedimientos de drenaje de la vía biliar, por la sospecha de un carcinoma pancreático6. En los casos refractarios o para ahorrar esteroides se han utilizado otros fármacos como azatioprina, metotrexato, rituximab y ácido ursodeoxicólico21-24. La resolución espontánea o después de la cirugía del aumento de volumen pancreático con normalización de las imágenes radiológicas también ha sido descrita, como ocurrió con este paciente. La aparición metacrónica de una lesión extrapancreática, como la FRP, 19 meses después del diagnóstico del seudotumor de la cabeza del páncreas apoya fuertemente el diagnóstico de una PAI en este paciente. Hasta 2008 se habían descrito en la bibliografía 14 casos de la asociación de ambas patologías17. En algunos casos ambos trastornos se han presentado simultáneamente2,6-9,16,19,25 y en otros en forma metacrónica con intervalos de meses o años. La PAI puede preceder a la FRP5,14,15,21 o presentarse posteriormente1,5,10-12. También puede presentase asociada con otras enfermedades fibroescleróticas como tiroiditis de Riedel, seudotumor de órbita, colangitis esclerosante, síndrome de Sjögren, fibroesclerosis multifocal y fibrosis de glándulas salivales, pulmón, vesícula y próstata1,3,6,15,19. Por la presencia común en estas patologías de infiltrado inflamatorio con células plasmáticas IgG4 (+) y la buena respuesta a los corticoides, se ha propuesto una nueva entidad clínico-patológica llamada enfermedad esclerosante relacionada con IgG4 o enfermedad por hiper-IgG43,27. Las enfermedades relacionadas con elevación de IgG4 son escasas (dermatitis atópica, asma bronquial, algunas enfermedades parasitarias, pénfigo vulgar y foliáceo) y se acompañan a menudo de elevación de inmunoglobulina E, lo que no ocurre en la PAI17,28.
La FRP es un trastorno caracterizado por la presencia de un tejido fibroinflamatorio en el retroperitoneo, característicamente alrededor de la aorta y que puede comprimir a los vasos sanguíneos y/o a los uréteres originando insuficiencia venosa, déficit arterial o más frecuentemente, insuficiencia renal por obstrucción ureteral. Dos tercios de los casos son idiopáticos y el resto se ha asociado con infecciones, traumatismos, cáncer, exposición a asbesto, radioterapia, quimioterapia y a algunos fármacos4. En este paciente no existía ninguno de estos factores asociados. Si bien, no se efectuó una biopsia del tejido retroperitoneal (el paciente no la aceptó), las imágenes radiológicas fueron características del trastorno y su asociación con el seudotumor pancreático hicieron altamente probable la presencia de una FRP idiopática. La histopatología de la FRP es muy semejante a la encontrada en la PAI, incluyendo la infiltración por células plasmáticas positivas para IgG4, por lo que se ha planteado una patogenia común3,6,17. Asimismo, la FRP se asocia con frecuencia con enfermedades autoinmunes y fibroesclerosantes4.
Si bien no existe una terapia universalmente aceptada para la FRP, se han utilizado con éxito los corticoides, inmunosupresores (ciclofosfamida, azatioprina, metotrexato, ciclosporina y micofenolato), tamoxifeno y fármcos antifibróticos y antiinflamatorios como la colchicina4,29,30. La asociación de corticoides y colchicina no sólo ha logrado la remisión de los síntomas y la reducción del tejido retroperitoneal o su desaparición sino que también ha evitado las recurrencias29. En un paciente con fiebre mediterránea asociada a FRP el uso de colchicina sin corticoides logró la desaparición del tejido retroperitoneal31. En este paciente la asociación de corticoides y colchicina logró la remisión de los síntomas dentro del primer mes de tratamiento, la normalización de los parámetros inflamatorios en los exámenes de laboratorio y la reducción del volumen del tejido retroperitoneal con desaparición de la hidronefrosis durante el primer año de tratamiento.
En una serie que incluyó a 42 pacientes con PAI con períodos de observación hasta de 7 años, se observó que 70% de los sujetos que no recibieron corticoides para el tratamiento de la PAI presentaron posteriormente colangitis esclerosante, estenosis de la vía biliar distal o FRP; en cambio, en los que recibieron corticoides sólo el 32% presentó alguno de estos trastornos. Los autores recomendaron que los pacientes que presenten ictericia obstructiva y estrechez de los conductos biliares, como este paciente, deberían ser tratados con esteroides y durante un tiempo prologado32.
En resumen, se comunica el caso muy infrecuente de un paciente con un seudotumor de la cabeza del páncreas, probablemente originado en una PAI asociado con FRP, de aparición metacrónica, en el que la FRP fue tratada con éxito mediante la asociación de esteroides y colchicina desapareciendo la hidronefrosis y reduciéndose significativamente el tamaño de la masa retroperitoneal.
Figura 1. Tomografía computarizada con contraste intravenoso relaizada en julio de 2008.
Figura 2. Control evolutivo de la fibrosis retroperitoneal con tomografía computarizada.