Han ocurrido numerosos avances en las técnicas de hemodiálisis en las últimas décadas que nos han permitido mejorar el manejo de la hipotensión intradiálisis. A pesar de ello, este fenómeno es frecuente (10 a 30 % de las sesiones) y se asocia a una elevada morbimortalidad de los pacientes y múltiples complicaciones. No existen guías ni tratamientos sistemáticos para tratar esta complicación y se utilizan diferentes maniobras para controlarla. Este artículo revisa las estrategias existentes para su manejo.
INTRODUCCIÓN
La hipotensión intradiálisis es un problema frecuente que ocurre en un 10-30 % de las sesiones y se asocia a un aumento de la morbimortalidad. Registros recientes de Estados Unidos y Reino Unido indican una incidencia de hipotensión sintomática en diálisis de entre el 20-60 %1-3.
Tiene tres componentes esenciales: una caída mayor de 20 mmHg de la tensión arterial sistólica (TAS) o de más de 10 mmHg de la tensión arterial media (TAM), la presencia de síntomas por isquemia de diferentes órganos e intervenciones por parte del personal de diálisis4.
En su patogenia existiría un desequilibrio entre la hipovolemia y las respuestas hemodinámicas a esta. Estas últimas consistirían en aumentar la resistencia vascular periférica en los lechos esplácnico y de la piel, y en aumentar la frecuencia y contractilidad cardíaca. A su vez, la disminución del retorno venoso es el factor más importante que impide al cuerpo mantener el gasto cardíaco adecuado en caso de hipovolemia5.
Existe una población de pacientes en diálisis con mayor dificultad para compensar la ultrafiltración, conformada por aquellos que tienen una disfunción autonómica o de los barrorreceptores (diabéticos, ancianos o la misma uremia) o alteraciones en la funcionalidad cardíaca (hipertrofia ventricular izquierda, enfermedad isquémica)4,6.
El otro mecanismo implicado es inherente al movimiento de fluidos desde el espacio intersticial al vascular, que ocurre cuando ultrafiltramos a los pacientes. El grado de relleno vascular va a depender del tamaño del espacio intersticial: en los casos de excesivas ganancias de peso entre las sesiones, la tasa de ultrafiltración necesaria puede exceder la capacidad del relleno plasmático desde el espacio intersticial5.
La hipoperfusión de los diferentes órganos lleva a la aparición de síntomas y complicaciones (tabla 1)1,5.
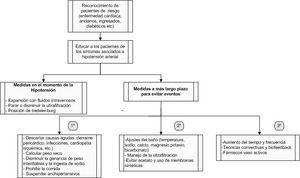
Elaboramos, basándonos en la literatura existente y en nuestra experiencia, una secuencia de actuaciones que se han de seguir en casos de hipotensiones sintomáticas (figura 1)1,5,7.
DETERMINACIÓN DEL PESO SECO
El primer paso para lograr un adecuado control de la volemia en estos pacientes es el cálculo del peso seco adecuado7.
El balance de agua se valora en función del peso corporal del paciente. Se supone que el peso ganado entre dos sesiones de hemodiálisis corresponde a un aumento del agua corporal y no varía en función de la masa muscular y/o adiposa. Estos últimos cambios suelen ser lentos y adquirir importancia al cabo de varios días. La pérdida de peso durante las sesiones se programa de acuerdo a la ganancia de agua y se realiza mediante convección8.
El ajuste de peso seco debe hacerse en cada sesión de diálisis o al menos semanalmente y tener en cuenta diferentes factores: ingesta y sed del paciente, hipotensiones e hipertensiones, entre otros8.
Una adecuada estimación del peso seco en las personas en hemodiálisis resulta de gran importancia. En la gran mayoría de las unidades de diálisis su determinación es clínica, valorando la presencia de edemas, cefalea, hipertensión arterial e hipotensión arterial9.
En un estudio se demostró que pequeñas reducciones del peso seco (1 kg) en pacientes hipertensos en hemodiálisis producían disminuciones de la TAS y la tensión arterial diastólica (TAD) de 6,6 y 3,3 mmHg, por lo que el ajuste del peso seco debe realizarse de forma cautelosa para evitar los efectos indeseables de la hipotensión10.
Los edemas son habitualmente considerados como un signo de sobrecarga de volumen en pacientes dializados. Recientemente Agarwal et al. estudiaron a 150 pacientes de hemodiálisis de cuatro centros diferentes. La volemia se calculó por diferentes métodos (ecocardiografía, medición del diámetro de la vena cava inferior, monitores de volumen y marcadores bioquímicos). Encontraron que los edemas, a pesar de relacionarse con la edad, la masa ventricular izquierda y el índice de masa corporal, no lo hacían con marcadores del volumen intravascular11.
También de forma reciente se demostró que la presencia de hipertensión sería un pobre predictor de sobrecarga de volumen. Wabel et al., en un estudio de 500 pacientes en hemodiálisis de ocho centros, midieron las tensiones arteriales previas a las sesiones y el estado de hidratación utilizando la bioimpedancia (BIA) multifrecuencia. Encontraron que el 13 % de los pacientes hipertensos no estaban hipervolémicos y que el 10 % estaban hipervolémicos pero sin hipertensión. Esto demuestra que la hipertensión arterial no siempre implica estar hipervolémico y que el paciente hipervolémico no necesariamente está hipertenso12.
Por todo lo anteriormente explicado y aunque de manera habitual el cálculo del peso seco se hace en base a parámetros clínicos, existen mejores herramientas para determinar el estado de la volemia de estos pacientes. Entre ellos, cabe mencionar:
- Determinación de la presión venosa central y de la presión de la arteria pulmonar: da una idea bastante aproximada de la volemia, pero desde el punto de vista práctico es de poca utilidad en los pacientes en diálisis, dado el tipo de técnica empleada, ya que no está disponible en todas las unidades y necesita formación e instrumentación adecuada8,9.
- Marcadores bioquímicos: péptido natriurético atrial y el 3,5 guanosín monofosfato cíclico. Ambos son solo de cierta utilidad en situaciones de sobrecarga de volumen, y de poca en pacientes normohidratados o deplecionados. Son costosos y se determinan por radioinmunoensayo, por lo que lleva cierto tiempo saber su resultado8,9.
- Diámetro anteroposterior de la vena cava inferior medido por ecografía, a la altura del segmento hepático: es un procedimiento simple, rápido y no invasivo. Da una buena idea del volumen intravascular, pero presenta ciertas limitaciones: variaciones importantes que se producen las dos primeras horas posteriores a la diálisis y dificultad de interpretación en pacientes con insuficiencia cardíaca, insuficiencia tricúspide y obesos8,9.
- BIA: muchos autores han revisado las aplicaciones de la BIA para el manejo de los fluidos; esta permite obtener información del agua corporal total y del volumen extracelular (VEC), y calcular de forma indirecta el volumen intracelular13,14. El modelo BCM ha sido validado en múltiples estudios multicéntricos, comparándolo con los métodos patrón de oro en pacientes tanto sanos como en hemodiálisis, demostrándose que la BIA es tan precisa como los otros métodos estándar para calcular el estado de normohidratación de estos pacientes15.
- Monitores de volemia: los cambios de la volemia se calcularían en base a cambios del hematocrito a lo largo de la sesión de diálisis5. Permitiría valorar los movimientos de fluidos que se producen durante las sesiones13,16. Se utilizaría como una herramienta para prevenir episodios de hipotensión, basándose en el concepto de que estos eventos ocurrirían con reducciones similares del volumen plasmático. Sin embargo, la mayoría de los estudios no han encontrado relación entre los cambios individuales de la volemia y los eventos de hipotensión17,18.
- Métodos isotópicos (deuterio para el agua y el sodio 23): es el procedimiento más exacto para medir el VEC, pero muy complejo. Además, hay estudios que demuestran una alta correlación entre los hallazgos con esta técnica y los de la BIA, por lo que actualmente el uso simultáneo de BIA y valoración clínica es el más adecuado para valorar el peso seco8,9.
DISMINUCIÓN DE LA GANACIA DE PESO ENTRE SESIONES Y RESTRICCIÓN DE LA INGESTA DE SAL
Las intervenciones para reducir la ganancia de peso entre sesiones y así lograr disminuir las tasas de ultrafiltración son difíciles de conseguir, ya que dependen del comportamiento de los pacientes, que estaría influido por factores culturales y psicológicos1.
Un error frecuente es pensar que se pueden conseguir reducciones de la ganancia de peso interdiálisis solo restringiendo la ingesta de fluidos. El principal determinante del volumen del fluido extracelular es el sodio y la ingesta de este último y pequeños aumentos de su concentración aumentarían la sed y, en consecuencia, la ingesta hídrica, por lo que se debería insistir en la restricción del sodio en la dieta y no solo de los líquidos19,20.
Existen evidencias de que los centros que insisten en la reducción de la ingesta de sal en la dieta tienen pacientes con menor ganancia de peso entre sesiones, menores masas ventriculares, menos episodios de hipotensión y utilizan menos medicación antihipertensiva, a pesar de tener cifras tensionales parecidas21.
Además de la restricción del sodio en la dieta, el sodio del dializado debe ser isonátremico al del plasma para evitar la sobrecarga de sodio durante la diálisis22.
PROHIBICIÓN DE LA COMIDA
A pesar de que los efectos hipotensores de la ingesta de comida en diálisis han sido documentados, los mecanismos hemodinámicos no están aclarados23.
La hipotensión asociada a la ingesta podría ser el resultado de la disminución de las resistencias vasculares periféricas y el aumento del flujo plasmático a la circulación esplácnica y hepática (con secuestro de sangre en el lecho esplénico), lo que llevaría a un reducción del relleno y gasto cardíaco. Por otro lado, la respuesta de los barroreceptores se perjudica tras ingerir glucosa24-26.
Esto ocurriría principalmente en pacientes con disfunción autonómica y en los ancianos27-30.
Sherman et al. demostraron en un estudio prospectivo controlado con 125 pacientes en hemodiálisis que la TAM descendía 14,4 mmHg/hora, 45 minutos después de dar una comida, que se administraba 1,5 y 2 horas tras iniciar la sesión de diálisis. Estos resultados fueron posteriormente confirmados por Zocatelli et al.24,25.
Estudios posteriores no pudieron confirmar la asociación entre la ingesta en diálisis y la hipotensión, si bien estos fueron con un número reducido de pacientes o con distintos tipos de limitaciones31,32.
Se necesitarían más estudios con mayor número de pacientes, prospectivos, para establecer la asociación entre la ingesta en diálisis y la hipotensión, las consecuencias a largo plazo de comer en las sesiones y finalmente para poder establecer recomendaciones al respecto32.
SUSPENSIÓN DE FÁRMACOS ANTIHIPERTENSIVOS
Aunque no existen estudios controlados al respecto, muchos nefrólogos suspenden la medicación antihipertensiva antes de la diálisis para prevenir los episodios de hipotensión1.
Hay que considerar que muchos fármacos antihipertensivos, incluidos los vasodilatadores y los nitritos, pueden disminuir las resistencias vasculares periféricas y empeorar el gasto cardíaco1.
No todos ellos interfieren en igual grado con los mecánicos defensivos del organismo frente a la hipotensión. El uso de alfa metildopa se asocia al doble de incidencia de hipotensión que el de la clonidina o los betabloqueantes, a pesar de un control similar de la hipertensión33.
Los betabloqueantes y los antagonistas cálcicos no dihidropiridínicos se asociarían a una reducción de eventos de hipotensión en pacientes con hipertrofia ventricular izquierda y disfunción diastólica5,34.
Aunque parece lógico disminuir la dosis o incluso retirar la medicación antihipertensiva, existe poca evidencia de qué hacer al respecto.
DIÁLISIS FRÍA
Una de las maniobras más simples para reducir los episodios de hipotensión en hemodiálisis es bajar la temperatura del baño. Esto fue descrito por primera vez por Maggiore et al. en 1980 y es válido tanto para la hemodiálisis como para la ultrafiltración aislada y on-line35,36.
La mejoría en la estabilidad cardiovascular durante la diálisis fría se basa en: mayor liberación de catecolaminas, aumento de las resistencias vasculares periféricas y del tono venoso, y aumento de la sensibilidad de los barroreceptores. Además, los niveles de óxido nítrico estarían aumentados en la diálisis estándar, pero no durante la hemodiálisis fría37-41.
Se beneficiarían de esta técnica los pacientes hemodinámicamente inestables y aquellos con comorbilidades. Fine et al. encontraron que el beneficio de la diálisis fría se limitaría al grupo de pacientes que presentan temperaturas corporales prediálisis < 36º (hipotérmicos), no encontrando beneficios en aquellos con temperaturas prediálisis42-44 > 36,5º.
Nicholas M. Selby et al. realizan una revisión de la literatura donde evalúan el efecto de la diálisis fría en la tensión arterial intradiálisis, la aparición de signos de hipotermia y si interfería en la eficacia dialítica. Abarcaron 22 estudios con un total de 408 pacientes. Dieciséis estudios (235 pacientes) incluían reducciones empíricas de la temperatura y 6 utilizaron BTM (173 pacientes). La duración de los estudios fue en todos ellos relativamente corta (entre 2 y 24 sesiones). Ninguno analizó la mortalidad. Encontraron que los episodios de hipotensión intradiálisis juntando todos los estudios ocurrían 7,1 (intervalo de confianza al 95 %: 5,3-8,9) veces más con la diálisis estándar que con la fría (para el grupo de los de reducción empírica fue 9,5 veces menor con diálisis fría y para los de BTM 2 veces menor que los controles). La TAM posdiálisis era 11,3 mmHg mayor con diálisis fría. La frecuencia y la severidad de los efectos debidos a los cambios de temperatura no fueron bien recogidas. En ninguno de los estudios encontraron diferencias entre ambas ramas con respecto a la adecuación (KT/V o porcentaje de reducción de urea)45.
Heng-Jung et al., en un estudio retrospectivo de pacientes en una unidad de diálisis desde 1993 a 2007 (910 pacientes), estudiaron la mortalidad total, la cardíaca y la de causa no cardiológica en dos grupos de pacientes: uno con temperatura del baño menor de 35,5º y otro estándar con temperatura entre 35,5º y 37º. Encontraron que la diálisis fría estaba asociada a una menor mortalidad global y de causa cardíaca, pero no a la de causa no cardíaca ni infecciosa46.
Diferentes estudios reflejan los beneficios hemodinámicos de la diálisis con temperatura baja47-50.
Ya en 1997 las guías KDOQI (Kidney Disease Outcomes Quality Initiative) recomendaban reducir la temperatura del baño para prevenir la hipotensión intradiálisis51.
No se demostró que otras maniobras para reducir la hipotensión en hemodiálisis fuesen mejores: ni la midodrina (agonista alfa), ni el uso de altas concentraciones de sodio en el dializado, ni los perfiles de sodio. No hemos encontrado en la literatura estudios que comparen los perfiles de sodio y ultrafiltración con la diálisis isotérmica52,53.
Tampoco los métodos convectivos parecen ofrecer un mejor perfil hemodinámico, comparados con la diálisis fría o isotérmica, ni la ultrafiltración aislada, ni la hemofiltración, ni la hemodiálisis estándar o la on-line. Sin embargo, la mayoría de estos estudios fueron de corta duración y con pacientes estables, por lo que es necesario realizar otros de más larga duración y con pacientes inestables54-58. La modalidad de reinfusión podría jugar algún papel: Beerenhout et al. encontraron diferencias entre la forma pre y posdilucional en cuanto a los efectos sobre la temperatura59.
Abdelbasit Ayuob et al., además de comprobar que la diálisis fría mejora la estabilidad hemodinámica de los pacientes sin producir cambios ni en el KT/V ni en el PRU, midieron mediante un cuestionario que los pacientes se sentían con más energía durante y tras las sesiones y que tenía un impacto positivo en las actividades de su vida diaria60.
SODIO DEL BAÑO, PERFILES DE SODIO Y ULTRAFILTRACIÓN
El balance de sodio está ligado al balance de agua, resulta tanto de su ingreso como de su eliminación, y es primordial para mantener la estabilidad cardiovascular y el control de la tensión arterial entre las sesiones de diálisis. En una hemodiálisis convencional, más del 80 % del sodio removido resulta de convección y solo un 15-20 % de difusión22,61.
Es posible cambiar la concentración de sodio del dializado para conseguir una diálisis iso, hiper o hiponatrémica. El objetivo sería perder con la diálisis la misma cantidad de sodio acumulado entre las sesiones, para obtener un balance cero. Esto se podría conseguir individualizando el concentrado de sodio del dializado en cada sesión, estrategia difícil de aplicar a la práctica diaria, ya que se precisaría saber la concentración plasmática de sodio previa a cada sesión. En consecuencia, la medida adoptada con mayor frecuencia sigue siendo la diálisis hipernatrémica62.
El aumento de la concentración de sodio en el líquido de diálisis favorece la difusión de sodio hacia el espacio intravascular, el aumento de la osmolaridad y el desplazamiento de agua desde el intersticio hacia el lecho vascular. Este mayor volumen mejora la tolerancia y permite una mayor ultrafiltración. El riesgo es la acumulación de sodio, que lleva a mayor sed, mayor ingesta, aumento del VEC y mayor incidencia de hipertensión61.
En cuanto a los perfiles de sodio, deberían sincronizarse con los de ultrafiltración, de modo que esta sea mayor con altas concentraciones de sodio en el baño. La combinación de ambas maniobras parece ser más efectiva en reducir la hipotensión que cada una de ellas por separado. A pesar de que los perfiles disminuyen la incidencia de eventos de hipotensión sintomática, frecuentemente resultan en balances positivos de sodio, que llevan a un aumento de la sed, de la ganancia de peso entre las sesiones e hipertensión arterial. Las guías KDOQI recomiendan no usar los perfiles de sodio22,63-65.
De Paula et al., en un estudio cruzado, doble ciego, con 27 pacientes no diabéticos y sin hipotensión ortostática, a los que se dializó durante 9 sesiones con concentración de sodio del baño de 138 mEq/lt, seguidas de otras 9 donde la concentración de sodio se pautaba según el promedio del sodio plasmático de los pacientes antes de las sesiones de diálisis («sodio del dializado individualizado»), concluyeron que la concentración de sodio en el baño individualizada en base a las concentraciones prediálisis plasmáticas de este disminuía la sed, la ganancia de peso entre las sesiones y los episodios de hipotensión66.
Yi Lun Zhou et al., a 8 pacientes estables en hemodiálisis, les realizaron cuatro tipos de tratamiento diferentes: concentración de sodio del dializado de 138 mmol/lt y ultrafiltración constante, perfil decreciente de sodio (148-131 mmol/l) con ultrafiltración constante, perfil decreciente de ultrafiltración con sodio fijo a 138 mmol/l, y finalmente perfil de sodio + perfil de ultrafiltración, aplicados durante 10 sesiones. Los autores observaron que con la combinación de ambos perfiles se obtenía mayor estabilidad intradiálisis del volumen plasmático, tensión arterial, gasto cardíaco y que el número de eventos de hipotensión se redujo de forma significativa67.
Se ha analizado el efecto del perfil descendente de ultrafiltración, con diversos resultados. Pero existen pocos estudios que combinen ambos perfiles (ultrafiltración y sodio), con una pérdida total de sodio igual a la hemodiálisis estándar, y sus resultados son aún debatidos64,67-71.
También se puede modificar la conductividad del líquido de diálisis de forma que la conductividad final sea igual a la inicial. La conductividad es fundamental para el ajuste del balance de sodio y la tolerancia a la técnica, teniendo en cuenta que los electrodos que la miden se pueden desajustar, por lo que deben reajustarse mensualmente8.
Además, las normas vigentes permiten una variabilidad del 2,5 % en la composición de los concentrados de diálisis, que es inadmisible para el sodio, pues sería una variación en su concentración de 136,5 a 143,5 mEq/l8.
Se han hecho diferentes estudios utilizando perfiles de sodio y con diversos resultados, y en muchos de ellos no había información suficiente para saber la remoción total de sodio ni el método utilizado para determinar su concentración. Se precisan trabajos con mayor número de pacientes y a largo plazo para ver el efecto de los perfiles de sodio64,69,72,73.
OTROS ELECTROLITOS
Calcio
El efecto de la concentración de calcio del baño sobre la tensión arterial estaría principalmente mediado por cambios en la contractilidad miocárdica y en la reactividad vascular61.
Muchos estudios realizados en pacientes en hemodiálisis han demostrado que cambios en el calcio iónico sérico tienen importantes efectos hemodinámicos74-78.
En un estudio prospectivo, doble ciego y aleatorizado, de 20 pacientes de hemodiálisis que fueron dializados alternativamente con concentraciones de calcio del baño de 2,5 y 3,5, se halló que a la hora y media de la sesión las TAS, TAD y TAM fueron 6, 3,6 y 4,6 mmHg más altas para el grupo de calcio de 3,5 mEq/lt del dializado, respecto al de 2,5 mEq/lt. Sin embargo, en un subgrupo de pacientes con hipotensión ortóstatica, las variaciones en la TAM fueron menores y la frecuencia de eventos de hipotensión no se redujo de forma significativa79.
En otro estudio realizado en pacientes con compromiso cardíaco se demostró que la TAS disminuía de forma estadística y clínicamente significativa cuando se utilizaba ultrafiltración más hemodiálisis con bajas concentraciones de calcio. Al contrario, usando altas concentraciones de este en el mismo grupo de pacientes, la TAM se mantenía estable80.
Por lo tanto, debido a los potenciales efectos adversos de un balance positivo de calcio y a que el uso de altas concentraciones de este en el baño podría tener una mayor significación clínica en pacientes con insuficiencia cardíaca congestiva (baja fracción de eyección), solo estaría indicado en pacientes añosos, con hipotensión intratable y corta expectativa de vida81.
Magnesio
El magnesio mantiene la estabilidad eléctrica miocárdica en pacientes en diálisis82.
En un trabajo con 58 pacientes se midió el magnesio al inicio, a las dos horas y al final de las sesiones. Encontraron lo siguiente: la concentración de magnesio bajaba significativamente durante las sesiones y los episodios de hipotensión se relacionaban con niveles plasmáticos más bajos de magnesio83.
Otros trabajos demuestran que mayores niveles de magnesio en la solución de diálisis podrían prevenir episodios de hipotensión arterial con mejoría de la tolerancia82-84.
Potasio
Hay muchas razones para creer que su concentración en el dializado influiría en la tensión arterial. La hipokalemia podría exacerbar la disfunción autonómica y alterar el inotropismo cardíaco. Además, la pérdida de potasio durante la diálisis se acompaña de reducción de los niveles de sodio por pérdida del mismo61,81,85,86.
Las concentraciones bajas de potasio en el dializado se asociarán con mayor frecuencia a episodios de hipotensión en estudios epidemiológicos y a episodios de hipertensión de rebote posdiálisis87-89.
A pesar de estas conjeturas, no hay evidencia directa de que la concentración de potasio en el dializado tenga un impacto en la frecuencia de hipotensiones85.
Bicarbonato
La baja concentración en el baño (30 mEq/l) se asociaría a tensiones arteriales intradiálisis más altas. Esto probablemente se debería a las mayores concentraciones de calcio iónico que se observan en los pacientes tratados con concentraciones más bajas de bicarbonato76,81.
TIPO DE LÍQUIDO DE DIÁLISIS Y DIALIZADORES
El uso de acetato en el líquido de diálisis se ha relacionado con vasodilatación esplácnica90 y disminución de la contractilidad miocárdica, alterándose la reserva contráctil91. También incrementaría los productos de la adenosina, lo que favorecería la hipotensión al inhibir la liberación de norepinefrina92,93. Con el uso de bicarbonato como buffer ha disminuido la incidencia de esta complicación94.
Shinzato et al. pretrataron en un estudio cruzado a los pacientes que usaban acetato con cafeína (un bloqueante de la adenosina) y encontraron que los tratados tenían menores descensos en la tensión arterial durante la diálisis. Este estudio no ha sido confirmado con otros similares posteriores95.
Se han asociado los episodios de hipotensión al uso de membranas sintéticas. Se atribuyó este hecho a la liberación por parte de monocitos activados por este tipo de membranas de diferentes citocinas: interleucinas 1 y 6, factor de necrosis tumoral. Varios estudios han valorado este fenómeno, pero ninguno ha confirmado este hecho, por lo que habría múltiples razones para utilizar dializadores biocompatibles, pero la hipotensión no sería una de ellas96-100.
AUMENTO DEL TIEMPO Y FRECUENCIA
Durante los últimos años se han publicado numerosos artículos que reflejan los beneficios hemodinámicos del aumento del tiempo y/o frecuencia de la diálisis101-106.
El estudio hecho por el grupo de FHN (Frequent Hemodialysis Network), que compara la diálisis convencional de tres veces a la semana con la diálisis consistente en seis sesiones a la semana de 1,5 a 2,75 horas de duración, encontró que en esta última modalidad se reducía la mortalidad, la masa ventricular izquierda, y como objetivo secundario demostró una mejoría en el control de las cifras de tensión arterial101. Este estudio confirma los datos de otro anterior realizado en Canadá105.
La hemodiálisis de larga duración propuesta por el grupo de Tassim permite obtener una ultrafiltración adecuada, con menor velocidad y mayor tiempo para el relleno plasmático desde el espacio intersticial, lo que da lugar a una menor incidencia de hipotensiones. A pesar de que esta técnica tiene múltiples ventajas, no se ha podido generalizar, principalmente por problemas estratégicos de las unidades de diálisis y mala tolerancia psíquica de los pacientes8.
En 1996, en un estudio aleatorizado y cruzado, se compararon los síntomas interdiálisis en 38 pacientes sometidos a sesiones de 5 horas y luego de 4 horas durante dos semanas en cada uno y se vio que en el esquema de 5 horas la incidencia de hipotensión y de hipotensión ortostática era menor107.
Otro estudio realizado por Lozano et al. utiliza tres esquemas de hemodiálisis: convencional de sesiones de 4 horas y 5 horas de duración en días alternos y sesiones de 4 horas sin descanso de fin de semana. El porcentaje de sesiones con hipotensión fue significativamente menor en el grupo sin descanso de fin de semana que en los otros dos108.
TÉCNICAS CONVECTIVAS Y MÓDULOS DE BIOFEEDBACK
Diferentes estudios demuestran los beneficios que añade la hemodiafiltración on-line (HDF OL) a las técnicas estrictamente difusivas, con mejor tolerancia durante las sesiones a expensas sobre todo de la estabilidad hemodinámica. Así, en el DOPPS (Dialysis Outcomes and Practice Patterns Study) 1 y 2 se observó disminución de la mortalidad en los pacientes en esta modalidad, reproduciéndose posteriormente en otros estudios tanto europeos como en el último publicado en nuestro país por el Dr. Maduell (ESHOL), en el que demuestra una disminución de la mortalidad cuanto mayor volumen de convección109-114.
En cuanto a la reducción de los episodios de hipotensión sintomática, se vio disminución de estos tanto con la HDF OL57,114,115 como con la hemofiltración on-line (HF OL) tanto predilucional como posdilucional116,117.
Locatelli es el primero en realizar un estudio multicéntrico, aleatorizado y controlado, comparando tres técnicas diferentes: hemodiálisis de bajo flujo, hemofiltración predilucional y hemodiafiltración predilucional. Concluye que existe una menor frecuencia de episodios de hipotensión sintomática en los dos grupos de terapia convectiva, siendo este efecto mayor en el grupo de hemodiafiltración, con episodios de hipertensión arterial sistólica prediálisis menos frecuentes que en el resto de las técnicas. Además, ratificó que el riesgo de presentar hipotensiones sintomáticas intradiálisis era mayor en los pacientes que presentaban la condición de diabéticos, ancianos, cardiopatía estructural, arteriopatía isquémica crónica, episodios previos de TIA y con valores altos de TAD prediálisis y, por supuesto, en todos aquellos que presentaban tasas de ultrafiltraciones elevadas (con un riesgo aumentado de un 14 % por cada dl/hora de la ultrafiltración)115.
Santoro revisa los principales mecanismos que influyen en la reactividad cardiovascular de las técnicas convectivas, así como el uso de membranas biocompatibles de alta permeabilidad, demostrando la ausencia de activación del sistema de complemento. Este tipo de membranas biocompatibles reduce la cantidad de sustancias vasodilatadoras y mejora la función simpática, por lo que se deduce que los dos aspectos más beneficiosos de su utilización serían menor balance negativo de sodio con discretos cambios en la temperatura corporal109,118.
La utilización de mecanismos reguladores de la volemia resulta de utilidad en el manejo del paciente en hemodiálisis. Para ello, existen determinados biosensores que monitorizan el volumen plasmático y, en función del porcentaje de su caída, se realizan las maniobras pertinentes para evitar episodios de hipotensión intradiálisis. Asimismo, se pueden utilizar perfiles de conductividad del sodio distintos a lo largo de la sesión adecuando la tasa de ultrafiltración, de tal manera que se ajuste la mayor conductividad en el momento que se tenga mayor tasa de ultrafiltración para intentar mejorar la tolerancia hemodiámica119,120.
TRATAMIENTO FARMACOLÓGICO
El fármaco ideal sería aquel que pueda modificar los factores fisiopatológicos asociados a la hipotensión intradiálisis. Sus principales blancos serían el sistema circulatorio (principalmente el volumen plasmático) y los vasos. Esta droga debería incrementar el volumen plasmático aumentando el relleno venoso y mantener unas resistencias vasculares adecuadas incrementando el tono arteriolar2.
La mayoría han sido poco o nada efectivos, mientras que unos pocos parecen prometedores2.
La epinefrina fue el primero en utilizarse, pero no se emplea en la actualidad debido a sus efectos adversos y su escasa eficacia2.
La fludrocortisona se ha usado de forma anecdótica en estos pacientes y no hay datos convincentes para su utilización2.
La cafeína es un antagonista de la adenosina, por lo que elevaría la tensión arterial inhibiendo su efecto vasodilatador. Shinzato et al. realizaron un estudio prospectivo con dos grupos: placebo y controles. Durante cuatro semanas se administró cafeína intradiálisis o placebo a dos grupos diferentes de pacientes, aquellos con hipotensión súbita y otros con hipotensión gradual, evaluando los efectos de la cafeína sobre la tensión arterial. Observaron que la cafeína era efectiva para las hipotensiones súbitas, pero no para las que ocurrían en forma gradual, y que la hipotensión de tipo súbito se precedía de un incremento agudo en los niveles plasmáticos de los metabolitos de la adenosina. Esto sugería que la adenosina mediaría los aumentos súbitos y no los graduales de la tensión arterial. Por lo tanto, parece ser que la cafeína sería efectiva en el subgrupo de pacientes con hipotensiones súbitas (que es la forma menos frecuente)121. Sin embargo, no se sabe si este tratamiento usado de forma crónica es efectivo y tolerado121.
La vasopresina (AVP) es una hormona endógena sintetizada en el hipotálamo y secretada por la hipófisis. Su secreción es estimulada por: la hiperosmolaridad, la hipotensión, la hipovolemia, las náuseas, los dolores y la hipoxia. Aumenta en el contexto de hipotensión en pacientes sépticos o con shock hipovolémico. En aquellos con insuficiencia autonómica, sus niveles son inapropiadamente bajos para el compromiso hemodinámico subyacente, por lo que se cree que existe una insuficiencia en la AVP que explicaría la hipotensión de estos pacientes122-124.
Aumenta la presión arterial en sujetos normales y en aquellos con hipotensión ortostática, por vía tanto intramuscular como intranasal. Entre sus efectos adversos destacan: infarto de miocardio, cefalea, calambres abdominales y musculares, acidez, episodios de taquifilaxis; y por vía intranasal en forma crónica: rinorrea, congestión y ulceración125,126.
El rol de la liberación insuficiente de AVP como causa de la hipotensión en pacientes con insuficiencia renal terminal fue estudiado en 1995 por Friees et al., que midieron los niveles de AVP, noradrenalina y adrenalina en 23 pacientes con hipotensiones recurrentes en diálisis durante episodios de hipotensión severos y sintomáticos. Aquellos sin náuseas mostraban ausencia o insuficiente estimulación de AVP, adrenalina y noradrenalina durante episodios agudos y severos de hipotensión, y al contrario, el grupo que tenía náuseas presentaba una importante estimulación de esta hormona. Esa deficiencia de la liberación de AVP reflejaría un defecto en las vías autonómicas aferentes (que podría ser por una alteración en los barroreceptores o en los nervios aferentes). Consideraron la posibilidad de la pérdida de AVP por el dializador, midiendo por RIA su concentración en el efluente de 11 pacientes antes y durante la hipotensión, pero no encontraron hormona en él. Hay diversas publicaciones respecto a este tema con diversos resultados127.
En el año 2007, Mira Roh et al. realizaron un estudio prospectivo observacional en 20 pacientes en hemodiálisis crónica, observando la tendencia de la AVP durante la ultrafiltración en pacientes con diagnóstico de hipotensión sintomática en diálisis y en aquellos que no la presentaban. Observaron, al igual que Friess, que las concentraciones de AVP no aumentaban en el grupo de los hipotensos, comparados con los controles, a pesar de los eventos de hipotensión124.
En noviembre de 2012, Seyed et al. publicaron un ensayo clínico doble ciego, comparando los efectos de la desmopresina intranasal (DDAVP) frente al agua destilada en 17 pacientes con hipotensión sintomática en diálisis. Los episodios de hipotensión ocurrieron en el 8,82 % de los pacientes con desmopresina frente al 61,27 % en el grupo placebo; a su vez, la TAM fue de 80,77 en el grupo con DDAVP frente a 73,92 en el grupo placebo, con P significativa. Se necesitarían más estudios con mayor número de pacientes para determinar el efecto de la desmopresina en la prevención de la hipotensión en diálisis128.
Ettema et al., en un estudio reciente, demuestran que con el sistema de hemocontrol mediante biofeedback los niveles iniciales de AVP eran superiores que con diálisis estándar. La mayor liberación de AVP con el sistema de biofeedback podría contribuir a la menor frecuencia de hipotensiones, facilitando la ultrafiltración durante la primera parte de la sesión, permitiendo bajar las tasas de ultrafiltración en la segunda parte129.
Aún se desconoce el motivo por el que no aumenta la AVP durante la diálisis estándar. Algunos grupos sugieren una disfunción autonómica, y otros sustentan que el aumento del óxido nítrico inducido por la hemodiálisis podría inhibir la liberación de AVP y finalmente la desmopresina podría eliminarse con la diálisis. Se necesitan más investigaciones para saber los mecanismos130-132.
La midodrina es una prodroga de acción alfa 1 adrenérgico que induce vasoconstricción (tanto arterial como venosa). El pico plasmático se alcanza una hora después de administrada y su vida media en hemodiálisis es de 3 horas, por lo que sus efectos no persisten en el período posdiálisis. Se suele administrar de 15 a 30 minutos antes de que empiece la sesión: 2,5-10 mg, y se puede dar una segunda dosis (menor que la primera) en la mitad de la sesión5.
Sua Prakash et al. realizaron una revisión de este fármaco y evaluaron 10 artículos (117 pacientes). La dosis de midodrina era entre 2,5 y 10 mg, administrándose 15-30 minutos antes de las sesiones. Observaron que tanto las TAS como las TAD eran más altas en el grupo con midodrina frente al control. Seis de estos 10 estudios mostraron mejoría en los síntomas relacionados con hipotensión, otro refiere no haber mejoría y los tres restantes no señalan nada al respecto. No se hizo referencia a efectos adversos secundarios severos con este fármaco. Esta revisión sugiere que la midodrina podría cumplir un papel en el tratamiento de la hipotensión en diálisis. No obstante, esta conclusión debería tomarse con cuidado debido a la calidad de los estudios y el número pequeño de pacientes133.
Este fármaco tendría el beneficio adicional de preservar el flujo cerebral en pacientes en hemodiálisis con hipotensión ortostática134.
L-carnitina: hay datos que sugieren que su déficit es relativamente frecuente en pacientes con enfermedad renal crónica terminal. Su déficit desempeñaría un papel importante en varias complicaciones de estos pacientes: fatiga, debilidad, calambres, exacerbación de la anemia, hipotensión y cardiomiopatía135.
Lynch et al. realizaron una revisión y metaanálisis de siete artículos: cuatro de ellos describen resultados favorables en hipotensión y calambres, uno solo en hipotensión, y dos solo en calambres. La limitación de esta revisión fue el escaso número de estudios disponibles y su heterogeneidad136.
No habría evidencia suficiente para el uso de L-carnitina, por lo que deberían realizarse estudios científicos más rigurosos137.
Sertralina: existen pocos estudios con este fármaco, con diferentes resultados138-140.
CONCLUSIONES
El número de pacientes con riesgo de hipotensión ha aumentado en los últimos tiempos debido a la población cada vez más longeva y con más comorbilidades que tenemos en nuestras unidades141.
Este fenómeno no debería tratarse como una condición benigna, ya que se asocia a una alta morbimortalidad y a múltiples y frecuentes complicaciones3.
Es primordial educar al personal de las unidades para reconocer a aquellos pacientes de riesgo: diabéticos (principalmente aquellos con neuropatía), cardiópatas (hipertrofia ventricular, disfunción diastólica, insuficiencia cardíaca congestiva, infartos de miocardio previos), aquellos con altas ganancias de peso interdiálisis, y los ingresados que presentan un riesgo adicional dependiendo de la causa del ingreso142.
Existen múltiples estrategias para controlar la hipotensión en hemodiálisis, basadas en corregir los mecanismos fisiopatológicos que intervienen en este fenómeno1,5.
Algunas se basan en corregir y/u optimizar ciertos parámetros de la técnica (ultrafiltración, composición del dializado, temperatura), otras en ajustar el peso seco, en intervenir farmacológicamente (basándose principalmente en mejorar la actividad simpática), y algunas son tan sencillas como evitar comer durante las sesiones o suspender la medicación antihipertensiva los días de diálisis1,5,7,17.
Cada caso se debe individualizar y siempre hay que descartar causas que no sean inherentes a la hemodiálisis, como: derrame pericárdico, infecciones, eventos de cardiopatía isquémica, etc.
Tal vez lo más prometedor en mejorar esta complicación tan frecuente sea el perfeccionamiento en las tecnologías capaces de ajustar temperatura, conductividad y ultrafiltración a lo largo de las sesiones, mejorando así la respuesta cardiovascular y el relleno vascular17.
La hipotensión intradiálisis es y continuará siendo un desafío para los nefrólogos, debido a la contracción y la expansión de volumen que presentan nuestros pacientes con tres sesiones semanales y la dificultad de muchos de ellos para restringir la ingesta de sodio y agua. Por esto nos resulta una opción atractiva, a pesar de sus limitaciones logísticas, la hemodiálisis diaria y poder ofrecer a más personas realizarla en su domicilio.
Deben hacerse más estudios para conocer y así mejorar el manejo de esta complicación.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Complicaciones asociadas a la hipotensión intradiálisis
Figura 1. Pasos que seguir en casos de hipotensiones sintomáticas