La infección por citomegalovirus (CMV) sigue siendo a día de hoy la causa principal de morbilidad viral en el receptor de injerto renal. Clásicamente, el período de mayor riesgo de infección era el comprendido entre el primero y el sexto mes postrasplante. No obstante, en la actualidad la infección puede desarrollarse en cualquier momento y presentarse de forma tardía. El uso generalizado de los inhibidores de las purinas ha condicionado un aumento de la prevalencia de la infección por CMV y un cambio en su presentación clínica, siendo la afectación actual más frecuente la digestiva. Dicha afectación suele ir acompañada de replicación viral en sangre, aunque existen casos en los que dicha premisa no se cumple. La alta incidencia de efectos adversos gastrointestinales de los inhibidores de las purinas obliga a descartar su toxicidad en casos de clínica digestiva en el receptor de trasplante renal. Presentamos 3 casos de enfermedad gastrointestinal por CMV con carga viral negativa en plasma determinada mediante reacción en cadena de la polimerasa-CMV en tiempo real, cuyo diagnóstico se realizó demostrando la presencia de CMV en las biopsias tomadas mediante colonoscopia. Estos casos señalan la indicación de dicha prueba para la obtención de muestras histológicas en pacientes trasplantados renales con clínica digestiva sin carga viral en plasma, una vez descartado el efecto tóxico de los inhibidores de las purinas.
INTRODUCCIÓN
El citomegalovirus (CMV) es un virus ADN de doble cadena que pertenece a la familia de los virus Herpesviridae, cuyas principales características son su ubicación latente en el huésped y su efecto citotóxico1. La infección por CMV sigue siendo a día de hoy la causa principal de morbilidad viral en el receptor de injerto renal2.
Las infecciones virales en los pacientes sometidos a trasplante de órgano sólido pueden tener una doble consecuencia: los efectos de la propia enfermedad infecciosa y el efecto inmunomodulador que contribuye a su vez al rechazo del injerto tanto agudo como crónico y a una mayor predisposición a sufrir otras infecciones oportunistas o neoplasias3.
La infección por CMV se define como la evidencia de replicación viral en pacientes asintomáticos, mientras que se considera enfermedad la presencia de síndrome viral con replicación de CMV en sangre o la enfermedad orgánica invasiva demostrando la presencia del virus en el órgano afecto4.
Durante los últimos años se han producido avances importantes en el manejo de esta infección. Desde el punto de vista diagnóstico, podemos detectar la presencia de replicación viral en sangre con distintas técnicas, como son la antigenemia y la carga viral, que han reemplazado métodos virológicos por cultivos con el fin de detectar y cuantificar la infección para predecir enfermedad y monitorizar el tratamiento antiviral5.
Actualmente, por un lado, con la finalidad de prevenir la enfermedad y, por otro, sus consecuencias, se han desarrollado estrategias eficaces de profilaxis universal y tratamiento anticipado6. Ambas parecen estar influyendo en el cambio evolutivo de dicha enfermedad, con aparición de nuevos problemas, como infecciones tardías por CMV o presentaciones clínicas inhabituales, lo que hace más difícil el diagnóstico por la menor prevalencia de dicha infección pasado el período de mayor riesgo7. La replicación viral se relaciona de forma directamente proporcional con la presencia de enfermedad8. Aun así, la ausencia de replicación viral en plasma podría no descartar el diagnóstico de enfermedad por CMV.
Como confirmación de este hecho, presentamos tres casos clínicos de enfermedad intestinal por CMV con carga viral negativa en plasma.
CASO 1
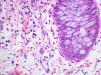
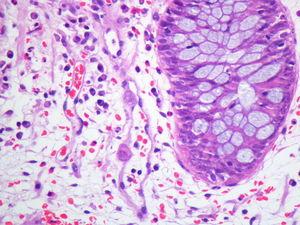
Varón de 60 años con hipertensión arterial esencial, valvuloplastia biológica aórtica y enfermedad renal crónica estadio V de etiología no filiada, en programa de hemodiálisis durante un año. Serología del virus de la hepatitis B (VHB), virus de la hepatitis C (VHC) y virus de la inmunodeficiencia humana (VIH) negativa. IgG CMV positiva. Recibió trasplante renal de donante cadáver. La inmunosupresión se efectuó con tacrolimus, micofenolato mofetilo y prednisona. El paciente presentó un curso clínico sin complicaciones y alcanzó función renal normal. Cuatro años después fue admitido en el hospital por un cuadro diarreico inespecífico no acompañado de otra sintomatología, con coprocultivo negativo, que se resolvió con tratamiento sintomático. Un año después ingresó por el mismo motivo y tras la suspensión de micofenolato mofetilo presentó mejoría clínica con resolución del cuadro, siendo remitido a consultas de digestivo de forma ambulatoria para estudio de diarrea crónica. A los tres meses del ingreso hospitalario se realizó colonoscopia con toma de biopsia, donde se observaron inclusiones citoplasmáticas y nucleares atribuibles a CMV (figura 1) con reacción en cadena de la polimerasa (PCR)-CMV 475 532 copias/ml. La PCR para CMV en plasma era negativa. Recibió tratamiento con ganciclovir intravenoso durante tres semanas. El paciente mantuvo función renal estable durante todo el proceso y permanece asintomático hasta el momento actual, diez meses después del diagnóstico.
CASO 2
Varón de 67 años con enfermedad renal crónica estadio V secundaria a nefroangioesclerosis, en programa de hemodiálisis durante dos años. Hipertensión arterial de larga evolución. Accidente cerebrovascular hemorrágico talámico sin secuelas neurológicas. Serología VHB, VHC y VIH negativa. IgG CMV positiva. Recibió trasplante renal de donante cadáver. La inmunosupresión se efectuó con tacrolimus, micofenolato mofetilo y prednisona, con mejoría progresiva de función renal y creatinina sérica al alta de 1 mg/dl. Cuatro años después consultó por deterioro del estado general y deposiciones líquidas sin productos patológicos de varios días de evolución. Presentaba episodios similares en los últimos meses. Tras observarse un deterioro de función renal, ingresó para estudio y reposición hídrica. Se disminuyó la dosis de micofenolato mofetilo y se solicitó carga viral CMV (PCR en tiempo real), que resultó negativa. Ante la persistencia de la sintomatología, se realizó colonoscopia con toma de biopsia rectal que mostró inclusiones citoplasmáticas y nucleares atribuibles a CMV con PCR-CMV 497 000 copias/ml, por lo que se inició tratamiento con ganciclovir intravenoso durante tres semanas, con desaparición de la clínica y recuperación de su función renal basal.
CASO 3
Mujer de 60 años de edad, con enfermedad renal crónica secundaria a nefritis tubulointersticial por ácido úrico, en programa de diálisis peritoneal continua ambulatoria durante dos años. Hipertensión arterial bien controlada. Hernia de hiato. Serología VHB, VHC y VIH negativa. IgG CMV positiva. Recibió trasplante renal de donante cadáver, iniciando inmunosupresión con tacrolimus, micofenolato mofetilo y prednisona, con mejoría progresiva de función renal y sin incidencias. Un mes después ingresó por cuadro de vómitos, dolor tipo cólico y diarrea sin fiebre ni productos patológicos, con coprocultivo negativo y carga viral PCR-CMV en tiempo real no detectable. El cuadro cedió con la retirada de micofenolato mofetilo. Al alta se reintrodujo en dosis de 250 mg cada 12 horas. Durante su seguimiento persistió la clínica descrita, por lo que se volvió a retirar el micofenolato mofetilo. Dada la recurrencia del cuadro, aun con PCR de CMV negativa en plasma de forma reiterada, se realizó biopsia de colon para descartar enfermedad intestinal invasiva por CMV. Tras confirmación ADN-CMV (89 980 copias/ml) en biopsia de colon y observándose inclusiones citoplasmáticas de CMV mediante inmunohistoquímica, se inició tratamiento intravenoso con ganciclovir durante tres semanas, remitiendo por completo la clínica referida.
DISCUSIÓN
En el trasplante renal, el paciente se ve expuesto a dosis máximas acumulativas de inmunosupresión durante los primeros seis meses de evolución, lo cual lo hace en este período susceptible a la aparición de infecciones por gérmenes oportunistas, entre los que destaca el CMV9. En la actualidad, la infección puede aparecer en cualquier momento de la evolución postrasplante10. Efectivamente, en dos de los tres casos que presentamos la enfermedad por CMV se desarrolló muy tardíamente, a los cuatro años postrasplante, período que en otro tiempo hubiera descartado de entrada el posible diagnóstico de enfermedad por CMV.
En el momento actual hemos asistido a un cambio en el comportamiento de la enfermedad. Previamente la neumonitis por CMV era una presentación habitual y constituía la causa más común de mortalidad en receptores de trasplante renal11. Actualmente la clínica digestiva cada vez es más frecuente, como es el caso de los tres pacientes que presentamos. La introducción prácticamente universal en los últimos años de los inhibidores de las purinas en la inmunosupresión del trasplante renal se ha asociado a un incremento en la prevalencia de infección por CMV en nuestros pacientes y a su afectación predominantemente digestiva12.
El virus puede afectar cualquier tramo del aparato digestivo en diferentes grados, pudiendo ocasionar desde una sintomatología leve hasta ulceraciones, cuadros hemorrágicos y perforaciones13. En consecuencia, ante todo paciente trasplantado que refiera síntomas digestivos, debería considerarse el diagnóstico de enfermedad por CMV, sea cual sea el momento de su evolución postrasplante. Así, Gutiérrez14 describe un caso de hemorragia digestiva alta con pancreatitis aguda y coagulopatía de consumo. Pérez-Valentín15 publicó otros dos casos con hemorragia digestiva severa como presentación de enfermedad por CMV, y también se ha descrito otro caso16 de perforación de vesícula biliar y pancreatitis aguda en el seno de una infección por CMV.
La confirmación de la sospecha clínica de infección por CMV viene dada por la presencia de replicación viral en sangre mediante la detección de carga viral o antigenemia17, pero su ausencia podría conducirnos a descartar el diagnóstico y, como consecuencia, no aplicar su tratamiento.
Por lo tanto, ante pacientes con clínica de afectación intestinal en los que la detección de CMV en plasma a través de PCR es negativa, nos planteamos si sería útil la realización de biopsias intestinales. Según nuestra experiencia en los casos 1 y 2, dicha intervención estuvo justificada y fruto de ella fue el diagnóstico precoz en el caso 3. Por otro lado, el estudio histológico de muestras intestinales en un paciente trasplantado con diarrea crónica puede conducir al diagnóstico de otras enfermedades con no menos morbilidad, aunque mucho menos comunes, como la infección por Cryptosporidium18.
Los criterios establecidos desde 2002 eran bastante estrictos y sostenían que, para diagnosticar la enfermedad, se necesitaría demostrar la presencia de CMV en tejido por aislamiento, tinción o inmunohistoquímica, lo que obligaría a realizar una biopsia a todos los pacientes con clínica digestiva y replicación viral en sangre4. Mattes publicó un estudio anatomo-patológico en el que demuestra que el 100 % de los pacientes con inclusiones citomegálicas tenía el ADN-CMV detectable en tejido, de manera que existe una correlación directa entre la carga viral y la presencia de inclusiones citomegálicas19. En los tres casos descritos los pacientes presentaban una alta carga viral en el tejido junto a inclusiones citoplasmáticas, por lo que nuestra experiencia confirma los datos de Mattes19.
Pérez-Valentín presenta dos casos de posible disociación entre la detección del virus en plasma y la presencia de este en el tracto digestivo. Los casos de Pérez-Valentín no son comparables a los nuestros, ya que la enfermedad por CMV se desarrolla de forma precoz, en uno de los casos con antigenemia positiva y en el otro con antigenemia negativa, pero con carga viral positiva15. Estos datos refuerzan la idea de una mayor sensibilidad de la carga viral sobre la antigenemia17,20,21. En nuestros enfermos hay que destacar que, utilizando el método más sensible en la detección de la carga viral, esta fue reiteradamente negativa, aun cuando nuestros pacientes presentaban una enfermedad por CMV.
Los casos 1 y 2 resultan especialmente atípicos, ya que desarrollan la enfermedad por CMV a los cuatro años del trasplante, no siendo en ninguno de ellos una primoinfección ni estando el cuadro en relación con un aumento de la inmunosupresión. Estos casos refuerzan la idea del cambio en la cronología de esta enfermedad, siendo precisa su sospecha en cualquier momento del postrasplante10. En el caso 3 el diagnóstico fue dificultado por la mejoría clínica de la paciente tras la retirada de micofenolato mofetilo, ya que su toxicidad digestiva entra en el diagnóstico diferencial de las alteraciones intestinales en el trasplante renal, dada la alta tasa de efectos secundarios sobre el tracto digestivo de este inmunosupresor22. Efectivamente, el descartar el efecto tóxico de los inhibidores de las purinas en el tracto digestivo debe ser siempre el primer paso en el estudio de alteraciones intestinales en el receptor de trasplante renal.
En nuestros casos, la confirmación del diagnóstico de sospecha se observó no solo por la demostración de la replicación viral en el órgano afectado, sino también por la resolución de la clínica en los tres pacientes una vez administrado el tratamiento.
En conclusión, estos casos demuestran la necesidad de obtener muestras histológicas intestinales en el receptor de trasplante renal con clínica digestiva, una vez descartada la posible toxicidad por inhibidores de las purinas, sea cual sea su tiempo de evolución postrasplante, aun con carga viral en plasma negativa, para descartar enfermedad por CMV, dada su alta rentabilidad diagnóstica.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Inclusiones citoplasmáticas por citomegalovirus en mucosa intestinal.
11954_19904_51996_es_11954_copy1.pdf
Edición versión impresa