El fósforo fue descubierto en 1669 por el alquimista alemán, nacido en Hamburgo, Henning Brandt. Ya desde su descubrimiento tuvo que ver con la Nefrología, puesto que se obtuvo a partir de grandes cantidades de orina, que tras descomponerse durante largo tiempo eran tratadas hasta obtener un producto blanco que en la oscuridad irradiaba luz. Por eso recibió un nombre tan hermoso « phos» «phorus», que en griego significa «portador de luz».
El fósforo está en la propia esencia de la vida; todos los organismos vivos dependen totalmente de los fosfatos. El material genético de la vida, ácido desoxirribonucleico (ADN) y ácido ribonucleico (ARN), consiste en moléculas de azúcar, unidas mediante unidades fosfato para formar la cadena en hélice. Por otro lado, la formación y la ruptura de los enlaces P-O sirven como almacén de energía en el trifosfato de adenosina (ATP). El fósforo activa y desactiva enzimas y proteínas mediante la pérdida o la ganancia de grupos fosfatos, con lo que controla parte de la actividad celular. Además de esta actividad funcional, el fósforo tiene un papel estructural, ya que forma parte de las membranas celulares que aíslan y protegen a las células y sus organelas; sin las membranas los compartimentos celulares o las propias células no existirían. Compone la estructura de nuestros huesos y dientes, y sin el fósforo, probablemente, nuestro aspecto sería diferente al que conocemos.
Sin embargo hasta un «portador de luz» tiene un lado oscuro. El fósforo causó la muerte de mujeres que trabajaban en fábricas de cerillas y aún hoy se usa en las guerras como arma química. Pero, además, el fósforo ingerido en gran cantidad puede provocar un fallo renal agudo. Ha sido implicado en el desarrollo del hiperparatiroidismo secundario (HPT 2.º), en la inflamación, en la alteración de la inmunidad, en la progresión de la enfermedad renal crónica (ERC), en la morbimortalidad cardiovascular y en la calcificación vascular. Además, disminuye la síntesis de calcitriol y promueve la elevación del factor de crecimiento de los fibroblastos (FGF), ambas implicadas en la mortalidad de los pacientes con ERC. Todo ello se describe con detalle a continuación.
NEFROPATÍA AGUDA POR FÓSFORO
La detección del cáncer colorrectal en individuos a partir de los 50 años ha sido un éxito desde el punto de vista de la salud pública. La preparación previa para la colonoscopia requiere la utilización de una solución oral de fosfato sódico, que generalmente es bien tolerada por individuos con función renal y gastrointestinal normales. Sin embargo, a partir del año 2003 se comenzaron a publicar casos aislados de nefropatía aguda por fósforo (NAF), ocasionada por la sobrecarga aguda de P, debida a la utilización de la solución de fosfato sódico, con un contenido de más de 12 g de fósforo, que ocasiona un fallo renal agudo a veces irreversible, objetivándose en la biopsia renal datos de nefrocalcinosis e inflamación intersticial. Esto ha llevado a la Food and Drug Administration (FDA) estadounidense a realizar una advertencia sobre la utilización de esta solución en pacientes con ERC y en aquéllos con comorbilidad cardiovascular.
En un artículo de revisión se recogen todos los casos conocidos hasta el momento. Se trata de 27 individuos (de los que 22 son mujeres), cuya media de edad es de 65 años y que refleja fundamentalmente la edad a la que se realiza la exploración de detección. Las mujeres de mayor edad tienen mayor riesgo, probablemente porque su capacidad renal para manejar la sobrecarga de fosfato está más reducida. Además, su menor índice de masa corporal (IMC) las hace más sensibles a la sobrecarga de volumen. El período de tiempo entre la colonoscopia y el diagnóstico de la NAF varió entre 1 y 150 días, lo que refleja la naturaleza silente del fallo renal. En cuanto a la función renal, fue prácticamente normal en todos los pacientes antes de la exploración, con unos valores de creatinina comprendidos entre 53 y 88 μmol/l; posteriormente aparecen elevaciones de entre 150 y 900 μol/l. Los factores de riesgo más habitualmente encontrados fueron: diabetes mellitus (DM), hipertensión arterial (HTA), mayor edad, algún grado de ERC o la toma de fármacos como inhibidores de la enzima de conversión de angiotensina (IECA), antagonistas de los receptores de angiotensina II (ARA II), antiinflamatorios no esteroideos (AINE), diuréticos y utilización de contrastes. En la patogénesis del cuadro subyace la sobrecarga de fosfato que estimula la hormona paratiroidea (PTH) y reduce la síntesis de 1-25 (OH)2 D3. La fosfaturia se eleva de la primera a la segunda dosis de 4 a 8 veces. La hipercalciuria es debida a que la sobrecarga de sodio (Na) suprime la reabsorción de calcio (Ca) en el túbulo proximal. En el asa de Henle, el líquido tubular sobresaturado en calcio y fósforo da lugar a la producción de un material sólido, probablemente apatita inmadura, que obstruye la luz; esta sustancia es internalizada por las células epiteliales y da lugar a una reacción inflamatoria y daño celular, lo que causa la posterior fibrosis intersticial1.
FÓSFORO E HIPERPARATIROIDISMO SECUNDARIO
Desde hace muchos años se conoce que las concentraciones plasmáticas de calcio y fósforo intervienen en el desarrollo del HPT 2.º en la ERC. Posteriormente se han ido descubriendo los mecanismos íntimos de esta relación. Así, hay trabajos que muestran que las proteínas AUF1 y KSPR (K¿homology splicing regulator protein) se unen al ARNm de la PTH estabilizándolo en situaciones de depleción de calcio, cambios en la fosfatemia o en la ERC2. Otro trabajo realizado con ratas muestra que los animales en los que se desencadenaba insuficiencia renal mediante nefrectomía 7/8 y que eran alimentados con dieta rica en fósforo presentaban unos niveles de P más elevados y glándulas paratiroides más grandes, junto con una marcada y general disminución de la expresión génica. Sin embargo, algunos genes que estuvieron sobreexpresados son genes que intervendrían en la hiperplasia de las glándulas paratiroides.
FÓSFORO Y FACTORES DE INFLAMACIÓN
Las alteraciones del metabolismo mineral y la inflamación son factores que se han relacionado con el incremento del riesgo vascular y la mortalidad por esta causa en los pacientes con ERC. En un estudio, el autor plantea analizar las posibles relaciones entre parámetros del metabolismo mineral, fundamentalmente el fósforo, y la inflamación, representada por los marcadores PCR, TNFα e IL-6. Se estudiaron 118 pacientes con ERC en estadio 3b-4; de ellos, 68 varones, con una media de edad de 61 años. Se determinaron los valores de calcio, fósforo, producto del calcio y fósforo, y PTH.
RESULTADOS
La PCR se relacionó con el filtrado glomerular y el fósforo, pero no con el colesterol ni la PTH; la IL-6 se relacionó con el filtrado glomerular y el fósforo, pero no con el colesterol, la edad o el IMC. En el análisis de regresión múltiple se demostró que la concentración sérica de fósforo era un determinante independiente de los niveles de PCR (p <0,01) e IL-6 (p <0,05)3.
FÓSFORO E INFECCIÓN
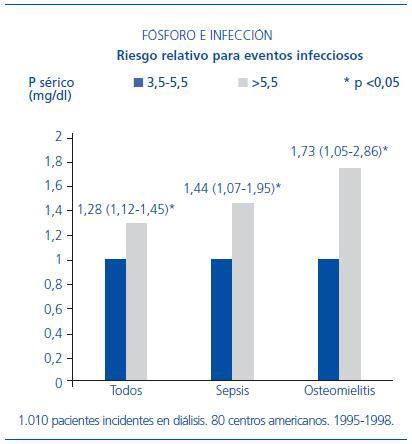
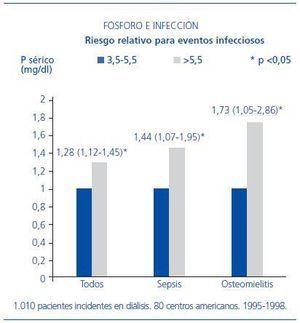
La hiperfosfatemia es muy frecuente en pacientes en diálisis. La relación de la fosfatemia con la disfunción inmunológica no se ha estudiado en profundidad. Hace unos meses, se ha publicado un ensayo en el que los autores estudiaron una cohorte de 1.010 pacientes incidentes en diálisis entre 1995 y 1998, pertenecientes a 80 centros americanos. Se recogieron datos de cualquier tipo de infección, sepsis y, más concretamente, infección respiratoria y osteomielitis a lo largo de todo el seguimiento. La fosfatemia >5,5 mg/dl se relacionó de forma significativa con la incidencia de todo tipo de infecciones, sepsis y osteomielitis (figura 1). No se halló significación con la infección respiratoria, y tampoco se encontró relación con los valores de calcemia4.
PROGRESIÓN DE LA ENFERMEDAD RENAL CRÓNICA
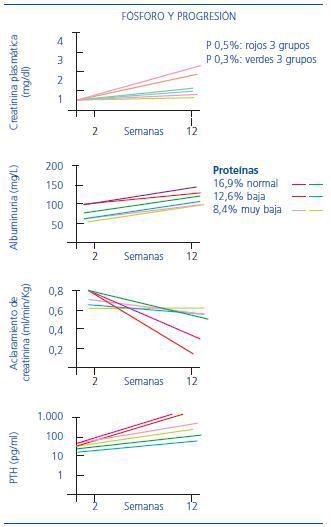
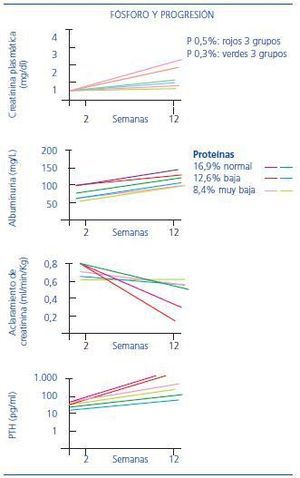
El fósforo también ha sido implicado en la progresión de la ERC. En un trabajo realizado por Kusano et al., se pretende discernir entre la sobrecarga proteica y la sobrecarga de fósforo, para valorar cuál de los dos factores tiene más peso en el desarrollo de la progresión de la ERC. El estudio se realizó con ratas. Los animales se dividieron en siete grupos: uno de ellos el grupo control y el resto fue sometido a nefrectomía unilateral e inyección de un anticuerpo monoclonal, lo que les produjo una nefropatía que remeda la GN IgA. A su vez, los seis grupos se dividieron en dos: tres grupos tomaron una dieta normal en fósforo y los otros tres una dieta pobre en fósforo, pero, a su vez, ambos tomaron una concentración de 16,9%, 12,6% u 8,4% de proteínas, en lo que denominan dieta normal, pobre y muy pobre en proteínas (figura 2).
La restricción de fósforo fue más eficaz para evitar la progresión que la dieta con restricción proteica5.
Otros estudios se diseñan para valorar los diferentes factores predictores de la evolución y progresión de la ERC. Quizás uno de los más representativos es el que se describe a continuación. Se trata de un estudio retrospectivo de una cohorte de 4.231 pacientes con una tasa de filtración glomerular estimada (TFGe) <30 ml/min y una media de edad de 61 años, reclutados entre enero de 2000 y enero de 2004. Se consideraron variables demográficas la edad, el sexo, la raza, patologías asociadas como HTA, DM y existencia de proteinuria; datos analíticos como hemoglobina, calcio, fósforo, PTH; tratamiento farmacológico con IECA, ARA II, eritropoyetina o vitamina D. El estudio concluyó que el fósforo fue un factor de riesgo tanto para el declinar de la función renal como para la muerte6.
FÓSFORO Y CORAZÓN
El fósforo ha demostrado su implicación en la calcificación coronaria. En 1984 se inició el estudio Coronary Artery Risk Development in Young Adults7, conocido como estudio CARDIA. Se trata de un estudio prospectivo, realizado con una cohorte de 5.116 individuos blancos y negros, varones y mujeres, de 18 a 30 años y sanos. Durante 15 años se realizó un seguimiento con el objetivo de investigar si el estilo de vida, los aspectos psicosociales y otros factores influyen favorable o desfavorablemente en la evolución de los factores de riesgo de la enfermedad coronaria. En más de la mitad de los participantes se midió la calcificación arterial coronaria (CAC) por técnicas de imagen. En todos ellos se realizaron medidas antropométricas y analítica en sangre y orina. Foley et al.8 realizaron un subanálisis de este estudio para investigar si existe asociación entre el nivel de fósforo y la calcificación coronaria. Al término del estudio se demostró una relación directa y significativa entre los niveles plasmáticos de fósforo y la calcificación de las arterias coronarias.
Otro estudio, el Dallas Heart Study9, realizado con 2.672 individuos con una media de edad de 45 años, permitió valorar factores de riesgo de calcificación vascular. Del total de individuos, 220 presentaban ERC. La calcificación vascular se midió mediante puntuaciones que podrían ser superiores o inferiores a 100. La prevalencia de la calcificación coronaria fue más elevada en los pacientes con ERC que en aquéllos sin enfermedad renal, y se incrementó significativamente a lo largo de las fases de dicha ERC. La asociación entre ERC y calcificación coronaria fue independiente de los factores de riesgo clásico, pero desapareció al ajustar por el producto CaxP, homocisteína y osteoprotegerina, mostrando de nuevo la relación entre la calcificación vascular y el metabolismo mineral.
Otro ensayo10 fue llevado a cabo con 85 pacientes con DM y nefropatía, ninguno de los cuales había requerido diálisis ni angioplastia o pontaje coronario. La calcificación coronaria se midió por tomografía axial computarizada (TAC) con multidetector. Se encontró una relación directa entre calcificación coronaria, fosfato, osteoprotegerina, presión arterial sistólica (PAS) y edad.
MORTALIDAD CARDIOVASCULAR
El fósforo ha sido relacionado con la mortalidad cardiovascular. El estudio ARIC es un gran estudio del que se han obtenido muy variados datos, además de los objetivos para los que se diseñó. Se comenzó en 1986, el reclutamiento finalizó en 1989, y se incluyó un total de 15.792 participantes con edades comprendidas entre 45 y 64 años, pertenecientes a diversas comunidades estadounidenses. Al inicio no debían padecer enfermedad cardiaca y su tasa de TFG debería ser >15 ml/min. Se realizaron analíticas de sangre para valorar los lípidos, glucemia, hemograma TFGe por MDRD y hábitos tóxicos como el tabaco, el IMC, las cifras de PA, la actividad física, etc. En el año 2000 se llevó a cabo el estudio de resultados. De éste se extrajo un subanálisis11 en el que, ajustando por todas las demás variables, el fósforo se asoció con enfermedad coronaria, ictus o muerte con una ratio de 1,03 (0,89-1,08); 1,11 (1,02-1,21, p = 0,02); 1,14 (1,09-1,20, p <0,0001), respectivamente.
El Dialysis Outcomes and Practice Patterns Study (DOPPS) fue un estudio prospectivo de 25.588 pacientes con ERC en hemodiálisis (HD), con más de 180 días de tratamiento sustitutivo. Hay tres fases en este estudio, desde 1996-2001 para DOPPS I; desde 2002-2004 para DOPPS II, y desde 2005-2007 para DOPPS III. El objetivo es estudiar todas las causas de muerte, así como la muerte, por causa cardiovascular. En la más reciente fase del DOPPS se halló que el más bajo riesgo de mortalidad corresponde a valores de calcemia comprendidos entre 8,6 y 10 mg/dl, fosfatemia entre 3,6 y 5 mg/dl, y PTH entre 101 y 300 pg/dl. El mayor riesgo de muerte es para calcio >10 mg/dl, fósforo >7 mg/dl y PTH >600 pg/dl12.
Otro estudio13 se llevó a cabo sobre una cohorte de 22.937 pacientes incidentes en diálisis de julio de 2000 a julio 2002, con dos años de seguimiento. El objetivo fue doble: ver cuántos pacientes tenían unas determinadas variables (calcio, fósforo y PTH dentro del rango aceptado) y cómo influía esto en la mortalidad.
RESULTADOS
Ninguna variable en rango: riesgo 51%; una variable en rango: riesgo del 35% al 39%; dos variables en rango: riesgo del 15% al 21%. El mantenimiento del P en rango disminuía el riesgo en un 38%.
FÓSFORO Y MORTALIDAD POR CUALQUIER CAUSA
Además de la mortalidad cardiovascular, el fósforo se ha implicado en la mortalidad global. La ERC es un poderoso factor de riesgo de mortalidad por cualquier causa, aunque fundamentalmente para mortalidad por causa cardiovascular. Un artículo de revisión14 realizó una búsqueda sistemática en Medline, EMBASE y Cochrane de todos aquellos estudios publicados entre enero de 1980 y diciembre de 2007. Se incluyeron 35 estudios; de ellos, en 29 se investiga la mortalidad por cualquier causa y en 11 se describe el riesgo cardiovascular, pero sólo se detallan los episodios cardiovasculares (ECV) en 4 de ellos. Los disturbios del metabolismo mineral produjeron un aumento de la mortalidad, ya fuera cardiovascular o de otra causa; el mayor riesgo fue debido al fósforo, seguido por el calcio y la PTH.
Las alteraciones del metabolismo mineral en el contexto de la ERC aumentan significativamente el riesgo cardiovascular, pero también hay un incremento del riesgo en pacientes malnutridos con albúmina baja. Para discernir entre estas dos causas de riesgo, se estudiaron 1.007 pacientes en diálisis15, que habían comenzado el tratamiento de sustitución entre enero de 1990 y diciembre de 2004. El valor de fósforo, calcio y albúmina se midió entre el tercero y el sexto mes tras el comienzo de la diálisis y se comparó con la supervivencia.
RESULTADOS
El 18% de los pacientes tenían P >5,5 mg/dl; la supervivencia a los 5 años fue del 48,4% frente a los que tenían P <5,5 mg/dl, cuya supervivencia fue del 58,6%. En cuanto a la albúmina, el 34,9% tenía albúmina <35 g/l, la mortalidad era significativamente más alta. Los pacientes que combinaban calcio, fósforo y albúmina normal tenían una supervivencia del 62,5% frente al 30,7% para los que no tenían ninguno de los tres valores en rango.
FÓSFORO Y CALCIFICACIÓN VASCULAR
Por último, el fósforo como factor decisivo en la calcificación vascular. Ésta no es una patología nueva, ya que mediante TAC se ha descubierto que ya existía calcificación vascular en el llamado «hombre de las nieves» al que se atribuyen más de 5.000 años de antigüedad. Alfrey et al. ya demostraron hace casi 30 años que los pacientes con ERC tenían mayor calcificación vascular que individuos de la misma edad y sexo.
Teniendo esto en cuenta, ¿cuál es la razón del gran interés por la calcificación vascular que ha aparecido entre los nefrólogos en los últimos años? Primero, la consistente relación entre calcificación vascular y riesgo de morbimortalidad cardiovascular. Segundo, la capacidad demostrada de conversión de las células de músculo liso vascular (CMLV) en condrocitos y osteoblastos-like. Tercero, el conocimiento de que hay proteínas clave en el desarrollo de esta calcificación vascular. Cuarto, una demostrada relación entre ERC y enfermedad ósea y vascular. Sabemos ahora que el arduo empeño en tratar la osteodistrofia nos ha llevado a acelerar la calcificación vascular en muchas ocasiones.
La calcificación vascular requiere de dos fenómenos, uno de ellos es la transformación fenotípica de las CMLV en condrocitos u osteoblastos-like, que podría considerarse como osificación, y el otro es un fenómeno fisicoquímico, cuyo desarrollo no requiere siquiera de la presencia celular, y es el depósito de calcio y fósforo, muy pH dependiente. Durante mucho tiempo, se ha considerado que la concentración de calcio y fósforo conocido por el concepto «producto calcio-fósforo», era predictivo de mineralización extraesquelética en pacientes con ERC y daba seguridad a los médicos cuando este producto estaba en rango normal. Sin embargo, esto no es completamente cierto, porque el riesgo asociado a un determinado producto calcio-fósforo depende, además, de la existencia de enfermedad arterial previa y de los factores que actúan inhibiendo o favoreciendo la mineralización. Lo más interesante es que, en modelos animales, la calcificación puede ser prevenida o reducida con los tratamientos médicos actuales. Además, estos estudios muestran una robusta evidencia de que la sobrecarga de fósforo y calcio son claves en el defecto del remodelado óseo que dará lugar a la calcificación vascular, confirmando un nexo de unión entre ambos fenómenos.
Sin embargo, no todos los pacientes en diálisis o con ERC desarrollan calcificación vascular, lo que indica que existen factores protectores en su pared vascular o en su torrente circulatorio. En el torrente circulatorio, uno de los más importantes factores es la fetuína A, que actúa como un aspirador de moléculas de calcio y fósforo en el plasma. La concentración de fetuína A disminuye con la inflamación, y los bajos niveles de ésta en pacientes en diálisis se asocian con calcificación vascular y valvular y muerte. Otros factores, en este caso locales, son la proteína de matriz Gla, el pirofosfato y la osteopontina, aunque es posible que la pared vascular contenga además otros mediadores, e incluso que su concentración varíe en las diferentes localizaciones anatómicas.
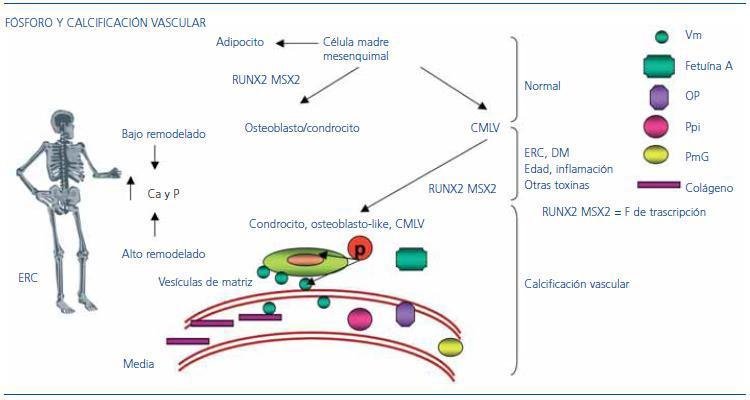
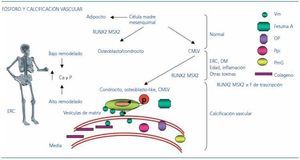
En situación normal, la célula madre mesenquimal dará lugar al adipocito y a la CMLV; además, y a través de factores de expresión génica RUNX2 y MSX2, dará lugar al osteoblasto/condrocito (figura 3). En situaciones de ERC, DM, inflamación, pacientes ancianos y en presencia de determinadas toxinas, el osteoblasto/condrocito también puede desarrollarse desde las CMLV dirigidas por los factores de expresión génica RUNX2 y MSX2. El fósforo actúa en este escenario de dos formas: a) penetrando en la CMLV a través de un canal dependiente de Na activando y desactivando genes hasta conseguir un cambio del fenotipo de la célula, que pasará de ser una CMLV a un osteoblasto/condrocito; b) junto con el calcio, mineralizará el tejido osteoide formado, dando lugar a la calcificación vascular.
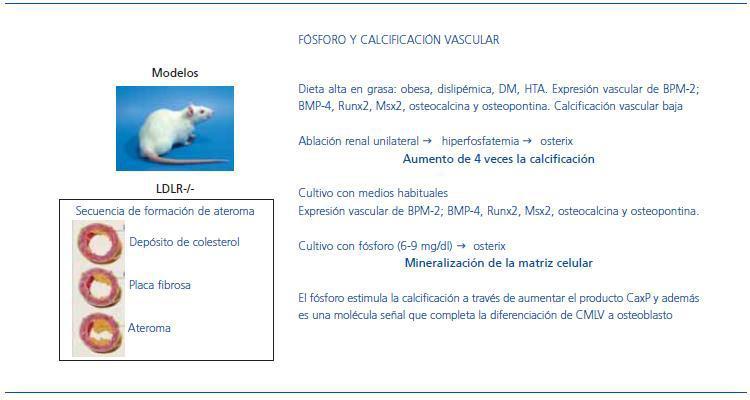
En los pacientes con ERC, ya sea con bajo o alto remodelado óseo, puede haber calcio y fósforo elevado, en el primer caso porque el hueso no acepta los minerales y en el segundo por aumento de la liberación de éstos. Hay una robusta evidencia epidemiológica de que el fosfato sérico es un factor de riesgo independiente de morbimortalidad cardiovascular. El grupo de Hruska et al., en St Louis16, ha desarrollado un modelo de ratas con deficiencia del receptor LDL a las que alimentó con una dieta rica en grasa. Los animales desarrollaron obesidad, dislipemia, DM e HTA, lo que en humanos se conoce como síndrome metabólico. A su vez, se observó aterosclerosis con placas de calcificación localizadas en la neoíntima de las arterias y en las válvulas cardiacas de los animales. Sus CMLV expresaban las proteínas morfogénicas de hueso BPM-2 y BPM-4, y los factores de trascripción Runx2, Msx2, osteocalcina y osteopontina, proteínas que muestran la diferenciación celular de CMLV a osteoblastos, y a pesar de ello la calcificación vascular era baja. Posteriormente, estas ratas fueron sometidas a ablación renal parcial, con lo que desarrollaron ERC y a su vez hiperfosfatemia, lo que produjo un aumento varias veces superior del factor de trascripción osterix y estimuló la calcificación de dos a cuatro veces más (figura 4).
Un segundo modelo de estudio17 consistió en CMLV de anillos de aorta humanos con placas de aterosclerosis, cultivados en medios habituales. Las células expresaban BPM-2, BMP-4, Runx2, Msx2 y osteocalcina. Cuando se aumentaba el fósforo en el medio de cultivo hasta un valor equiparable a una concentración plasmática de 6-9 mg/dl, se incrementaba varias veces la expresión de osterix y esto promovía la mineralización de la matriz celular.
Cuando se reducía la concentración de fósforo en sangre en los animales mediante quelantes o se bloqueaba la acción de fósforo en el medio de cultivo, se inhibía la mineralización de la matriz en la pared vascular.
Por todo esto, el fósforo es más que un estimulador de la calcificación vascular que actúa mediante una elevación del producto calcio x fósforo en la ERC y la IRC; es una molécula señal que sirve para completar la diferenciación de la CMLV a osteoblasto y para calcificar las lesiones ateromatosas mediante el estímulo de factores como osterix.
Las ratas con deficiencia del receptor LDL, alimentadas con dieta rica en grasas y con posterior ablación renal para desarrollar ERC e IRC, presentaban unos valores de fósforo plasmático de 10 mg/ml, y cuando fueron tratadas con cualquiera de los tres tipos de quelantes (carbonato de calcio, carbonato de lantano y carbonato de sevelamer), la fosfatemia descendió y la calcificación de la aorta se redujo, aunque esta disminución sólo resultó significativa en los animales que consiguieron un descenso del fósforo por debajo de 6 mg/dl.
El fósforo es capaz de favorecer la calcificación vascular de forma directa, pero también indirectamente a través de su acción sobre inhibidores. El pirofosfato (Ppi) es un inhibidor bien establecido de la calcificación en el cartílago, de la cristalización del oxalato de calcio en el riñón y de la calcificación vascular en ratas intoxicadas con vitamina D. Es un potente inhibidor de la hidroxiapatita, y mínimas concentraciones de pirofosfato en plasma son suficientes para inhibir la cristalización de soluciones sobresaturadas de fosfato y de calcio. La fosfatasa alcalina no específica de tejido (FANT) es la llave que determina la concentración de PPi, ya que hidroliza y, por ende, destruye la molécula. En ratas a las que se les produce ERC e IRC mediante dieta rica en adenina o nefrectomía 5/6, se objetiva un aumento del 92% de actividad de FANT en cultivo de aortas de dichos animales. La eliminación de la adventicia y el endotelio de dichos vasos no modificó la actividad de FANT, demostrando que las productoras de la FANT eran las CMLV. El aumento de la FANT podría ser regulado, en parte, disminuyendo su degradación; los factores candidatos para ello incluyen la hiperfosfatemia y el HPT 2.º. Éste es otro mecanismo que se postula a través del cual la hiperfosfatemia conduce a la calcificación vascular.
CONCLUSIONES
- La sobrecarga oral de fósforo produce daño renalagudo.
- El fósforo está implicado en la progresión de la ERC.
- El fósforo está implicado en un aumento de la mortalidad global y la morbimortalidad cardiovascular.
- El fósforo está implicado en la calcificación vascular en varios niveles.
Figura 1. Influencia del nivel de fósforo sérico en el riesgo de algunos procesos infecciosos en enfermos en hemodiálisis.
Figura 2. Influencia en el desarrollo de ERC tanto de las proteínas como del fósforo.
Figura 3. Mecanismos condicionantes de la calcificación vascular.
Figura 4. Modelo experimental de rata (con déficit de receptor LDL) sin y con insuficiencia renal añadida.