El campo de la inmunología del trasplante vive una época de importantes avances en la investigación básica y clínica. Los métodos moleculares para la tipificación HLA (antígenos leucocitarios humanos) y los test de fase sólida para determinar los anticuerpos anti-HLA son la base para caracterizar el riesgo inmunológico del trasplante. Su uso clínico se ha extendido para conocer el grado de inmunización de los pacientes, para realizar pruebas cruzadas virtuales de alta sensibilidad (VXM, sin necesidad de células) y para el diagnóstico y seguimiento del rechazo mediado por anticuerpos. El estudio de los anticuerpos específicos frente a los antígenos HLA del donante (DSA), preformados o de novo, y algunas de sus propiedades, como su concentración, su capacidad de fijación de complemento y el tipo de subclase de inmunoglobulina que los conforman, tienen una enorme utilidad para el pronóstico del rechazo y de la supervivencia del injerto. Hoy es posible trasplantar a pacientes con DSA gracias a programas basados en VXM en pacientes hiperinmunizados y a protocolos de desensibilización con rituximab, plasmaféresis, inmunoglobulinas y endoproteasas microbianas.
Los recientes avances en inmunología del trasplante que cambiarán la práctica clínica en el futuro pasan, entre otros, por la selección de la pareja donante-receptor basada en la incompatibilidad de epítopos HLA y en alcanzar la tolerancia inmunológica con terapia celular génica (células T reguladoras), sin necesidad de usar fármacos inmunosupresores.
INTRODUCCIÓN
El trasplante renal ha supuesto una mejora sustancial en la supervivencia y calidad de vida del paciente con enfermedad renal crónica terminal. A pesar de los avances conseguidos, la principal barrera para el trasplante sigue siendo la respuesta inmune frente al órgano trasplantado. Esta revisión se centrará en la importancia del conocimiento del sistema inmune, el estudio y significado de los anticuerpos anti-HLA (antígenos leucocitarios humanos), las estrategias disponibles para los pacientes con estos anticuerpos y, finalmente, una breve reseña sobre líneas futuras innovadoras en la inmunología del trasplante renal.
MOLÉCULAS HLA CLÁSICAS: FUNCIÓN, TIPOS E IMPORTANCIA EN EL TRASPLANTE DE ÓRGANOS ALOGÉNICOS. PRINCIPALES MÉTODOS DE TIPIFICACIÓN HLA
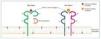
Las moléculas HLA clásicas son glucoproteínas de membrana implicadas en la presentación de antígenos a las células T (fig. 1) y se dividen en 2 grandes grupos, las moléculas HLA de clase I, que se expresan en todas las células nucleadas y presentan antígenos procedentes del catabolismo endógeno a las células T CD8+ o citotóxicas, y las de clase II, que presentan péptidos captados por vía endosomal a las células T CD4+ o colaboradoras que, fundamentalmente, se expresan en las células presentadoras de antígenos profesionales1, si bien en otros linajes celulares, como el endotelio vascular, su expresión puede verse inducida en un contexto inflamatorio2. Los genes que codifican las moléculas HLA se localizan en el brazo corto del cromosoma 6, incluyen los loci HLA-A, -B y -Cw para la clase I y los loci HLA-DR, -DP y -DQ para la clase II. Una de las principales características de las moléculas HLA es su elevado polimorfismo (existen múltiples alelos de cada gen presentes en la población). Esta extraordinaria variabilidad HLA, evolutivamente seleccionada para optimizar nuestra respuesta inmunológica frente a las agresiones externas, constituye la base molecular del rechazo. Así, las diferencias HLA entre donante y receptor se perciben por el sistema inmune de este último, que desencadena un conjunto de respuestas aloespecíficas, cuyo fin es destruir el aloinjerto.
Figura 1. Las moléculas HLA de clase I presentan una estructura con 2 cadenas polipeptídicas: una larga cadena α y una pequeña cadena invariante β2-microglobulina. Las moléculas HLA de clase II también presentan una estructura con 2 cadenas polipeptídicas: las cadenas α y β, de aproximadamente la misma longitud.
Se dispone de diferentes métodos para identificar este polimorfismo HLA (tipificación HLA); el más rápido y sencillo es el método serológico, que se basa en la citotoxicidad dependiente de complemento (CDC)3. Más recientemente, con el desarrollo de la reacción en cadena de la polimerasa (PCR), los métodos moleculares se han impuesto a los serológicos por su mayor sensibilidad y resolución. Dentro de estos, la PCR-SSO (sequence-specific oligonucleotide) es probablemente el más utilizado. Se basa en la amplificación por PCR de los diferentes locus HLA en sus regiones polimórficas, seguida de la hibridación de los productos amplificados con sondas SSO inmovilizadas en un soporte sólido. Otro método muy usado es la PCR-SSP (sequence-specific priming), que utiliza múltiples pares de primers específicos de alelo. Es un proceso simple, rápido e ideal para la tipificación HLA de muestras aisladas. La tipificación HLA por PCR-secuenciación es un método más largo y costoso, en el que los productos amplificados son directamente secuenciados y, además, necesita recurrir a otros métodos para resolver las combinaciones ambiguas. Finalmente, en los últimos años, se está produciendo una verdadera revolución con el desarrollo de la NGS (next-generation sequencing), que proporciona una caracterización completa del HLA con el uso de protocolos relativamente sencillos y baratos, sin necesidad de recurrir a técnicas adicionales4.
ANTICUERPOS ANTI-HLA: DESARROLLO Y RELEVANCIA CLÍNICA. IDENTIFICACIÓN Y CARACTERIZACIÓN
Los anticuerpos anti-HLA están específicamente dirigidos frente a los antígenos leucocitarios humanos. Su desarrollo se produce como respuesta ante una exposición de antígenos HLA alogénicos, que pueden darse en 3 contextos: trasplante, embarazo y transfusiones sanguíneas. No obstante, se ha descrito que estos anticuerpos también pueden aparecer por fenómenos de sensibilización cruzada durante el curso de una infección o tras procesos inflamatorios5. La presencia de anticuerpos anti-HLA (preformados o de novo), dirigidos específicamente frente a los antígenos HLA del donante (DSA), está fuertemente asociada a fenómenos de rechazo y a fallo prematuro del injerto6. Su determinación (ya sea previa al trasplante o durante el curso de este) se ha convertido en una práctica crucial para el correcto abordaje del paciente en los programas de trasplante renal.
Las técnicas para determinar la presencia de aloanticuerpos anti-HLA han evolucionado a lo largo del tiempo. Las primeras se desarrollaron en la década de 1960 y se basan en la citotoxicidad dependiente de complemento (CDC). Su principal limitación es su baja sensibilidad. La introducción de la citometría de flujo (CF) en la década de 1980 mejoró la sensibilidad para la detección de aloanticuerpos anti-HLA mediante el empleo de anticuerpos monoclonales secundarios (anti-IgG) conjugados con fluorocromos. En la década de 1990 surgen los primeros ensayos en fase sólida que, al contrario que los ensayos celulares, solubilizan e inmovilizan las moléculas HLA sobre un soporte sólido. El ensayo ELISA (enzyme-linked immunosorbent assay) se adaptó para la detección de anticuerpos anti-HLA en 1995 y utiliza inmunoprecipitados de glucoproteínas HLA obtenidas a partir de células transformadas con el virus de Epstein-Barr e inmovilizadas en los pocillos de una microplaca7.
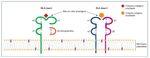
A partir del año 2003, la tecnología Luminex (fig. 2) revoluciona el área de la histocompatibilidad, y actualmente es el método de referencia dadas su gran sensibilidad y reproducibilidad8. Esta tecnología utiliza moléculas HLA purificadas a partir de líneas celulares linfoblásticas e inmovilizadas sobre microesferas de poliestireno, que contienen una mezcla determinada de fluorocromos. Cada microesfera está cargada, bien con un conjunto de antígenos HLA (lo que permite detectar la presencia o ausencia de anticuerpos frente a moléculas de clase I y/o II) o bien con una única especificidad HLA (single antigen bead, SAB), lo que permite definir individualmente las especificidades antigénicas frente a las que el suero presenta anticuerpos.
Figura 2. Tecnología Luminex para la detección de anticuerpos anti-HLA: cribado y definición de especificidades.
FISIOPATOLOGÍA DE LOS ANTICUERPOS ANTI-HLA: EL RECHAZO MEDIADO POR ANTICUERPOS
Los DSA en el postrasplante tienen un marcado efecto patológico sobre el injerto renal, en el que provocan una lesión de naturaleza vascular a través de múltiples mecanismos efectores. Estos mecanismos incluyen desde la activación de la cascada del complemento a la citotoxicidad celular dependiente de anticuerpos (ADCC) o la activación del endotelio vascular9. El complemento representa la principal vía de daño y su activación tiene un papel destacado en la fisiopatología subyacente a fenómenos de rechazo, tanto agudo como crónico10,11. La cascada del complemento se inicia con la unión de los DSA a sus dianas antigénicas (HLA) del endotelio vascular del injerto. Los complejos antígeno-anticuerpo se fijan a la molécula C1q disparando la activación del complemento por la vía clásica, la cual, a través de una serie de eventos, conduce a la formación del complejo de ataque a la membrana (MAC). El MAC forma poros transmembrana, lo que provoca la lisis celular. Otros componentes del complemento, como C3a y C5a, actúan como quimioatrayentes para neutrófilos y macrófagos. El C5a actúa también como una potente anafilotoxina y conduce a la formación de edema. Esta activación del complemento por la vía clásica deja un rastro en forma de depósitos de C4d, que actualmente se utiliza en el diagnóstico de rechazo, activo o crónico, mediado por anticuerpos (antibody mediated rejection, AMR), junto con hallazgos histológicos de daño tisular y evidencias serológicas basadas en la propia presencia del DSA inductor del proceso12. El C4d es un fragmento derivado del componente C4b que se une covalentemente al endotelio y se convierte en una huella duradera y altamente específica de daño mediado por anticuerpos13.
No obstante, una parte importante de los fenómenos de rechazo humoral descritos (especialmente los asociados a daño crónico) pueden cursar sin evidencia de actividad del complemento, y el concepto de AMR en ausencia de C4d está ampliamente aceptado. Desde hace décadas hay evidencias de que la ACDD mediada por células natural killer (NK) podría tener un papel importante en la aparición de daño renal crónico. La principal hipótesis plantea que las células NK, a través de su receptor FcγRIII (CD16), son capaces de unirse a los anticuerpos anclados sobre los HLA endoteliales del aloinjerto14. Esta unión NK-DSA induciría la liberación de citocinas proinflamatorias (INF-γ y TNF) y activaría su capacidad citotóxica. Experimentos en ratones ya han demostrado la existencia de esta vía como inductora de daño crónico en ausencia de complemento, y cada vez hay más evidencias de su relevancia en fenómenos de AMR en humanos15. Finalmente, los DSA también pueden activar el endotelio vascular per se. Histológicamente, estos cambios se manifiestan como una proliferación de las células endoteliales y/o el engrosamiento, duplicación y multilaminación de la membrana basal del glomérulo y los capilares peritubulares9.
PRUEBA CRUZADA PRETRASPLANTE
La prueba cruzada (crossmatch, XM) se realiza para descartar la presencia de DSA preformados. La primera que se desarrolló se basó en la capacidad de algunos anticuerpos para activar la cascada del complemento (XM-CDC). En 1969, Patel y Terasaki describieron la fuerte asociación entre fallo renal temprano y un resultado positivo de esta prueba16. Esencialmente, en una XMCDC primero se incuba (30 min) el suero del receptor candidato con linfocitos extraídos del donante. Después se añade complemento exógeno y, tras un período de 30-45 min, las células mueren (lisis mediada por complemento) en caso de que el suero presente DSA o permanecen vivas en caso de ausencia. Un resultado positivo, que se considera con un porcentaje de muerte superior al 20%, contraindica el trasplante.
La XM por CF es un método más sensible, pues permite detectar anticuerpos a una menor concentración, pero es menos específico17. En este procedimiento, tras incubar el suero del receptor con las células del donante, la unión antígeno (moléculas HLA de las células T y/o B)-anticuerpo (anti-HLA) queda revelada por el uso de un anticuerpo secundario (anti-IgG) conjugado con un fluorocromo. La combinación de anticuerpos frente a otras moléculas específicas, como CD19, CD20 o CD3, posibilita la discriminación entre células T y B. Los resultados se estiman según el valor del canal medio de fluorescencia.
Finalmente, a partir del desarrollo de los ensayos en fase sólida en conjunción con las sofisticadas técnicas de genotipificación HLA, se ha introducido la XM virtual (VXM), con objeto de predecir el resultado de una XM (CDC o CF), y con ello se optimiza la selección de sujetos candidatos. Una VXM se considera positiva cuando, al cruzar los datos (con una aplicación informática) del HLA-donante y el panel de anticuerpos anti-HLA en el receptor (por SAB), se objetiva la presencia de DSA. La VXM es una herramienta fiable en la predicción de AMR y fallo temprano18, y ya se utiliza con éxito para mejorar el intercambio de órganos, sobre todo en pacientes hiperinmunizados (Programa para Pacientes Hiperinmunizados en Andalucía, implantado en 2012 y posteriormente por la Organización Nacional de Trasplantes PATHI)19,20; además permite acortar el tiempo de isquemia y no requiere disponer de las células del donante para su realización. Aunque la correlación entre una VXM negativa y una XM (CDC o CF) negativa suele ser muy alta21, se han descrito resultados positivos de XM en ausencia de anticuerpos anti-HLA (VXM–), debido a la presencia de autoanticuerpos o de anticuerpos IgM, que pueden limitar el acceso al trasplante de pacientes candidatos. Algunos estudios han demostrado que pacientes trasplantados con XM+ y VXM– no presentan un incremento en el riesgo de rechazo temprano22 o una menor supervivencia23, lo que sugiere que en estos casos la VXM es la herramienta más fiable. Finalmente, la excesiva sensibilidad del SAB limita su especificidad y así, la presencia de anticuerpos (VXM+), en un contexto de XM–, no necesariamente está asociada a mayor riesgo de AMR. A este respecto, se están evaluando determinadas características del DSA para intentar definir su valor patológico (véase con más detalle en el siguiente apartado).
TRASPLANTE CON ANTICUERPOS ESPECÍFICOS DE DONANTE
La consolidación de los ensayos de fase sólida ha incrementado las expectativas de éxito en el trasplante de órganos, y mantiene baja la incidencia de rechazo18 gracias a su gran capacidad para detectar anticuerpos. Sin embargo, esta extraordinaria sensibilidad ha limitado el acceso al trasplante de una parte de la población previamente sensibilizada. Aunque hay evidencias de que la presencia de anticuerpos detectados en fase sólida incrementa el riesgo de AMR24, lo cierto es que no hay un consenso unánime al respecto.
En la práctica clínica se han evaluado algunas estrategias para tratar de definir el riesgo inmunológico de un anticuerpo detectado en fase sólida (SAB). La primera de estas estrategias cuantifica el anticuerpo (mediante su valor de MFI, mean fluorescence intensity) asumiendo que dicho valor es una medida de su concentración. Bajo esta premisa, únicamente los anticuerpos anti-HLA cuyo valor de MFI supere un umbral (suele estar entre 3.000-5.000 MFI) se consideran de alto riesgo. Si bien algunos estudios han demostrado una relación causal entre el valor MFI y la incidencia de AMR y fallo prematuro25, la media de MFI es una medida semicuantitativa y (al menos en algunos casos) está lejos de ser una estimación real del nivel de anticuerpos. El efecto prozona, un efecto común en pacientes hiperinmunizados, es un fenómeno por el que altas concentraciones de anticuerpos, potencialmente muy lesivas, quedan enmascaradas con bajos niveles de MFI; por otra parte, valores elevados de MFI no siempre indican un alto título de anticuerpo. La dilución del suero parece ser una estrategia fiable para definir un MFI más real26; no obstante, la relación de este ajuste con el resultado del trasplante está todavía por confirmarse.
Una segunda estrategia pretende definir el riesgo patológico de un anticuerpo sobre la base de su capacidad para fijar complemento. Esta estrategia asume como cierta la idea de que la activación del complemento es la principal vía de daño mediado por anticuerpos. La capacidad de activar complemento puede evaluarse in vitro a través de diversas modificaciones del ensayo SAB original, que permiten la detección de C1q, C4d o C3d27-29 unidos a los complejos antígeno-anticuerpo. La utilidad clínica de estos ensayos en el pretrasplante es discutida y los trabajos publicados hasta la fecha muestran controversia. Así, mientras algunos estudios no encuentran asociación entre la capacidad de fijar complemento de un anticuerpo y el riesgo de fallo prematuro30,31, otros sugieren que esta capacidad define mejor el riesgo de AMR32 y mejora la predicción de fallo renal33.
El trasplante con DSA debe contemplarse como una opción plausible para pacientes hiperinmunizados. Determinadas propiedades del anticuerpo, como el MFI y la capacidad de activar complemento, pueden ser útiles en la estratificación del riesgo inmunológico. Finalmente, la monitorización de DSA postrasplante es crucial en el correcto abordaje de este tipo de pacientes. Se recomienda una evaluación temprana (dentro de las primeras semanas del trasplante) del DSA y realizar controles histológicos (biopsias de protocolo). Modificaciones significativas en las propiedades del DSA (aumento de MFI o cambio en la capacidad de no activar a activar complemento) pueden reflejar un aumento del riesgo inmunológico. En caso de persistencia del DSA, en un contexto de estabilidad clínica, se recomiendan monitorizaciones regulares (cada 3-6 meses), evitando minimizar la inmunosupresión34.
ANTICUERPOS ESPECÍFICOS DE DONANTE DE NOVO
El desarrollo de novo de anticuerpos dirigidos frente a los antígenos HLA del aloinjerto juega un papel crucial en su evolución. Su aparición se asocia a fenómenos de rechazo y a una reducción significativa de la supervivencia del injerto35. Estos anticuerpos (DSA de novo) están preferentemente dirigidos frente a antígenos HLA de clase II (DR y DQ), y la no adherencia al tratamiento es uno de los principales factores de riesgo para su formación36. Además, el ambiente inflamatorio secundario a fenómenos de rechazo celular temprano, infecciones o a procesos quirúrgicos y traumatismos parece favorecer el desarrollo ulterior de estos anticuerpos37. Su aparición puede darse dentro de los 6 primeros meses o varios años después del trasplante36.
Dada su relevancia clínica, la presencia de DSA de novo se ha convertido en un biomarcador con un importante valor predictivo. Desde un punto de vista clínico, el interés de su monitorización radica en que su aparición antecede al fallo renal38. Se recomienda monitorizar los DSA de novo al menos una vez entre los primeros 3-12 meses postrasplante y continuar al menos con determinaciones anuales34. Ante cambios en el tratamiento inmunosupresor, sospecha de no adherencia al tratamiento o disfunción renal, se justifican monitorizaciones adicionales.
Finalmente, algunas propiedades de los DSA de novo, como la capacidad de fijar complemento o la composición relativa de subclases (IgG1-4), han resultado útiles en la definición del fenotipo de daño asociado y en la predicción del riesgo de fracaso precoz del injerto39-42.
EL PACIENTE SENSIBILIZADO ANTES DEL TRASPLANTE
Para los pacientes sensibilizados, la mejor opción terapéutica es recibir un injerto renal frente al que no presenten DSA, es decir, de un donante compatible. Pero encontrar un donante compatible supone alargar considerablemente el tiempo en lista de espera.
En la lista de espera, los pacientes sensibilizados se clasifican según el grado de incompatibilidad HLA, que se puede cuantificar numéricamente como la tasa de anticuerpos frente a un panel comercial in vitro (panel reactive antibodies, PRA) o bien como la tasa frente a una base de donantes locales o nacionales ante los cuales el paciente no es compatible (PRA calculado, cPRA). Así, para calcular el cPRA de la UNOS, se utilizan más de 14.000 donantes; el de Eurotransplant, 6.870 donantes; el de CTR, 1.700 donantes, y el del PATHI, 250 donantes43. El rango del PRA puede oscilar entre el 0 y el 100%. Existen calculadoras on line para calcular el PRA (https://www.etrl.org/Virtual%20 PRA/ y https://optn.transplant.hrsa.gov/resources/allocation-calculators/cpra-calculator/).
Los pacientes con PRA elevado (hipersensibilizados), generalmente por encima del 80%, tienen prioridad en la mayoría de las listas de espera de trasplante44 y generalmente forman parte de una lista exclusiva con un programa de intercambio de donantes regional, nacional o internacional cuando su PRA supera el 95-98%. Si el paciente dispone de un donante vivo pero frente al cual posee DSA, se puede incluir en un programa de intercambio de órganos para aumentar la probabilidad de encontrar un donante HLA compatible mediante la donación cruzada.
Otra estrategia puede ser recurrir a un donante HLA incompatible (HLAi) y aplicar un tratamiento de desensibilización (eliminando o disminuyendo el título de DSA) antes del trasplante. Hasta ahora, esto solo es posible con un donante vivo, ya que la desensibilización supone un tratamiento de varias semanas previas al trasplante. Generalmente se utiliza la combinación de plasmaféresis (para eliminar anticuerpos), rituximab (para evitar formación de nuevos anticuerpos) e inmunoglobulinas intravenosas45. El trasplante HLAi supone una supervivencia del paciente superior (el 76,5% a los 8 años) que prolongar el tiempo en lista de espera de un trasplante HLA compatible (el 62,9% de supervivencia a los 8 años)46. Este beneficio se obtiene incluso en los receptores con alto riesgo inmunológico (supervivencia a los 8 años de los pacientes con solo VXM positiva, el 89,2%; en aquellos con VXM y XM-CF positivas y XM-CDC negativa, el 76,3%, o incluso en aquellos con XM-CDC positiva, el 71%)46. Como inconvenientes, con esta estrategia los anticuerpos pueden volver a reaparecer con el tiempo, la tasa de AMR es elevada y la supervivencia a largo plazo de un paciente desensibilizado con HLAi es más corta47. Además, la reducción del título de anticuerpos no siempre se consigue y hasta en un 30% de los casos no es posible48.
Recientemente se ha publicado un nuevo protocolo de desensibilización basado en la capacidad de una enzima microbiana para degradar la IgG humana. Se trata de una proteasa producida por Streptococcus piogenes, con la propiedad de escindir la IgG por su región Fc. Por tanto, esta enzima (denominada IdeS) inactiva la IgG y, con ello, su capacidad de activar el complemento, bloqueando la respuesta humoral y la citotoxicidad mediada por anticuerpos. Además, la IdeS degrada los receptores de las células B circulantes, y así inhibe su respuesta. Una de las principales ventajas de esta técnica es que se puede utilizar con donantes fallecidos, porque se puede aplicar justo antes del trasplante.
En 2017, Jordan et al49 publicaron el primer ensayo clínico piloto de desensibilización con IdeS: en los 25 pacientes tratados desaparecieron los anticuerpos (anti-HLA) IgG, y solo se perdió 1 de los 25 injertos. Por contra, hubo 10 AMR (con buena respuesta al tratamiento) y se desconoce la evolución a medio o largo plazo de los trasplantes. Con más preguntas que respuestas, esta estrategia de desensibilización abre una nueva puerta al trasplante de los hiperinmunizados.
FRONTERAS EN LA INMUNOLOGÍA DEL TRASPLANTE
Aunque son muchos los avances que se viven en el campo de la inmunología del trasplante, algunos destacan especialmente por su potencial impacto en los próximos años: la selección donante-receptor basada en epítopos HLA y el desarrollo de tolerancia inmunológica mediante terapia celular.
Selección del donante-receptor basada en epítopos
Clásicamente, los anticuerpos (anti-HLA) se han considerado como específicos de un antígeno HLA. Sin embargo, los anticuerpos solo reconocen ciertas regiones dentro del antígeno HLA, que son las realmente inmunogénicas. Los anticuerpos se unen al antígeno HLA por 6 regiones específicas denominadas regiones determinantes de complementariedad (complementary-determining regions, CDR). El conjunto de los CDR de un anticuerpo se denomina paratopo. Los CDR se unen a zonas específicas del antígeno compuestas por unas secuencias peptídicas entre 10-25 residuos, denominadas epítopos. En los CDR y los epítopos reside la capacidad específica y la afinidad de unión antígeno-anticuerpo. Cada antígeno HLA presenta varios epítopos. Los epítopos pueden ser lineales (triplets), constituidos por un grupo de aminoácidos continuos en la secuencia de proteína, o conformacionales (eplets), que es lo más común, y en los que los aminoácidos quedan agrupados como consecuencia del plegamiento tridimensional del péptido50-52.
El siguiente paso es definir una lista completa de epítopos que sean dianas de los anticuerpos y que se puedan utilizar con fines clínicos. Se han identificado 110 epítopos de clase I y 78 de clase II (60 DR y 18 DQ)51,53. Hay epítopos cuya función es estructural y otros que son funcionales, que pueden tener a su vez un grado diferente de inmunogenicidad. Pero lo más interesante y el aspecto más novedoso es que un mismo epítopo puede estar presente en varios locus HLA: por ejemplo, el epítopo 82LR está presente en todos los antígenos de Bw4, y hay 5 epítopos compartidos entre los antígenos HLA-A, -B y -C53. Por tanto, la compatibilidad (matching) donante-receptor dependerá de la identidad entre los epítopos del donante y del receptor. Debido al gran número de epítopos, el inconveniente es que a la hora del trasplante el cruce se complica y se requiere un programa informático con algoritmos basados en inteligencia artificial. Hay disponible información interesante y programas sobre este tópico en la web de HLAMatchmaker en www.epitopes.net o en PIRCHE www.pirche.org54.
Varios estudios de cohortes han mostrado que la incompatibilidad (mismatch) de epítopos se asocia a la aparición de DSA de novo, al rechazo agudo y al desarrollo de glomerulopatía del trasplante50. En clínica ya se está aplicando el cruce con epítopos en un hospital pediátrico australiano, con buenos resultados y una baja tasa de sensibilización HLA55. En resumen, el cruce (HLA matching) que utiliza epítopos es superior al que usa antígenos HLA clásicos como predictor de los resultados del trasplante y promete ser especialmente interesante en pacientes hiperinmunizados.
Tolerancia inmunológica con células T reguladoras
La terapia inmunosupresora en el trasplante utilizando células T reguladoras persigue alcanzar la tolerancia inmunológica evitando el uso de los fármacos inmunosupresores. Consiste en aplicar células T reguladoras que inducen tolerancia al aloinjerto. Las células T inmunorreguladoras (CD4+CD25+FOXP3+) o Tregs han demostrado que son eficaces en prevenir la respuesta aloinmune en modelos animales y en algunos ensayos clínicos56.
Puesto que las Tregs constituyen el 5-10% de las células CD4 circulantes, conseguir una célula T reguladora natural dirigida frente a un antígeno específico es difícil y costoso. Sin embargo, ya es posible modificar en el laboratorio la especificidad de las células T frente a antígenos y expandirlas usando técnicas de manipulación genética con virus. Según qué tipo de gen se transfiera, pueden generarse 3 tipos de Tregs: las que expresan CAR específicos (cadena simple de antígenos quiméricos), para inhibir la vía directa de reconocimiento del aloantígeno, útil para evitar el rechazo celular; las transfectadas con TCR (receptores específicos de células T), para conferir aloespecificidad indirecta y así promover tolerancia, y las transfectadas con genes que codifican BAR (dominios antigénicos) frente a células B y que serían útiles para el rechazo humoral57. En la actualidad, la fuente más adecuada de células Tregs susceptibles de ser modificadas genéticamente para inducir tolerancia parece ser la de origen tímico. El grupo de Megan Levings en Canadá ha conseguido desarrollar Tregs específicas para HLA-A2 CAR humano (A2-CAR) y ha demostrado su eficacia en modelos animales58.
En clínica se han utilizado ya células Treg modificadas con buenos resultados en leucemia aguda de células B59. Además, hay en marcha ensayos clínicos con Tregs en patologías tan diversas como la enfermedad de Crohn, el lupus eritematoso, la esclerosis múltiple, la diabetes tipo 1, la hepatitis autoinmune y en los trasplantes de médula ósea, hepático y renal60. Aunque el futuro parece prometedor, el objetivo final de inducir la tolerancia del trasplante con células Tregs está todavía en fase clínica experimental.
CRITERIOS CON LOS QUE SE HA REALIZADO LA REVISIÓN
Búsqueda en PubMEd de las palabras clave: rechazo mediado por anticuerpos, sistema HLA, prueba cruzada virtual, C1q, MFI, citometría de flujo, PRA, trasplante renal, tolerancia inmunológica, epítopos, eplets, Tregs, CD4 CD25 FOXP3.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Conceptos clave
1. El elevado polimorfismo del sistema HLA y su capacidad para provocar respuestas aloespecíficas constituyen la base molecular del rechazo de órganos trasplantados.
2. La detección por ensayos en fase sólida (Luminex) de los anticuerpos anti-HLA ha permitido caracterizar sus propiedades y es fundamental para la valoración del riesgo inmunológico del paciente y del pronóstico del trasplante.
3. Los anticuerpos frente al donante pueden activar la cascada del complemento y/o la citotoxicidad mediada por células, provocando daño endotelial, que es la base del rechazo mediado por anticuerpos.
4. Los pacientes con anticuerpos específicos de donante requieren un abordaje especial para facilitar su acceso al trasplante; los programas de hiperinmunizados basados en pruebas cruzadas virtuales, la donación cruzada de vivo o los protocolos de desensibilización específicos son recursos disponibles para ellos.
5. La prueba cruzada basada en epítopos de HLA puede suponer un avance importante en la asignación de órganos en pacientes con alta tasa de anticuerpos anti-HLA y para evitar la inmunización postrasplante.
6. La terapia celular dirigida a conseguir la tolerancia inmunológica sin necesidad de fármacos, basada en células T reguladoras, es uno de los caminos futuros más prometedores en el trasplante.
Correspondencia:
María Luisa Agüera
Hospital Universitario Reina Sofía.
Avda. Menéndez Pidal, s/n. 14004 Córdoba.
marial.aguera.sspa@juntadeandalucia.es
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.