Las amiloidosis son un grupo de enfermedades multisistémicas causadas por depósitos de proteínas anómalas, que provocan disfunción de diferentes órganos. La afectación renal es frecuente y se manifiesta como proteinuria o insuficiencia renal. La artritis reumatoide es una poliartritis inflamatoria y puede estar acompañada de manifestaciones sistémicas. Presentamos el caso de una mujer de 70 años, con artritis reumatoide y tratamiento previo con sales de oro y antiinflamatorios no esteroideos, remitida a nefrología por síndrome nefrótico. Tras ser estudiada, y con la sospecha de amiloidosis secundaria a su artritis reumatoide, se realizó biopsia renal que halló una amiloidosis primaria. Existen escasos reportes de la asociación de la artritis reumatoide con la amiloidosis primaria, y se describen como asociaciones casuales. No obstante, se reporta con más frecuencia la asociación del síndrome Sjögren, cuya prevalencia es elevada en la artritis reumatoide, con amiloidosis primaria, lo que nos inclina a pensar que esta relación es algo más que una casualidad.
INTRODUCCIÓN
Las amiloidosis son un grupo de enfermedades que tienen en común el depósito tisular, localizado o sistémico, de proteína amiloide. Se clasifican en: amiloidosis primaria (AL: de cadenas ligeras), amiloidosis secundaria (AA: de amiloide A), amiloidosis relacionada con la diálisis (Ab2M: β2-microglobulina) y amiloidosis hereditarias por mutaciones en genes de ciertas proteínas séricas (transtiretina, apolipoproteína A1 u otras)1. La artritis reumatoide (AR) es una poliartritis inflamatoria crónica que afecta especialmente a articulaciones periféricas de forma simétrica. Se acompaña de manifestaciones sistémicas en aproximadamente un 65% de los casos, y la amiloidosis secundaria es la forma más frecuente de afectación renal (10-25%).
CASO CLÍNICO
Presentamos el caso de una mujer de 70 años, remitida a nuestra consulta desde reumatología por proteinuria de 1,3 g en 24 h.
Sus antecedentes personales incluían hipertensión arterial, dislipemia, osteoporosis y AR de 35 años de evolución, que había sido tratada con sales de oro, metotrexato, corticoides y antiinflamatorios. En el momento actual, la paciente estaba en tratamiento con leflunomida (200 mg/24 h) desde hacía 6 años, con aceptable control, felodipino y rosuvastatina. Como única manifestación clínica, la paciente refería edema ocasional en miembros inferiores. La exploración física era normal.
En el control analítico se constató: creatinina, 0,53 mg/dl; urea, 36 mg/dl; proteínas totales, 6 g/dl; albúmina, 3 g/dl; ionograma y perfil hepático normales. Metabolismo lipídico: colesterol, 228 mg/dl y LDL (lipoproteínas de baja densidad), 141 mg/dl. El sistemático de orina mostró proteinuria de 100 mg/dl sin microhematuria. Las determinaciones de inmunoglobulinas, C3, C4, autoinmunidad (ANA [anticuerpos antinucleares], ANCA [anticuerpos citoplasmáticos antineutrófilos]), crioglobulinas y serologías para el VHC (virus de la hepatitis C), el VHB (virus de la hepatitis B), el VIH (virus de la inmunodeficiencia humana) y Treponema pallidum fueron negativas. La ecografía renal mostró riñones de tamaño y morfología normales.
Durante el seguimiento, la paciente desarrolló un síndrome nefrótico con proteinuria de 4,8 g en 24 h, descenso de las proteínas totales hasta 5,4 g/dl e hipoalbuminemia de 2,5 g/dl, acompañado de aumento de edema en miembros inferiores, a pesar de que se le prescribió tratamiento con ARA II (antagonista del receptor de la angiotensina II), que hubo que retirar por hipotensión de la paciente.
Se realizó PAAF (punción aspiración con aguja fina) de grasa abdominal, que fue negativa para amiloide.
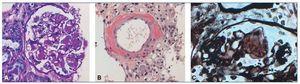
Con el diagnóstico de presunción de síndrome nefrótico secundario a amiloidosis AA por AR de largo tiempo de evolución, se realizó la biopsia renal (fig. 1), que mostró depósitos de amiloide. Pero el resultado posterior de la inmunohistoquímica, negativa para amiloide AA, descartó la amiloidosis secundaria, y la paciente fue diagnosticada de amiloidosis primaria.
Figura 1. Biopsia renal.
A) Técnica de PAS: glomérulo con material amorfo y acelular en el mesangio representando los depósitos de amiloide. B) Tinción de rojo Congo, que muestra unos depósitos rojizos compatibles con amiloide en capilar renal. Con luz polarizada se verá un intenso verde manzana. C) Técnica de platametenamina: engrosamiento y desflecamiento de las membranas basales de los glomérulos, que producen las típicas imágenes de spikes.
Al revisar los estudios, realizados previamente y cuyos resultados no estaban disponibles en el momento de la biopsia renal, se objetivó en el proteinograma sérico un componente monoclonal de cadenas ligeras lambda (9,23 mg/dl), con cadenas ligeras libres kappa de 3,24 mg/dl. En orina, tanto las cadenas ligeras kappa como la proteína de Bence Jones fueron negativas, con mínima elevación de cadenas ligeras lambda (0,9 mg/dl).
La paciente se remitió a la consulta de hematología, donde se le realizó una biopsia de medula ósea, que mostró un 2% de células plasmáticas patológicas, una resonancia magnética cardíaca, con ligero aumento del volumen extracelular compatible con depósito incipiente de amiloide, y una serie ósea, sin lesiones líticas.
Confirmado el diagnóstico de amiloidosis primaria, se inició tratamiento con ciclofosfamida 450 mg, bortezomib 2 mg y dexametasona 20 mg, con buena respuesta durante el seguimiento, negativización de las cadenas ligeras lambda y reducción de la proteinuria hasta 0,2 g/24 h. Se desestimó el trasplante autólogo de progenitores hematopoyéticos, dada la edad y la pluripatología de la paciente y la buena respuesta al tratamiento instaurado (fig. 2).
Figura 2. Evolución de la proteinuria y de las cadenas ligeras.
Bor: bortezomib; CTX: ciclofosfamida; Dex: dexametasona.
DISCUSIÓN
La AR es una enfermedad sistémica en la que predomina la afectación articular; cuando esta es grave puede existir afectación de otros órganos. Los efectos directos de la AR sobre el riñón son raros. La afectación renal como consecuencia del tratamiento medicamentoso es mucho más frecuente; así, tanto los antiinflamatorios no esteroideos (AINE) o las sales de oro, como la ciclosporina o los inhibidores del TNFa pueden producir lesión renal como la glomerulonefritis membranosa, la nefritis intersticial o, rara vez, la nefropatía de mínimos cambios. Además, en los pacientes con AR de largo tiempo de evolución no se puede descartar la existencia de AA, aunque hoy en día es relativamente rara, dada la efectividad de los tratamientos actuales en el control de la inflamación. Cuando aparece AA en pacientes con AR, la manifestación clínica más frecuente es la renal (59%), que cursa con proteinuria o deterioro de la función renal2. El desarrollo de AA en pacientes con AR ensombrece su pronóstico.
Presentamos el caso de una paciente con síndrome nefrótico y AR que había recibido tratamiento con AINE y sales de oro. Nuestra primera sospecha clínica era que el síndrome nefrótico estuviera en relación con la AR y se tratara de una amiloidosis secundaria. Otras posibilidades diagnósticas de patología glomerular en relación con la AR incluían la glomerulonefritis membranosa, la membranoproliferativa o la vasculitis, o que la afectación renal fuera secundaria a los tratamientos medicamentosos recibidos.
En adultos de entre 15 y 65 años, la causa más frecuente de síndrome nefrótico es la glomerulonefritis membranosa (24%), de mínimos cambios (16%), el lupus (14%), la glomerulonefritis focal y segmentaria (12%), la glomerulonefritis membranoproliferativa (7%), la amiloidosis (6%) y la nefropatía IgA (6%). En mayores de 65 años, como es el caso que nos ocupa, la prevalencia de amiloidosis aumenta al 17%3.
Ante la sospecha de amiloidosis, se aconseja la biopsia del tejido afectado, para confirmar la presencia de amiloide; preferiblemente, esta se inicia en el tejido más accesible. La biopsia de grasa subcutánea abdominal es segura, presenta una sensibilidad de entre el 72 y el 95% y se trata de una estrategia diagnóstica inicial razonable. Otra alternativa es la biopsia de tejido rectal. Si ambas resultan negativas, debe llevarse a cabo la biopsia del órgano presuntamente dañado, como en nuestro caso era el riñón3,4, si bien también se recomienda realizar detección de inmunoglobulinas monoclonales en suero, y de cadenas ligeras libres en suero y orina para excluir la presencia de AL. Nuestra sospecha de amiloidosis secundaria a AR justifica el hecho de que, ante el resultado de la PAAF de grasa subcutánea negativa, nos planteáramos realizar la biopsia renal de manera precoz sin esperar a tener el resultado del proteinograma, cadenas ligeras libres en sangre/orina y biopsia de médula ósea realizada posteriormente a la vista de los resultados. No obstante creemos que la indicación de la biopsia renal no es discutida, quizás sí lo sea su momento de realización, que estuvo condicionado por nuestra presunción diagnóstica inicial, ya que su sensibilidad en el diagnóstico de AL es superior al de médula ósea, y aportó información diagnóstica y pronóstica que ayudó a planificar mejor la estrategia terapéutica.
En la literatura científica hay varios casos descritos de pacientes con amiloidosis primaria que presentan síndromes de Sjögren, cuya prevalencia es elevada en los pacientes con AR. El síndrome de Sjögren es una enfermedad inflamatoria crónica, que se caracteriza por queratoconjuntivitis y xerostomía, resultado de la destrucción por infiltración linfoide de las glándulas exocrinas. Su etiología es, en la mayoría de las ocasiones, autoinmune. La amiloidosis primaria se debe considerar en el diagnóstico diferencial de pacientes con síndrome de Sjögren5-7.
Por otra parte, hay que tener en cuenta que los pacientes con amiloidosis primaria pueden presentar artropatía amiloidea, que suele afectar a las articulaciones proximales (hombros, rodillas, muñecas) y a las articulaciones pequeñas de las manos, de forma simétrica, pero sin rigidez matutina; en las pruebas radiológicas se evidencia la conservación o incluso ensanchamiento de los espacios interarticulares8,9.
En resumen, hay escasos reportes en los cuales se asocia la AR con la amiloidosis primaria y en la mayoría de las ocasiones se describe como una asociación casual10; con más frecuencia aparecen artículos que relacionan el síndrome Sjögren, cuya prevalencia es elevada en los pacientes con AR, con la existencia de amiloidosis primaria, lo que nos inclina a pensar que esta asociación es algo más que una casualidad. Por tanto, no debemos descartar, de inicio, la posibilidad de la existencia de amiloidosis primaria en pacientes con AR, en la que la artropatía amiloidea puede empeorar las manifestaciones clínicas articulares de la AR, y realizar un estudio completo de síndrome nefrótico11, independientemente de nuestra presunción diagnóstica inicial.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia: Anika Tyszkiewicz
Servicio de Nefrología.
Hospital Universitario de Salamanca.
Complejo Asistencial Universitario de Salamanca. Paseo de San Vicente, 58-182. 37007 Salamanca.
anika.tysz@yahoo.de
Revisión por expertos bajo la responsabilidad de la Sociedad Española de Nefrología.