La nefropatía IgA (NIgA) es la enfermedad glomerular primaria más frecuente en todo el mundo. Las variables clínicas más frecuentemente relacionadas con riesgo de desarrollo de enfermedad renal terminal (ERT) para la NIgA son el grado de proteinuria, el filtrado glomerular reducido de partida y la presencia de hipertensión arterial1. Dada la gran variedad de lesiones histológicas mostradas en la NIgA, se homogeneizó su descripción y se buscaron variables que tuvieran significado pronóstico para el deterioro renal, desarrollando la clasificación de Oxford2,3, que ha sido validada en diversos estudios3,4. Demostrar la eficacia de alguna medida terapéutica en la NIgA es muy difícil dada la lenta evolución de la enfermedad y la necesidad de un tiempo muy largo de seguimiento. El uso de esteroides se recomienda en casos con proteinuria >1g/día y filtrado glomerular >50ml/min/1,73m2, aunque también se ha observado respuestas positivas con filtrados glomerulares inferiores5, logrando una mejor preservación de la función renal, reducción de proteinuria y de la microhematuria5–7, aunque con frecuentes efectos adversos6,8. La respuesta a esteroides parece ser mayor en pacientes con proliferación mesangial y endocapilar, con glomeruloesclerosis e incluso con fibrosis tubulointersticial5, aunque el pronóstico no está claro en relación con la clasificación de Oxford.
Nuestro objetivo en este estudio fue revisar la respuesta a corto plazo de la función renal y de la proteinuria de pacientes con NIgA que fueron tratados con corticoides, teniendo en cuenta los parámetros histológicos de la clasificación de Oxford. Revisamos pacientes que hubieran recibido tratamiento con corticoides durante un mínimo de 6 meses. El estudio incluyó a 33 pacientes con 41±13 años, con 23 varones (69,7%) y 73,2±12,4kg de peso. Tomando IECA había 19 pacientes, 7 con ARA2 y 7 con doble bloqueo. Todos llevaban con este tratamiento al menos 6 meses antes de iniciar tratamiento esteroideo (media de tratamiento 14 meses). Empleamos prednisona a dosis inicial de 40-80mg/día (<1mg/kg/día) durante 2-3 semanas con descenso gradual posterior de 10mg/cada 2-3 semanas hasta llegar a 10mg/día como tratamiento de mantenimiento durante 6 meses. Si la proteinuria había descendido <250mg/día antes de los 6 meses, se procedía a reducirla hasta suspenderla en 3 meses. La dosis inicial de prednisona fue de 57±6mg/día (mediana 60) y de 0,8±0,1mg/kg/día. En 6 pacientes asociamos ciclofosfamida (50mg/día en uno, 100mg/día en 4 y 125mg/día en uno) durante un máximo de 6 meses. La prevalencia de las variables de Oxford fueron: M1 63,6%; E1 42,4%; S1 45,5%; T0 39,4%, T1 45,5% y T2 3%; C 27,3%.
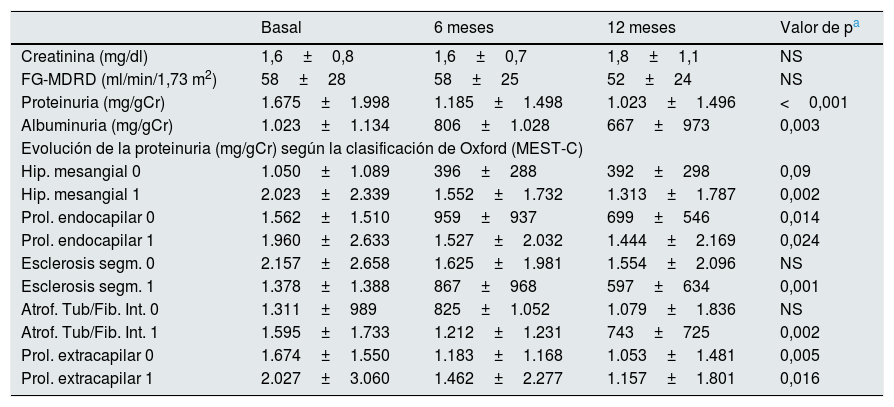
En la evolución observamos un descenso significativo de la proteinuria y de la albuminuria a los 6 y 12 meses, sin observar cambios significativos en la función renal (tabla 1). La proteinuria descendió en el 72,7% de los pacientes a los 6 meses y en el 81,8% a los 12 meses. La mediana de reducción de proteinuria fue del 40% a los 6 meses y del 45,8% a los 12 meses.
Evolución de la función renal y de la proteinuria y albuminuria tras el tratamiento con prednisona en pacientes con nefropatía IgA
| Basal | 6 meses | 12 meses | Valor de pa | |
|---|---|---|---|---|
| Creatinina (mg/dl) | 1,6±0,8 | 1,6±0,7 | 1,8±1,1 | NS |
| FG-MDRD (ml/min/1,73 m2) | 58±28 | 58±25 | 52±24 | NS |
| Proteinuria (mg/gCr) | 1.675±1.998 | 1.185±1.498 | 1.023±1.496 | <0,001 |
| Albuminuria (mg/gCr) | 1.023±1.134 | 806±1.028 | 667±973 | 0,003 |
| Evolución de la proteinuria (mg/gCr) según la clasificación de Oxford (MEST-C) | ||||
| Hip. mesangial 0 | 1.050±1.089 | 396±288 | 392±298 | 0,09 |
| Hip. mesangial 1 | 2.023±2.339 | 1.552±1.732 | 1.313±1.787 | 0,002 |
| Prol. endocapilar 0 | 1.562±1.510 | 959±937 | 699±546 | 0,014 |
| Prol. endocapilar 1 | 1.960±2.633 | 1.527±2.032 | 1.444±2.169 | 0,024 |
| Esclerosis segm. 0 | 2.157±2.658 | 1.625±1.981 | 1.554±2.096 | NS |
| Esclerosis segm. 1 | 1.378±1.388 | 867±968 | 597±634 | 0,001 |
| Atrof. Tub/Fib. Int. 0 | 1.311±989 | 825±1.052 | 1.079±1.836 | NS |
| Atrof. Tub/Fib. Int. 1 | 1.595±1.733 | 1.212±1.231 | 743±725 | 0,002 |
| Prol. extracapilar 0 | 1.674±1.550 | 1.183±1.168 | 1.053±1.481 | 0,005 |
| Prol. extracapilar 1 | 2.027±3.060 | 1.462±2.277 | 1.157±1.801 | 0,016 |
Se observa globalmente un descenso significativo de la proteinuria y albuminuria a los 6 y 12 meses del tratamiento, sin cambios significativos en la función renal. Al estratificar según parámetros histológicos de la clasificación de Oxford observamos un descenso de la proteinuria en cada estrato de los parámetros de la clasificación de Oxford.
NS: no significativo.
En la tabla 1 se muestra la evolución de la proteinuria según los parámetros MEST-C de la clasificación de Oxford. La proteinuria basal fue mayor en pacientes con hiperplasia mesangial, con proliferación endocapilar, con atrofia tubular/fibrosis intersticial y con proliferación extracapilar, aunque no alcanzó significación estadística. En la evolución observamos reducción de los niveles de proteinuria de forma general, en prácticamente todos los estratos considerados de la escala MEST-C. La presencia de hialinosis arteriolar, hiperplasia muscular o de proliferación intimal arterial no mostraron influencia.
En algunos estudios se observa una peor respuesta al tratamiento en casos con proliferación mesangial M1, esclerosis segmentaria S1 y atrofia tubular T1/T29. Pero en otras publicaciones el empleo de corticoides mostró reducción de la proteinuria y del ritmo de progresión del deterioro renal en cuantía similar en ambos estratos de las variables de la clasificación de Oxford5. En nuestro caso a pesar de presentar mayor proteinuria y peor función renal inicial en las categorías 1 frente a la 0 de las variables MEST-C, hemos observado reducción de la proteinuria en todos los estratos estudiados. Cuando se repiten biopsias renales tras tratamiento se observa mejoría de todos los parámetros proliferativos y de los cambios de fibrosis y atrofia tubular cuando se emplean corticoides10, lo que podría explicar la falta de relación con los parámetros basales histológicos de la clasificación de Oxford.
Por tanto, en pacientes con NIgA el tratamiento con esteroides puede producir una reducción de la proteinuria con independencia de las características MEST-C. Faltan estudios que aclaren el grado de respuesta esperable tras el uso de esteroides sobre el deterioro del filtrado glomerular teniendo en cuenta cada variable pronóstica de la clasificación MEST-C.