ENFERMEDAD RENAL CRÓNICA (ERC) EN DM
La diabetes mellitus (DM) y la enfermedad renal crónica (ERC) representan dos de los principales problemas de salud pública, tanto por su elevada prevalencia, como por su importante morbimortalidad cardiovascular. La diabetes es actualmente la causa más frecuente de enfermedad renal terminal, representando el 20-40% de los nuevos casos y la ERC representa una de las complicaciones más graves de la DM1.
La nefropatía diabética es el conjunto de lesiones renales características de la diabetes, clínicamente caracterizada por albuminuria, elevación de la presión arterial y descenso progresivo del filtrado glomerular. Desde hace años se conoce la estrecha relación entre nefropatía y retinopatía diabéticas, pero sólo recientemente se conoce el elevadísimo riesgo de enfermedad cardiovascular que presentan los pacientes con cualquier grado de nefropatía diabética2.
En la diabetes tipo 1, la incidencia se incrementa a partir del 5º año del diagnóstico, siendo máxima de 5 a 15 años después del diagnóstico. A partir de aquí, existe un descenso gradual de la incidencia. En la diabetes tipo 2, la evolución natural de la nefropatía diabética se encuentra peor caracterizada, debido al inicio indeterminado de la enfermedad. En general, afecta al 40% de DM tipo 1 con más de 20 años de evolución y al 10-25% de DM tipo 2.
La microalbuminuria es el indicador más importante de fallo renal tanto en los diabéticos tipo 1 como los del tipo 2 y es el primer signo de nefropatía incipiente. El mecanismo etiopatogénico fundamental de la nefropatía diabética es la hiperglucemia. Aunque existen otros factores familiares y ambientales interrelacionados, aparece casi siempre en pacientes con DM de largo tiempo de evolución y con mal control metabólico.
Por todo ello, se hace necesario implementar estrategias para lograr el mejor control metabólico en todo paciente diabético, con o sin ERC, ya que un status euglucémico mantenido es el mejor método para prevenir y/o enlentecer la evolución progresiva de la ERC, además de actuar sobre otros factores de progresión de la nefropatía diabética como la hipertensión arterial, albuminuria, tabaquismo y sobrepeso.
CONTROL METABÓLICO EN ENFERMEDAD RENAL CRÓNICA
1) ANTIDIABÉTICOS ORALES (ADOS)
a. Perfil de acción de ADOS
Los objetivos de control son mantener cifras de HbA1c < 7%. El tratamiento con estos fármacos debe iniciarse cuando no se alcanzan o no puedan mantenerse los objetivos de control metabólico con la dietoterapia y los cambios en el estilo de vida. De acuerdo con el Consenso de 20083, se debe iniciar desde el momento del diagnóstico el tratamiento con metformina (a no ser que esté contraindicada). Los cambios en el tratamiento deben ser precoces para prevenir o retrasar las complicaciones, instaurando de forma precoz el tratamiento combinado.
Los antidiabéticos orales se clasifican en:
¿ Fármacos insulinosecretores (secretagogos de insulina): sulfonilureas, meglitinidas (repaglinida, nateglinida).
¿ Fármacos potenciadores de incretinas o inhibidores de dipeptidilpeptidasa IV (sitagliptina, vildagliptina).
¿ Fármacos que estimulan la acción periférica de la insulina: biguanidas, glitazonas.
¿ Fármacos que inhiben las α-glucosidasas a nivel intestinal (retardan la absorción de glucosa): acarbosa, miglitol.
a.1.- Secretagogos de insulina
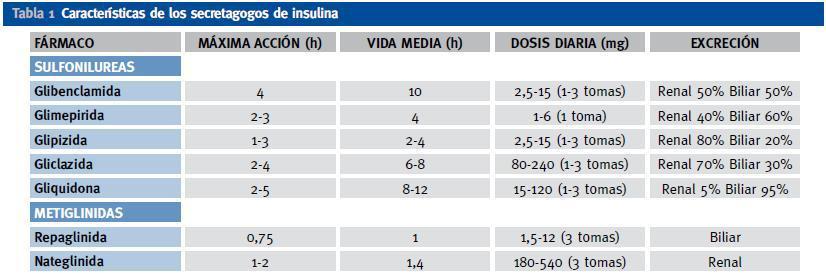
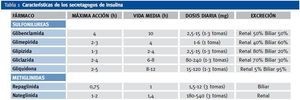
Son fármacos capaces de estimular a las células β para que aumenten su secreción endógena de insulina. Pueden estimular directamente la secreción de insulina o aumentar su respuesta secretora frente a nutrientes como la glucosa. Existen dos clases de secretagogos de insulina: sulfonilureas y meglitinidas. Las sulfonilureas están contraindicadas en caso de insuficiencia renal moderada, excepto la gliquidona que por su eliminación biliar puede usarse en caso de enfermedad renal crónica con aclaramiento de creatinina < 50-60 ml/min/m2. Sus principales efectos secundarios son las hipoglucemias y el aumento de peso. La eliminación de repaglinida es principalmente biliar, lo que puede hacerla útil en cualquier estadío de ERC, debiéndose administrar antes de las comidas principales. En la tabla 1 aparecen los principales secretagogos.
a.2.- Potenciadores de incretinas:
Sitagliptina y vildagliptina.
Un nuevo grupo de fármacos potencia la acción de las incretinas al inhibir la enzima dipeptidilpeptidasa IV (DPP-IV), que degrada al GLP -1 (péptido similar al glucagón), con lo que se produce una secreción fisiológica de la insulina mediada por la ingesta y una inhibición del exceso de glucagón. Los potenciadotes de incretinas (sitagliptina, vildagliptina) en la actualidad sólo se pueden utilizar en ERC leve (aclaramiento de creatinina > 60 ml/min/m2), aunque hay estudios clínicos en marcha para su aprobación en casos de ERC moderada o grave.
a.3.- Biguanidas
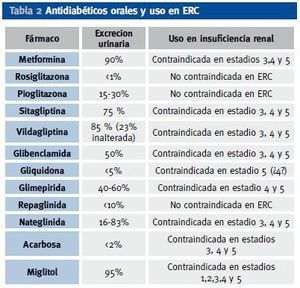
El mecanismo de acción principal de las biguanidas es la reducción de la producción hepática de glucosa mediante la disminución de la neoglucogénesis hepática, aunque también aumenta la captación de glucosa en la célula muscular. La metformina es la única biguanida utilizada en la actualidad. No se metaboliza en el hígado y su eliminación es renal, por lo que está contraindicada en pacientes con aclaramiento de creatinina < 60 ml/min/m2.
a.4.- Glitazonas
El grupo de las glitazonas está constituido por rosiglitazona y pioglitazona. Su principal mecanismo de acción es en el músculo y tejido graso, aumentando la captación y uso de la glucosa en los tejidos. También disminuyen, aunque en menor medida, la neoglucogénesis y la síntesis de ácidos grasos a nivel hepático. Se metabolizan en hígado y se excretan por heces, por lo que pueden utilizarse en cualquier estadío de ERC. Están indicadas en tratamiento combinado con sulfonilureas o metformina y pioglitazona también en combinación con insulina. En monoterapia sólo están indicadas si el tratamiento con metformina está contraindicado (en caso de ERC moderada o grave) o presencia de intolerancia a la metformina. Están contraindicadas en caso de insuficiencia cardíaca o hepática y hay que tener presente la posibilidad de aumento de fracturas distales en mujeres y el seguimiento de la cardiopatía isquémica en pacientes tratados con rosiglitazona.
a.5.- Inhibidores de α-glucosidasas
Los inhibidores de α-glucosidasas está constituidos por miglitol y acarbosa e inhiben de forma competitiva y reversible las alfaglucosidasas de las microvellosidades intestinales, retrasando la absorción de los hidratos de carbono complejos y disminuyendo el pico glucémico posprandial. En monoterapia no producen incremento de peso ni hipoglucemia. Están contraindicados en ERC moderada-grave.
b. ADOS en ERC en pacientes no en diálisis
La disminución del consumo de proteínas a 0,8-1 g/kg de peso corporal/día en individuos con diabetes y en los primeros estadíos de ERC, y a 0,8 g/kg/día en los últimos estadíos de ERC, puede mejorar las condiciones de función renal (excreción urinaria de albúmina, tasa de filtrado glomerular) y está recomendada en las modificaciones de la dieta del diabético con ERC con un grado de evidencia B4.
De acuerdo con el Consenso de 20083, se debe iniciar desde el momento del diagnóstico, junto a las modificaciones del estilo de vida, el tratamiento con metformina, pero esta biguanida clásicamente está contraindicada en los estadíos 3,4 y 5 de ERC (contraindicación por riesgo de acidosis láctica si creatinina ≥ 1,5 mg/dl en hombres o creatinina ≥ 1,4 mg/dl en mujeres o si aclaramiento de creatinina < 60 ml/min/m2). En recientes trabajos se considera que su uso es seguro en caso de aclaramientos de creatinina > 30 ml/min/m2, por lo que la podríamos usar en el estadío 3 de ERC5. En la actualidad se está replanteando algunas de las contraindicaciones del uso de metformina, debido a la baja incidencia de acidosis láctica, a pesar de no respetarse en ocasiones las contraindicaciones para su utilización y al gran número de pacientes a los que se les prescribe6.
En el grupo de sulfonilureas (secretagogos clásicos) debe evitarse su uso en pacientes con ERC avanzada (estadios 4 y 5). En ERC leve (estadio 3), pueden utilizarse, siendo de elección la gliquidona, y en segundo lugar glipizida y glimepirida.
Dentro de los fármacos secretagogos el más utilizado en pacientes con ERC es la repaglinida. La repaglinida se elimina principalmente por la bilis y, por lo tanto, la excreción no se modifica en presencia de ERC y no es necesario ajustar las dosis. Solo el 8% de la dosis administrada se elimina por vía renal7. Está contraindicada su utilización junto con el gemfibrozilo, por la posibilidad de aumento del número de hipoglucemias si no se ajusta la dosis de repaglinida. Por el contrario, la nateglinida tiene un metabolismo hepático con la formación de numerosos metabolitos activos, que se elimina por vía renal. Debe contraindicarse la nateglinida en pacientes con ERC estadios 3, 4 y 58.
El grupo de inhibidores de α-glucosidasas tienen escasa potencia hipoglucemiante. La acarbosa prácticamente no se absorbe. El miglitol se absorbe bien, no se metaboliza y se elimina por vía renal con una semivida de 2-3 horas. Sus concentraciones plasmáticas aumentan en pacientes con insuficiencia renal, por lo que el miglitol está contraindicado en caso de ERC.
El grupo de glitazonas se puede utilizar en cualquier estadío de ERC, aunque en caso de ERC grave hay que tener precaución por la posibilidad de efectos adversos (aumento de peso, edema, agravamiento de insuficiencia cardíaca). No se precisa ajuste de dosis en enfermos con ERC leve o moderada. Se dispone de datos limitados de rosiglitazona en pacientes con ERC grave (aclaramiento de creatinina < 30 ml/min), por tanto rosiglitazona debe utilizarse con precaución en estos pacientes, aunque no se ha observado ninguna diferencia clínicamente significativa en la farmacocinética de la rosiglitazona entre los enfermos con insuficiencia renal o enfermedad renal terminal en régimen de diálisis crónica. En pacientes con ERC, las concentraciones plasmáticas de pioglitazona y sus metabolitos son menores que las observadas en individuos con la función renal normal. Sin embargo, el aclaramiento de la sustancia original es similar. Por tanto, la concentración de pioglitazona libre permanece inalterada, por lo que su uso no está contraindicado en pacientes con ERC. Tanto rosiglitazona como pioglitazona, en casos de ERC leve o moderada (ClCr entre 30-90 ml/minuto), pueden producir alguna retención de líquidos, por lo que se recomienda vigilar más estrechamente a los pacientes que puedan presentar insuficiencia cardiaca, así como asegurar el tratamiento diurético cuando sean utilizados dichos fármacos.
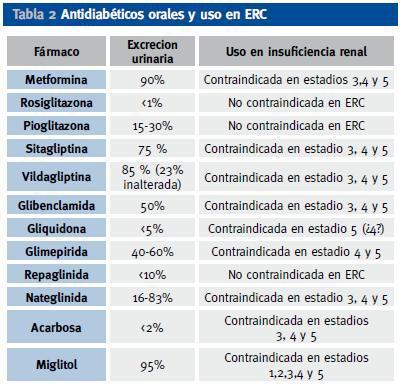
En la tabla 2 aparecen los antidiabéticos más usados y su excreción renal. Recientemente ha aparecido un nuevo grupo terapéutico que actúa inhibiendo a la enzima DPP -IV, con lo cual se incrementa el GLP-1 (incretina que se incrementa con la ingesta y favorece la secreción de insulina e inhibe el exceso de glucagón de los diabéticos tipo 2 tras las comidas). La posibilidad de hipoglucemia se minimiza con los potenciadores de incretinas, ya que su acción se produce ante la ingesta de alimentos y la posterior hiperglucemia, y en situación de hipoglucemia no se produce ese incremento de GLP-1. Este nuevo grupo terapéutico está autorizado su uso en caso de ERC leve, con aclaramientos de creatinina > 60 ml/min/m2, aunque como su eliminación renal inalterada es baja (Tabla 2), se están realizando ensayos para su posible indicación en fases más avanzadas (estadíos 4 y 5) de ERC9.
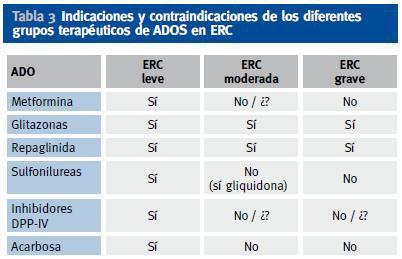
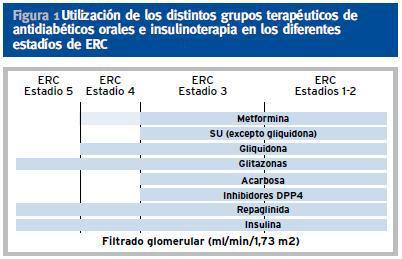
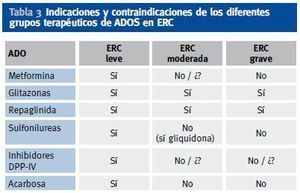
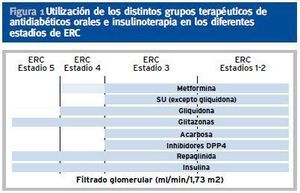
En caso de ERC con aclaramiento de creatinina < 30-60 ml/min/m2 se puede usar la combinación de repaglinida (que mejora la secreción de insulina, en caso de que persista reserva insulínica) con glitazona (que mejora la sensibilidad a la insulina). En la tabla 3 aparecen las indicaciones y contraindicaciones de los distintos grupos de ADOS en diferentes estadíos de ERC (figura 1).
2) PARTICULARIDADES DEL TRATAMIENTO DE LA HIPERGLUCEMIA EN PACIENTES EN DIÁLISIS
Ademas de la resistencia a la insulina que presentan los pacientes con ERC, a medida que el filtrado glomerular es menor, especialmente en la ERC avanzada, existe una menor degradación de la insulina. En dicha situación el paciente percibe que requiere menos dosis de ADOS llegando en ocasiones a suspenderlos transitoriamente por alargamiento de la vida de la insulina endógena, o se reducen las dosis habituales de insulina. Por dicho motivo el paciente se resiste con frecuencia a la insulinización si recibía ADOS. En el caso de recibir insulina puede percibir una falsa sensación de mejoría del tratamiento de la hiperglucemia.
Las sulfonilureas deben evitarse en los pacientes en hemodiálisis. Se unen fuertemente a la albúmina y por ello los niveles elevados del fármaco no se pueden eliminar con hemodiálisis. Además, la administración simultánea de betabloqueantes, aspirina, dicumarínicos aumentan la proporción de fármaco libre en sangre y puede producir hipoglucemia grave. Esta situación es menos acusada con algunos ADOS (glipizida o glimepirida). No obstante no se recomienda su administración en hemodiálisis.
Las glitazonas se asocian a alto riesgo de edema e insuficiencia cardiaca, siendo mayor a medida que el filtrado glomerular es menor. Por ello se desaconseja su uso en pacientes en diálisis, aunque pueda usarse en pacientes con ERC avanzada. La repaglinida, al tener un metabolismo hepático puede utilizarse en estos pacientes, aunque con mucha precaución por el alto riesgo de hipoglucemia. Se debe iniciar tratamiento con la mínima dosis (0,5 mg) y monitorizar cuidadosamente la dosis. Con todas estas limitaciones de los ADOS, la insulinoterapìa es el tratamiento de elección en el paciente en diálisis, tanto hemodiálisis como diálisis peritoneal.
3) INSULINO TERAPIA
a. Ajustes de dosis de insulina en el paciente con insuficiencia renal crónica sin diálisis
La insuficiencia renal crónica se asocia a un descenso del catabolismo renal de la insulina. Por ello, los niveles de glucemia de los pacientes diabéticos con insuficiencia renal en tratamiento insulínico se deben monitorizar de forma estrecha y realizar ajustes en la dosificación de forma individual. No obstante, se han establecido determinadas recomendaciones generales para la dosificación de la insulina en estos pacientes10;11:
¿ No se precisa ajuste de dosis si el filtrado glomerular renal (FGR) es superior a 50 mL/min.
¿ La dosis de insulina se debe reducir un 25% cuando el FGR se encuentra entre 10 y 50 mL/min.
¿ La dosis se debe reducir un 50% cuando el FGR es inferior a 10 mL/min.
b. Pautas de insulina subcutánea en pacientes en diálisis
Cuando el paciente inicia diálisis, con la corrección de la uremia mejora parcialmente la resistencia a la insulina y se aumenta la degradación de la misma. Por ello los requerimientos insulínicos en cada paciente dependen del balance entre mejoría de la sensibilidad a la insulina y restauración del metabolismo hepático de la insulina.
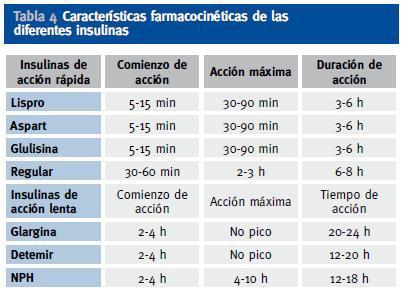
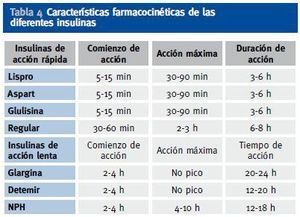
Se pueden utilizar, al igual que en el paciente diabético sin insuficiencia renal, diversos regímenes de insulinoterapia, como insulina premezclada 2-3 veces al día, o pautas basalbolus (insulina de acción lenta junto con insulina de acción rápida antes de las principales ingestas)12;13. Aunque no existe una pauta única recomendada para estos pacientes11, son especialmente recomendables en estos pacientes los análogos de insulina frente a las insulinas humanas, puesto que los análogos han demostrado menor frecuencia de hipoglucemias. Por ello, se prefieren los análogos basales (glargina 1 vez al día o detemir 1-2 veces al día) frente a la insulina NPH, y los análogos de acción rápida (lispro, aspart y glulisina) frente a la insulina regular (Tabla 4).
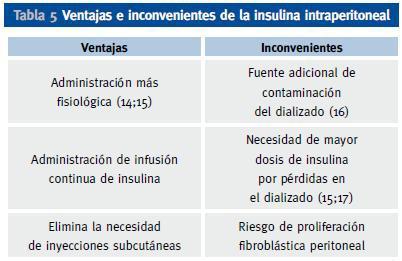
c. Insulina intraperitoneal en pacientes en diálisis peritoneal
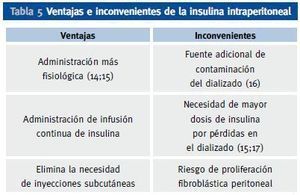
En los pacientes diabéticos se recomienda utilizar soluciones de líquido peritoneal con bajo contenido de glucosa o con liquidos sin glucosa, como los basados en aminoácidos o polímeros de la glucosa. La administración de insulina se puede hacer por la vía subcutánea clásica o por vía intraperitoneal, introduciendo la insulina en las bolsas de diálisis peritoneal justamente antes de la infusión en peritoneo. Si solo se utiliza la vía subcutánea, la administración de la misma debe repartirse en 2 dosis de insulina premezclada, 1 o 2 dosis de las nuevas insulinas basales lentas e incluso algunos pacientes se manejan aceptablemente con 3 dosis de insulina regular en relación con las comidas. La vía intraperitoneal, presenta ventajas e inconvenientes respecto a la vía subcutánea (tabla 5), pero permite un excelente control de la glucemia y por ello suele ser la mejor opción para dicho tratamiento en la mayoría de los pacientes, pero especialmente en aquellos mas disciplinados, autosuficientes y con gran motivación. Esta ruta de administración es más fisiológica que la subcutánea, pues la insulina se absorbe directamente a vena porta como ocurre en personas no diabéticas con la insulina endógena, reduciendo los efectos secundarios derivados de la absorción de la insulina directamente a circulación sistémica. Se debe utilizar siempre insulina rápida y hacer la administración en las bolsas en el momento previo a la infusión, haciendo coincidir el horario de los intercambios de bolsa con las comidas principales. Se precisan agujas relativamente largas (3,8 cm) para asegurar que se inyecta la dosis total en la bolsa de la solución de diálisis. Esta bolsa se debe invertir en varias ocasiones tras la inyección para asegurar una adecuada mezcla.
Se han propuesto diversos algoritmos de administración de diálisis peritoneal continua ambulatoria (DPCA)17;18. Uno de ellos es el protocolo de Toronto Western, con 4 recambios de 2 litros diarios19. Los primeros 3 recambios se realizan 20 minutos antes de las principales comidas y el cuarto al acostarse. La glucemia se mide en ayunas y una hora después de cada comida principal. La glucemia en ayunas traduce el efecto de la insulina nocturna, mientras que los valores postprandiales reflejan la insulina añadida a la solución de diálisis utilizada antes de cada ingesta. El primer día, se administra la cuarta parte de la dosis subcutánea total diaria en forma de insulina regular en cada uno de los 4 recambios. Esta insulina sirve para metabolizar la ingesta de carbohidratos. Se añade un suplemento de insulina en cada bolsa para metabolizar la glucosa absorbida desde la solución de diálisis: 2 unidades por cada 2 litros de recambio si la solución de diálisis es glucosa al 1,5%, 4 unidades si es glucosa al 2,5% y 6 unidades si es glucosa al 4,25%. El segundo día, se ajusta la dosis de insulina según los niveles de glucemia del día anterior. Esta dosis también precisa ajustarse en función de la ingesta de hidratos de carbono y de la actividad física. Se debe tener presente que los pacientes insulin-deficientes (diabetes tipo 1, diabetes tipo 2 de larga evolución) precisan la utilización de insulina basal para evitar el desarrollo de cetoacidosis, por lo que en estos pacientes, y en todos aquellos en los que no se logre un buen control exclusivamente con insulina regular intraperitoneal, sería más adecuado combinar el uso de insulina regular intraperitoneal en los recambios realizados antes de las ingestas, eliminando la insulina del recambio nocturno, con el uso de insulina basal administrada mediante pluma o jeringuilla de forma subcutánea (glargina o detemir).
En general, en la administración de insulina intraperitoneal se precisan dosis bastante elevadas de insulina rápida, que suelen ser 3,5 veces la cantidad de insulina retardada que el paciente utilizaba por vía subcutánea previamente a comenzar diálisis peritoneal20. Ello es debido a la degradación de insulina por el hígado, a la cantidad de insulina que se necesita para metabolizar el contenido de glucosa de las bolsas de diálisis peritoneal y a la retención de insulina en el material plástico de la bolsa.
Una parte considerable de la insulina introducida en las bolsas de diálisis queda retenida en el material plástico de las bolsas y de las vías, con lo que solo un 35% de lo administrado entra en la cavidad peritoneal21. Además, no toda la insulina que por fin entra en el peritoneo es utilizada, sino que una parte queda en el dializado y sale con el drenaje del líquido.
En el caso de técnicas de diálisis automática (diálisis peritoneal continua con cicladora o diálisis peritoneal intermitente nocturna), en las cuales la mayoría de la diálisis ocurre por la noche, la dosis intraperitoneal se debe añadir como insulina regular en cualquiera de los recipientes de diálisis asociados a la cicladora, y su administración proporciona cobertura basal durante la noche. La cantidad inicial debe ser la dosis total de insulina subcutánea previa, ajustando posteriormente en función de la glucemia basal. En estos casos, se precisa con frecuencia insulina de acción rápida administrada de forma subcutánea para metabolizar los carbohidratos de la ingesta. La dosis total de insulina suele ser menor en la tecnicas de diálisis peritoneal automatizada que en la DPC A por ser mas corta la permanencia de los intercambios. En diálisis peritoneal nocturna con día seco se necesita añadir alguna dosis por vía subcutánea durante el día y en cualquier técnica de diálisis peritoneal automatizada, la combinación de las dos vías de administración puede ser necesaria, con el 50% de la cantidad total en los intercambios nocturnos y otro 50% en la bolsa diurna22.
Las recomendaciones previas asumen que la cinética de transferencia peritoneal es normal. Sin embargo, los pacientes diabéticos con DPCA y mal control glucémico deberían someterse a un test del equilibrio peritoneal. Los pacientes ¿altos transportadores¿ presentan una absorción más rápida de la glucosa peritoneal, y por ello la carga glucémica puede ser elevada y responsable del mal control glucémico. Además de subir la glucemia, la absorción rápida de glucosa reduce el gradiente osmótico entre el dializado y la sangre, lo que se traduce en una ultrafiltración disminuida, con menor eliminación de urea y mayor retención de fluidos. El edema generalizado requiere el uso frecuente de soluciones de glucosa al 2,5 y al 4,25%, lo que aumenta a su vez la hiperglucemia, estableciéndose así un círculo vicioso. Estos pacientes se benefician habitualmente de cambiar a diálisis peritoneal nocturna15;23.
Otro problema es que la absorción de insulina puede variar significativamente entre pacientes o reducirse con el tiempo en un mismo individuo debido a alteraciones adquiridas en la membrana peritoneal24.
PUNTOS CLAVE
1. Se hace necesario implementar estrategias para lograr el mejor control metabólico en todo paciente diabético, con o sin ERC, ya que un status euglucémico mantenido es el mejor método para prevenir y/o enlentecer la evolución progresiva de la ERC.
2. La disminución del consumo de proteínas a 0,8-1 g/kg de peso corporal/día en individuos con diabetes y en los primeros estadíos de ERC, y a 0,8 g/kg/día en los últimos estadíos de ERC, puede mejorar las condiciones de función renal.
3. La metformina clásicamente está contraindicada en los estadíos 3,4 y 5 de ERC (contraindicación por riesgo de acidosis láctica si creatinina ≥ 1,5 mg/dl en hombres o creatinina ≥ 1,4 mg/dl en mujeres o si aclaramiento de creatinina < 60 ml/min/m2). En recientes trabajos se considera que su uso es seguro en caso de aclaramientos de creatinina > 30 ml/min/m2. En la actualidad se está replanteando algunas de las contraindicaciones del uso de metformina.
4. En caso de ERC con aclaramiento de creatinina < 30-60 ml/min/m2 se puede usar la combinación de repaglinida (que mejora la secreción de insulina, en caso de que persista reserva insulínica) con glitazona (que mejora la sensibilidad a la insulina).
5. La insuficiencia renal crónica se asocia a menor catabolismo de la insulina, por lo que los pacientes diabéticos en tratamiento insulínico con insuficiencia renal pre-diálisis suelen requerir una reducción de su dosis de insulina.
6. Una vez el paciente entra en diálisis, la dosis de insulina puede aumentar o disminuir en función de cada paciente.
7. Los análogos de insulina de acción lenta (glargina y detemir) y rápida (lispro, aspart, glulisina) presentan menos frecuencia de hipoglucemias que las insulinas humanas (NPH y regular).
8. En los pacientes en hemodiálisis y diálisis peritoneal el tratamiento de la hiperglucemia debe basarse en las medidas generales y tratamiento con insulina.
9. Los pacientes diabéticos en tratamiento insulínico en tratamiento con diálisis peritoneal, la administración de insulina intraperitoneal es en la mayoría de los casos el tratamiento de elección.
Tabla 1. Características de los secretagogos de insulina
Tabla 2. Antidiabéticos orales y uso en ERC
Tabla 3. Indicaciones y contraindicaciones de los diferentes grupos terapéuticos de ADOS en ERC
Figura 1. Utilización de los distintos grupos terapéuticos de antidiabéticos orales e insulinoterapia en los diferentes estadíos de ERC
Tabla 4. Características farmacocinéticas de las diferentes insulinas
Tabla 5. Ventajas e inconvenientes de la insulina intraperitoneal