El estudio europeo COSMOS, que incluye 6.797 pacientes en hemodiálisis procedentes de 20 países, mostró que los niveles elevados de PTH se asociaban con un mayor riesgo de mortalidad en pacientes diabéticos comparados con no diabéticos. Los niveles de PTH elevados se han asociado a procesos inflamatorios. El objetivo de este estudio fue analizar en arterias epigástricas de pacientes en diálisis, si la diabetes y los niveles elevados de PTH podrían actuar sinérgicamente modulando la expresión de marcadores inflamatorios y de calcificación vascular a través de ADAM17 y/o su inhibidor, TIMP3.
Material y métodosSe examinaron muestras de arterias epigástricas de 62 pacientes con enfermedad renal crónica, 31 no diabéticos y 31 diabéticos con características similares, obtenidas durante el trasplante renal. Se evaluó la expresión génica de ADAM17, TIMP3, marcadores inflamatorios (TNF-α, VCAM e ICAM), α-actina, DKK1 y RUNX2, la expresión proteica de RUNX2 y la calcificación vascular. Los análisis se realizaron en función de la presencia/ausencia de diabetes y de los niveles de PTH sérica (utilizando el valor de la mediana como punto de corte). Las diferencias entre los grupos se evaluaron mediante las pruebas estadísticas Chi-cuadrado en el caso de variables cualitativas o Wilcoxon en variables cuantitativas.
ResultadosEn las arterias epigástricas de pacientes diabéticos se observó una menor expresión génica de TIMP3 (1,0 [0,8] vs. 0,6 [0,5] U. R.; p=0,028) y α-actina (1,0 [0,6] vs. 0,7 [0,5] U. R.; p=0,006), mayor expresión génica de VCAM (1,0 [0,9] vs. 2,1 [2,8] U. R.; p=0,011), TNF-α (1,0 [1,1] vs. 2,0 [1,9] U. R.; p=0,008) y RUNX2 (1,0 [0,8] vs. 2,4 [2,8] U. R.; p=0,009) y mayor porcentaje de núcleos positivos para RUNX2 (14,9 [15,8] vs. 31,1 [27,1]; p=0,038) en comparación con los no diabéticos. Las arterias de pacientes con PTH por encima de la mediana mostraron mayor expresión génica de ADAM17 (1,0 [0,6] vs. 1,8 [1,6] U. R.; p=0,026). El aumento en la expresión de ADAM17 se mantuvo cuando se analizaron solo los pacientes diabéticos (1,0 [0,5] vs. 2,9 [2,9] U. R.; p=0,038), pero no en los pacientes no diabéticos. La combinación de ambas circunstancias, PTH elevada y diabetes, se asoció con mayor expresión génica de RUNX2 (1,0 [0,8] vs. 2,7 [3,3] U. R.; p=0,019), mayor porcentaje de núcleos positivos para RUNX2 (13,3 [17,0] vs. 32,9 [27,2]; p=0,039) y mayor índice de Kauppila (3,9 [5,0] vs. 9,7 [7,3]; p=0,045).
ConclusionesAunque se observaron cambios en la expresión génica de ADAM17 y TIMP3 en pacientes diabéticos que podrían relacionarse con un aumento en la síntesis y/o liberación de factores proinflamatorios, estos no parecen explicar la diferencia en la mortalidad asociada a niveles elevados de PTH entre pacientes diabéticos y no diabéticos que se observó en el estudio COSMOS. Sin embargo, el aumento de la mortalidad en pacientes diabéticos con PTH elevada podría estar relacionado con una mayor progresión de la calcificación vascular mediado por RUNX2.
The European COSMOS study, which included 6797 haemodialysis patients from 20 countries, demonstrated that elevated PTH levels were associated with a higher risk of mortality in diabetic patients compared to non-diabetic ones. Elevated PTH levels have been linked to inflammatory processes. This study aimed to analyse, in epigastric arteries of dialysis patients, whether diabetes and elevated PTH levels might synergistically modulate the expression of inflammatory and vascular calcification markers through ADAM17 and/or its inhibitor, TIMP3.
Material and methodsEpigastric artery samples were examined from 62 chronic kidney disease patients, 31 non-diabetic and 31 diabetic with similar characteristics, obtained during kidney transplantation. The gene expression of ADAM17, TIMP3, inflammatory markers (TNF-α, VCAM, and ICAM), α-actin, DKK1, and RUNX2, as well as protein expression of RUNX2 and vascular calcification, were evaluated. Analyses were performed based on the presence/absence of diabetes and serum PTH levels (using the median value as the cut-off). Differences between groups were assessed using Chi-squared tests for qualitative variables or Wilcoxon tests for quantitative variables.
ResultsIn the epigastric arteries of diabetic patients, there was lower gene expression of TIMP3 (1.0 [0.8] vs. 0.6 [0.5] R. U.; p=0.028) and α-actin (1.0 [0.6] vs. 0.7 [0.5] R. U.; p=0.006), higher gene expression of VCAM (1.0 [0.9] vs. 2.1 [2.8] R. U.; p=0.011), TNF-α (1.0 [1.1] vs. 2.0 [1.9] R. U.; p=0.008), and RUNX2 (1.0 [0.8] vs. 2.4 [2.8] R. U.; p=0.009), and a higher percentage of RUNX2-positive nuclei (14.9 [15.8] vs. 31.1 [27.1]; p=0.038) compared to non-diabetic patients. Arteries from patients with PTH levels above the median exhibited higher gene expression of ADAM17 (1.0 [0.6] vs. 1.8 [1.6] R. U.; p=0.026). The increase in ADAM17 expression persisted when only diabetic patients were analysed (1.0 [0.5] vs. 2.9 [2.9] R. U.; p=0.038), but not in non-diabetic patients. The combination of elevated PTH and diabetes was associated with higher gene expression of RUNX2 (1.0 [0.8] vs. 2.7 [3.3] R. U.; p=0.019), a higher percentage of RUNX2-positive nuclei (13.3 [17.0] vs. 32.9 [27.2]; p=0.039), and a higher Kauppila index (3.9 [5.0] vs. 9.7 [7.3]; p=0.045).
ConclusionsAlthough changes in ADAM17 and TIMP3 gene expression were observed in diabetic patients, potentially related to increased synthesis and/or release of pro-inflammatory factors, these do not appear to explain the difference in mortality associated with elevated PTH levels between diabetic and non-diabetic patients observed in the COSMOS study. However, the increased mortality in diabetic patients with elevated PTH may be linked to greater vascular calcification progression mediated by RUNX2.
La prevalencia de calcificación vascular (CV) en pacientes de diálisis es superior a la de la población general y se sitúa entre el 47-83% en aquellos con enfermedad renal crónica (ERC) y una tasa de filtración glomerular inferior a 60mL/min/1,73m21–5. Esta prevalencia se ve aumentada en pacientes diabéticos con ERC, en los que la CV tiende a ser más severa y presentarse en etapas más tempranas de la enfermedad1,6–8, si bien no se suelen observar diferencias en los niveles de los factores procalcificantes clásicos como fósforo y factor de crecimiento fibroblástico 239. Estos datos evidencian que en pacientes diabéticos podrían existir otros factores de riesgo asociados con la CV, como un mayor grado de inflamación9 y un control inadecuado de la glucemia10.
Resultados previos del estudio COSMOS (6.797 pacientes de hemodiálisis de 20 países de Europa) mostraron que los pacientes diabéticos con niveles elevados de hormona paratiroidea (PTH) sérica tuvieron un mayor riesgo relativo de mortalidad con respecto a los no diabéticos11, demostrando que los pacientes diabéticos podrían ser más sensibles a incrementos de la PTH. En diversos estudios se ha observado una correlación entre PTH e inflamación tanto en población general como en pacientes con hiperparatiroidismo primario12–14. En el mismo sentido, un estudio en pacientes en hemodiálisis con hiperparatiroidismo secundario mostró un descenso del cociente neutrófilos/linfocitos (marcador de inflamación) tras la paratiroidectomía15.
Estos resultados evidencian que una PTH elevada podría favorecer un mayor estado inflamatorio. Desde esa misma perspectiva, un estudio reciente basado en la Encuesta Nacional de Examen de Salud y Nutrición –NHANES– del Centro Nacional de Estadísticas de Salud de EE. UU. mostró que la inflamación podría afectar a los niveles de PTH, dado que el consumo de una dieta proinflamatoria se asoció con un mayor riesgo de hiperparatiroidismo16. Uno de los posibles mecanismos implicados en este proceso inflamatorio podría ser la activación de ADAM17 (desintegrina y metaloproteinasa 17) o la enzima convertidora del factor de necrosis tumoral alfa (TNF-α), un importante mediador de eventos de señalización asociados a procesos inflamatorios que participa en la adhesión celular y escisión proteolítica de varias moléculas de la superficie celular17. Esta posibilidad estaría respaldada por la observación de un aumento en la expresión/actividad de ADAM17 en la ERC18 y en condiciones de hiperglucemia19. De hecho, los ratones nulos para TIMP3, inhibidor de ADAM1717, presentan mayor inflamación y resistencia a la insulina20. Esta enzima también participa en la liberación de moléculas de adhesión celular, como VCAM e ICAM, que están involucradas en el reclutamiento de leucocitos y la disfunción del endotelio vascular17,21.
La hipótesis del presente estudio fue que los pacientes diabéticos tendrían una mayor expresión de factores proinflamatorios, que podrían verse aumentados con niveles elevados de PTH, contribuyendo a un mayor riesgo y a un incremento de la CV. Por tanto, los objetivos de este estudio fueron analizar en arterias epigástricas la posible asociación entre la presencia de diabetes y/o los niveles de PTH con la expresión de ADAM17, su inhibidor (TIMP3), y otras moléculas procesadas por esta enzima como VCAM, ICAM y TNF-α, además de marcadores de fenotipo muscular contráctil (α-actina) y osteogénico (RUNX2 y DKK1), y parámetros de calcificación como el contenido en calcio y el índice de Kauppila.
Material y métodosDiseño del estudioSe realizó un estudio retrospectivo en 62 pacientes en diálisis (31 no diabéticos y 31 diabéticos) sometidos a trasplante renal entre los años 2011 y 2023, de forma que por cada paciente diabético se seleccionó un paciente no diabético con características similares. Durante la cirugía de trasplante renal se recogió de cada paciente un fragmento de arteria epigástrica, sobrante del proceso, que fue dividido en 2 o 3 partes: una fue utilizada para la extracción de ARN, otra para la determinación del contenido en calcio, y, cuando se dispuso de tejido suficiente, un tercer fragmento se incluyó en parafina para estudios de inmunohistoquímica.
De la historia clínica se recopilaron datos demográficos y antropométricos, como sexo, edad en el momento del trasplante, hábito tabáquico e índice de masa corporal; comorbilidades como hipertensión, hiperlipidemia y diabetes; tipo y tiempo en diálisis y etiología de la enfermedad renal crónica; y datos bioquímicos promedio de los 6 meses previos al trasplante: PTH, fosfato, calcio, magnesio, albúmina y hemoglobina, que se midieron de forma centralizada en el laboratorio del Hospital Universitario Central de Asturias mediante un autoanalizador Cobas® 8000 (Roche Diagnostics, Suiza).
El estudio fue aprobado por el Comité de Ética de la Investigación del Principado de Asturias (códigos 42/2011, 53/2014, 110/2017 y 2022.240). Todos los participantes firmaron el consentimiento informado para su inclusión en el estudio. El estudio fue realizado siguiendo los principios éticos para las investigaciones médicas en seres humanos de la Declaración de Helsinki.
Determinación de la calcificación vascularPara la determinación del contenido de calcio en la arteria epigástrica, se utilizó un fragmento que se congeló con nitrógeno líquido, se trituró en un mortero, se añadió HCl 0,6N y se mantuvo en agitación a 4°C durante 24h. Después de una centrifugación, se midió el contenido en calcio en el sobrenadante mediante el método de O-cresolftaleína complexona22. El pellet se resuspendió en tampón de lisis (125mM de Tris y 2% SDS a pH 6,8) para extraer las proteínas y se cuantificaron utilizando el método de Lowry (Bio-Rad, EE. UU.). El contenido de calcio se normalizó por el contenido total de proteína y se expresó como μg Ca/mg proteína.
También se evaluó la CV de la aorta abdominal en cada paciente mediante una radiografía lateral de abdomen en la que se determinó el índice de Kauppila, que otorga una puntuación entre 0 y 2423.
Extracción de ARN y PCR cuantitativa en tiempo real en arterias epigástricasOtro fragmento de arteria epigástrica se congeló en nitrógeno líquido y se trituró utilizando un mortero. Para la extracción del ARN se utilizó el reactivo TRI Reagent® (Sigma-Aldrich, Merck KGaA, Alemania) siguiendo las instrucciones del fabricante. El ADN copia se obtuvo utilizando el kit High-Capacity cDNA Reverse Transcription (Applied Biosystem®, EE. UU.), seguido de una preamplificación de los genes objeto de estudio utilizando el kit TaqMan® PreAmp Master Mix (Applied Biosystem®, EE. UU.). La expresión génica de ADAM17, TIMP3, VCAM, ICAM, TNF-α, α-actina, RUNX2 y DKK1 se midieron mediante PCR cuantitativa en tiempo real en un equipo QuantStudio 3 Real-Time PCR System (Applied Biosystems, EE. UU.) utilizando sondas TaqMan (Applied Biosystems, EE. UU.). Se utilizó gliceraldehído-3-fosfato-deshidrogenasa como gen constitutivo. La cuantificación relativa de los genes se realizó utilizando el método ΔΔCt24. Los resultados se representaron como unidades relativas (U. R.).
Análisis inmunohistoquímico de la expresión y localización nuclear de RUNX2 en arterias epigástricasEn 38 muestras de arterias epigástricas (21 no diabéticos y 17 diabéticos) se analizó la expresión y localización nuclear de RUNX2 siguiendo el protocolo descrito previamente25. En toda la sección de la muestra se analizó el número de núcleos positivos para RUNX2 y el total de núcleos. El resultado se expresó como porcentaje de la ratio número núcleos positivos para RUNX2/total de núcleos de cada arteria epigástrica.
Análisis estadísticoCon los datos recogidos se analizaron la expresión génica, el contenido en calcio y los parámetros bioquímicos en pacientes diabéticos y no diabéticos. También se realizaron análisis en función de los niveles de PTH, para lo cual se dividió a la población a estudiar (todos los pacientes y por separado diabéticos y no diabéticos) en 2 grupos: PTH baja (<mediana) o PTH elevada (≥mediana), en función de la mediana de los valores medios de PTH de los 6 meses previos al trasplante.
Los resultados se expresaron como medias y desviaciones estándar. Las diferencias entre los grupos se evaluaron mediante las pruebas estadísticas Chi-cuadrado en el caso de variables cualitativas o Wilcoxon en variables cuantitativas. Las correlaciones se analizaron mediante el test de Spearman y se muestran como representaciones no paramétricas (rangos de valores paramétricos de las variables). Se consideraron diferencias estadísticamente significativas cuando p<0,05. Todos los análisis estadísticos y los gráficos se realizaron utilizando el software R para Windows (versión 4.1.2; R Foundation for Statistical Computing, Austria).
ResultadosCaracterísticas demográficas y valores bioquímicos de los pacientes estudiadosSe analizaron muestras de arterias epigástricas de 31 pacientes no diabéticos y 31 diabéticos sometidos a trasplante renal. La edad media de los pacientes fue de 60,8 (8,8) años, el 67,7% fueron hombres y de media permanecieron 25 meses en diálisis, siendo la hemodiálisis el tipo de diálisis mayoritario. Las características de los pacientes se recogen en la tabla 1. Los pacientes diabéticos presentaron un índice de masa corporal significativamente mayor que los pacientes no diabéticos, mientras que los niveles de albúmina sérica fueron significativamente menores (tabla 1). En los pacientes diabéticos la causa más frecuente de ERC fue la diabetes (67,7%) mientras que en los no diabéticos fueron la hipertensión arterial o nefroangioesclerosis hipertensiva (22,6%) y la intersticial u obstructiva (22,6%).
Características demográficas y valores bioquímicos en pacientes no diabéticos y diabéticos
| Todos los pacientes | No diabéticos | Diabéticos | p | |
|---|---|---|---|---|
| N | 62 | 31 | 31 | |
| Sexo femenino, n (%) | 20 (32,3) | 11 (35,5) | 9 (29,0) | 0,786 |
| Edad (años), media (DE) | 60,8 (8,8) | 60,5 (9,8) | 61,1 (7,9) | 0,899 |
| Fumador, n (%) | 9 (18,0) | 4 (15,4) | 5 (20,8) | 0,894 |
| IMC (kg/m2), media (DE) | 26,9 (4,3) | 25,5 (4,6) | 28,4 (3,5) | 0,011 |
| Hipertensión arterial, n (%) | 49 (96,1) | 25 (92,6) | 24 (100,0) | 0,524 |
| Hiperlipidemia, n (%) | 24 (52,2) | 13 (50,0) | 11 (55,0) | 0,969 |
| Etiología enfermedad renal crónica, n (%) | <0,001 | |||
| Diabetes | 21 (33,9) | 0 (0,0) | 21 (67,7) | |
| Glomerulonefritis | 6 (9,7) | 6 (19,4) | 0 (0,0) | |
| HTA/nefroangioesclerosis hipertensiva | 7 (11,3) | 7 (22,6) | 0 (0,0) | |
| Intersticial/obstructiva | 10 (16,1) | 7 (22,6) | 3 (9,7) | |
| Poliquistosis renal | 8 (12,9) | 6 (19,4) | 2 (6,5) | |
| Desconocida | 7 (11,3) | 4 (12,9) | 3 (9,7) | |
| Otros | 3 (4,8) | 1 (3,2) | 2 (6,5) | |
| Tipo de diabetes, n (%) | <0,001 | |||
| Diabetes tipo 1 | 4 (6,5) | 0 (0,0) | 4 (12,9) | |
| Diabetes tipo 2 | 27 (43,5) | 0 (0,0) | 27 (87,1) | |
| No diabetes | 31 (50,0) | 31 (100,0) | 0 (0,0) | |
| Tipo de diálisis, n (%) | 0,336 | |||
| Hemodiálisis | 38 (61,3) | 19 (61,3) | 19 (61,3) | |
| Peritoneal | 22 (35,5) | 12 (38,7) | 10 (32,3) | |
| ERCA | 2 (3,2) | 0 (0,0) | 2 (6,5) | |
| Tiempo en diálisis (meses), media (DE) | 25,0 (29,0) | 21,3 (11,0) | 28,6 (39,4) | 0,647 |
| PTH (pg/mL), media (DE) | 268,5 (183,4) | 301,0 (222,5) | 236,0 (129,2) | 0,183 |
| Fósforo (mmol/L), media (DE) | 1,4 (0,3) | 1,4 (0,3) | 1,3 (0,3) | 0,621 |
| Calcio (mmol/L), media (DE) | 2,3 (0,2) | 2,3 (0,2) | 2,3 (0,2) | 0,784 |
| Magnesio (mmol/L), media (DE) | 0,9 (0,1) | 0,9 (0,1) | 0,9 (0,1) | 0,792 |
| Albúmina (g/L), media (DE) | 38,3 (4,0) | 39,5 (3,9) | 36,5 (3,4) | 0,006 |
| Hemoglobina (g/dL), media (DE) | 11,5 (1,2) | 11,5 (1,3) | 11,5 (1,2) | 0,539 |
| Índice de Kauppila, media (DE) | 6,4 (6,1) | 5,2 (5,7) | 7,9 (6,3) | 0,112 |
| Calcio arteria (μg Ca/mg prot.), media (DE) | 287,6 (681,2) | 286,2 (777,2) | 289,3 (571,5) | 0,071 |
DE: desviación estándar; ERCA: enfermedad renal crónica avanzada; HTA: hipertensión arterial; IMC: índice de masa corporal; prot.: proteína; PTH: hormona paratiroidea.
No se encontraron diferencias significativas entre ambos grupos en sexo, edad, porcentaje de fumadores, hipertensión arterial, hiperlipidemia, tiempo en diálisis, tipo de diálisis, niveles medios de PTH, fósforo, calcio, magnesio y hemoglobina, en el índice de Kauppila o el contenido en calcio de la arteria epigástrica.
Se observó una correlación positiva entre el contenido el calcio de la arteria epigástrica y la calcificación de la aorta abdominal determinado mediante el índice de Kauppila (rho=0,392, p=0,014) (figura suplementaria 1).
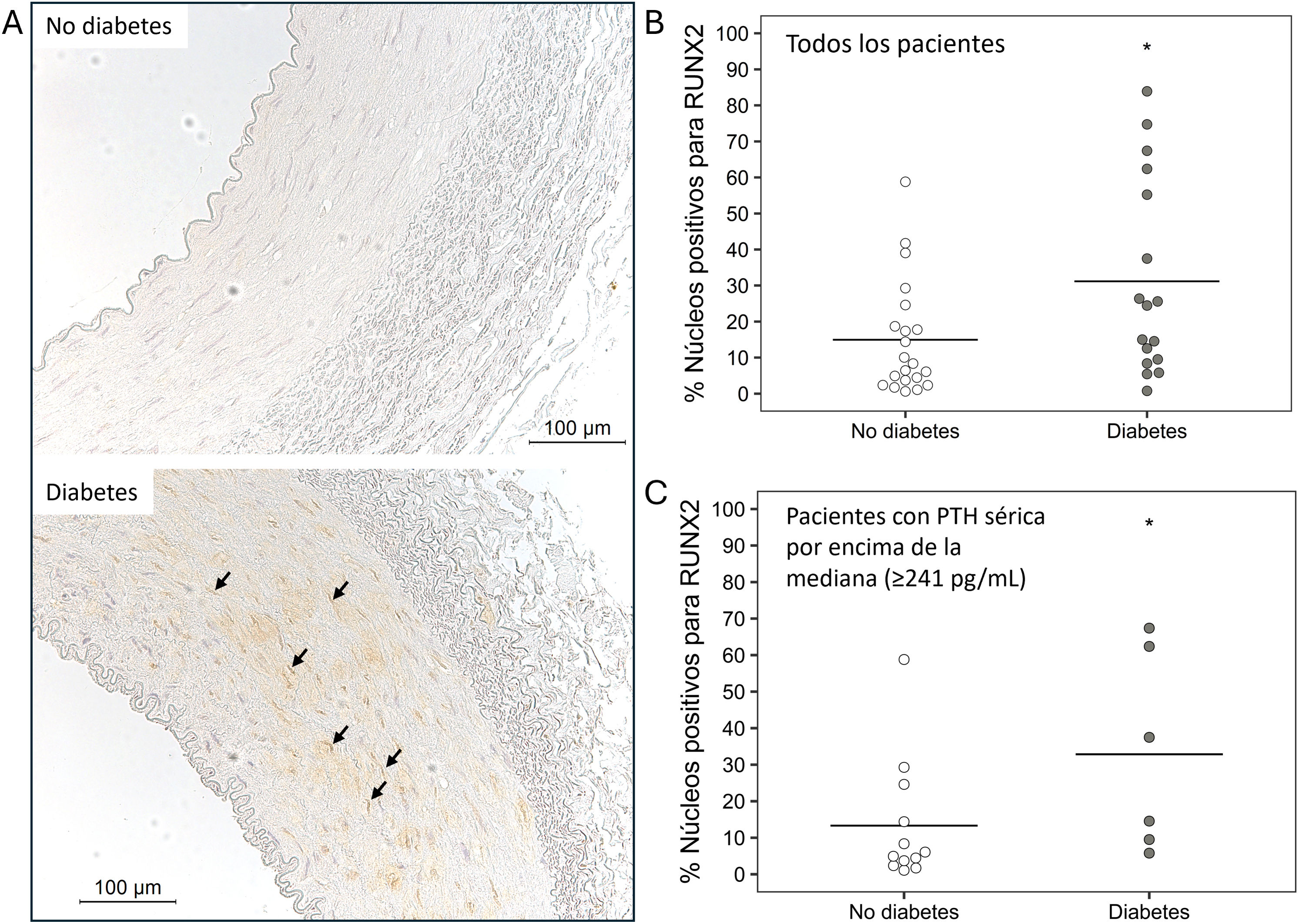
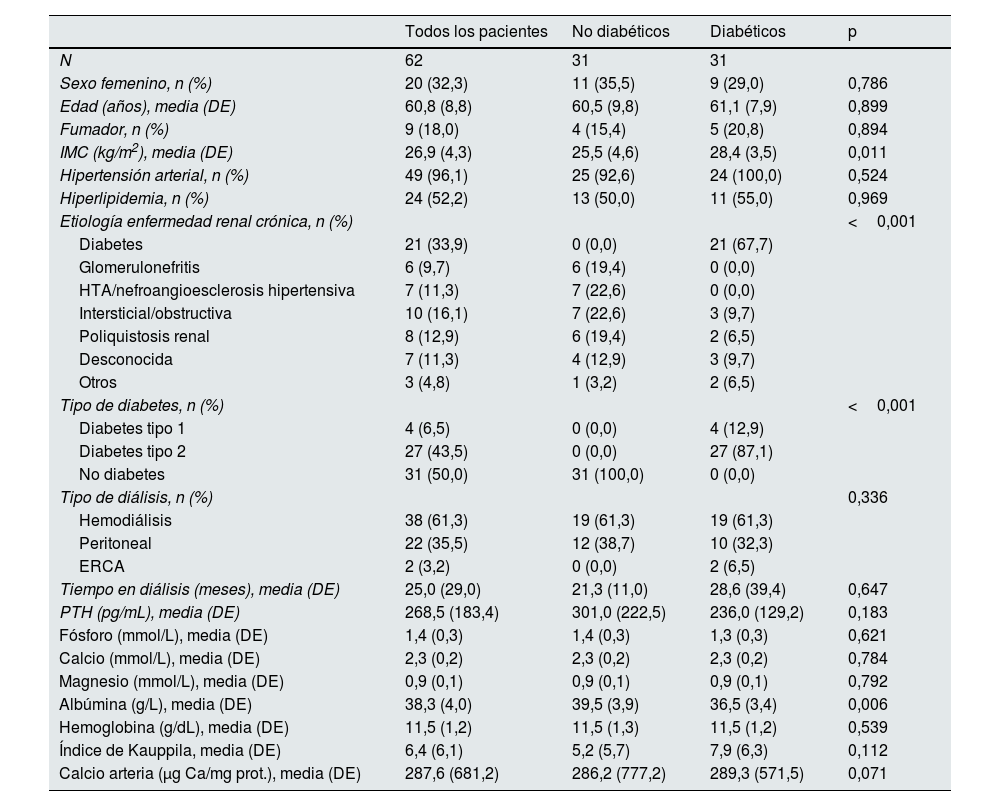
Análisis de expresión en pacientes no diabéticos y diabéticosEn los pacientes diabéticos, la expresión de TIMP3 y α-actina fue significativamente menor, mientras que la expresión de VCAM, TNF-α y RUNX2 fue mayor en comparación con los pacientes no diabéticos (tabla 2). En los pacientes diabéticos el porcentaje de núcleos positivos para RUNX2 fue significativamente mayor que en los pacientes no diabéticos (14,9 [15,8] vs. 31,1 [27,1]; p=0,038) (fig. 1A y B).
Niveles de expresión génica y marcadores de calcificación vascular en pacientes no diabéticos y diabéticos
| No diabéticos | Diabéticos | p | |
|---|---|---|---|
| N | 31 | 31 | |
| ADAM17 (U. R.) | 1,0 (0,7) | 1,1 (1,2) | 0,356 |
| TIMP3 (U. R.) | 1,0 (0,8) | 0,6 (0,5) | 0,028 |
| VCAM (U. R.) | 1,0 (0,9) | 2,1 (2,8) | 0,011 |
| ICAM (U. R.) | 1,0 (1,5) | 0,7 (1,0) | 0,751 |
| TNF-α (U. R.) | 1,0 (1,1) | 2,0 (1,9) | 0,008 |
| α-actina (U. R.) | 1,0 (0,6) | 0,7 (0,5) | 0,006 |
| RUNX2 (U. R.) | 1,0 (0,8) | 2,4 (2,8) | 0,009 |
| DKK1 (U. R.) | 1,0 (0,9) | 1,7 (2,4) | 0,840 |
Los resultados se expresan como medias y desviaciones estándar.
ADAM17: a disintegrin and metalloproteinase17; TIMP3: tissue inhibitor of metalloproteinase 3; VCAM: vascular cell adhesion molecules; ICAM: intercellular adhesion molecules; TNF-α: tumor necrosis factor-alpha; RUNX2: runt-related transcription factor 2; DKK1: Dickkopf-1; U.R.: unidades relativas.
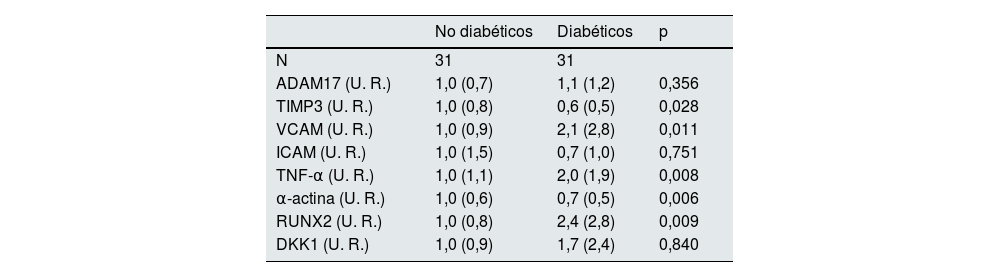
Inmunohistoquímica de RUNX2 en arterias epigástricas. A) Imágenes representativas de la expresión y localización de RUNX2 en arterias epigástricas de pacientes no diabéticos y diabéticos (las flechas indican los núcleos con tinción positiva para RUNX2). Cuantificación de núcleos positivos para RUNX2 respecto al total de núcleos en las arterias epigástricas de pacientes no diabéticos y diabéticos (*p=0,038) en B, y en pacientes no diabéticos y diabéticos con PTH sérica por encima de la media (≥241pg/mL) (*p=0,039) en C, expresados en porcentaje.
La mediana de los niveles de PTH sérico en los 62 pacientes incluidos en el estudio fue de 241pg/mL, valor que se utilizó para dividir a la población en 2 grupos: PTH baja y PTH elevada (tabla 3).
Características demográficas, valores bioquímicos, niveles de expresión génica y marcadores de calcificación vascular en pacientes con PTH sérica baja y elevada
| PTH baja(<241pg/mL) | PTH elevada(≥241pg/mL) | p | |
|---|---|---|---|
| N | 30 | 32 | |
| Sexo femenino, n (%) | 12 (40,0) | 8 (25,0) | 0,322 |
| Edad (años), media (DE) | 61,9 (8,9) | 59,8 (8,7) | 0,544 |
| IMC (kg/m2), media (DE) | 27,3 (4,2) | 26,6 (4,4) | 0,355 |
| Tipo de diabetes, n (%) | 0,584 | ||
| Diabetes tipo 1 | 2 (7,7) | 2 (6,9) | |
| Diabetes tipo 2 | 15 (50,0) | 12 (37,5) | |
| No diabetes | 13 (43,3) | 18 (56,2) | |
| Tipo de diálisis, n (%) | 0,329 | ||
| Hemodiálisis | 18 (60,0) | 20 (62,5) | |
| Peritoneal | 10 (33,3) | 12 (37,5) | |
| ERCA | 2 (8,7) | 0 (0,0) | |
| Tiempo en diálisis (meses), media (DE) | 24,3 (28,6) | 25,6 (29,7) | 0,778 |
| PTH (pg/mL), media (DE) | 154,6 (56,3) | 375,4 (197,1) | <0,001 |
| Fósforo (mmol/L), media (DE) | 1,3 (0,3) | 1,4 (0,3) | 0,071 |
| Calcio (mmol/L), media (DE) | 2,3 (0,2) | 2,3 (0,2) | 0,698 |
| Magnesio (mmol/L), media (DE) | 0,9 (0,1) | 0,9 (0,1) | 0,394 |
| Albúmina (g/L), media (DE) | 38,0 (4,6) | 38,5 (3,4) | 0,425 |
| Hemoglobina (g/dL), media (DE) | 11,5 (1,0) | 11,5 (1,4) | 0,805 |
| Índice de Kauppila, media (DE) | 7,1 (6,0) | 5,6 (6,2) | 0,378 |
| Calcio arteria (μg Ca/mg prot.), media (DE) | 348,3 (781,8) | 216,9 (555,3) | 0,005 |
| ADAM17 (U. R.), media (DE) | 1,0 (0,6) | 1,8 (1,6) | 0,026 |
| TIMP3 (U. R.), media (DE) | 1,0 (0,9) | 1,1 (1,0) | 0,822 |
| VCAM (U. R.), media (DE) | 1,0 (1,7) | 0,9 (0,8) | 0,508 |
| ICAM (U. R.), media (DE) | 1,0 (1,4) | 1,4 (2,1) | 0,499 |
| TNF-α (U. R.), media (DE) | 1,0 (1,2) | 1,8 (3,5) | 0,272 |
| α-actina (U. R.), media (DE) | 1,0 (0,8) | 1,1 (0,8) | 0,455 |
| RUNX2 (U. R.), media (DE) | 1,0 (1,2) | 1,0 (1,4) | 0,938 |
| DKK1 (U. R.), media (DE) | 1,0 (1,6) | 1,3 (1,5) | 0,078 |
DE: desviación estándar; ERCA: enfermedad renal crónica avanzada; IMC: índice de masa corporal; prot.: proteína; PTH: hormona paratiroidea; U. R.: unidades relativas.
En este caso, se observó que la expresión de ADAM17 en las arterias epigástricas fue significativamente mayor en el grupo de pacientes con niveles séricos de PTH igual o por encima de la mediana. Por otro lado, los pacientes con niveles de PTH bajos presentaron mayor contenido de calcio en la arteria epigástrica.
No se encontraron diferencias significativas en el resto de los parámetros analizados.
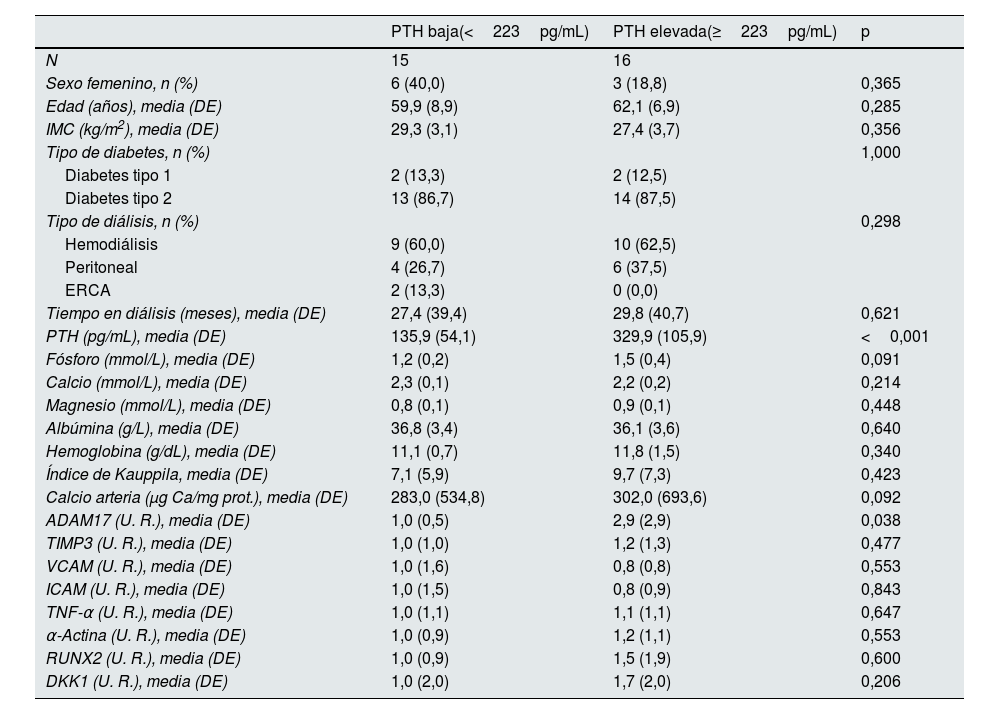
Este mismo análisis se realizó teniendo en cuenta solo a los pacientes con diabetes (tabla 4). En este caso, la mediana de los valores de PTH en los pacientes diabéticos fue de 223pg/mL.
Características demográficas, valores bioquímicos, niveles de expresión génica y marcadores de calcificación vascular en pacientes diabéticos con PTH sérica baja y elevada
| PTH baja(<223pg/mL) | PTH elevada(≥223pg/mL) | p | |
|---|---|---|---|
| N | 15 | 16 | |
| Sexo femenino, n (%) | 6 (40,0) | 3 (18,8) | 0,365 |
| Edad (años), media (DE) | 59,9 (8,9) | 62,1 (6,9) | 0,285 |
| IMC (kg/m2), media (DE) | 29,3 (3,1) | 27,4 (3,7) | 0,356 |
| Tipo de diabetes, n (%) | 1,000 | ||
| Diabetes tipo 1 | 2 (13,3) | 2 (12,5) | |
| Diabetes tipo 2 | 13 (86,7) | 14 (87,5) | |
| Tipo de diálisis, n (%) | 0,298 | ||
| Hemodiálisis | 9 (60,0) | 10 (62,5) | |
| Peritoneal | 4 (26,7) | 6 (37,5) | |
| ERCA | 2 (13,3) | 0 (0,0) | |
| Tiempo en diálisis (meses), media (DE) | 27,4 (39,4) | 29,8 (40,7) | 0,621 |
| PTH (pg/mL), media (DE) | 135,9 (54,1) | 329,9 (105,9) | <0,001 |
| Fósforo (mmol/L), media (DE) | 1,2 (0,2) | 1,5 (0,4) | 0,091 |
| Calcio (mmol/L), media (DE) | 2,3 (0,1) | 2,2 (0,2) | 0,214 |
| Magnesio (mmol/L), media (DE) | 0,8 (0,1) | 0,9 (0,1) | 0,448 |
| Albúmina (g/L), media (DE) | 36,8 (3,4) | 36,1 (3,6) | 0,640 |
| Hemoglobina (g/dL), media (DE) | 11,1 (0,7) | 11,8 (1,5) | 0,340 |
| Índice de Kauppila, media (DE) | 7,1 (5,9) | 9,7 (7,3) | 0,423 |
| Calcio arteria (μg Ca/mg prot.), media (DE) | 283,0 (534,8) | 302,0 (693,6) | 0,092 |
| ADAM17 (U. R.), media (DE) | 1,0 (0,5) | 2,9 (2,9) | 0,038 |
| TIMP3 (U. R.), media (DE) | 1,0 (1,0) | 1,2 (1,3) | 0,477 |
| VCAM (U. R.), media (DE) | 1,0 (1,6) | 0,8 (0,8) | 0,553 |
| ICAM (U. R.), media (DE) | 1,0 (1,5) | 0,8 (0,9) | 0,843 |
| TNF-α (U. R.), media (DE) | 1,0 (1,1) | 1,1 (1,1) | 0,647 |
| α-Actina (U. R.), media (DE) | 1,0 (0,9) | 1,2 (1,1) | 0,553 |
| RUNX2 (U. R.), media (DE) | 1,0 (0,9) | 1,5 (1,9) | 0,600 |
| DKK1 (U. R.), media (DE) | 1,0 (2,0) | 1,7 (2,0) | 0,206 |
DE: desviación estándar; ERCA: enfermedad renal crónica avanzada; IMC: índice de masa corporal; prot.: proteína; PTH: hormona paratiroidea; U. R.: unidades relativas.
En pacientes diabéticos con niveles de PTH sérica igual y por encima de la mediana, la expresión de ADAM17 en las arterias epigástricas fue significativamente mayor comparada con la de aquellos con niveles de PTH por debajo de la mediana. No se encontraron diferencias significativas en el resto de los parámetros analizados.
No se encontraron correlaciones estadísticamente significativas entre los niveles de PTH sérica y los marcadores de inflamación y calcificación analizados en este trabajo en los pacientes diabéticos, aunque se puede observar una tendencia entre los niveles de PTH sérica y la expresión de ADAM17 en la artería epigástrica (rho=0,359, p=0,051) (figuras suplementarias 2 y 4).
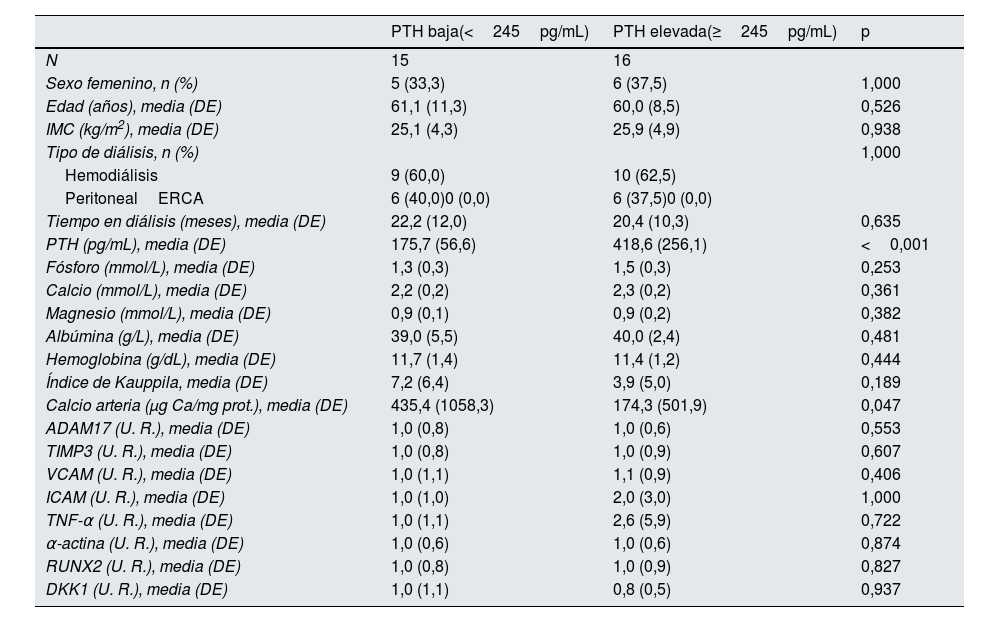
El mismo análisis fue realizado en los pacientes no diabéticos, siendo el valor de la mediana para dividir la población en PTH baja y elevada de 245mg/dL (tabla 5).
Características demográficas, valores bioquímicos, niveles de expresión génica y marcadores de calcificación vascular en pacientes no diabéticos con niveles de PTH sérica baja y elevada
| PTH baja(<245pg/mL) | PTH elevada(≥245pg/mL) | p | |
|---|---|---|---|
| N | 15 | 16 | |
| Sexo femenino, n (%) | 5 (33,3) | 6 (37,5) | 1,000 |
| Edad (años), media (DE) | 61,1 (11,3) | 60,0 (8,5) | 0,526 |
| IMC (kg/m2), media (DE) | 25,1 (4,3) | 25,9 (4,9) | 0,938 |
| Tipo de diálisis, n (%) | 1,000 | ||
| Hemodiálisis | 9 (60,0) | 10 (62,5) | |
| PeritonealERCA | 6 (40,0)0 (0,0) | 6 (37,5)0 (0,0) | |
| Tiempo en diálisis (meses), media (DE) | 22,2 (12,0) | 20,4 (10,3) | 0,635 |
| PTH (pg/mL), media (DE) | 175,7 (56,6) | 418,6 (256,1) | <0,001 |
| Fósforo (mmol/L), media (DE) | 1,3 (0,3) | 1,5 (0,3) | 0,253 |
| Calcio (mmol/L), media (DE) | 2,2 (0,2) | 2,3 (0,2) | 0,361 |
| Magnesio (mmol/L), media (DE) | 0,9 (0,1) | 0,9 (0,2) | 0,382 |
| Albúmina (g/L), media (DE) | 39,0 (5,5) | 40,0 (2,4) | 0,481 |
| Hemoglobina (g/dL), media (DE) | 11,7 (1,4) | 11,4 (1,2) | 0,444 |
| Índice de Kauppila, media (DE) | 7,2 (6,4) | 3,9 (5,0) | 0,189 |
| Calcio arteria (μg Ca/mg prot.), media (DE) | 435,4 (1058,3) | 174,3 (501,9) | 0,047 |
| ADAM17 (U. R.), media (DE) | 1,0 (0,8) | 1,0 (0,6) | 0,553 |
| TIMP3 (U. R.), media (DE) | 1,0 (0,8) | 1,0 (0,9) | 0,607 |
| VCAM (U. R.), media (DE) | 1,0 (1,1) | 1,1 (0,9) | 0,406 |
| ICAM (U. R.), media (DE) | 1,0 (1,0) | 2,0 (3,0) | 1,000 |
| TNF-α (U. R.), media (DE) | 1,0 (1,1) | 2,6 (5,9) | 0,722 |
| α-actina (U. R.), media (DE) | 1,0 (0,6) | 1,0 (0,6) | 0,874 |
| RUNX2 (U. R.), media (DE) | 1,0 (0,8) | 1,0 (0,9) | 0,827 |
| DKK1 (U. R.), media (DE) | 1,0 (1,1) | 0,8 (0,5) | 0,937 |
DE: desviación estándar; ERCA: enfermedad renal crónica avanzada; IMC: índice de masa corporal; prot.: proteína; PTH: hormona paratiroidea; U. R.: unidades relativas.
En el grupo de pacientes no diabéticos se encontró que el contenido en calcio de la arteria epigástrica de los pacientes con PTH baja era significativamente mayor comparado con el de los pacientes no diabéticos con PTH elevada. No se encontraron diferencias significativas en el resto de los parámetros analizados (tabla 5).
No se encontraron correlaciones estadísticamente significativas entre los niveles de PTH sérica y los marcadores de inflamación y calcificación analizados en este trabajo en los pacientes no diabéticos (figuras suplementarias 3 y 5).
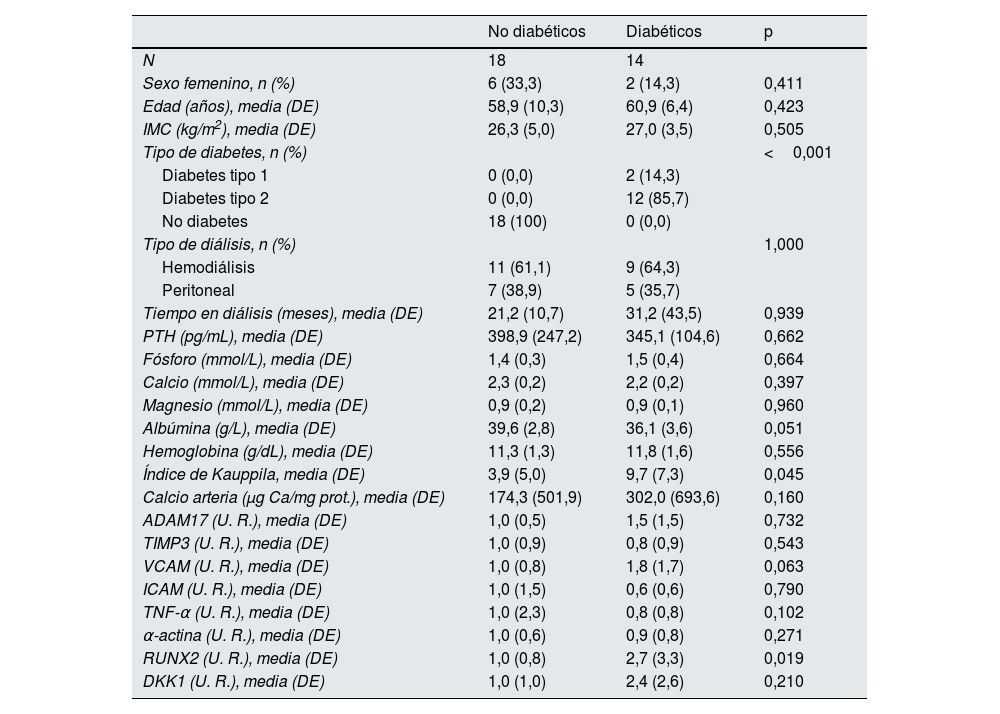
Análisis de expresión en pacientes diabéticos y no diabéticos con PTH elevadaEn el grupo de pacientes con niveles de PTH sérica iguales o por encima de la mediana la expresión de RUNX2 y el índice de Kauppila fueron significativamente mayores en los pacientes diabéticos comparados con los no diabéticos (tabla 6). También se observó un aumento significativo en el porcentaje de núcleos positivos para RUNX2 del total de núcleos en las arterias epigástricas de los pacientes diabéticos respecto a los no diabéticos con PTH elevadas (13,3 [17,0] vs. 32,9 [27,2]; p=0,039) (fig. 1C).
Características demográficas, valores bioquímicos, niveles de expresión génica y marcadores de calcificación vascular en pacientes no diabéticos y diabéticos con PTH sérica por encima de la mediana (≥241pg/mL)
| No diabéticos | Diabéticos | p | |
|---|---|---|---|
| N | 18 | 14 | |
| Sexo femenino, n (%) | 6 (33,3) | 2 (14,3) | 0,411 |
| Edad (años), media (DE) | 58,9 (10,3) | 60,9 (6,4) | 0,423 |
| IMC (kg/m2), media (DE) | 26,3 (5,0) | 27,0 (3,5) | 0,505 |
| Tipo de diabetes, n (%) | <0,001 | ||
| Diabetes tipo 1 | 0 (0,0) | 2 (14,3) | |
| Diabetes tipo 2 | 0 (0,0) | 12 (85,7) | |
| No diabetes | 18 (100) | 0 (0,0) | |
| Tipo de diálisis, n (%) | 1,000 | ||
| Hemodiálisis | 11 (61,1) | 9 (64,3) | |
| Peritoneal | 7 (38,9) | 5 (35,7) | |
| Tiempo en diálisis (meses), media (DE) | 21,2 (10,7) | 31,2 (43,5) | 0,939 |
| PTH (pg/mL), media (DE) | 398,9 (247,2) | 345,1 (104,6) | 0,662 |
| Fósforo (mmol/L), media (DE) | 1,4 (0,3) | 1,5 (0,4) | 0,664 |
| Calcio (mmol/L), media (DE) | 2,3 (0,2) | 2,2 (0,2) | 0,397 |
| Magnesio (mmol/L), media (DE) | 0,9 (0,2) | 0,9 (0,1) | 0,960 |
| Albúmina (g/L), media (DE) | 39,6 (2,8) | 36,1 (3,6) | 0,051 |
| Hemoglobina (g/dL), media (DE) | 11,3 (1,3) | 11,8 (1,6) | 0,556 |
| Índice de Kauppila, media (DE) | 3,9 (5,0) | 9,7 (7,3) | 0,045 |
| Calcio arteria (μg Ca/mg prot.), media (DE) | 174,3 (501,9) | 302,0 (693,6) | 0,160 |
| ADAM17 (U. R.), media (DE) | 1,0 (0,5) | 1,5 (1,5) | 0,732 |
| TIMP3 (U. R.), media (DE) | 1,0 (0,9) | 0,8 (0,9) | 0,543 |
| VCAM (U. R.), media (DE) | 1,0 (0,8) | 1,8 (1,7) | 0,063 |
| ICAM (U. R.), media (DE) | 1,0 (1,5) | 0,6 (0,6) | 0,790 |
| TNF-α (U. R.), media (DE) | 1,0 (2,3) | 0,8 (0,8) | 0,102 |
| α-actina (U. R.), media (DE) | 1,0 (0,6) | 0,9 (0,8) | 0,271 |
| RUNX2 (U. R.), media (DE) | 1,0 (0,8) | 2,7 (3,3) | 0,019 |
| DKK1 (U. R.), media (DE) | 1,0 (1,0) | 2,4 (2,6) | 0,210 |
DE: desviación estándar; IMC: índice de masa corporal; prot.: proteína; PTH: hormona paratiroidea; U. R.: unidades relativas.
En el presente estudio, las arterias epigástricas de pacientes diabéticos en diálisis mostraron una mayor inflamación (menos expresión de TIMP3 y más expresión de VCAM y TNF-α) junto con una pérdida de fenotipo muscular contráctil (α-actina) y mayor expresión de marcadores de fenotipo óseo (RUNX2) comparados con los no diabéticos (tabla 1). Además, la PTH elevada se asoció con mayor expresión de ADAM17, aunque menor contenido en calcio en la arteria epigástrica. En los pacientes diabéticos la PTH elevada también se asoció con mayor expresión de ADAM17, mientras que en los no diabéticos la PTH baja se asoció con más calcificación de la arteria epigástrica (tablas 4 y 5, respectivamente). La combinación de ambas circunstancias, PTH elevada y diabetes, se asoció con mayor expresión de RUNX2 y mayor calcificación de la arteria abdominal (tabla 6).
A pesar de los avances en las técnicas de diálisis, la tasa de mortalidad de los pacientes en tratamiento crónico con hemodiálisis sigue siendo elevada26. La diabetes es uno de los factores que más impacto tiene en el aumento del riesgo de mortalidad en la ERC, especialmente en los pacientes en diálisis, cuyo riesgo duplica al de los pacientes no diabéticos11,27. Varios factores pueden contribuir a este aumento de la mortalidad, como el nivel de glucemia. Si bien una reducción en el nivel de glucosa disminuye el riesgo de complicaciones microvasculares, el control glucémico por sí solo no es suficiente para reducir el riesgo de complicaciones macrovasculares28. Por otro lado, los niveles de PTH elevados se asocian con mayor incidencia de eventos cardiovasculares y rápida progresión de la ERC29. Sin embargo, hasta donde sabemos, no hay trabajos que evalúen a nivel molecular el efecto conjunto de niveles elevados de PTH y la diabetes en el sistema vascular de pacientes en diálisis.
En las arterias epigástricas de los pacientes diabéticos se observó una menor expresión de TIMP3 junto con el aumento en la expresión de factores proinflamatorios como TNF-α y VCAM respecto a los no diabéticos (tabla 3). La inhibición de la expresión de TIMP3 se ha relacionado con el inicio y progresión de la enfermedad renal diabética30, y un aumento de la actividad de ADAM17 y de los niveles circulantes de TNF-α y VCAM31. TIMP3 inhibe a ADAM17 al unirse a su dominio catalítico, bloqueando su función17. En el presente estudio no se analizó la actividad de ADAM17, pero la inhibición de TIMP3 y el aumento en la expresión de TNF-α y VCAM podría traducirse en un aumento de los niveles circulantes de estas moléculas relacionadas con la respuesta inflamatoria. El descenso en la expresión de TIMP3 podría deberse al aumento en la expresión de RUNX2, ya que varios trabajos describen a RUNX2 como un inhibidor de la expresión de TIMP332,33. Por otra parte, el aumento de RUNX2 y el descenso de α-actina indicarían un cambio de fenotipo de las células de músculo liso vascular a tipo osteoblasto asociado a la CV34, aunque no se observaron cambios en el contenido en calcio de las arterias ni en el índice de Kauppila. Estos resultados podrían estar indicando una mayor inflamación y una progresión más rápida hacia la CV en los pacientes diabéticos comparados con los no diabéticos.
Los pacientes diabéticos con niveles de PTH por encima de la mediana mostraron una mayor expresión génica y proteica de RUNX2 y un índice de Kauppila más alto, lo que indicaría una mayor CV respecto a los pacientes no diabéticos con PTH elevada (tabla 6). En la ERC, los niveles de PTH altos se han asociado con aumentos en los niveles séricos de fósforo y calcio que conllevan una mayor progresión de la ERC y aumentos de la CV y valvular29,34–36. Además, en pacientes diabéticos tipo 2 sin ERC severa, los niveles séricos de PTH elevados también se asocian con un aumento de la CV periférica37. En el presente estudio, de manera opuesta, cuando se analizaron los pacientes no diabéticos, los niveles bajos de PTH se asociaron con un mayor contenido en calcio en la arteria epigástrica, al igual que se describe en otros trabajos38. Estos resultados, donde valores bajos y altos de PTH se asocian con calcificación, han sido descritos previamente en cultivo in vitro34, y ambos se han relacionado con un aumento de la mortalidad cardiovascular39. Estos hallazgos parecen indicar que la PTH podría ser un mediador de procesos diferentes en pacientes diabéticos y no diabéticos.
Varios estudios han demostrado que la glucosa activa la expresión y actividad de ADAM1719,40, que a su vez se ha correlacionado con resistencia a la insulina41. En nuestro estudio no se encontraron diferencias estadísticamente significativas en la expresión de ADAM17 entre diabéticos y no diabéticos. Sin embargo, la expresión de ADAM17 parece relacionarse con la PTH, ya que niveles séricos de PTH por encima de la mediana se asociaron con una mayor expresión de ADAM17. Estos datos confirman resultados previos de nuestro grupo en los que se observó una menor expresión de ADAM17 en el corazón de animales con insuficiencia renal crónica y paratiroidectomizados comparados con los no paratiroidectomizados42.
La mayor expresión de ADAM17 también se observó, e incluso con cambios más marcados, en pacientes diabéticos con PTH elevada respecto a diabéticos con PTH baja. Estas diferencias en la expresión de ADAM17 no se constataron en los pacientes no diabéticos. Por tanto, la expresión de ADAM17 en las arterias epigástricas parece estar relacionada con los niveles de PTH únicamente en los pacientes diabéticos. Aunque en este estudio no se analizó la actividad de ADAM17, otros trabajos mostraron una correlación entre el aumento en la expresión de esta proteína y el incremento de su actividad19. Por tanto, la mayor expresión de ADAM17 observada en los pacientes diabéticos con PTH elevada podría asociarse con un mayor estado inflamatorio debido a la liberación de factores proinflamatorios como TNF-α, VCAM e ICAM, respecto a los pacientes diabéticos con PTH baja.
Estudios previos han mostrado la existencia de una asociación entre los niveles séricos de magnesio y PTH43. Además, la hipomagnesemia se ha relacionado con inflamación, mortalidad cardiovascular y CV principalmente en pacientes con diabetes, en los que la hipomagnesemia es mucho más frecuente44. Estudios clínicos han mostrado que la suplementación con magnesio ejerce un efecto regulador de la respuesta inmunológica45. En nuestro estudio no se encontraron diferencias significativas en los niveles de magnesio entre los distintos grupos de pacientes analizados que puedan explicar las diferencias encontradas en parámetros inflamatorios.
Aunque este estudio profundiza en diversos aspectos de la interrelación entre diabetes, PTH e inflamación, es necesario reconocer diversas limitaciones, como los niveles de PTH no excesivamente elevados. Mientras en el estudio COSMOS el incremento de la mortalidad en los pacientes diabéticos se observó principalmente con valores de PTH sérica>400pg/mL, en el presente estudio solo 11 (17,7%) presentaron niveles por encima de ese valor. La mayor disponibilidad actual de tratamientos como los calcimiméticos, a diferencia de la época en la que se realizó el estudio COSMOS, ha podido contribuir a que los niveles de PTH no estén tan elevados en el presente estudio. Por otra parte, en el estudio COSMOS solo se incluyeron pacientes en hemodiálisis, mientras que en este estudio se incluyeron además pacientes en diálisis peritoneal y con ERC avanzada. Otra limitación del estudio incluye no disponer de los valores séricos de factor de crecimiento fibroblástico 23, regulador de la expresión de PTH, que aumenta en condiciones de inflamación46 y se correlaciona positivamente con la de la CV47.
ConclusiónLos resultados de este trabajo no mostraron una relación entre los niveles elevados de PTH y la expresión de ADAM17, su inhibidor, TIMP3, y los factores proinflamatorios ICAM, VCAM y TNF-α en los pacientes diabéticos respecto a los no diabéticos. Sin embargo, los niveles séricos elevados de PTH aumentaron la expresión de ADAM17 en los pacientes diabéticos. Por tanto, no debería descartarse completamente la relación entre la inflamación y los niveles séricos de PTH elevados en los pacientes diabéticos y serían necesarios más estudios para clarificar estos resultados.
Además, los pacientes diabéticos con concentraciones elevadas de PTH mostraron un incremento en la expresión de RUNX2 y del índice de Kauppila, lo que podría indicar una progresión más rápida de la CV, que se asocia negativamente con la supervivencia2–4, y explicaría en parte el aumento de la mortalidad entre los pacientes diabéticos con PTH alta respecto a los no diabéticos, encontrada en el estudio COSMOS.
FinanciaciónEste trabajo ha sido posible gracias a una ayuda a la investigación en nefrología del año 2021 de la Fundación Senefro y la Sociedad Española de Nefrología sobre «Asociación entre los niveles de PTH e inflamación en el riesgo de mortalidad en pacientes diabéticos con enfermedad renal crónica. Estudio clínico experimental». Este estudio también ha sido financiado por el Instituto de Salud Carlos III (ISCIII, PI14/00707, PI17/00384, PI20/00633, PI22/00195, PI23/00833 y PI24/01785) y programa RICORS (RD21/0005/0019 y RD24/0004/006) financiado por la Unión Europea-Next Generation, Mecanismo para la Recuperación y la Resiliencia (MRR), Plan de Ciencia, Tecnología e Innovación 2018-2027 del Principado de Asturias (IDI-2018-000152, IDI/2021/000080 e IDE/2024/000706) y Fundación Renal Íñigo Álvarez de Toledo (FRIAT). B.M.C. y S.F.V. han recibido financiación mediante una beca del Gobierno del Principado de Asturias (Programa Severo Ochoa BP19-057 y BP20-081), N.G.G. por el ISCIII (Programa PFIS, FI23/00007), S.P y N.C.L. por el ISCIII (Programa Miguel Servet CP23/00105 y CP23/00058, respectivamente) y cofinanciado por la Unión Europea, y C.A.M. por la Fundación Biosanitaria del Principado de Asturias (ISPA).
Conflicto de interesesLos autores declaran no tener conflictos de interés.
Queremos manifestar nuestro agradecimiento a todos los pacientes que han participado en el estudio, a Francisco Otero García y Pilar Alonso Suarez, de la Unidad de Coordinación de Trasplantes del Hospital Universitario Central de Asturias, por su ayuda en la recogida, y al BioBanco del Principado de Asturias por su ayuda en el procesamiento y custodia de las arterias epigástricas. También queremos agradecer a la Asociación para la Lucha Contra las Enfermedades Renales (ALCER) de Asturias, y a la Asociación de Diabéticos del Principado de Asturias (ASDIPAS) por su apoyo a la investigación básica.