La asociación de hipouricemia e hipercalciuria es poco frecuente. En 1974 se describió un nuevo síndrome nominado Hipouricemia con hipercalciuria y reducción de la densidad ósea. Posteriormente, se publicaron algunos casos con esa asociación en los que la excreción fraccional de urato era superior a 20/100ml FGR. Hemos analizado una serie de niños que fueron diagnosticados de hipouricemia e hipercalciuria y que fueron controlados evolutivamente. El objetivo del trabajo es intentar conocer si nuestros pacientes podrían estar afectos del síndrome antes mencionado o ser portadores de una variante de hipercalciuria idiopática.
Pacientes y métodosEstudio retrospectivo longitudinal en el que se estudiaron las historias clínicas de 8 pacientes (5V y 3M) diagnosticados de hipouricemia e hipercalciuria en la infancia. Se anotaron la clínica al diagnóstico, los hallazgos ecográficos y densitométricos, y determinadas variables bioquímicas, con especial hincapié en el manejo tubular renal del urato. Los resultados se compararon con los de 36 niños afectos de hipercalciuria idiopática sin hipouricemia (14V y 22M).
ResultadosEn el grupo con hipouricemia los niveles iniciales de uricemia fueron 1,9 (0,3) mg/dl (rango: 1,5-2) y los del cociente calcio/creatinina en primera orina del día, 0,27 (0,05) mg/mg (rango: 0,23-0,31). En todos los casos la excreción fraccional de urato fue inferior a 20ml/100ml FGR. Los valores de z-DMO fueron menores de −1 en 4/8 casos. En el último control, solo en 3 casos persistía el cociente calcio/creatinina elevado, y en todos la uricemia era superior a 2mg/dl. El valor de z-DMO había mejorado en 5 casos y empeorado en otros 3. En relación con el grupo sin hipouricemia, no se observaron diferencias entre los diversos parámetros estudiados incluido el valor de z-DMO, con la excepción de la excreción fraccional y la reabsorción tubular de urato, aunque los niveles de uricemia seguían siendo significativamente inferiores.
ConclusiónNuestros pacientes con hipercalciuria e hipouricemia estarían afectos de una variante de hipercalciuria idiopática en la que por causa desconocida la reabsorción tubular proximal de urato está reducida discretamente y mejora con el tiempo. Es posible que el síndrome de Hipouricemia con hipercalciuria y reducción de la densidad ósea no sea una entidad específica.
The association of hypouricemia and hypercalciuria is rare. In 1974 a new syndrome named Hypouricemia with hypercalciuria and decreased bone density was described. Afterwards, some cases with such association were published in which the fractional excretion of urate was higher than 20/100ml FGR. We have analyzed a series of children who were diagnosed with hypouricemia and hypercalciuria and who were monitored. The aim of this study was to determine whether our patients could be affected by the aforementioned syndrome or be carriers of a variant of idiopathic hypercalciuria.
Patients and methodsRetrospective longitudinal study in which the medical records of eight patients (5V and 3M) diagnosed with hypouricemia and hypercalciuria in childhood. Clinical features at diagnosis, ultrasound and densitometric findings and selected biochemical variables were noted, with special emphasis on renal tubular handling of urate. Results were compared with 36 children with idiopathic hypercalciuria without hypouricemia (14V and 22M).
ResultsIn the hypouricemia group baseline urate levels were 1.9 (0.3)mg/dl (range: 1.5-2) and first day urine calcium/creatinine ratio 0.27 (0.05)mg/mg (range: 0.23-0.31). In all cases fractional urate excretion was less than 20/100ml FGR. The z-DMO values were less than −1 in 4/8 cases. At the last follow-up only three cases still had an elevated calcium/creatinine ratio and in all of them the urates levels was greater than 2mg/dl. The z-DMO value had improved in five cases and worsened in three others. In relation to the group without hypouricemia, no differences were observed between the various parameters studied including the z-DMO value, with the exception of fractional excretion and tubular urate reabsorption although plasmatic uric acid levels were still significantly lower.
ConclusionOur patients with hypercalciuria and hypouricemia would be affected by a variant of idiopathic hypercalciuria in which, due to an unknown cause, the proximal tubular reabsorption of urate is modestly reduced and improves over time. Hypouricemia with hypercalciuria and decreased bone density may not be a specific entity.
En 1972 Greene et al. describieron un paciente adulto con hipouricemia que remitía discretamente tras la administración de pirazinamida y que asociaba hiperuricosuria e hipercalciuria1. Dos años después, Sperling et al. publicaron los datos de una familia de origen judío que, a las características anteriores asociaban reducción de la masa ósea. Los autores pensaron que estaban ante una nueva enfermedad a la que denominaron como Síndrome de hipouricemia con hipercalciuria y reducción de la densidad ósea (OMIM 242050)2. Posteriormente, se describieron algunos pacientes con la agrupación de hipouricemia e hipercalciuria3–6. Desde 1993 no tenemos noticia de que se hayan publicado nuevos casos de dicha asociación coincidiendo, aproximadamente, con la descripción de los transportadores involucrados en el manejo tubular proximal de urato.
En 1994, nuestro grupo presentó los datos de varios niños con hipouricemia e hipercalciuria, algo inusual dada la rareza de la asociación7. En este trabajo hemos analizado 8 casos que fueron diagnosticados de hipouricemia e hipercalciuria en la infancia y que han sido seguidos evolutivamente hasta la adolescencia. Al tiempo, se ha intentado establecer si se trata de una entidad real o de una variante de hipercalciuria idiopática (HI).
Pacientes y métodosDiseñoEstudio retrospectivo longitudinal en el que se estudiaron las historias clínicas de 8 pacientes (5V y 3M) diagnosticados de hipouricemia e hipercalciuria en la infancia. La hipercalciuria se definió por una excreción renal de calcio de 24h superior a 4mg/kg/día8. Habían sido diagnosticados a la edad de 8 (5,7) años (rango: 1-11). La calciuria inicial fue 4,92 (1,47) mg/kg/día (rango: 4,7-8). Los síntomas y signos al diagnóstico fueron vejiga hiperactiva (n=3; 2 de ellos con microhematuria), infección de vías urinarias (n=2) y litiasis (n=2); el paciente restante era asintomático y se le solicitó la calciuria al padecer una purpura de Schönlein-Henoch. Existían antecedentes familiares de litiasis en el 50% de los pacientes. Todos ellos tenían determinada la excreción fraccional de urato (EFUr) y realizadas tanto una ecografía renal como una densitometría ósea. A lo largo de la evolución, 5 pacientes mostraron cálculos; 2 de ellos eran microcálculos ecográficos. En el periodo 2, la edad fue de 17 (12,5) años (rango: 11,8-27).
Otros 9 pacientes más con hipouricemia e hipercalciuria no se incluyeron en este trabajo por no disponerse de los valores de EFUr y/o de la densidad mineral ósea. Sus niveles de urato oscilaron entre 0,53 y 1,93mg/dl y los del cociente calcio/creatinina entre 0,21 y 0,57mg/mg. Su clínica de presentación era muy similar a la de los pacientes del grupo con los datos completos.
Los resultados se compararon con los de 36 pacientes afectos de HI (14V y 22M) que tenían determinada la uricemia y realizadas tanto una ecografía renal como una densitometría ósea (periodo 1). Habían sido diagnosticados a la edad de 10,1 (3,8) años (rango: 2-13). La calciuria inicial fue de 5,33 (2,66) mg/kg/día (rango: 4,01-11,09). Los síntomas y signos al diagnóstico fueron infección de la vía urinaria (n=9), vejiga hiperactiva y/o enuresis nocturna (n=6), hematuria macro o microscópica (n=4), dolor abdominal crónico (n=3), litiasis (n=3) y disuria (n=3); en los 8 restantes, se determinó la calciuria por la existencia de antecedentes familiares de HI y/o urolitiasis. En el periodo 2, la edad fue de 13,2 (3,9) años (rango: 8,2-18,2). Existían antecedentes familiares de litiasis en el 67% de los casos.
En los pacientes de ambos grupos no existían otros datos de disfunción tubular proximal renal tales como hiperaminoaciduria, glucosuria o proteinuria de bajo peso molecular.
En ambos grupos, las recomendaciones dietéticas en el momento del diagnóstico fueron las habituales en los niños con litiasis o prelitiasis, es decir, incrementar la ingesta de líquidos y aumentar la ingesta de verduras, frutas (sobre todo, cítricos), pescados «azules» ricos en ácidos grasos omega-3 y gofio. El gofio producto rico en fitato es típico de las islas Canarias; está compuesto por una harina de cereales tostados, generalmente, de trigo o maíz. Asimismo, se recomendó que no abusaran de la ingesta de sal ni de otras proteínas, de tal modo que se instó a que no tomaran más de 500ml diarios de leche y/o productos lácteos.
DatosLos datos del periodo 1, tanto en el grupo de estudio como en el de los niños con HI, corresponden al momento en el que se determinaron por primera vez los niveles de urato. De ese momento se determinaron el peso y la altura y se calculó el índice de masa corporal (IMC). Los parámetros recogidos en sus historias clínicas fueron los niveles sanguíneos de creatinina, urato, calcio, fosfato y PTH intacta, así como la calciuria y los valores de calcio y creatinina en la primera orina del día. Además, se anotó el valor de la osmolalidad urinaria máxima y el valor z de la densidad mineral ósea (z-DMO). Se calculó el cociente calcio/creatinina, el volumen correspondiente a 100ml de FGR (V/FGR), la EFUr y el urato reabsorbido por 100ml de filtrado glomerular (tabla 1). Los datos del periodo 2, en ambos grupos, corresponden a la segunda cuantificación de los niveles de urato, generalmente en torno a la adolescencia.
Fórmulas empleadas
| Volumen correspondiente a 100ml de FGR (V/FGR) (ml/100ml FGR) | ([PCr]×100)/[UCr] |
| Excreción fraccional de urato (EFUr) (ml/100ml FGR) | ([UUr]×V/GFR)/[PUr] |
| Reabsorción tubular de urato (PUr-índice de excreción de Ur) (mg/dl) | [PUr]–(([UUr]×[Pcr])/[UCr]) |
PCr y UCr: niveles plasmáticos y urinarios de creatinina, respectivamente; PUr y UUr: niveles plasmáticos y urinarios de urato, respectivamente.
La creatinina (técnica enzimática), el calcio, el fosfato y el urato se midieron utilizando un analizador automatizado (Cobas® 702 Roche Diagnostics). Se consideró hipouricemia cuando los niveles de urato fueron iguales o inferiores a 2mg/dl9. La paratohormona intacta (PTHi) se cuantificó mediante un ensayo inmuno-radiométrico ELISA-PTH (Cisbio Bioassays); se consideraron valores normales los comprendidos entre 10 y 65pg/ml. La osteocalcina y el calcitriol fueron determinados mediante radioinmunoanálisis (RIA). En la determinación de la deoxipiridinolina (Dpir) se empleó una técnica de quimioluminiscencia directa con un inmunoanálisis competitivo en el que la Dpir de la muestra compite con piridinolina acoplada a partículas paramagnéticas por un anticuerpo monoclonal anti-Dpir (Chiron Diagnostics)10.
Prueba de concentración con desmopresinaUna vez vaciada la vejiga, se administraron 20μg de desmopresina por vía intranasal o bien 120μg del liofilizado oral que se administra por vía sublingual (Minurin Flas®). Se recogieron 3 muestras de orina en intervalos de 90min. Se permitió la ingestión de alimentos y se recomendó no abusar de líquidos. Se dio como resultado de la prueba el valor mayor de osmolalidad determinado. Se considera normal un valor de osmolaridad urinaria máxima superior a 800mOsm/kg11.
Densitometría mineral óseaLa densidad mineral ósea (DMO) se determinó mediante tecnología DXA utilizando un densitómetro QDR® 4500 SL (Hologic, Danbury, CT). En las 2 fases del estudio se utilizó el mismo densitómetro. El contenido mineral óseo se midió en la columna lumbar. El coeficiente de variación es de 1,06% para la columna. Los resultados se expresaron mediante el valor z (z-DMO) que compara el valor de cada participante con el de una población de control emparejada por edad y sexo; z-DMO se calcula utilizando los datos de controles proporcionados por el software del densitómetro12.
Análisis estadísticoLas variables cuantitativas se expresaron como mediana y rango intercuartil. Para investigar las diferencias entre grupos se usó la prueba de la U de Mann-Whitney. Para estudiar las diferencias entre las variables cualitativas se empleó la prueba de la Chi-cuadrado con la variante de Yates, cuando fue necesario. Los datos se analizaron utilizando el programa SPSS® versión 20.0 (SPSS Inc., Chicago, IL, EE. UU.).
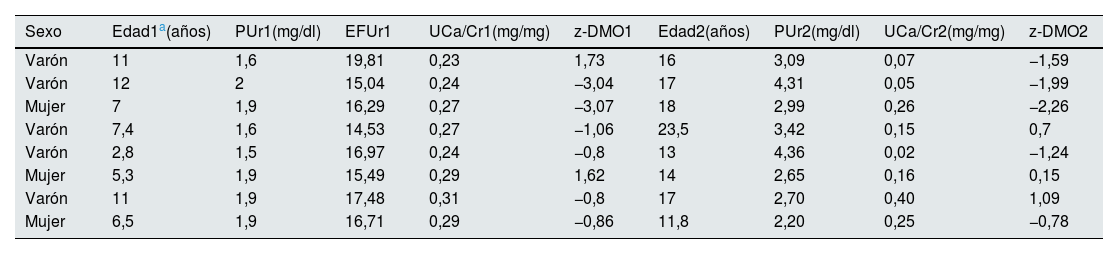
ResultadosLos valores iniciales y finales de la edad, niveles de ácido úrico, cociente calcio/creatinina y z-DMO en los pacientes del grupo de hipouricemia e hipercalciuria figuran en la tabla 2. Asimismo, en esa tabla se reflejan los valores iniciales de la EFUr y del urato reabsorbido por 100ml de filtrado glomerular. La osmolalidad urinaria máxima fue normal en todos los casos (tabla 3). Los niveles de calcitriol (n=7; rango: 19-45pg/ml), así como los de PTH intacta (n=7; rango: 6,1-27,9pg/ml) fueron normales. A cinco pacientes se les había realizado la prueba de la pirazinamida con una respuesta adecuada, de tal modo que EFUr descendió a valores comprendidos entre 0,11 y 1,84ml/100ml FGR. Los valores de z-DMO fueron menores de −1 en 4/8 casos. En el periodo 2, el valor del cociente calcio/creatinina permanecía elevado solo en 3 casos y todos los pacientes tenían unos niveles de urato superiores a 2mg/dl (tabla 2). El valor del z-DMO había mejorado en 5 casos y se había reducido en los 3 restantes. Tres pacientes mostraron cálculos ecográficos y 2 microcálculos.
Diversas variables cuantitativas de los pacientes con hipouricemia e hipercalciuria al inicio (1) y al final del seguimiento (2)
| Sexo | Edad1a(años) | PUr1(mg/dl) | EFUr1 | UCa/Cr1(mg/mg) | z-DMO1 | Edad2(años) | PUr2(mg/dl) | UCa/Cr2(mg/mg) | z-DMO2 |
|---|---|---|---|---|---|---|---|---|---|
| Varón | 11 | 1,6 | 19,81 | 0,23 | 1,73 | 16 | 3,09 | 0,07 | −1,59 |
| Varón | 12 | 2 | 15,04 | 0,24 | −3,04 | 17 | 4,31 | 0,05 | −1,99 |
| Mujer | 7 | 1,9 | 16,29 | 0,27 | −3,07 | 18 | 2,99 | 0,26 | −2,26 |
| Varón | 7,4 | 1,6 | 14,53 | 0,27 | −1,06 | 23,5 | 3,42 | 0,15 | 0,7 |
| Varón | 2,8 | 1,5 | 16,97 | 0,24 | −0,8 | 13 | 4,36 | 0,02 | −1,24 |
| Mujer | 5,3 | 1,9 | 15,49 | 0,29 | 1,62 | 14 | 2,65 | 0,16 | 0,15 |
| Varón | 11 | 1,9 | 17,48 | 0,31 | −0,8 | 17 | 2,70 | 0,40 | 1,09 |
| Mujer | 6,5 | 1,9 | 16,71 | 0,29 | −0,86 | 11,8 | 2,20 | 0,25 | −0,78 |
EFUr: excreción fraccional de urato; PUr: niveles plasmáticos de urato; UCa/Cr: cociente calculado entre las concentraciones urinarias de calcio y creatinina; z-DMO: valor z de la densidad mineral ósea.
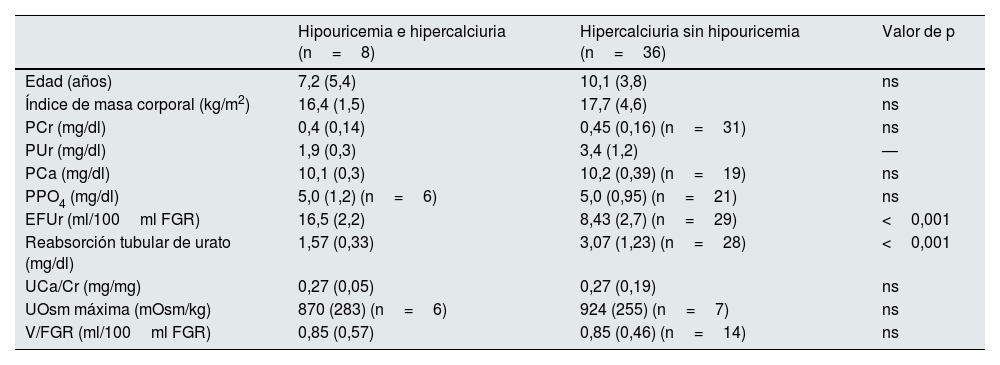
Edad, índice de masa corporal y parámetros sanguíneos y urinarios cuantificados en los 2 subgrupos incluidos en el estudio en el periodo 1
| Hipouricemia e hipercalciuria (n=8) | Hipercalciuria sin hipouricemia (n=36) | Valor de p | |
|---|---|---|---|
| Edad (años) | 7,2 (5,4) | 10,1 (3,8) | ns |
| Índice de masa corporal (kg/m2) | 16,4 (1,5) | 17,7 (4,6) | ns |
| PCr (mg/dl) | 0,4 (0,14) | 0,45 (0,16) (n=31) | ns |
| PUr (mg/dl) | 1,9 (0,3) | 3,4 (1,2) | — |
| PCa (mg/dl) | 10,1 (0,3) | 10,2 (0,39) (n=19) | ns |
| PPO4 (mg/dl) | 5,0 (1,2) (n=6) | 5,0 (0,95) (n=21) | ns |
| EFUr (ml/100ml FGR) | 16,5 (2,2) | 8,43 (2,7) (n=29) | <0,001 |
| Reabsorción tubular de urato (mg/dl) | 1,57 (0,33) | 3,07 (1,23) (n=28) | <0,001 |
| UCa/Cr (mg/mg) | 0,27 (0,05) | 0,27 (0,19) | ns |
| UOsm máxima (mOsm/kg) | 870 (283) (n=6) | 924 (255) (n=7) | ns |
| V/FGR (ml/100ml FGR) | 0,85 (0,57) | 0,85 (0,46) (n=14) | ns |
EFUr: excreción fraccional de urato; ns: no significativo; PCa y UCa: niveles plasmáticos y urinarios de calcio, respectivamente; PPO4: niveles plasmáticos de fosfato; PUr: niveles plasmáticos de urato; UCa/Cr: cociente calculado entre las concentraciones urinarias de calcio y creatinina; UOsm: osmolalidad urinaria máxima; V/FGR: volumen urinario corregido por 100ml de FGR.
En el grupo con hipouricemia e hipercalciuria en relación con el grupo con HI y normouricemia, no se apreciaron diferencias en el periodo 1 en cuanto a la edad, el índice de masa corporal, los parámetros que estudian el manejo renal del agua, los niveles de creatinina, calcemia y fosfatemia y el cociente calcio/creatinina, y solo se observaron diferencias estadísticamente significativas en los parámetros que estudian la eliminación urinaria de urato (tabla 3).
En la tabla 4 se recogen los parámetros de remodelado óseo y de DMO en el periodo 1. No se observaron diferencias entre ambos grupos en el cociente deoxipiridinolina/creatinina y el valor del z-DMO, aunque sí en los niveles de osteocalcina.
Marcadores de remodelado óseo y valor z de la densidad mineral ósea en los 2 grupos incluidos en el estudio en el periodo 1
| Hipouricemia ehipercalciuria (n=8) | Hipercalciuria sin hipouricemia (n=36) | Valor de p | |
|---|---|---|---|
| Osteocalcina (ng/ml) | 21,4 (20,2) (n=7) | 45,9 (28,9) (n=16) | 0,03 |
| UDPir/Cr (nM/mM) | 23,1 (16,1) (n=5) | 29,3 (7,2) (n=14) | ns |
| z-DMO | −0,83 (3,56) | −1,40 (1,19) | ns |
ns: no significativo; UDPir: deoxipiridinolina en orina; z-DMO: valor z de la densidad mineral ósea.
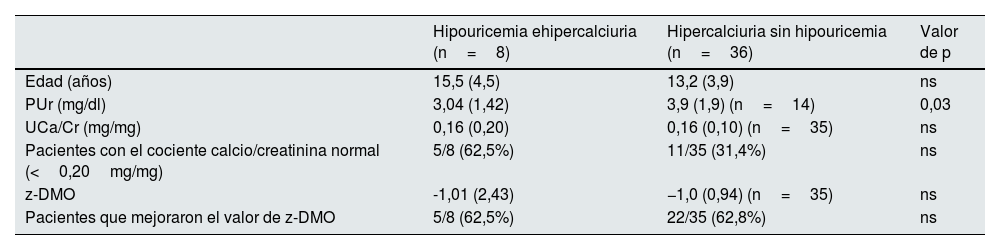
En el periodo 2, los niveles de uricemia seguían siendo significativamente inferiores con respecto a los del grupo HI, aunque sin observarse diferencias en la calciuria ni en el valor del z-DMO. Asimismo, tampoco se comprobaron diferencias en la frecuencia de niños que habían mejorado el cociente calcio/creatinina ni en la de los que mejoraron el valor del z-DMO. En este periodo no se dispuso de los parámetros que estudian la eliminación urinaria de urato (tabla 5).
Edad, niveles de urato y del cociente calcio/creatinina y valor del z-DMO en los 2 subgrupos incluidos en el estudio en el periodo 2. Pacientes con mejoría del cociente calcio/creatinina y del valor de z-DMO
| Hipouricemia ehipercalciuria (n=8) | Hipercalciuria sin hipouricemia (n=36) | Valor de p | |
|---|---|---|---|
| Edad (años) | 15,5 (4,5) | 13,2 (3,9) | ns |
| PUr (mg/dl) | 3,04 (1,42) | 3,9 (1,9) (n=14) | 0,03 |
| UCa/Cr (mg/mg) | 0,16 (0,20) | 0,16 (0,10) (n=35) | ns |
| Pacientes con el cociente calcio/creatinina normal (<0,20mg/mg) | 5/8 (62,5%) | 11/35 (31,4%) | ns |
| z-DMO | -1,01 (2,43) | −1,0 (0,94) (n=35) | ns |
| Pacientes que mejoraron el valor de z-DMO | 5/8 (62,5%) | 22/35 (62,8%) | ns |
ns: no significativo; PUr: niveles plasmáticos de urato; UCa/Cr: cociente calculado entre las concentraciones urinarias de calcio y creatinina; z-DMO: valor z de la densidad mineral ósea.
A pH sanguíneo fisiológico, alrededor del 98% del ácido úrico en sangre se encuentra en forma de urato monosódico. En la orina, cuando el pH está por debajo de 5,5, el ácido úrico se halla en forma no disociada y altamente insoluble, por lo que puede cristalizar. La tubulopatía Hipouricemia tubular renal (tipo 1: OMIM 220150 y tipo 2: OMIM 612076) fue descrita en 1950 por Praetorius y Kirk13. Estos autores observaron que, en su paciente, la hiperuricosuria era muy elevada, y el aclaramiento de urato superior al de creatinina, lo que sugería la existencia de una secreción tubular del ión. Estudios fisiológicos realizados en los años siguientes hicieron presuponer que el manejo tubular proximal del urato tenía 3 componentes, a saber, reabsorción presecretora, secreción tubular y reabsorción postsecretora. Estos mecanismos no se han podido confirmar recientemente al conocerse, con técnicas de biología molecular, la complejidad y la diversidad de los transportadores que intervienen en la reabsorción tubular proximal de urato
En concreto, la Hipouricemia tubular renal tipo 1 es causada por mutaciones en el gen SLC22A12 que codifica el intercambiador luminal urato-anión urate-anion transporter 1 (URAT1)14. Estos pacientes se caracterizan por mostrar niveles reducidos de urato (entre 0,5 y 1,5mg/dl), una EFUr elevada (entre 20 y 90/100ml FGR) y una respuesta atenuada de la uricosuria al probenecid y la pirazinamida15. La hipouricemia tubular renal tipo 2 es causada por mutaciones en el gen SLC2A9 que codifica el transportador basolateral glucose transporter (GLUT9)16. Los pacientes con esta variante muestran niveles aún más reducidos de urato (menores de 0,5mg/dl) y unos valores de EFUr superiores a 150/100ml FGR17. La respuesta a pirazinamida está conservada18.
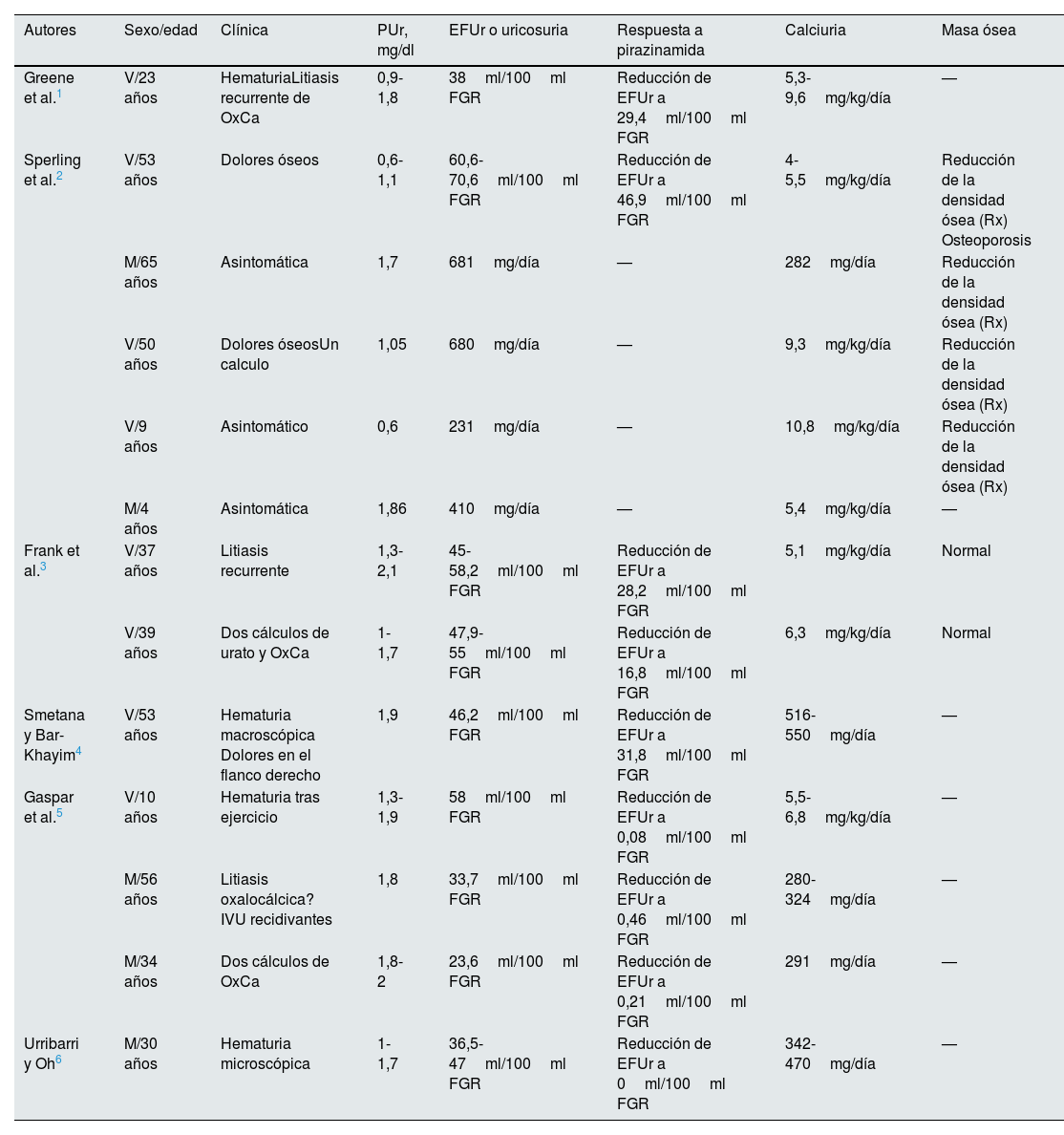
En la literatura sobre el tema se han descrito algunos casos de Hipouricemia tubular renal en los que existía hipercalciuria1–6. Los datos más importantes de estos pacientes se han recogido en la tabla 6. Algunos pacientes con esta asociación no se han incluido en la tabla por estar afectos de otras enfermedades como parálisis cerebral19, diabetes mellitus20, mieloma5 y síndrome nefrótico21. Los niveles de urato de los pacientes revisados oscilaban entre 0,6 y 2mg/dl y la EFUr siempre fue superior a 20/100ml FGR. Los casos publicados por Greene et al.1, Sperling et al.2, Frank et al.3 y Smetana y Bar-Khayim4 parecen compatibles con alteraciones funcionales en el intercambiador URAT dada la respuesta atenuada a la pirazinamida15 (tabla 6). Además, los 3 pacientes presentados en 2 de las publicaciones anteriores3,4 también mostraron una respuesta atenuada al probenecid (datos no mostrados en la tabla 5). En los casos de Hipouricemia tubular renal publicados por Gaspar et al.5 y Uribarri y Oh6, la respuesta a la pirazinamida fue adecuada. Esta es la respuesta esperada en pacientes con alteraciones funcionales en el transportador GLUT918, pero en esa circunstancia los niveles de urato son muy reducidos, dato no observado en los pacientes citados por lo que, quizás, fueran portadores heterocigotos de una mutación con pérdida de función en GLUT9. En todo caso, por lo revisado parece ser que la hipercalciuria no es específica de ninguno de los 2 tipos de Hipouricemia tubular renal. Hasta ahora, no se ha descrito que una alteración del manejo tubular proximal del urato se acompañe de una reducción de la reabsorción tubular renal de calcio a ese nivel. Además, si eso ocurriera podría recuperarse calcio en los segmentos más distales de la nefrona, especialmente, en el túbulo distal.
Datos clínicos y bioquímicos de los pacientes publicados con hipouricemia tubular renal e hipercalciuria
| Autores | Sexo/edad | Clínica | PUr, mg/dl | EFUr o uricosuria | Respuesta a pirazinamida | Calciuria | Masa ósea |
|---|---|---|---|---|---|---|---|
| Greene et al.1 | V/23 años | HematuriaLitiasis recurrente de OxCa | 0,9-1,8 | 38ml/100ml FGR | Reducción de EFUr a 29,4ml/100ml FGR | 5,3-9,6mg/kg/día | — |
| Sperling et al.2 | V/53 años | Dolores óseos | 0,6-1,1 | 60,6-70,6ml/100ml FGR | Reducción de EFUr a 46,9ml/100ml FGR | 4-5,5mg/kg/día | Reducción de la densidad ósea (Rx) Osteoporosis |
| M/65 años | Asintomática | 1,7 | 681mg/día | — | 282mg/día | Reducción de la densidad ósea (Rx) | |
| V/50 años | Dolores óseosUn calculo | 1,05 | 680mg/día | — | 9,3mg/kg/día | Reducción de la densidad ósea (Rx) | |
| V/9 años | Asintomático | 0,6 | 231mg/día | — | 10,8mg/kg/día | Reducción de la densidad ósea (Rx) | |
| M/4 años | Asintomática | 1,86 | 410mg/día | — | 5,4mg/kg/día | — | |
| Frank et al.3 | V/37 años | Litiasis recurrente | 1,3-2,1 | 45-58,2ml/100ml FGR | Reducción de EFUr a 28,2ml/100ml FGR | 5,1mg/kg/día | Normal |
| V/39 años | Dos cálculos de urato y OxCa | 1-1,7 | 47,9-55ml/100ml FGR | Reducción de EFUr a 16,8ml/100ml FGR | 6,3mg/kg/día | Normal | |
| Smetana y Bar-Khayim4 | V/53 años | Hematuria macroscópica Dolores en el flanco derecho | 1,9 | 46,2ml/100ml FGR | Reducción de EFUr a 31,8ml/100ml FGR | 516-550mg/día | — |
| Gaspar et al.5 | V/10 años | Hematuria tras ejercicio | 1,3-1,9 | 58ml/100ml FGR | Reducción de EFUr a 0,08ml/100ml FGR | 5,5-6,8mg/kg/día | — |
| M/56 años | Litiasis oxalocálcica? IVU recidivantes | 1,8 | 33,7ml/100ml FGR | Reducción de EFUr a 0,46ml/100ml FGR | 280-324mg/día | — | |
| M/34 años | Dos cálculos de OxCa | 1,8-2 | 23,6ml/100ml FGR | Reducción de EFUr a 0,21ml/100ml FGR | 291mg/día | — | |
| Urribarri y Oh6 | M/30 años | Hematuria microscópica | 1-1,7 | 36,5-47ml/100ml FGR | Reducción de EFUr a 0ml/100ml FGR | 342-470mg/día | — |
EFUr: excreción fraccional de urato; IVU: infección de vías urinarias; M: mujer; OxCa: oxalato cálcico; PUr: niveles plasmáticos de urato; Rx: radiología convencional; V: varón.
Por lo recogido en la tabla 6, puede observarse que en los años 70 y 80 del pasado siglo se publicaron escasos casos de la asociación de hipouricemia con hipercalciuria. El interés de nuestro grupo por el tema se basa en el hecho de que en los años 90 habíamos diagnosticado en nuestro hospital varios pacientes con esa rara asociación7. Muchos de ellos tenían antecesores que provenían de la vecina isla de La Gomera. Como consecuencia de ello, en un estudio realizado en niños que vivían en varias poblaciones de esa isla, observamos que eran portadores de una elevada frecuencia de hipercalciuria y muy escasa de hipouricemia22, lo que no invalida la hipótesis de que algunos de ellos hubieran podido tener niveles reducidos sanguíneos transitorios de urato en los primeros años de la vida.
En el presente trabajo hemos estudiado 8 pacientes diagnosticados en nuestro hospital en la infancia de la asociación de hipouricemia con hipercalciuria. La intención es responder si se trata de pacientes afectos de Hipouricemia tubular renal con hipercalciuria o de pacientes con HI e hipouricemia.
En los últimos años se ha descrito que la HI no es una enfermedad y, por tanto, no es una tubulopatía. Lo más probable es que la hipercalciuria esté relacionada con un incremento del número de receptores de la vitamina D, con la consecuencia de un acrecentamiento de la absorción intestinal de calcio23 y un aumento de la resorción ósea24 que se traduce en una discreta de reducción de la DMO. Un valor de z-DMO menor de −1 se observa entre el 30 al 40% de los niños25 y en el 60% de las pacientes adultas con HI26. En este sentido, es posible que algunos de los casos de la denominada Osteoporosis idiopática juvenil sean, en realidad formas extremas de HI27,28. Recientemente, hemos descrito que muchos pacientes con HI, sobre todo mujeres, mejoran el valor de z-DMO al llegar a la edad adulta29.
En nuestro trabajo, en el grupo de hipouricemia e hipercalciuria en relación con el grupo de hipercalciuria con niveles de urato normales, no se apreciaron diferencias en los parámetros que estudian el manejo renal del agua, los niveles de calcemia y fosfatemia, el cociente calcio/creatinina y el valor del z-DMO (tablas 3-5). Únicamente se observaron diferencias estadísticamente significativas en los parámetros que estudian la eliminación urinaria de urato (tabla 3), en los niveles de osteocalcina (tabla 4) y en la uricemia al final del seguimiento (tabla 5). Es de destacar que muchos pacientes de ambos grupos habían normalizado el cociente calcio/creatinina y mejorado el valor del z-DMO en el periodo 2 (tabla 5). En esta fase, como se ha indicado, no se dispuso de los parámetros que estudian la eliminación urinaria de urato. Este dato coincide con lo comunicado previamente por nuestro grupo en el sentido de que algunos pacientes diagnosticados de HI en la infancia normalizan la calciuria, además de la masa ósea, alrededor de la adolescencia o en la edad adulta temprana29.
En la literatura sobre el tema se ha descrito una cierta relación entre los niveles de urato y los de calcitriol. Así, en 1993, Vanholder et al. observaron en pacientes con insuficiencia renal crónica leve a moderada que, tras la administración de alopurinol a corto plazo, se reducían los niveles de urato plasmático y se incrementaban los niveles de calcitriol30. En animales de experimentación, Chen et al. demostraron que la hiperuricemia suprime la 1-α hidroxilasa renal conduciendo a una menor concentración de calcitriol y a niveles más elevados de PTH31. En consecuencia, en pacientes con hipouricemia, es posible que la ausencia del efecto inhibitorio del ácido úrico intracelular sobre la 1-alfa-hidroxilasa, favorezca un incremento de los niveles de calcitriol y la aparición consiguiente de hipercalciuria6.
En resumen, en algunos pacientes con Hipouricemia tubular renal (EFUr mayor del 20%) (tabla 6) existe hipercalciuria que podría estar mediada por la ausencia ya comentada del efecto inhibitorio del ácido úrico intracelular sobre la 1-alfa-hidroxilasa. Por otro lado, algunos pacientes con HI, como se ha observado en nuestra serie, tienen pérdidas urinarias discretas de urato (EFUr menor del 20%), presumiblemente a nivel tubular proximal, si bien los valores de uricemia y de calciuria tienden a normalizarse en muchos casos con la edad y no existen diferencias en el valor de z-DMO en relación con los pacientes con HI sin hipouricemia.
En resumen, nuestros pacientes con hipercalciuria e hipouricemia estarían afectos de una variante de HI en la que por causa desconocida estaría reducida discretamente y de modo mejorable la reabsorción tubular proximal de urato.
Es necesario indicar que nueve pacientes con hipouricemia e hipercalciuria no se incluyeron en el trabajo por no disponerse de valores básicos que eran necesarios para el diagnóstico. Esta ausencia de esos datos tiene un efecto limitante en nuestros resultados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.