La mejoría en la supervivencia del receptor y del injerto renal sufre un proceso de deceleración. La tasa de pérdida del injerto a medio y largo plazo permanece estable desde hace 25 años. Es fundamental conocer las causas de pérdida del injerto y los factores relacionados, así como identificar si se han producido cambios en las causas de pérdida del injerto en los últimos años.
El objetivo del presente estudio fue evaluar las causas de pérdida del injerto según fallecimiento del receptor o pérdida del injerto con vuelta a diálisis/retrasplante, y analizar las causas específicas de pérdida del injerto en 2 épocas (1979-1999 y 2000-2019) para identificar cambios en el perfil de los injertos perdidos.
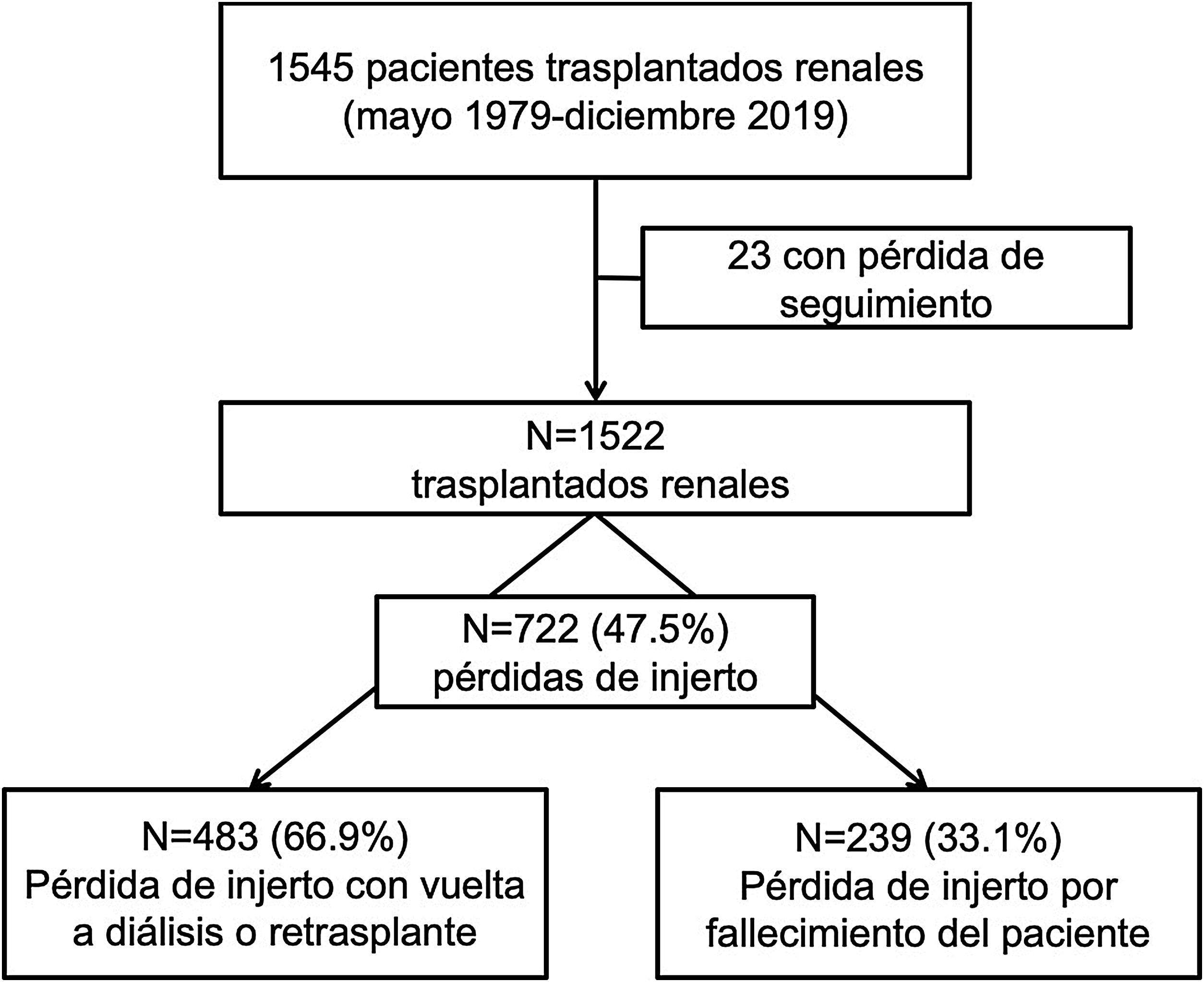
Pacientes y métodosEstudio retrospectivo de todos los trasplantes renales (TR) realizados en el Hospital del Mar (Barcelona) entre mayo-1979 y diciembre-2019. Consideramos pérdida del injerto el fallecimiento del paciente con injerto funcionante o el re-inicio de diálisis o retrasplante. Revisamos las causas de pérdida mediante información clínica e histológica, y analizamos los resultados en 2 periodos (1979-1999 y 2000-2019).
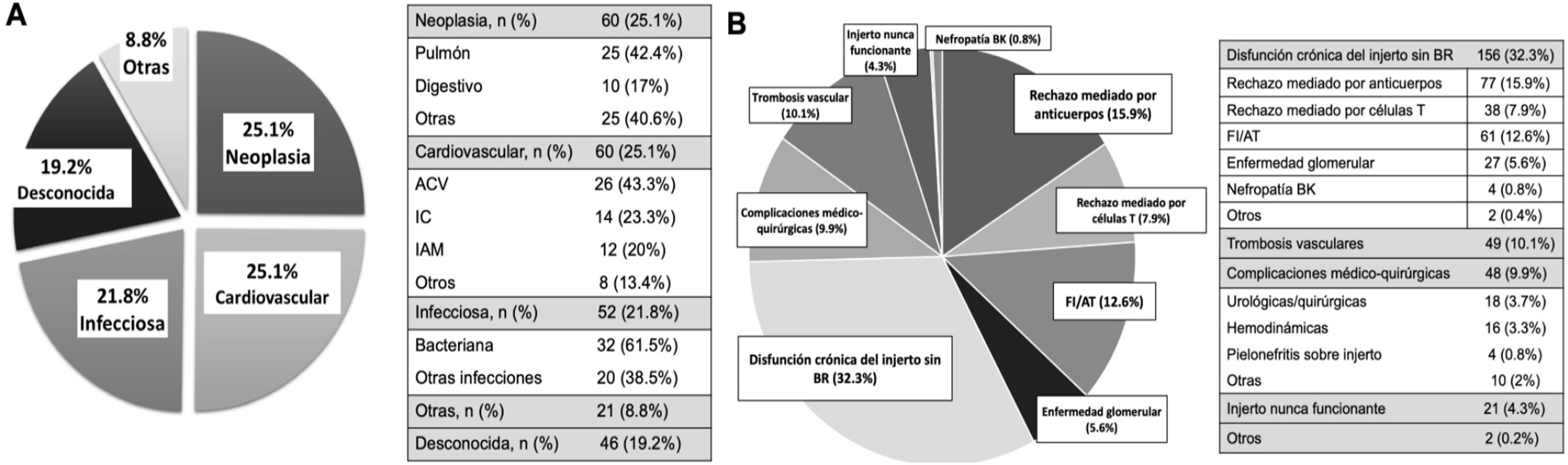
ResultadosDe los 1.522 TR realizados, 722 (47,5%) perdieron el injerto renal con una mediana de seguimiento hasta la pérdida de 56 (RIQ: 8-123) meses. De estas pérdidas, 483 (66,9%) se produjeron por fracaso del injerto y 239 (33,1%) por fallecimiento del receptor con injerto funcionante. Las causas del fallecimiento fueron las cardiovasculares (25,1%), las neoplasias (25,1%) y las infecciones (21,8%), de forma similar en ambas épocas de trasplante. Solo el éxitus de causa desconocida ha disminuido en la época más reciente.
La principal causa de vuelta a diálisis/retrasplante fue la disfunción del injerto (75%), siendo el rechazo mediado por anticuerpos y la fibrosis intersticial/atrofia tubular los hallazgos histológicos más frecuentes (15,9 y 12,6%). Del total de pérdidas, 213 fueron precoces (29,5%). La trombosis vascular fue la causa más frecuente de pérdida precoz (<1 año posTR) entre 2000 y 2019 (46,7%), mientras que en el periodo 1979-1999 lo fue el rechazo celular (31,3%). Las causas de pérdida del injerto tardías fueron similares en ambas épocas.
ConclusionesLos pacientes fallecen de causas cardiovasculares y neoplasias, y esto no ha cambiado con los años. La trombosis vascular emerge como causa frecuente de pérdida precoz del injerto en la época actual. La identificación adecuada de las causas de pérdida del injerto es fundamental para mejorar los resultados postrasplante.
The improvement of kidney allograft recipient and graft survival showed a decrease over the last 40 years. Long-term graft loss rate remained stable during a 25-year time span. Knowing the changing causes and the risk factors associated with graft loss requires special attention.
The present study aimed to assess the causes of graft loss and kidney allograft recipient death. Also, we aimed to compare two different periods (1979-1999 and 2000-2019) to identify changes in the characteristics of the failed allografts and recipient and donors profile.
Methods and patientsWe performed a single-center cohort study. We included all the kidney transplant recipients at the Hospital del Mar (Barcelona) between May 1979 and December 2019. Graft loss was defined as recipient death with functioning graft and as loss of graft function (return to dialysis or retransplantation). We assessed the causes of graft loss using clinical and histological information. We also analyzed the results of the two different transplant periods (1979-1999 and 2000-2019).
ResultsBetween 1979 and 2019, 1522 transplants were performed. The median follow-up time was 56 (IQR: 8-123) months. During follow-up, 722 (47.5%) grafts were lost: 483 (66.9%) due to graft failure and 239 (33.1%) due to death with functioning graft. The main causes of death were cardiovascular (25.1%), neoplasms (25.1%), and infectious diseases (21.8%). These causes were stable between the two periods of time. Only the unknown cause of death has decreased in the last period.
The main cause of graft failure (loss of graft function) was the allograft chronic dysfunction (75%). When histologic information was available, antibody-mediated rejection (ABMR) and interstitial fibrosis/tubular atrophy (IF/TA) were the most frequent specific causes (15.9% and 12.6%). Of the graft failures, 213 (29.5%) were early (<1 year of transplantation). Vascular thrombosis was the main cause of early graft failure in the second period (2000-2019) (46.7%) and T-cell-mediated rejection (TCMR) was the main cause (31.3%) in the first period (1979-1999). The causes of late graft loss were similar between the two periods.
ConclusionsThe causes of kidney allograft recipient death are still due to cardiovascular and malignant diseases. Vascular thrombosis has emerged as a frequent cause of early graft loss in the most recent years. The evaluation of the causes of graft loss is necessary to improve kidney transplantation outcomes.
- •
Las causas de la pérdida del injerto más allá de primer año postrasplante, y las causas de fallecimiento de los receptores de trasplante renal no han variado en los últimos 40 años.
- •
La trombosis vascular emerge como una causa frecuente de la pérdida precoz del injerto. Sin embargo, la pérdida del injerto por rechazo agudo mediado por células T es poco frecuente en la época más reciente comparado con las etapas iniciales del programa de trasplante.
- •
Durante los últimos 20 años mejora la supervivencia del injerto con una menor tasa de pérdida durante el primer año postrasplante. Las tasas de la pérdida del injerto permanecen estables a partir del primer año postrasplante.
El trasplante renal (TR) es el tratamiento renal sustitutivo (TRS) de elección para los pacientes con enfermedad renal crónica (ERC) avanzada dado que mejora su morbimortalidad1–4. Los avances en inmunosupresión, en las técnicas quirúrgicas y en el conocimiento de la inmunología del trasplante han permitido mejorar las tasas de supervivencia del paciente y del injerto, fundamentalmente a corto plazo5. La probabilidad de pérdida del injerto por todas las causas el primer año postrasplante ha pasado del 13,9% en 1997 al 6,7% en 20176.
Sin embargo, más del 50% de los injertos renales se pierden a los 10 años, y las tasas de pérdida del injerto más allá del primer año se han mantenido estables en los últimos 25 años, siendo la tasa anual de pérdida del 3-5% para trasplantes renales procedentes de donantes fallecidos óptimos y del 2-3% para el donante vivo5. Los registros estadounidense y europeo muestran una mejoría de la supervivencia a corto y largo plazo hasta el año 2000. Pero en las últimas décadas, la mejoría de la supervivencia sufre un proceso de deceleración7–9. Hay estudios que lo atribuyen a un problema global por la ausencia de innovación, tanto en el campo de la inmunosupresión como del manejo integral del paciente trasplantado8, y otros apuntan a un cambio de perfil del donante y del paciente en lista de espera, cada vez más expandidos, como responsables de la pérdida precoz del injerto o del fallecimiento prematuro del paciente9. Son necesarias estrategias que permitan mejorar los resultados en TR y, para ello, es fundamental identificar las causas de la pérdida del injerto y del fallecimiento del receptor. El escaso conocimiento o la errónea interpretación de estas causas son una importante barrera para mejorar la supervivencia del receptor y del injerto a corto y largo plazo.
El objetivo de nuestro trabajo fue identificar las causas de la pérdida del injerto según fallecimiento del receptor con injerto funcionante o pérdida de función renal con vuelta a diálisis o retrasplante. Además, quisimos analizar las diferentes causas de la pérdida del injerto comparando 2 épocas de trasplante (1979-1999 y 2000-2019) para identificar si se han producido cambios en el perfil de las pérdidas entre ambos periodos.
Material y métodosPoblación de estudioSe incluyeron todos los pacientes trasplantados renales en el Hospital del Mar (Barcelona) desde mayo de 1979 hasta diciembre de 2019. Se realizó seguimiento hasta la pérdida del injerto por fallecimiento del paciente o vuelta a TRS (diálisis o retrasplante) o hasta final de seguimiento el 31 de diciembre de 2020. Todos los trasplantes se realizaron con prueba cruzada por citotoxicidad negativa.
Todas las actividades clínicas e investigadoras incluidas en este trabajo fueron desarrolladas de acuerdo con los principios de las Declaraciones de Helsinki y Estambul.
Estudio histológico de biopsias del injerto renalSe incluyeron todas las biopsias del injerto renal (BR) realizadas en esta cohorte de pacientes durante el seguimiento. Las biopsias fueron por indicación clínica: proteinuria significativa, deterioro de función renal o detección de anticuerpos HLA donante específicos (DSA). Desde el año 2014, disponemos de BR iterativas de seguimiento a 1, 3 y 5 años postrasplante. Las biopsias fueron revisadas por un patólogo y un nefrólogo de forma independiente. El diagnóstico de todas las biopsias renales fue realizado según la clasificación de Banff 201710.
Estudio de anticuerpos anti-HLA postrasplanteSe realizó cribado de anticuerpos anti-HLA en plataforma Luminex® (Lifecodes LifeScreen Deluxe assay. Immucor Lifecodes Transplant Diagnostics, Nijlen, Bélgica). Cuando el cribado de anticuerpos anti-HLA resultó positivo, se realizó la identificación de anticuerpos HLA IgG utilizando Lifecodes® LSA clase I y/o clase II según las indicaciones del fabricante. Se realizó el análisis con el software MatchIT® y se consideró positivo el resultado con MFI>1.000.
La especificidad de los anticuerpos anti-HLA se atribuyó teniendo en cuenta HLA-A, HLA-B, HLA-C, DRB1* y DQB1*. Cuando no se disponía del tipaje HLA-C o DQB1* del donante, los anticuerpos anti-HLA frente al donante se asignaron considerando el desequilibrio de ligamiento.
Evaluación de las causas de la pérdida del injertoLa pérdida del injerto fue definida como ausencia de función renal ocurrida en cualquier momento del seguimiento postrasplante debida al fallecimiento del paciente o al daño irreversible del injerto con necesidad de vuelta a diálisis o retrasplante. Las causas de la pérdida de los injertos fueron clasificadas en 2 grupos1: fallecimiento del paciente con injerto funcionante2 y pérdida de la función del injerto.
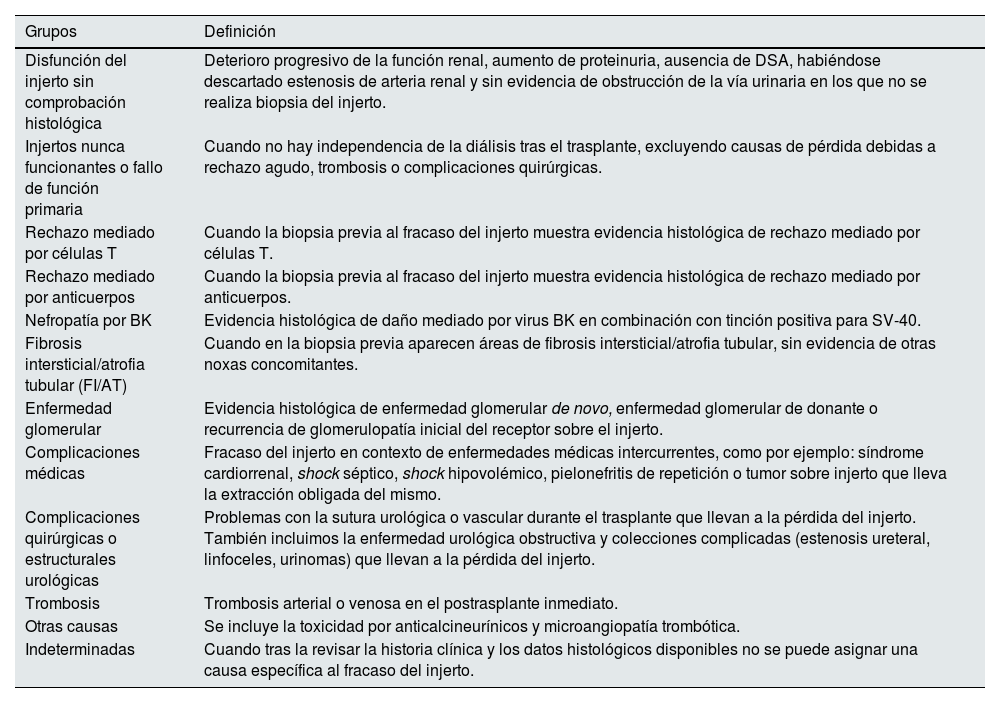
La causa de la pérdida del injerto se estableció tras la revisión exhaustiva de la historia clínica del paciente. Las causas de fracaso del injerto fueron clasificadas en 11 grupos basados en la información clínica e histológica (tabla 1). En algunos casos, varios procesos patológicos pudieron haber contribuido al fracaso del injerto. Estos casos, fueron clasificados dentro de un solo grupo basados en el juicio clínico de los investigadores, y según el diagnóstico más relevante.
Clasificación de causas de pérdida de injerto
| Grupos | Definición |
|---|---|
| Disfunción del injerto sin comprobación histológica | Deterioro progresivo de la función renal, aumento de proteinuria, ausencia de DSA, habiéndose descartado estenosis de arteria renal y sin evidencia de obstrucción de la vía urinaria en los que no se realiza biopsia del injerto. |
| Injertos nunca funcionantes o fallo de función primaria | Cuando no hay independencia de la diálisis tras el trasplante, excluyendo causas de pérdida debidas a rechazo agudo, trombosis o complicaciones quirúrgicas. |
| Rechazo mediado por células T | Cuando la biopsia previa al fracaso del injerto muestra evidencia histológica de rechazo mediado por células T. |
| Rechazo mediado por anticuerpos | Cuando la biopsia previa al fracaso del injerto muestra evidencia histológica de rechazo mediado por anticuerpos. |
| Nefropatía por BK | Evidencia histológica de daño mediado por virus BK en combinación con tinción positiva para SV-40. |
| Fibrosis intersticial/atrofia tubular (FI/AT) | Cuando en la biopsia previa aparecen áreas de fibrosis intersticial/atrofia tubular, sin evidencia de otras noxas concomitantes. |
| Enfermedad glomerular | Evidencia histológica de enfermedad glomerular de novo, enfermedad glomerular de donante o recurrencia de glomerulopatía inicial del receptor sobre el injerto. |
| Complicaciones médicas | Fracaso del injerto en contexto de enfermedades médicas intercurrentes, como por ejemplo: síndrome cardiorrenal, shock séptico, shock hipovolémico, pielonefritis de repetición o tumor sobre injerto que lleva la extracción obligada del mismo. |
| Complicaciones quirúrgicas o estructurales urológicas | Problemas con la sutura urológica o vascular durante el trasplante que llevan a la pérdida del injerto. También incluimos la enfermedad urológica obstructiva y colecciones complicadas (estenosis ureteral, linfoceles, urinomas) que llevan a la pérdida del injerto. |
| Trombosis | Trombosis arterial o venosa en el postrasplante inmediato. |
| Otras causas | Se incluye la toxicidad por anticalcineurínicos y microangiopatía trombótica. |
| Indeterminadas | Cuando tras la revisar la historia clínica y los datos histológicos disponibles no se puede asignar una causa específica al fracaso del injerto. |
Se analizaron las causas de pérdida del injerto según dos épocas de trasplante: periodo 1 (que incluye el periodo comprendido desde el año 1979 hasta el año 1999) y periodo 2 (desde el año 2000 hasta el 2019).
Análisis estadísticoLas variables con una distribución normal fueron expresadas como media±desviación estándar (DE) y las variables con distribución no normal con la mediana y el rango intercuartílico (RIQ). En el análisis comparativo de las características entre los grupos se aplicó el test de Chi-cuadrado o exacto de Fisher para analizar las variables categóricas. Para variables continuas con distribución normal se utilizó el test de la t de Student y el test U de Mann-Whitney para las variables continuas no paramétricas. Se realizó tel est de ANOVA para comparaciones de más de 2 grupos.
La supervivencia del injerto y del paciente fue estimada mediante las curvas de Kaplan-Meier con el test de log-rank. El tiempo hasta la pérdida del injerto censurada por muerte se consideró desde la fecha del trasplante hasta el comienzo de diálisis o retrasplante. Se realizó una regresión logística para el análisis univariante y multivariante de los factores asociados a la pérdida del injerto por trombosis. Para el estudio de factores asociados a la pérdida del injerto se calculó la hazard rario (HR) con intervalo de confianza del 95% (IC 95%) mediante la regresión de Cox. El análisis de attrition rates se realizó calculando la tasa absoluta de pérdida corregida por la amplitud del período7,11.
El análisis estadístico se realizó mediante el paquete SPSS® versión 25 (IBM). Los valores de p<0,05 fueron considerados como estadísticamente significativos.
ResultadosCaracterísticas de la poblaciónEntre 1979 y 2019, se realizaron 1.522 trasplantes renales. Con una mediana de seguimiento de 63 (RIQ: 26-122) meses, observamos 722 pérdidas (47,4%).
En 239 (33,1%) la pérdida fue debida al fallecimiento del receptor con injerto funcionante y en 483 (66,9%) por pérdida de la función renal con vuelta a diálisis o retrasplante (fig. 1).
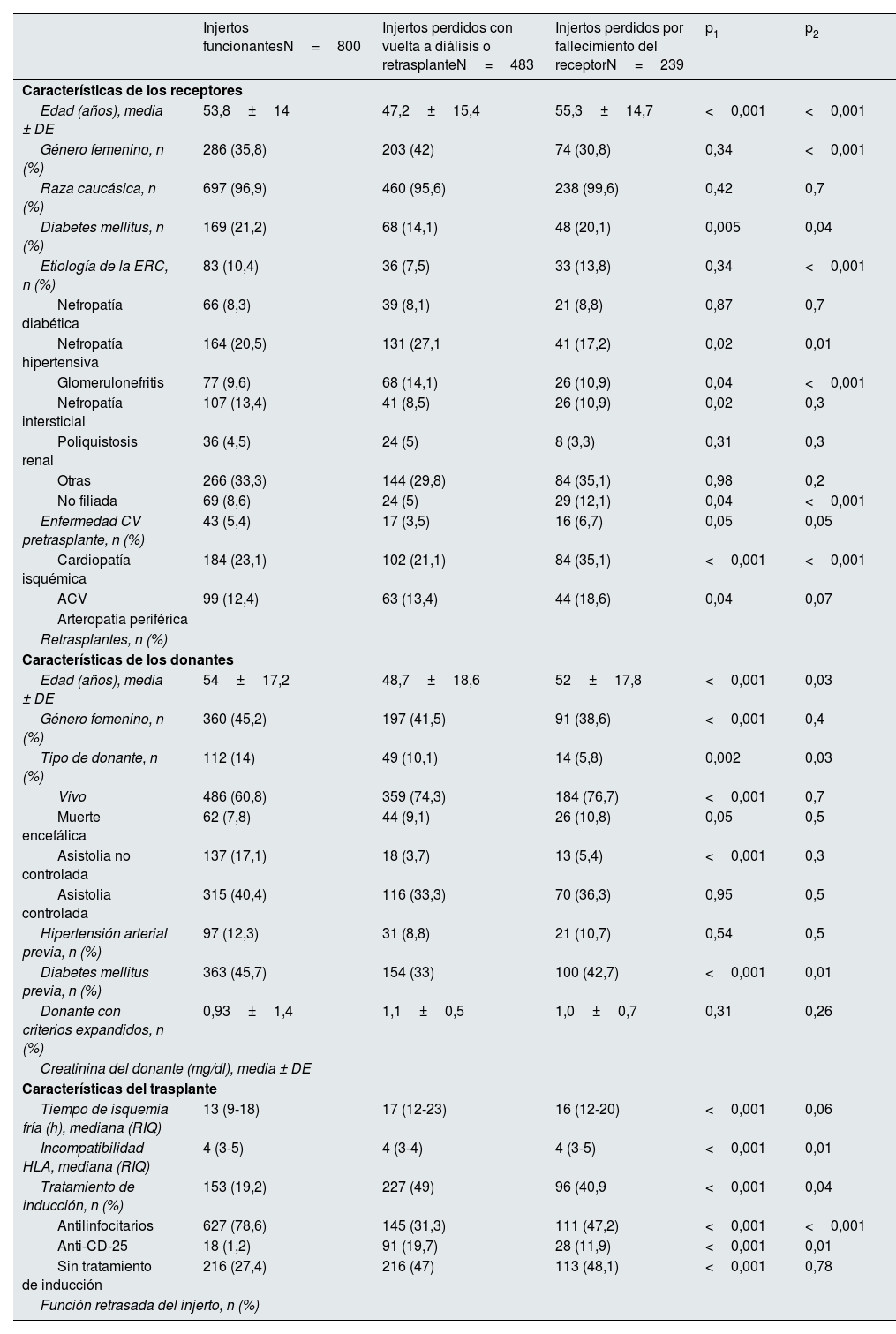
Las características demográficas y clínicas basales de la población del estudio se recogen en la tabla 2.
Características basales de la población a estudio según la pérdida del injerto
| Injertos funcionantesN=800 | Injertos perdidos con vuelta a diálisis o retrasplanteN=483 | Injertos perdidos por fallecimiento del receptorN=239 | p1 | p2 | |
|---|---|---|---|---|---|
| Características de los receptores | |||||
| Edad (años), media ± DE | 53,8±14 | 47,2±15,4 | 55,3±14,7 | <0,001 | <0,001 |
| Género femenino, n (%) | 286 (35,8) | 203 (42) | 74 (30,8) | 0,34 | <0,001 |
| Raza caucásica, n (%) | 697 (96,9) | 460 (95,6) | 238 (99,6) | 0,42 | 0,7 |
| Diabetes mellitus, n (%) | 169 (21,2) | 68 (14,1) | 48 (20,1) | 0,005 | 0,04 |
| Etiología de la ERC, n (%) | 83 (10,4) | 36 (7,5) | 33 (13,8) | 0,34 | <0,001 |
| Nefropatía diabética | 66 (8,3) | 39 (8,1) | 21 (8,8) | 0,87 | 0,7 |
| Nefropatía hipertensiva | 164 (20,5) | 131 (27,1 | 41 (17,2) | 0,02 | 0,01 |
| Glomerulonefritis | 77 (9,6) | 68 (14,1) | 26 (10,9) | 0,04 | <0,001 |
| Nefropatía intersticial | 107 (13,4) | 41 (8,5) | 26 (10,9) | 0,02 | 0,3 |
| Poliquistosis renal | 36 (4,5) | 24 (5) | 8 (3,3) | 0,31 | 0,3 |
| Otras | 266 (33,3) | 144 (29,8) | 84 (35,1) | 0,98 | 0,2 |
| No filiada | 69 (8,6) | 24 (5) | 29 (12,1) | 0,04 | <0,001 |
| Enfermedad CV pretrasplante, n (%) | 43 (5,4) | 17 (3,5) | 16 (6,7) | 0,05 | 0,05 |
| Cardiopatía isquémica | 184 (23,1) | 102 (21,1) | 84 (35,1) | <0,001 | <0,001 |
| ACV | 99 (12,4) | 63 (13,4) | 44 (18,6) | 0,04 | 0,07 |
| Arteropatía periférica | |||||
| Retrasplantes, n (%) | |||||
| Características de los donantes | |||||
| Edad (años), media ± DE | 54±17,2 | 48,7±18,6 | 52±17,8 | <0,001 | 0,03 |
| Género femenino, n (%) | 360 (45,2) | 197 (41,5) | 91 (38,6) | <0,001 | 0,4 |
| Tipo de donante, n (%) | 112 (14) | 49 (10,1) | 14 (5,8) | 0,002 | 0,03 |
| Vivo | 486 (60,8) | 359 (74,3) | 184 (76,7) | <0,001 | 0,7 |
| Muerte encefálica | 62 (7,8) | 44 (9,1) | 26 (10,8) | 0,05 | 0,5 |
| Asistolia no controlada | 137 (17,1) | 18 (3,7) | 13 (5,4) | <0,001 | 0,3 |
| Asistolia controlada | 315 (40,4) | 116 (33,3) | 70 (36,3) | 0,95 | 0,5 |
| Hipertensión arterial previa, n (%) | 97 (12,3) | 31 (8,8) | 21 (10,7) | 0,54 | 0,5 |
| Diabetes mellitus previa, n (%) | 363 (45,7) | 154 (33) | 100 (42,7) | <0,001 | 0,01 |
| Donante con criterios expandidos, n (%) | 0,93±1,4 | 1,1±0,5 | 1,0±0,7 | 0,31 | 0,26 |
| Creatinina del donante (mg/dl), media ± DE | |||||
| Características del trasplante | |||||
| Tiempo de isquemia fría (h), mediana (RIQ) | 13 (9-18) | 17 (12-23) | 16 (12-20) | <0,001 | 0,06 |
| Incompatibilidad HLA, mediana (RIQ) | 4 (3-5) | 4 (3-4) | 4 (3-5) | <0,001 | 0,01 |
| Tratamiento de inducción, n (%) | 153 (19,2) | 227 (49) | 96 (40,9 | <0,001 | 0,04 |
| Antilinfocitarios | 627 (78,6) | 145 (31,3) | 111 (47,2) | <0,001 | <0,001 |
| Anti-CD-25 | 18 (1,2) | 91 (19,7) | 28 (11,9) | <0,001 | 0,01 |
| Sin tratamiento de inducción | 216 (27,4) | 216 (47) | 113 (48,1) | <0,001 | 0,78 |
| Función retrasada del injerto, n (%) | |||||
ACV: accidente cerebrovascular; CV: cardiovascular; DE: desviación estándar; ERC: enfermedad renal crónica; h: horas; RIQ: rango intercuartílico.
P1: comparación entre receptores con injerto funcionante y no funcionante (perdidos por fracaso del injerto y por fallecimiento del receptor).
P2: comparación entre receptores con injerto perdido por fracaso del injerto con vuelta a diálisis/retrasplante y por fallecimiento del receptor.
La muerte del receptor con un injerto funcionante fue la causa de la pérdida en 239 de los 722 (33,1%) injertos perdidos. La mediana de tiempo hasta el fallecimiento fue de 67,5 (RIQ: 35-122) meses después del trasplante.
De forma global, la enfermedad cardiovascular (CV) (25,1%) y las neoplasias (25,1%) fueron las causas más frecuentes de muerte, seguidas de las causas infecciosas que supusieron un 21,8% de los fallecimientos. En el 19,2% casos no pudo determinarse la causa de la muerte (fig. 2A).
La edad media en el momento del fallecimiento fue de 62,3±13,8 años. No se encontraron diferencias en las edades de los receptores en el momento del fallecimiento según las causas de muerte (causa CV: 64,5±15,9 años; causa neoplásica: 62±13,5; causa infecciosa: 62,5±12,3; p=0,52).
Fracaso del injerto con vuelta a diálisis o retrasplanteEl fracaso del injerto con necesidad de inicio de TRS fue la principal causa de la pérdida del injerto (66,9%) con una mediana global de tiempo hasta el fracaso de 52 (RIQ: 43-61) meses postrasplante. La mediana de tiempo hasta la pérdida precoz (antes del 1er año postrasplante) fue de 1 (RIQ: 0-3) mes y hasta la pérdida tardía (más de un año postrasplante) fue de 89 (RIQ: 51-153) meses.
Los pacientes en los que fracasó el injerto eran más jóvenes que los que lo perdieron por fallecimiento (47,2 vs. 55,3 años; p<0,01). Además, en el primer grupo, había más mujeres (42 vs. 30,8%; p<0,01) y los pacientes tenían menos comorbilidades: diabetes mellitus (DM) (14,1 vs. 20,1%; p=0,04), cardiopatía isquémica (5 vs. 12,1%; p<0,01), accidente cerebrovascular (ACV) (3,5 vs. 6,7%; p=0,05) y arteriopatía periférica (AP) (21,1 vs. 35,1%; p<0,01).
En cuanto a las características de los donantes, los injertos perdidos por fracaso del mismo provenían de donantes más jóvenes que los que se perdían por muerte del receptor (48,7 vs. 52 años; p=0,03). Los injertos de donantes con criterios expandidos (DCE) se pierden más frecuentemente por muerte del receptor (42,7 vs. 33%; p<0,01). El tiempo de isquemia fría (TIF) fue ligeramente más prolongado en los injertos perdidos por fracaso del injerto respecto a los perdidos por muerte (17 vs. 16h; p=0.06) (tabla 2).
Durante el tiempo de seguimiento fracasaron 483 injertos con necesidad de vuelta a diálisis o retrasplante del receptor. La causa más frecuente de la pérdida fue la disfunción crónica del injerto sin estudio histológico (32,3%), seguida del rechazo mediado por anticuerpos (15,9%) y la FI/AT (12,6%). Las pérdidas por rechazo mediado por células T y por enfermedad glomerular (recidiva/de novo) fueron el 7,9 y el 5,6%, respectivamente. Las trombosis vasculares fueron responsables del 10,1% de las pérdidas, seguidas de las complicaciones médico-quirúrgicas (9,9%) y los injertos nunca funcionantes (4,3%) (fig. 2B).
Análisis por épocas de trasplanteDurante el periodo 1 (años 1979 a 1999) y el periodo 2 (años 2000 a 2019) se realizaron 445 (29,2%) y 1.077 (70,8%) trasplantes, respectivamente.
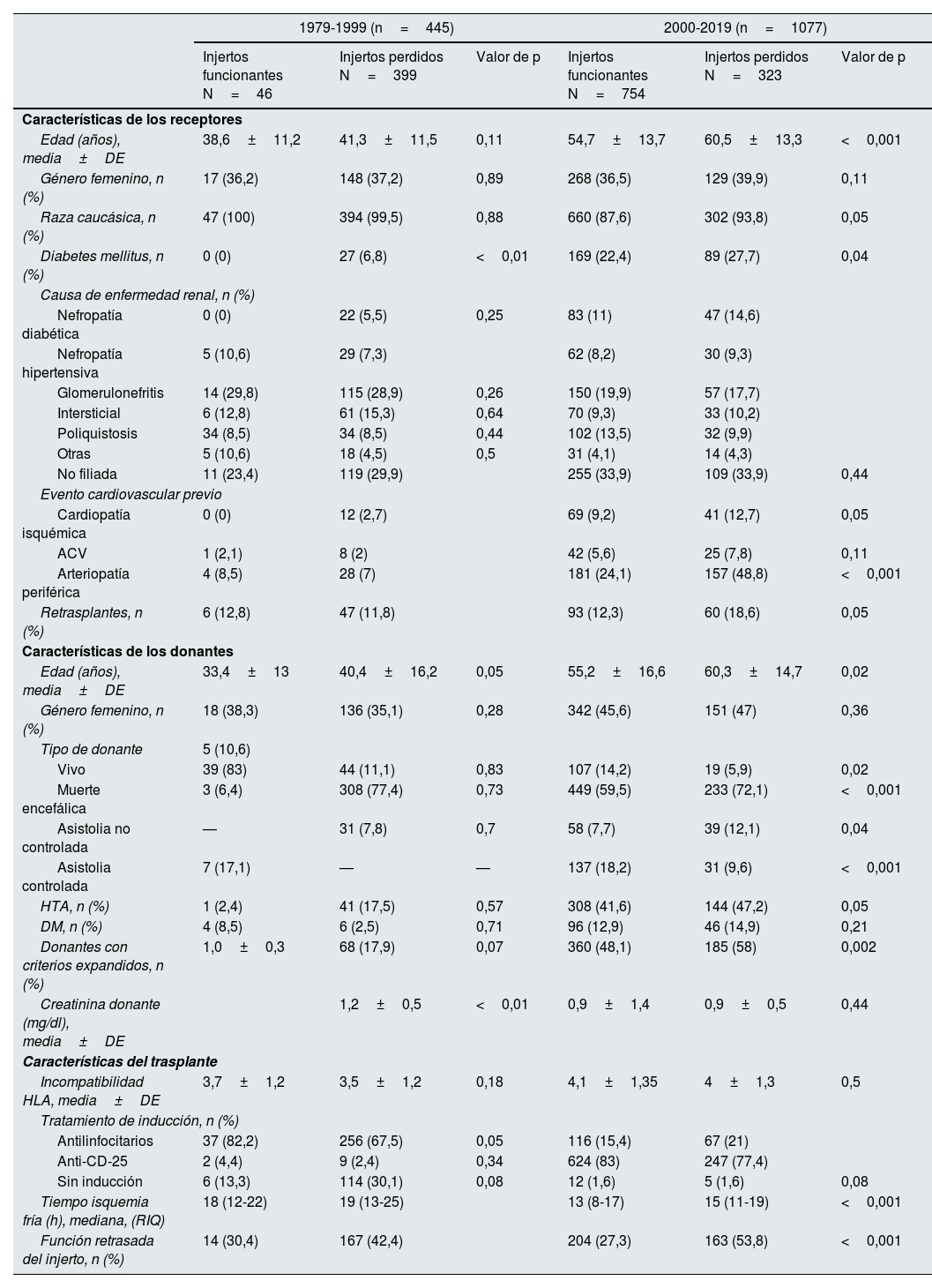
De los trasplantes en el periodo 1, se han perdido 399 (89,7%). Del total de las pérdidas de ese grupo, 300 (75,2%) se debieron a fracaso del injerto con vuelta a diálisis/retrasplante y 99 (24,8%) a fallecimiento del receptor. Las pérdidas fueron más frecuentes en receptores diabéticos (0 vs. 6,8%; p<0,01) y en injertos procedentes de donantes más añosos (33,4 vs. 40,4 años; p=0,05) y con una peor función renal (creatinina a la extracción 1,0 vs. 1,2mg/dl; p<0,01). En esta época, el TIF y función retrasada del injerto (FRI) fue similar entre los injertos perdidos y los funcionantes..
De los trasplantes realizados durante el segundo periodo, 323 (30%) injertos se perdieron durante el tiempo de seguimiento. Del total de pérdidas, 183 (56,6%) fueron por fracaso del injerto y 140 (43%) por fallecimiento del receptor (datos no mostrados). Estos injertos procedían de donantes más añosos (603 vs. 55,2 años; p=0,02) y con DCE (58 vs. 48,1%; p<0,01). Los injertos procedentes de donantes vivos eran más frecuentes entre los injertos funcionantes (14,2 vs. 5,9%; p=0,02). Además, las pérdidas se dieron con más frecuencia en receptores más mayores (60,5 vs. 54,7 años; p<0,01), diabéticos (27,7 vs. 22,4%; p=0,04), con más comorbilidad previa (CI: 12,7 vs. 9,2%; p=0,05 y AP: 48,8 vs. 24,1%; p<0,01) y más re-TR (1,86 vs. 12,3%; p=0,05). En este periodo, los injertos perdidos tenían mayor TIF (15 vs. 13h; p<0,01) y mayor tasa de FRI (53,8 vs. 27,3%; p<0,01) (tabla 3).
Características basales de la población a estudio según el periodo en el que se produjo la pérdida del injerto
| 1979-1999 (n=445) | 2000-2019 (n=1077) | |||||
|---|---|---|---|---|---|---|
| Injertos funcionantes N=46 | Injertos perdidos N=399 | Valor de p | Injertos funcionantes N=754 | Injertos perdidos N=323 | Valor de p | |
| Características de los receptores | ||||||
| Edad (años), media±DE | 38,6±11,2 | 41,3±11,5 | 0,11 | 54,7±13,7 | 60,5±13,3 | <0,001 |
| Género femenino, n (%) | 17 (36,2) | 148 (37,2) | 0,89 | 268 (36,5) | 129 (39,9) | 0,11 |
| Raza caucásica, n (%) | 47 (100) | 394 (99,5) | 0,88 | 660 (87,6) | 302 (93,8) | 0,05 |
| Diabetes mellitus, n (%) | 0 (0) | 27 (6,8) | <0,01 | 169 (22,4) | 89 (27,7) | 0,04 |
| Causa de enfermedad renal, n (%) | ||||||
| Nefropatía diabética | 0 (0) | 22 (5,5) | 0,25 | 83 (11) | 47 (14,6) | |
| Nefropatía hipertensiva | 5 (10,6) | 29 (7,3) | 62 (8,2) | 30 (9,3) | ||
| Glomerulonefritis | 14 (29,8) | 115 (28,9) | 0,26 | 150 (19,9) | 57 (17,7) | |
| Intersticial | 6 (12,8) | 61 (15,3) | 0,64 | 70 (9,3) | 33 (10,2) | |
| Poliquistosis | 34 (8,5) | 34 (8,5) | 0,44 | 102 (13,5) | 32 (9,9) | |
| Otras | 5 (10,6) | 18 (4,5) | 0,5 | 31 (4,1) | 14 (4,3) | |
| No filiada | 11 (23,4) | 119 (29,9) | 255 (33,9) | 109 (33,9) | 0,44 | |
| Evento cardiovascular previo | ||||||
| Cardiopatía isquémica | 0 (0) | 12 (2,7) | 69 (9,2) | 41 (12,7) | 0,05 | |
| ACV | 1 (2,1) | 8 (2) | 42 (5,6) | 25 (7,8) | 0,11 | |
| Arteriopatía periférica | 4 (8,5) | 28 (7) | 181 (24,1) | 157 (48,8) | <0,001 | |
| Retrasplantes, n (%) | 6 (12,8) | 47 (11,8) | 93 (12,3) | 60 (18,6) | 0,05 | |
| Características de los donantes | ||||||
| Edad (años), media±DE | 33,4±13 | 40,4±16,2 | 0,05 | 55,2±16,6 | 60,3±14,7 | 0,02 |
| Género femenino, n (%) | 18 (38,3) | 136 (35,1) | 0,28 | 342 (45,6) | 151 (47) | 0,36 |
| Tipo de donante | 5 (10,6) | |||||
| Vivo | 39 (83) | 44 (11,1) | 0,83 | 107 (14,2) | 19 (5,9) | 0,02 |
| Muerte encefálica | 3 (6,4) | 308 (77,4) | 0,73 | 449 (59,5) | 233 (72,1) | <0,001 |
| Asistolia no controlada | — | 31 (7,8) | 0,7 | 58 (7,7) | 39 (12,1) | 0,04 |
| Asistolia controlada | 7 (17,1) | — | — | 137 (18,2) | 31 (9,6) | <0,001 |
| HTA, n (%) | 1 (2,4) | 41 (17,5) | 0,57 | 308 (41,6) | 144 (47,2) | 0,05 |
| DM, n (%) | 4 (8,5) | 6 (2,5) | 0,71 | 96 (12,9) | 46 (14,9) | 0,21 |
| Donantes con criterios expandidos, n (%) | 1,0±0,3 | 68 (17,9) | 0,07 | 360 (48,1) | 185 (58) | 0,002 |
| Creatinina donante (mg/dl), media±DE | 1,2±0,5 | <0,01 | 0,9±1,4 | 0,9±0,5 | 0,44 | |
| Características del trasplante | ||||||
| Incompatibilidad HLA, media±DE | 3,7±1,2 | 3,5±1,2 | 0,18 | 4,1±1,35 | 4±1,3 | 0,5 |
| Tratamiento de inducción, n (%) | ||||||
| Antilinfocitarios | 37 (82,2) | 256 (67,5) | 0,05 | 116 (15,4) | 67 (21) | |
| Anti-CD-25 | 2 (4,4) | 9 (2,4) | 0,34 | 624 (83) | 247 (77,4) | |
| Sin inducción | 6 (13,3) | 114 (30,1) | 0,08 | 12 (1,6) | 5 (1,6) | 0,08 |
| Tiempo isquemia fría (h), mediana, (RIQ) | 18 (12-22) | 19 (13-25) | 13 (8-17) | 15 (11-19) | <0,001 | |
| Función retrasada del injerto, n (%) | 14 (30,4) | 167 (42,4) | 204 (27,3) | 163 (53,8) | <0,001 | |
ACV: accidente cerebrovascular; DE: desviación estándar; DM: diabetes mellitus; h: horas; HTA: hipertensión arterial; RIQ: rango intercuartílico.
Cuando analizamos los factores de riesgo asociados a la pérdida del injerto de forma global, solo la edad del donante (HR: 1.010; IC 95%: 1,00-1,01; p=0,04) resulta como factor de riesgo independiente. La época de trasplante no resultó ser factor de riesgo de la pérdida en el análisis ajustado (Tabla suplementaria 1).
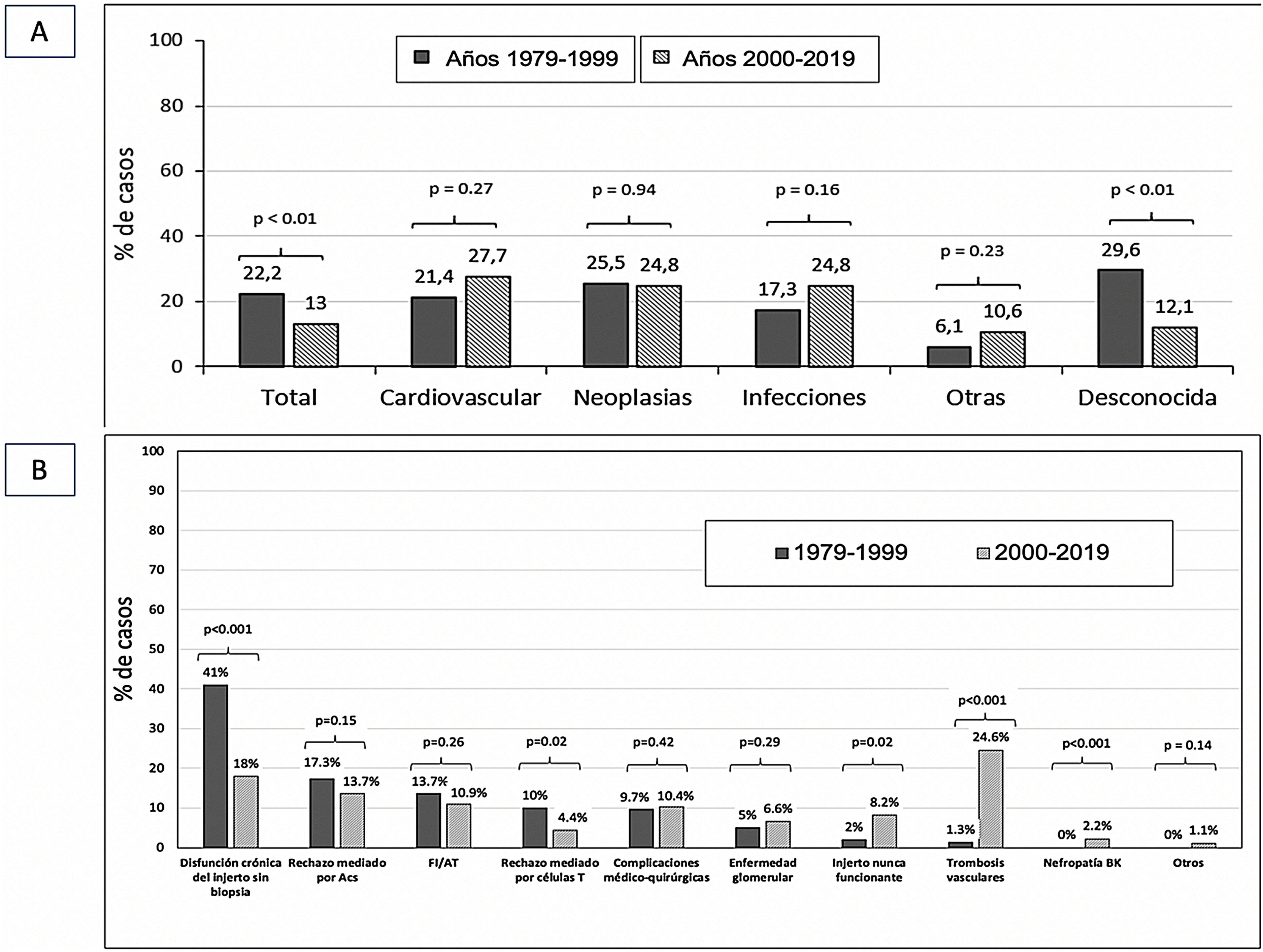
1) Pérdidas por fallecimiento con injerto funcionante según épocas de trasplanteLas causas de fallecimiento del receptor son similares en ambas épocas de trasplante. Solo el número de pacientes que fallecen por una causa desconocida es menor en la época actual (29,6 vs. 12,1%; p<0,01) (fig. 3A).
2) Pérdida de injerto con vuelta a terapia renal sustitutiva según épocas de trasplanteLa causa más frecuente de pérdida del injerto en el periodo 1 (años 1979-1999) fue la disfunción del injerto sin comprobación histológica (41%), mientras que en el periodo 2 (años 2000-2019) lo fue la trombosis vascular (24,6%).
El rechazo mediado por células T fue más frecuente entre los injertos perdidos del periodo 1 (10 vs. 4,4%; p=0,02), mientras que los injertos nunca funcionantes lo fueron en el periodo 2 (8,2 vs. 2%; p=0,02). La nefropatía por BK también fue superior en este periodo (0 vs. 2,2%). El resto de causas de pérdida del injerto fueron similares en ambos periodos (fig. 3B).
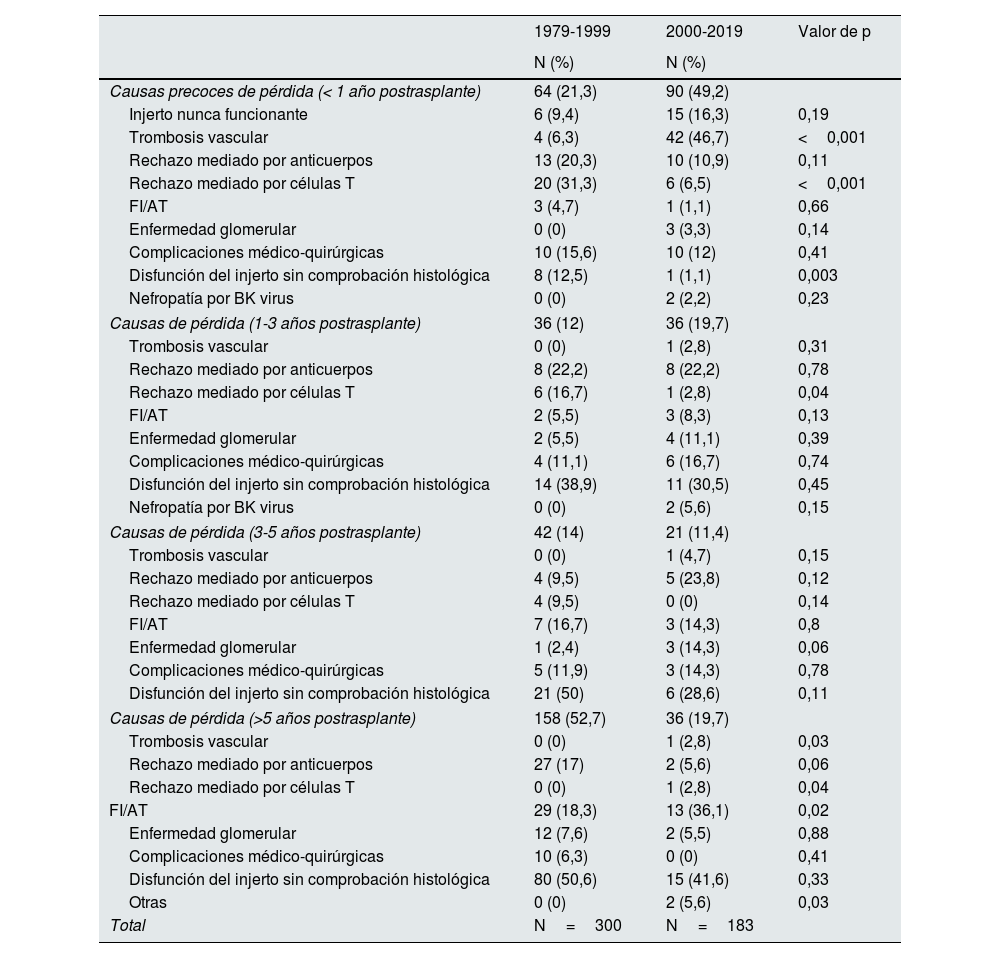
3) Causas de pérdida precoz y tardía (>1 año postrasplante) según épocas de trasplanteEn el primer periodo (años 1979-1999), la causa más frecuente de pérdida precoz (<1 año postrasplante) fue el rechazo mediado por células T (31,3 vs. 6,5%; p<0,01). Sin embargo, en el periodo 2 (años 2000-2019) la trombosis vascular fue el motivo más frecuente de pérdida en el primer año postrasplante (46,7 vs. 6,3%; p<0,001).
En el análisis de causas de pérdida tardía (1-3 años postrasplante) encontramos diferencias en las pérdidas por rechazo mediado por célula T (16,7 vs. 2,8%; p=0,04) que fue más frecuente en las etapas más antiguas del programa de trasplante. No encontramos diferencias en los motivos de pérdida del injerto en los años 3 a 5 postrasplante entre ambas épocas de trasplante. Más allá de los 5 años postrasplante, la pérdida por FI/AT fue más frecuente en el periodo 2 (tabla 4).
Causas de pérdida de injerto según el periodo en el que se produjo la pérdida del injerto
| 1979-1999 | 2000-2019 | Valor de p | |
|---|---|---|---|
| N (%) | N (%) | ||
| Causas precoces de pérdida (< 1 año postrasplante) | 64 (21,3) | 90 (49,2) | |
| Injerto nunca funcionante | 6 (9,4) | 15 (16,3) | 0,19 |
| Trombosis vascular | 4 (6,3) | 42 (46,7) | <0,001 |
| Rechazo mediado por anticuerpos | 13 (20,3) | 10 (10,9) | 0,11 |
| Rechazo mediado por células T | 20 (31,3) | 6 (6,5) | <0,001 |
| FI/AT | 3 (4,7) | 1 (1,1) | 0,66 |
| Enfermedad glomerular | 0 (0) | 3 (3,3) | 0,14 |
| Complicaciones médico-quirúrgicas | 10 (15,6) | 10 (12) | 0,41 |
| Disfunción del injerto sin comprobación histológica | 8 (12,5) | 1 (1,1) | 0,003 |
| Nefropatía por BK virus | 0 (0) | 2 (2,2) | 0,23 |
| Causas de pérdida (1-3 años postrasplante) | 36 (12) | 36 (19,7) | |
| Trombosis vascular | 0 (0) | 1 (2,8) | 0,31 |
| Rechazo mediado por anticuerpos | 8 (22,2) | 8 (22,2) | 0,78 |
| Rechazo mediado por células T | 6 (16,7) | 1 (2,8) | 0,04 |
| FI/AT | 2 (5,5) | 3 (8,3) | 0,13 |
| Enfermedad glomerular | 2 (5,5) | 4 (11,1) | 0,39 |
| Complicaciones médico-quirúrgicas | 4 (11,1) | 6 (16,7) | 0,74 |
| Disfunción del injerto sin comprobación histológica | 14 (38,9) | 11 (30,5) | 0,45 |
| Nefropatía por BK virus | 0 (0) | 2 (5,6) | 0,15 |
| Causas de pérdida (3-5 años postrasplante) | 42 (14) | 21 (11,4) | |
| Trombosis vascular | 0 (0) | 1 (4,7) | 0,15 |
| Rechazo mediado por anticuerpos | 4 (9,5) | 5 (23,8) | 0,12 |
| Rechazo mediado por células T | 4 (9,5) | 0 (0) | 0,14 |
| FI/AT | 7 (16,7) | 3 (14,3) | 0,8 |
| Enfermedad glomerular | 1 (2,4) | 3 (14,3) | 0,06 |
| Complicaciones médico-quirúrgicas | 5 (11,9) | 3 (14,3) | 0,78 |
| Disfunción del injerto sin comprobación histológica | 21 (50) | 6 (28,6) | 0,11 |
| Causas de pérdida (>5 años postrasplante) | 158 (52,7) | 36 (19,7) | |
| Trombosis vascular | 0 (0) | 1 (2,8) | 0,03 |
| Rechazo mediado por anticuerpos | 27 (17) | 2 (5,6) | 0,06 |
| Rechazo mediado por células T | 0 (0) | 1 (2,8) | 0,04 |
| FI/AT | 29 (18,3) | 13 (36,1) | 0,02 |
| Enfermedad glomerular | 12 (7,6) | 2 (5,5) | 0,88 |
| Complicaciones médico-quirúrgicas | 10 (6,3) | 0 (0) | 0,41 |
| Disfunción del injerto sin comprobación histológica | 80 (50,6) | 15 (41,6) | 0,33 |
| Otras | 0 (0) | 2 (5,6) | 0,03 |
| Total | N=300 | N=183 | |
BR: biopsia renal; FI/AT: fibrosis intersticial/atrofia tubular.
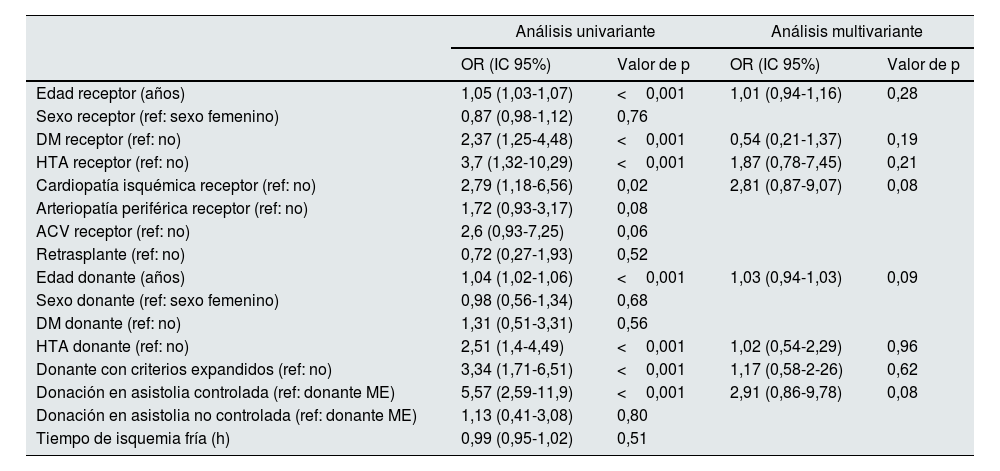
El análisis univariante de los 48 receptores que perdieron el trasplante por trombosis, mostró que los injertos renales provenían de donantes (OR: 1,05; IC 95%: 1,03-1,07; p<0,001) y receptores más añosos (OR: 1,04; IC 95%: 1,02-1,06; p<0,001). La trombosis fue más frecuente en los injertos procedentes de donantes con HTA (OR: 2,51; IC 95%: 1,4-4,49; p<0,001) y en asistolia controlada (OR: 5,57; IC 95%: 2,59-11,9; p<0,00).
Sin embargo, en el análisis multivariante no encontramos ningún factor de riesgo independiente asociado a la pérdida del injerto por trombosis vascular (tabla 5).
Factores asociados a pérdida por trombosis del injerto
| Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|
| OR (IC 95%) | Valor de p | OR (IC 95%) | Valor de p | |
| Edad receptor (años) | 1,05 (1,03-1,07) | <0,001 | 1,01 (0,94-1,16) | 0,28 |
| Sexo receptor (ref: sexo femenino) | 0,87 (0,98-1,12) | 0,76 | ||
| DM receptor (ref: no) | 2,37 (1,25-4,48) | <0,001 | 0,54 (0,21-1,37) | 0,19 |
| HTA receptor (ref: no) | 3,7 (1,32-10,29) | <0,001 | 1,87 (0,78-7,45) | 0,21 |
| Cardiopatía isquémica receptor (ref: no) | 2,79 (1,18-6,56) | 0,02 | 2,81 (0,87-9,07) | 0,08 |
| Arteriopatía periférica receptor (ref: no) | 1,72 (0,93-3,17) | 0,08 | ||
| ACV receptor (ref: no) | 2,6 (0,93-7,25) | 0,06 | ||
| Retrasplante (ref: no) | 0,72 (0,27-1,93) | 0,52 | ||
| Edad donante (años) | 1,04 (1,02-1,06) | <0,001 | 1,03 (0,94-1,03) | 0,09 |
| Sexo donante (ref: sexo femenino) | 0,98 (0,56-1,34) | 0,68 | ||
| DM donante (ref: no) | 1,31 (0,51-3,31) | 0,56 | ||
| HTA donante (ref: no) | 2,51 (1,4-4,49) | <0,001 | 1,02 (0,54-2,29) | 0,96 |
| Donante con criterios expandidos (ref: no) | 3,34 (1,71-6,51) | <0,001 | 1,17 (0,58-2-26) | 0,62 |
| Donación en asistolia controlada (ref: donante ME) | 5,57 (2,59-11,9) | <0,001 | 2,91 (0,86-9,78) | 0,08 |
| Donación en asistolia no controlada (ref: donante ME) | 1,13 (0,41-3,08) | 0,80 | ||
| Tiempo de isquemia fría (h) | 0,99 (0,95-1,02) | 0,51 | ||
ACV: accidente cerebrovascular; DM: diabetes mellitus; HTA: hipertensión arterial; IC: intervalo de confianza; ME: muerte encefálica; OR: odds ratio.
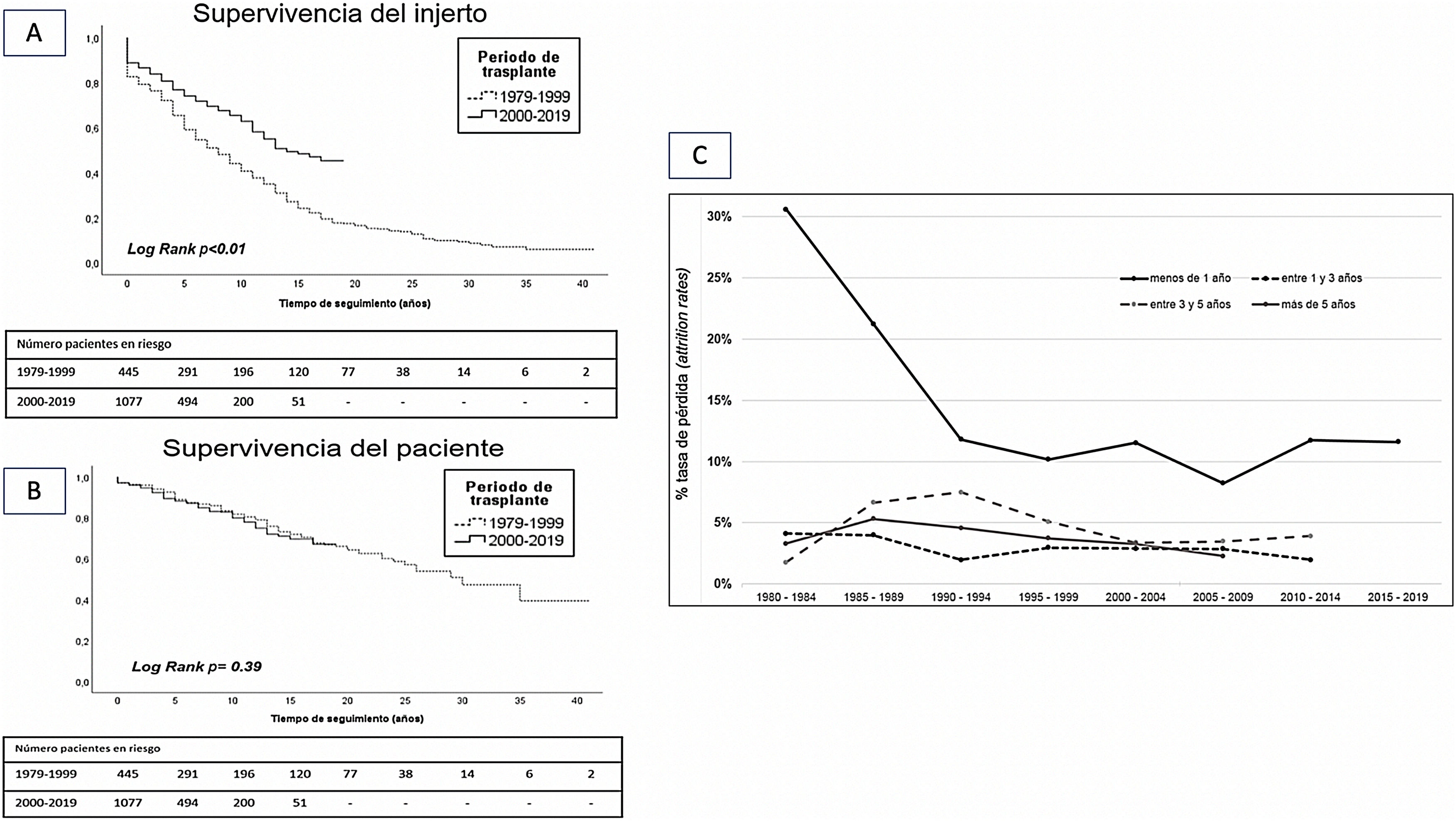
El análisis comparativo de la supervivencia del injerto y de la supervivencia del paciente entre ambas épocas de trasplante mostró una supervivencia a 10 años superior en los injertos procedentes de los años 2000-2019 respecto a los procedentes de los años 1979-1999 (62 vs. 44%; p<0,01). Sin embargo, no hubo diferencias en la supervivencia del paciente a 10 años entre ambos periodos (73 vs. 70%; p=0,39). (figs. 4A y B).
El análisis de tasa de pérdida mostró una tasa de pérdida significativamente mayor durante el primer año que ha mejorado en las últimas décadas. Sin embargo, las tasas de pérdidas son similares en los periodos 1-3 años, 3-5 años y más de 5 años en todas las épocas de trasplante (fig. 4C).
DiscusiónEn este estudio observacional y retrospectivo se analizaron las causas de la pérdida del injerto desde el inicio del programa de trasplante en el Hospital del Mar en el año 1979 hasta la actualidad. Se consiguió identificar la causa de la pérdida del injerto en casi el 70% de los casos. Aunque este porcentaje es algo menor que el aportado por otros estudios12,13, nuestra serie cuenta con un tiempo de seguimiento más largo, ya que incluye pacientes trasplantados desde el año 1979. En otros estudios, el análisis de pérdidas incluye trasplantados desde los años 9012,14–16.
Casi el 68% de las pérdidas se deben al fracaso del injerto con vuelta a diálisis o retrasplante. Esta tasa de pérdida es similar a lo reportado en la literatura que oscila entre el 42 y el 60%12,15. Aunque en series más recientes, la pérdida por fallecimiento del receptor con injerto funcionante es cada vez más frecuente y se convierte en la causa principal de la pérdida del injerto17.
La disfunción del injerto biopsiada fue la causa más frecuente de la pérdida en la serie global (43%). Sin embargo, en las épocas más tempranas del trasplante (años 1979-1999) la disfunción del injerto sin comprobación histológica es más frecuente que en las épocas más recientes (años 2000-2019), que es del 18%. Este porcentaje es algo más elevado que en otras series, que reportan entre el 4,5 y el 9% como causa de la pérdida de la disfunción del injerto sin biopsia12,13,18.
El diagnóstico histológico más frecuente fue el rechazo mediado por anticuerpos sin diferencias entre épocas de trasplante. Acorde con la literatura, estos diagnósticos son los que confieren peor pronóstico en términos de supervivencia del injerto19,20. Otras series que analizan los hallazgos histológicos en pérdidas de injerto tienen resultados similares. Sellares et al.14 reportan el 64% de rechazo mediado por anticuerpos en 74 biopsias de injertos perdidos, mientras que en una cohorte belga que cuenta con 140 biopsias estudiadas, las tasas de pérdida por rechazo agudo y crónico no llegan al 20%.
Las causas de la pérdida del injerto son diferentes según el momento de la evolución postrasplante. El rechazo agudo celular ha sido relegado actualmente a un puesto de menor relevancia entre las pérdidas que ocurren de forma precoz en el primer año postrasplante13,17,18,21. Sin embargo, en la época más reciente surge la trombosis vascular como la primera causa de pérdida precoz seguida de la no función primaria del injerto. Esta tendencia coincide con los resultados reportados por Van Loon et al.17 donde la no función primaria es la causa del 25% de los injertos que se pierden el primer año postrasplante. Otro estudio reciente que revisó las causas de la pérdida durante el primer año postrasplante, identificó que el 41% de los injertos se perdían por trombosis vascular y el 29% por fallo de función primaria, mientras que el 15% se perdían por rechazo agudo9. Se ha sugerido que este cambio en las causas de pérdida precoz del injerto está en relación con el cambio de perfil en el donante y el receptor cada vez más añosos y con más comorbilidades al que asistimos en las últimas décadas21. Este cambio viene derivado del intento por expandir el pool de donantes ya que el TR en receptores añosos ofrece mejores resultados comparados con permanecer en lista de espera en diálisis22.
En cambio, las causas de pérdida tardía (posterior al primer año postrasplante) son similares en las 2 épocas de trasplante. El rechazo mediado por anticuerpos es la causa más frecuente (35 y 39%, respectivamente) de pérdida de los injertos biopsiados, seguido del daño crónico sobre el injerto en forma de fibrosis intersticial/atrofia tubular (30 y 29%, respectivamente). Probablemente esto es reflejo del escaso conocimiento y tratamientos poco efectivos en estas lesiones histológicas15.
En nuestra cohorte, la pérdida por fallecimiento del receptor con injerto funcionante supuso el 33% de las pérdidas del injerto, similar a lo reportado en otras series de nuestro entorno. En el Registre de Malalts Renals de Catalunya durante el periodo 2011-2017, la tasa de pérdida por fallecimiento del paciente más allá del primer año postrasplante es de 2,5 por 100/personas/año, siendo la tasa global de pérdida de ese periodo de 4,7 por 100/personas/año22,23. Los datos del registro de Reino Unido muestran que la muerte del receptor fue la causa del 40% de todas las pérdidas entre los años 2000-201317. En cambio, los datos del grupo belga de Van Loon et al.17 en un trabajo que incluyó 1.000 trasplantados renales entre los años 2004 y 2013, mostró que el fallecimiento del paciente era la principal causa de pérdida (57%), por delante del fracaso del injerto. Esta diferencia con nuestros resultados podría deberse a las características de nuestra cohorte con largo tiempo de seguimiento, ya que más de la mitad de los injertos perdidos (55,3%) corresponden al periodo de 1979-1999, y en esta época la mayoría se perdían por fracaso del injerto (75,2%). Sin embargo, en la etapa más reciente entre los años 2000 y 2019 ha aumentado la tasa de pérdida del injerto por fallecimiento del receptor (43%).
Las principales causas de fallecimiento del receptor son la cardiovascular, las infecciones y los tumores malignos similar a lo reportado en otras series11,16. Es llamativo que estas causas permanecen estables a lo largo del tiempo y no han variado de una época de trasplante a otra.
En nuestro estudio hay algunas limitaciones, fundamentalmente derivadas del carácter retrospectivo y descriptivo del análisis. Además, las biopsias incluidas son por indicación clínica y por seguimiento desde el año 2014, y no contamos con biopsias de seguimiento iterativas en todos los casos para evaluar la evolución de las lesiones histológicas. Además, la determinación sistemática de anticuerpos anti-HLA pre y postrasplante en plataforma Luminex® se empieza a realizar de forma rutinaria a partir del año 2010.
En conclusión, comparando dos épocas de trasplante (1970-1999 vs. 2000-2019) observamos un cambio en las causas de pérdida precoz de los injertos renales. Durante el primer año postrasplante, las pérdidas de causa inmunológica como el rechazo agudo quedan en un segundo plano, mientras que las trombosis vasculares y los injertos nunca funcionantes surgen como causas más frecuentes de pérdida del injerto. Sin embargo, las causas de pérdida del injerto más allá del primer año postrasplante y las causas de fallecimiento de los receptores con injertos funcionantes no han cambiado a lo largo de los años.
Es necesario realizar más estudios para identificar adecuadamente las causas de pérdida del injerto renal, con el uso de las pruebas diagnósticas actuales de forma sistemática, además de mejorar las herramientas para una adecuada selección de donante y receptor para mejorar los resultados a corto y largo plazo en TR.
FinanciaciónEste trabajo se ha realizado gracias a la financiación del ISCIII FIS-FEDER PI10/01370, PI13/00598, PI16/00617, PI19/00037 y PI20/00090; del ISCIII FEDER RedinRen RD12/0021/0024 y RD16/0009/0013 y de la Fundació la Marató de TV3 201822-10, 121530.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo forma parte del proyecto de tesis doctoral de A.B en el Departamento de Medicina de la Universidad Autónoma de Barcelona. AB disfruta de un contrato Río Ortega CM19/0004. MJPS disfruta de una ayuda para la intensificación de la actividad investigadora de facultativos de la Sociedad Española de Trasplante.
Los autores agradecen a Adriana Sierra, Alfonso Califano, Sheila Bermejo, Ana Marina Granados, Anna Faura, Sara Álvarez, Nuria Cubino, María Vera y Montserrat Folgueiras por la contribución al desarrollo de la base de datos TRASMAR. También agradecimiento a Rosa Causadias and Anna Bach por su colaboración. Agradecimiento a Xavier Durán por su apoyo con el análisis estadístico final.