La hipertensión arterial resistente (HTAR) supone un importante problema de salud de manejo complejo. Este trabajo evalúa los riesgos y beneficios de añadir espironolactona para tratar la HTAR.
Material y métodosSe evaluaron 216 pacientes con HTAR a quienes se añadió espironolactona (12,5-25mg/día) como antihipertensivo. Ciento veinticinco se analizaron retrospectivamente y 91 prospectivamente. Se analizaron parámetros de presión arterial (PA) y laboratorio (creatinina plasmática [Creap], filtrado glomerular [FGe] y potasio plasmático [Kp]) al momento basal y tras 3-6-12 meses con espironolactona.
ResultadosSe objetivó una variación de PA sistólica/diastólica (media± desviación estándar) de −10,9±2,7/−4,3±1,6mmHg a los 3 meses y −13,6±2,8/−6,0±1,6mmHg a los 12 meses; p<0,001. Valores confirmados mediante monitorización ambulatoria de PA a los 12 meses. A los 3 meses, la Creap incrementó 0,10±0,04mg/dl, el FGe disminuyó −5,4±1,9ml/min/1,73m2 y el Kp incrementó 0,3±0,1mmol/l; p<0,001 para todos los casos. Estas variaciones se mantuvieron a los 12 meses. No hubo diferencias significativas en las variaciones de PA, Creap, FGe y Kp entre los 3 y 12 meses. Los resultados al analizar las cohortes retrospectiva y prospectiva por separado fueron superponibles. En la cohorte prospectiva, espironolactona fue suspendida en 9 pacientes (9,9%) por efectos adversos.
ConclusionesTras 3 meses con espironolactona se observó un descenso de PA asociado a descenso del FGe y aumento de Creap y Kp, cambios que se mantuvieron a los 12 meses. Espironolactona es un tratamiento eficaz y seguro para la HTAR en pacientes con FGe basal ≥30ml/min/1,73m2.
Resistant hypertension (RH) is a significant health problem with complex management. The aim of this study was to evaluate the risks and benefits of adding spironolactone to treat RH.
Material and methodsIn total, 216 patients with RH in whom spironolactone (12.5-25mg daily) was added as an antihypertensive were evaluated. One-hundred and twenty-five (125) were analysed retrospectively and 91 prospectively. Blood pressure (BP) and laboratory parameters (serum creatinine [sCrea], estimated glomerular filtration rate [eGFR] and serum potassium [sK]) were analysed at baseline and at 3-6-12 months after introducing spironolactone.
ResultsA change of systolic/diastolic BP (mean±standard deviation) of −10.9±2.7/−4.3±1.6mmHg at 3 months and −13.6±2.8/−6.0±1.6mmHg at 12 months; p<0.001 was observed. These values were confirmed with ambulatory-BP monitoring at 12 months. At 3 months, an increase in sCrea of 0.10±0.04mg/dl, a decrease in eGFR of −5.4±1.9ml/min/1.73m2 and an increase in sK of 0.3±0.1mmol/l; p<0.001 was observed for all cases. These changes were maintained after 12 months. There were no significant differences in changes of BP, sCrea, eGFR and sK between 3 and 12 months. Results of the retrospective and prospective cohorts separately were superimposable. In the prospective cohort, spironolactone was withdrawn in 9 patients (9.9%) because of adverse effects.
ConclusionsAfter 3 months with spironolactone, a decrease in BP associated with a decrease in the eGFR and an increase in sCrea and sK was observed. These changes were maintained at 12 months. Spironolactone is an effective and safe treatment for RH in patients with baseline eGFR ≥30ml/min/1.73m2.
La hipertensión arterial (HTA) resistente (HTAR) se define como la presión arterial (PA) que persiste mal controlada a pesar de tratamiento con al menos 3 fármacos antihipertensivos de diferentes clases, incluido un diurético, correctamente combinados y a dosis adecuadas. Se considera control insuficiente de la PA clínica cuando está por encima de 140 y/o 90mmHg de PA sistólica (PAS) y/o diastólica (PAD), respectivamente, o de la PA ambulatoria de 24h cuando es superior a 130 y/o 80mmHg1–3.
Actualmente, la HTAR supone un gran problema de salud pública, ya que su prevalencia se estima entre un 10-20% de la población hipertensa tratada2–4. Comparado con los pacientes afectos de HTA de fácil control, los pacientes con HTAR tienen un riesgo más elevado de presentar episodios cardiovasculares mayores4,5.
Las nuevas guías de práctica clínica de la Sociedad Europea de Hipertensión y de la Sociedad Europea de Cardiología recomiendan el uso de espironolactona, antagonista del receptor de la aldosterona, como cuarto fármaco en pacientes con HTAR3. En los últimos años numerosos estudios han confirmado la eficacia antihipertensiva de espironolactona6–9, además de sus beneficios a nivel de reducción de fibrosis miocárdica y del remodelado ventricular10 o de reducción de la proteinuria11. Por todo ello, la prescripción de espironolactona ha ido aumentando en los últimos años. Este uso creciente ha estimulado la publicación de diversos estudios que evalúan su utilización y los posibles efectos adversos asociados, principalmente relacionados con el aumento del potasio plasmático (Kp) o el empeoramiento de la función renal. Dichos estudios se han centrado en la indicación de espironolactona para la reducción de proteinuria en pacientes con diabetes mellitus11,12 o la disfunción ventricular13,14 en pacientes con o sin enfermedad renal crónica15. Asimismo, existen estudios sobre el uso de espironolactona en HTAR en los que el objetivo principal es la eficacia antihipertensiva6–9. Sin embargo, son escasos los trabajos que comunican resultados no solo en cuanto a la eficacia antihipertensiva sino también sobre los cambios funcionales renales, tanto de forma precoz como a medio-largo plazo.
El objetivo de este estudio es evaluar los riesgos y beneficios de la utilización de espironolactona para el tratamiento de la HTAR.
MétodosPoblaciónEstudio observacional de 216 pacientes con HTAR a los cuales se añadió espironolactona en el régimen antihipertensivo (dosis inicial de 12,5-25mg al día), atendidos en la Unidad de Hipertensión Arterial del Servicio de Nefrología del Hospital del Mar de Barcelona. Los primeros 125 pacientes incluidos fueron evaluados entre junio de 2007 y marzo de 2016, y se analizaron de forma retrospectiva (cohorte I). Posteriormente, se amplió el estudio con 91 pacientes adicionales de las mismas características, que se analizaron de forma prospectiva (cohorte II) desde abril de 2016 a septiembre de 2018 (90 completaron el estudio a los 3 meses, 85 a los 6 meses y 75 a los 12 meses).
Los objetivos específicos fueron: (a) evaluar la eficacia antihipertensiva de la espironolactona; (b) evaluar la variación de la creatinina plasmática (Creap), del filtrado glomerular estimado (FGe) por la fórmula de Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI), y de la concentración de Kp. Estos parámetros fueron evaluados a los 3, 6 y 12 meses tras el inicio del tratamiento con espironolactona.
Se incluyeron pacientes de edad igual o superior a los 18 años, diagnosticados de HTAR, definida esta de acuerdo con las guías de la Sociedad Europea de Hipertensión3 como PA>140/90mmHg a pesar de recibir tratamiento con 3 o más fármacos antihipertensivos de diferentes clases terapéuticas incluido un diurético. Se confirmó el diagnóstico de HTAR mediante monitorización ambulatoria de presión arterial (MAPA)3 de 24h en la mayoría de casos. Los criterios de exclusión fueron la enfermedad renal crónica grados 4, 5 o 5D, así como niveles de Kp basal>5mmol/l.
Variables estudiadasSe evaluaron datos clínicos y de laboratorio en el momento inicial y a los 3, 6 y 12 meses tras iniciar espironolactona. Además, en la cohorte II se analizaron los casos en que el facultativo indicó retirar espironolactona y sus razones. Para ello se recogieron datos demográficos y de la historia clínica de los pacientes, incluyendo edad, sexo, hábito tabáquico, peso e índice de masa corporal (IMC), enfermedad cardiovascular (cardiopatía isquémica, insuficiencia cardíaca, enfermedad cerebrovascular y enfermedad vascular periférica), diabetes mellitus, dislipidemia, enfermedad renal, síndrome de apnea obstructiva del sueño (SAOS), PA en consulta y ambulatoria por MAPA-24h y parámetros de laboratorio (Creap, FGe, concentración de Kp y cociente albúmina/creatinina en orina) en el momento basal. En el seguimiento, se recogieron datos de PA en consulta y parámetros de laboratorio a los 3, 6 y 12 meses tras iniciar espironolactona. Además, a los 12 meses también se recogieron datos de PA medida por MAPA-24h en 108 pacientes.
El FGe se estimó mediante la ecuación de CKD-EPI16. La albuminuria se evaluó por método inmunonefelométrico, siendo expresada mediante el cociente albúmina/creatinina determinado en orina reciente de primera hora de la mañana. Los parámetros bioquímicos se analizaron con autoanalizadores utilizando métodos estándares.
Se analizó la PA clínica utilizando un dispositivo semiautomático validado (Omron 705IT) con manguito de tamaño adecuado al perímetro braquial de cada sujeto. En cada visita se realizaron 3 medidas de PA, espaciadas 1-2min, iniciadas tras 5min de reposo con el paciente sentado y se consideró como valor definitivo el promedio de las 3 medidas.
Se recogieron datos referentes a los fármacos antihipertensivos prescritos en el momento basal y tras 12 meses del inicio de espironolactona. La adherencia al tratamiento fue evaluada por los datos autorreportados por el paciente, con revisión sistemática del mismo en cada visita.
Análisis estadísticoSe utilizaron estadísticos de tendencia central, media aritmética (intervalo de confianza del 95%), para las variables continuas y distribución de frecuencias para las variables discretas. Se utilizaron otros estadísticos de tendencia central, mediana (percentiles 25 y 75), para las variables continuas que no seguían una distribución normal. La evolución de los parámetros de interés a lo largo del seguimiento se estudió mediante modelos lineales mixtos. Se utilizó el test de Wilcoxon para evaluar el cambio que experimenta la albuminuria, parámetro de distribución no normal, entre el momento inicial y a los 12 meses de tratamiento con espironolactona.
Todos los análisis se ajustaron por las variables edad, sexo, IMC, diabetes mellitus, SAOS y FGe. Se consideraron resultados estadísticamente significativos los valores de p<0,05. Para el análisis estadístico se utilizó el programa STATA 15.1 (StataCorp, CollegeStation, TX, EE.UU.).
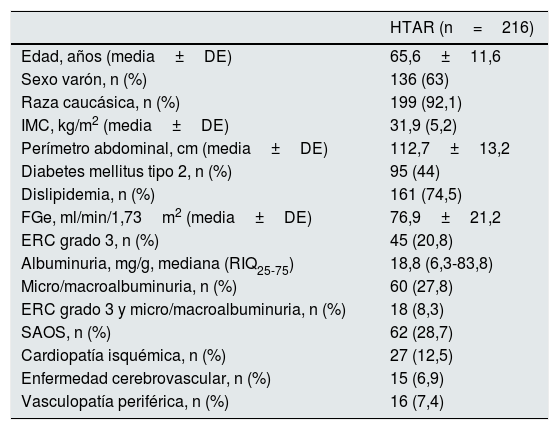
ResultadosSe incluyeron un total de 216 pacientes (edad media de 66 años), la mayoría de los cuales eran varones de raza caucásica, con alta prevalencia de diabetes mellitus, dislipidemia y SAOS (tabla 1).
Características basales de los pacientes con hipertensión arterial resistente
| HTAR (n=216) | |
|---|---|
| Edad, años (media±DE) | 65,6±11,6 |
| Sexo varón, n (%) | 136 (63) |
| Raza caucásica, n (%) | 199 (92,1) |
| IMC, kg/m2 (media±DE) | 31,9 (5,2) |
| Perímetro abdominal, cm (media±DE) | 112,7±13,2 |
| Diabetes mellitus tipo 2, n (%) | 95 (44) |
| Dislipidemia, n (%) | 161 (74,5) |
| FGe, ml/min/1,73m2 (media±DE) | 76,9±21,2 |
| ERC grado 3, n (%) | 45 (20,8) |
| Albuminuria, mg/g, mediana (RIQ25-75) | 18,8 (6,3-83,8) |
| Micro/macroalbuminuria, n (%) | 60 (27,8) |
| ERC grado 3 y micro/macroalbuminuria, n (%) | 18 (8,3) |
| SAOS, n (%) | 62 (28,7) |
| Cardiopatía isquémica, n (%) | 27 (12,5) |
| Enfermedad cerebrovascular, n (%) | 15 (6,9) |
| Vasculopatía periférica, n (%) | 16 (7,4) |
DE: desviación estándar; ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; HTAR: hipertensión arterial resistente; IMC: índice de masa corporal; RIQ: rango intercuartílico; SAOS: síndrome apnea obstructiva del sueño.
Antes de iniciar espironolactona, los pacientes recibían de media 4,0±1 fármacos antihipertensivos: 100% un diurético (74,2% tiazídico y 25,8% de asa), 93,5% un bloqueante del sistema renina-angiotensina-aldosterona (79,1% ARA-II y 14,4% IECA), 87,5% un calcioantagonista, 59,7% un betabloqueante, 38,0% un alfabloqueante, 10,2% un simpaticolítico (clonidina o moxonidina), 3,2% un inhibidor directo de renina (aliskiren) y 1% un vasodilatador arterial (hidralazina).
La dosis diaria de espironolactona inicial (mediana [RIQ25-75]) fue de 25mg (12,5 a 25) en la cohorte I y de 12,5mg (12,5 a 25) en la cohorte II, y a los 12 meses fue de 25mg (25-50) y 25mg (12,5 a 25) en las cohortes I y II, respectivamente.
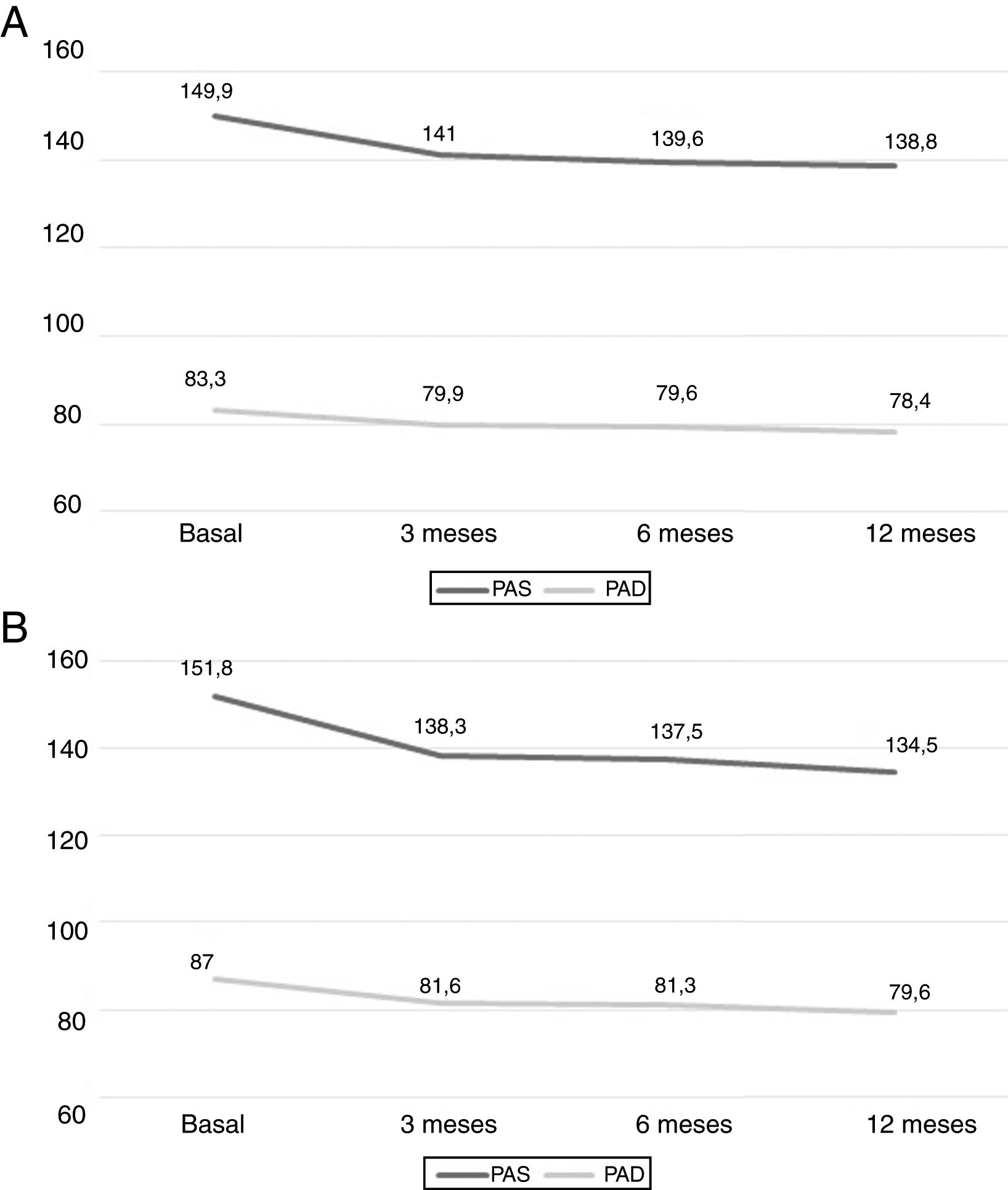
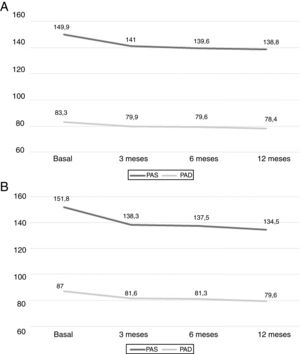
EficaciaLa PA clínica disminuyó de forma significativa a los 3 meses de tratamiento (p<0,001) y esta reducción se mantuvo a los 12 meses, siendo la media (IC del 95%) inicial de 149,9mmHg (146,7 a 153,1) y 151,8mmHg (148,1 a 155,5) en las cohortes I y II, respectivamente, y la final de 138,8mmHg (135,2 a 142,3) y 134,5mmHg (130,2 a 138,9) para las cohortes I y II, respectivamente. No se objetivaron cambios significativos entre los períodos de 3 y 6 meses, entre los 6 y 12 meses, y entre los 3 y los 12 meses (p>0,05 para todas las comparaciones). La figura 1 muestra los resultados por separado de ambas cohortes.
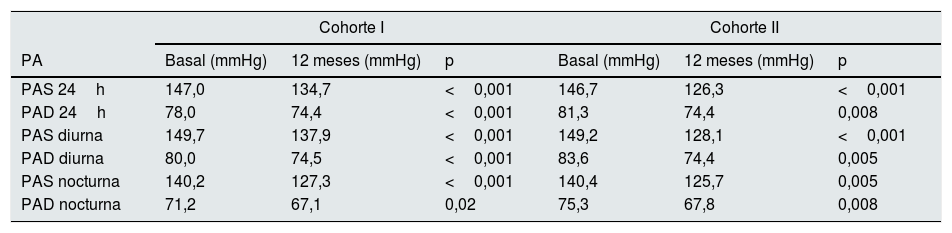
Además, se analizaron los cambios de la PA ambulatoria por MAPA-24h en el momento inicial y tras 12 meses de tratamiento con espironolactona (tabla 2), datos obtenidos en 108 pacientes. A los 12 meses, la PAS de 24h disminuyó −13,9mmHg (−18,4 a −9,4) y la PAD de 24h −6,1mmHg (−9,3 a −2,9); p<0,001 en ambos casos. Un 46,3% de los pacientes cambiaron su estatus inicial de HTAR no controlada a HTAR controlada (PAS 24h ≤130mmHg y PAD ≤80mmHg) tras 12 meses de tratamiento con espironolactona. Estos cambios no se relacionaron con cambios de peso, −0,17kg (−1,2 a +0,5) p=0,5, o IMC, −0,14kg/m2 (−0,6 a +0,2) p=0,7, en 12 meses.
Variación de presión arterial por MAPA-24h durante el tratamiento con espironolactona
| Cohorte I | Cohorte II | |||||
|---|---|---|---|---|---|---|
| PA | Basal (mmHg) | 12 meses (mmHg) | p | Basal (mmHg) | 12 meses (mmHg) | p |
| PAS 24h | 147,0 | 134,7 | <0,001 | 146,7 | 126,3 | <0,001 |
| PAD 24h | 78,0 | 74,4 | <0,001 | 81,3 | 74,4 | 0,008 |
| PAS diurna | 149,7 | 137,9 | <0,001 | 149,2 | 128,1 | <0,001 |
| PAD diurna | 80,0 | 74,5 | <0,001 | 83,6 | 74,4 | 0,005 |
| PAS nocturna | 140,2 | 127,3 | <0,001 | 140,4 | 125,7 | 0,005 |
| PAD nocturna | 71,2 | 67,1 | 0,02 | 75,3 | 67,8 | 0,008 |
MAPA: monitorización ambulatoria de presión arterial; PA: presión arterial; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Atendiendo a los patrones circadianos de la PA, el 62,1% de los pacientes presentaban inicialmente un patrón non-dipper o riser, proporción que se redujo al 48,9% en la MAPA-24h final tras 12 meses con espironolactona (p=0,001). Un 20,9% de los sujetos presentaron un cambio favorable en el patrón circadiano respecto a la MAPA inicial (pasando de riser a non-dipper, de riser a dipper o de non-dipper a dipper) (p=0,012).
La albúmina/creatinina urinaria descendió desde una mediana (RIQ25-75) inicial de 18,8mg/g (6,3 a 83,8) hasta 9,5mg/g (3,9 a 31,0) a los 12 meses, p<0,001. Este descenso fue especialmente relevante en pacientes con micro/macroalbuminuria en los que la excreción urinaria de albúmina (mediana [RIQ25-75]) inicial y final fue de 149,7mg/g (58,3 a 447,9) y 44,0mg/g (13,0 a 154,8) respectivamente, p<0,001.
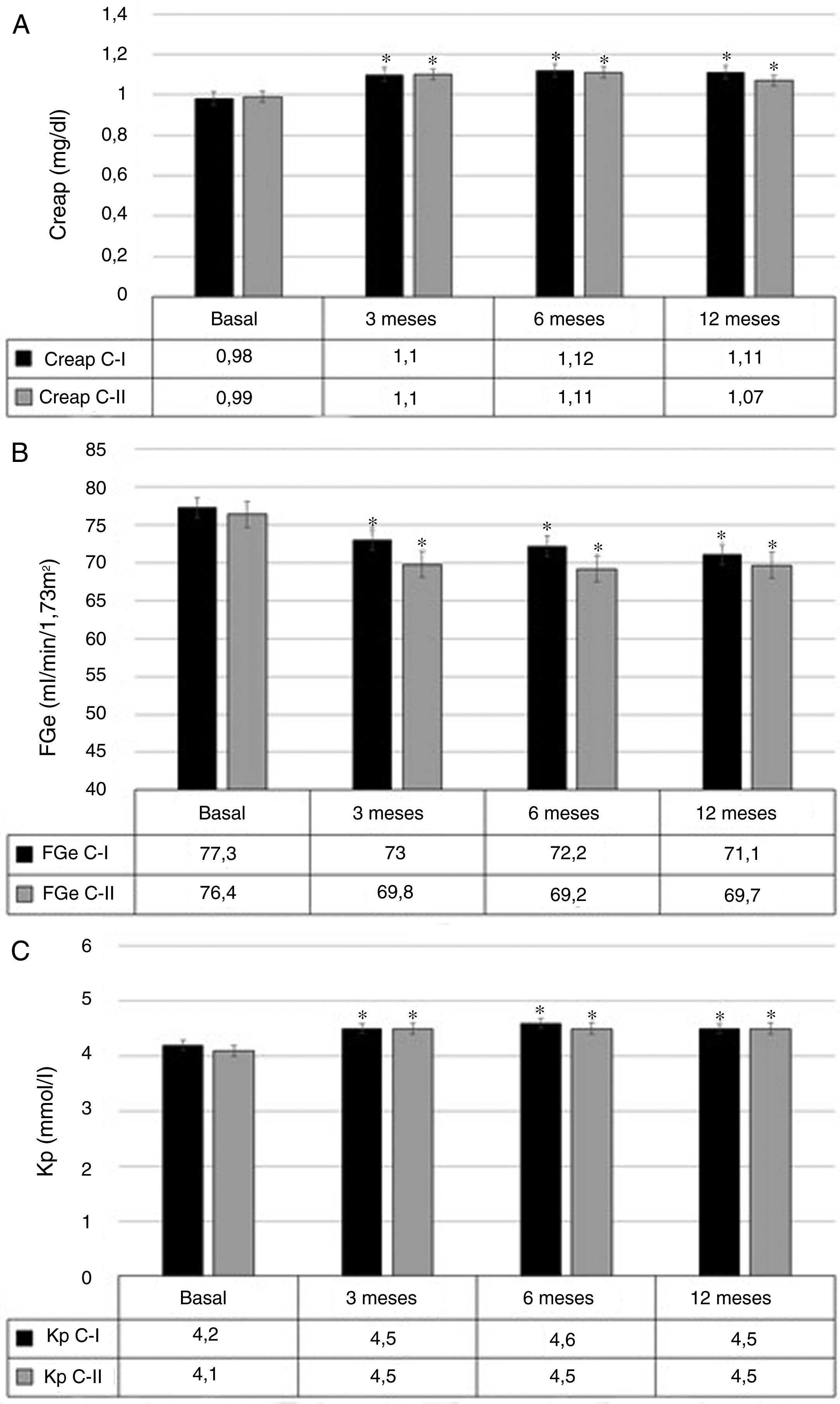
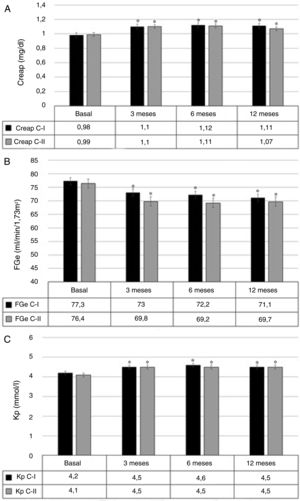
SeguridadLa Creap aumentó a los 3 meses en 0,10mg/dl (0,07 a 0,14), p<0,001. Este incremento se mantuvo estable a los 6 y 12 meses, sin diferencias significativas entre ambos períodos (fig. 2A, resultados por separado de las cohortes I y II).
Variación de creatinina plasmática (A), filtrado glomerular estimado (B) y potasio plasmático (C) durante el tratamiento con espironolactona.
C-I: cohorte retrospectiva; C-II: cohorte prospectiva; Creap: creatinina plasmática; FGe: filtrado glomerular estimado; Kp: potasio plasmático.
*p<0,05 vs. basal.
El FGe inicial fue de 76,9ml/min/1,73m2 (72,7 a 81,0). A los 3 meses, se objetivó una variación de −5,4ml/min/1,73m2 (−7,3 a −3,5), p<0,001. El descenso del FGe se mantuvo estable a los 6 y 12 meses, sin diferencias significativas entre ambos períodos (fig. 2B, resultados por separado de ambas cohortes).
El Kp aumentó a los 3 meses en 0,3mmol/l (0,2 a 0,4) (p<0,001). Este incremento se mantuvo estable a los 6 y 12 meses, sin diferencias significativas entre ambos períodos (fig. 2C, resultados por separado de ambas cohortes).
En la cohorte II, se retiró espironolactona en 9 de los 91 pacientes (9,9%). Las causas fueron: intolerancia gastrointestinal (un paciente a los 6 meses y 3 pacientes a los 12 meses), descenso del FGe>20% (2 pacientes tras 3 meses de tratamiento), ginecomastia (un paciente), dismenorrea (un paciente) e hipercaliemia (un paciente, >5,5mEq/l a los 12 meses).
DiscusiónEl presente estudio confirma que el uso de espironolactona para tratar la HTAR da lugar a un descenso significativo de la PA, ya evidente a los 3 meses, y mantenido a los 12 meses. Este descenso se objetiva no solo en la PA clínica, sino también en la PA ambulatoria de 24h. Asimismo, se evidencia que los efectos adversos, la disminución del FGe y el aumento del Kp, se presentan tras 3 meses de iniciar espironolactona, permaneciendo estables a largo plazo.
Espironolactona es un antagonista de los receptores mineralocorticoides con potente eficacia antihipertensiva. Nuestro estudio objetivó una reducción de PA de 10,9/4,3mmHg, PAS y PAD, respectivamente, resultados similares a estudios previos6,7. Asimismo, la reducción de PA objetivada mediante MAPA-24h también es superponible a datos ya publicados7–9, pero nuestro estudio aporta además información sobre el patrón de la MAPA y su variación tras la introducción de espironolactona, destacando una importante reducción a los 12 meses del porcentaje de pacientes con patrón no-dipper o riser inicial, lo que supone una mejoría en el perfil de riesgo cardiovascular de estos pacientes.
Respecto al poder antiproteinúrico de espironolactona, nuestro estudio muestra una importante reducción de la albuminuria al 50% (alrededor de 9,3mg/g). Van den Meiracker et al.11 objetivaron una eficacia antiproteinúrica similar en diabetes mellitus tipo 2 con dosis diarias de espironolactona superiores, 25-50mg, pero no se evidenciaron diferencias entre el grupo placebo y el de espironolactona. Bianchi et al.12, que añadían 25mg diarios de espironolactona al tratamiento antihipertensivo convencional, también mostraron una reducción de la proteinuria pero sin diferencias entre placebo y espironolactona.
El uso de espironolactona queda limitado por el temor a sus efectos adversos, especialmente a nivel de la función renal. Dichos efectos adversos se han analizado sobre todo en estudios donde la indicación de espironolactona era la proteinuria en pacientes diabéticos11 o la disfunción ventricular en pacientes con insuficiencia cardíaca13,14. En los citados estudios, se objetivó un deterioro progresivo de la función renal, acelerado en los primeros 3 meses y más paulatino pero progresivo a largo plazo. Referente a la caliemia, hemos observado un aumento inicial tras el inicio de espironolactona, que se estabiliza y mantiene a largo plazo. Respecto al uso de espironolactona en HTAR, el estudio PRAGUE-158 no evidenció variaciones significativas del FGe ni del Kp tras 12 meses con espironolactona, pero solo 19 pacientes completaron el tratamiento a los 12 meses. En cambio, el estudio PATHWAY-26 mostró un incremento del Kp (0,45mmol/l) tras iniciar espironolactona, y el descenso del FGe se objetivó en todos los grupos en los que se añadió un antihipertensivo (espironolactona, bisoprolol o doxazosina). La retirada de tratamiento antihipertensivo por empeoramiento de la función renal e hipercaliemia no fue significativamente diferente entre los distintos grupos de tratamiento del estudio. Por otro lado, los cambios de la función renal fueron evaluados a los 6 meses9 de iniciar el tratamiento; nuestro estudio permite un período más prolongado de observación, hasta los 12 meses.
La eficacia antihipertensiva de la espironolactona se pone de manifiesto ya a los 3 meses de su inicio, tanto para la PAS como para la PAD, manteniéndose estable, sin cambios estadísticamente significativos, a los 6 y 12 meses. Asimismo, los efectos adversos en cuanto al descenso del FGe y al aumento de la caliemia aparecen a los 3 meses del inicio de espironolactona y, posteriormente, se mantienen estables a los 6 y 12 meses. La dosis media de espironolactona no se redujo a lo largo del tratamiento.
El presente estudio en su cohorte de seguimiento prospectivo muestra que prácticamente en uno de cada 10 pacientes se retira la espironolactona, y la causa principal es la intolerancia gastrointestinal. Los efectos adversos renales obligaron a la suspensión del tratamiento en 3 de 91 pacientes (3,3%), una tasa aceptable teniendo en cuenta el balance global riesgos/beneficios que se muestra en este análisis.
Los efectos de espironolactona, tanto en cuanto a eficacia como a efectos adversos, son evidentes a los 3 meses de la introducción del fármaco, posiblemente con relación a cambios hemodinámicos que tienen lugar como respuesta adaptativa a los efectos del fármaco de acuerdo con su mecanismo de acción. Globalmente estos datos sugieren que se produce una adaptación a dichos cambios hemodinámicos, con estabilización tanto en el descenso de la PA como en el empeoramiento de los efectos adversos.
Entre las limitaciones principales del estudio se incluye el hecho de tratarse de un estudio observacional, aunque esto queda parcialmente contrarrestado por la cohorte de pacientes seguidos de forma prospectiva, y también porque al realizarse en un único centro, los protocolos de práctica clínica seguidos son muy homogéneos para todos los pacientes. Asimismo, la exclusión de pacientes con enfermedad renal crónica grados 4, 5 o en diálisis, impide extraer conclusiones para dichas poblaciones.
En conclusión, espironolactona es un fármaco seguro y eficaz en el tratamiento de la HTAR en pacientes con FGe basal ≥30ml/min/1,73m2.
FinanciaciónEste estudio ha contado con financiación parcial del proyecto ISCIII - Subprograma RETICS, fondos FEDER y REDinREN RD16/0009/0013.
Conflicto de interesesLos autores declaran no tener conflictos de interés relacionados con el contenido de este artículo.