Los registros (RE) científicos en trasplante (Tx) renal son muy útiles dado que nos permiten identificar factores de riesgo en esta población y facilitan contrastar la información con otros registros nacionales e internacionales, pudiendo contribuir a establecer estrategias que mejoren los resultados en términos de supervivencia. Constituyen un sistema organizado y planificado que utiliza métodos observacionales y procesos sistemáticos estandarizados, incluyendo modelos ajustados de riesgo, para evaluar esencialmente resultados de supervivencia. Los RE científicos se complementan con los ensayos clínicos aportando evidencia científica, pero necesitan inexcusablemente análisis estadísticos adecuados para generar datos clínicos fehacientes que contribuyan a optimizar el pronóstico de la población trasplantada. Asimismo, los RE científicos proporcionan información valiosa sobre el rendimiento de los programas de Tx y ayudan a generar índices pronósticos, que redundarán en la mejoría de la supervivencia. Con estas premisas, esta revisión profundizará en los siguientes aspectos relacionados con los RE científicos en el Tx: 1) el concepto y la importancia de implementar los RE en Tx; 2) las medidas que se necesitan para la correcta ejecución de los RE científicos; 3) los beneficios, la calidad y las limitaciones de los RE; 4) las herramientas estadísticas para el adecuado análisis de la supervivencia, y 5) la utilidad de los RE en la evaluación de la calidad, el rendimiento y las expectativas de los programas de Tx y la generación de índices de comorbilidad.
The scientific Registries (RE) in renal transplantation (Tx) are very useful since they allow us to identify risk factors in this population and facilitate contrasting the information with other national and international registries, contributing to establishing strategies which improve outcomes in terms of survival. They constitute an organised and planned system that uses observational methods and standardised systematic processes, including adjusted risk models, to essentially evaluate survival outcomes. The scientific RE are complemented with clinical trials providing scientific evidence, but inexcusably need adequate statistical analysis to generate reliable clinical data that contribute to optimising the prognosis of the transplant population. In addition, scientific RE provide valuable information on the performance of Tx programmes and help generate prognostic indexes, which could contribute to improving survival. Under these prerequisites, this review will assess the following aspects related to the scientific RE in the Tx: 1) the concept and importance of implementing RE in Tx; 2) the measures that are needed for the correct execution of the scientific RE; 3) the benefits, quality and limitations of RE; 4) the statistical tools for the adequate analysis of survival; and 5) utility of RE in the evaluation of performance, quality and surveillance of transplant programmes and the generation of comorbidity índices.
Durante los últimos años ha proliferado una ingente cantidad de registros (RE) y estudios poblacionales en diferentes áreas de la Medicina, incluyendo el campo de los trasplantes (Tx) de órganos, con fines básicamente organizativos, epidemiológicos o asistenciales. Pero, ¿aportan evidencia a nuestros conocimientos?; ¿son realmente útiles?, o ¿solo representan meras bases de datos inaccesibles e ininteligibles con escaso interés para la comunidad científica?
Como parte de los estudios observacionales (EO), los RE aportan datos clínicos y epidemiológicos esenciales para conocer el estado de salud de la población y la calidad y el coste de los servicios médicos, orientando a los gestores sanitarios a establecer prioridades y estrategias específicas en la planificación sanitaria de diferentes entidades clínicas, incluido el Tx1-7. Indudablemente, esto puede mejorar los resultados en términos de supervivencia. En esta línea, muchos países de nuestro entorno, incluida España, han apostado por los RE científicos para aumentar el conocimiento y mejorar los resultados en diferentes entidades clínicas como el Tx.
La Sociedad Española de Nefrología ha promocionado desde su inicio el desarrollo del RE de pacientes renales en tratamiento renal sustitutivo de la función renal (disponible en www.senefro.org). De hecho, este RE ha estado operativo en España desde el año 1979 y siempre ha estado estrechamente relacionado con el Registro de la European Dialysis and Transplantation Association (ERA-EDTA) y la Organización Nacional de Trasplantes (ONT)7,8.
Aunque el Tx es el tratamiento de elección para los pacientes con enfermedad renal crónica avanzada, tras el Tx se sigue observando una pérdida crónica de injertos, aún en las mejores condiciones de partida como el Tx con donante vivo, debida fundamentalmente a la muerte del paciente y a la disfunción del injerto9,10. Indudablemente, esto conlleva un importante consumo de recursos sanitarios y económicos, lo que obliga a un análisis detallado a través de los RE para conocer y mejorar nuestra práctica médica habitual en el campo del Tx. Para alcanzar este objetivo, los RE científicos necesitan análisis estadísticos adecuados que generen datos clínicos sólidos y fehacientes.
Con estas premisas, en esta revisión profundizaremos en los siguientes aspectos: a) el concepto y la importancia de implementar los RE en Tx; 2) las medidas que se necesitan para la correcta ejecución de los RE; 3) los beneficios, la calidad y las limitaciones de los RE; 4) las herramientas estadísticas para el adecuado análisis de la supervivencia, y 5) la utilidad de los RE: rendimiento de los programas de Tx y generación de índices de comorbilidad (IC).
Concepto e importancia de los registros en trasplantesConceptualmente, los RE constituyen un sistema organizado y planificado que utiliza métodos observacionales para recoger datos clínicos y epidemiológicos con la intención de evaluar resultados de una población definida, especialmente la supervivencia, con propósitos científicos, clínicos o administrativos11. En efecto, los RE permiten conocer el estado de salud de la población, proporcionan datos clínicos y epidemiológicos esenciales para analizar y comparar resultados con otros RE nacionales e internacionales, y ayudan a profundizar en los indicadores de calidad y salud, orientando a los gestores sanitarios a identificar prioridades y establecer estrategias específicas. Al mismo tiempo, pueden incrementar el nivel de evidencia complementándose con los ensayos clínicos (EC), los cuales tienen en ocasiones importantes limitaciones de índole poblacional (escaso tamaño muestral, población muy seleccionada, corto periodo de seguimiento, etc.) para proporcionar conclusiones contundentes. A título de ejemplo, a partir del Registro Científico Americano de Receptores de Trasplantes (Scientific Registry Transplant Receptor [SRTR]) y de los factores de riesgo de la comunidad (obesidad, tabaco, inactividad física, pobreza, etc.) (disponible en http://www.countyhealthrankings.org), que tienen un impacto negativo sobre la supervivencia, se pueden detectar pacientes en lista de espera para Tx que están en riesgo de muerte12. Asimismo, se ha observado que los receptores de Tx con mayor número de factores de riesgo de la comunidad tienen una disminución significativa de la supervivencia13.
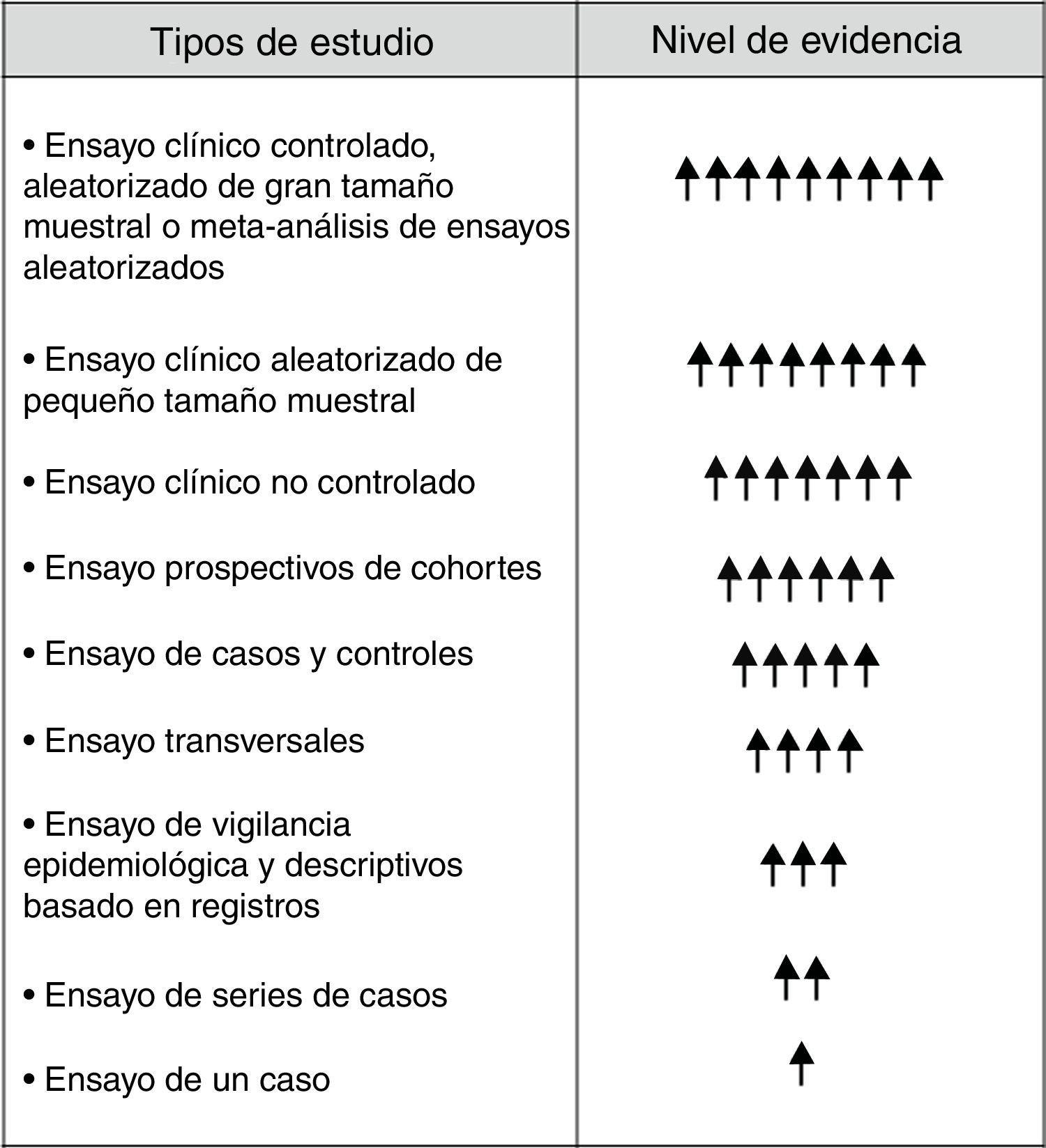
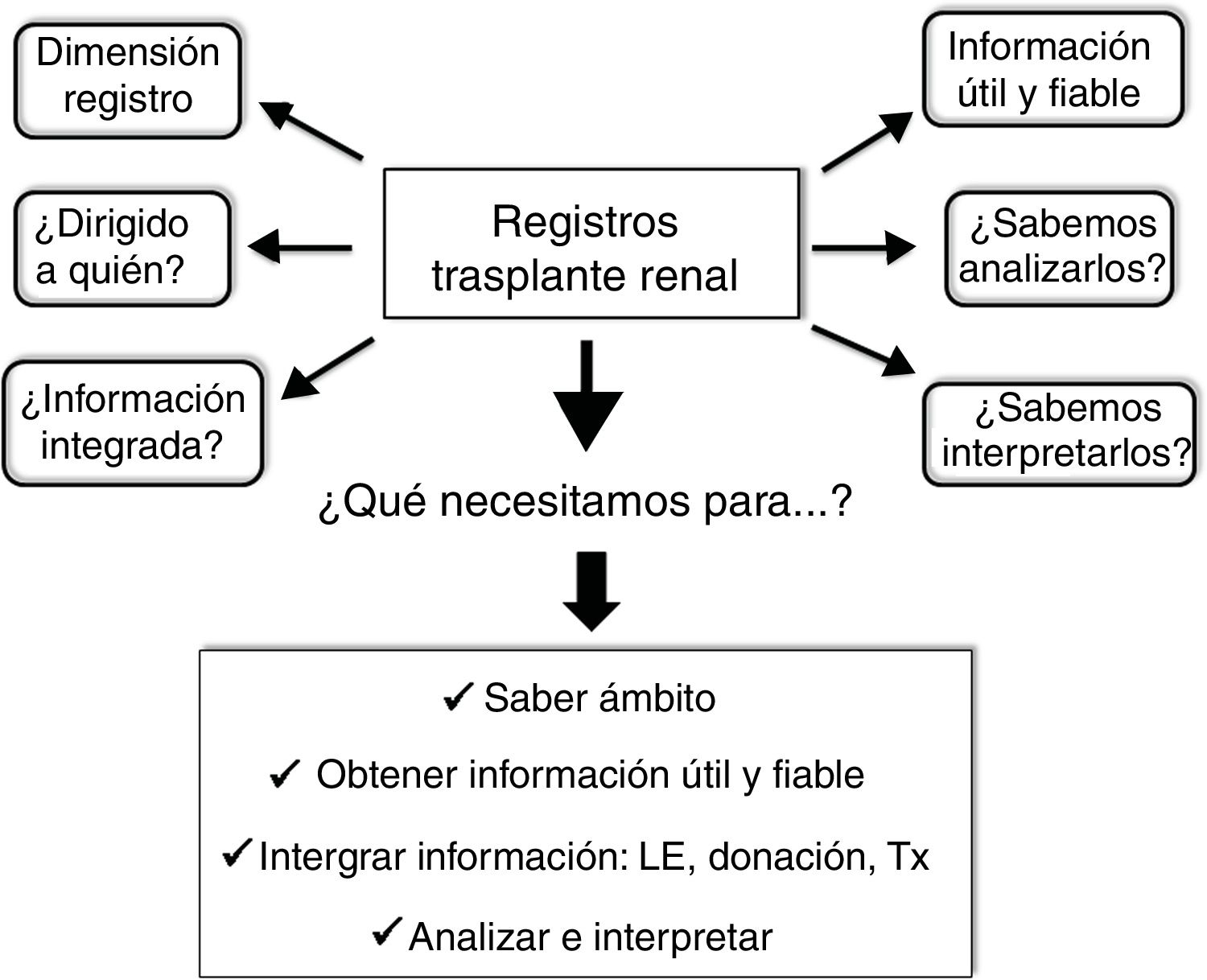
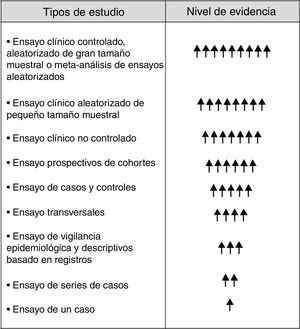
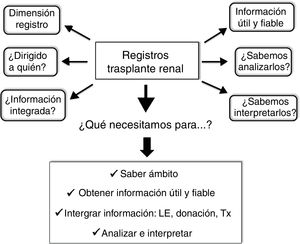
Aunque en la escala jerárquica de la evidencia los RE ocupan posiciones inferiores (fig. 1), proporcionan datos clínicos y epidemiológicos muy valiosos para su implementación en la práctica clínica, especialmente cuando se complementan con EC6,14,15. Para alcanzar este objetivo se requiere inexcusablemente conocer y contestar las siguientes cuestiones: 1) la dimensión del RE con objetivos claros y precisos; 2) a quién van dirigidos; 3) saber extraer información útil y fiable del RE; 4) obtener información integrada del RE (donación, lista de espera y Tx), y 5) analizarlos e interpretarlos correctamente. Una apropiada respuesta a estas cuestiones y necesidades contribuirá, sin duda, a que los RE no sean meras bases de datos inaccesibles e ininteligibles, sino que generen información de interés general en el ámbito del Tx. En otras palabras, la aplicación de un procedimiento estandarizado redundará en que los RE en Tx aporten datos fehacientes que nos ayuden a modificar y mejorar nuestra práctica clínica (fig. 2).
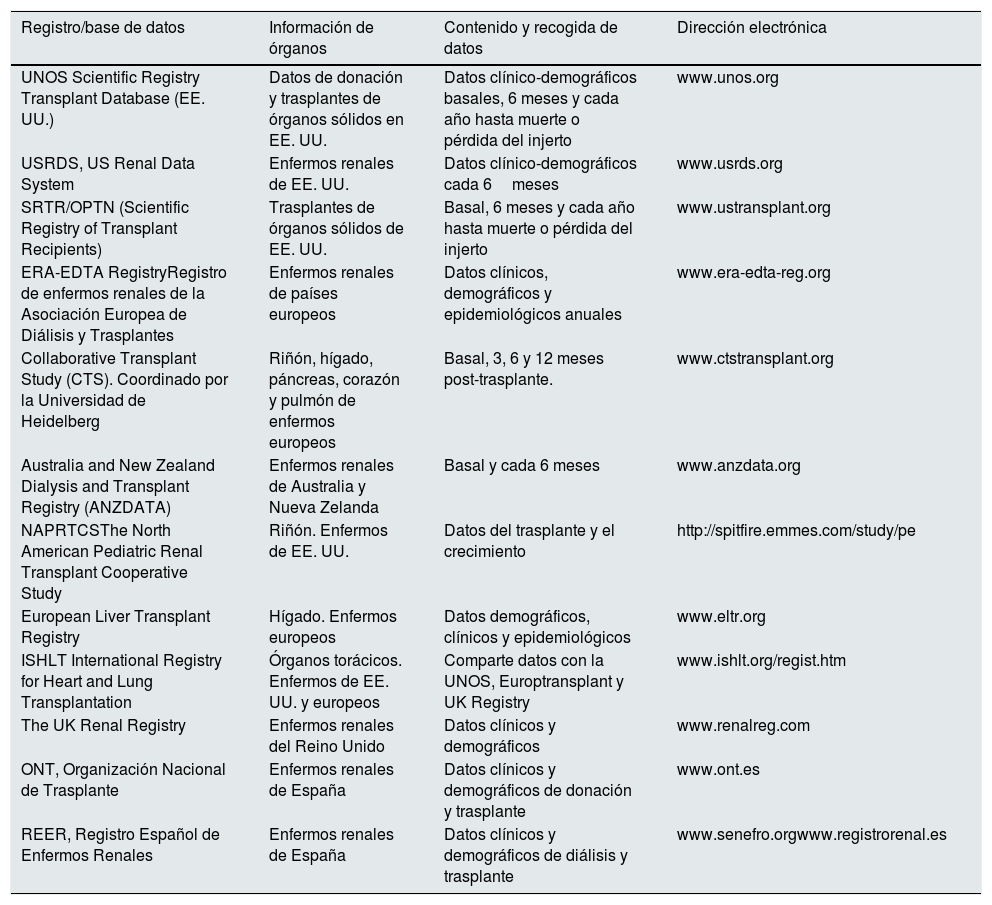
Ejecución de los registros. Procedimiento sistemático estandarizadoExisten RE internacionales y nacionales de Tx de órganos sólidos (TOS) en varios países del mundo que proporcionan una información muy útil sobre el número de pacientes en lista de espera, las características de los donantes o el volumen de Tx realizados, pero pocos RE proporcionan información pormenorizada de los resultados del Tx en términos de supervivencia o sobre el rendimiento de los programas de Tx. Estos últimos tienen en común que han sido desarrollados como procesos sistemáticos estandarizados (PSE), los cuales incluyen modelos ajustados de supervivencia, así como análisis de las expectativas de los programas de Tx para alcanzar tales objetivos5,16-18. A modo de ejemplo, el SRTR americano mantiene en la actualidad 43 modelos de ajuste de riesgo para evaluar la supervivencia en diferentes TOS (disponible en http://www.srtr.org/csr/current/modtabs.aspx), que se renuevan cada 6meses. La generación y la difusión de PSE a lo largo del mundo para la creación de modelos de riesgo pudieran ayudar a otros países a desarrollar o mejorar sus RE nacionales, facilitando comparaciones internacionales para incrementar la calidad asistencial y los resultados del Tx19. En la tabla 1 se muestra información general sobre algunos de los RE de Tx con mayor impacto sociosanitario.
Algunos de los registros de trasplantes con mayor impacto socio-sanitario
| Registro/base de datos | Información de órganos | Contenido y recogida de datos | Dirección electrónica |
|---|---|---|---|
| UNOS Scientific Registry Transplant Database (EE. UU.) | Datos de donación y trasplantes de órganos sólidos en EE. UU. | Datos clínico-demográficos basales, 6 meses y cada año hasta muerte o pérdida del injerto | www.unos.org |
| USRDS, US Renal Data System | Enfermos renales de EE. UU. | Datos clínico-demográficos cada 6meses | www.usrds.org |
| SRTR/OPTN (Scientific Registry of Transplant Recipients) | Trasplantes de órganos sólidos de EE. UU. | Basal, 6 meses y cada año hasta muerte o pérdida del injerto | www.ustransplant.org |
| ERA-EDTA RegistryRegistro de enfermos renales de la Asociación Europea de Diálisis y Trasplantes | Enfermos renales de países europeos | Datos clínicos, demográficos y epidemiológicos anuales | www.era-edta-reg.org |
| Collaborative Transplant Study (CTS). Coordinado por la Universidad de Heidelberg | Riñón, hígado, páncreas, corazón y pulmón de enfermos europeos | Basal, 3, 6 y 12 meses post-trasplante. | www.ctstransplant.org |
| Australia and New Zealand Dialysis and Transplant Registry (ANZDATA) | Enfermos renales de Australia y Nueva Zelanda | Basal y cada 6 meses | www.anzdata.org |
| NAPRTCSThe North American Pediatric Renal Transplant Cooperative Study | Riñón. Enfermos de EE. UU. | Datos del trasplante y el crecimiento | http://spitfire.emmes.com/study/pe |
| European Liver Transplant Registry | Hígado. Enfermos europeos | Datos demográficos, clínicos y epidemiológicos | www.eltr.org |
| ISHLT International Registry for Heart and Lung Transplantation | Órganos torácicos. Enfermos de EE. UU. y europeos | Comparte datos con la UNOS, Europtransplant y UK Registry | www.ishlt.org/regist.htm |
| The UK Renal Registry | Enfermos renales del Reino Unido | Datos clínicos y demográficos | www.renalreg.com |
| ONT, Organización Nacional de Trasplante | Enfermos renales de España | Datos clínicos y demográficos de donación y trasplante | www.ont.es |
| REER, Registro Español de Enfermos Renales | Enfermos renales de España | Datos clínicos y demográficos de diálisis y trasplante | www.senefro.orgwww.registrorenal.es |
Con estas premisas, los PSE deben contemplar inicialmente un plan director que incluya objetivos claros y precisos, una población diana bien identificada, una adecuada definición de las variables y un conocimiento apropiado del ámbito del RE. Un RE debe reflejar la realidad de lo que ocurre en un determinado ámbito médico, teniendo en cuenta que a medida que aumenta la dimensión del RE, disminuye la viabilidad y sostenibilidad del mismo.
Los PSE requieren un mínimo de requisitos para permitir que los RE científicos proporciones una información fiable y creíble a la comunidad científica y a la población general5,6,17,18,20: 1) elección adecuada de la cohorte (p. ej., Tx donante vivo vs. donante fallecido, adulto vs. pediátrico, Tx simple vs. múltiple, etc.); 2) un número adecuado de eventos por cada factor de riesgo analizado (en general 10 por cada factor de riesgo); 3) elección apropiada de las variables principales y secundarias por el comité de expertos; 4) imputación adecuada de los valores missing; 5) construir el mejor modelo de riesgo con el menor número de variables evitando el sobreajuste (modelo parsimonioso); 6) valorar interacciones por expertos clínicos; 7) validar el RE mediante la discriminación y la calibración; 8) aplicación de los modelos de riesgo en la propia cohorte de estudio y en otras cohortes similares o más recientes, y 9) garantizar la custodia y vigilancia del RE, así como mantener sus sostenibilidad (tabla 2). Una guía muy útil para la creación de RE se encuentra disponible en https://www.ncbi.nlm.nih.gov/pubmed/24945055.
Requisitos de los procesos sistemáticos estandarizados para la elaboración de registros científicos
| Elección adecuada de la cohorteNúmero mínimo de eventos (10 por cada factor de riesgo)Decisión de los datos que serán incluidos en los modelos de riesgoElección apropiada las variables: comité expertosImputación adecuada de los valores missingConstrucción del mejor modelo de riesgo (parsimonioso)Valorar interacciones por expertosValidarlo: discriminación y calibraciónAplicación en cohorte de estudio y otra más recienteVigilancia y mantenimiento |
Por todo ello, para la ejecución de los RE en Tx necesitamos el concurso de un comité científico que agrupe expertos clínicos en la materia de estudio, epidemiólogos y bioestadísticos con conocimientos y experiencia en el desarrollo de RE. Esto facilitará la creación de bases de datos en un entorno informático «amigable» para minimizar los errores de transcripción, definiendo bien los end-points y las medidas subordinadas. El empleo de herramientas estadísticas potentes permitirá análisis sensatos, minuciosos y potentes para evitar los sesgos inherentes a los propios RE. Con ello, se responderá adecuadamente a las preguntas y a los objetivos planteados en el RE. Saber exactamente qué se registrará y para qué.
El desarrollo de un RE de Tx mediante esta estrategia nos proporcionará datos sobre incidencia, prevalencia, modalidades terapéuticas, resultados de supervivencia e indicadores clínicos de riesgo, lo que permitirá comparaciones epidemiológicas entre comunidades autónomas u otros países. Sin duda, esto representa una acertada inversión de tiempo, siempre que se acojan a las normas de calidad establecidas para los mismos y se empleen PSE para su desarrollo. En este sentido, una reciente publicación del SRTR americano mostraba que una gran proporción de los usuarios que solicitan información sobre el proceso de Tx, las tasas de supervivencia y los programas de Tx, son candidatos a Tx, familiares de candidatos o aquellos individuos relacionados con Tx de donante vivo y profesionales sanitarios21.
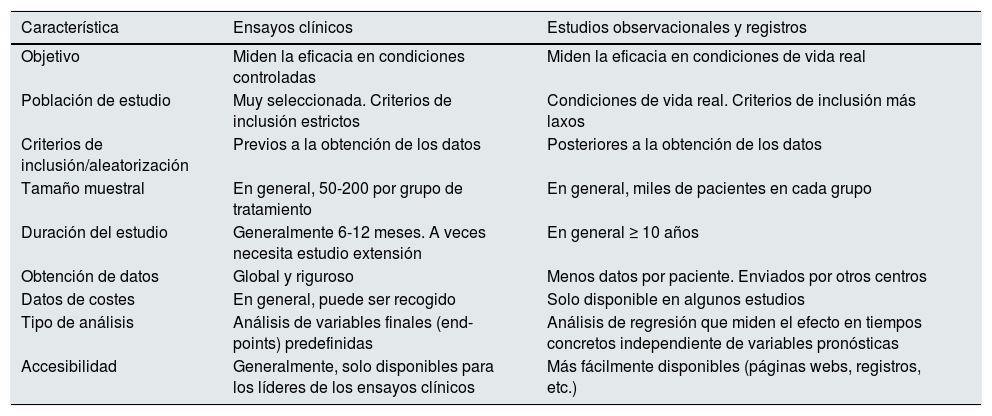
Beneficios, limitaciones y calidad de los registrosAunque los EC constituyen un instrumento esencial para comprobar determinadas hipótesis que se plantean en la investigación biomédica, algunas razones de peso justifican la necesidad de desarrollar grandes RE y EO en cualquier disciplina médica, incluido el Tx. La tabla 3 muestra algunas diferencias más importantes entre los EC y los EO que nos ayudarán a comprender las ventajas y las limitaciones de los mismos6. En efecto, los EC tienen también sus propias limitaciones derivadas de sus condiciones de estudio y de su incapacidad para detectar pequeñas pero notorias diferencias entre las cohortes que se analizan. El tamaño de la muestra y la duración de los EC es notoriamente menor que en los EO, los cuales analizan miles de pacientes durante un largo seguimiento (generalmente > 10 años). Los EC pueden carecer del poder estadístico suficiente para detectar diferencias en las tasas de supervivencia ante determinadas intervenciones terapéuticas. Esto se hace más patente en el campo del Tx donde muchas veces se emplean variables finales intermedias como la tasa de rechazos agudos o recidivas obviando como objetivo primario la supervivencia del paciente o injerto. Asimismo, los EC se realizan en pacientes muy seleccionados y en condiciones muy rigurosas, lo que pudiera alejarnos de la realidad en la práctica clínica habitual y llevarnos a una engañosa generalización de sus resultados. De hecho, en circunstancias diferentes del propio EC, la eficacia de un determinado tratamiento pudiera debilitarse. Por el contrario, los RE basados en métodos observacionales analizan la efectividad en condiciones habituales de la vida cotidiana. Los EO retrospectivos pueden llegar a confirmar si los efectos testados previamente en los EC son aplicables a otras poblaciones y en otras circunstancias. Con todo, la investigación biomédica en el campo del Tx descansa mayoritariamente en los EO. De estos argumentos se deduce que el EO y el EC deben complementarse y aunar sus conclusiones para escalar niveles de evidencia y lograr el máximo rendimiento en la aplicación de sus resultados en pacientes con Tx.
Diferencias más relevantes entre los ensayos clínicos y los estudios observacionales y registros
| Característica | Ensayos clínicos | Estudios observacionales y registros |
|---|---|---|
| Objetivo | Miden la eficacia en condiciones controladas | Miden la eficacia en condiciones de vida real |
| Población de estudio | Muy seleccionada. Criterios de inclusión estrictos | Condiciones de vida real. Criterios de inclusión más laxos |
| Criterios de inclusión/aleatorización | Previos a la obtención de los datos | Posteriores a la obtención de los datos |
| Tamaño muestral | En general, 50-200 por grupo de tratamiento | En general, miles de pacientes en cada grupo |
| Duración del estudio | Generalmente 6-12 meses. A veces necesita estudio extensión | En general ≥ 10 años |
| Obtención de datos | Global y riguroso | Menos datos por paciente. Enviados por otros centros |
| Datos de costes | En general, puede ser recogido | Solo disponible en algunos estudios |
| Tipo de análisis | Análisis de variables finales (end-points) predefinidas | Análisis de regresión que miden el efecto en tiempos concretos independiente de variables pronósticas |
| Accesibilidad | Generalmente, solo disponibles para los líderes de los ensayos clínicos | Más fácilmente disponibles (páginas webs, registros, etc.) |
Sin embargo, existen numerosas limitaciones de los RE y EO que debemos conocer. Algunos hallazgos médicos que nacieron de EO no fueron confirmados posteriormente por EC rigurosos, lo que denota que los EO y los RE son muy vulnerables a factores de confusión («confounding factors»), principalmente por la visión retrospectiva inherente al propio RE. En efecto, los RE y los EO tienen importantes limitaciones derivadas de grandes sesgos en sus análisis, especialmente la supervivencia. Estos sesgos incluyen la inadecuada definición de los end-point o la elección de medidas subordinadas (surrogate measures) inapropiadas, la recogida imprecisa de la información, el análisis de poblaciones muy heterogéneas, la falta de aleatorización de los grupos de estudio o la presencia de variables de confusión3,18,22-24. Afortunadamente, existen potentes herramientas estadísticas, como los análisis de regresión, que minimizan esta situación y proyectan los EO y los grandes RE a niveles más altos en la escala jerárquica de la evidencia. Un documento de consenso sobre la calidad y la vigilancia de los RE de Tx aportó una serie de recomendaciones sobre los modelos estadísticos a utilizar y los oportunos ajustes a realizar para evitar el sobreajuste y las imprecisiones en los análisis de supervivencia en pacientes lista de espera y post-Tx25.
A pesar de estas medidas, es esperable que aún se cometan errores. Por ello, grandes RE con importante impacto sanitario necesitan controles de calidad o auditorías externas que, independientemente, confirmen la veracidad y la precisión de los datos recogidos. Pero, ¿cómo se puede asegurar la calidad de los RE? En general, la calidad de los RE depende de la inclusión de un grupo de pacientes representativo y de la veracidad de los datos recogidos. Esto implica que los datos sean completos, precisos y fiables26,27. Independientemente de un buen diseño del RE con una selección adecuada de variables y una correcta recogida de la información, existen básicamente 2métodos para asegurar la calidad de los datos. El primero consiste en analizar la calidad de los datos dentro de la misma base de datos (validez interna). Con ello, inicialmente detectaremos los valores perdidos (valores missing) y los valores incongruentes, los cuales son más preocupantes que los primeros ya que pueden afectar más a los resultados de un estudio epidemiológico que los valores perdidos. El segundo método para garantizar y validar la calidad de los datos descansa en reproducir exactamente la recogida de datos de una parte de la muestra inicial y compararla con la muestra original (validez externa). El grado de acuerdo o concordancia entre las variables categóricas de las 2muestras será determinado por el índice kappa. Un índice kappa que se acerque a la unidad indicará una gran similitud entre las muestras y avalará, por tanto, la calidad de los datos. Dado que estos métodos no evitan por completo la generación de errores, en ocasiones se recurre a las auditorías externas para comprobar la veracidad de los RE, comparando los datos contenidos en las bases de datos con las historias clínicas de los pacientes. Un estudio previo sobre el control de calidad del RE europeo de Tx hepático, en el que se auditaron aleatoriamente las bases de datos de 21 centros en 12 países europeos, comprobó que los datos en su gran mayoría eran fiables (1,5% de datos incongruentes y 5% de valores missing), así como los resultados científicos derivados de los mismos28. Estos hallazgos apuntalaban la fiabilidad de este RE, lo que pude servir de modelo para garantizar la calidad de otros RE, incluidos los del territorio nacional.
Al margen de estas consideraciones técnicas, la integración de los RE de Tx en una comunidad científica de un país con diferentes RE pudiera incrementar también la calidad y la veracidad de los mismos. En otras palabras, cuestiones de carácter sociosanitarias o administrativas que conlleven la fragmentación de los RE científicos de un país, pudieran debilitar la validez y contundencia de los mismos. El empleo de sistemas diferentes o incompatibles en la recogida de información y un ingente consumo de tiempo y recursos apoyan la debilidad de esta estrategia y no garantizan la precisión ni la cumplimentación de los datos. Actualmente, en nuestro ámbito contamos con RE muy valiosos, como el RE de Donación y Trasplante de la ONT, los RE científicos de Tx de diferentes sociedades científicas y los RE autonómicos de diálisis y Tx. Idealmente, sería más razonable y operativo la integración de todos los RE de Tx de España en un solo RE científico que aunase toda la información disponible del registro de la ONT, de los RE autonómicos y de los RE de las sociedades científicas (incluida la Sociedad Española de Nefrología), para que fuera compartido por todos de una manera transparente. Esto pudiera incrementar la precisión de los datos y el nivel de conocimiento en esta población. A modo de ejemplo, la comparación reciente de los datos de cáncer entre los pacientes trasplantados del RE americano de Tx (SRTR/Organ Procurement and Transplantation Network [OPTN]) y los RE individuales de diferentes tipos de cánceres, demostró que solo el 36% de los cánceres estaban en ambos RE, indicando que los datos incompletos o pocos precisos pueden limitar la utilidad del RE para fines asistenciales y de investigación29. De manera similar, también se ha reportado una discordancia entre la incidencia de linfomas post-Tx entre los datos de la OPTN y los datos del RE Medicare americano30.
Actualmente, existe una pléyade de ejemplos de grandes publicaciones científicas en todo el mundo derivada de RE, especialmente del RE americano SRTR, que identifican problemas de salud y factores de riesgo para la supervivencia de injertos y pacientes con Tx3-5,24,31-35. En nuestro entorno, el empleo del RE andaluz de diálisis y Tx con más de 22.000 pacientes incluidos en desde 1984 hasta la actualidad nos ha permitido el análisis de la supervivencia en pacientes en lista de espera para Tx y los factores de riesgo de mortalidad de esta población, lo cual pudiera mejorar el cuidado de nuestros enfermos candidatos a Tx36-39.
Herramientas estadísticas para el análisis de supervivencia en los registros de trasplantesLa elección de modelos estadísticos apropiados es otro paso crucial para el análisis de los RE y el estudio de la supervivencia en el Tx. Los EO y los RE son muy vulnerables a factores de confusión y carecen de la asignación aleatoria que se produce en los EC, lo que evita el sesgo de selección o de susceptibilidad. Básicamente, existen 3métodos para controlar este sesgo en los estudios de RE y EO: estratificación-estandarización, los modelos de regresión y el índice de propensión. Sin embargo, estas herramientas solo controlan la confusión provocada por características observadas, a diferencia de la aleatorización, que controla por las observadas y no observadas. En cualquier caso, estas medidas minimizan el efecto de las variables de confusión en la interpretación de los resultados de los RE y EO6,17,18.
Un primer paso para el conocimiento de los resultados del Tx de un RE lo constituyen los análisis de supervivencia. Estos análisis representan un conjunto de técnicas diseñadas para estudiar una variable conocida como el «tiempo hasta un evento» (muerte, fallo del injerto, rechazo, etc.) y las asociaciones entre dicha variable y potenciales variables explicativas.
La variable «tiempo al evento» es determinada a través de 2probabilidades que están relacionadas: la función de supervivencia, que indica la probabilidad de que un individuo sobreviva en un tiempo ≥ t, y la función de riesgo (hazard), que representa la probabilidad instantánea (por unidad de t) de que un paciente en un tiempo t tenga el evento18,40. Por tanto, los análisis de supervivencia tienen 3objetivos: estimar e interpretar curvas de supervivencia, comparar curvas (p. ej., 2tratamientos) o estimar la relación de factores de riesgo con la supervivencia. La probabilidad de supervivencia puede ser estimada con métodos no paramétricos a partir del tiempo de supervivencia observado, usando el análisis de Kaplan-Meier. Sin embargo, estos análisis pueden tener puntos críticos en la estimación de la variable «tiempo al evento», originando imprecisiones en su determinación. Estos puntos críticos son: 1) asunción de que las censuras (pérdida de seguimiento, finalización del estudio sin eventos y aparición de eventos competitivos) no aportan información pronóstica; ante eventos competitivos, habría que emplear modelos de riesgos competitivos18,41-43; 2) imprecisión en el cálculo de la mediana de tiempo de seguimiento cuando no se hayan producido suficientes eventos; esto puede traducirse en estimaciones ficticias de la supervivencia tras la asunción de otros modelos43,44, y 3) no aportar la precisión de las estimaciones del efecto a través del intervalo de confianza del 95% o la tabla de los individuos en riesgo. Abraira et al. mostraron que menos del 50% de los análisis de supervivencia publicados de diferentes áreas de conocimiento mostraban la descripción de las censuras o la mediana de tiempo de seguimiento45. Asimismo, solo el 50% de los mismos mostraba datos sobre la precisión de las estimaciones de los efectos45, lo cual deja abierta un área de mejora en la calidad de estos análisis.
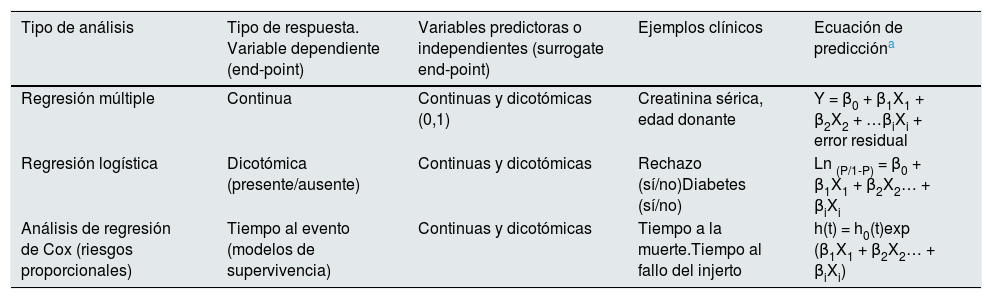
El análisis de Kaplan-Meier pretende conocer la influencia individual de una variable con la supervivencia, pero ignora el impacto de otros factores. Por ello, son vulnerables a los factores de confusión y no cuantifican el efecto sobre la supervivencia. Por tanto, los análisis de Kaplan-Meier deben seguirse de la estimación del nivel de incertidumbre a través de los modelos de regresión, los cuales permiten cuantificar el efecto (hazard ratio) y conocer la contribución independiente de varios factores de riesgo sobre la supervivencia. En la tabla 4 se muestran los tipos de análisis de regresión más empleados en los TOS y sus características más importantes. Estos modelos de regresión permiten además comparar curvas, testar interacciones y generar modelos predictivos. El modelo de Cox es el más utilizado y proporciona el riesgo relativo del pronóstico en cuestión (variables dependiente), en función de posibles factores explicativas o de confusión (variables independientes), asumiendo que, a medida que transcurre el tiempo, el riesgo de los 2grupos es constante.
Análisis de regresión más empleados en investigación clínica en los trasplantes de órganos sólidos
| Tipo de análisis | Tipo de respuesta. Variable dependiente (end-point) | Variables predictoras o independientes (surrogate end-point) | Ejemplos clínicos | Ecuación de prediccióna |
|---|---|---|---|---|
| Regresión múltiple | Continua | Continuas y dicotómicas (0,1) | Creatinina sérica, edad donante | Y = β0 + β1X1 + β2X2 + …βiXi + error residual |
| Regresión logística | Dicotómica (presente/ausente) | Continuas y dicotómicas | Rechazo (sí/no)Diabetes (sí/no) | Ln (P/1-P) = β0 + β1X1 + β2X2… + βiXi |
| Análisis de regresión de Cox (riesgos proporcionales) | Tiempo al evento (modelos de supervivencia) | Continuas y dicotómicas | Tiempo a la muerte.Tiempo al fallo del injerto | h(t) = h0(t)exp (β1X1 + β2X2… + βiXi) |
Donde β0 es el valor teórico de Y cuando Xi es igual a cero (intercept) y β1, β2… y βi son los coeficientes de regresión. Regresión logística, el valor de p es la probabilidad de respuesta y Xi son las variables predictoras y βi son los coeficientes de regresión. Análisis de regresión de Cox, donde la función de riesgo h(t) es dependiente o determinada por las covariables (X1, X2… Xi), cuyo impacto es estimado por el tamaño de los coeficientes de regresión (β1, β2…βi). El término h0 es la función de riesgo basal y es el valor del riesgo si todas las Xi son igual a cero.
El siguiente paso para desarrollar un modelo de regresión es establecer una apropiada estrategia de modelización acorde con el objetivo del estudio, teniendo en cuenta que debe haber, al menos, 10 eventos por cada factor de riesgo que queramos analizar17,18,40,46. Básicamente, estas estrategias son: 1) estrategia backward o «hacia detrás» (recomendada en estudios predictivos), introduciendo el máximo número de variables que interese analizar y quitando de una en una en función del menor grado de significación estadístico (mayor valor de p) o en función de que sean o no «confundentes» (objetivo estimativo); 2) estrategia forward o «hacia delante»: partiendo de una única variable (la de menor valor de p) se van introduciendo todas las demás variables hasta conseguir el modelo definitivo; 3) estrategia stepwise o «paso a paso»: es una modificación de la anterior para evitar que una estrategia «hacia delante» quede con variables no significativas, y 4) selección automática de variables mediante el método Least Absolute Shrinkage and Selection Operator (LASSO): es útil ante variables muy relacionados que tienen coeficientes de regresión muy grandes47. Asimismo, debemos testar la «confusión» y la «interacción» entre las variables para evitar imprecisiones en las estimaciones siempre que el objetivo del modelo sea estimativo. Hay confusión cuando la relación entre la variable en estudio y el pronóstico difiere (hazard ratio cambia > 10%) después de introducir otra variable. Existe interacción cuando la relación ente la variable en estudio y el pronóstico (muerte o fallo del injerto) varía acorde con los diferentes niveles de otra variable (p. ej., diabético vs. no diabético). Sin embargo, los modelos de regresión tienen puntos críticos que conducen a errores e imprecisiones en sus resultados. Brevemente, estos puntos críticos son: 1) asunción de la proporcionalidad del modelo a lo largo del tiempo, la cual debemos comprobar visualmente o buscando la interacción de la variable en estudio con el tiempo; 2) colinealidad entre variables muy relacionadas (p. ej., glucemia y HbA1c), que pudiera sobrestimar el modelo; 3) análisis y búsqueda de variables tiempo-dependientes (variables que varían con el tiempo o efectos diferentes con el tiempo); 4) riesgos competitivos ante eventos que compitan con el evento de interés (p. ej., Tx en el estudio de la mortalidad en lista de espera)36,39,42; 5) comprobar la bondad de ajuste; 6) manejo adecuado de los valores missing; 7) existencia de variables confusoras por indicación que permitirían una mayor probabilidad a la exposición (p. ej., ser diabético y recibir inhibidores de la enzima conversora de angiotensina) en los RE y EO; en este caso, se aplicarían análisis de propensión48-50; 8) análisis de la validación del modelo mediante la calibración (concordancia entre lo estimado y lo observado) y la discriminación (capacidad de distinguir entre pacientes de alto y bajo riesgo), y 9) aplicación de métodos «frecuentistas» a partir de cálculos de resultados observados y esperados frente a métodos bayesianos, los cuales emplean probabilidades basadas en asunciones previas al evaluar la trayectoria de los programas de Tx17,18,51,52. La tabla 5 muestra los puntos que deberíamos testar a modo de checklist para evitar errores en el desarrollo de los modelos de regresión y la valoración de la supervivencia a partir de los EO y RE.
Valoración de los puntos críticos (checklist) para realizar los análisis de regresión y la evaluación de la supervivencia
| 1. Descripción del objetivo del estudio2. Identificar las variables empleadas y mostrar un análisis estadístico descriptivo de las mismas3. Confirmar que se cumplen las asunciones (p. ej., proporcionalidad)4. Explicar el motivo de las censuras5. Proporcionar la probabilidad de supervivencia estimada con sus intervalos de confianza, el número de pacientes en riesgo y la mediana de supervivencia en cada grupo6. Especificar cómo fueron tratados los datos missing7. Mostrar la ecuación de regresión8. Reportar el nivel α usado en los análisis univariados9. Documentar la presencia de colinealidad, confusión e interacción10. Considerar la presencia de eventos competitivos o variables tiempo-dependientes | 11. Considerar el empleo de índices de propensión12. Definir la estrategia de modelación (forward, backward, etc.)13. Describir el coeficiente de regresión de cada variable, la hazard ratio, los intervalos de confianza y el valor de p14. Proporcionar la bondad de ajuste15. Especificar si el modelo fue validado y cómo fue validado16. Considerar mostrar los resultados gráficamente para los análisis de regresión lineal simple, curvas de Kaplan-Meier o análisis de Cox17. Especificar el paquete o programa estadístico utilizado |
En general, los RE científicos y epidemiológicos tienen la obligación de proporcionar información sobre la trayectoria de los programas de Tx y los datos de supervivencia, evitando controversias derivadas de publicaciones específicas de algunos programas25. Con estas premisas, los informes de RE de Tx pueden ser utilizados con garantías y credibilidad por agencias reguladoras, centros de Tx, compañías de seguros, asociaciones de pacientes e instituciones sanitarias. Todos los centros de Tx deberían emplear herramientas que facilitasen la valoración de la calidad sus propios programas de Tx y la mejoría en el rendimiento de los mismos. Recientemente, el SRTR americano ha incorporado métodos «bayesianos» basados en la probabilidad de eventos en lugar de los métodos «frecuentistas» para estimar las expectativas, la calidad y la evolución de los programas de Tx25. En esta línea, los RE pueden ser muy útiles para identificar si los programas de Tx que aceptan injertos de peor calidad (p. ej., Kidney Donor Profile Index [KDPI] > 80%) tienen peores resultados de supervivencia que aquellos que solo aceptan injertos de buena calidad. Un interesante estudio mostró que el uso de donantes con un KDPI elevado no aumentaba el riesgo de muerte ni de pérdida de injerto cuando se emplean apropiados modelos ajustados basados en métodos bayesianos53.
Por otra parte, la aplicación de medidas de calidad en los RE, basados en un concepto conocido en economía como benchmarking, puede también ayudar a identificar los mejores hospitales en procesos donación, utilizando indicadores o variables del propio proceso como describieron Matesanz et al.54. En esencia, el benchmarking representa un proceso de evaluación continuo y sistemático para analizar y comparar los procesos de una organización respecto a otras consideradas líderes, obteniendo la información necesaria para mejorar una práctica o actividad. Se trata, por tanto, de establecer una metodología estructurada de investigación para la identificación de mejores prácticas a partir de RE. Obviamente, este método de trabajo conlleva la necesidad de describir el proceso en el que se quiere aplicar dicha metodología, construir unos indicadores del resultado del proceso, identificar las unidades de estudio con mejores indicadores (referencias o benchmarks) e investigar y describir las prácticas que pueden justificar esos resultados de excelencia, favoreciendo posteriormente su implementación adaptada. Dada la buena experiencia en la aplicación del benchmarking en el proceso de donación en muerte encefálica en España, esta metodología puede ser de gran utilidad para reimpulsar otras actividades en los TOS, como el Tx con donante vivo.
Actualmente, el SRTR americano emplea también la herramienta de la suma acumulativa (CUSUM) para valorar el rendimiento y calidad de los programas de Tx55. Una descripción estadística detallada de este método está más allá del alcance de esta revisión, pero en esencia es un proceso estadístico que acumula datos en el tiempo a medida que el proceso se desarrolla, utilizando modelos ajustados de riesgo proporcionales de Cox y tasas observadas y esperadas. Este método puede identificar fluctuaciones de las tasas de eventos de un programa de Tx a lo largo del tiempo. Esto confirma la potencial variabilidad de los programas de Tx55.
El Tx se asocia a un incremento de la morbimortalidad con respecto a la población general de similar edad y sexo56. Por tanto, predecir la mortalidad y la comorbilidad puede ser crucial para establecer las medidas terapéuticas más apropiadas y prolongar la supervivencia en estos enfermos. En los pacientes con Tx se necesita la aplicación de IC que incluyan factores de riesgo comórbidos y medidas subordinadas de la supervivencia, para estimar con precisión la supervivencia y tomar las decisiones terapéuticas más acertadas18,24. Con estas premisas, se infiere que los EO y los grandes RE representan los pilares de los diferentes IC. Básicamente, esto lo consiguen por el importante número de pacientes que incluyen durante un largo periodo de seguimiento.
En general, el rendimiento predictivo de los IC que se apoyan en los RE o grandes bases de datos depende de varios factores: 1) las condiciones clínicas incluidas en el IC y sus pesos estadísticos relativos; 2) la distribución de las condiciones comórbidas en la población de estudio; 3) la variable final primaria (end-point) del estudio, y 4) la precisión de los datos recogidos57. Dado que la aplicación de IC utilizados en la población general (p. ej., puntuación de Framingham) subestiman el riesgo en los pacientes con Tx58,59 y que los factores clásicos de riesgo no explican bien la elevada mortalidad en esta población, un desarrollo apropiado de un IC en estos pacientes debería de incluir factores tradicionales y no tradicionales de riesgo cardiovascular, factores relacionados con el Tx, más indicadores de salud de la comunidad18. Durante los últimos años, se han elaborado diferentes índices pronósticos de mortalidad y comorbilidad en los pacientes con Tx60,61. Asimismo, se han desarrollado diferentes recursos electrónicos para predecir el riesgo en estos pacientes derivado de estos IC62 (p. ej., www.transplantscore.com, www.transplantmodels.com, www.renalmed.co.uk/risk-calculator). Algunos de estos índices se basan en scores de riesgo aplicados a población general63-66, mientras que otros también incluyen variables de riesgo pre-Tx y post-Tx61. En general, todos estos IC predicen con precisión el riesgo de muerte o de aparición de comorbilidades. La mayoría han sido validados internamente usando principalmente datos de RE y otros han sido validados externamente en estudios prospectivos. En este sentido, la creación de PSE para el desarrollo de modelos de riesgo, usando datos de RE nacionales, podría ayudar a los equipos de Tx y facilitar las comparaciones internacionales para mejorar los resultados del Tx17. Con todo, muy pocos modelos han evaluado exclusivamente la supervivencia en pacientes de edad avanzada65,67-74. Como consecuencia, actualmente no hay consenso sobre la predicción de la mortalidad en receptores de Tx de edad avanzada. Mientras tanto, los médicos de Tx deben implementar el modelo de riesgo más útil de acuerdo con su propio centro de Tx o características de los pacientes.
Conceptos clave- •
Los RE científicos de Tx son muy útiles porque nos permiten identificar factores de riesgo en esta población y facilitan contrastar la información con otros RE nacionales e internacionales, pudiendo contribuir a establecer estrategias que mejoren los resultados en términos de supervivencia.
- •
Los RE científicos se complementan con los EC incrementando el nivel de evidencia científica para mejorar el rendimiento de nuestras decisiones clínicas.
- •
Los RE científicos en Tx constituyen un sistema organizado y planificado que utiliza métodos observacionales y PSE, incluyendo modelos ajustados de riesgo, con la intención de evaluar resultados de supervivencia.
- •
Los RE científicos en Tx necesitan inexcusablemente análisis estadísticos adecuados y potentes en aras de generar datos clínicos fehacientes y optimizar el pronóstico de la población trasplantada.
- •
A partir de RE científicos en Tx, se puede estimar la calidad y la trayectoria de los programas de Tx y generar IC, lo cual pudiera optimizar los resultados del Tx.
Este estudio fue financiado en parte por el Ministerio de Economía, Industria y Competitividad de España del Instituto de Salud Carlos III (FIS ICI14/00016 y FIS PI17/02043), cofinanciado por el Fondo Europeo de Desarrollo Regional-FEDER, RETICS (REDINREN, RD16/0009, RD16/0009/0006, RD16/0009/0021).
Conflicto de interesesLos autores declaran que no tienen conflictos de interés relacionados con los contenidos de este artículo.