Las consecuencias a largo plazo asociadas con la donación renal resultan controvertidas. La tasa de filtración glomerular (TFG) pre y posdonación resulta determinante en la ponderación del riesgo renal y cardiovascular. En Latinoamérica, existe escasa experiencia sobre la evaluación de la función renal por técnicas de medición del filtrado glomerular en donantes renales. Las ecuaciones MDRD y la CKD-EPI son consideradas alternativas razonables. El objetivo del trabajo fue evaluar el rendimiento de las ecuaciones MDRD y CKD-EPI en la dinámica del filtrado glomerular posnefrectomía en donantes renales.
Materiales y métodosEstudio prospectivo de cohorte con medición (mTFG) y estimación de la tasa de filtrado glomerular (eTFG) en 189 donantes renales con nefrectomía entre 2007 y 2016 en el Hospital Privado Universitario de Córdoba, Argentina. Las TFG se evaluaron, previo y posterior a la nefrectomía, mediante el aclaramiento de iotalamato determinado por cromatografía líquida de alta eficacia y por las ecuaciones para estimación de TFG: MDRD y CKD-EPI. Se constituyeron 2grupos de estudio: grupo 1 (n=107) con un tiempo de evaluación posterior a la estabilización de la TFG posdonación (3 meses) hasta los 5 años y grupo 2 (n=82) con un tiempo entre 5 y 10 años posdonación.
ResultadosEl valor de compensación renal fue del 61,9% (52,0-71,1%) y 75,6% (64,9-84,4%) para los grupos 1 (n=107) y 2 (n=82), respectivamente. La ecuación MDRD subestimó la TFG en el 3,2% (90ml/min/1,73 m2) y el 38,6% (60ml/min/1,73 m2) respecto a la mTFG y la CKD-EPI subestimó en un 2,6% (90ml/min/1,73 m2) y un 13,8% (60ml/min/1,73 m2). Se evaluó el rendimiento diagnóstico con curva ROC (mTFG<60ml/min/1,73 m2) para MDRD (ABC=0,66, IC: 0,59-0,73), sensibilidad: 98,7% y especificidad: 63,3%, y para CKD-EPI (ABC=0,79, IC: 0,73-0,85), sensibilidad: 96,9% y especificidad: 76,4%. Las eTFG mostraron un bajo desempeño para estimar el filtrado en el seguimiento posnefrectomía de los donantes mayores de 50 años.
ConclusionesLas ecuaciones de estimación de la TFG muestran un bajo desempeño para el seguimiento a largo plazo del filtrado posnefrectomía y la medición del filtrado sería recomendable en la selección como en el seguimiento de ciertos donantes bajo los criterios actuales de selección.
Long-term consequences associated with kidney donation are controversial. Pre- and post-donation glomerular filtration rates (GFRs) are determinants of renal and cardiovascular risk weighting. In Latin America, there is limited experience in evaluating kidney function using GFR measurement techniques in kidney donors. The MDRD 4-variable and CKD-EPI equations are considered reasonable options. The objective of this study was to evaluate the performance of the MDRD and CKD-EPI equations in post-nephrectomy GFR dynamics in kidney donors.
Materials and methodsA prospective cohort study with GFR measurement and estimation in 189 kidney donors who underwent nephrectomy between 2007 and 2016 at the Hospital Privado Universitario de Córdoba [Private University Hospital of Córdoba] in Córdoba, Argentina. GFRs were evaluated before and after nephrectomy by iothalamate clearance determined by HPLC and by the MDRD and CKD-EPI equations for estimating GFR. Two groups were formed for this study: Group 1 (n=107), with an evaluation time subsequent to GFR stabilization (3 months) of up to 5 years, and Group 2 (n=82), with an evaluation time of 5-10 years following donation. Measured GFR (mGFR) was assessed by iothalamate clearance determined by HPLC.
ResultsRenal compensation values were 61.9% (52.0%-71.1%) and 75.6% (64.9%-84.4%) for Group 1 (n=107) and Group 2 (n=82), respectively. MDRD underestimated the GFR in 3.2% (90ml/min/1.73m2) and 38.6% (60ml/min/1.73m2) compared to the mGFR, and CKD-EPI underestimated the GFR in 2.6% (90ml/min/1.73 m2) and 13.8% (60ml/min/1.73 m2). Diagnostic performance was evaluated with a ROC curve (mGFR<60ml/min/1.73 m2) for MDRD (ABC=0.66; CI: 0.59-0.73; sensitivity: 98.7%; specificity: 63.3%) and for CKD-EPI (ABC=0.79 CI: 0.73-0.85; sensitivity: 96.9%; specificity: 76.4%. Estimated GFR (eGFR) showed poor performance for estimating the glomerular filtration rate in the post-nephrectomy follow-up of donors over 50 years of age.
ConclusionsEquations for estimating GFRs showed poor performance for long-term follow-up of post-nephrectomy GFRs. Measuring GFRs to determine kidney function is recommended in the screening and follow-up of some donors under the current selection criteria.
Las consecuencias de la donación renal en términos de morbimortalidad a largo plazo son controvertidas1,2. Mientras que ciertos estudios descartan un riesgo significativo de enfermedad renal crónica o de muerte comparados con población general3,4, otros reportan un incremento en el riesgo renal y cardiovascular5,6.
Debido a la escasez de órganos, los criterios de selección de los potenciales donantes se han flexibilizado en la mayoría de los programas de trasplante, generando una mayor proporción de candidatos marginales con un número creciente de comorbilidades7,8. Esta situación podría crear como resultado una pérdida acelerada de la función renal posdonación.
Aunque históricamente el riesgo absoluto de enfermedad renal terminal posdonación ha sido bajo (0,31-0,47%), existen comorbilidades en los donantes marginales, tales como albuminuria, hipertensión arterial y obesidad9,10, que podrían cambiar este paradigma.
Es por ello que una evaluación precisa de la función renal predonación y el seguimiento de la misma posnefrectomía son esenciales para identificar los donantes de riesgo con el objetivo de implementar estrategias de prevención y seguimiento.
La tasa de filtración glomerular medida (mTFG) usando un marcador exógeno es considerado el método óptimo para medir función renal11. Sin embargo, su complejidad y costos limitan la disponibilidad de esta técnica en la mayoría de los centros de trasplante12.
Alternativamente, las ecuaciones para estimar la TFG (eTFG), incluida la ecuación Modification of Diet in Renal Disease (MDRD)13 y la ecuación de la Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI)14, son consideradas alternativas razonables15.
Sin embargo, las ecuaciones han sido diseñadas y validadas en poblaciones con enfermedad renal crónica, proporcionando una subestimación de TFG en el rango más alto16,17.
El aclaramiento de creatinina también puede ser de utilidad, pero generalmente muestra una gran variabilidad18.
Dentro de las limitaciones de la fórmula MDRD, se encuentra una baja correlación con la mTFG con valores superiores a 60ml/min/1,73 m2. La fórmula CKD-EPI se validó a partir de una cohorte que, a diferencia de MDRD, además de pacientes con función renal reducida incorpora a individuos con función renal normal, con lo que proporciona una mejor correlación con la mTFG en sujetos sanos19,20.
En Latinoamérica, existe escasa experiencia sobre la evaluación de la función renal por técnicas de medición del filtrado glomerular de los donantes renales como criterio de aceptación o en el seguimiento del filtrado posnefrectomía.
El objetivo del trabajo fue evaluar en donantes renales, el rendimiento a largo plazo de las ecuaciones MDRD y CKD-EPI para el estudio de la dinámica del filtrado glomerular posnefrectomía.
Materiales y métodosDiseño del estudioSe realizó un estudio prospectivo de cohorte con mediciones y estimaciones repetidas de la TFG en 189 donantes renales, todos mayores de 18 años, a los que se realizó una nefrectomía entre los años 2007 y 2016 en el Hospital Privado Universitario de Córdoba, Argentina. Se incluyó a todos los donantes con al menos una medición predonación de la TFG y a quienes se les realizó una nueva medición de la TFG posterior a la nefrectomía, ambas mediciones realizadas mediante aclaramiento de iotalamato, en los años 2017 y 2018. Todos los participantes firmaron un consentimiento informado para este estudio.
Se excluyó a aquellos donantes alérgicos al yodo o al contraste empleado (iotalamato de meglumina), con evidencia comprobada de una infección urinaria o sistémica de cualquier origen al momento de la realización del estudio, en tratamiento con diuréticos, antiinflamatorios no esteroides o trimetroprim-sulfametoxazol, o donantes renales que se encontraban con enfermedades cardiovasculares descompensadas, deshidratación o con los procesos infecciosos antes mencionados, que afectaban la TFG en el momento de la realización del aclaramiento.
La medición de la TFG se realizó con iotalamato determinado por HPLC y su valor fue utilizado como criterio de aceptación para la donación. Una nueva medición se realizó posterior a la donación renal a diferentes tiempos respecto a la predonación. El estudio fue aprobado por el comité de ética institucional (CIEIS). Todos los procedimientos fueron realizados de acuerdo con las Declaraciones de Helsinki y Estambul. En todas las visitas, se recopilaron datos de altura, peso e índice de masa corporal (IMC).
Medición de la función renalMedición del aclaramiento de IotalamatoEl aclaramiento de iotalamato se realizó a aquellos donantes que cumplieron con las condiciones previstas en el protocolo. El estudio se realizó en condiciones de ayuno y sin toma de fármacos.
Inicialmente, se procedió con el vaciamiento de la vejiga y el descarte de la orina; luego se procedió con la administración subcutánea de 1ml de iotalamato de meglumina (Conray® [Mallinckrodt Inc. Blanchardstown, Dublín, Irlanda] 60%). Se aguardó un período de equilibrio de 60 min y se tomó la primera muestra de sangre. El donante permaneció en reposo, manteniendo hidratación oral de 150ml de agua cada 15 min, hasta un nuevo vaciamiento vesical. Se recolectó todo el volumen de orina a las 2 h posterior a la administración del iotalamato con la segunda toma muestra de sangre.
La medición filtrado glomerular se realizó mediante aclaramiento renal de iotalamato no radiomarcado determinado por cromatografía liquida de alta eficacia. El instrumento utilizado fue un HPLC Gilson® (Middleton, WI, EE. UU.) con detector UV/Visible Modelo 189. La columna Phenomenex® (Torrance, CA, EE. UU.) de C18, 20×4,5mm. Las muestras de plasma se recolectaron con heparina de litio como anticoagulante y las muestras de orina se obtuvieron en frascos estériles. El aclaramiento fue calculado como U×V/P, donde U es la concentración de iotalamato determinado en orina, P es la concentración de iotalamato determinado en plasma, V=volumen (ml) ajustado por tiempo e IMC11,21.
Cálculo de la tasa de filtrado glomerular estimadaSe utilizó la fórmula MDRD abreviada (MDRD-4)13, con creatinina estandarizada por espectrometría de masa dilución isotópica (ID-MS). Se utilizó CKD-EPI según género y estratificación por niveles de creatinina14. La concentración de creatinina en suero se realizó por técnica de Jaffé cinético compensado trazable al método de referencia ID-MS en los autoanalizadores MODULAR P® (Roche, Mannheim, Alemania) y COBAS 6000® (Roche, Mannheim, Alemania). Los reactivos y los calibradores utilizados fueron de Roche y los controles de calidad internos fueron de RANDOX® ACUSERA (Randox Laboratories Ltd. County Antrim, Reino Unido) y el control externo utilizado fue RIQAS (Reino Unido).
Análisis estadísticosLas variables continuas se expresaron como medias con su intervalo de confianza del 95% o como mediana con su percentil 25-75 (p25-p75), dependiendo del tipo de distribución. Las variables cualitativas en porcentajes con sus IC del 95%.
El test de estudio normalidad de las variables cuantitativas ha sido la prueba de Kolmogorov-Smirnov. Para las comparaciones entre los diferentes grupos de las variables cuantitativas independientes se han utilizado como pruebas no paramétricas, el test de Kruskal-Wallis (> 2 muestras) y el test de Wilcoxon como prueba no paramétrica para el análisis de 2 muestras relacionadas. Para evaluar la concordancia entre 2sistemas de medida se realizó el propuesto por Bland-Altman. Se construyeron curvas receiver operating characteristic (ROC) a partir de las cuales se obtuvieron diferentes parámetros diagnósticos, como el área bajo la curva (ABC) de cada eTFG para la detección de un mTFG menor de 60ml/min/1,73 m2. Los IC se expresaron con un 95%. El nivel de significación fue del 95% (p<0,05).
La compensación renal fue definida como el porcentaje de la TFG alcanzada por el riñón remanente en comparación de la TFG basal evaluada previa a la nefrectomía.
Se calculó el porcentaje de donantes cuya TFG posnefrectomía, estimada por las ecuaciones MDRD y CKD-EPI, subestimaban el valor del filtrado al compararlas con la TFG medida por aclaramiento de iotalamato. Los valores estudiados fueron 60 y 90ml/min/1,73 m2.
Para la realización del estudio estadístico se ha utilizado el paquete estadístico IBM SPSS® Statistics versión 19 (Armonk, Nueva York, EE. UU.).
ResultadosLas características demográficas, antropométricas y la funcionalidad renal de la cohorte predonación se muestran en la tabla 1. Se estudió en un subgrupo de donantes la dinámica de la estabilización de filtrado glomerular posnefrectomía. Se observó una estabilización del mismo a partir de los 3 meses posnefrectomía (resultados no mostrados).
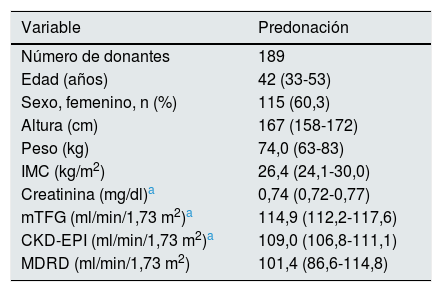
Características demográficas y parámetros de función renal de los donantes predonación
| Variable | Predonación |
|---|---|
| Número de donantes | 189 |
| Edad (años) | 42 (33-53) |
| Sexo, femenino, n (%) | 115 (60,3) |
| Altura (cm) | 167 (158-172) |
| Peso (kg) | 74,0 (63-83) |
| IMC (kg/m2) | 26,4 (24,1-30,0) |
| Creatinina (mg/dl)a | 0,74 (0,72-0,77) |
| mTFG (ml/min/1,73 m2)a | 114,9 (112,2-117,6) |
| CKD-EPI (ml/min/1,73 m2)a | 109,0 (106,8-111,1) |
| MDRD (ml/min/1,73 m2) | 101,4 (86,6-114,8) |
Las variables cuantitativas se expresaron como mediana p(25,75).
CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; IMC: índice de masa corporal; MDRD: Modification of Diet in Renal Disease; mTFG: tasa de filtrado glomerular medido.
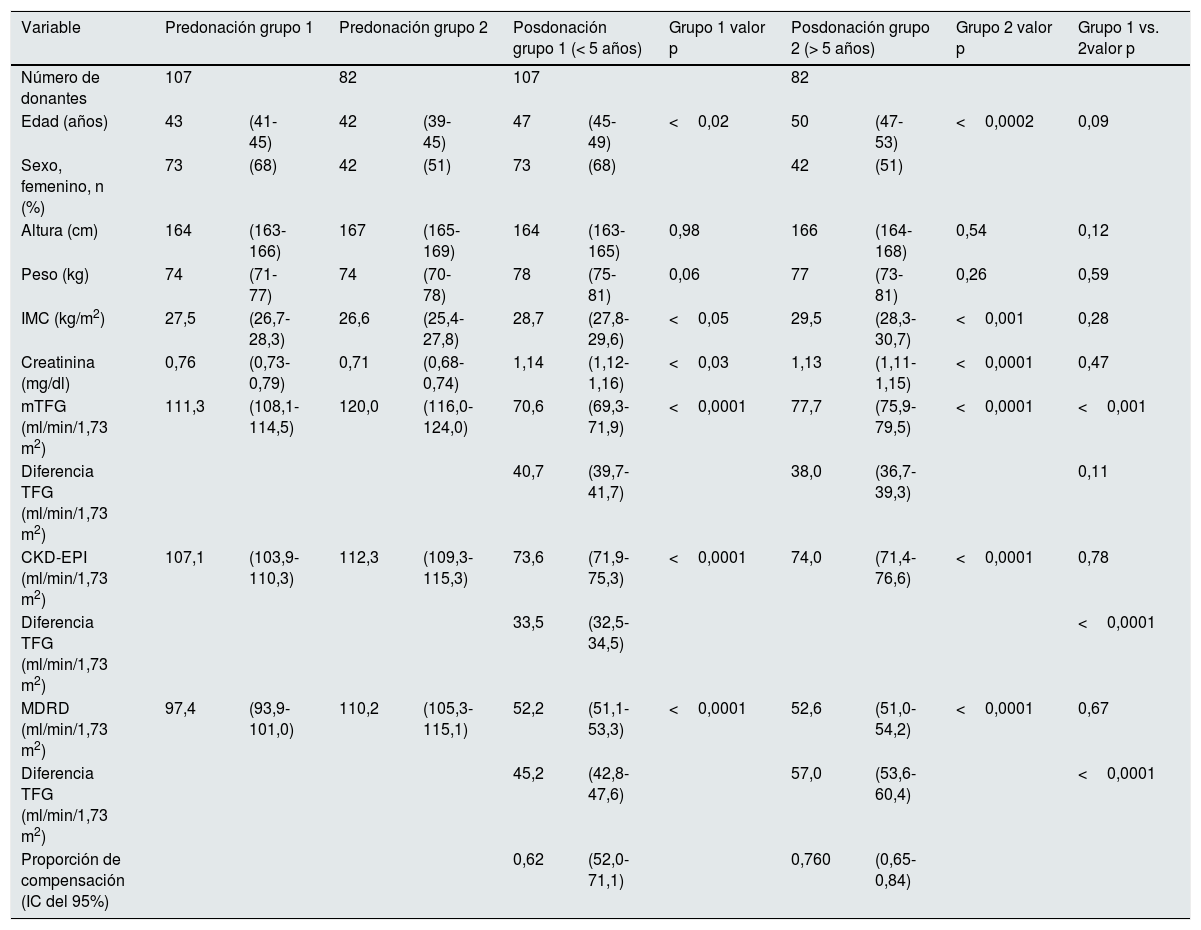
En la tabla 2 se muestran los valores demográficos y función renal. Se establecieron 2 grupos considerando el tiempo de evaluación de la TFG posdonación. Grupo 1 (n=107), con un tiempo de evaluación entre los 3 meses, periodo observado para la estabilización de la TFG posdonación hasta los 5 años y grupo 2 (n=82) con un tiempo entre 5 y 10 años posdonación. Se observó una diferencia estadísticamente significativa en todos los parámetros pre y posdonación, tanto en el grupo 1 como en el grupo 2, a excepción de peso y altura. Los grupos estudiados no mostraron diferencias en la evolución de la creatinina a largo plazo respecto al corto plazo (grupo hasta 5 años y más de 5 años, p=0,47). El valor de compensación renal de ambos grupos fue del 61,9% (52,0-71,1%) y 75,6% (64,9-84,4%) para los grupos 1 y 2, respectivamente.
Características demográficas y parámetros de función renal según el tiempo de seguimiento posnefrectomía
| Variable | Predonación grupo 1 | Predonación grupo 2 | Posdonación grupo 1 (< 5 años) | Grupo 1 valor p | Posdonación grupo 2 (> 5 años) | Grupo 2 valor p | Grupo 1 vs. 2valor p | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Número de donantes | 107 | 82 | 107 | 82 | |||||||
| Edad (años) | 43 | (41-45) | 42 | (39-45) | 47 | (45-49) | <0,02 | 50 | (47-53) | <0,0002 | 0,09 |
| Sexo, femenino, n (%) | 73 | (68) | 42 | (51) | 73 | (68) | 42 | (51) | |||
| Altura (cm) | 164 | (163-166) | 167 | (165-169) | 164 | (163-165) | 0,98 | 166 | (164-168) | 0,54 | 0,12 |
| Peso (kg) | 74 | (71-77) | 74 | (70-78) | 78 | (75-81) | 0,06 | 77 | (73-81) | 0,26 | 0,59 |
| IMC (kg/m2) | 27,5 | (26,7-28,3) | 26,6 | (25,4-27,8) | 28,7 | (27,8-29,6) | <0,05 | 29,5 | (28,3-30,7) | <0,001 | 0,28 |
| Creatinina (mg/dl) | 0,76 | (0,73-0,79) | 0,71 | (0,68-0,74) | 1,14 | (1,12-1,16) | <0,03 | 1,13 | (1,11-1,15) | <0,0001 | 0,47 |
| mTFG (ml/min/1,73 m2) | 111,3 | (108,1-114,5) | 120,0 | (116,0-124,0) | 70,6 | (69,3-71,9) | <0,0001 | 77,7 | (75,9-79,5) | <0,0001 | <0,001 |
| Diferencia TFG (ml/min/1,73 m2) | 40,7 | (39,7-41,7) | 38,0 | (36,7-39,3) | 0,11 | ||||||
| CKD-EPI (ml/min/1,73 m2) | 107,1 | (103,9-110,3) | 112,3 | (109,3-115,3) | 73,6 | (71,9-75,3) | <0,0001 | 74,0 | (71,4-76,6) | <0,0001 | 0,78 |
| Diferencia TFG (ml/min/1,73 m2) | 33,5 | (32,5-34,5) | <0,0001 | ||||||||
| MDRD (ml/min/1,73 m2) | 97,4 | (93,9-101,0) | 110,2 | (105,3-115,1) | 52,2 | (51,1-53,3) | <0,0001 | 52,6 | (51,0-54,2) | <0,0001 | 0,67 |
| Diferencia TFG (ml/min/1,73 m2) | 45,2 | (42,8-47,6) | 57,0 | (53,6-60,4) | <0,0001 | ||||||
| Proporción de compensación (IC del 95%) | 0,62 | (52,0-71,1) | 0,760 | (0,65-0,84) | |||||||
Las variables cuantitativas se expresaron como media (intervalo de confianza [IC] del 95%).
CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; IMC: índice de masa corporal; MDRD: Modification of Diet in Renal Disease; mTFG: tasa de filtrado glomerular medido.
Se compararon los grupos posdonación entre sí, donde se observó una diferencia estadísticamente significativa solamente en la TFG medida (p<0,001).
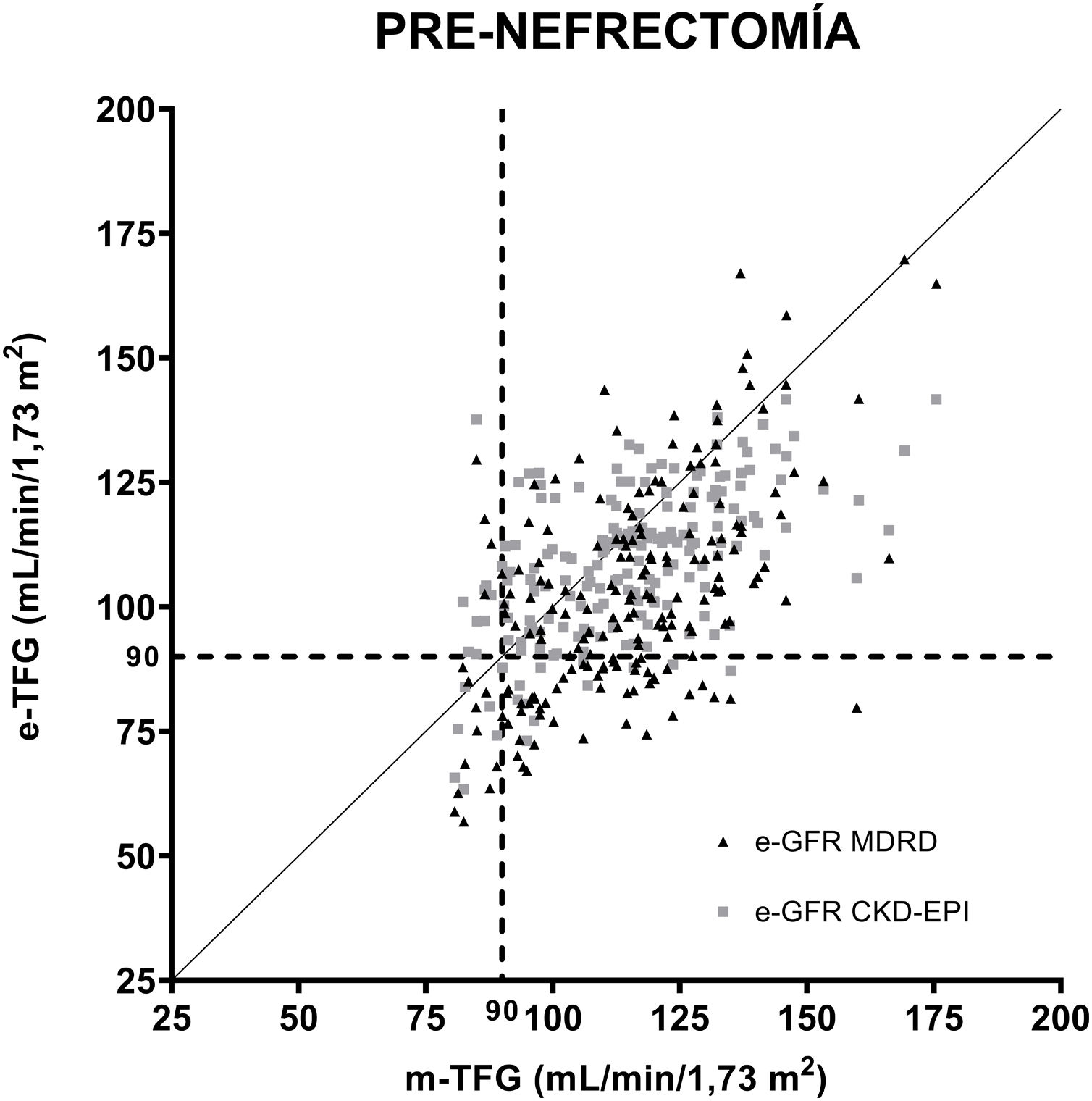
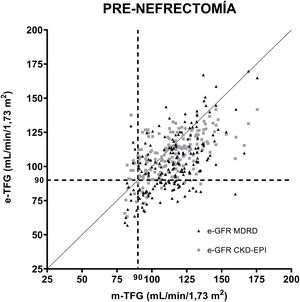
En la figura 1 se muestran las correlaciones entre las TFG estimadas por las ecuaciones MDRD y CKD-EPI en relación con las medidas por aclaramiento de iotalamato previas a la nefrectomía. Se definió como referencia el valor de 90ml/min/1,73 m2. Se analizaron las regresiones para ambas fórmulas, la ecuación resultante para MDRD fue y=0,6608 X+26,52, r: 0,53 p<0,001, y la ecuación para CKD-EPI fue y=0,4702 X+54,69, r: 0,58 p<0,001.
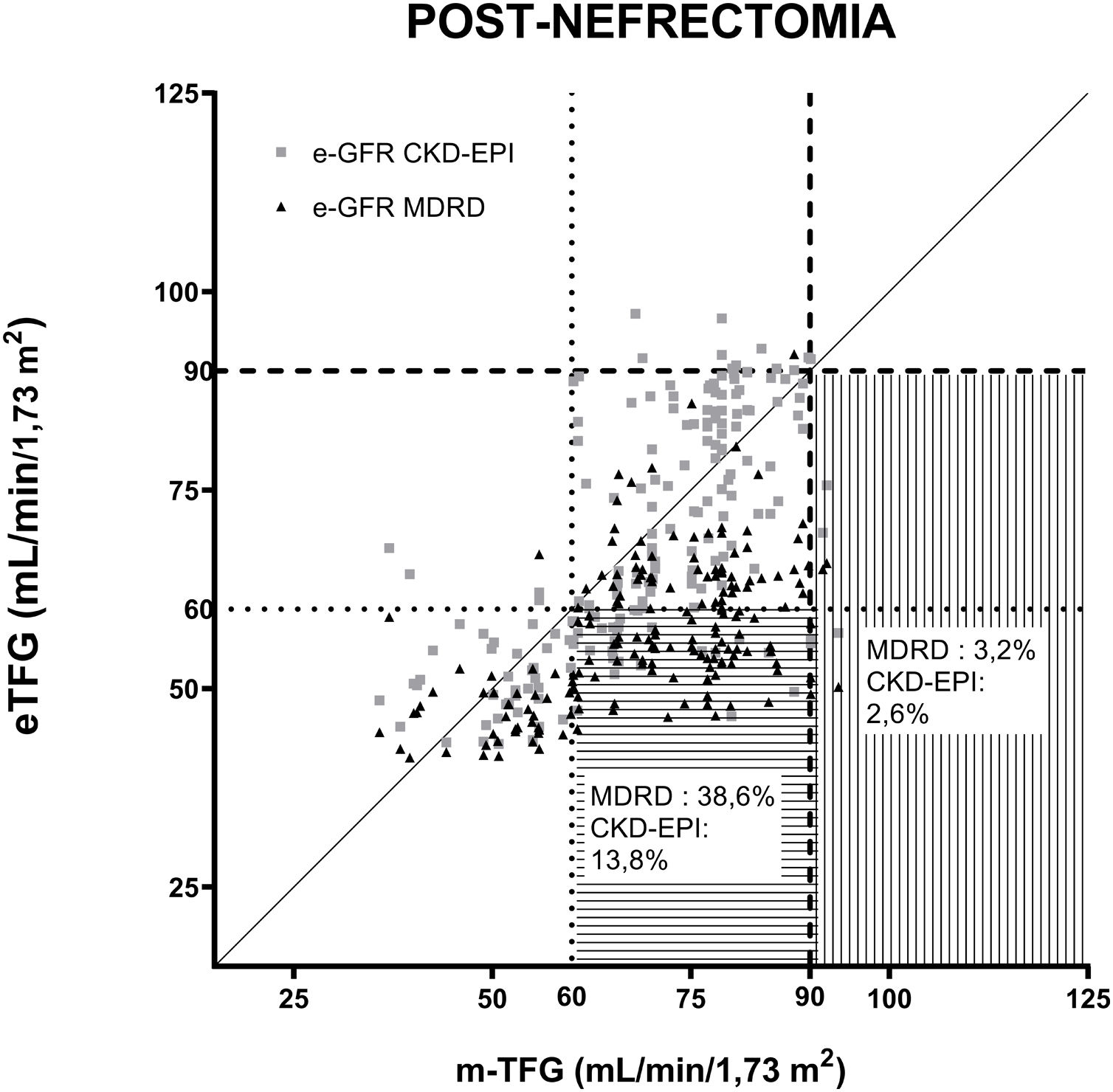
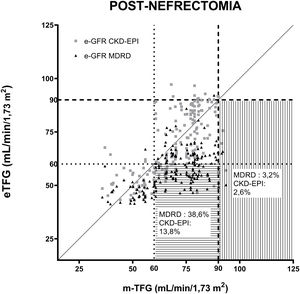
La figura 2 muestra el TFG estimado por las ecuaciones MDRD y CKD-EPI respecto a la TFG medida por aclaramiento de iotalamato posnefrectomía, estableciéndose 2valores de TFG: 60ml/min/1,73 m2 y 90ml/min/1,73 m2 considerados de referencia.
Correlación de las ecuaciones para estimar la TFG (MDRD y CKD-EPI) posterior a la uninefrectomía. Las ecuaciones comparadas con aclaramiento de iotalamato. En (----) se indica el valor de TFG 90ml/min/1,73 m2 y en (….) se indica el valor de TFG 60ml/min/1,73 m2. En líneas horizontales se grafica el área donde se hallan las TFG subestimadas con relación a 60ml/min/1,73 m2 y en líneas verticales, las TFG subestimadas con relación a 90ml/min/1,73 m2.
Se determinó el porcentaje de donantes cuya TFG posnefrectomía determinada por cada ecuación subestimaba su valor al ser comparada con la mTFG de referencia 60 y 90ml/min/1,73 m2. La ecuación MDRD subestimó las TFG del 3,2 y el 38,6% de los donantes comparados con la mTFG mayor de 90 y 60ml/min/1,73 m2, mientras que la CKD-EPI mostró que el 2,6 y el 13,8% de las eTFG subestimaban evaluando mTFG superiores a 90 y 60ml/min/1,73 m2, respectivamente.
Se determinó el rendimiento diagnóstico utilizando el área bajo la curva ROC para cada eTFG en la evaluación posnefrectomía de los donantes: MDRD (ABC=0,66, IC: 0,59-0,73), sensibilidad 98,7%, especificidad 63,3% y CKD-EPI (ABC=0,79, IC: 0,73-0,85), sensibilidad 96,9% y especificidad 76,4%, considerando como referencia la TFG de 60ml/min/1,73 m2.
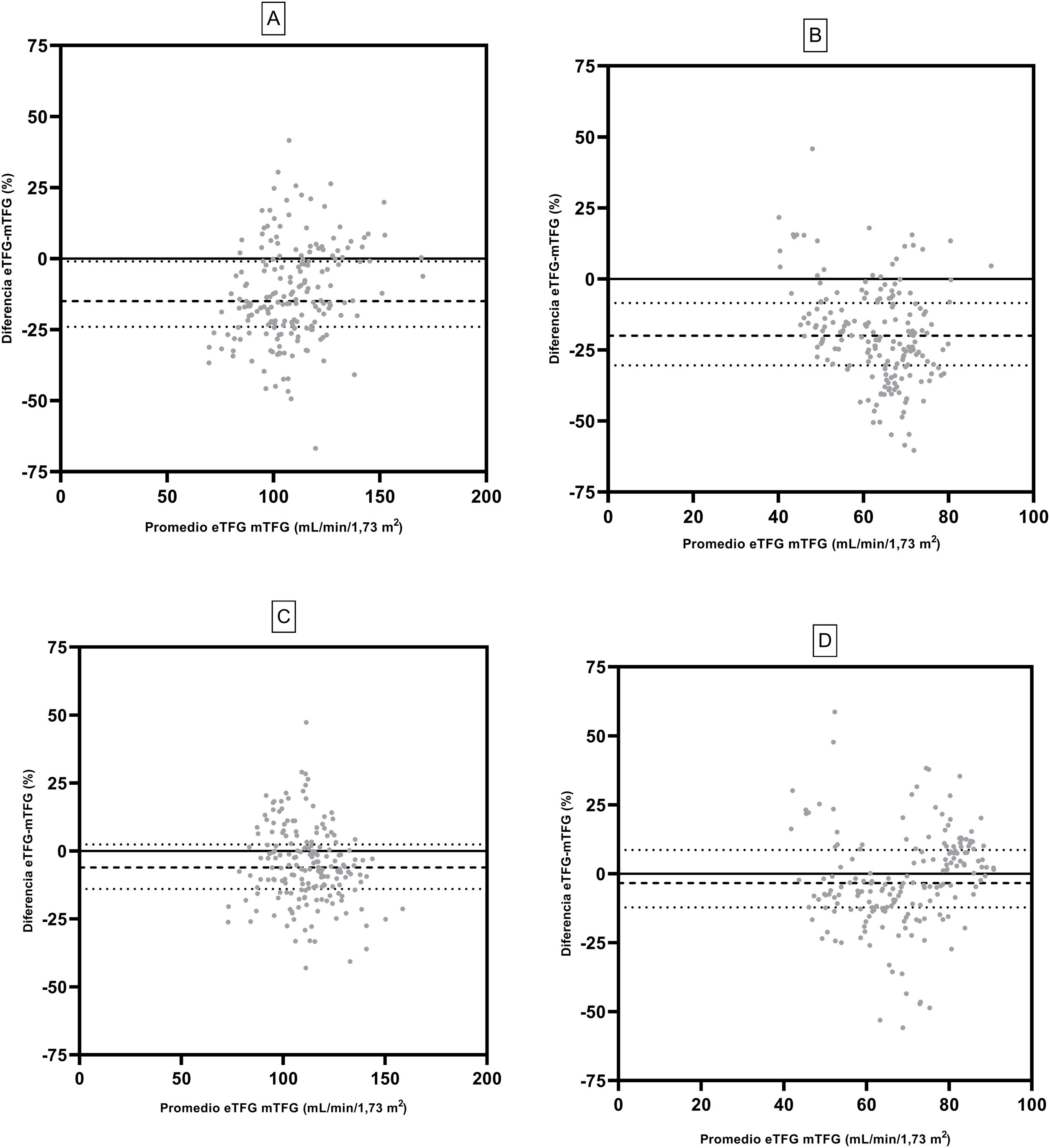
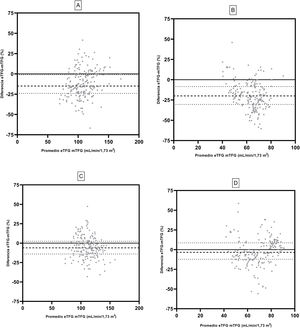
En la figura 3 se muestra la concordancia de la TFG estimada pre y posdonación mediante el test de Bland-Altman. La ecuación MDRD mostró un sesgo previo de donación de –15,0 (IC: –24,0; –0,2) ml/min/1,73 m2 y posterior a la donación de –20,5 (–30,4; –08,5) ml/min/1,73 m2. La ecuación CKD-EPI mostró un sesgo de –6,1 (–14,0; 2,4) ml/min/1,73 m2 y –3,4 (–12,1; 8,6) ml/min/1,73 m2, en TFG previa y posterior a la nefrectomía.
Bland-Altman de ambas ecuaciones de la TFG. Se muestra la ecuación MDRD predonación (A) y MDRD postdonación renal (B). CKD-EPI predonación (C) y CKD EPI posdonación (D). La medición de la TFG se determinó utilizando el aclaramiento de iotalamato. Líneas (- - -) indican mediana y líneas (….) indican percentiles 25 y 75 del sesgo.
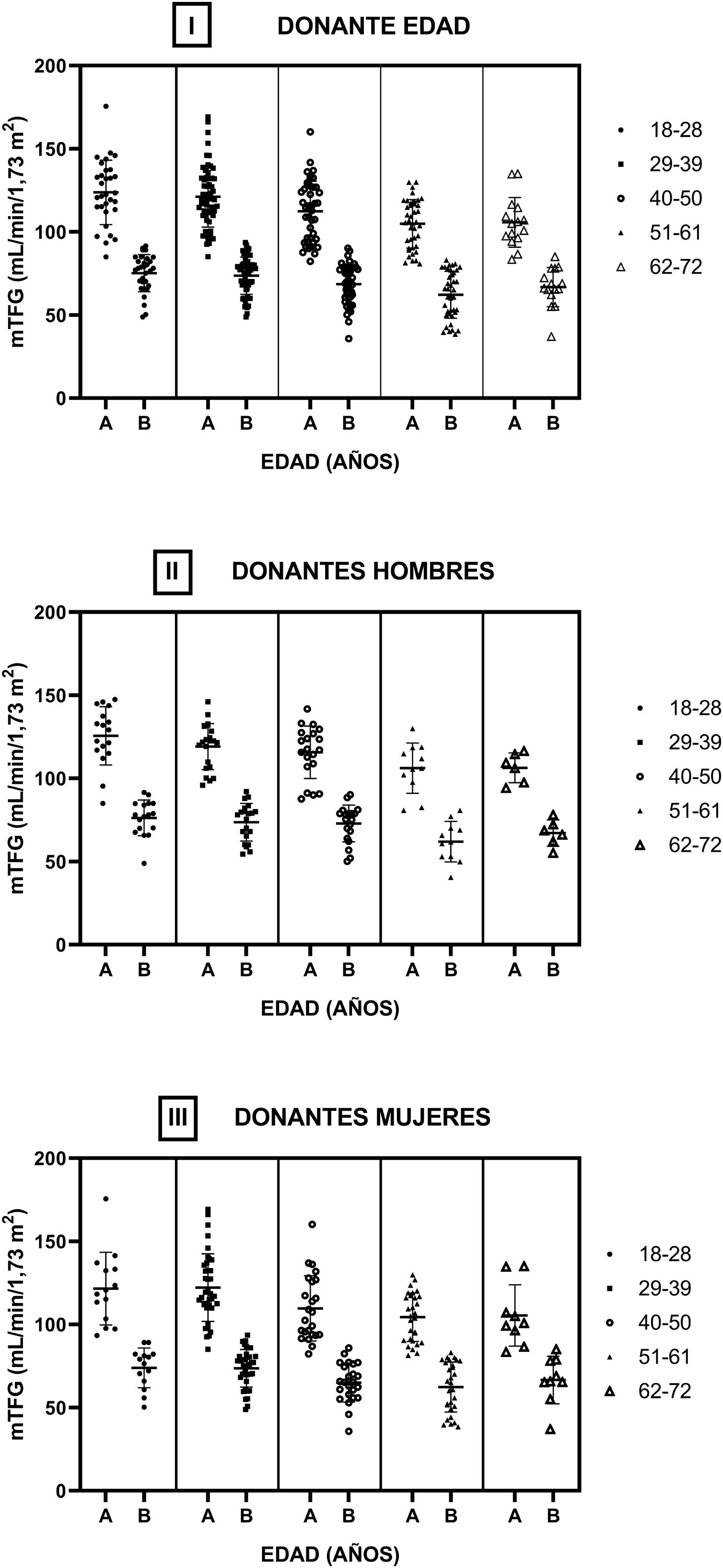
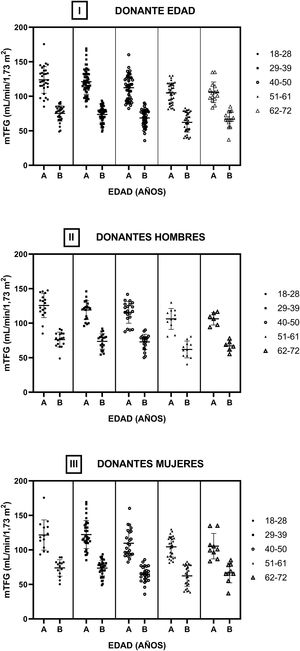
En la figura 4 se muestran las TFG de los donantes pre y posnefrectomía según los diferentes grupos etarios (i). No se encontraron diferencias estadísticamente significativas entre las TFG intragrupo (antes y después de la nefrectomía) y entre los diferentes grupos etarios considerando los TFG previos entre sí y los TFG posnefrectomía. Se dividió la cohorte en hombres (ii) y mujeres (iii), realizando la misma estructura de análisis que en la cohorte completa. No se encontraron diferencias estadísticamente significativas entre las TFG en las mismas condiciones en las que se comparó la muestra completa.
Filtrado glomerular medido por aclaramiento de iotalamato por rango etario. Se dividió la cohorte en 5 subgrupos y en cada uno se muestran las TFG previas (A) y posterior (B) a la nefrectomía. En i se observa toda la cohorte de donantes renales. En ii y iii se muestra el subgrupo de hombres y mujeres, respectivamente.
Los estudios previos que han comparado la ecuación MDRD y CKD-EPI con métodos de medición de la TFG para la evaluación de la función renal en la selección de donantes han hallado resultados diferentes22. Las ecuaciones mostraron subestimaciones respecto a la mTFG y presentaron precisión escasa. El rendimiento de las ecuaciones implicaba porcentajes altos de potenciales donantes que se rechazarían sin la medición de filtrado glomerular por técnicas directas. De la misma forma, se observaron donantes que podrían ser aceptados erróneamente con la utilización de las ecuaciones21,23. Por lo tanto, la estimación de la TFG con MDRD y CKD-EPI en candidatos a donación renal proporciona como resultado tanto rechazo de candidatos adecuados con falsamente baja TFG como la aceptación de candidatos inadecuados con supuestamente elevada TFG.
Se considera recomendable el uso de un método medido, ya que la aproximación (correlación y el porcentaje de error) de la eTFG por ecuaciones a la TFG medida es escasa24. A pesar de su importancia, no existe un consenso sobre el límite de la TFG permitida para someter a un donante a nefrectomía y por lo cual evidencia la necesidad de una evaluación más exhaustiva de la TFG en la selección de los mismos.
El presente estudio evaluó el comportamiento de la función renal y el rendimiento de diferentes métodos de medición y estimación de la misma en una cohorte de donantes renales. Los valores de compensación observados posnefrectomía variaron entre el 62 y el 76% entre los 3 meses y 10 años posnefrectomía.
Varios estudios han analizado la recuperación de la función renal posdonación; en todos ellos se relaciona el incremento del volumen renal con la compensación de la TFG25-27. Diferentes reportes han detallado el proceso a través del cual el riñón remanente aumenta su TFG tras la donación25. En el donante renal vivo, inmediatamente tras la nefrectomía se incrementa el flujo renal, de manera que, a pesar de una pérdida de la mitad de la masa renal funcional, la TFG alcanza el 70% de la función renal previa. Existen estudios que evaluaron los factores preexistentes asociados a la recuperación de la función renal, coincidiendo que una mayor TFG basal predice una mejor función renal al año de la donación9,28,29.
Se evaluó el rendimiento de las ecuaciones para la estimación de la TFG posnefrectomía luego de su estabilización; tanto MDRD como CKD-EPI subestimaron la TFG posdonación, particularmente con filtrados entre 60-90ml/min/1,73 m2.
Varios estudios han evaluado estas ecuaciones como herramientas para selección de donantes, mientras que pocos estudiaron las mismas, posterior a la donación.
En este escenario fue donde observamos el mayor efecto de subestimación, particularmente con MDRD, la cual clasificó erróneamente el 38,6% de los donantes posnefrectomía con TFG mayores de 60ml/min/1,73 m2. El área bajo la curva ROC de la MDRD, para un mTFG<60ml/min/1,73 m2 fue un valor bajo (0,66) por su pobre especificidad diagnóstica, que puede provocar una incorrecta evaluación de las TFG en los donantes renales posnefrectomía.
En el presente estudio reportamos sesgos por parte de la MDRD y la CKD-EPI, coincidentes con otros trabajos publicados19,22,30, observándose un incremento del sesgo de MDRD cuando es aplicada posnefrectomía (–19,5ml/min/1,73 m2).
Evaluamos la distribución de los valores estimados y medidos de la TFG considerando el rango etario del donante. En ambas ecuaciones aplicadas a diferentes rangos etarios observamos falta de concordancia con los valores medidos, tanto en la evaluación previa como en la posterior a la donación.
La ecuación CKD-EPI mostró una distribución con mayor concordancia en comparación con la MDRD respecto a los valores medidos de la TFG; sin embargo, se evidenció una subestimación en todos los rangos etarios. La subestimación y la alta variabilidad de las ecuaciones, en donde para los mismos valores se observan amplios rangos de valores estimados respecto a los medidos, ponen en cuestión su aplicabilidad.
Esto adquiere gran importancia cuando es necesaria la determinación precisa de la TFG en el cuidado de donantes renales, como también en la selección de los mismos, particularmente en aquellos con criterios expandidos.
La posibilidad de detectar cambios modestos en el filtrado glomerular es esencial para identificar donantes con riesgo y de esta manera poder implementar tempestivamente estrategias preventivas y de monitorización individualizada. La mayoría de los programas de trasplante evalúan la concentración de creatinina sérica o estiman la TFG con las ecuaciones que evaluamos en el presente estudio para el seguimiento a largo plazo de sus donantes, todo ello por razones de accesibilidad, a pesar de las limitaciones previamente descriptas en población general y confirmadas en nuestro trabajo al aplicarse en donantes18,19,31.
Las guías KDIGO afirman la necesidad de determinar la TFG, pero no establecen la metodología más adecuada a aplicar32. Los resultados de nuestra serie sugieren que, en donantes menores de 40 años con antecedentes familiares de enfermedad renal crónica, albuminuria o presión arterial en el límite superior del rango de referencia, una estrategia de medición sobre la estimación con las fórmulas tradicionales estaría recomendada.
En conclusión, el filtrado glomerular luego de la donación y su estabilización posnefrectomía logra una compensación promedio del 70% de la TFG inicial. Las ecuaciones de estimación muestran un bajo desempeño para el seguimiento a largo plazo del filtrado posnefrectomía. La medición del filtrado sería recomendable en la selección y el seguimiento de ciertos donantes bajo los criterios actuales de selección y la aceptabilidad para la donación.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno.