El concepto de fragilidad ha sido desarrollado principalmente en el campo de la geriatría y surgió para identificar a aquellos pacientes que presentaban vulnerabilidad al enfrentarse a un evento clínico estresante. Los pacientes frágiles tienen mayor riesgo de mortalidad, complicaciones y discapacidad, independientemente de su edad o comorbilidades. Se ha descrito una alta prevalencia de fragilidad entre sujetos con enfermedad renal crónica, sobre todo en terapia renal sustitutiva. El porcentaje de pacientes frágiles o prefrágiles en lista de espera de trasplante renal se sitúa en torno a un 20-30% y se ha demostrado que estos pacientes tienen peores resultados tras el trasplante renal, que constituye un evento estresante. Las herramientas para evaluar la fragilidad, escalas e índices, pueden ser útiles para identificar qué pacientes están en riesgo de padecer más complicaciones postrasplante, lo que resulta necesario para adaptar nuestra práctica clínica y evitar morbilidad. La más utilizada en pacientes renales es la escala de Fried, que se basa en la detección de cinco dimensiones fenotípicas. Además, conocer la fragilidad de nuestros pacientes permite plantear intervenciones prehabilitadoras durante el tiempo que estén en lista de espera, con el objetivo de mejorar esta vulnerabilidad pretrasplante, y así optimizar los resultados postrasplante. Se necesitan estudios en población renal para mejorar y prevenir la fragilidad.
Frailty is a concept that has been mainly developed in geriatrics and it came from the need of identifying subjects at risk to develop complications when they faced a stressful event. Frail patients have higher risk of mortality, poor outcomes and disability, and this is independent from their age or comorbidities. Chronic kidney disease patients present with high prevalence of frailty, especially those who are in renal replacement therapy. Frail or pre-frail patients on the kidney transplant waiting list represent 20-30%, and these patients are proven to have poorer results after the transplant, which is a stressful event itself. Tools for frailty assessment, both scales or indexes, may be useful to identify which subjects might be at risk for complications after transplant, and this is necessary to adapt our clinical practice and minimize morbidity. The most used frailty scale in kidney patients is Fried scale, which is based in five phenotypic items. Besides that, knowing frail population allows potential interventions such as prehabilitation while the patient is waiting for the kidney transplant, which the aim of improving their vulnerability prior to transplant and, therefore, optimizing results after transplant. More studies are needed amongst kidney patients to improve and prevent frailty.
Hace casi veinte años que la geriatra Linda Fried definió la fragilidad como un «estado fisiológico de aumento de vulnerabilidad a estresores y resultado de una disminución o disregulación de las reservas de múltiples sistemas, que origina dificultad para mantener la homeostasis»1. Sin embargo, aunque esta es la definición más aceptada, resulta también un tanto inespecífica. Globalmente, la fragilidad define un estado de vulnerabilidad a problemas de salud, pero se han desarrollado dos conceptualizaciones del término que han dado lugar a diferentes enfoques para su medición2. En primer lugar, la fragilidad puede ser considerada como un síndrome que da lugar a un fenotipo y que presenta sarcopenia como una de sus características fisiopatológicas fundamentales. Este enfoque, ya enunciado por los autores al final del siglo pasado3, facilita la medición de la fragilidad como un conjunto específico de signos y síntomas: pérdida de peso, lentitud en la marcha, baja actividad física, debilidad y baja energía. Es el fenotipo de fragilidad de Fried1. El segundo enfoque surge casi de manera simultánea en Canadá y de la mano del también geriatra Kenneth Rockwood, quien mide la fragilidad mediante un índice o escala, considerándola como un estado de acumulación de déficits que comienza a nivel celular y conduce a una pérdida de función en los sistemas orgánicos4–6. En este caso, la fragilidad se conceptúa como un marcador de edad biológica y, en consecuencia, se cuantifica sumando déficits en múltiples sistemas. Independientemente de cómo se mida –se han utilizado al menos 67 escalas diferentes en población general–, se sabe que los pacientes frágiles experimentan una disminución en la función física y un mayor riesgo de resultados adversos para la salud, discapacidad y mortalidad. Durante los últimos años, en población geriátrica, se ha introducido la medida de la fragilidad como una variable asociada a la supervivencia del paciente de forma independiente a la edad y a las enfermedades coexistentes. En la acción conjunta europea sobre prevención y manejo de la fragilidad (ADVANTAGE), la fragilidad se define como un estado clínico que aumenta la vulnerabilidad de un individuo para desarrollar dependencia y/o aumentar la mortalidad cuando es expuesto a un factor de estrés7. Puede ser el resultado de una serie de enfermedades y condiciones médicas (de hecho, está incrementada en pacientes con enfermedades crónicas8) y, lo más importante, su evolución hacia la discapacidad puede retrasarse o evitarse si se identifica y trata precozmente.
Los pacientes con enfermedad renal crónica (ERC) son el prototipo del paciente frágil. No es pues de extrañar que los nefrólogos nos hayamos ido incorporando al conocimiento de su fisiopatología y la potencial intervención sobre factores modificables que podrían revertir o al menos mejorar la fragilidad de nuestros pacientes. En el contexto del trasplante renal (TR), su conocido beneficio en supervivencia global frente a la diálisis, incluso en pacientes de edad avanzada9, puede verse mermado por la presencia de fragilidad, por lo que es necesaria una exhaustiva valoración del candidato, para evitar complicaciones en aquellos vulnerables en los que el estrés de la cirugía y el tratamiento inmunosupresor puedan incrementar su riesgo de muerte y/o complicaciones.
Justificación¿Por qué es importante la fragilidad en pacientes candidatos a trasplante renal? Resultados pre y postrasplante renalLa relación entre ERC y fragilidad, si bien no totalmente comprendida, parece relacionarse con varios factores: 1) el daño muscular a nivel tisular, común en pacientes con ERC avanzada debido a la uremia; 2) la alteración del sabor y del olor, que predispone a la anorexia en estos pacientes; y 3) la pérdida de energía que experimentan a medida que la ERC progresa. También contribuyen a la inflamación, el estrés oxidativo, el desequilibrio hormonal anabólico/catabólico, la acidosis metabólica y otras alteraciones celulares en el medio urémico10–12. Una revisión sistemática ha demostrado la asociación entre la gravedad de la ERC y la fragilidad del paciente, así como su relación con mortalidad y hospitalización13. La fragilidad, por tanto, es más frecuente en pacientes con ERC avanzada (15-21%) que en la población general (3-6%)13. Esta prevalencia es especialmente elevada en pacientes en hemodiálisis, hasta del 73%14, y se ha asociado a múltiples resultados de salud adversos14–19. Los pacientes frágiles escogen con mayor frecuencia tratamiento conservador de su ERC avanzada14, y cuando entran en programa de hemodiálisis presentan más caídas15, hospitalizaciones16 y mortalidad16–19. Esta fragilidad probablemente explica que menos del 25% de los pacientes en hemodiálisis acceden a lista de espera de trasplante en nuestro país20. En un estudio multicéntrico estadounidense se identificó que el 21% de los candidatos que iniciaban el estudio de entrada en lista para TR eran frágiles, mientras que entre los finalmente incluidos solo lo eran un 12%21. A pesar de estas limitaciones, la edad y la comorbilidad de los receptores de TR han aumentado de forma progresiva, de modo que la edad por sí misma ha dejado de ser un límite para el trasplante, y se aceptan candidatos de más de 80 años20.
Se estima que un 20% de los pacientes son frágiles en el momento del TR, con la disminución de la fuerza de prensión y la baja actividad física como sus componentes más destacados22. Cuando un paciente se trasplanta siendo frágil, su riesgo de función retrasada del injerto está incrementado23, así como el de tener una hospitalización más prolongada24, o de reingresar tras el trasplante independientemente de su edad 25. Los pacientes frágiles tienen también mayor riesgo de fallecer después del trasplante, ajustando por otras variables de confusión26,27. Utilizando como medida de fragilidad el fenotipo de Fried1, el Epidemiology Research Group in Organ Transplantation del Hospital Johns Hopkins ha descrito que más del 50% de sus receptores de TR son frágiles (20%) o pre-frágiles (32%)27. Pero al mismo tiempo, aquellos que superan el TR tienen una mayor capacidad de mejorar su fragilidad tras el mismo. En un estudio prospectivo, el 22% de los candidatos a TR empeoraron su estado de fragilidad desde la evaluación y tras el TR, mientras que el 24,4% se convirtió en menos frágil. Los que aumentaron su estado de fragilidad mostraron más probabilidades de una duración de la estancia hospitalaria ≥ 2 semanas y también más mortalidad postrasplante28. La fragilidad pretrasplante también se ha asociado con mayor deterioro cognitivo a medio plazo29 y a una probabilidad mayor de intolerancia al tratamiento inmunosupresor27. Esto puede ser especialmente relevante, dada la asociación existente entre fragilidad y alteración del sistema inmunitario30–32 y su potencial implicación en la supervivencia del injerto y la individualización del tratamiento inmunosupresor en estos receptores. La inmunosenescencia, definida como un estado inmunitario alterado que predispone a infecciones y a cáncer33–35, se ha relacionado con el envejecimiento en receptores de TR36. Estas células senescentes son capaces de secretar diversas proteínas, factores de crecimiento y citocinas, que contribuyen al estado inflamatorio que presentan estos pacientes mayores con enfermedad renal37. Dado el perfil del candidato a trasplante renal actual, necesitamos investigar sobre mecanismos de acción, dosificación y farmacocinética de las diferentes drogas inmunosupresoras en pacientes inmunosenescentes, para mejorar el equilibrio entre la contención de la respuesta inmunitaria frente al aloinjerto y la adecuada respuesta en el caso de infección o cáncer.
Los candidatos a TR a menudo presentan múltiples comorbilidades, que podrían ser las responsables de este incremento en la mortalidad. De hecho, se han publicado experiencias españolas al respecto, donde se ha comprobado que la comorbilidad del receptor puede predecir el riesgo de mortalidad postrasplante38,39. Sin embargo, la fragilidad tiene tanto peso en la mortalidad, que la comorbilidad solo incrementa la mortalidad en los pacientes no frágiles40. De los 177 candidatos a trasplante estudiados en el Hospital del Mar con la escala de Fried, 14 eran frágiles (7,9%) y 41 prefrágiles (23,2%). La fragilidad se asoció con mayor edad, sexo femenino, diabetes, un mayor índice de masa corporal y más tiempo en diálisis41. Además, datos posteriormente comunicados de esta cohorte confirmaron que el 30% de los pacientes que recibieron un injerto renal eran frágiles, presentando mayor mortalidad y pérdida del injerto tras el TR42.
Parece razonable pensar que intervenciones sobre la reserva funcional de los receptores antes del trasplante podrían mejorar los resultados postrasplante y, por ello, en la última revisión de las guías KDIGO para la evaluación de los candidatos a TR, se sugiere que se evalúe la fragilidad al momento de la inclusión, y de forma periódica, una vez en lista de espera43.
Métodos¿Cómo medir la fragilidad a los pacientes en lista de espera de trasplante? Una aproximación prácticaHistóricamente, los nefrólogos no han sido muy partidarios de aplicar sistemas de puntuación, como sí lo han hecho otros especialistas como intensivistas, anestesistas o geriatras con los ASA, SOFA, APACHE, etc. La ERC (y mucho más la diálisis) ya estigmatiza bastante a los pacientes renales como para añadirles una etiqueta más. El problema es que algunos de estos scores sí se han aplicado a población renal y sí predicen resultados a largo plazo y, por tanto, identificar a pacientes en riesgo y mejorar –o revertir si es posible–, esta situación, se convierte en una obligación. Debe avanzarse un paso más allá del comentario en la historia clínica en el que, de una manera subjetiva, se plasma la impresión sobre si el paciente renal es frágil o no. De hecho, la fiabilidad del nefrólogo para identificar la fragilidad de los candidatos a TR puede fallar hasta en un 37% de los pacientes, sobre todo a expensas de la población mayor44.
Como hemos mencionado anteriormente, existen diversas aproximaciones para caracterizar la fragilidad. La que considera la fragilidad como un fenotipo de mala función física se apoya fundamentalmente en medidas objetivas de fragilidad física (la fuerza de prensión y la velocidad de la marcha). La escala más utilizada con esta orientación es la ya referida escala de Fried, descrita y validada en el Cardiovascular Health Study y que da lugar al fenotipo de fragilidad o frailty phenotype1. A diferencia de este enfoque, que entiende la fragilidad como un estadio previo a la dependencia, otros entienden la fragilidad como consecuencia del acúmulo de comorbilidades, discapacidades, síntomas y alteraciones de las pruebas de laboratorio, así que su medición incluye la comorbilidad y la dependencia. Entre estos últimos, el Frailty Index, que entiende la fragilidad como un continuo e incluye en su versión original más de 70 ítems, es uno de los más utilizados, si bien luego se redujo a 4045 y, posteriormente, se ha realizado una versión basada en pictogramas con el objetivo de facilitar su uso en clínica, el llamado Clinical Frailty Scale46. La realización de algunas de las pruebas descritas es laboriosa y necesita de instrumentos auxiliares. Por este motivo, se ha desarrollado como instrumento de cribado en la población general la escala FRAIL, fácil de aplicar (menos de dos minutos) y con preguntas que responde el paciente, sin pruebas físicas ni parámetros de laboratorio47. Esta herramienta evalúa cinco componentes «fatigue, resistance, aerobic, illnesses, loss of weight» (FRAIL) y ha sido validada en distintos contextos clínicos48–50 y en población renal51.
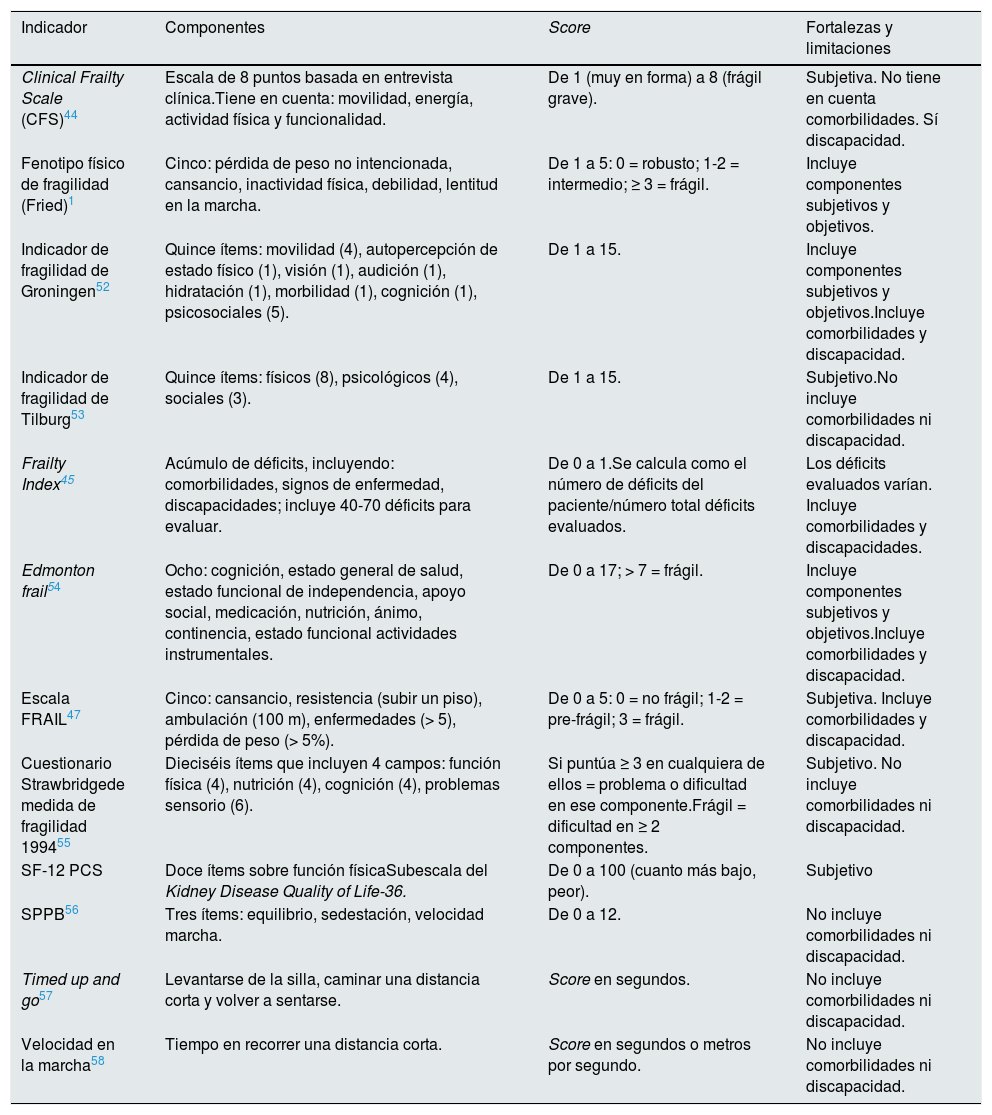
La tabla 1 recoge las escalas aplicadas a población renal en distintos estadios de enfermedad, con sus fortalezas y debilidades1,46,47,52–59. La más utilizada ha sido la escala de Fried1. Escoger entre una escala u otra va a depender de varios factores, fundamentalmente de tipo logístico. Por ejemplo, las escalas que rellena el propio paciente, según su percepción, como la Kidney Disease Quality of Life Short Form Physical Component Subscale (SF-12 PCS) son, obviamente, más fácilmente aplicables. Sin embargo, ante el nefrólogo que evalúa la entrada en lista de espera de trasplante, el paciente se puede mostrar reacio a mostrar sus «debilidades», y en este caso, escalas puramente objetivas como la Short Physical Performance Battery56 pueden ser más adecuadas, aunque habrá que tener en cuenta el tiempo y los recursos empleados en cada una de ellas.
Escalas y medidas de fragilidad utilizadas en pacientes con enfermedad renal crónica
| Indicador | Componentes | Score | Fortalezas y limitaciones |
|---|---|---|---|
| Clinical Frailty Scale (CFS)44 | Escala de 8 puntos basada en entrevista clínica.Tiene en cuenta: movilidad, energía, actividad física y funcionalidad. | De 1 (muy en forma) a 8 (frágil grave). | Subjetiva. No tiene en cuenta comorbilidades. Sí discapacidad. |
| Fenotipo físico de fragilidad (Fried)1 | Cinco: pérdida de peso no intencionada, cansancio, inactividad física, debilidad, lentitud en la marcha. | De 1 a 5: 0 = robusto; 1-2 = intermedio; ≥ 3 = frágil. | Incluye componentes subjetivos y objetivos. |
| Indicador de fragilidad de Groningen52 | Quince ítems: movilidad (4), autopercepción de estado físico (1), visión (1), audición (1), hidratación (1), morbilidad (1), cognición (1), psicosociales (5). | De 1 a 15. | Incluye componentes subjetivos y objetivos.Incluye comorbilidades y discapacidad. |
| Indicador de fragilidad de Tilburg53 | Quince ítems: físicos (8), psicológicos (4), sociales (3). | De 1 a 15. | Subjetivo.No incluye comorbilidades ni discapacidad. |
| Frailty Index45 | Acúmulo de déficits, incluyendo: comorbilidades, signos de enfermedad, discapacidades; incluye 40-70 déficits para evaluar. | De 0 a 1.Se calcula como el número de déficits del paciente/número total déficits evaluados. | Los déficits evaluados varían. Incluye comorbilidades y discapacidades. |
| Edmonton frail54 | Ocho: cognición, estado general de salud, estado funcional de independencia, apoyo social, medicación, nutrición, ánimo, continencia, estado funcional actividades instrumentales. | De 0 a 17; > 7 = frágil. | Incluye componentes subjetivos y objetivos.Incluye comorbilidades y discapacidad. |
| Escala FRAIL47 | Cinco: cansancio, resistencia (subir un piso), ambulación (100 m), enfermedades (> 5), pérdida de peso (> 5%). | De 0 a 5: 0 = no frágil; 1-2 = pre-frágil; 3 = frágil. | Subjetiva. Incluye comorbilidades y discapacidad. |
| Cuestionario Strawbridgede medida de fragilidad 199455 | Dieciséis ítems que incluyen 4 campos: función física (4), nutrición (4), cognición (4), problemas sensorio (6). | Si puntúa ≥ 3 en cualquiera de ellos = problema o dificultad en ese componente.Frágil = dificultad en ≥ 2 componentes. | Subjetivo. No incluye comorbilidades ni discapacidad. |
| SF-12 PCS | Doce ítems sobre función físicaSubescala del Kidney Disease Quality of Life-36. | De 0 a 100 (cuanto más bajo, peor). | Subjetivo |
| SPPB56 | Tres ítems: equilibrio, sedestación, velocidad marcha. | De 0 a 12. | No incluye comorbilidades ni discapacidad. |
| Timed up and go57 | Levantarse de la silla, caminar una distancia corta y volver a sentarse. | Score en segundos. | No incluye comorbilidades ni discapacidad. |
| Velocidad en la marcha58 | Tiempo en recorrer una distancia corta. | Score en segundos o metros por segundo. | No incluye comorbilidades ni discapacidad. |
Adaptada de Harhay M.N., et al. An overview of frailty in kidney transplantation: measurement, management and future considerations59.
La fragilidad, según hemos visto, es frecuente en los pacientes con ERC y, además, confiere un peor pronóstico en hemodiálisis. Si los pacientes entran en lista de espera de trasplante, ser frágil predice su evolución postrasplante. ¿Es por tanto la fragilidad una herramienta más para incluir o no a pacientes en lista de espera? ¿Debe aplicarse esta clasificación, como hacen los cardiólogos con el EuroSCORE, para ver si un paciente es candidato a cirugía cardíaca?60 Realmente este es un planteamiento equivocado. De hecho, incluso en pacientes frágiles, la única evidencia disponible al respecto es que el trasplante es mejor opción terapéutica que la diálisis. Un estudio retrospectivo llevado a cabo en casi 20.000 receptores de TR con registro previo del cuestionario de salud SF- 12 PCS identificó que aquellos en el último cuartil tenían peor supervivencia que los del primer cuartil a tres años (84 vs. 92%). Sin embargo, el beneficio del TR sobre la diálisis persistía en todos los cuartiles, incluso en los más frágiles61. Por tanto, identificar a los sujetos frágiles no solo tiene un propósito pronóstico, sino, y esto es lo más interesante, un propósito terapéutico. Hoy sabemos que se puede mejorar y/o revertir esta fragilidad. Que es posible intervenir.
El nivel de capacidad funcional de una persona predice resultados asociados con las intervenciones quirúrgicas electivas. Así nace el concepto de «prehabilitación»: un programa de terapia basada fundamentalmente en ejercicio, que pretende mejorar la capacidad funcional preoperatoria para mejorar la tolerancia al estresor próximo, derivando en mejores resultados después de la cirugía62–65. Además del ejercicio físico, dentro de la prehabilitación también se ha contemplado la optimización nutricional64 o psicológica del paciente65. Mejorar el estado funcional global preoperatorio es importante porque un estado funcional deficitario se asocia con resultados adversos peri- y postoperatorios, también en el TR66. Se ha estudiado el efecto de la prehabilitación basada en el ejercicio en varias poblaciones quirúrgicas67–69. El aumento de actividad física y de la capacidad funcional antes de un importante estresor quirúrgico contribuye a una reducción en el tiempo de recuperación postoperatoria y a un retorno más rápido a la capacidad funcional previa67–70. Los esfuerzos para mejorar los resultados después del TR se han centrado típicamente en intervenciones posteriores al TR. Intervenir antes del TR puede ser más útil, dado que los candidatos suelen esperar meses y años, la llegada del riñón71. Intervenir después del TR con ejercicio puede no ser útil, dada la fuerte caída en la actividad física en el primer año tras el TR y el pobre cumplimiento del tratamiento de rehabilitación prescrito72,73. En cambio, los candidatos a TR pueden estar más motivados a hacerlo, sabiendo que van a ser sometidos a una cirugía mayor en los próximos meses74. Sólo un pequeño estudio ha evaluado la posibilidad de prehabilitación para candidatos a TR75. La intervención consistió en sesiones semanales de fisioterapia en un centro de pacientes ambulatorios con ejercicios en casa. Con dificultad, por baja acogida, se incluyeron 18 participantes, 31% de ellos frágiles. Tras dos meses de prehabilitación, los participantes mejoraron su actividad física en un 64% (p = 0,004). Los participantes informaron de una alta satisfacción, mayor función física y energía, una resistencia sostenida, y una actitud mejor. En los cinco participantes que recibieron un TR durante el estudio, la duración de la estancia hospitalaria fue más corta que en los controles.
Sin embargo, la prehabilitación antes del TR es más difícil que en otras modalidades quirúrgicas, porque suele desconocerse la fecha del trasplante. Además, probablemente no todos los candidatos a TR serán capaces de asistir a sesiones semanales de prehabilitación en el centro, ya que se tienen que compaginar con los horarios de HD. Esto no debe ser impedimento para el intento, la reinvención y la búsqueda constante de opciones que mejoren el estado funcional de los pacientes renales. De hecho, hay programas de ejercicio para sujetos frágiles, de baja intensidad, que han mostrado sus beneficios en pacientes tanto en régimen ambulatorio y domiciliario como durante ingreso hospitalario por enfermedad aguda76–78.
ConclusionesLa fragilidad es una condición frecuente en pacientes renales, desde ERC avanzada hasta diálisis y TR. Ser frágil se asocia con peores resultados tras el trasplante. En candidatos a TR, medir la fragilidad puede facilitar el desarrollo de estrategias para revertirla en lista de espera y para minimizar la morbimortalidad peri y postoperatoria. Son necesarios estudios de intervención que permitan analizar si la intervención precoz puede mejorar estos resultados.
FinanciaciónMJPS y JP están financiados con el proyecto FIS-FEDER PI19/00037 del ISCII.
Los autores de este trabajo agradecen al Grupo Prometeo y a Novartis-Sandoz la iniciativa sobre el estudio de la fragilidad en candidatos a trasplante renal.