1) Identificar las variables que se asocian con los niveles urinarios de MBL, C4d y C5b-9 en enfermos con nefropatía IgA idiopática. 2) Analizar si los niveles urinarios de MBL o C4d son útiles para identificar la presencia de depósitos mesangiales de C4d/MBL.
Pacientes y métodoSe estudió a 96 enfermos con nefropatía IgA primaria. Se registraron las variables demográficas, clínicas y bioquímicas en el momento del diagnóstico. Las lesiones renales se cuantificaron mediante la clasificación de Oxford. En las biopsias, se realizaron tinciones inmunohistoquímicas para MBL, properdina, C4d, y C5b-9. En orina, se determinó el nivel de properdina, MBL, C4d y C5b-9.
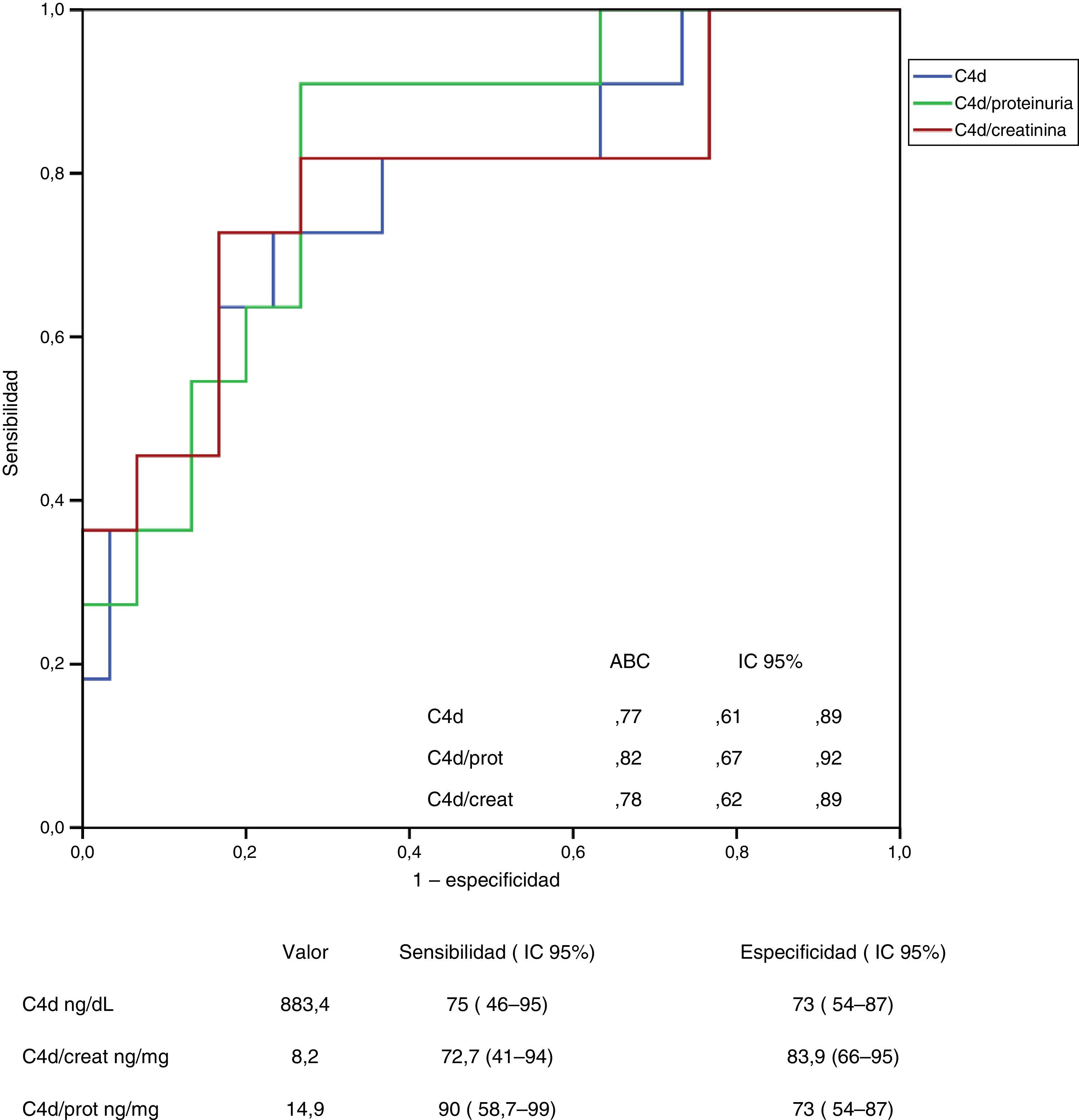
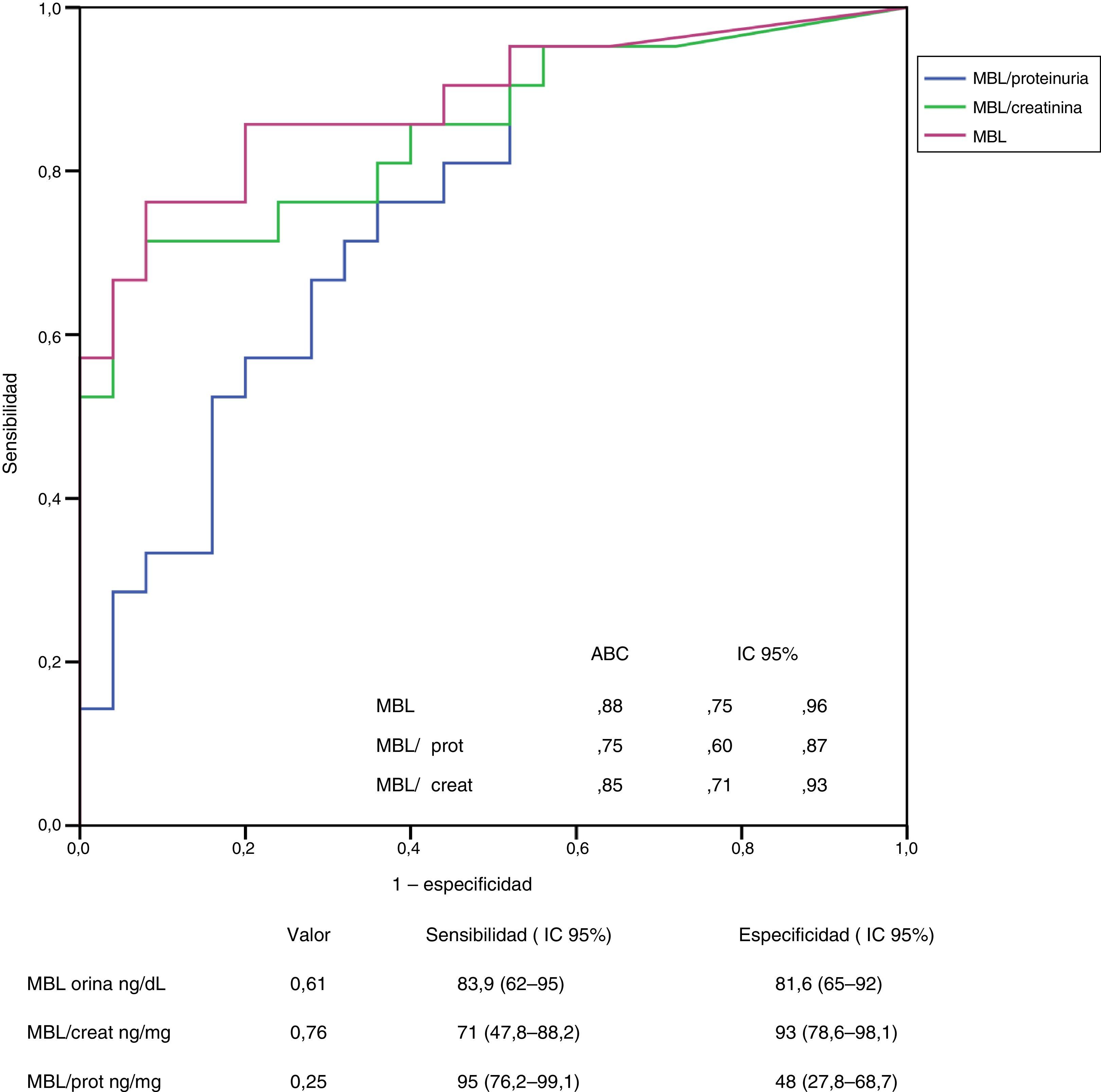
ResultadosLos predictores independientes de los niveles de C4d y MBL en orina fueron el depósito mesangial de cada una de ellas y, en menor grado, la proteinuria. Los predictores independientes de los niveles urinarios de C5b-9 fueron los niveles de MBL y properdina, y la proteinuria. La excreción urinaria de C4d tuvo una sensibilidad del 90% (IC 95%: 58,7-99) y una especificidad del 73% (IC 95%: 54-87) para la detección de depósitos mesangiales de C4d y el nivel de MBL tuvo una sensibilidad del 83,9% (IC 95%: 62-95) y una especificidad del 81,6% (IC 95%: 65-92) para identificar depósitos mesangiales de MBL.
ConclusiónEl principal predictor de la concentración urinaria de C4d y MBL es la presencia de depósitos mesangiales de ellas. La MBL podría contribuir a la activación del complemento en la luz tubular a través de la vía de las lectinas. Los niveles urinarios de MBL y C4d podrían ser biomarcadores sensibles y específicos para la identificación de los enfermos que presentan depósitos mesangiales de MBL o C4d.
1. To identify the variables that are associated with urinary levels of properdin, MBL, C4d, and C5b-9 in patients with idiopathic IgA nephropathy. 2. To analyse whether urinary levels of MBL and/or C4d are useful for identifying the presence of mesangial deposits of C4d/MBL.
Patients and methodA total of 96 patients with IgA nephropathy were studied. Demographic, clinical and biochemical variables were recorded at the time of diagnosis. Renal lesions were quantified using the Oxford classification. Immunohistochemical staining for MBL, MASP-2, properdin, C4d, and C5b-9 was performed in kidney biopsies, and in urine, the levels of properdin, MBL, C4d and C5b-9 were determined.
ResultsIn multivariate analysis, the independent predictors of C4d and MBL levels in urine were the mesangial deposits of each protein and, to a lesser extent, the urinary protein excretion. The independent predictors of urinary levels of C5b-9 were MBL properdin and proteinuria. Urinary excretion of C4d had a sensitivity of 90% (95% CI: 58,7 to 99) and a specificity of 73% (95% CI: 54-87) for detecting mesangial C4d deposits, and the level of MBL had a sensitivity of 83.9% (95% CI: 62-95) and a specificity of 81.6% (95% CI: 65-92) for identifying mesangial deposits of MBL.
ConclusionThe main predictor of urinary concentration of C4d and MBL was the presence of their respective mesangial deposits. Urine MBL may contribute to complement activation in the tubular luz through the lectin pathway. Urinary levels of MBL and C4d could be sensitive and specific biomarkers for the identification of patients with mesangial deposits of MBL and C4d.
La nefropatía mesangial IgA es una de las nefropatías primarias más frecuentes1. Aproximadamente un 25-30% de los enfermos presenta evolución a insuficiencia renal crónica a largo plazo1. La presencia de insuficiencia renal en el momento del diagnóstico, de proteinuria persistentemente superior a 1 g/día, de esclerosis glomerular o intersticial en la biopsia y la hipertensión arterial han sido identificados como predictores independientes de la evolución a insuficiencia renal crónica2–6. El modelo actualmente vigente sobre la patogenia de la nefropatía IgA considera que para que se produzca enfermedad renal, la IgA1 deficiente en galactosa debe depositarse en el mesangio renal, tanto en forma aislada como en forma de inmunocomplejos IgA/IgG o IgA/IgA, y una vez depositada, a través de interacción con receptores mesangiales específicos o por activación del complemento, inducir activación, proliferación y aumento de síntesis de la matriz mesangial y, finalmente, lesión celular7. Se han descrito 2posibles vías patogénicas, no mutuamente excluyentes, a través de las que el depósito renal de IgA1 podría inducir la activación del sistema del complemento en la nefropatía IgA: la vía alternativa y la vía de las lectinas (MBL)8–10.
En la actualidad, hay datos que indican que la vía de activación del complemento puede determinar el pronóstico a largo plazo. Datos de estudios independientes indican que la presencia de MBL y C4d, indicadoras de activación del complemento a través de la vía MBL, se asocia a un mayor grado de lesión renal y a un peor pronóstico a largo plazo11–18. Por ello, la evidencia de activación de esta vía en las biopsias en el momento del diagnóstico podría ser considerada como una variable precoz de mal pronóstico, relacionada con una determinada vía patogénica e independiente de las variables pronósticas clásicas. Actualmente, la identificación de esta vía de activación del complemento requiere obligadamente la práctica de una biopsia rena. Debido al carácter segmentario y focal de las lesiones, un resultado positivo puede considerarse confirmatorio mientras que, para aceptar un resultado negativo, es necesario disponer de una muestra amplia de glomérulos en la biopsia renal. En biopsias con escasos glomérulos, podrían producirse resultados falsamente negativos. Por ello, sería de gran importancia disponer de métodos no invasivos que permitieran identificar a estos enfermos desde el momento del diagnóstico o en una fase temprana de la enfermedad. En diversos estudios, se ha demostrado que la excreción urinaria de proteínas del complemento y del complejo de ataque a membrana están elevadas en enfermos con nefropatía IgA y que se correlacionan con la gravedad de la lesión renal19–21. Además, en un estudio reciente22, se ha descrito que en enfermos con nefropatía IgA, los niveles de MBL en la orina se correlacionan con la intensidad de las lesiones de la biopsia renal y con la proteinuria.
Estos datos, en conjunto, indican que la determinación de los niveles urinarios de proteínas de la cascada del complemento y de MBL, al margen de su posible valor pronóstico, podría ser útil para identificar a los enfermos que presentan depósitos mesangiales de MBL y C4d. Sin embargo, la presencia de proteínas de la cascada del complemento y de C5b-9 en la orina ha sido descrita también en otras nefropatías asociadas a proteinuria23–25 y la evidencia actualmente disponible indica que podría reflejar la activación intratubular del complemento, a través de la vía alternativa, mediada por la properdina26,27. Por otra parte, en ninguno de los estudios realizados hasta el momento se ha analizado si la excreción urinaria de C4d y de MBL se relaciona o no con la presencia de depósitos mesangiales de ambas proteínas.
Los objetivos del presente estudio son: 1) identificar las variables clínicas, bioquímicas e anatomopatológicas que se asocian con los niveles urinarios de properdina, MBL, C4d y C5b-9 en enfermos con nefropatía IgA idiopática y 2) analizar si, en estos enfermos, los niveles urinarios de MBL o C4d permiten identificar la presencia de depósitos mesangiales de C4d o MBL.
Pacientes y métodoSe estudió un total de 96 pacientes con nefropatía IgA idiopática diagnosticada por biopsia renal. En el momento de la biopsia renal y antes de iniciar cualquier tratamiento, se registraron las variables demográficas y clínicas, se realizaron determinaciones de creatinina sérica, filtrado glomerular estimado (FGe) mediante la ecuación CKD-EPI28, excreción urinaria de sodio y cociente proteinuria/creatinina (CPC) y se obtuvieron muestras de sangre y de orina de la segunda micción de la mañana para medir los niveles de properdina, MBL, C5b-9 y C4d. En todas las muestras de orina se descartó la presencia de piuria mediante estudio del sedimento urinario. Las muestras de orina se centrifugaron a 1.500g durante 10 min y se almacenaron a −80°C hasta su procesamiento. Los valores de creatinina se determinaron utilizando un método IDMS compensado (Hitachi Modular P-800 Roche Diagnostics, Berlín, Alemania). Los niveles séricos y urinarios de properdina, MBL, C4d y C5b-9 se midieron mediante sistemas de ELISA comerciales: ELISA properdina (Hycult Biotech, Uden, Holanda), ELISA MBL (Antibodyshop, Gentofte, Dinamarca), C5b-9 ELISA BD Biosciences (San José, California, EE. UU.) y ELISA Quidel MicroVue ™ C4d Fragment (San Diego, California, EE. UU). Las concentraciones urinarias de cada molécula se expresan en valor absoluto y tras ajustar por la proteinuria (ng/mg de proteinuria) y por la excreción de creatinina (ng/mg de creatinina).
Las mismas determinaciones se realizaron en un grupo control de 30 enfermos que habían sido estudiados por presentar proteinuria, con o sin alteración de la función renal, en los que, en la biopsia renal, se apreciaron lesiones de glomeruloesclerosis asociadas a inmunofluorescencia negativa y presentaban edad, distribución por sexos, niveles de filtrado glomerular y proteinuria comparables.
El protocolo de estudio se desarrolló siguiendo las normas de Helsinki y fue aprobado por el Comité de Ética del hospital. Todos los enfermos otorgaron un consentimiento informado por escrito. Los datos fueron tratados siguiendo las normas estrictas de confidencialidad.
Estudio anatomopatológico de las biopsias renalesEl tejido renal se fijó en parafina, y se realizaron cortes de 4μm, que se tiñeron con hematoxilina-eosina, tricrómico de Masson, ácido periódico de Schiff y metenamina de Jones. Los estudios de inmunofluorescencia se realizaron en muestras de tejido congeladas, utilizando anticuerpos contra las inmunoglobulinas A, G y M, fibrinógeno, C3 y C1q. Las tinciones para properdina, MBL, C4d y C5b-9 se realizaron mediante innmunohistoquímica, utilizando los siguientes anticuerpos: properdina (anti-MRP2 antibody [EPR10997(2)] (ab187644) Cambridge, Reino Unido), MBL (lectina de unión a manosa anticuerpo monoclonal [3E7] Rockford Road, IL, EE. UU.) y C5b-9 (anti-C5b-9 antibody [aE11] (ab66768) abcam, Cambridge, Reino Unido). Las tinciones inmunohistoquímicas se realizaron en cortes de 4μm, desparafinados y rehidratados tras recuperación de antígeno por cocción en microondas durante 5 min en tampón Tris/EDTA, pH 8,5. Como controles positivos, se utilizaron biopsias de enfermos con rechazo humoral, nefropatía membranosa y glomerulonefritis membranoproliferativa y como controles negativos, biopsias de enfermos con nefropatía por cambios mínimos. La extensión de las lesiones de fibrosis intersticial y de atrofia tubular se valoró mediante un método de morfometría cuantitativa, utilizando el sistema de análisis de imágenes Olympus WCUE-2. Las biopsias renales, además, fueron clasificadas siguiendo los criterios de Oxford29.
Análisis estadísticoLos resultados se expresan como media y desviación estándar para las variables con distribución normal o como mediana y cuartiles para las variables no normales. Las diferencias de medias entre grupos se analizaron mediante la prueba t de Student para datos independientes o la prueba de Mann-Whitney. Las diferencias en proporciones se analizaron mediante el test de χ2 o la prueba exacta de Fisher. Para el análisis de correlación entre las variables cuantitativas se utilizó la prueba de correlación de Spearman. Para analizar los predictores independientes de los niveles urinarios de MBL, C4d y C5b-9 en orina, se realizó un análisis de regresión simple univariado, seguido de un análisis multivariado paso a paso, con introducción manual de las variables, considerando el logaritmo de la concentración de cada molécula como variable dependiente, tras comprobar su distribución normal. Mediante curvas ROC, de entre todas las combinaciones posibles de sensibilidad vs. especificidad, se identificaron los niveles urinarios de C4d y MBL que tenían, a la vez, la mayor sensibilidad y especificidad, para la identificación de pacientes con depósitos renales de C4d y MBL. Una vez identificados, se calculó la sensibilidad y especificidad de dichos valores para la identificación de depósitos mesangiales de C4d y MBL. Se consideró estadísticamente significativo todo valor de p < 0,05. El análisis estadístico se realizó mediante el programa SPSS versión 20.0.
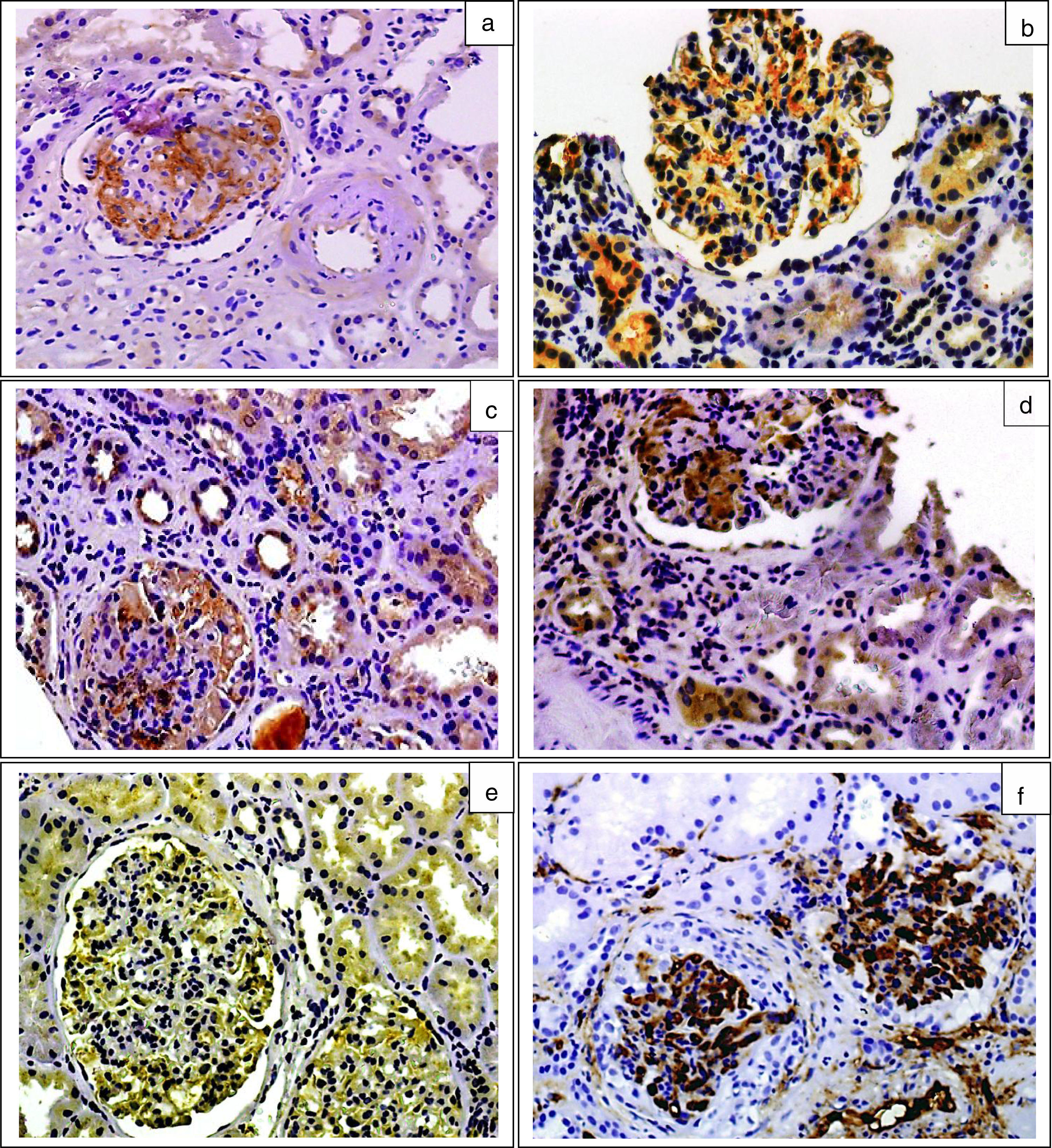
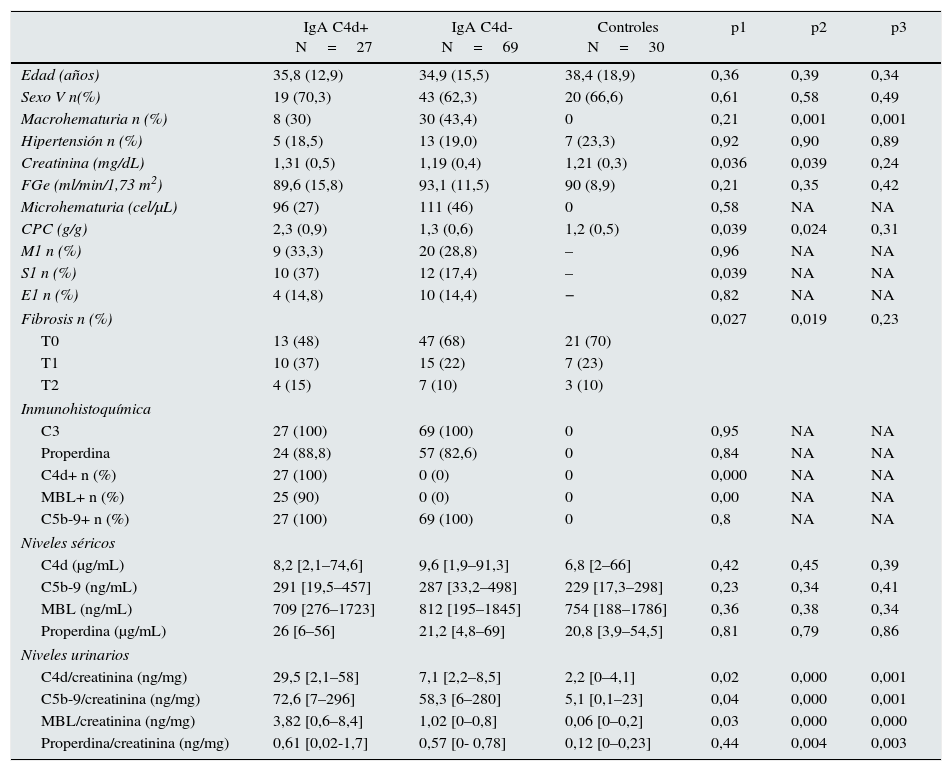
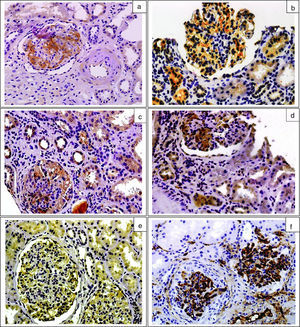
ResultadosEn la tabla 1 se resumen las características clínicas, bioquímicas y anatomopatológicas de los pacientes con nefropatía IgA, dependiendo de la presencia o ausencia de depósitos mesangiales de C4d o MBL en las biopsias renales y las de los enfermos del grupo control. No se apreciaron diferencias en edad, distribución por sexos ni en FGe entre los grupos. Los enfermos con nefropatía IgA C4d positivos presentaron niveles de MBL, C4d y C5b-9 significativamente superiores a los de los enfermos C4d negativos y a los del grupo control. Los niveles de properdina fueron significativamente superiores en los enfermos con nefropatía IgA que en el grupo control, sin diferencias entre enfermos C4d positivos y negativos. En la figura 1 se muestran ejemplos representativos de tinciones inmunohistoquímicas con depósitos mesangiales de MBL, C4d, properdina, C3 y C5b-9. Todas las biopsias de enfermos con nefropatía IgA presentaron depósitos mesangiales de C3 y de C5b-9. Un total de 27 enfermos (28,1%) presentaron depósitos mesangiales de C4d y 25 (26%) presentaron depósitos de MBL. De los 27 enfermos C4d positivos, 25 (92,5%) presentaron depósitos mesangiales de MBL que colocalizaron con los depósitos de C4d. Con relación a los enfermos C4d negativos, los enfermos C4d positivos presentaron menor prevalencia de macrohematuria, mayor prevalencia de lesiones S1 y mayores lesiones de fibrosis intersticial.
Características clínicas, bioquímicas y anatomopatológicas de los pacientes con nefropatía IgA, dependiendo de la presencia o ausencia de depósitos mesangiales de C4d o MBL en las biopsias renales y del grupo control
| IgA C4d+ N=27 | IgA C4d- N=69 | Controles N=30 | p1 | p2 | p3 | |
|---|---|---|---|---|---|---|
| Edad (años) | 35,8 (12,9) | 34,9 (15,5) | 38,4 (18,9) | 0,36 | 0,39 | 0,34 |
| Sexo V n(%) | 19 (70,3) | 43 (62,3) | 20 (66,6) | 0,61 | 0,58 | 0,49 |
| Macrohematuria n (%) | 8 (30) | 30 (43,4) | 0 | 0,21 | 0,001 | 0,001 |
| Hipertensión n (%) | 5 (18,5) | 13 (19,0) | 7 (23,3) | 0,92 | 0,90 | 0,89 |
| Creatinina (mg/dL) | 1,31 (0,5) | 1,19 (0,4) | 1,21 (0,3) | 0,036 | 0,039 | 0,24 |
| FGe (ml/min/1,73 m2) | 89,6 (15,8) | 93,1 (11,5) | 90 (8,9) | 0,21 | 0,35 | 0,42 |
| Microhematuria (cel/μL) | 96 (27) | 111 (46) | 0 | 0,58 | NA | NA |
| CPC (g/g) | 2,3 (0,9) | 1,3 (0,6) | 1,2 (0,5) | 0,039 | 0,024 | 0,31 |
| M1 n (%) | 9 (33,3) | 20 (28,8) | – | 0,96 | NA | NA |
| S1 n (%) | 10 (37) | 12 (17,4) | – | 0,039 | NA | NA |
| E1 n (%) | 4 (14,8) | 10 (14,4) | − | 0,82 | NA | NA |
| Fibrosis n (%) | 0,027 | 0,019 | 0,23 | |||
| T0 | 13 (48) | 47 (68) | 21 (70) | |||
| T1 | 10 (37) | 15 (22) | 7 (23) | |||
| T2 | 4 (15) | 7 (10) | 3 (10) | |||
| Inmunohistoquímica | ||||||
| C3 | 27 (100) | 69 (100) | 0 | 0,95 | NA | NA |
| Properdina | 24 (88,8) | 57 (82,6) | 0 | 0,84 | NA | NA |
| C4d+ n (%) | 27 (100) | 0 (0) | 0 | 0,000 | NA | NA |
| MBL+ n (%) | 25 (90) | 0 (0) | 0 | 0,00 | NA | NA |
| C5b-9+ n (%) | 27 (100) | 69 (100) | 0 | 0,8 | NA | NA |
| Niveles séricos | ||||||
| C4d (μg/mL) | 8,2 [2,1–74,6] | 9,6 [1,9–91,3] | 6,8 [2–66] | 0,42 | 0,45 | 0,39 |
| C5b-9 (ng/mL) | 291 [19,5–457] | 287 [33,2–498] | 229 [17,3–298] | 0,23 | 0,34 | 0,41 |
| MBL (ng/mL) | 709 [276–1723] | 812 [195–1845] | 754 [188–1786] | 0,36 | 0,38 | 0,34 |
| Properdina (μg/mL) | 26 [6–56] | 21,2 [4,8–69] | 20,8 [3,9–54,5] | 0,81 | 0,79 | 0,86 |
| Niveles urinarios | ||||||
| C4d/creatinina (ng/mg) | 29,5 [2,1–58] | 7,1 [2,2–8,5] | 2,2 [0–4,1] | 0,02 | 0,000 | 0,001 |
| C5b-9/creatinina (ng/mg) | 72,6 [7–296] | 58,3 [6–280] | 5,1 [0,1–23] | 0,04 | 0,000 | 0,001 |
| MBL/creatinina (ng/mg) | 3,82 [0,6–8,4] | 1,02 [0–0,8] | 0,06 [0–0,2] | 0,03 | 0,000 | 0,000 |
| Properdina/creatinina (ng/mg) | 0,61 [0,02-1,7] | 0,57 [0- 0,78] | 0,12 [0–0,23] | 0,44 | 0,004 | 0,003 |
Los resultados de las variables cuantitativas se expresan como media (DE). Los resultados de las variables categóricas se expresan como valor absoluto (porcentaje).
Los niveles séricos y urinarios de C4d, C5b-9, MBL y properdina corresponden a la mediana y [P25-P75].
CPC: cociente proteinuria/creatinina; FGe: filtrado glomerular estimado; NA: no aplicable; p1: diferencias entre pacientes con nefropatía IgA C4d positivos y C4d negativos; p2: diferencias entre enfermos con nefropatía IgA C4d positivos y controles; p3: diferencias entre enfermos con nefropatía IgA C4d negativos y controles.
Imágenes de tinciones inmunohistoquímicas representativas de la presencia de depósitos mesangiales. a) MBL. b) C4d. c y d) Properdina (la positividad para depósito de properdina se observó tanto en el área mesangial como en el epitelio tubular). e) C3. f) C5b-9. Técnica streptavidina peroxidasa (x200).
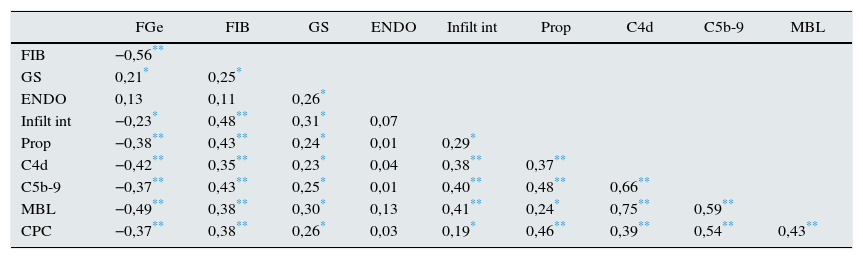
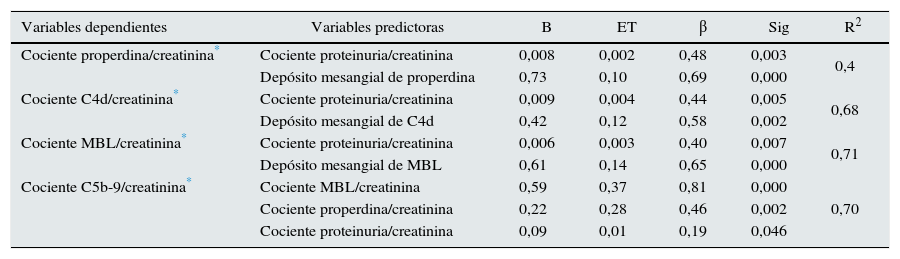
En la tabla 2 se muestra la matriz de correlaciones entre las distintas variables bioquímicas y anatomopatológicas. Los niveles urinarios de properdina, C4d y MBL y C5b-9 fueron independientes de sus respectivos niveles séricos (r: 0,09; p: 0,34; r: 0,09; p: 0,76; r: 0,02; p: 0,59, respectivamente) y tuvieron correlaciones negativas con el filtrado glomerular y positivas con la extensión de la glomeruloesclerosis focal, los infiltrados y la fibrosis intersticial. Además, todos ellos mostraron una correlación significativa con la proteinuria. Los depósitos de MBL y C4d tuvieron una elevada correlación entre sí y con los niveles de C5b-9. Los niveles de properdina se asociaron significativamente con los de C5b-9 y, de forma débil, con los de MBL y C4d. Los niveles de C5b-9 se asociaron significativamente con la proteinuria y con los niveles urinarios de properdina, MBL y de C4d. En la tabla 3 se resumen los predictores independientes de los niveles urinarios de properdina, C4d, MBL y C5b-9 en el análisis de regresión múltiple y la proporción de la variabilidad explicada por las variables predictoras, para cada una de ellas.
Matriz de correlaciones entre variables bioquímicas y anatomopatológicas
| FGe | FIB | GS | ENDO | Infilt int | Prop | C4d | C5b-9 | MBL | |
|---|---|---|---|---|---|---|---|---|---|
| FIB | −0,56** | ||||||||
| GS | 0,21* | 0,25* | |||||||
| ENDO | 0,13 | 0,11 | 0,26* | ||||||
| Infilt int | −0,23* | 0,48** | 0,31* | 0,07 | |||||
| Prop | −0,38** | 0,43** | 0,24* | 0,01 | 0,29* | ||||
| C4d | −0,42** | 0,35** | 0,23* | 0,04 | 0,38** | 0,37** | |||
| C5b-9 | −0,37** | 0,43** | 0,25* | 0,01 | 0,40** | 0,48** | 0,66** | ||
| MBL | −0,49** | 0,38** | 0,30* | 0,13 | 0,41** | 0,24* | 0,75** | 0,59** | |
| CPC | −0,37** | 0,38** | 0,26* | 0,03 | 0,19* | 0,46** | 0,39** | 0,54** | 0,43** |
C4d: nivel de C4d en orina (ng/mg creatinina); C5b-9: nivel de C5b-9 en orina (ng/mg creatinina); ENDO: porcentaje de glomérulos con proliferación endotelial; FGe: filtrado glomerular estimado; FIB: porcentaje de fibrosis intersticial; GF: porcentaje de glomérulos con esclerosis segmentaria; Infilt int: porcentaje de infiltrado celular intersticial; MBL: nivel de MBL en orina (ng/mg creatinina); Prop: nivel de properdina en orina (ng/mg creatinina); RPC: cociente proteinuria/creatinina.
Predictores independientes de los cocientes properdina/creatinina C4d/creatinina, MBL/creatinina y C5b9/creatinina en orina mediante análisis de regresión múltiple
| Variables dependientes | Variables predictoras | B | ET | β | Sig | R2 |
|---|---|---|---|---|---|---|
| Cociente properdina/creatinina* | Cociente proteinuria/creatinina | 0,008 | 0,002 | 0,48 | 0,003 | 0,4 |
| Depósito mesangial de properdina | 0,73 | 0,10 | 0,69 | 0,000 | ||
| Cociente C4d/creatinina* | Cociente proteinuria/creatinina | 0,009 | 0,004 | 0,44 | 0,005 | 0,68 |
| Depósito mesangial de C4d | 0,42 | 0,12 | 0,58 | 0,002 | ||
| Cociente MBL/creatinina* | Cociente proteinuria/creatinina | 0,006 | 0,003 | 0,40 | 0,007 | 0,71 |
| Depósito mesangial de MBL | 0,61 | 0,14 | 0,65 | 0,000 | ||
| Cociente C5b-9/creatinina* | Cociente MBL/creatinina | 0,59 | 0,37 | 0,81 | 0,000 | 0,70 |
| Cociente properdina/creatinina | 0,22 | 0,28 | 0,46 | 0,002 | ||
| Cociente proteinuria/creatinina | 0,09 | 0,01 | 0,19 | 0,046 |
β: coeficiente estandarizado; R2: porcentaje de la variabilidad explicada por el conjunto de las variables independientes.
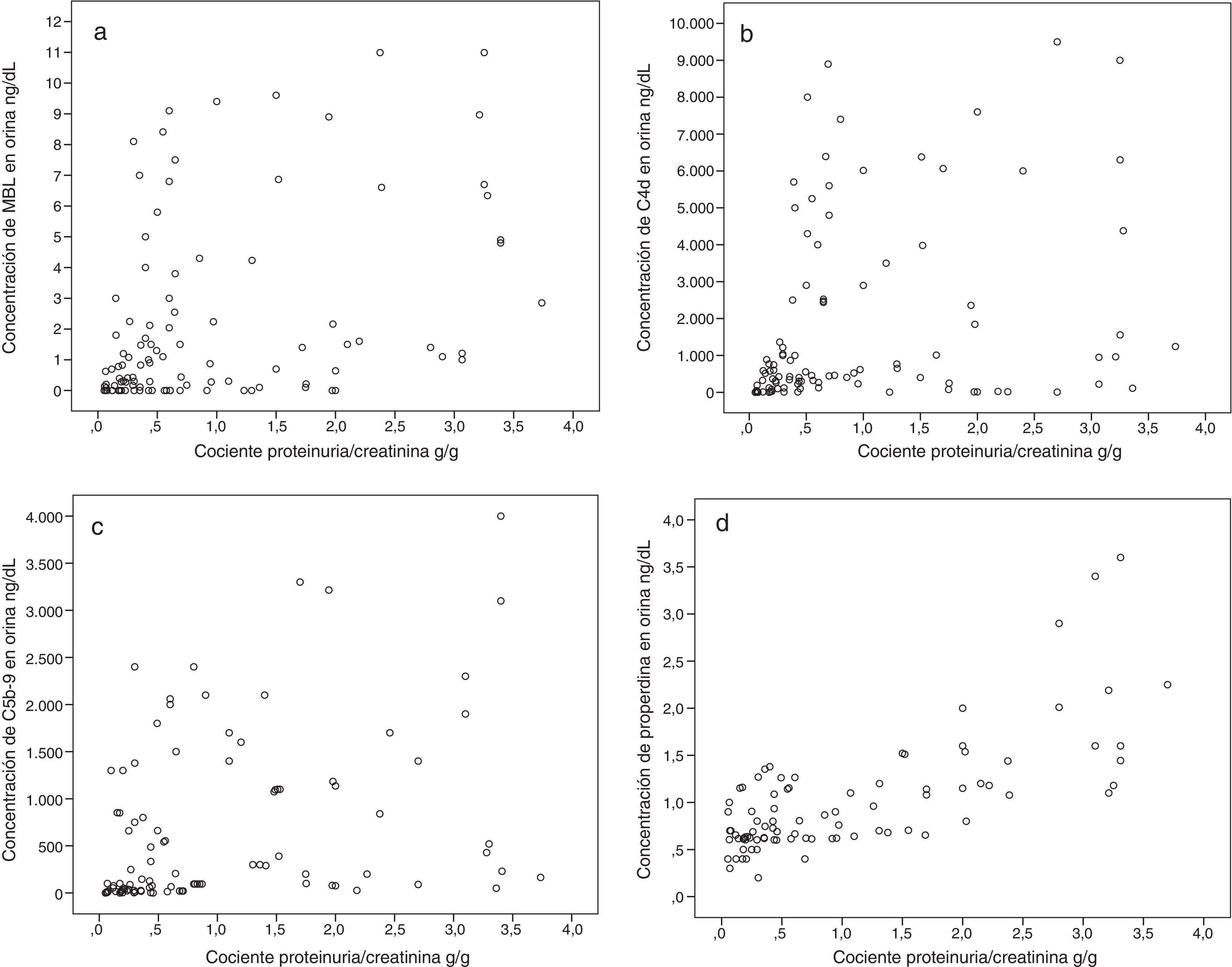
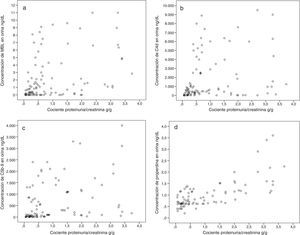
El CPC se identificó como un predictor independiente común a todas ellas, pero su influencia y su peso fueron distintos en cada caso. En el caso de la properdina, el CPC fue el único predictor identificado. En el caso de los niveles de C4d y de MBL, el principal predictor fue la presencia de depósitos mesangiales de MBL, mientras que el CPC tuvo un peso muy inferior. Los principales predictores independientes de los niveles de C5b-9 fueron el nivel urinario de properdina y el de MBL y, en mucho menor grado, el CPC. En la figura 2 se representa el diagrama de dispersión entre la excreción urinaria de MBL, C4d, C5b-9 y properdina y el CPC. En conjunto, se observa que la excreción urinaria de las 4moléculas tiende a aumentar a medida que lo hace la proteinuria (ver tabla 2). Sin embargo, enfermos con niveles de proteinuria bajos pueden tener niveles de excreción elevados de MBL, C4d, C5b-9 y properdina, mientras que enfermos con proteinuria elevadas pueden tener niveles de excreción bajos de todas ellas.
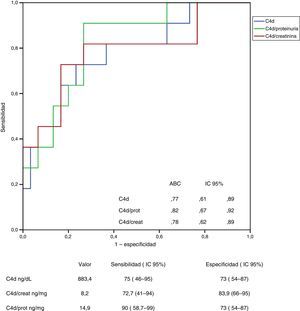
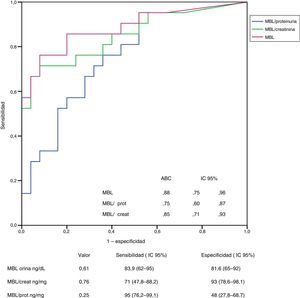
En las figuras 3 y 4 se representan las curvas ROC con las que se analiza el valor de los niveles urinarios de C4d y de MBL para predecir la presencia de sus respectivos depósitos mesangiales y se especifican los puntos de corte con mayor sensibilidad y especificidad en valores absolutos y tras ajustar por creatinina y proteinuria. Para la predicción de la presencia de depósitos mesangiales de C4d, los niveles urinarios tuvieron una sensibilidad y especificidad similar, tanto en términos absolutos como tras ajustar por creatinina o proteinuria. Para la predicción de los depósitos mesangiales de MBL, la sensibilidad fue también similar, independientemente de la forma de expresión de la concentración urinaria de MBL, pero la especificidad fue mayor (p: 0,027) al expresar el nivel de MBL en términos absolutos o como cociente con la creatinina que al expresarlo mediante el cociente MBL/proteinuria.
Análisis del valor de los niveles de C4d en orina para la identificación de la presencia de depósitos mesangiales de C4d mediante curva ROC.
ABC: área bajo la curva; DT: desviación tipo; IC 95%: intervalo de confianza del 95%.
No se apreciaron diferencias significativas entre las curvas correspondientes a los valores absolutos de C4d y las curvas correspondientes a los cocientes C4d/creatinina o C4d/proteinuria.
ABC: área bajo la curva; DT: desviación tipo; IC 95%: intervalo de confianza del 95%.
Análisis del valor de los niveles de MBL en orina para la identificación de la presencia de depósitos mesangiales de MBL mediante curva ROC.
No se apreciaron diferencias significativas entre las curvas correspondientes a los valores absolutos de MBL y las correspondientes a los cocientes MBL/creatinina o MBL/proteinuria.
ABC: área bajo la curva; DT: desviación tipo; IC 95%: intervalo de confianza del 95%.
Los resultados de nuestro estudio indican que en enfermos con nefropatía IgA idiopática, los niveles urinarios de properdina, MBL, C4d y C5b-9 se hallan elevados, se correlacionan significativamente con el filtrado glomerular, con la proteinuria y con la severidad y extensión de las lesiones de fibrosis tubulointersticial. Además, nuestros resultados indican que los niveles urinarios de C4d y de MBL pueden ser útiles para identificar a los enfermos que presentan depósitos mesangiales de ambas proteínas.
El análisis inmunohistoquímico de las biopsias renales fue comparable al descrito en estudios previos11–18. La presencia de depósitos mesangiales de C3 fue constante y se asoció a depósitos mesangiales de properdina y de C5b-9, lo que, en conjunto, indica que la activación de la vía alternativa del complemento es común a todos los enfermos con nefropatía IgA. La presencia de C4d mesangial se observó únicamente en algunos enfermos y se asoció de forma invariable a depósitos de MBL, lo que indica la existencia de capacidad funcional para la activación del complemento por la vía de las lectinas. Sin embargo, la presencia de C4d no excluye que, simultáneamente, pueda producirse una activación a través de la vía alternativa. La suma de activación del complemento a través de distintas vías podría explicar, al menos en parte, por qué los enfermos con depósitos mesangiales de C4d presentan lesiones glomerulares y tubulointersticiales más extensas y mayor pérdida de función renal.
La presencia de properdina, MBL, C4d y C5b-9 en la orina podría ser debida a su excreción urinaria como resultado de la pérdida de integridad de la barrera de filtración glomerular. Sin embargo, la mera filtración de proteínas no parece una explicación suficiente, ya que los niveles urinarios de properdina fueron significativamente superiores en los enfermos con nefropatía IgA que en el grupo control y los depósitos mesangiales de MBL y C4d fueron significativamente superiores en los enfermos con IgA C4d positivos que en los enfermos con IgA C4d negativos y que en los enfermos con otras nefropatías no mediadas por activación del complemento, tras ajustar por la proteinuria. Por otra parte, en los modelos multivariados, la proteinuria explicó tan solo una parte muy pequeña de la variación observada en los niveles urinarios de properdina, MBL, C4d y C5b-9. La mayor parte de esa variación dependió de la presencia o ausencia de sus respectivos depósitos mesangiales. Estos datos indican que el patrón de excreción urinaria de proteínas relacionadas con la activación del complemento podría proporcionar información sobre la intensidad y el tipo de vía de activación predominante en un momento determinado de la evolución clínica. Además, las evidencias de que los niveles urinarios de MBL y C4d fueron significativamente superiores en los enfermos con depósitos mesangiales de ambas moléculas, de la elevada asociación existente entre los niveles urinarios de MBL y C4d y de que su excreción, tanto en términos absolutos como tras ajustar por proteinuria o creatinina, tuvieron una alta sensibilidad y especificidad para identificar a los enfermos con depósitos mesangiales de C4d y MBL, podrían ser consideradas como una prueba de concepto en favor de su posible utilidad clínica y justificarían la realización de estudios para definir los procedimientos preanalíticos y estandarizar adecuadamente los distintos aspectos técnicos relacionados con su medición para poder analizar su posible aplicabilidad en la práctica clínica.
Además de proporcionar información sobre la activación del complemento en el mesangio renal, nuestros datos indican que los niveles de excreción urinaria de MBL y de C4d podrían tener también relación con la extensión de las lesiones tubulointersticiales. En diversos estudios, se ha descrito que en distintas nefropatías asociadas a proteinuria, incluida la nefropatía IgA, la pérdida de integridad de la barrera de filtración permitiría el paso a la luz tubular de moléculas capaces de activar la cascada del complemento en la superficie de la célula tubular. Esta activación luminal del complemento ha sido destacada como una de las posibles vías a través de las cuales la proteinuria podría inducir lesión tubulointersticial.
La evidencia disponible indica que la activación del complemento en la luz tubular se produce fundamentalmente a través de la vía alternativa y se inicia tras la unión específica y pH dependiente de la properdina (presente en la orina) al heparán-sulfato de la membrana de las células tubulares26,27,30,31. Nuestros datos son coincidentes con esta hipótesis y, además, indican que la presencia de MBL en la orina podría contribuir también a la activación intraluminal del complemento a través de la vía de las lectinas ya que, en los modelos de regresión múltiple, los niveles de MBL explicaron una proporción elevada de la variación en los niveles de C4d y fueron predictores independientes de la excreción de C5b-9 tras ajustar por properdina y proteinuria. La suma de la activación luminal del complemento mediada por properdina y la mediada por MBL podría contribuir a explicar por qué los enfermos con depósitos mesangiales de MBL y C4d y mayor excreción urinaria de ambas proteínas presentan mayor extensión de lesiones tubulointersticiales en el momento del diagnóstico, incluso tras ajustar por la proteinuria11–18 y por qué, en estudios recientes, los niveles elevados de MBL en la orina se han identificado como un signo de mal pronóstico22.
En resumen, los datos de nuestro estudio indican que, en los enfermos con nefropatía IgA idiopática, la excreción urinaria de MBL se correlaciona con la presencia de depósitos mesangiales de MBL y C4d y se asocia significativamente con los niveles de excreción urinaria de C4d y C5b-9 y con la extensión de las lesiones tubulointersticiales, independientemente de la proteinuria y del filtrado glomerular. Por otra parte, los niveles urinarios de MBL y C4d podrían ser biomarcadores sensibles y específicos para la identificación de los enfermos que presentan depósitos mesangiales de dichas proteínas. Ambos aspectos justificarían la realización de estudios dirigidos a definir los distintos aspectos técnicos relacionados con los procedimientos de medida, para poder analizar la posible utilidad de la medición de dichas moléculas en la práctica clínica.
FinanciaciónEl presente estudio ha sido financiado mediante una ayuda del Fondo de Investigaciones Sanitarias FISS n.° de expediente: PI14/01831.
Conflicto de interesesNinguno de los autores declara tener conflictos de interés.