La hiperpotasemia constituye un importante desequilibrio electrolítico en la enfermedad renal crónica (ERC). Los inhibidores del sistema renina-angiotensina-aldosterona (iSRAA) tienen propiedades beneficiosas cardiorrenales, aunque son causa importante de hiperpotasemia.
ObjetivoExaminar la prevalencia de la hiperpotasemia en la ERC, identificar factores asociados a su aparición y la relación entre hiperpotasemia y mortalidad.
Pacientes y métodosEstudio observacional retrospectivo en pacientes con ERC en el período 1971-2017. La población se categorizó en 3grupos: grupo 1, pacientes con ERC sin tratamiento renal sustitutivo; grupo 2, pacientes en hemodiálisis, y grupo 3, pacientes en diálisis peritoneal continua ambulatoria.
ResultadosSe evaluó a 2.629 pacientes. La prevalencia observada en los distintos grupos fue del 9,6, el 16,4 y el 10,6%, respectivamente. Los factores de riesgo relacionados con la aparición de hiperpotasemia en el grupo de ERC fueron la tasa de filtrado glomerular (FG) (p < 0,001), la creatinina plasmática (p < 0,001), el sodio plasmático (p < 0,001), la hemoglobina (p = 0,028), la presión arterial diastólica (p = 0,012), la ingesta de inhibidores de la enzima de conversión de la angiotensina o antagonistas de receptores de angiotensina ii (p = 0,008), el tratamiento con metformina (p < 0,001) y la diabetes (p = 0,045). El tratamiento con iSRAA incrementó de forma relevante la hiperpotasemia a medida que disminuía el FG, así como en pacientes con diabetes o insuficiencia cardiaca.
ConclusionesLa hiperpotasemia es una alteración metabólica frecuente en pacientes con ERC que aumenta en presencia de fármacos con propiedades beneficiosas cardiorrenales (iSRAA), por lo que en muchos casos los pacientes pierden el beneficio asociado a estos fármacos. Nuevos compuestos no absorbibles de reciente aparición, que se unen al potasio en el tracto gastrointestinal potenciando su excreción fecal, manteniendo el beneficio cardiorrenal de los iSRAA, pudieran ser relevantes en la evolución de los pacientes con ERC.
Hyperkalaemia is a significant electrolyte imbalance in chronic kidney disease (CKD). Renin-angiotensin-aldosterone system inhibitors (RAASi) have beneficial cardio-renal properties, although they can often cause hyperkalaemia.
ObjectiveTo examine the prevalence of hyperkalaemia in CKD, identify factors associated with its appearance and the relationship between hyperkalaemia and mortality.
Patients and methodsRetrospective observational study on patients with CKD in the period 1971-2017. The population was categorised into 3groups: Group 1, patients with CKD without renal replacement therapy; Group 2, patients on haemodialysis; and Group 3, patients on continuous ambulatory peritoneal dialysis.
ResultsA total of 2,629 patients were evaluated. The prevalence observed in the different groups was: 9.6%, 16.4% and 10.6%, respectively. Risk factors related to the appearance of hyperkalaemia in the CKD group were glomerular filtration rate (GFR) (P<.001), plasma creatinine (P<.001), plasma sodium (P<.001), haemoglobin (P=.028), diastolic blood pressure (P=.012), intake of ACE inhibitors and/or angiotensin ii receptor blockers (P=.008), treatment with metformin (P<.001) and diabetes (P=.045). Treatment with RAASi significantly increased hyperkalaemia as GFR decreased, as well as in patients with diabetes or heart failure.
ConclusionsHyperkalaemia is a frequent metabolic alteration in CKD patients that increases in the presence of drugs with beneficial cardio-renal properties (RAASi), which means that patients often lose the benefit associated with these drugs. New, recently-appearing non-absorbable compounds, which bind to potassium in the gastrointestinal tract, enhancing faecal excretion and thus maintaining the cardio-renal benefit of the RAASi, could be relevant in the progress of patients with CKD.
La enfermedad renal crónica (ERC) se encuentra asociada a importantes desequilibrios electrolíticos, entre los que la hiperpotasemia constituye uno de las más importantes debido a su potencial riesgo de desarrollo de arritmias asociadas a resultados cardiacos adversos e incremento de la mortalidad1-3. El mantenimiento a largo plazo por parte de los riñones de la homeostasis del potasio, a pesar del deterioro de la tasa de filtrado glomerular (FG) vinculado a la progresión de la ERC, refleja una adaptación progresiva de los mecanismos reguladores de la concentración sérica de potasio4, aunque su capacidad para responder a un aumento agudo de la carga de potasio se ve obstaculizada, lo que resulta en el desarrollo de episodios de hiperpotasemia. Como resultado de este mecanismo adaptativo, los niveles séricos de potasio suelen encontrarse en rango normal hasta niveles de FG ≤ 10-15 ml/min, salvo que concurran otros factores coadyuvantes a la hiperpotasemia, como determinados fármacos, o en casos de hipoaldosteronismo hiporreninémico, en los que puede aparecer hiperpotasemia con grados menores de disminución del FG, tal como puede ocurrir en la nefropatía diabética, las nefropatías intersticiales y la uropatía obstructiva. Comorbilidades frecuentes durante la ERC, como la diabetes mellitus (DM) y la enfermedad cardiovascular se asocian al desarrollo de hiperpotasemia a través de diversos mecanismos. La deficiencia de insulina y la hipertonía causada por hiperglucemia en pacientes con diabetes contribuyen a la incapacidad de dispersar altas cargas de potasio en el espacio intracelular5. Igualmente, la DM se asocia a hipoaldosteronismo hiporreninémico y la consiguiente incapacidad para regular positivamente la secreción tubular de potasio6. Por su parte, las enfermedades cardiovasculares, como la hipertrofia ventricular izquierda y la insuficiencia cardiaca, requieren diversos tratamientos médicos que se han relacionado con la hiperpotasemia. En la práctica clínica la insuficiencia renal y los fármacos son los principales factores que predisponen al desarrollo de hiperpotasemia. Terapias con ciertos medicamentos, tales como diuréticos ahorradores de potasio, betabloqueantes, antiinflamatorios no esteroideos (AINE) y fundamentalmente los inhibidores del sistema renina-angiotensina-aldosterona (iSRAA), pueden afectar a la capacidad del riñón para mantener un adecuado equilibrio entre la ingesta, la excreción y la distribución transcelular del potasio, dando lugar a diversas dispotasemias. Los iSRAA han mostrado su eficacia en la ralentización de la progresión de la ERC, la hipertensión, la proteinuria y la insuficiencia cardiaca, si bien se hallan asociados a un mayor riesgo de hiperpotasemia7, por lo que su uso puede verse limitado por esta circunstancia, lo cual plantea frecuentemente un importante dilema terapéutico entre el riesgo/beneficio. Considerando la relación de la insuficiencia renal con la hiperpotasemia, examinamos la prevalencia y la asociación de elevados valores de potasio plasmático y mortalidad en una cohorte de pacientes de nuestro Servicio de Nefrología.
Pacientes y métodosEstudio observacional retrospectivo en pacientes con ERC incluidos en el registro del Servicio de Nefrología del Hospital Universitario Marqués de Valdecilla (HUMV), durante el período 30 de noviembre de 1971 hasta el 1 de febrero del 2017. Se analizaron datos de 3.331 pacientes. La población se categorizó en 3grupos en función del valor de FG estimado (FGe) y encontrarse o no recibiendo tratamiento renal sustitutivo en el momento de realización del estudio. Un total de 198 pacientes, que a lo largo del período del estudio habían estado de forma transitoria en hemodiálisis (HD) o diálisis peritoneal continua ambulatoria (DPCA), quedaron excluidos de los cálculos. Igualmente, dado el carácter hipercalemiante de los anticalcineurínicos usados en la terapia inmunosupresora de los trasplantados renales, fueron excluidos 504 pacientes. La población final analizada fue de 2.629 pacientes. Los grupos analizados fueron:
- -
Grupo 1: pacientes con ERC (FGe < 60 ml/min/1,73 m2) que no están en tratamiento renal sustitutivo (n = 1.088).
- -
Grupo 2: pacientes en tratamiento con HD en el momento de realización del estudio (n = 1.097).
- -
Grupo 3: pacientes en tratamiento con DPCA en el momento de realización del estudio (n = 444).
La hiperpotasemia se definió como un nivel de potasio sérico > 5,5 mmol/l. En el período del 30 de noviembre de 1971 al 3 de febrero del 2013, la función renal se determinó mediante ecuación MDRD-4. Una vez estandarizada la creatinina sérica, la función renal quedó determinada mediante la ecuación CKD-EPI. Al no disponer de la etnia, para el cálculo del FGe, toda la población fue considerada como blanca. Ante las recomendaciones de nuestro laboratorio, las muestras hemolizadas no se tuvieron en consideración, procediéndose a la obtención de nuevas muestras. Solo fueron considerados pacientes con un FGe < 60 ml/min/1,73 m2 y su categorización en los distintos estadios de ERC se llevó a cabo con arreglo a los criterios de la vigente clasificación KDIGO 2012.
La cuantificación de potasio sérico en los distintos grupos analizados se llevó a cabo con arreglo a los siguientes criterios:
- -
En el grupo 1 de ERC, el existente el día de la confirmación de la ERC (2.a determinación FGe < 60 ml/min/1,73 m2, al menos 90 días después de la primera).
- -
En los grupos 2 y 3 de pacientes en HD o DPCA el valor medio correspondiente al mes de inicio del tratamiento renal sustitutivo.
La severidad de la hiperpotasemia se clasificó en los siguientes 4 estadios: leve (K: 5,5-5,9 mmol/l), moderada (K: 6,0-6,4 mmol/l), grave (K: 6,5-6,9 mmol/l) y severa (K ≥ 7,0 mmol/l). Los detalles demográficos se obtuvieron del registro de pacientes del servicio de Nefrología del HUMV. DM, hipertensión arterial, enfermedad coronaria y otras comorbilidades se definieron usando criterios preespecificados y validados bibliográficamente. Los niveles de potasio sérico y otros datos relevantes de laboratorio se obtuvieron de los registros electrónicos de laboratorio. Los principales resultados de interés, causas de mortalidad y enfermedad renal terminal fueron comprobados y vinculados a nuestro registro de ERC. Los pacientes fueron seguidos desde su fecha de inclusión en el registro (fecha de la segunda medición de FGe) hasta el 1 de febrero del 2017.
Análisis estadísticoLas variables categóricas se expresaron como número y porcentaje, y las variables continuas como media ± desviación típica, o mediana y rango intercuartílico según se ajustasen o no a la distribución normal. La comparación de valores medios entre los distintos grupos de pacientes se llevó a cabo mediante el análisis de varianza (ANOVA), con la corrección de Bonferroni. La asociación entre variables continuas y categóricas se llevó a cabo mediante las pruebas de la t de Student y de la chi al cuadrado, respectivamente. Con los resultados obtenidos se llevó a cabo un análisis de regresión logística multivariante con objeto de determinar cuáles eran las variables predictoras independientes que actúan como factores de riesgo para el desarrollo de hiperpotasemia. El análisis de supervivencia y la significación estadística de las distintas curvas se llevaron a cabo mediante el método de Kaplan-Meier y pruebas Log Rank, respectivamente. Se consideró estadísticamente significativa una p < 0,05.
ResultadosSe evaluaron datos de 2.629 pacientes, el 66,8% varones con una edad media de 64,7 (56,4-75,6) años y un 33,2% mujeres con una edad media de 64,8 (54,9-76,9) años. El período medio de seguimiento fue de 3,2 (1,4-6,1) años.
Los valores medios de K sérico fueron: 4,6 mmol/l; 4,7 mmol/l; 4,8 mmol/l, y 4,8 mmol/l para estadios 3a, 3b, 4 y 5 del grupo de ERC, y 4,7 mmol/l y 4,5 mmol/l, en los grupos de HD y DPCA, respectivamente.
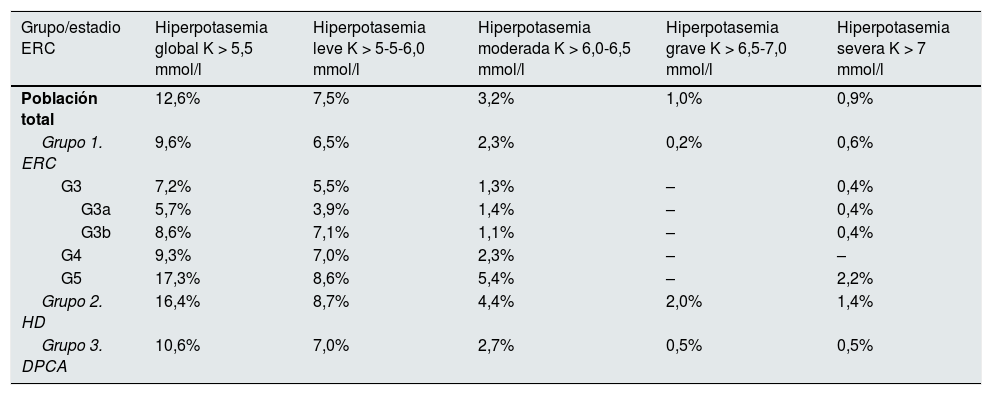
PrevalenciaEn el conjunto global de la población analizada, la prevalencia de hiperpotasemia (K > 5,5 mmol/l) fue del 12,6%. Por subgrupos poblacionales la prevalencia observada fue: en el grupo de ERC, del 9,6%; en el grupo de HD, del 16,4%, y en el grupo de DPCA, del 10,6%. En razón de su severidad, los porcentajes de prevalencia observados en el total de la población analizada fueron: el 7,5, el 3,2, el 1,0 y el 0,9% para niveles de potasemia leve, moderada, grave y severa, respectivamente. La tabla 1 refleja la distribución de la prevalencia de la hiperpotasemia por grupos poblacionales, estadios de ERC y grado de severidad de la hiperpotasemia.
Prevalencia de hiperpotasemia en población con ERC
| Grupo/estadio ERC | Hiperpotasemia global K > 5,5 mmol/l | Hiperpotasemia leve K > 5-5-6,0 mmol/l | Hiperpotasemia moderada K > 6,0-6,5 mmol/l | Hiperpotasemia grave K > 6,5-7,0 mmol/l | Hiperpotasemia severa K > 7 mmol/l |
|---|---|---|---|---|---|
| Población total | 12,6% | 7,5% | 3,2% | 1,0% | 0,9% |
| Grupo 1. ERC | 9,6% | 6,5% | 2,3% | 0,2% | 0,6% |
| G3 | 7,2% | 5,5% | 1,3% | – | 0,4% |
| G3a | 5,7% | 3,9% | 1,4% | – | 0,4% |
| G3b | 8,6% | 7,1% | 1,1% | – | 0,4% |
| G4 | 9,3% | 7,0% | 2,3% | – | – |
| G5 | 17,3% | 8,6% | 5,4% | – | 2,2% |
| Grupo 2. HD | 16,4% | 8,7% | 4,4% | 2,0% | 1,4% |
| Grupo 3. DPCA | 10,6% | 7,0% | 2,7% | 0,5% | 0,5% |
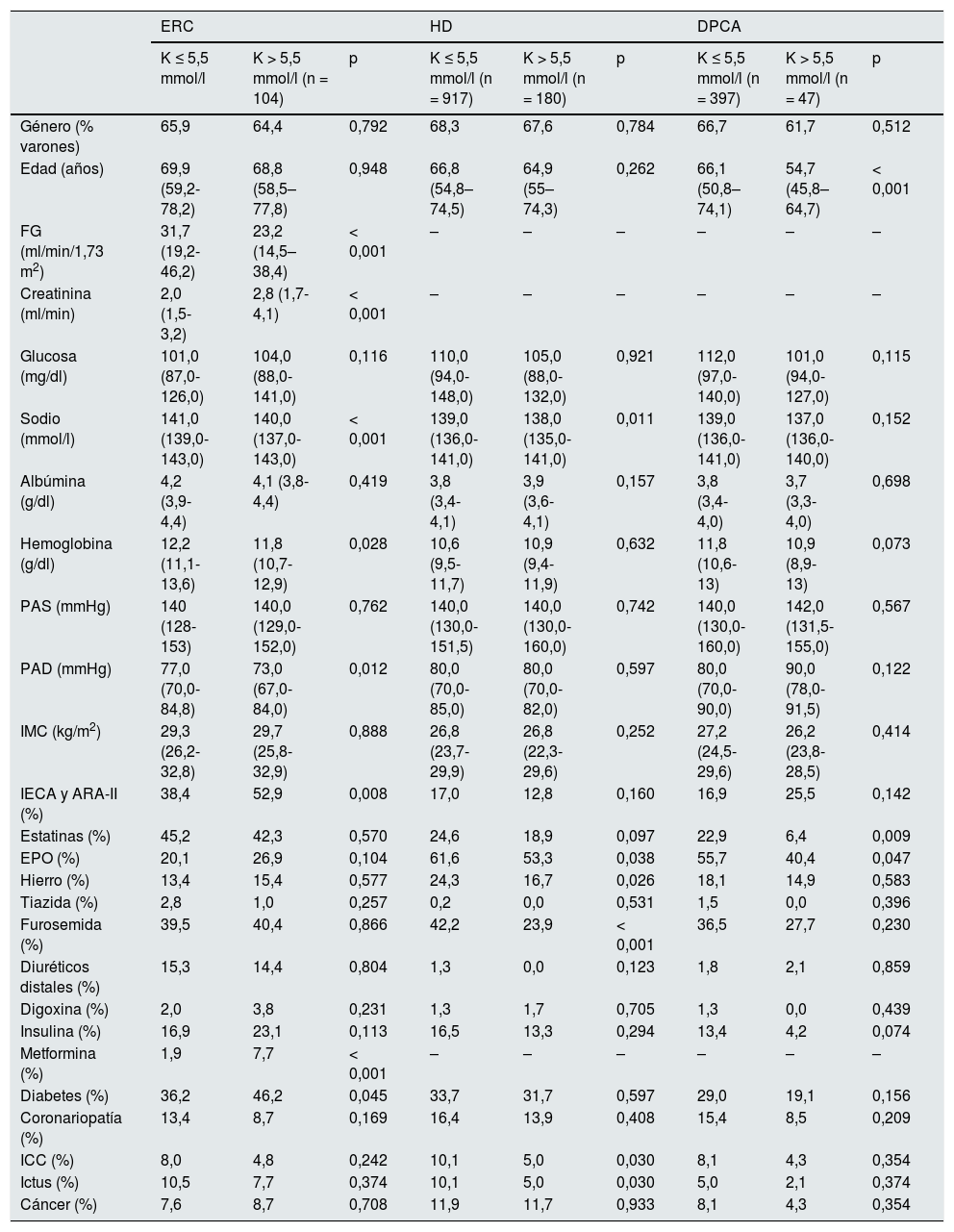
En el análisis univariante, fueron factores de riesgo relacionados con la aparición de hiperpotasemia los siguientes: en el conjunto global de la población analizada, el FGe, los niveles plasmáticos de creatinina, sodio y hemoglobina, la presión arterial diastólica (PAD), el tratamiento con estatinas, furosemida y metformina, así como la presencia de insuficiencia cardiaca congestiva (ICC). En el grupo de pacientes con ERC, el FG, los niveles de creatinina, sodio y hemoglobina, la PAD, el tratamiento con inhibidores de la enzima de conversión de la angiotensina (IECA) o antagonistas de receptores de angiotensina ii (ARA-II) y con metformina, así como la presencia de DM. En el grupo de HD los niveles de sodio plasmático, el tratamiento con eritropoyetina, hierro y furosemida, así como los antecedentes de ICC e ictus. Por último, en el grupo de pacientes en régimen de DPCA, fueron significativos la edad y el tratamiento farmacológico con estatinas y eritropoyetina. La tabla 2 recoge el detalle, por grupos poblacionales, de los distintos factores analizados.
Principales factores relacionados con el desarrollo de hiperpotasemia en los distintos grupos poblacionales
| ERC | HD | DPCA | |||||||
|---|---|---|---|---|---|---|---|---|---|
| K ≤ 5,5 mmol/l | K > 5,5 mmol/l (n = 104) | p | K ≤ 5,5 mmol/l (n = 917) | K > 5,5 mmol/l (n = 180) | p | K ≤ 5,5 mmol/l (n = 397) | K > 5,5 mmol/l (n = 47) | p | |
| Género (% varones) | 65,9 | 64,4 | 0,792 | 68,3 | 67,6 | 0,784 | 66,7 | 61,7 | 0,512 |
| Edad (años) | 69,9 (59,2-78,2) | 68,8 (58,5–77,8) | 0,948 | 66,8 (54,8–74,5) | 64,9 (55–74,3) | 0,262 | 66,1 (50,8–74,1) | 54,7 (45,8–64,7) | < 0,001 |
| FG (ml/min/1,73 m2) | 31,7 (19,2-46,2) | 23,2 (14,5–38,4) | < 0,001 | – | – | – | – | – | – |
| Creatinina (ml/min) | 2,0 (1,5-3,2) | 2,8 (1,7-4,1) | < 0,001 | – | – | – | – | – | – |
| Glucosa (mg/dl) | 101,0 (87,0-126,0) | 104,0 (88,0-141,0) | 0,116 | 110,0 (94,0-148,0) | 105,0 (88,0-132,0) | 0,921 | 112,0 (97,0-140,0) | 101,0 (94,0-127,0) | 0,115 |
| Sodio (mmol/l) | 141,0 (139,0-143,0) | 140,0 (137,0-143,0) | < 0,001 | 139,0 (136,0-141,0) | 138,0 (135,0-141,0) | 0,011 | 139,0 (136,0-141,0) | 137,0 (136,0-140,0) | 0,152 |
| Albúmina (g/dl) | 4,2 (3,9-4,4) | 4,1 (3,8-4,4) | 0,419 | 3,8 (3,4-4,1) | 3,9 (3,6-4,1) | 0,157 | 3,8 (3,4-4,0) | 3,7 (3,3-4,0) | 0,698 |
| Hemoglobina (g/dl) | 12,2 (11,1-13,6) | 11,8 (10,7-12,9) | 0,028 | 10,6 (9,5-11,7) | 10,9 (9,4-11,9) | 0,632 | 11,8 (10,6-13) | 10,9 (8,9-13) | 0,073 |
| PAS (mmHg) | 140 (128-153) | 140,0 (129,0-152,0) | 0,762 | 140,0 (130,0-151,5) | 140,0 (130,0-160,0) | 0,742 | 140,0 (130,0-160,0) | 142,0 (131,5-155,0) | 0,567 |
| PAD (mmHg) | 77,0 (70,0-84,8) | 73,0 (67,0-84,0) | 0,012 | 80,0 (70,0-85,0) | 80,0 (70,0-82,0) | 0,597 | 80,0 (70,0-90,0) | 90,0 (78,0-91,5) | 0,122 |
| IMC (kg/m2) | 29,3 (26,2-32,8) | 29,7 (25,8-32,9) | 0,888 | 26,8 (23,7-29,9) | 26,8 (22,3-29,6) | 0,252 | 27,2 (24,5-29,6) | 26,2 (23,8-28,5) | 0,414 |
| IECA y ARA-II (%) | 38,4 | 52,9 | 0,008 | 17,0 | 12,8 | 0,160 | 16,9 | 25,5 | 0,142 |
| Estatinas (%) | 45,2 | 42,3 | 0,570 | 24,6 | 18,9 | 0,097 | 22,9 | 6,4 | 0,009 |
| EPO (%) | 20,1 | 26,9 | 0,104 | 61,6 | 53,3 | 0,038 | 55,7 | 40,4 | 0,047 |
| Hierro (%) | 13,4 | 15,4 | 0,577 | 24,3 | 16,7 | 0,026 | 18,1 | 14,9 | 0,583 |
| Tiazida (%) | 2,8 | 1,0 | 0,257 | 0,2 | 0,0 | 0,531 | 1,5 | 0,0 | 0,396 |
| Furosemida (%) | 39,5 | 40,4 | 0,866 | 42,2 | 23,9 | < 0,001 | 36,5 | 27,7 | 0,230 |
| Diuréticos distales (%) | 15,3 | 14,4 | 0,804 | 1,3 | 0,0 | 0,123 | 1,8 | 2,1 | 0,859 |
| Digoxina (%) | 2,0 | 3,8 | 0,231 | 1,3 | 1,7 | 0,705 | 1,3 | 0,0 | 0,439 |
| Insulina (%) | 16,9 | 23,1 | 0,113 | 16,5 | 13,3 | 0,294 | 13,4 | 4,2 | 0,074 |
| Metformina (%) | 1,9 | 7,7 | < 0,001 | – | – | – | – | – | – |
| Diabetes (%) | 36,2 | 46,2 | 0,045 | 33,7 | 31,7 | 0,597 | 29,0 | 19,1 | 0,156 |
| Coronariopatía (%) | 13,4 | 8,7 | 0,169 | 16,4 | 13,9 | 0,408 | 15,4 | 8,5 | 0,209 |
| ICC (%) | 8,0 | 4,8 | 0,242 | 10,1 | 5,0 | 0,030 | 8,1 | 4,3 | 0,354 |
| Ictus (%) | 10,5 | 7,7 | 0,374 | 10,1 | 5,0 | 0,030 | 5,0 | 2,1 | 0,374 |
| Cáncer (%) | 7,6 | 8,7 | 0,708 | 11,9 | 11,7 | 0,933 | 8,1 | 4,3 | 0,354 |
En el análisis de regresión logística multivariante, los factores independientes de riesgo de hiperpotasemia (K > 5,5 mmol/l), en los distintos grupos de pacientes fueron los siguientes:
- -
En el grupo de pacientes con ERC, el FG (OR: 0,962; IC del 95%: 0,944-0,982; p < 0,001), el sodio plasmático (OR: 0,906; IC del 95%: 0,847-0,968; p = 0,004), el uso de IECA o ARA-II (OR: 2,040; IC del 95%: 1,223-3,402; p = 0,006) y el uso de metformina (OR: 6,027; IC del 95%: 2,070-17,547; p = 0,001).
- -
En el grupo de HD, el sodio plasmático (OR: 0,953; IC del 95%: 0,916-0,992; p = 0,017) y el uso de furosemida (OR: 0,443; IC del 95%: 0,306-0,640; p < 0,001).
- -
En el grupo de pacientes en régimen de DPCA, la edad (OR: 0,969; IC del 95%: 0,951-0,987; p = 0,001) y la toma de estatinas (OR: 0,232; IC del 95%: 0,070-0,768; p = 0,017).
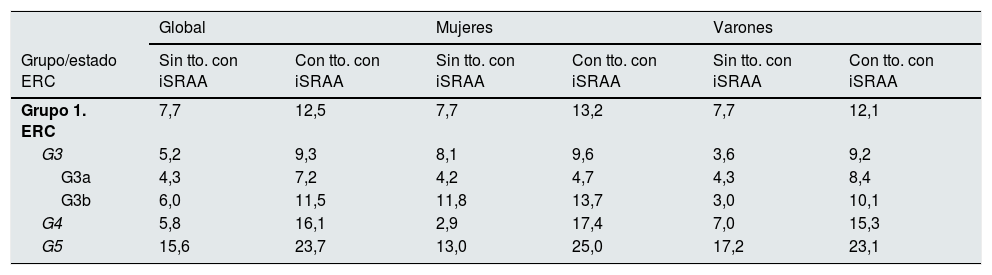
La prevalencia de hiperpotasemia entre pacientes sin o con tratamiento con iSRAA en el grupo 1 de pacientes en ERC fue del 7,7 y el 12,5%, respectivamente. En el análisis por género, entre las mujeres sin o con tratamiento con iSRAA, la prevalencia observada fue del 7,7% vs. 13,2% y entre varones del 7,7% vs. 12,1%. Por estadios de ERC, entre las mujeres, las mayores diferencias de prevalencia se observaron en estadio 4 (2,9% vs. 17,4%) y estadio 5 (13,0% vs. 25,0%) y entre los varones, estadio 3b (3,0% vs. 10,1%) y estadio 4 (7,0% vs. 15,3%). La tabla 3 refleja, para el grupo 1 de pacientes en ERC, la distribución de prevalencias de hiperpotasemia por género y tratamiento con iSRAA en los distintos estadios de la ERC.
Distribución de hiperpotasemia por género y tratamiento con iSRAA en el grupo 1 de ERC
| Global | Mujeres | Varones | ||||
|---|---|---|---|---|---|---|
| Grupo/estado ERC | Sin tto. con iSRAA | Con tto. con iSRAA | Sin tto. con iSRAA | Con tto. con iSRAA | Sin tto. con iSRAA | Con tto. con iSRAA |
| Grupo 1. ERC | 7,7 | 12,5 | 7,7 | 13,2 | 7,7 | 12,1 |
| G3 | 5,2 | 9,3 | 8,1 | 9,6 | 3,6 | 9,2 |
| G3a | 4,3 | 7,2 | 4,2 | 4,7 | 4,3 | 8,4 |
| G3b | 6,0 | 11,5 | 11,8 | 13,7 | 3,0 | 10,1 |
| G4 | 5,8 | 16,1 | 2,9 | 17,4 | 7,0 | 15,3 |
| G5 | 15,6 | 23,7 | 13,0 | 25,0 | 17,2 | 23,1 |
Dentro de grupo 1 de pacientes en ERC, la prevalencia de hiperpotasemia observada entre pacientes diabéticos sin tratamiento con iSRAA o en tratamiento con dichos fármacos fue del 7,6 y el 17,3%, respectivamente. Entre los pacientes con insuficiencia cardiaca de este mismo grupo, las prevalencias observadas fueron del 3,4% entre aquellos pacientes sin tratamiento con iSRAA y del 11,5% entre aquellos con tratamiento con dichos fármacos.
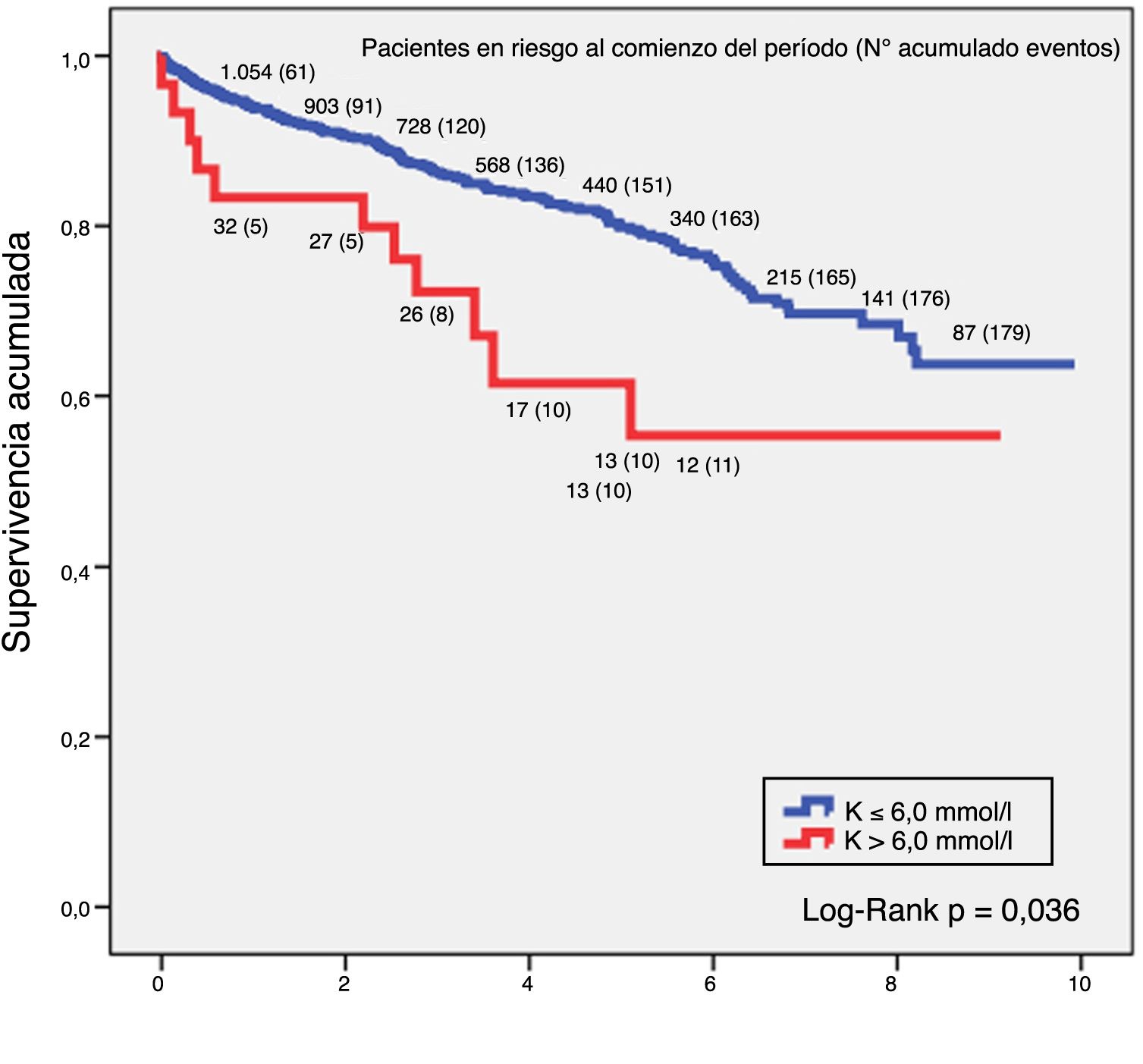
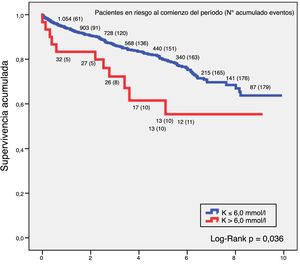
SupervivenciaLa relación entre hiperpotasemia y mortalidad por cualquier causa en el grupo de ERC demostró que valores de potasio por encima de 6,0 mmol/l tenían más riesgo de mortalidad. El análisis de supervivencia mediante la técnica de Kaplan-Meier en este grupo de pacientes constató que para un K > 6,0 mmol/l la supervivencia a 5 años era del 64,5% y a 10 años del 59,1%, y para un nivel de K ≤ 6,0 mmol/l, la supervivencia a 5 años ascendía al 80,6% y a 10 años al 69,1%, siendo la diferencia entre ambas curvas estadísticamente significativa (log-rank p = 0,036). La figura 1 refleja estos resultados.
DiscusiónEn nuestro estudio, la prevalencia global de hiperpotasemia observada en población con ERC fue del 12,6%. Esta prevalencia aumenta en estadio 5 de ERC, no en diálisis, hasta el 25,0% en mujeres y al 23,1% en varones en tratamiento con iSRAA. Extrapolando estos resultados al total de la población española, podemos cuantificar que alrededor de 500.000 personas con ERC presentan hiperpotasemia, cifra cuya magnitud debiera hacer reflexionar sobre las medidas a adoptar. La prevalencia de la hiperpotasemia en población general es baja (2%-3%)8. En la ERC, los datos sobre prevalencia son dispares, señalándose tasas de prevalencia entre un 40-50%, en función del tamaño y la estructura poblacional analizada, del estadio de ERC, del punto de corte establecido para la definición de hiperpotasemia (> 5 o > 5,5 mmol/l) y de las comorbilidades concomitantes con la ERC, correspondiendo las mayores tasas de prevalencia a estadios avanzados de ERC, pacientes diabéticos, receptores de trasplante renal y pacientes tratados con iSRAA8. En un reciente estudio, Latts et al.9 evaluaron la prevalencia de hiperpotasemia en aproximadamente 1,7 millones de pacientes con ERC, estadios 3 y 4 e insuficiencia cardiaca concomitante, señalando, por una parte, que al menos el 47,6% de los pacientes había presentado un episodio de hiperpotasemia y, por otro lado, que la concurrencia en estos pacientes con ERC de DM o insuficiencia cardiaca incrementaba el riesgo de hiperpotasemia entre 2,5-5,6 veces.
Tal como se ha constatado en múltiples estudios, nuestros resultados confirman una relación inversa entre el FG y el nivel de hiperpotasemia, de tal forma que a medida que progresa la enfermedad renal y disminuye el FG, crecen los niveles de potasio sérico. Así, la prevalencia global de hiperpotasemia en el grupo de ERC era del 9,6%, (7,2% en estadio 3, 9,3% en estadio 4 y 17,3% en estadio 5). Incluso dentro del estadio 3 observamos este mismo patrón de relación inversa entre FGe y K sérico, de tal forma que la prevalencia en estadio 3a era del 5,7%, incrementándose hasta un 8,6% al pasar al estadio 3b. En los grupos con terapia renal sustitutiva, las prevalencias eran del 16,4% en el grupo de HD y del 10,6% en el grupo de DPCA. De la misma forma, entre los distintos grados de severidad de hiperpotasemia —leve, moderada, grave y severa— se observa esta misma relación de dependencia entre FGe y el nivel de potasio sérico.
Con relación a los factores demográficos asociados al desarrollo de hiperpotasemia, los más comúnmente señalados son género y edad. En cuanto al género, diversos estudios señalan el sexo masculino como un factor de riesgo independiente10-12. Nuestros resultados son coherentes con estos datos, de tal forma que los porcentajes de varones y mujeres que presentaron hiperpotasemia en el conjunto global de la población fueron del 65,6% vs. 34,4% (ratio 1,9:1). Por subgrupos de poblaciones, se mantuvo prácticamente esta misma proporción: 64,4% vs. 35,6% en el grupo de ERC; 67,2% vs. 32,8% en el grupo de HD y 61,7% vs. 38,3% en el grupo de DPCA.
A pesar de este desequilibrio a favor del género masculino, por lo que se refiere a la prevalencia de la hiperpotasemia por género, diversos estudios reflejan cifras contradictorias, probablemente debidos a diferencias en la metodología seguida, hábitos alimenticios, comorbilidades concomitantes, etc. Así, en un amplio estudio de Epstein et al.13, sobre 195.000 pacientes en tratamiento con iSRAA, las prevalencias de hiperpotasemia observadas fueron del 52,6% en mujeres y el 47,2% en varones. En otro estudio de Einhorn et al.3 sobre la frecuencia de hiperpotasemia y su importancia en la ERC realizado con 245.808 pacientes, se reflejan prevalencias del 14,0% en varones y el 7,3% en mujeres. Nuestro estudio refleja prevalencias de hiperpotasemia similares entre ambos sexos: 9,9% en mujeres vs. 9,4% en varones en el grupo 1 de ERC, 16,9% en mujeres vs. 16,2% en varones en el grupo 2 de HD y 11,9% en mujeres vs. 9,9% en varones en el grupo 3 de DPCA. No obstante, y a diferencia de los estudios mencionados, en nuestros resultados, no encontramos significación estadística al género como factor asociado al desarrollo de hiperpotasemia. Por lo que se refiere a la edad, el mencionado estudio de Latts et al.9 señalaba que la prevalencia de hiperpotasemia en pacientes con comorbilidades similares y edad ≥ 65 años duplicaba prácticamente a la de menores de dicha edad. En nuestros resultados, no encontramos diferencias esenciales de edad entre los distintos grupos poblacionales. Como factor de riesgo independiente, no hallamos asociación estadística significativa entre la edad y la aparición de hiperpotasemia, salvo en el caso del grupo de DPCA, en la que, a diferencia de lo que dice la literatura, encontramos una relación inversa entre hiperpotasemia y edad (OR: 0,969; IC del 95%: 0,951-0,987; p = 0,001), lo que podría atribuirse a una dieta más liberal en los pacientes más jóvenes. La población anciana es más susceptible al desarrollo de hiperpotasemia debido por una parte a la disminución de la secreción de renina y aldosterona que da origen a la aparición de un hipoaldosteronismo hiporreninémico y, de otro lado, al mayor número de comorbilidades concurrentes en esta población para cuyo tratamiento es habitual el consumo de fármacos con efectos hipercalemiantes como AINE y principalmente los iSRAA14,15. En nuestro estudio, no observamos diferencias significativas en la prevalencia de hiperpotasemia en pacientes con edad ≥ 70 años, con o sin DM (10,4% vs. 10,8%, p = 0,382).
Nuestro estudio refleja una asociación entre el sodio plasmático y la hiperpotasemia en los grupos de pacientes en ERC y HD, que atribuimos en parte a la hiperglucemia, así como al propio avance de la ERC. La DM se asocia a alteraciones en el metabolismo electrolítico, siendo la disminución del sodio sérico una respuesta osmorreguladora asociada a la hiperglucemia cuya causa puede radicar en la desregulación diabética, o más bien la deficiencia de insulina16,17. Por otro lado, en pacientes en estadios avanzados de ERC los mecanismos adaptativos del riñón para mantener una adecuada homeostasis del sodio resultan insuficientes, lo que puede dar lugar a una depleción o sobrecarga de volumen por pérdida o retención renal de sodio18. En nuestro caso, se produjeron 339 casos de hiponatremia, de los que 305 (90,0%) se encontraban en estadio 5 de ERC y 104 (30,7%) se encontraban en estadio 5 de ERC y a la vez eran diabéticos. Del mismo modo, la incidencia de hiperpotasemia es mayor en pacientes diabéticos que en la población general, siendo el hipoaldosteronismo hiporreninémico más prevalente en nefropatías tubulointersticiales y nefropatías diabéticas, responsable de una reducción de la secreción tubular de K, el factor más usual de hiperpotasemia crónica, normalmente asintomática, en pacientes diabéticos con ERC leve a moderada19-21.
En la práctica clínica los fármacos se consideran como la causa más importante de hiperpotasemia, interfiriendo en la homeostasis del potasio a través de diversos mecanismos, como la disminución de la producción o secreción de aldosterona, inhibiendo la secreción renal de potasio o alterando su distribución intra/extracelular. De todos ellos, la reducción de la excreción renal de potasio debido a la inhibición del SRAA representa el mecanismo más importante por el cual los medicamentos pueden provocar la hiperpotasemia. En los primeros ensayos clínicos con iSRAA la incidencia de hiperpotasemia era en general baja (< 1-2%) Sin embargo, ensayos posteriores con pacientes más heterogéneos reflejaron incidencias de hiperpotasemia entre el 1,9 y el 38,4%. La hiperpotasemia fue más común en pacientes con ERC y su incidencia aumentó con el número de iSRAA recibidos7,8. Al mismo tiempo, en un modelo ajustado observó que la mortalidad por todas las causas asociada a la hiperpotasemia se incrementaba de forma significativa por cada 0,1 mEq/l de incremento del potasio sérico, señalando a los iSRAA como los principales fármacos relacionados con la hiperpotasemia. La evidencia sugiere la existencia de una relación en forma de U entre el potasio sérico y la mortalidad, donde tanto niveles bajos o elevados de potasio sérico se asocian a un aumento en la mortalidad cardiovascular y por todas las causas. En esta asociación en forma de U, la mortalidad asociada a la hiperpotasemia se observa un punto de inflexión para niveles de K ≥ 6,0 mmol/l, a partir del cual se produce un importante incremento del riesgo de mortalidad, circunstancia por la cual nuestro análisis de supervivencia se ha llevado a cabo comparando valores inferiores o superiores a dicho nivel11,22,23.
Nuestros resultados señalaron exclusivamente a 2fármacos como factores de riesgo independientes para el desarrollo de la hiperpotasemia: la metformina (OR: 5,269; IC del 95%: 1,768-15,708; p = 0,003) y los IECA o ARA-II (OR: 2,206; IC del 95%: 1,311-3,711; p = 0,003), en ambos casos dentro del grupo 1 de pacientes con ERC.
La incidencia de acidosis láctica por metformina es escasa, 3-10 casos por 100.000 pacientes-año en población con ERC24,25, por lo que dado el período de seguimiento de nuestro estudio (11.699,8 pacientes-año), el número de casos de acidosis láctica habrá sido muy escaso y su influencia sobre el potasio, irrelevante. En las acidosis inorgánicas (hiperclorémicas o con anión gap normal), los hidrogeniones del medio extracelular entran en la célula y se produce una salida pasiva de potasio al medio extracelular para mantener la electroneutralidad. Este fenómeno es menos acusado en las acidosis con anión gap aumentado producidas por ácidos orgánicos (como es el caso de la acidosis láctica por metformina), ya que estos aniones orgánicos son más permeables y penetran más fácilmente en las células, con lo que reducen el gradiente eléctrico favorable a la salida de potasio de la célula. La hiperpotasemia asociada a DM incluye acidosis (por cada 0,1 de caída en pH, el potasio aumenta aproximadamente 0,4-0,6 mmol/l)21,26. A pesar de que en nuestro estudio, en el grupo de ERC, observamos una diferencia significativa en los niveles séricos de K entre pacientes tratados con metformina respecto aquellos sin dicho tratamiento (5,1 ± 0,6 mmol/l vs. 4,7 ± 0,7 mmol/l, p = 0,001), consideramos improbable que la hiperpotasemia estuviera asociada a la metformina, sino que es una consecuencia de la hiperpotasemia asociada a la propia DM.
Los iSRAA, tales como los IECA, los bloqueadores de receptores de aldosterona, los ARA-II y los inhibidores directos de la renina, han demostrado su eficacia en el tratamiento de la insuficiencia cardiaca y la DM, así como en la reducción de la presión arterial y la proteinuria, retardando la progresión de la ERC. Por el contrario, su uso se halla asociado a diversos eventos adversos entre los que se incluye la hiperpotasemia, lo que puede ocurrir en cualquier nivel de la función renal, aunque se considera que existe mayor riesgo en pacientes con ERC e insuficiencia cardiaca27, lo cual plantea un importante dilema terapéutico entre el riesgo/beneficio derivado de su uso, pudiendo llegar a limitar o infrautilizar este tipo de fármacos, precisamente en aquellos pacientes en los que se espera obtener mayor beneficio7,12,19,28-31. Epstein et al. constataron que en pacientes a dosis máximas de iSRAA, tras un episodio de hiperpotasemia moderada a severa, se produjo una reducción de dosis o una discontinuación del tratamiento en casi el 50% de los casos. Igualmente, la reducción de dosis o descontinuación del tratamiento, en pacientes con ERC, en estadios 3 y 4, supuso un incremento de efectos adversos de 5-7%, así como una duplicación de las tasas de mortalidad32.
Algunos estudios señalan que la hiperpotasemia secundaria al tratamiento con iSRAA ocurre en el 10-38% de los pacientes hospitalizados y en aproximadamente el 10% de los pacientes ambulatorios dentro del año siguiente al inicio del tratamiento19. Igualmente, se ha informado que la adición de un antagonista mineralocorticoide a un IECA/ARA-II duplica el riesgo de hiperpotasemia33. Otros estudios señalan que el riesgo de hiperpotasemia con iSRAA en monoterapia es bajo (< 2%) en pacientes sin factores predisponentes, aunque crece cuando se combinan varios fármacos (< 5%), y aún más si se utilizan en pacientes con factores de riesgo adicionales, como edad elevada, DM, ERC, especialmente con FGe < 30ml por min, hipertensión arterial o insuficiencia cardiaca (del 5 al 10%). Igualmente, se apunta que dicho riesgo puede ser ligeramente inferior en ARA-II en comparación con IECA34.
Algunos estudios, como CHARM-Added35 y EPHESUS36, han demostrado no solo los beneficios del tratamiento con combinaciones de iSRAA, sino que esos beneficios se mantienen incluso en los pacientes con mayor riesgo de desarrollar hiperpotasemia37-39, por lo que se concluye que el riesgo de desarrollar hiperpotasemia no es razón suficiente para negar a los pacientes los beneficios que es probable que logren mediante el uso de estos agentes. Ante estas discrepancias y para minimizar los riesgos asociados con su ingesta y prevenir la hiperpotasemia, la vigente guía para la evaluación y el manejo de la enfermedad renal recomienda evaluar la tasa de FG y el K sérico dentro de la semana siguiente al inicio del tratamiento con IECA/ARA-II, independientemente del nivel basal de potasio, así como evaluar si el paciente tiene una ingesta excesiva de potasio de la dieta o recibe tratamiento con otros fármacos hipercalemiantes40.
Nuestros resultados demuestran que el tratamiento con iSRAA incrementa sustancialmente la prevalencia de hiperpotasemia. Así, en el grupo 1 de pacientes con ERC, la prevalencia de los pacientes sin tratamiento con iSRAA era del 7,7%, mientras que la de pacientes con dicho tratamiento era del 12,5%. Así mismo, dentro de este mismo grupo de pacientes, comparando los pacientes sin o con tratamiento con iSRAA, observamos un incremento de la hiperpotasemia a medida que declina la función renal (5,2% vs. 9,3% en estadio 3, 5,8% vs. 16,1% en estadio 4 y 15,6% vs. 23,7% en estadio 5). En lo que se refiere a las diferencias de prevalencia por género, nuestros resultados, a diferencia de otros que señalan mayores prevalencias de hiperpotasemia en varones tratados con iSRAA que en mujeres41, reflejan una práctica igualdad de prevalencia entre géneros, incluso algo superior en las mujeres (7,7% vs.12,1% en varones y 7,7% vs. 13,2% en mujeres), lo que achacamos al pequeño número de pacientes.
El tratamiento actual de la hiperpotasemia suele consistir en la adopción de medidas higiénico-dietéticas, la suspensión o la limitación de medicamentos hipercalemiantes como los iSRAA32 y el uso de resinas de intercambio y diuréticos. Las resinas de intercambio catiónico constituyen el tratamiento predominante en la actualidad, si bien cuentan con importantes efectos adversos gastrointestinales42. Además, las formas orales de presentación de estas resinas suelen tener un desagradable sabor que no favorece la adherencia al tratamiento43,44.
En los últimos tiempos se han desarrollado 2nuevos quelantes de potasio, patiromer45 y ZS-946, que en fase de ensayo han demostrado buenos perfiles de eficacia y seguridad en el tratamiento de la hiperpotasemia, así como para el mantenimiento de la normopotasemia, sin la reducción de la dosis o la suspensión de los iSRAA, lo que podría beneficiar a pacientes con hiperpotasemias leves que han visto interrumpido su tratamiento con iSRAA, o a quienes no les ha sido pautada dicha terapia ante el temor de desarrollo de hiperpotasemia47. Sin embargo, en los ensayos que avalan estos fármacos quedaron excluidos los pacientes con hiperpotasemias > 6,5 mmol/l y pacientes en diálisis, por lo que la práctica clínica a largo plazo será la avale su eficacia.
La principal debilidad de nuestro estudio radica en su carácter observacional y retrospectivo. Otras limitaciones que pueden achacarse al mismo, aunque consideramos que no afectan sustancialmente al objetivo del estudio, pueden ser la ausencia de determinación de la acidosis metabólica, el no haber recogido el uso de antagonistas del receptor mineralocorticoide, el hecho de basarnos en una única determinación del potasio sérico y la determinación del mismo en los pacientes en tratamiento renal sustitutivo al mes de inicio del mismo, así como la falta de ajuste por posibles factores de confusión en el análisis de supervivencia. Como principales ventajas, además del amplio período analizado, hay que señalar que hemos analizado una cohorte amplia y representativa de todo el espectro de la ERC de un solo centro.
Concluimos que la hiperpotasemia es una alteración metabólica frecuente en pacientes con ERC, dependiente del FG y asociada a mayor mortalidad. Esta complicación aumenta en presencia de fármacos con propiedades beneficiosas cardiorrenales (IECA/ARA-II) por lo que en muchos casos los pacientes pierden el beneficio asociado a estos fármacos. En los últimos tiempos han surgido nuevos compuestos no absorbibles, que llevan a cabo un intercambio catiónico selectivo entre sodio/calcio y potasio a nivel gastrointestinal, limitando la reabsorción e incrementando la excreción fecal de este último, manteniendo el beneficio cardiorrenal de los iSRAA, pudieran ser relevantes en la evolución de los pacientes con ERC. En todo caso, se precisan ensayos adicionales aleatorizados de control, así como la constatación de su eficacia por parte de la práctica clínica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.