Si bien la enfermedad renal diabética es la causa más frecuente de enfermedad renal crónica avanzada1,2, en estos pacientes con hemodiálisis de mantenimiento las opciones terapéuticas a día hoy son limitadas. Los agonistas del receptor de GLP-1 (AR-GLP-1) contribuyen a mejorar el control glucémico, reduciendo la hemoglobina glicada (HbA1c)3. Además muestran otros efectos beneficiosos: sensación de saciedad, pérdida de peso, aumento de la nutriuresis, reducción de la presión arterial, descenso de la albuminuria y ralentización de la progresión de la enfermedad renal diabética4,5. Sin embargo, el uso en población en hemodiálisis es escasa.
Presentamos el caso de un varón de 56 años con hipertensión, enfermedad pulmonar obstructiva crónica, enfermedad renal crónica avanzada en prediálisis, diabetes mellitus de tipo 2 en tratamiento con 32 UI de insulina detemir, 3mg de repaglinida y 5mg de linaglitpina al día, con una HbA1c de 8,5% y un IMC de 36,5kg/m2. En enero del 2021 inició hemodiálisis incremental con una sesión/semanal (240 min) con dializador de triacetato de celulosa asimétrico (1,9?m2) (ATA®) por sintomatología urémica, mal control tensional e hiperpotasemia moderada-grave. La creatinina sérica era de 6,97mg/dl (tasa de filtración glomerular estimada, utilizando la fórmula CKD-EPI, de 8,48ml/min/1,73 m2), aclaramiento de creatinina (ClCr) y urea (KrU) medidos mediante orina de 24 h de 16 y 5,84ml/min/1,73 m2, respectivamente. El índice de filtrado glomerular medido mediante la semisuma del ClCr y KrU fue de 10,92ml/min/1,73 m2 y el cociente albúmina/creatinina de 3.200mg/g.
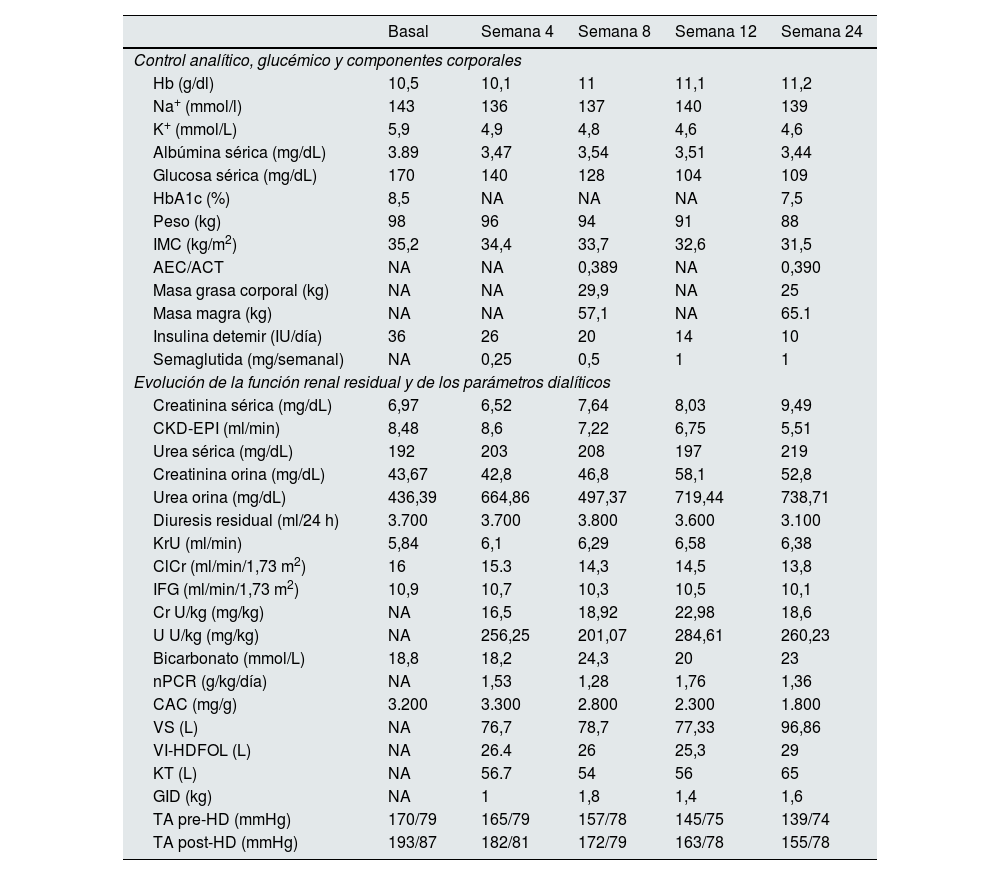
Para optimizar el control glucémico se añadió semaglutida (0,25mg/semanal) al tratamiento y se suspendieron linagliptina y repaglinida. Las dosis fueron aumentándose progresivamente hasta 1mg en las 12 semanas, con buena tolerancia y sin episodios de hipoglucemia, y se fue reduciendo de forma paulatina la dosis de insulina. A las 24 semanas, la HbA1c disminuyó un 23,5%, el peso un 10,2% y el IMC un 10,5%. Además, el paciente presentó un descenso del 16,4% y 12,2% en la masa grasa y en el agua corporal total, respectivamente. Por el contrario, aumentó la masa magra en un 14% (tabla 1). Por otro lado, el índice de filtrado glomerular se mantuvo sin cambios a lo largo del periodo observado. Sin embargo, ambos parámetros (KrU y ClCr) presentaron una evolución diferente en apariencia, aumentando y disminuyendo, respectivamente. La excreción de creatinina en orina, normalizada a kilo de peso, se incrementó y se mantuvo estable la de urea. También se observó un descenso de la presión arterial y del cociente albúmina/creatinina (tabla 1).
Control evolutivo analítico y parámetros de hemodiálisis
| Basal | Semana 4 | Semana 8 | Semana 12 | Semana 24 | |
|---|---|---|---|---|---|
| Control analítico, glucémico y componentes corporales | |||||
| Hb (g/dl) | 10,5 | 10,1 | 11 | 11,1 | 11,2 |
| Na+ (mmol/l) | 143 | 136 | 137 | 140 | 139 |
| K+ (mmol/L) | 5,9 | 4,9 | 4,8 | 4,6 | 4,6 |
| Albúmina sérica (mg/dL) | 3.89 | 3,47 | 3,54 | 3,51 | 3,44 |
| Glucosa sérica (mg/dL) | 170 | 140 | 128 | 104 | 109 |
| HbA1c (%) | 8,5 | NA | NA | NA | 7,5 |
| Peso (kg) | 98 | 96 | 94 | 91 | 88 |
| IMC (kg/m2) | 35,2 | 34,4 | 33,7 | 32,6 | 31,5 |
| AEC/ACT | NA | NA | 0,389 | NA | 0,390 |
| Masa grasa corporal (kg) | NA | NA | 29,9 | NA | 25 |
| Masa magra (kg) | NA | NA | 57,1 | NA | 65.1 |
| Insulina detemir (IU/día) | 36 | 26 | 20 | 14 | 10 |
| Semaglutida (mg/semanal) | NA | 0,25 | 0,5 | 1 | 1 |
| Evolución de la función renal residual y de los parámetros dialíticos | |||||
| Creatinina sérica (mg/dL) | 6,97 | 6,52 | 7,64 | 8,03 | 9,49 |
| CKD-EPI (ml/min) | 8,48 | 8,6 | 7,22 | 6,75 | 5,51 |
| Urea sérica (mg/dL) | 192 | 203 | 208 | 197 | 219 |
| Creatinina orina (mg/dL) | 43,67 | 42,8 | 46,8 | 58,1 | 52,8 |
| Urea orina (mg/dL) | 436,39 | 664,86 | 497,37 | 719,44 | 738,71 |
| Diuresis residual (ml/24 h) | 3.700 | 3.700 | 3.800 | 3.600 | 3.100 |
| KrU (ml/min) | 5,84 | 6,1 | 6,29 | 6,58 | 6,38 |
| ClCr (ml/min/1,73 m2) | 16 | 15.3 | 14,3 | 14,5 | 13,8 |
| IFG (ml/min/1,73 m2) | 10,9 | 10,7 | 10,3 | 10,5 | 10,1 |
| Cr U/kg (mg/kg) | NA | 16,5 | 18,92 | 22,98 | 18,6 |
| U U/kg (mg/kg) | NA | 256,25 | 201,07 | 284,61 | 260,23 |
| Bicarbonato (mmol/L) | 18,8 | 18,2 | 24,3 | 20 | 23 |
| nPCR (g/kg/día) | NA | 1,53 | 1,28 | 1,76 | 1,36 |
| CAC (mg/g) | 3.200 | 3.300 | 2.800 | 2.300 | 1.800 |
| VS (L) | NA | 76,7 | 78,7 | 77,33 | 96,86 |
| VI-HDFOL (L) | NA | 26.4 | 26 | 25,3 | 29 |
| KT (L) | NA | 56.7 | 54 | 56 | 65 |
| GID (kg) | NA | 1 | 1,8 | 1,4 | 1,6 |
| TA pre-HD (mmHg) | 170/79 | 165/79 | 157/78 | 145/75 | 139/74 |
| TA post-HD (mmHg) | 193/87 | 182/81 | 172/79 | 163/78 | 155/78 |
AEC/ACT: cociente agua extracelular/agua corporal total; CAC: cociente albúmina/creatinina; ClCr: aclaramiento de creatinina en orina de 24h; Cr U/kg: excreción de creatinina en orina por kilo de peso; GID: ganancia de peso interdialítica; Hb: hemoglobina; Hb1Ac: hemoglobina glicada; HD: hemodiálisis; IFG: índice de filtrado glomerular; IMC: Índice de masa corporal; K+: potasio plasmático; KrU: aclaramiento renal de urea residual; KT: eficacia de tratamiento dialítico; NA: no asignado; Na+: sodio plasmático; nPCR: tasa de catabolismo proteico; PA: presión arterial;U U/kg: excreción de urea en orina por kilo de peso; VI-HDFOL: volumen de infusión en hemodiafiltración en línea; VS: volumen de sangre dializada.
En la actualidad hay pocos informes de casos descritos sobre el uso de semaglutida en pacientes en hemodiálisis convencional6 y, a nuestro entender, no hay ninguno en régimen de hemodiálisis incremental. Este caso describe por primera vez la eficacia y seguridad de semaglutida subcutánea en un paciente diabético y obeso en hemodiálisis incremental con una sesión semanal. Describimos los efectos favorables sobre el control glucémico, el descenso de la HbA1c, el control tensional y la preservación de la función renal residual. A pesar del efecto saciante del fármaco, la ingesta proteica no se ve mermada, como muestra la nPCR> de 1 g/kg al día.
Las nuevas guías de práctica clínica del consorcio KDIGO (Kidney Disease: Improving Global Outcomes) sobre el manejo de la enfermedad renal diabética del 20207 recomiendan la prescripción de los AR-GLP-1 por sus beneficios renales y cardiovasculares comprobados, independientemente de los niveles de HbA1c. Semaglutida estimula la insulina e inhibe la secreción de glucagón en los islotes pancreáticos de manera dependiente de glucosa, lo que conduce a niveles más bajos de glucosa sérica. Por lo tanto, se puede esperar que este agente tenga el mismo efecto hipoglucemiante en pacientes en hemodiálisis y en población diabética general.
En nuestro centro, la pauta de hemodiálisis se ajusta según la función renal residual, considerando un régimen incremental con una sesión semanal en pacientes con KrU> de 4ml/min/1,73 m2, así como otros criterios recogidos en el estudio DIPPI8. En el paciente descrito, el KrU se mantuvo, incluso mejoró, durante el periodo observado. El índice de filtrado glomerular no aumentó debido al «aparente» descenso del ClCr, el cual fue debido al aumento de la masa magra, que condiciona un aumento de la creatinina sérica y el descenso de su aclaramiento. Por el contrario, observamos un interesante aumento de la eliminación de urea y, sobre todo, de la excreción de creatinina por kilo de peso. Este aumento de la excreción pudiera en parte deberse a un aumento de la secreción tubular, lo que facilitaría la eliminación de otras sustancias que a día de hoy son solo eliminadas por secreción tubular, como las toxinas urémicas ligadas a proteínas. Además, el tratamiento con AR-GLP-1 potencia la natriuresis, con lo que mejora el control tensional. Este hecho, junto con la reducción del peso, explicaría el descenso del cociente albúmina/creatinina, algo crucial en el mantenimiento de la función renal residual.
Según nuestra experiencia, creemos que el uso de los AR-GLP-1 en pacientes diabéticos y obesos ayuda a lograr los objetivos de control glucémico, ponderal, tensional y otros beneficios sobre la función renal residual como los aquí descritos. Todo ello produciría una mejora de la morbimortalidad a largo plazo de estos pacientes y facilitaría su inclusión en las listas de espera de trasplante renal.
Responsabilidades éticasEl estudio cumplió con los principios enunciados en la declaración de Helsinki. Los autores declaran que cuenta con el consentimiento informado del sujeto estudiado, y respetan el derecho a la privacidad del paciente. Para esta investigación no se realizaron experimentos en seres humanos ni en animales.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses ni apoyo financiero.