INTRODUCCIÓN
El sistema inmunitario existe porque el ser humano está expuesto a microorganismos frente a los que libra una batalla permanente. Gracias a todo el arsenal celular y humoral que ha desarrollado, puede combatir de forma especializada a todos estos agentes. Esa gran especialización se acompaña de una capacidad excelente de discernir entre aquello que no supone una amenaza y lo que sí, según la teoría del peligro1. En este contexto, el sistema inmunitario reconoce como extraño el aloinjerto, el cual no está previsto en la evolución natural, salvo en el caso del feto, que es el primer y principal tipo de aloinjerto al que se expone el ser humano. Para evitar la pérdida del aloinjerto por el alorreconocimiento y la alorrespuesta que se generan en condiciones normales, contamos con la inmunosupresión farmacológica, la cual ha sido esencial para el éxito y la implantación del trasplante de órganos en la práctica clínica2. A pesar de ello, la inmunosupresión tiene serios efectos adversos motivados en gran mediad por la falta de especificidad inmunológica y entre los que destaca el riesgo de infecciones y de neoplasias, así como el riesgo cardiovascular2. Por ello, en el ámbito del trasplante se persigue conseguir un verdadero estado de tolerancia inmunológica frente al aloinjerto, donde el receptor sea capaz de responder a los agentes infecciosos a que se expone y el riesgo de neoplasia por la inmunosupresión inespecífica disminuya3. Esta tolerancia es específica y los beneficios a largo plazo son claros. Sin embargo, el principal handicap es que no disponemos de biomarcadores clínicos que nos ayuden a determinar el estado de tolerancia en un receptor de un trasplante4.
Por lo anterior, en el campo del trasplante se buscan biomarcadores que nos permitan cumplir cuatro objetivos necesarios para manejar correctamente al receptor de un injerto4,5:
• Medir el nivel de inmunosupresión correcto para evitar efectos adversos.
• Individualizar para cada paciente el tipo de inmunosupresión más conveniente.
• Emplear marcadores moleculares de imagen que permitan anticiparse a la lesión ya establecida clásica de las biopsias.
• Contar con herramientas que puedan predecir la evolución del injerto.
En el ámbito del trasplante renal, la investigación se ha realizado normalmente de forma transversal, donde se han seleccionado pacientes en distintas situaciones clínicas (rechazo agudo, rechazo crónico, tolerancia operacional) y en los que se han aplicado diversos biomarcadores más o menos invasivos. Algunos de estos biomarcadores que demuestran cierta utilidad se intentan validar posteriormente en estudios prospectivos randomizados. Los principales son ensayos clínicos donde se emplean estos biomarcadores en pacientes trasplantados de novo y se compara la inmunosupresión estándar frente a nuevos inmunosupresores o regímenes. También se validan los biomarcadores en ensayos randomizados con pacientes trasplantados estables en los que se decide aplicar tratamientos de minimización de la inmunosupresión. Este tipo de ensayos prospectivos con biomarcadores se realizan en el contexto de grandes consorcios como el RISET (Reprogramming the Immune System for the Establishment of Tolerance) europeo o el ITN (Immune Tolerance Network) americano6.
Los mecanismos de tolerancia en el campo del trasplante pueden ser principalmente cuatro7: deleción, anergia, desviación inmunitaria y supresión. Los dos primeros son pasivos, mientras que los dos últimos suponen mecanismos activos de tolerancia. La deleción puede ocurrir a nivel central (tímica) o en la periferia. La desviación inmunitaria supone la diferenciación hacia los distintos tipos de células Th efectoras, mientras que la supresión hace referencia a las células T reguladoras, fundamentalmente las Treg, pero también otros tipos (Tr1, Th3, T CD8+CD28-…).
Desde el momento de la implantación del órgano del donante en el cuerpo del receptor, se produce un alorreconocimiento de antígenos del donante, denominados aloantígenos, por parte de los linfocitos del receptor. Los principales aloantígenos que son reconocidos son las moléculas del complejo mayor de histocompatibilidad (MHC, por sus siglas en inglés, major histocompatibility complex), que en humanos se denominan antígenos leucocitarios humanos (HLA por sus siglas en inglés, human leukocyte antigen). No obstante, cualquier antígeno que se codifique por genes polimórficos y que dé lugar a distintas proteínas entre sujetos de la misma especie puede ser desencadenante de una respuesta frente al aloinjerto. El alorreconocimiento puede ser de tipo directo de las moléculas incompatibles presentadas por las células presentadoras de antígeno (APC por sus siglas en inglés, antigen presenting cells) del donante o indirecto, donde se presentan los aloantígenos del donante por parte de las APC del receptor que, previamente, las han procesado. En cualquier caso, la célula principal en todo el proceso parece ser la célula T helper (Th) CD4+ del receptor que se activa y genera una serie de citocinas que, según el tipo de estímulo, pueden favorecer una alorrespuesta frente al injerto de tipo celular o de tipo humoral. La activación de la célula T CD4+ depende de tres señales. La primera es la dependiente de la señalización a través del receptor de la célula T (TCR por sus siglas en inglés, T-cell receptor), que confiere especificidad a la respuesta. Sin embargo, esta primera señal es insuficiente para activar completamente la célula T, puesto que requiere de una segunda señal coestimuladora, mediada principalmente a través de CD28 al interaccionar con CD80 y CD86 en la APC. Esta segunda señal produce una activación de la transcripción de genes y, sobre todo, de la interleucina 2 (IL-2), una citocina que interacciona con su receptor en la superficie de la célula T y genera la tercera señal necesaria para inducir la proliferación de los linfocitos T2.
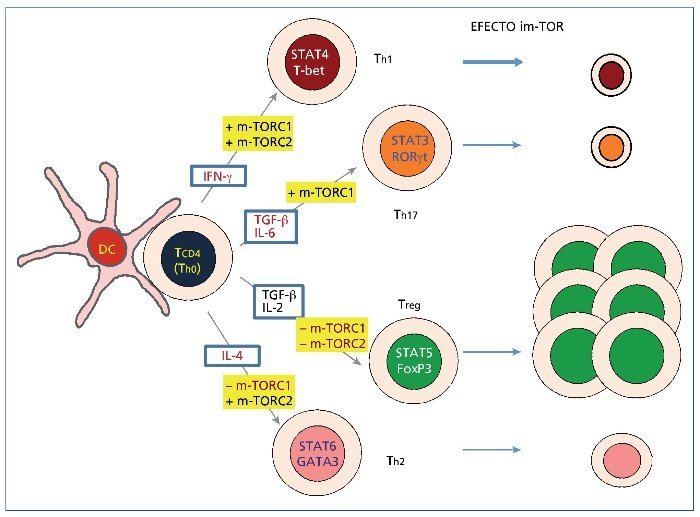
La actual aproximación inmunosupresora, por otro lado, parece ser demasiado general e inespecífica para bloquear una respuesta tan compleja como la inmunitaria, donde cada día se describen nuevos tipos de células T CD4+ (Th1, Th2, Treg, Th3, Th17, Th9…). Estas células están diferenciadas para inducir un tipo de respuesta efectora o supresora en distintas situaciones8. Las células T CD4+ se diferencian de una célula Th0 naive hacia células efectoras Th1, Th2 o Th17, o hacia células T reguladoras (Treg), en función básicamente de las citocinas presentes en el ambiente donde se diferencian (figura 1). Así, el interferón gamma (IFN-γ) facilita la diferenciación hacia Th1, que se define por el factor de transcripción T-bet. La IL-4 favorece la diferenciación hacia Th2 (factor de transcripción GATA-3). El factor de crecimiento transformador beta (TGF-β por sus siglas en inglés, transforming growth factor beta) es capaz de diferenciar hasta tres tipos de células T CD4+ según la otra citocina que se asocie: el TGF-β y la IL-6 inducen diferenciación hacia Th17 (factor de transcripción ROR-γ-T); el TGF-β y la IL-4 inducen Th9 (factores de transcripción PU.1 e IRF-4) y el TGF-β y la IL-2 inducen la diferenciación hacia Treg (factor de transcripción FoxP3). Además, se ha descrito recientemente otro tipo de célula T CD4+ efectora, la Th22, que se induce con la presencia en el medio de citocinas proinflamatorias como la IL-6 y el factor de necrosis tumoral alfa (TNF-α, por sus siglas en inglés, tumour necrosis factoralpha)9.
Figura 1. Diferenciación funcional de los cuatro tipos fundamentales de células Th CD4+ (Th1, Th2, Th17 y Treg). Se muestran las citocinas principales implicadas en su diferenciación y producidas tras el estímulo recibido por la célula Th0 de las células dendríticas presentadoras del antígeno. En cada tipo celular se indican los factores de transcripción que le son propios. En rectángulos de fondo amarillo se muestra el efecto que los dos tipos de complejos m-TOR (m-TORC1 y m-TORC2) inducen en la diferenciación de células Th. A la derecha, se representa esquemáticamente el efecto que el tratamiento con inhibidores de m-TOR como el sirolimus y el everolimus puede tener sobre los cuatro tipos celulares. No se muestran las células Th9 y Th22 por no haber aún evidencia acerca del efecto de los complejos mTOR en su diferenciación. DC: células dendríticas; IFN-γ: interferón gamma; IL: interleucina; m-TOR: diana de la rapamicina en mamíferos; TGF-β: factor de crecimiento transformador beta.
Por otro lado, cada una de estas células Th secreta citocinas necesarias para su función efectora o supresora y para inhibir la diferenciación hacia otro tipo de células Th. De este modo, las células Th1 se caracterizan por secretar fundamentalmente IFN-γ, que por otra parte bloquea la diferenciación hacia Th2 o Th17. De forma semejante, las células Th2 secretan IL-10, que bloquea la diferenciación hacia Th1, e IL-4, que bloquea la diferenciación hacia Th17. Estas secretan IL-17 como citocina efectora, la cual es capaz de bloquear la diferenciación hacia Th1, Th2 o Treg. Finalmente, las células Treg son capaces de inhibir la diferenciación y la función de cualquiera de los tres tipos de células Th efectoras10.
Aunque sean las células T CD4+ las que secretan las citocinas y facilitan o inhiben la diferenciación hacia un tipo celular u otro, son las APC, y especialmente las células dendríticas (DC por sus siglas en inglés, dendritic cells), las que captan las señales de peligro del medio y, al interaccionar con las células T CD4+, dirigen la respuesta hacia una más inflamatoria (Th9, Th1 o Th17) o más inmunorreguladora (Treg, Th3 o Tr1)11. Además, un hecho diferencial y de reciente descripción es la extraordinaria capacidad plástica que tienen los distintos tipos de células Th CD4+, de modo que, en función del tipo de señal de alarma que capten las DC del tejido donde se detecte esa señal y de las citocinas que se produzcan en cada momento, un tipo de célula Th se puede transformar en otro10.
CÉLULAS TH CD4+: EFECTO DE LA INMUNOSUPRESIÓN EN LAS CÉLULAS TREG Y OTRAS CÉLULAS TH
Como se ha mencionado en la introducción, las células T reguladoras son varios subtipos de células con capacidad de supresión de la respuesta inmunitaria a diversos niveles y mediante diferentes mecanismos (contacto dependiente, citocinas antiinflamatorias, etc.). Los tipos de células más estudiados han sido las denominadas Treg, células T CD4+ caracterizadas por la expresión de niveles elevados de CD25 (CD25high) y del factor de transcripción FoxP312. Las células Treg naturales expresan también CD27 y tienen muy baja o ausente expresión de CD127. Estas células tienen un origen central tímico en un porcentaje del 5-10%, que se puede expandir a nivel periférico. Sin embargo, la gran mayoría de ellas adquiere el fenotipo CD+CD25highFoxP3+ en la periferia a partir de células T CD4+ naive y de otros subtipos de células T CD4+, gracias a la plasticidad comentada anteriormente12. Además, existen otros tipos de células T reguladoras de origen periférico, como las células Tr1 y las Th3. Incluso, en la periferia se ha descrito diferenciación de células T CD8+ con función reguladora (CD8+CD28-).
Desde la descripción y la aceptación definitivas de las células Treg como células con capacidad inmunorreguladora en general, su utilidad en la inducción de tolerancia en el ámbito del trasplante ha sido una constante, bien como herramientas tolerogénicas13 o bien como biomarcadores14 para definir la tolerancia frente al aloinjerto. En este sentido, el objetivo del empleo de biomarcadores de tolerancia es definir aquellos pacientes en los que la inmunosupresión puede minimizarse o incluso quitarse sin riesgo de pérdida del injerto. Sin embargo, es posible que cualquier paciente que se defina como no tolerante con una batería de biomarcadores inmunológicos, incluidas las Treg, pueda tener una función renal normal. Es decir, una función normal no tiene por qué acompañarse de un panel de biomarcadores de tolerancia inmunológica. Además, la tolerancia y la inmunosupresión farmacológica total son los dos extremos de la situación que puede ocurrir en un trasplante de órganos como el renal, los cuales nunca se llegan a alcanzar. Existen situaciones intermedias en las que se busca un equilibrio entre la cantidad de inmunosupresión administrada y el grado de alotolerancia que se consigue12. Es posible que la monitorización de biomarcadores, como las Treg, permita establecer el grado de tolerancia/inmunosupresión en el paciente trasplantado.
Existen diversos factores que se deben considerar a la hora de definir biomarcadores15. En el caso del trasplante renal, el primer aspecto destacable es la matriz biológica donde se va a medir. Como en cualquier órgano, la fuente más directa y que aporta mayor información es el propio tejido (biopsia), pero con el gran inconveniente de tratarse del método más invasivo. La fuente biológica menos invasiva probablemente es la orina del trasplantado renal, aunque se trata de un material difícil de recolectar convenientemente y sus cantidades a veces no son suficientes. Además, lo que se detecta en orina suele reflejar lo que ya ha ocurrido en el riñón y quizás no permita predecir eventos futuros. Entre la biopsia y la orina, quizás la matriz con más utilidad sea la sangre puesto que su obtención es mínimamente invasiva y, además, puede ser reflejo de cambios inmunológicos a nivel sistémico que permitan predecir eventos posteriores.
Otro aspecto que se debe considerar en el estudio de los biomarcadores en el trasplante renal es el tipo de metodología que se va a utilizar (genómica, proteómica, transcriptómica o metabolómica). Es posible que el panel de biomarcadores que defina un estado de alotolerancia en el futuro sea una combinación de varios de esos métodos4. Hasta la fecha, la mayoría de las aproximaciones empleaban una u otra técnica, pero en los últimos años y gracias a los consorcios establecidos, se combina un panel de diferentes técnicas.
Además, el trasplante renal no es un proceso estático, sino que es dinámico y cambia en el tiempo, y en su evolución influyen múltiples factores inmunológicos (sensibilización previa, compatibilidad HLA) y no inmunológicos (tipo de inmunosupresor, nefrotoxicidad, infecciones, diabetes, daño de isquemia-reperfusión…). Estos factores también pueden contribuir a cambios en los biomarcadores que estudiamos.
Por ello, uno de los factores que pueden influir en el estudio de las células Treg como biomarcadores en un trasplantado renal es el tipo de inmunosupresión empleado. En este sentido, existe una clara diferencia entre el empleo de inhibidores de la calcineurina (CNI por sus siglas en inglés, calcineurin inhibitors) o de inhibidores de la diana de la rapamicina en mamíferos (m-TOR por sus siglas en inglés, mammalian target of rapamycin), im-TOR, como principales inmunosupresores incluidos en la triple terapia de mantenimiento tras el trasplante renal. De este modo, se demostró ya hace una década que los CNI eran capaces de inducir un descenso en las cifras de células Treg en la sangre de trasplantados renales estables y de más de 2 años de evolución respecto a los tratados con im-TOR, que mantenían cifras semejantes a los donantes sanos y los pacientes con enfermedad renal terminal16. El descenso de las células Treg que los CNI inducen se recupera incluso cuando los pacientes se retiran de regímenes que combinaban los CNI con los im-TOR o cuando los pacientes cambian de un tratamiento con CNI a otro con im-TOR. Además, el aumento de células Treg tras la conversión de 18 trasplantados renales de terapia con CNI a im-TOR se acompañó en otro estudio de un descenso en la activación de linfocitos T CD4+ circulantes, medido por el método Immuknow, a los 3 meses de la conversión17. Todos estos datos se corresponden con los estudios iniciales in vitro que mostraban cómo la rapamicina inducía la diferenciación hacia células Treg a partir de células T CD4+ efectoras convencionales y no por expansión de células Treg naturales18-20.
Cabe destacar que las células Treg definidas hace 20 años han demostrado ser un grupo de células con diferentes subtipos y grados de activación. Así, Miyara et al21 demostraron tres fracciones de células Treg con distinta capacidad supresora y que eran definidas por diferentes fenotipos según la expresión de los marcadores celulares mediante citometría de flujo. De este modo, se define la población de células Treg activada como con mayor capacidad supresora con fenotipo CD4+CD45RA-CD-25highFoxP3high. Además, hay otros dos tipos de células Treg que pueden activarse y que tienen fenotipos distintos: células Treg naive (CD4+CD45RA+CD25+FoxP3+) y células Treg silentes (CD4+CD45RA+CD25+FoxP3+). Las células Treg activadas expresan el mayor nivel de la molécula inhibidora de la segunda señal, CTLA-4, seguidas por las células Treg silentes y las naive21. En un estudio multicéntrico español, se midieron los niveles circulantes de células Treg totales y de los distintos subtipos de células Treg descritos, mediante citometría de flujo, en una cohorte de 75 trasplantados renales22. Se consensuó la metodología empleada en los cuatro centros y se establecieron protocolos normalizados de trabajo empleando lotes de reactivos idénticos para minimizar los coeficientes de variación inter- e intralaboratorio, que pueden sesgar los trabajos multicéntricos que emplean este tipo de métodos. Los niveles de las células Treg se cuantificaron antes del trasplante y durante el primer año postrasplante renal. Estas células cayeron de forma significativa desde la primera semana después del trasplante y a partir del segundo mes se fueron recuperando para alcanzar los niveles pretrasplante al año22, de forma semejante a lo descrito previamente en un estudio unicéntrico con 33 trasplantados renales23. Un comportamiento paralelo mostraron las células Treg activadas, pero de forma importante, se demostró que estas células activadas estaban ya aumentadas antes del trasplante en aquellos receptores que sufrían un rechazo agudo22. En concreto, se estableció que la presencia de una frecuencia de células Treg activadas en sangre superior al 1,4% se asociaba de forma significativa a un mayor riesgo de rechazo agudo. En dicho estudio no se demostró diferencia alguna en el número de los subtipos de células Treg en función del inmunosupresor empleado, puesto que la mayoría de los pacientes estaban con un régimen basado en los CNI.
Aunque las células Treg son los biomarcadores más asociados con la tolerancia, dados los distintos tipos de células T CD4+ y su enorme plasticidad, es importante considerar el balance entre células reguladoras y células efectoras o entre células antinflamatorias y células inflamatorias; dicho de otro modo, el balance entre células Treg y células Th1-Th1724. Dicho balance puede ser alterado por el empleo de los fármacos inmunosupresores en el postrasplante renal. Así, se sabe que existen dos complejos de la m-TOR implicados en la inducción y en la diferenciación de los subtipos de células Th CD4+: los complejos m-TORC1 y m-TORC2 (figura 1). Así, m-TORC1, que se activa más que m-TORC2 en el linfocito que recibe señales coestimuladoras, induce la diferenciación hacia Th1 y Th17, mientras que inhibe la de Th2 y Treg. Por su parte, m-TORC2 estimula la diferenciación hacia Th1 y hacia Th2. Se conoce que la rapamicina bloquea ambos complejos m-TOR, aunque con mayor potencia el m-TORC125,26. En consecuencia, el uso de los im-TOR, como la rapamicina, sería capaz de inhibir la diferenciación hacia células efectoras como Th1 y Th17 y, en menor medida, hacia Th2, mientras que facilitaría la inducción de células Treg (figura 1). En este sentido, un trabajo reciente en cultivo mixto linfocitario in vitro y en presencia de citocinas inflamatorias muestra cómo el tacrolimus es capaz de inhibir la diferenciación tanto hacia Th1 y Th17 como hacia Treg27. La rapamicina disminuye la cantidad de células Th1 y Th17 en el cultivo pero aumenta las células Treg. Además, cuando se emplean de forma combinada el tacrolimus y la rapamicina, el efecto inhibidor de las células Th1 y Th17 se potencia, mientras que la combinación es capaz de recuperar el descenso de células Treg inducido por el tacrolimus.
CÉLULAS T DE MEMORIA
El desarrollo en el conocimiento de las diferentes subpoblaciones de células T ha permitido el avance en el estudio de los mecanismos inmunológicos implicados en el rechazo del aloinjerto. Las células más estudiadas en el rechazo o aceptación de un trasplante han sido los subtipos funcionales de linfocitos T CD4+ (Th1, Th2, Th17, Treg). Sin embargo, pocos estudios se centran en el análisis de una población que persiste tras el trasplante con un patrón de diferenciación ambiguo: las células Th de memoria28. Esta población de memoria comprende a células T tanto efectoras (Th1, Th17) como reguladoras, las cuales pueden modificar sus patrones de expresión específica del subtipo si cambian las señales de diferenciación precisas29. Por otro lado, la mayoría de los estudios en los que se analiza la implicación de las células T naive frente a las de memoria se han realizado en animales de experimentación30 y se da la paradoja de que en estos animales la frecuencia de células T de memoria es < 3%, mientras que en humanos esa frecuencia aumenta aproximadamente al 70%. Probablemente la frecuencia de células T de memoria en un receptor en lista de espera para recibir un injerto renal sea aún mayor por la exposición previa a infecciones, transfusiones y estímulos inflamatorios continuos, como los derivados de la diálisis.
En el trasplante, la respuesta inmunitaria de memoria, al igual que en el caso de cualquier infección, es mucho más rápida y agresiva que la dirigida por las células T naive, puesto que el componente de memoria contiene multitud de células T clonales expandidas mientras que el naive contiene pocas células, cada una con especificidades diferentes. Gracias a las nuevas metodologías se han descrito diferentes subpoblaciones de células T de memoria con diferentes propiedades fenotípicas y funcionales, así como de distribución tisular31.
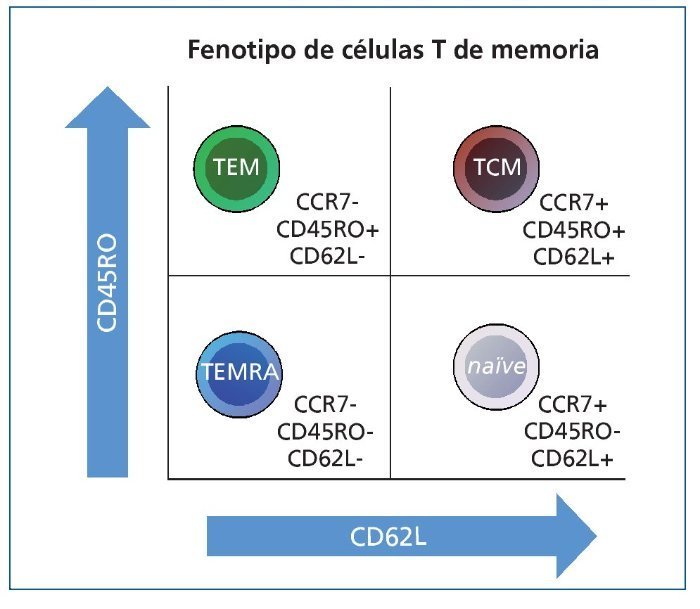
Las células T de memoria humanas tienen una expresión diferenciada de CD45RA, CD27, CD28, CCR7 y CD62L frente a las células T naive (figura 2). Estas últimas son células CD45RA+CD27+CD28+, productoras en gran medida de IL-2, necesaria para su supervivencia. Las células T de memoria se dividen en T centrales de memoria (TCM por sus siglas en inglés, T centralmemory cells), localizadas principalmente en tejidos linfoides periféricos en un estado silente. Se caracterizan por la expresión en superficie de CD45RO (y ausencia de CD45RA) y de CD62L, necesaria para su reclutamiento en tejidos linfoides, además de CD27 y CD28. Existe un estadio intermedio de célula T de memoria en que se pierde la expresión de CD28 respecto al estadio TCM, manteniendo la expresión de CD27. Estas células ya secretan IFN-γ al tiempo que decae la producción de IL-2. Finalmente, la célula T de memoria se diferencia hacia célula efectora de memoria (TEM por sus siglas en inglés, Teffector memory cells), que también presenta CD45RO en superficie, pero se diferencia de las TCM en la ausencia de expresión de CD62L (por lo que se localizan en órganos no linfoides periféricos) y en la ausencia de CD27 y CD28. La principal diferencia entre las TCM y las TEM es funcional, puesto que las TEM son capaces de inducir una respuesta de memoria rápida con un menor requerimiento de señales de coestimulación, lo que las convierte en las células con mayor capacidad de rechazar un injerto trasplantado. Estas células TEM se caracterizan en humanos por producir IFN-γ y casi nada de IL-231,32. Recientemente se ha demostrado que las células T de memoria montan una alorrespuesta de tal magnitud que incluso las células Treg (conocidas por su papel favorecedor del establecimiento de tolerancia a injertos) son incapaces de controlarla28. Gran parte del poder de esta alorrespuesta es la capacidad de reclutar células mononucleares por parte de las células de memoria. Si se evita la movilización de estas células, las células Treg serían capaces de controlar dicha alorrespuesta33. Cada vez parece más evidente que conseguir un control efectivo sobre las células de memoria facilitaría el establecimiento de un estado de tolerancia o, al menos, de aceptación del injerto trasplantado, objetivo último en estos pacientes.
Figura 2. Representación de los marcadores de superficie que identifican los distintos subtipos de células T en su maduración y cómo se distribuirían en una imagen de citometría de flujo. TCM: células T centrales de memoria; TEM: células T efectoras de memoria; TEMRA: células T efectoras terminales.
El estudio del grupo de Nantes y el del Hospital Clínic de Barcelona en trasplantados renales mostraron un aumento de las células con fenotipo de TEM mediante citometría de flujo en los receptores renales tratados con im-TOR respecto a los tratados con CNI34. Además, dicho aumento se acompañó de un incremento de transcritos de RNA relacionados con la ruta inflamatoria del factor nuclear kappa B (NF-kB por sus siglas en inglés, nuclear factor kappa B) y de linaje monocitario y células natural killer (NK). También el tratamiento con im-TOR indujo un aumento de células Treg comparado con el de CNI. Por lo tanto, el efecto de los inmunosupresores sobre los tipos funcionales y madurativos de células Th CD4+ parece complejo y aún por definir. Incluso, los dos principales im-TOR, el everolimus y el sirolimus, parecen tener efectos dispares. En cultivos in vitro, tras activación policlonal, se demuestra que el everolimus, pero no el sirolimus, es capaz de bloquear la maduración de células Th naive hacia células TCM o TEM35. Además, el everolimus inhibe de forma más eficiente la proliferación de células TCM y TEM que el sirolimus, aunque ninguno de ellos consigue el nivel antiproliferativo del tacrolimus. Aunque el trabajo muestra esas diferencias madurativas en las células Th, no lo hace en la producción de citocinas características de cada tipo funcional Th ni con CNI ni con im-TOR35.
CÉLULAS LINFOIDES INNATAS: UN NUEVO TIPO CELULAR QUE PUEDE SER MODULADO POR LA INMUNOSUPRESIÓN
La complejidad de la respuesta inmunitaria es tal que el nivel de especialización descrito en la respuesta adaptativa, aunque en menor grado, también parece detectarse en la repuesta innata. De este modo, se han descrito familias de células linfoides innatas (sin TCR) pero que comparten factores de transcripción y citocinas producidas con los subtipos de células Th de la respuesta adaptativa36. La función de estos tipos de células es probablemente complementaria y de soporte a la activación de los tipos Th más especializados. Se han descrito grupos de células linfoides innatas (ILC por sus siglas en inglés, innate lymphoidcells). Las ILC del grupo 1 expresan el factor de transcripción propio de las Th1, el T-bet, y secretan fundamentalmente IFN-γ. Existe un subtipo en este grupo, las NK-like, que, además del T-bet, tienen el factor de transcripción EOMES. Las ILC del grupo 2 tienen el factor de transcripción GATA-3 y ROR-α y secretan IL-4, IL-5 e IL-13. Las ILC del grupo 3 expresan el factor ROR-γ-T y se subdividen en tres subtipos: las células inductoras de tejido linfoide (LTi por sus siglas en inglés, lymphoidtissue inducer cells) y las células linfoides innatas 3 sin receptor de citotoxicidad natural (NCR-ILC-3 por sus siglas en inglés, natural cytotoxicity receptor), que secretan IL-17 e IL-22, y las células linfoides innatas 3 con receptor de citotoxicidad natural (NCR+ILC-3), que secretan solo IL-22. Todo parece indicar que estos subtipos de ILC pueden tener también capacidad plástica y en función de los estímulos y de los tejidos donde se encuentren pueden transformarse en un tipo u otro.
Dada su reciente descripción, no existen aún trabajos acerca de la influencia de los tratamientos inmunosupresores en estas células. Recientemente, un estudio en ratones jóvenes tratados con sirolimus ponía de manifiesto cómo aumentaba el porcentaje de células ILC-1 e ILC-3 circulantes. El efecto también se mostraba para las ILC-1 en ratones viejos, pero no para las ILC-326. En los próximos años aparecerán más evidencias en relación con las ILC y el efecto de los fármacos inmunosupresores y su influencia en la evolución del trasplante de órganos.
LA RESPUESTA HUMORAL EN EL TRASPLANTE NO SOLO SE INHIBE CON TERAPIAS ESPECIALMENTE DIRIGIDAS A LAS CÉLULAS B
El rechazo humoral es el resultado de una activación linfocitaria B que desencadena la producción de anticuerpos específicos frente al HLA del donante (DSA por sus siglas en inglés, donor specific antibodies) que activan el complemento, lo que supone un elevado riesgo de pérdida del injerto. Esto ha motivado el desarrollo de tratamientos dirigidos específicamente a hacer frente a moléculas y rutas de activación de células B37. No obstante, debe tenerse en cuenta que la respuesta de anticuerpos anti-HLA es de tipo T-dependiente, donde la colaboración entre células Th CD4+ y célula B es necesaria. Por este motivo, la inmunosupresión con fármacos como los CNI o los im-TOR, adscrita tradicionalmente a la inhibición solo de células T, también participa en el control de la respuesta humoral.
El grupo de Berlín fue el primero en demostrar, en un estudio que combinaba dos cohortes randomizadas y que sumaban 127 pacientes, que el tratamiento con CNI inhibía de forma más efectiva la producción de DSA y el rechazo humoral que el tratamiento con everolimus38. Más recientemente, en una cohorte de 247 trasplantados renales unicéntrica, se demostró que la conversión de un régimen basado en CNI a otro basado en im-TOR favorecía la producción de anticuerpos anti-HLA en más del doble respecto a los pacientes que se mantenían con los CNI, aunque la mayoría no eran DSA39. De forma significativa, este trabajo demostró que el riesgo de producir anticuerpos, especialmente los DSA, era mayor en aquellos pacientes que tenían cierto grado de sensibilización antes de la conversión de CNI a im-TOR39. Por lo tanto, el mensaje incidía en la necesidad de determinar el nivel de anticuerpos anti-HLA en un paciente antes de realizar la conversión y evitar realizarla en caso de presencia de anticuerpos circulantes. Un trabajo más reciente mostró cómo la conversión de tacrolimus a everolimus a los 3 meses del trasplante inducía el triple de producción de DSA de novo respecto a los pacientes que se mantenían con tacrolimus40. No obstante, el riesgo de producción de DSA parece depender también del momento de la conversión, puesto que aquellos pacientes convertidos después del año del trasplante tienen un riesgo muy inferior que los que lo hacen antes del año41.
A pesar de que la razón aducida para el mayor riesgo de rechazo humoral con los im-TOR radica en su menor capacidad supresora de células T respecto a los CNI, existen escasas evidencias del efecto directo de los dos tipos de inmunosupresores sobre las células B. Un trabajo reciente demuestra que el tacrolimus no afecta ni a la proliferación de células B in vitro ni tampoco a su diferenciación hacia células con fenotipo de célula plasmática42. En cambio, el sirolimus, tanto a dosis terapéuticas como infraterapéuticas, reduce la proliferación de las células B y también su diferenciación hacia células plasmáticas productoras de anticuerpos. Evidentemente, se trata de un trabajo in vitro, pero que no concuerda con los resultados encontrados in vivo de los niveles de los DSA circulantes.
De modo semejante al resto de poblaciones celulares T mencionadas hasta ahora, las células B también tienen subtipos según la función que ejercen. Así, existen células B patogénicas, que median el rechazo humoral con producción de citocinas inflamatorias y aloanticuerpos y que tienen capacidad de memoria, y células B con función reguladora, equivalente a la de las células Treg43. Es posible que las discordancias entre los datos in vivo e in vitro, como las descritas en el párrafo anterior, tengan que ver con los subtipos funcionales de células B que fenotípicamente no somos capaces de distinguir. De hecho, los trabajos de los consorcios americano (ITN) y europeo (RISET) demostraron una firma molecular rica en transcritos de células B y producción de anticuerpos no DSA en los pacientes renales con tolerancia operacional que habían abandonado la inmunosupresión44,45. Este hallazgo fue contradictorio en aquel momento, puesto que cualquier rasgo de respuesta humoral se asociaba entonces a rechazo de tipo vascular agresivo. Además, en aquellos trabajos no se mostraba evidencia de aumento de células ni genes relacionados con células T reguladoras. Más recientemente, un grupo de Chicago ha demostrado que en los receptores de trasplante renal de vivo y HLA idéntico en los que se dejaba la inmunosupresión a los 2 años del trasplante, se conseguía tolerancia frente al aloinjerto. En dicho estudio, se demuestra un aumento de células Treg (CD4+CD25highCD127-FoxP3+) respecto a los no tolerantes, al tiempo que la firma molecular es compatible con la descrita por el ITN como la asociada a la tolerancia operacional46.
Actualmente se considera que existen células B reguladoras que tienen diversos fenotipos, pero que, de forma destacada, realizan su función supresora mediante la citocina antinflamatoria IL-1047. Básicamente se han descrito dos tipos de células con distintos fenotipos: células Breg (CD19+CD20+CD24highCD27-CD38highIgDhighIgMhigh) y células B transicionales o de la zona marginal (CD19+CD24+CD38+IgD+). Nuestro grupo estudió los niveles en sangre de estas últimas células en trasplantados renales a los que se realizaba una biopsia por indicación clínica. Los resultados mostraban cómo las células B transicionales estaban disminuidas en la sangre en los trasplantados en el momento del rechazo respecto a los trasplantados con biopsia que no tenía datos de rechazo. Al cabo de 30 días de la biopsia, los porcentajes de estas células en sangre se igualaban entre los dos grupos48. Más recientemente, un estudio con 36 trasplantados renales estables demuestra que las células B transicionales aumentan con el tiempo, lo que se relaciona con la supervivencia a largo plazo con independencia del tratamiento inmunosupresor. Curiosamente, en ese trabajo no hay diferencias en el número de células Breg entre los receptores tratados con CNI o con im-TOR, a diferencia de las células Treg, que sí que caen con los CNI49, tal como se ha comentado anteriormente.
LA CÉLULA PRESENTADORA DE ANTÍGENO: LA OLVIDADA POR LA INMUNOSUPRESIÓN
La activación correcta de la célula T precisa en todo momento de una APC que le presente el aloantígeno, en el caso del trasplante, y le transmita señales coestimuladoras. Es la APC la que, en función del tejido y del ambiente de citocinas y otros factores en que se encuentre, induce la diferenciación hacia un tipo de respuesta inmunitaria u otro. Por lo tanto, es una célula central en la alorrespuesta y, sin embargo, se han estudiado muy poco los efectos que los fármacos inmunosupresores ejercen sobre ella.
Entre los escasos trabajos, Wang et al50 demostraron que un tipo de APC, las células endoteliales, cuando se pretratan con sirolimus, inducen la expansión de células Treg in vitro. Este efecto es semejante al obtenido con RNA de interferencia frente a m-TOR que, además de inducir una expansión de células Treg, induce la expresión de FoxP3, mientras que no cambia la expresión de otros genes propios de la respuesta celular efectora (Cbl-b, Grail, Itch). Este efecto de la rapamicina puede ser secundario a la inhibición de la secreción de citocinas inflamatorias como la IL-6 y al aumento de la expresión de las moléculas tolerogénicas ligando de muerte programada 1 (PD-L1 por sus siglas en inglés, programmed death ligand 1) y 2 (PD-L2) en las APC50.
El sistema mononuclear fagocítico comprende tres tipos de linajes definidos a partir de estudios de alta resolución genética: la población de macrófagos establecida durante la embriogénesis, los monocitos que se desarrollan en el adulto y las células dendríticas. Estos subtipos tienen funciones diferenciadas y especializadas. Su empleo y su monitorización en el campo del trasplante de órganos están aún por definir51. De todos ellos, se ha descrito cómo los macrófagos que expresan la molécula de adhesión intercelular no asociada a integrina específica de células dendríticas (DC-SIGN por sus siglas en inglés, dendritic cell-specific intercellular adhesion molecule3-grabbing non-integrin) son capaces de promover tolerancia mediante la inhibición de las células T CD8+ y la expansión de las células Treg52. El efecto de los inmunosupresores empleados en la clínica sobre estas células aún no se conoce.
CONCLUSIONES
Aunque el establecimiento de un estado de tolerancia real frente al aloinjerto es el objetivo último en el ámbito del trasplante para conseguir una supervivencia prolongada del injerto en ausencia de los efectos adversos de la inmunosupresión, es una realidad aún lejana en la actualidad. La tolerancia operacional es, hoy por hoy, el mejor medio para comprender los mecanismos de alotolerancia y establecer biomarcadores útiles. Entre estos biomarcadores, los relacionados con la supresión activa, como las células T reguladoras, son los de mayor utilidad para definir la mejor inmunosupresión. Sin embargo, los efectos de los inmunosupresores de uso clínico no se dirigen únicamente a hacer frente a las células T CD4+, sino que cada día se describen nuevos efectos de los CNI y los im-TOR, junto con los nuevos tipos celulares (células linfoides innatas, sistema mononuclear fagocítico, células Breg…) de la respuesta inmunitaria y su papel en la evolución del trasplante. En todo caso, probablemente la mejor opción desde el punto de vista de la inmunosupresión farmacológica sea el empleo de una combinación de CNI e im-TOR con efectos sinérgicos.
Conflicto de intereses
El autor declara que no tiene conflictos de intereses potenciales relacionados con los contenidos de este artículo.
Correspondencia:
Marcos López Hoyos
Sección de Inmunología. Hospital Universitario Marqués de Valdecilla-IDIVAL, Santander.
mlopezhoyos@humv.es