Durante los últimos años, la introducción de nuevos fármacos inmunosupresores ha permitido reducir la tasa de rechazo agudo y mejorar de forma muy significativa los resultados del trasplante renal a corto plazo. Sin embargo, esta mejoría no se ha traducido en cambios tan significativos en los resultados a largo plazo, de tal forma que el fracaso tardío del injerto sigue siendo una causa frecuente de reingreso en programas de diálisis y de reentrada en la lista de espera. Múltiples agresiones de origen inmune y no inmune actúan de forma conjunta y conducen a la disfunción crónica del injerto. Las características del órgano implantado son un determinante mayor de la supervivencia del injerto y, aunque se han diseñado diversos algoritmos para conocer el riesgo del órgano a trasplantar y poderlo asignar al receptor más adecuado, su aplicación en la clínica es todavía excepcional. Por otra parte, caracterizar en cada paciente los factores inmunes (rechazo clínico y subclínico, reactivación de infecciones virales latentes, adherencia al tratamiento) y no inmunes (hipertensión, diabetes, anemia, dislipemia) que contribuyen a la disfunción crónica del injerto puede permitirnos intervenir de forma eficaz para retrasar la progresión de este proceso. Por lo tanto, identificar las causas de fracaso del injerto y sus factores de riesgo, aplicar modelos predictivos e intervenir sobre los factores causales pueden ser algunas de las estrategias para mejorar los resultados de trasplante renal en términos de supervivencia. En esta revisión se analizan algunas de las evidencias que condicionan el fracaso del injerto, así como los aspectos terapéuticos y pronósticos relacionados con este: 1) Magnitud del problema y causas de fracaso del injerto; 2) Identificación de los factores de riesgo de fracaso del injerto; 3) Estrategias terapéuticas para disminuir el fracaso del injerto; y 4) Predicción del fracaso del injerto.
The introduction of new immunosuppressant drugs in recent years has allowed for a reduction in acute rejection rates along with highly significant improvements in short-term kidney transplantation results. Nonetheless, this improvement has not translated into such significant changes in long-term results. In this manner, late graft failure continues to be a frequent cause of readmission onto dialysis programmes and re-entry onto the waiting list. Multiple entities of immunological and non-immunological origin act together and lead to chronic allograft dysfunction. The characteristics of the transplanted organ are a greater determinant of graft survival, and although various algorithms have been designed as a way of understanding the risk of the transplant organ and assigning the most adequate recipient accordingly. They are applied in the clinical setting only under exceptional circumstances. Characterising, for each patient, the immune factors (clinical and subclinical rejection, reactivation of dormant viral infections, adherence to treatment) and non-immune factors (hypertension, diabetes, anaemia, dyslipidaemia) that contribute to chronic allograft dysfunction could allow us to intervene more effectively as a way of delaying the progress of such processes. Therefore, identifying the causes of graft failure and its risk factors, applying predictive models, and intervening in causal factors could constitute strategies for improving kidney transplantation results in terms of survival. This review analyses some of the evidences conditioning graft failure as well as related therapeutic and prognostic aspects: 1) magnitude of the problem and causes of graft failure; 2) identification of graft failure risk factors; 3) therapeutic strategies for reducing graft failure, and; 4) graft failure prediction.
INTRODUCCIÓN
El trasplante renal (TX) constituye el tratamiento de elección para los pacientes con enfermedad renal crónica avanzada (ERCA), ya que se asocia con una mayor supervivencia del paciente, una mejor calidad de vida y un coste menor que el tratamiento sustitutivo con diálisis1. Durante las últimas décadas, este tratamiento se ha difundido de manera progresiva entre un mayor número de pacientes, de tal forma que en nuestro país alrededor de la mitad de los pacientes con ERCA son portadores de un TX funcionante2. Los registros existentes en distintos países han confirmado una progresiva mejoría de los resultados del TX a corto plazo. Actualmente, la incidencia de rechazo agudo es < 15 % y la supervivencia del injerto es > 90 % al año del TX. En cambio, la evaluación de los resultados a largo plazo ha sido difícil de interpretar, ya que se han reportado informaciones contradictorias3,4. La tasa de pérdida del injerto a partir del año del trasplante se sitúa entre 3-6 % anual y el retorno a diálisis tras el fracaso de un injerto es una de las causas más frecuentes de ingreso en programas de diálisis y de reentrada en la lista de espera5.
Durante los últimos años se ha producido un cambio en las características demográficas y la comorbilidad de los donantes y los receptores de un TX que sin duda ha influido en los resultados de este6. Por otra parte, se han introducido en la práctica clínica nuevos fármacos inmunosupresores que han permitido reducir la tasa de episodios de rechazo agudo. Además, en los pacientes con un TX se ha incrementado el uso de tratamientos, potencialmente cardio y renoprotectores (antihipertensivos, estatinas, antiagregantes), que pueden modificar la progresión de la insuficiencia renal.
Para evaluar el fracaso tardío del injerto, es preciso disponer de información adecuada sobre las causas del fracaso de este y, para ello, tras descartar los problemas vasculares y de la vía urinaria, va a ser imprescindible el estudio histológico del aloinjerto. La clasificación internacional del grupo de Banff7 ha sufrido diversas modificaciones desde 1991 para integrar los conocimientos adquiridos8-11. Así, durante la década de los noventa, la nefropatía crónica del trasplante (NCT) se convirtió en la primera causa de fracaso del injerto12,13, pero la escasa especificidad de este diagnóstico limitó el análisis de las causas de dicho fracaso. Además, durante los últimos años, se ha dispuesto de técnicas más sensibles para detectar anticuerpos anti-HLA, lo que ha contribuido a caracterizar el papel del rechazo mediado por anticuerpos14.
Así pues, prolongar la supervivencia del injerto tras el TX representa en la actualidad una prioridad clínica. Por lo tanto, conocer las causas de fracaso, identificar los factores de riesgo, aplicar modelos predictivos e intervenir en los factores causales pueden ser algunas de las estrategias para optimizar los resultados del TX.
A lo largo de esta revisión, abordaremos las evidencias etiopatogénicas asociadas al fracaso del injerto y los aspectos terapéuticos y pronósticos profundizando en los siguientes puntos clínicos: 1) Magnitud del problema y causas de fracaso del injerto; 2) Identificación de los factores de riesgo; 3) Estrategias terapéuticas que pueden minimizar el fracaso del injerto; y 4) Predicción de la supervivencia del injerto.
1. MAGNITUD DEL PROBLEMA Y CAUSAS DE FRACASO DEL INJERTO
Actualmente no disponemos de un registro español de TX que nos ofrezca una información precisa sobre la tasa de pérdida del injerto y sus causas. Por lo tanto, la información la extraeremos de registros internacionales, de registros autonómicos y de un estudio español6,15 que evaluó las cohortes de pacientes trasplantados en los años 1990, 1994, 1998 y 2002 y que incluyó a casi 5000 pacientes que alcanzaron el año del trasplante con un injerto funcionante (GEENCT, Grupo Español para el Estudio de la Nefropatía Crónica del Trasplante)16. Hasta hace pocos años, el trasplante de donante vivo ha sido una práctica clínica excepcional en nuestro país, por lo que no disponemos a nivel nacional de resultados a largo plazo.
La introducción en la práctica clínica de los nuevos agentes inmunosupresores se produjo durante los últimos años de la década de los noventa y los primeros del 2000, y se acompañó de una disminución de la tasa de rechazo agudo desde el 40-50 % al 10-15 %. Además, el fracaso del injerto por rechazo agudo se ha convertido en una causa infrecuente de pérdida del injerto en los pacientes de bajo riesgo inmunológico (1-2 %)17,18. En la actualidad, durante el primer año del TX, la primera causa de fracaso del injerto se halla en relación con complicaciones de la técnica quirúrgica, especialmente la trombosis vascular (2-5 %)17,18. La utilización de donantes en asistolia y donantes con criterios expandidos se asocia con un porcentaje significativo de fracaso primario del injerto que puede alcanzar hasta el 20 % en los donantes en asistolia19.
Para evaluar el impacto de las nuevas pautas de inmunosupresión sobre los resultados a partir del primer año, deben compararse cohortes de pacientes trasplantados durante las distintas eras de inmunosupresión. Los datos del registro australiano20, comparando las cohortes de pacientes trasplantados entre 1993 y 2004, muestran una disminución de la tasa de rechazo agudo del 40 al 23 % que se acompaña de una mejoría en la supervivencia del injerto de donante cadáver al año (85 vs. 90,2 %) y a los 5 años (69,9 vs. 76,7 %). Los resultados en Europa aportados por el Collaborative Transplant Study (CTS)21 sugieren un aumento muy significativo en la vida media del injerto (12,5 años en el período 1988-1990 vs. 21,8 años en el período 2003-2005). En cambio, en los EE. UU. la mejoría en los resultados a largo plazo en el trasplante de donante cadáver ha sido más modesta, ya que la vida media del injerto ha aumentado de 6,6 años en 1989 a 8,8 años en 2005 para el TX de donante cadáver. De todas formas, los datos de este registro muestran que desde 1989 a 2005 la tasa de pérdida anual del injerto ha disminuido del 6-8 % hasta el 4-7 % durante los primeros 10 años postrasplante. Además, si se censura la muerte del paciente con injerto funcionante, esta mejoría pasa del 4-6 % de pérdidas anuales al 2-4 % para el donante estándar22.
En nuestro país, los datos del registro catalán muestran que entre los períodos 1984-1989 y 2002-2009 se ha producido una mejoría en los resultados a corto y medio plazo5. Así, la supervivencia al año ha aumentado del 78,1 al 89,4 %, mientras que la supervivencia a los 5 años ha aumentado del 58,1 al 76,7 %. Esto representa que entre el 2.º y el 5.º año la tasa de pérdida anual se ha reducido del 4 al 2,5 %. En cambio, los resultados del GEENCT15 mostraron que la reducción de la tasa de rechazo agudo del 46 al 15,8 % entre 1990 y 2002 se acompañó de un aumento no significativo en la vida media del injerto censurando la muerte del paciente (15 vs. 19 años). Finalmente, en nuestro país, un estudio unicéntrico realizado con más de 1400 pacientes mostró que entre los períodos 1985-1995 y 1996-2005 se ha producido un aumento significativo en la vida media del injerto renal de casi 1 año23.
De todas formas, los resultados en la supervivencia del injerto deben entenderse en conjunto con los cambios demográficos de la población de donantes y receptores. Para intentar superar esta limitación, el GEENCT realizó un estudio de casos y controles pareando a la población de las 4 cohortes en función de 6 variables de los donantes y receptores24. Este estudio mostró que la reducción de la tasa de rechazo agudo se asoció con una mejoría significativa en los resultados a largo plazo.
Finalmente, parece que gran parte de las diferencias reportadas entre países se relacionan con la metodología empleada, ya que un estudio comparativo entre pacientes del GEENCT y pacientes del registro americano, realizado con la misma metodología y ajustando por las variables confundentes, mostró que la supervivencia del injerto censurando la muerte del paciente a los 10 años es similar entre ambos países (75,6 vs. 76 %)25.
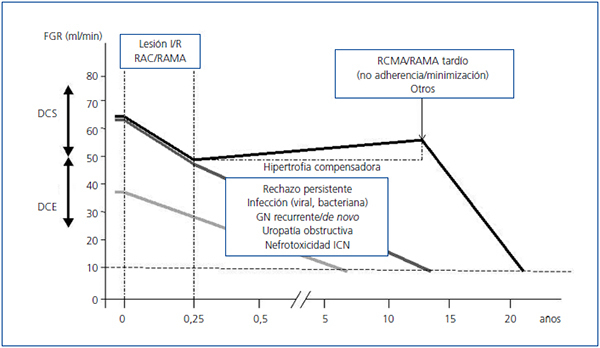
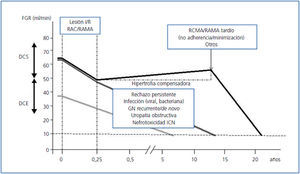
La evaluación de las causas de fracaso tardío del injerto ha sufrido durante los últimos años un cambio significativo. La definición de la NCT por el grupo de Banff en 1991 condujo a que durante muchos años esta entidad inespecífica liderara las causas de fracaso tardío del injerto13. La presencia de fibrosis intersticial y atrofia tubular (FI/AT) que define la NCT es un hallazgo muy frecuente en diversos estudios realizados en biopsias de seguimiento y afecta a más del 60 % de los injertos al año del trasplante12,26. Diversos estudios han confirmado que la presencia de FI/AT aislada en injertos estables no se asocia con un peor pronóstico para el injerto27,28, y que debe investigarse la presencia de otras lesiones que contribuyan a la disfunción crónica de este. En la figura 1 se proponen distintos patrones para explicar la aparición de disfunción crónica del injerto renal. Durante los primeros meses postrasplante observamos una pérdida de función renal asociada a la lesión de isquemia/reperfusión y a la presencia de episodios de disfunción inmunológica celular o mediada por anticuerpos. Posteriormente, muchos injertos van a mantener una función renal estable durante años y se producirá un progresivo declinar de la función renal solo si aparece algún evento que lo desencadene (línea negra en la figura 1). Estudios recientes sugieren que este fenómeno suele hallarse en relación con la aparición de anticuerpos donante-específicos (ADE) de novo en el contexto de una inmunosupresión inadecuada29,30. El patrón histológico observado es el del rechazo crónico humoral10 caracterizado por la presencia de inflamación en la microcirculación del injerto y glomerulopatía del trasplante (con o sin depósitos de C4d). La no adherencia al tratamiento inmunosupresor, así como las pautas de minimización de la inmunosupresión (por patología asociada u otras), parecen ser las principales causas de este fenómeno. Además, un tratamiento insuficiente puede asociarse con la aparición de episodios de rechazo agudo tardío (celular, humoral o mixto) que presentan una inadecuada respuesta al tratamiento. Otros mecanismos pueden contribuir de manera menos frecuente a la aparición de este fenotipo (glomerulonefritis recurrente o de novo, enfermedades concomitantes graves).
Existe un segundo fenotipo de disfunción crónica del injerto en el que la lesión producida durante los primeros meses del trasplante se sigue de una pérdida lenta y progresiva de función renal durante los siguientes años (línea gris oscuro en la figura 1). Estudios realizados con biopsias de seguimiento muestran que el rechazo agudo celular persistente puede afectar al 5-10 % de los injertos y contribuir a una pérdida progresiva de nefronas con glomerulosclerosis y FI/AT progresivas31. Además, en los pacientes con ADE preformados, los estudios con biopsias de seguimiento han demostrado que en un porcentaje muy elevado de casos se observa una inflamación persistente en la microcirculación renal que se asociará con la aparición de rechazo mediado por anticuerpos32 y una arteriosclerosis acelerada del injerto33. Aparte de la lesión inmune persistente (mediada por células T y/o anticuerpos), otras lesiones de origen no inmunológico (enfermedades renales recurrentes o de novo, las infecciones virales y bacterianas de repetición y la uropatía obstructiva) pueden contribuir a la aparición de este segundo fenotipo. Durante muchos años se ha debatido sobre el papel que juega la nefrotoxicidad por inhibidores de la calcineurina en la disfunción crónica del injerto, ya que algunas de las lesiones asociadas con este tratamiento también pueden asociarse con una inmunosupresión insuficiente34-38. Aunque existe consenso en que la nefrotoxicidad contribuye en la progresión de la enfermedad renal crónica (ERC), estudios recientes sugieren que esta lesión aislada es una causa excepcional de disfunción crónica del injerto17,30. Finalmente, las características del injerto implantado pueden condicionar también de manera muy significativa su pronóstico39,40. Así, los receptores de órganos con criterios expandidos (línea gris claro en la figura 1) van a alcanzar una función renal significativamente inferior tras los primeros meses del trasplante. En este contexto, se puede producir una progresión de la insuficiencia renal mediada por mecanismos de hiperfiltración41 y/o senescencia acelerada42 sin que sea necesario que participen nuevas lesiones sobre el injerto.
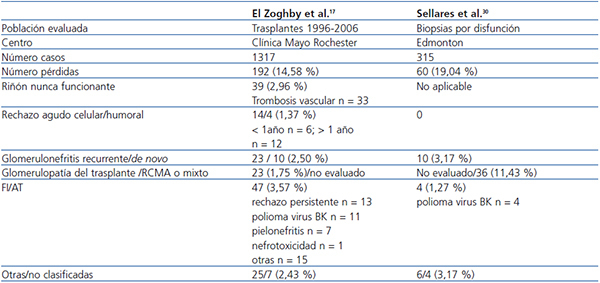
En la tabla 1 se resumen dos estudios recientes que han revisado la contribución de las distintas causas anteriormente comentadas sobre el fracaso del injerto. El diseño de los estudios y terminología empleada en cada uno de ellos justifica en gran parte las diferencias observadas. Finalmente, es posible que la combinación de varios factores sea la verdadera causa de la disfunción crónica del injerto.
2. IDENTIFICACIÓN DE LOS FACTORES DE RIESGO DE FRACASO DEL INJERTO
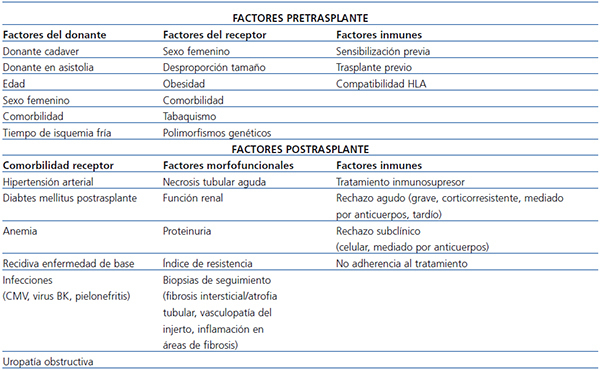
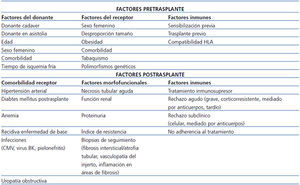
El análisis de los factores de riesgo de fracaso del injerto a corto y largo plazo ha sido revisado recientemente43,44. Para realizar un análisis adecuado, es necesario separar las variables presentes en el momento del TX de las variables que aparecen después de él, ya que en muchas ocasiones estas reflejan el resultado de la interacción entre las características clínicas e inmunológicas del donante y del receptor. En la tabla 2 se muestran las variables pre y postrasplante que se han relacionado con la supervivencia del injerto renal, que incluyen factores inmunes y no inmunes. Entre los factores no inmunes destacan las características demográficas de los donantes y receptores y la comorbilidad de estos. Los factores inmunes pretrasplante tienen un peso específico en la evolución del injerto. La presencia de sensibilización previa por transfusiones, embarazos o trasplantes previos se asocia de forma consistente con una peor supervivencia del injerto. En la era de la moderna inmunosupresión, el impacto de la compatibilidad HLA sobre la supervivencia del injerto es menor, pero, en los estudios de registro con gran número de pacientes, el número de compatibilidades HLA sigue asociándose con la supervivencia del injerto45.
El impacto de las variables postrasplante sobre la supervivencia del injerto es diferente según las distintas series analizadas. Las diversas comorbilidades que afectan al receptor (hipertensión arterial, diabetes, infecciones virales, recidiva de la enfermedad de base) se asocian con variables propias del paciente (edad, obesidad), pero también están relacionadas con el tipo de inmunosupresión recibida. Pautas de inmunosupresión de mantenimiento con tacrolimus, micofenolato mofetilo y corticoides se asocian con una mayor prevalencia de diabetes, hipertensión arterial o infecciones virales, mientras que las pautas basadas en la utilización de inhibidores de mTOR (mammalian target of rapamycin) se asocian con mayor prevalencia de dislipemia, pero menor prevalencia de hipertensión arterial e infecciones virales. Existen múltiples ensayos clínicos y metanálisis sobre los riesgos y beneficios de la retirada de corticoides46, pero no debe olvidarse que algunas glomerulonefritis pueden recurrir más frecuentemente tras su retirada47 y no se sabe con claridad la evolución de los ADE con esta estrategia.
El rechazo agudo puede tener un impacto negativo de primera magnitud sobre la evolución. Estudios recientes muestran que los episodios de rechazo celular agudo corticosensibles con recuperación completa de la función renal no tienen impacto sobre la supervivencia. En cambio, los episodios de rechazo agudo severo, con componente vascular, y el rechazo agudo mediado por anticuerpos se asocian con una peor supervivencia del injerto48. Además, los episodios de rechazo agudo tardío se asocian con un tratamiento inmunosupresor insuficiente y presentan una inadecuada respuesta al tratamiento48. Por otra parte, diversos estudios con biopsias de seguimiento han mostrado que la presencia de episodios de rechazo subclínico celular o mediado por anticuerpos se asocian con un peor pronóstico para la supervivencia del injerto31-33. De todas formas, en la era de la moderna inmunosupresión, la prevalencia de episodios de rechazo subclínico es muy baja (inferior al 5 %) en los pacientes de bajo riesgo inmunológico49,50. Finalmente, la no adherencia al tratamiento inmunosupresor se ha asociado tanto con la aparición de episodios de rechazo agudo tardío como con la aparición de ADE y rechazo crónico humoral30. En la actualidad, la única herramienta disponible para evaluar la adherencia es la monitorización de los niveles en sangre de los fármacos inmunosupresores, aunque diversos estudios han mostrado que la no adherencia se relaciona con diversas variables del receptor (adolescentes, bajo nivel socioeconómico, etc.).
La presencia de necrosis tubular aguda pos-TX se asocia no tan solo con un mayor riesgo de rechazo agudo, sino también con un mayor riesgo de disfunción crónica de forma independiente a la presencia de rechazo51. La función renal alcanzada a los 3-6 meses del trasplante, la presencia de proteinuria (incluso de bajo rango, entre 0,15 y 1 g/día) o la progresión de la función renal/proteinuria entre los 3 y los 12 meses también se han asociado con el fracaso tardío del injerto15,52. Otras variables menos utilizadas para monitorizar el injerto, como el índice de resistencia obtenido mediante ecografía doppler del injerto53,54 o los hallazgos en biopsias de seguimiento26, también se han relacionado con el fracaso del injerto.
3. ESTRATEGIAS TERAPÉUTICAS QUE PUEDEN MINIMIZAR EL FRACASO DEL INJERTO
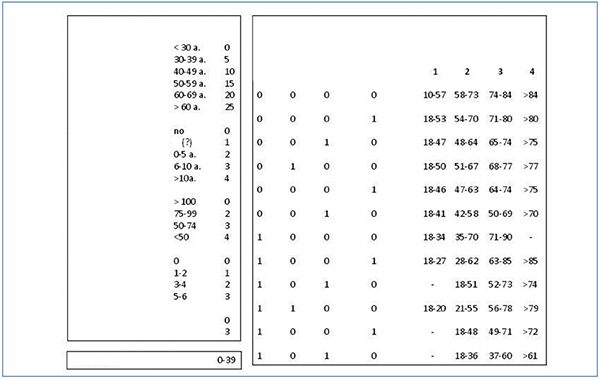
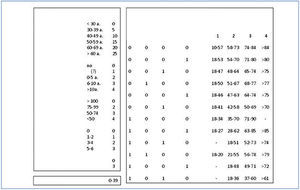
Las estrategias terapéuticas dirigidas a disminuir la tasa de pérdida del injerto deben incidir sobre los factores de riesgo antes mencionados. Obviamente, no podemos incidir sobre las variables demográficas y la comorbilidad de donantes y receptores, pero estas variables deben participar en el momento de asignar receptores para cada donante con el objetivo de maximizar los resultados del trasplante. Una de las propuestas más simples es utilizar los órganos de los donantes añosos para receptores añosos55,56, aunque algunos estudios sugieren que los beneficios obtenidos con este método de asignación son escasos y limitan el acceso al trasplante a los receptores de menor edad57-59. También se ha propuesto que los órganos obtenidos de donantes con criterios expandidos se utilicen para receptores no sensibilizados de más de 60 años (o más de 40 años para los diabéticos) o para receptores con graves problemas de acceso vascular60. Alternativamente, se han desarrollado algoritmos con el objetivo de maximizar los resultados del trasplante teniendo en cuenta los principios de equidad (igualdad de oportunidades para todos los receptores incluidos en la lista de espera), eficiencia (reducir la pérdida de injertos por muerte del paciente con injerto funcionante) y utilidad (maximizar el número de pacientes con injerto funcionante para reducir la reentrada de pacientes en lista de espera). Los algoritmos necesarios para estos sistemas de asignación son complejos y requieren de la colaboración de estadísticos y matemáticos que tengan en cuenta las características de la población y el impacto que tienen estas variables sobre la supervivencia del injerto. En la figura 2 se muestra el algoritmo propuesto por Baskin-Bey y Nyberg61,62 teniendo en cuenta los score de riesgo para el donante y el receptor y siguiendo el principio de que el número de donantes y receptores en cada rango de riesgo no es homogéneo y, por lo tanto, el número de pacientes en cada rango de riesgo para el receptor se debe ajustar al número de órganos disponible según el score del donante.
La lesión de isquemia-reperfusión es uno de los condicionantes de la función renal en el postrasplante inmediato que se traduce en la presencia de necrosis tubular aguda. Las dos estrategias más útiles para atenuar esta lesión, especialmente en los injertos de alto riesgo (donantes con criterios expandidos y donantes en asistolia), son acortar el tiempo de isquemia fría63 y mantener el injerto en una máquina de perfusión pulsátil en lugar del almacenamiento en frío64.
La pauta de inmunosupresión utilizada puede tener un papel crucial en la supervivencia del injerto. Actualmente, la mayoría de los centros utilizan la combinación de un inhibidor de la calcineurina (tacrolimus o ciclosporina), un agente antiproliferativo (micofenolato mofetilo o azatioprina) y corticoides. El tratamiento con tacrolimus se ha asociado con menor tasa de rechazo agudo clínico y subclínico, mejor función renal y supervivencia del injerto que el tratamiento con ciclosporina o sirolimus en ensayos clínicos y metanálisis65,66. En cambio, los beneficios del micofenolato mofetilo en los resultados a corto y medio plazo67 no siempre han sido confirmados68,69. De todas formas, la elección de la pauta de inmunosupresión debe balancearse con las toxicidades propias de cada fármaco. Tacrolimus se asocia con mayor prevalencia de diabetes postrasplante o neurotoxicidad65, mientras que los inhibidores de mTOR presentan menor toxicidad renal y menor prevalencia de infecciones virales y neoplasias. Se ha sugerido que las modificaciones en la pauta de inmunosupresión a lo largo del seguimiento deberían acompañarse de una monitorización de la respuesta inmune mediante la determinación de anticuerpos anti-HLA15.
La presencia de hipertensión arterial afecta a más del 75 % de los receptores y se correlaciona con la función renal y el tratamiento con diversos inmunosupresores70. El tratamiento con calcioantagonistas contrarresta la vasoconstricción inducida por los inhibidores de la calcineurina y se asocia con una mejoría de la función renal y la supervivencia del injerto71. En cambio, la utilización de los antagonistas del sistema renina-angiotensina-aldosterona, que pueden reducir la fibrosis del injerto, la proteinuria y mejorar la supervivencia del injerto, ha ofrecido resultados contradictorios72-74. Aunque su uso se ha asociado con un menor filtrado glomerular y un mayor grado de anemia75, el análisis del GEENCT sugiere que su empleo puede estar relacionado con una menor tasa de pérdida del injerto cuando se introducen precozmente76. Finalmente, se debe emplear el tratamiento necesario, incluyendo diuréticos, para alcanzar una presión arterial inferior a 130/80 mmHg sin olvidar que muchos pacientes presentan un patrón circadiano de la presión arterial alterado (non dipper o reverse dipper), el cual también se ha relacionado con la supervivencia del injerto77. No existen ensayos clínicos para valorar si la cronoterapia puede modificar la supervivencia del paciente o del injerto.
La diabetes pretrasplante y postrasplante se han asociado con la supervivencia del injerto, conduciendo a una mayor tasa de mortalidad y de fracaso del injerto78. Por lo tanto, alcanzar un buen control glicémico modificando la dieta, el estilo de vida y utilizando antidiabéticos por vía oral y/o insulina puede incrementar la supervivencia del injerto. Algunos estudios sugieren que los cambios de nefropatía diabética aparecen más precozmente en el injerto que en el riñón nativo79.
La presencia de dislipemia afecta a más del 50 % de los receptores y su tratamiento puede reducir la tasa de eventos cardiovasculares. Sin embargo, aunque un ensayo clínico mostró una menor progresión de la vasculopatía del injerto a los 6 meses80, la utilización de estatinas no parece modificar la supervivencia del injerto en ensayos clínicos ni en distintos análisis de registro, incluyendo el del GEENCT81,82.
La anemia es una complicación frecuente en la población sometida a trasplante renal (35-40 %) que tiene un fuerte impacto en la supervivencia del paciente y del injerto. Su tratamiento con agentes estimuladores de la eritropoyesis en los pacientes con disfunción crónica del injerto disminuye el requerimiento de transfusiones y mejora la calidad de vida de los pacientes83. Está por definir el nivel de hemoglobina diana en el paciente sometido a trasplante renal con disfunción crónica y, aunque puede asumirse la misma que en la población no sometida a trasplante (10-12 g/dl), un ensayo clínico reciente sugiere que la normalización de la hemoglobina (13-15 g/dl) es segura y se asocia con una menor progresión de la insuficiencia renal a los 2 años (2,4 ml/min/1,73 m2 en el grupo de normalización vs. 5,9 ml/min/1,73 m2 en el grupo de corrección parcial)84.
4. PREDICCIÓN DE LA SUPERVIVENCIA DEL INJERTO
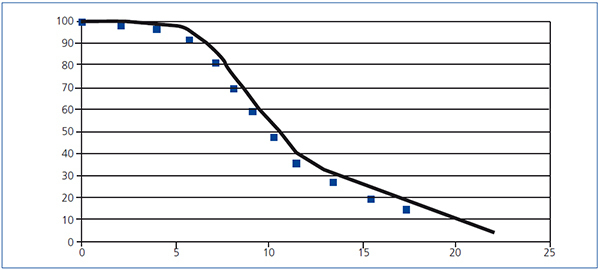
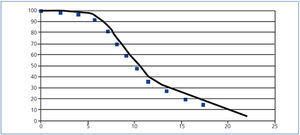
La disfunción crónica del injerto se caracteriza por un progresivo deterioro del filtrado glomerular renal (FGR) a lo largo del tiempo que se puede modelizar de distintas maneras. Se ha utilizado ampliamente el modelo exponencial para estimar la vida media del injerto, definido como el tiempo transcurrido hasta el fracaso del 50 % de los injertos. Desgraciadamente, en el contexto del TX, este tipo de modelización comporta una sobrestimación de la vida media para las cohortes con seguimiento corto3,4,15. En efecto, utilizando los datos del GEENCT, Serón et al.15 evaluaron la bondad de 5 modelos (exponencial, Weibull, gamma, lognormal y loglineal) para estimar la vida media del injerto y concluyeron que el modelo exponencial sobrestima la vida media del injerto (entre 1990 y 2002 aumentaba desde 14 a 52 años), mientras que el resto de los modelos tenían una bondad de ajuste parecida y confirmaban un aumento no significativo en la vida media del injerto de entre 3 y 4 años. En la figura 3 se representa a modo de ejemplo la función de distribución loglineal que presentó el mejor ajuste.
Para monitorizar la pérdida de función renal, también se puede utilizar la pérdida de FGR a lo largo del tiempo. Utilizando los datos del registro americano, Srinivas et al.85 demostraron que entre 2003 y 2008 se ha producido un cambio en la evolución de la función renal durante los 2 primeros años postrasplante, Así, durante este período el FGR a los 6 meses ha aumentado de 53,1 ml/min a 56,5 ml/min, y la tasa de pérdida de FGR entre los 6 y los 12 meses ha disminuido de –1,18 ml/min a +0,09 ml/min y entre los 12 y 24 meses ha pasado de –4,29 ml/min a 0 ml/min. Con este tipo de aproximación, se puede también modelizar la progresión de la ERC, bien mediante modelos lineales86 o mediante modelos más complejos que tienen en cuenta que se va a producir una progresión más acelerada en los estadios más avanzados de la ERC. En este sentido, Khalkhali87 desarrolló un modelo en una cohorte de 214 pacientes con ERC progresiva de los 1534 seguidos en su centro durante el período 1997-2005. En su estudio muestra que el tiempo que se halla cada paciente en cada estadio es menor tal como progresa la ERC (estadio 1: 26,4 meses; estadio 2: 24,7 meses; estadio 3: 22,0 meses, y estadio 4: 18,5 meses).
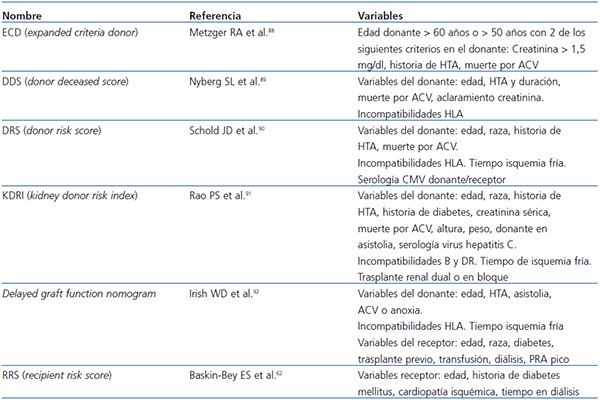
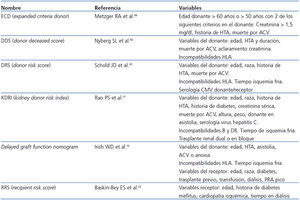
Por otra parte, también se han analizado los factores de riesgo que se asocian con dicho fracaso o progresión. En algunos modelos se incluyen solo las variables pretrasplante68,86-91 y en otros también se incluyen variables postrasplante92 (tabla 3). Se ha comparado la bondad de ajuste de estos diversos scores en algunos trabajos. El donor risk score definido por Schold et al.90 es uno de los que presenta mejor ajuste con el desarrollo de ERCA estadio 4 al año del trasplante93. En otros estudios se han añadido, a las variables clínicas, variables histológicas. Anglicheau et al.40 mostraron el valor predictivo sobre alcanzar un FGR < 25 ml/min de un score compuesto por el porcentaje de glomérulos esclerosados en la biopsia del donante, la presencia de hipertensión en el donante y una creatinina sérica > 1,5 mg/dl antes de la extracción (área bajo la curva ROC [Receiver Operating Characteristic] de 0,84).
Finalmente, aunque los datos clínicos (rechazo agudo, creatinina, proteinuria) e histológicos de las biopsias de seguimiento se asocien con la supervivencia del injerto a largo plazo, su capacidad predictiva a largo plazo es insuficiente26,94,95. Por ejemplo, aunque el riesgo relativo de fracaso del injerto aumenta 2,2 veces por cada mg/dl de la creatinina sérica al año, su valor predictivo analizado mediante curvas ROC sobre el fracaso del injerto a los 7 años solo arroja un área bajo la curva de 0,62. Lo mismo sucede con la progresión de la ERC: medida mediante el inverso de la creatinina, ofrece un área bajo la curva de 0,55. De hecho, se ha propuesto que ni el rechazo agudo ni la creatinina sérica son buenas medidas subordinadas de la supervivencia del injerto a largo plazo96.
CONCEPTOS CLAVE
1. El fracaso del aloinjerto renal es un problema de primera magnitud en el tratamiento de la insuficiencia renal crónica, ya que es una de las causas más frecuentes de reingreso en programa de diálisis y de reentrada en la lista de espera.
2. La introducción de los nuevos fármacos inmunosupresores ha permitido reducir la tasa de rechazo agudo y mejorar la supervivencia del injerto a largo plazo. Al mismo tiempo, la combinación de estos fármacos ha contribuido a disminuir la tasa de fracaso tardío del injerto.
3. El conocimiento de las causas y los factores de riesgo que conducen a la pérdida del aloinjerto deben dirigir a una intervención precoz sobre los factores de progresión tanto inmunes como no inmunes para prevenir dicho fracaso.
4. Los factores relacionados con el donante son determinantes mayores de la supervivencia del injerto renal. Los algoritmos desarrollados para asignar los órganos al receptor adecuado para maximizar los resultados son complejos y difíciles de implementar en la práctica clínica.
5. La continua modificación en las características demográficas y la comorbilidad de los donantes y receptores obliga a monitorizar de forma continuada los resultados del trasplante. Hasta la actualidad no disponemos de modelos predictivos con suficiente precisión para determinar la supervivencia del injerto a largo plazo.
Agradecimientos
Este estudio ha sido financiado en parte por el Ministerio Español de Ciencia e Innovación (Instituto de Salud Carlos III, FIS PI10/0185 y PI10/01020), REDINREN RD12/0021/0015, por la I Beca Novartis-SET y por la Consejería de Salud del Gobierno de Andalucía (PI-0499/2009).
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Distintos patrones de evolución de la función renal en los injertos renales con disfunción crónica
Figura 2. Algoritmo para calcular el score de riesgo de los donantes y los receptores
Figura 3. Función de supervivencia lognormal
Tabla 1. Causas de fracaso del injerto renal en 2 series de casos
Tabla 2. Factores de riesgo asociados con el fracaso del injerto
Tabla 3. Scores de riesgo sobre la pérdida del injerto