Sr. Director:
Una de las manifestaciones dermatológicas de la enfermedad renal crónica (ERC) es la arteriolopatía urémica calcificante (AUC) o calcifilaxis. Es una entidad anatomopatológica caracterizada por la necrosis de la piel y del tejido adiposo por un depósito anómalo de sales cálcicas1. La morbimortalidad de la calcifialxis es alta debido a sus complicaciones: sepsis e isquemia. Distintas entidades clínicas pueden manifestar calcifilaxis: artritis reumatoide, enfermedad inflamatoria intestinal, neoplasias, ERC, lupus eritematoso sistémico o la infección por VIH1. Su tratamiento ha de ser agresivo. El tiosulfato sódico ha demostrado mejoría en las lesiones dérmicas por calcifilaxis.
Nuestro paciente era un hombre de 78 años con antecedentes de hipertensión arterial, diabetes mellitus tipo 2, dislipemia, enfermedad renal crónica no filiada en hemodiálisis tres veces por semana de 3 h de duración, alteración óseo-mineral relacionada con ERC (AOM-ERC), fibrilación auricular y cardiopatía isquémica. Su tratamiento habitual era con sevelamer, enalapril, aspirina, acenocumarol e insulina.
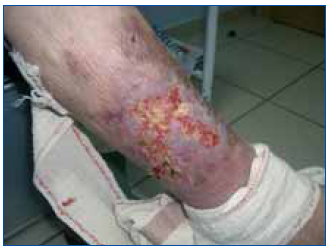
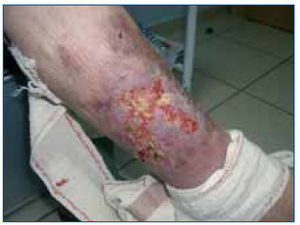
Ingresa por aparición de lesiones dérmicas dolorosas, eritematosas, con bordes necróticos, en ambas extremidades inferiores, de 5 x 6 cm. Exploración física: buen estado general, índice de masa corporal 23, presión arterial 150/63 mmHg, frecuencia cardíaca 64 lat/min, afebril. Auscultación cardiopulmonar y abdomen: anodinos. Extremidades inferiores: pulsos conservados, sin signos de trombosis venosa profunda y con las lesiones descritas. Analíticamente destacan: hormona paratiroidea (PTH) 826,3 pg/ml, calcio 8,9 mg/dl, fósforo 7,40, creatinina 9,8 mg/dl, albúmina 3 g/dl, urea 156 mg/dl, proteína C reactiva 4,3. Se realizan ecografía cervical y gammagrafía de paratiroides objetivándose hiperplasia paratiroidea sin adenomas. El estudio radiológico (serie ósea y Doppler de troncos supraaórticos) muestra calcificaciones vasculares en aorta ascendente y descendente. Ante la sospecha de calcifilaxis se procede a biopsiar una de las lesiones cuyo estudio es compatible con calcifilaxis: lesión con abundantes depósitos de calcio en relación con las paredes de pequeñas estructuras vasculares. Septos engrosados a expensas de fibrosis (figura 1). No se observan signos de necrosis. Finalmente se realiza gammagrafia con tecnecio-99 que no muestra extensión ósea de la calcifilaxis.
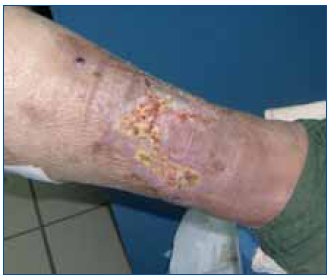
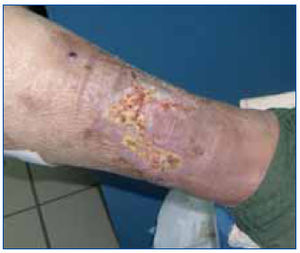
Consideramos la EOM-ERC como causante de calcifilaxis y se procedió a intensificar el tratamiento frente a la misma: inicio de hemodiálisis diarias de 4 h de duración con calcio bajo (2,5 mEq/l) en el baño de hemodiálisis y dializador de alto flujo, intensificación del tratamiento con quelantes del fósforo sin calcio: carbonato de lantano 750 mg/8 h y sevelamer 1.600 mg/8 h, y control de PTH con calcimiméticos 60 mg/24 h. Se procede a la retirada de acenocumarol e inicio de tratamiento con 80 ml de tiosulfato sódico al 25% (20 g) posthemodiálisis (tres veces por semana), con mejoría de las lesiones a los 2 meses (figura 2 y figura 3). Parámetros analíticos al alta: P 3,6 mg/dl, Ca total 8,9 mg/dl, PTH 406,90 pg/ml.
La AUC consiste en un depósito de hidroxiapatita en la piel y tejidos blandos con riesgo de necrosis. En la ERC la fisiopatología de la AUC se debe a la alteración del metabolismo fósfocálcico, al estado urémico, al aumento de PTH (aunque hay casos de AUC tras paratiroidectomía2), quelantes del fósforo cálcicos, y concentración alta de calcio en el baño de diálisis3. El fósforo y el calcio se unen produciendo calcificaciones vasculares, dérmicas y orgánicas4.
Otros factores predisponentes son: sexo femenino, obesidad5, hipoalbuminemia (<2 g/dl), diabetes mellitus, déficit de proteínas C y S6, anticoagulantes orales (inhiben la síntesis de la 4,8-gamma-carboxiglutamato7), hierro intravenoso y vitamina D por su acción intestinal sobre la reabsorción de calcio8.
La localización de las lesiones por AUC suele ser en el abdomen y en la zona gemelar, por su abundancia en tejido subcutáneo. La lesión se asemeja a livedo reticularis con progresión hacia la ulceración. Los depósitos de calcio en la piel se depositan en la dermis y en el tejido subcutáneo. Fisiopatogénicamente los niveles elevados de urea y de fósforo provocan una transformación de las células del músculo liso en células osteoblásticas que a su vez aumentan los niveles de osteoponina que, junto con moléculas proinflamatorias y de radicales libres, facilita la adhesión del fósforo al calcio1,7,9,10. Este magma se concentra alrededor de los depósitos cálcicos que también se encuentran en las arteriolas1 y en la capa media de los vasos.
El diagnóstico es fundamentalmente clínico. La biopsia de las lesiones no es recomendable dado el riesgo de infecciones y de ulceración10. Para el diagnóstico de la extensión ósea se emplea la gammagrafía con tecnecio-9910. La calcifilaxis presenta un 80% de morbimortalidad por el riesgo de infección y de necrosis.
El enfoque terapéutico de la AUC ha de ser agresivo controlando las alteraciones que la propicien (control de EOM-ERC), evitando agentes que puedan potenciarla y las curas de la lesión y de las complicaciones infecciosas2. El control de la EOM-ERC se hará mediante el uso de quelantes de fósforo exentos de calcio, soluciones de hemodiálisis y diálisis peritoneal bajas en calcio (por encima de 4 mEq/lL puede aparecer AUC11) e implantación de hemodiálisis diarias. El control de la PTH se hará mediante calcimiméticos y vitamina D, preferiblemente análogos de vitamina D por su menor efecto calcificante e hiperfosfatemiante2. La paratiroidectomía se reservará para casos resistente al tratamiento médico.
Las lesiones dérmicas de la AUC sin ulceración mejoran con corticoides10; Si presentan ulceración, la cámara hiperbárica de oxígeno posee efecto frente a organismos anaeróbicos11. El uso de tiosulfato sódico (antídoto frente al cianuro, con uso en el tratamiento tópico del acné y la pitiriasis versicolor, y protector frente a la toxicidad del carboplatino y cisplatino) está demostrando ser una medida terapéutica exitosa en las lesiones por AUC5,14. El tiosulfato sódico inhibe la precipitación de las sales cálcicas y disuelve los depósitos cálcicos12,13. No tiene efectos sobre los niveles de calcio, fósforo o PTH. La dosis recomendada es de 20 g i.v. tres veces por semana durante un mínimo de 6 meses2,14. Su administración puede conllevar acidosis metabólica, activación de osteoclastos, sobrecarga de volumen e hipotensión.
En definitiva, la AUC es una entidad grave en nuestros pacientes. Su tratamiento ha de ser agresivo. El tiosulfato sódico es un agente terapéutico válido en el tratamiento de la lesión de AUC. Su uso es seguro y el beneficio obtenido permite considerarlo fármaco de primera línea en las lesiones de AUC.
Figura 1. Lesión en extremidad inferior derecha previa al tratamiento con tiosulfato.
Figura 2. Lesión en extremidad inferior derecha en el segundo mes de tratamiento con tiosulfato sódico.