El desgaste proteico energético (DPE) se asocia a mayor mortalidad y difiere dependiendo del estadio de la enfermedad renal y de la técnica de diálisis. Su prevalencia en pacientes sin diálisis se encuentra poco estudiada y oscila entre el 0 y el 40,8%.
ObjetivoEvaluar el estado nutricional según criterios de DPE y por valoración global subjetiva (VGS) de un colectivo de pacientes españoles con enfermedad renal crónica avanzada (ERCA).
Pacientes y métodosEstudio transversal de 186 pacientes (101 hombres) con edad media de 66,1±16 años. Se realizó evaluación nutricional mediante: VGS, criterios de DPE, registro dietético de 3 días, parámetros antropométricos y bioimpedancia vectorial.
ResultadosUn 30,1% presentaba DPE, con diferencias significativas entre hombres y mujeres (22,8 vs. 33,8%; p<0,005) y un 27,9% tenía valores de VGS en rangos de desnutrición. Sin diferencia entre los 2 métodos estudiados. Los hombres presentaron mayores niveles de proteinuria, porcentaje de masa muscular e ingesta de nutrientes. Las mujeres tuvieron mayores niveles de colesterol total, HDL y porcentaje de masa grasa. Las características de los pacientes con DPE fueron: bajos valores de albúmina y recuento total de linfocitos, elevada proteinuria, baja masa grasa, baja masa muscular y cociente Na/K elevado.
El análisis multivariante mostró asociación de DPE con proteinuria (OR: 1,257; IC 95%: 1,084-1,457; p=0,002), porcentaje de ingesta lipídica (OR: 0,903; IC 95%: 0,893-0,983; p=0,008), recuento total de linfocitos (OR: 0,999; IC 95%: 0,998-0,999; p=0,001) y el índice de masa celular (OR: 0,995; IC 95%: 0,992-0,998).
ConclusiónExiste malnutrición en población española con ERCA, medida por diferentes herramientas. Consideramos conveniente adecuar nuevos elementos diagnósticos a los criterios de DPE.
Protein-energy wasting (PEW) is associated with increased mortality and differs depending on the chronic kidney disease (CKD) stage and the dialysis technique. The prevalence in non-dialysis patients is understudied and ranges from 0 to 40.8%.
ObjectiveTo evaluate the nutritional status of a group of Spanish advanced CKD patients by PEW criteria and subjective global assessment (SGA).
Patients and methodsCross-sectional study of 186 patients (101 men) with a mean age of 66.1±16 years. The nutritional assessment consisted of: SGA, PEW criteria, 3-day dietary records, anthropometric parameters and bioelectrical impedance vector analysis.
ResultsThe prevalence of PEW was 30.1%, with significant differences between men and women (22.8 vs. 33.8%, p < 0.005), while 27.9% of SGA values were within the range of malnutrition. No differences were found between the 2methods. Men had higher proteinuria, percentage of muscle mass and nutrient intake. Women had higher levels of total cholesterol, HDL and a higher body fat percentage. The characteristics of patients with PEW were low albumin levels and a low total lymphocyte count, high proteinuria, low fat and muscle mass and a high Na/K ratio.
The multivariate analysis found PEW to be associated with: proteinuria (OR: 1.257; 95% CI: 1.084–1.457, p=0.002), percentage of fat intake (OR: 0.903; 95% CI: 0.893–0.983, p=0.008), total lymphocyte count (OR: 0.999; 95% CI: 0.998–0.999, p=0.001) and cell mass index (OR: 0.995; 95% CI: 0.992–0.998).
ConclusionMalnutrition was identified in Spanish advanced CKD patients measured by different tools. We consider it appropriate to adapt new diagnostic elements to PEW criteria.
Se define como protein energy wasting (PEW) aquel estado patológico en el que existe una disminución de los depósitos proteicos y energéticos1. El grupo de Gracia propone como traducción al castellano el término desgaste proteico energético (DPE), haciendo hincapié en que este término otorga igual importancia a la malnutrición y al catabolismo2.
El DPE aumenta el riesgo de mortalidad por enfermedad cardiovascular. Este hecho está comprobado en pacientes en hemodiálisis y en pacientes que inician técnicas de diálisis3,4, mientras que en pacientes con enfermedad renal crónica (ERC) sin diálisis se ha demostrado que la disminución de los niveles de albúmina y de recuento total de linfocitos (RTL) aumentan el riesgo de mortalidad5.
La prevalencia de malnutrición difiere según el estadio de enfermedad renal, la técnica de diálisis y la metodología empleada para su diagnóstico; así, en pacientes en hemodiálisis, utilizando la valoración global subjetiva (VGS) se sitúa en torno al 28-80%6,7; en población española, utilizando criterios de la Sociedad Internacional de Nutrición Renal y Metabolismo (ISRNM) en el 37,7%8 y en diálisis peritoneal (DP), utilizando como herramienta la VGS, las cifras se encuentran entre el 11,3 y el 71,5%9,10. En cuanto a los pacientes con enfermedad renal crónica sin diálisis, son muy pocos los estudios que evalúan la presencia de malnutrición, y la mayoría de ellos también utilizan como herramienta la VGS y la escala de malnutrición-inflamación (MIS); ninguno ha sido realizado en población española y su prevalencia oscila entre el 0 y el 40,8%5,11–13.
Son muchas las herramientas que se utilizan para la valoración del estado nutricional en el paciente renal. Por este motivo, el ISRNM ha propuesto unos criterios diagnósticos de DPE en los que se incluyen 4 categorías (bioquímica, masa corporal, masa muscular y relativa a la ingesta), así como la posibilidad de reconocer otras medidas adicionales como marcadores inflamatorios o parámetros de bioimpedancia1.
Debido a que no existe ningún estudio que evalué la presencia de DPE en pacientes españoles con ERCA, y que la etapa ERCA tiene una gran influencia sobre las etapas posteriores de tratamiento renal sustitutivo (TRS), se decidió realizar el presente estudio bajo la hipótesis de que el pronóstico nutricional a largo plazo del paciente con ERCA es modificable mediante un adecuado diagnóstico y posterior intervención, para poder evitar la aparición y el carácter progresivo del DPE.
El objetivo del presente estudio es evaluar el estado nutricional de un colectivo de pacientes españoles con ERCA según criterios de DPE del ISRNM1 y de VGS14.
Pacientes y métodosPacientesSe realizó un estudio transversal en el que fueron incluidos 186 pacientes con ERCA. La población fue seleccionada entre los pacientes atendidos en la consulta de ERCA del Servicio de Nefrología del Hospital Universitario La Paz (Madrid, España).
Los criterios de inclusión fueron los siguientes: ser mayor de 18 años, con ERC estadio 4 y 5, sin TRS (156 presentaban un aclaramiento de creatinina<20ml/min/1,73 m2 [5 no diálisis] y 30 un aclaramiento entre 20 y 30ml/min/1,73 m2), sin deterioro de sus capacidades cognitivas y firmar el consentimiento informado. Los criterios de exclusión fueron: presentar neoplasia activa, infección activa o enfermedad pulmonar grave. El período de reclutamiento de los pacientes fue de marzo del 2008 a septiembre del 2011.
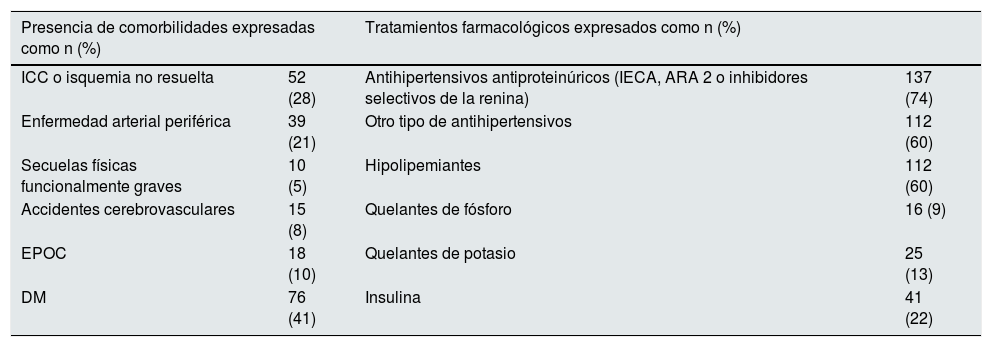
La edad media del colectivo fue de 66,15±16,01 años y el 54,3% (n=101) fueron varones. La etiología de la enfermedad renal fue la siguiente: 76 (40,9%) diabetes mellitus (DM), de los cuales, 6 (7,9%) presentaban DM de tipo 1; 26 (14%) glomerulares; 24 (13,4%) nefroangiosclerosis; otras 19 (14,35%) y no fue filiada en 11 pacientes (10,3%). En la tabla 1, se muestran las comorbilidades y los tratamientos farmacológicos de los pacientes del estudio, sin encontrar diferencias por sexos.
Porcentaje de comorbilidades y tratamientos farmacológicos de 186 pacientes en consulta ERCA
| Presencia de comorbilidades expresadas como n (%) | Tratamientos farmacológicos expresados como n (%) | ||
|---|---|---|---|
| ICC o isquemia no resuelta | 52 (28) | Antihipertensivos antiproteinúricos (IECA, ARA 2 o inhibidores selectivos de la renina) | 137 (74) |
| Enfermedad arterial periférica | 39 (21) | Otro tipo de antihipertensivos | 112 (60) |
| Secuelas físicas funcionalmente graves | 10 (5) | Hipolipemiantes | 112 (60) |
| Accidentes cerebrovasculares | 15 (8) | Quelantes de fósforo | 16 (9) |
| EPOC | 18 (10) | Quelantes de potasio | 25 (13) |
| DM | 76 (41) | Insulina | 41 (22) |
De los 186 pacientes estudiados, 76 presentaban DM, 6 de los cuales era DM tipo I.
ARA 2: antagonistas del receptor de la angiotensina 2; DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica; ICC: insuficiencia cardiaca congestiva; IECA: inhibidores de la enzima convertidores de la angiotensina.
Se recogieron datos relativos a la enfermedad de base, al tratamiento farmacológico, así como a comorbilidades o procesos intercurrentes que pudieran repercutir en el estado nutricional.
Todos los pacientes recibieron las indicaciones dietéticas del nefrólogo, según la práctica clínica habitual y siguiendo las guías K/DOQI15.
Determinaciones analíticasLas muestras sanguíneas fueron recogidas con los pacientes en ayunas. Se determinaron las siguientes variables: albúmina, prealbúmina, aclaramiento de creatinina, creatinina sérica, potasio sérico, fósforo sérico, proteína C reactiva (PCR), recuento total de linfocitos (RTL), colesterol total, LDL, HDL y triglicéridos (TG). También se recogieron variables de la analítica de orina de 24 h: volumen de diuresis y proteinuria. El análisis de los parámetros bioquímicos se realizó en su totalidad siguiendo los métodos estandarizados habituales del Laboratorio de la Unidad de Bioquímica del Hospital Universitario La Paz. La determinación de la albúmina fue mediante la técnica de bromocresol.
Parámetros antropométricos y de composición corporalLa obtención de las medidas antropométricas de los pacientes se ajustó a la técnica estándar y siguió la normativa internacional vigente recomendada (WHO, 1976). Estas medidas fueron realizadas con el sujeto descalzo y en ropa interior. Para medir el peso se utilizó una balanza digital (TANITA BC-420MA, Biológica Tecnología Médica S.L. Barcelona, España). La talla fue obtenida mediante un tallímetro de precisión milimétrica (rango: 80-200cm). Para la medición de la circunferencia muscular del brazo (CMB) se utilizó una cinta métrica inextensible de precisión milimétrica (0,1cm). El pliegue tricipital (PT) se obtuvo mediante un plicómetro Holtain de 20cm de amplitud y sensibilidad de 0,2mm. A partir de las medidas antropométricas de peso y talla, se calculó el índice de masa corporal (IMC) (peso en kg/[talla en cm]2).
La composición corporal se valoró en 80 pacientes con un analizador de bioimpedancia vectorial (BIVA) (Akern Florencia, Italia), que mide a 50Hz y a una intensidad de 0,8mA. Tetrapolar y total. Con un error estándar del 2%. La medición se realizó siguiendo los criterios establecidos por el National Institute of Health Technology Assesment Conference Statement16. En el caso de que el paciente presentase acceso vascular para la realización de la diálisis, todas las mediciones se realizaron en el lado contralateral17. Se calcularon los siguientes parámetros a partir de los valores de resistencia y reactancia, todos en porcentaje: masa grasa (MG), masa muscular (MM), masa libre de grasa (MLG). Con relación a los líquidos corporales, todos en porcentaje: agua corporal total (ACT), agua extracelular (AEC) y agua intracelular (AIC), así como ángulo de fase (AP°), intercambio Na/K, masa celular e índice de masa celular (BCMI).
Patrón alimentarioLa ingesta global de cada paciente se recogió mediante un registro de alimentos de 3 días donde anotaron la totalidad de la ingesta realizada (incluyendo hidratación) durante 3 días consecutivos, uno de ellos de fin de semana. El valor calórico y nutricional de la dieta fue cuantificado con el programa nutricional DietSOURCE® 3.0 (Consumer Health SA).
Estado nutricionalLa evaluación del estado nutricional fue realizada mediante VGS y criterios de DPE de la ISRNM.
Se utilizó la VGS de Detsky14, la cual se divide en 5 subescalas, que valoran: el porcentaje de pérdida de peso en los últimos 3-6 meses, los cambios en la ingesta dietética, la presencia de sintomatología intestinal en las 2últimas semanas (naúseas, vómitos, diarrea, anorexia) y la presencia de cualquier incapacidad funcional. La cuarta subescala es un examen físico en el que se valora la pérdida de MG o MM, la presencia de edemas y ascitis, y se otorga a cada uno una puntuación según normal-media-moderada-severa.
Con estos datos se clasifica al paciente en 3categorías, A (paciente normonutrido), B (paciente leve o moderadamente desnutrido) y C (paciente desnutrido).
Para determinar el estado nutricional según criterios de ISRNM, es necesario que el paciente cumpla un criterio en 3 de las 4 categorías que determinan la presencia de DPE, y que se repitan en al menos 2determinaciones:
- -
categoría bioquímica: albúmina < 3,8g/dl; prealbúmina<30mg/dl masa corporal; colesterol<100mg/dl sin terapia hipolipidemiante18 (en nuestro caso no fue utilizado debido a que 147 pacientes los consumían);
- -
categoría masa corporal: IMC<23kg/m2; pérdida no intencionada de peso del 5% en los últimos 3 meses o de un 10% en los últimos 6 meses;
- -
categoría MM: reducción del 10% de CMB con relación a p50.
- -
categoría de ingesta: tasa de catabolismo proteico (nPNA) <0,6g/kg peso/día; ingesta energética < 25kcal/kg peso/día mantenida en un período de 2 meses. (Para la realización del ajuste energético se ha utilizado peso real, peso ideal o peso ajustado según las guías K/DOQI)15.
Para la descripción de las variables cualitativas se presentan las frecuencias absolutas y porcentajes; y, para las variables cuantitativas, la media y la desviación estándar (X±DE).
La comparación de las variables cualitativas entre 2o más grupos se ha realizado a través del test de la chi-cuadrado o test exacto de Fisher, dependiendo de la distribución de los datos. La comparación de variables cuantitativas entre 2grupos se realizó a través del test de la U de Mann-Whitney o el test de la t de Student, dependiendo de la distribución de los datos.
Para conocer el perfil de los pacientes que tenían DPE, se realizó un modelo de regresión logística multivariante por pasos mediante el método «por pasos hacia delante condicional». Los resultados del ajuste del modelo se describen mediante las odds ratio (OR), con sus correspondientes IC 95%, y los valores p obtenidos.
Todas las pruebas estadísticas se han considerado bilaterales, con un nivel de significación de 0,05. El análisis estadístico fue realizado con el programa estadístico SPSS 17.0.
ResultadosDescripción general de la muestraTodas las variables analizadas se categorizaron por sexo, sin encontrar diferencias entre hombres y mujeres; la edad media de los hombres fue de 65,4±16,1 años y la de las mujeres de 67,1±16,0 años, sin diferencias.
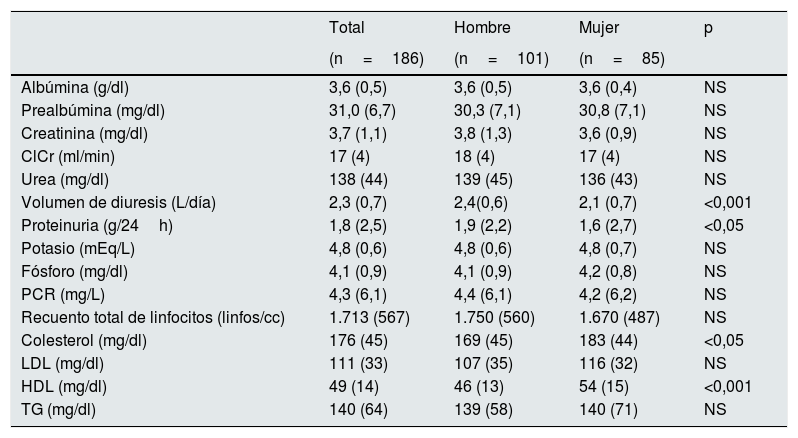
Al analizar los parámetros bioquímicos (tabla 2), los pacientes presentaban niveles bajos de albúmina con niveles normales de prealbúmina, así como concentraciones séricas de PCR y proteinuria elevadas. Los varones presentaron un mayor volumen de diuresis y mayores valores de proteinuria, y las mujeres, mayores valores de colesterol plasmático total (sin alcanzar valores claramente patológicos), así como también de HDL.
Parámetros bioquímicos estudiados de la muestra global de 186 pacientes con ERCA, y estratificada según sexo
| Total | Hombre | Mujer | p | |
|---|---|---|---|---|
| (n=186) | (n=101) | (n=85) | ||
| Albúmina (g/dl) | 3,6 (0,5) | 3,6 (0,5) | 3,6 (0,4) | NS |
| Prealbúmina (mg/dl) | 31,0 (6,7) | 30,3 (7,1) | 30,8 (7,1) | NS |
| Creatinina (mg/dl) | 3,7 (1,1) | 3,8 (1,3) | 3,6 (0,9) | NS |
| ClCr (ml/min) | 17 (4) | 18 (4) | 17 (4) | NS |
| Urea (mg/dl) | 138 (44) | 139 (45) | 136 (43) | NS |
| Volumen de diuresis (L/día) | 2,3 (0,7) | 2,4(0,6) | 2,1 (0,7) | <0,001 |
| Proteinuria (g/24h) | 1,8 (2,5) | 1,9 (2,2) | 1,6 (2,7) | <0,05 |
| Potasio (mEq/L) | 4,8 (0,6) | 4,8 (0,6) | 4,8 (0,7) | NS |
| Fósforo (mg/dl) | 4,1 (0,9) | 4,1 (0,9) | 4,2 (0,8) | NS |
| PCR (mg/L) | 4,3 (6,1) | 4,4 (6,1) | 4,2 (6,2) | NS |
| Recuento total de linfocitos (linfos/cc) | 1.713 (567) | 1.750 (560) | 1.670 (487) | NS |
| Colesterol (mg/dl) | 176 (45) | 169 (45) | 183 (44) | <0,05 |
| LDL (mg/dl) | 111 (33) | 107 (35) | 116 (32) | NS |
| HDL (mg/dl) | 49 (14) | 46 (13) | 54 (15) | <0,001 |
| TG (mg/dl) | 140 (64) | 139 (58) | 140 (71) | NS |
Valores mostrados como media (desviación estándar).
ClCr: aclaramiento de creatinina; HDL: lipoproteína de alta densidad; LDL: lipoproteína de baja densidad; PCR: proteína C reactiva; TG: triglicéridos.
La proteinuria media fue ligera, pero significativamente mayor en los varones. Además, y debido al gran rango encontrado y a que esta tiene una influencia reconocida sobre el estado nutricional, categorizamos la variable en los siguientes intervalos: ≤0,5 g/24 h, 0,6-3 g/24 h y >3 g/24 h, y encontramos que los hombres presentaban más frecuentemente valores de proteinuria >3 g/dl (39 vs. 30%; p < 0,05). La proteinuria correlaciona de manera negativa con la albúmina (r = −0,446; p < 0,05).
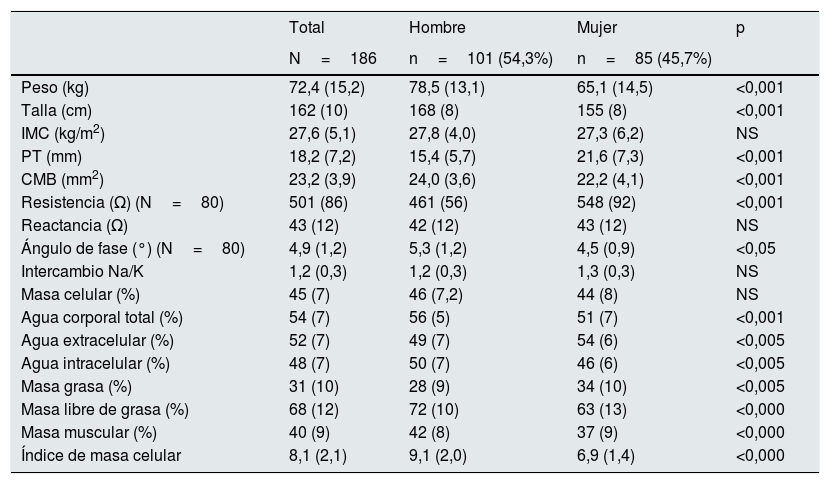
Con relación a los parámetros antropométricos (tabla 3), el IMC medio fue de 27 ± 5,10 kg/m2; los pacientes estudiados se encontraban en rango de sobrepeso grado ii, con la distribución por IMC siguiente: 4 (2,5%) presentaban un IMC < 18,5 kg/m2; 52 pacientes se encontraban en normopeso (IMC: 18,5-24,9 kg/m2); la mayoría, 70 pacientes, se situaban en rangos de sobrepeso (IMC: 25-29,9 kg/m2); 58 presentaban obesidad (IMC > 30 kg/m2) y 3 de ellos presentaban obesidad mórbida.
Parámetros de antropometría y bioimpedancia estudiados de la muestra global de 186 pacientes, estratificada según sexo
| Total | Hombre | Mujer | p | |
|---|---|---|---|---|
| N=186 | n=101 (54,3%) | n=85 (45,7%) | ||
| Peso (kg) | 72,4 (15,2) | 78,5 (13,1) | 65,1 (14,5) | <0,001 |
| Talla (cm) | 162 (10) | 168 (8) | 155 (8) | <0,001 |
| IMC (kg/m2) | 27,6 (5,1) | 27,8 (4,0) | 27,3 (6,2) | NS |
| PT (mm) | 18,2 (7,2) | 15,4 (5,7) | 21,6 (7,3) | <0,001 |
| CMB (mm2) | 23,2 (3,9) | 24,0 (3,6) | 22,2 (4,1) | <0,001 |
| Resistencia (Ω) (N=80) | 501 (86) | 461 (56) | 548 (92) | <0,001 |
| Reactancia (Ω) | 43 (12) | 42 (12) | 43 (12) | NS |
| Ángulo de fase (°) (N=80) | 4,9 (1,2) | 5,3 (1,2) | 4,5 (0,9) | <0,05 |
| Intercambio Na/K | 1,2 (0,3) | 1,2 (0,3) | 1,3 (0,3) | NS |
| Masa celular (%) | 45 (7) | 46 (7,2) | 44 (8) | NS |
| Agua corporal total (%) | 54 (7) | 56 (5) | 51 (7) | <0,001 |
| Agua extracelular (%) | 52 (7) | 49 (7) | 54 (6) | <0,005 |
| Agua intracelular (%) | 48 (7) | 50 (7) | 46 (6) | <0,005 |
| Masa grasa (%) | 31 (10) | 28 (9) | 34 (10) | <0,005 |
| Masa libre de grasa (%) | 68 (12) | 72 (10) | 63 (13) | <0,000 |
| Masa muscular (%) | 40 (9) | 42 (8) | 37 (9) | <0,000 |
| Índice de masa celular | 8,1 (2,1) | 9,1 (2,0) | 6,9 (1,4) | <0,000 |
Valores mostrados como media (desviación estándar).
CMB: circunferencia muscular del brazo; IMC: índice de masa corporal; PT: pliegue triccipital.
La composición corporal medida por bioimpedancia mostraba baja MM, con niveles normales de MG. Con relación a los líquidos corporales, encontramos: AEC ligeramente elevada, con disminución de AIC, tal y como se refleja en los niveles de intercambio Na/K, y valores normales de ACT. Los varones presentaron un mayor peso corporal, sin diferencias en IMC, y se caracterizaron por mayores valores de CMB y por tener mayor cantidad de MLG y MM, en comparación con las mujeres, que presentaban valores mayores de MG y de PT. En cuanto a los líquidos corporales, había mayor porcentaje de ACT en los varones, con ligero predominio de AIC, al contrario que en las mujeres. En las variables relacionadas directamente con el estado nutricional, las mujeres reflejaban peor situación nutricional, con menores valores de AP° y de BCMI.
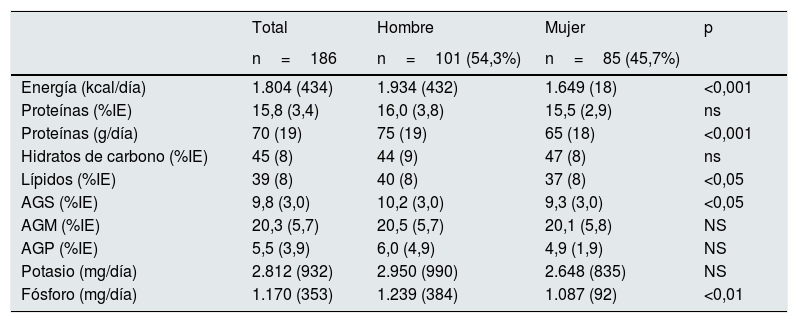
Al analizar el patrón de ingesta de los sujetos estudiados (tabla 4), tanto su perfil calórico como lipídico se encontraban en rangos de normalidad; sin embargo, encontramos diferencias importantes al analizarlos por sexos: la ingesta energética fue significativamente mayor en los varones, acompañada de mayor ingesta proteica y lipídica, y de AGS. De los 2micronutrientes estudiados, potasio y fósforo, su ingesta muestra valores elevados para este colectivo de pacientes, con una mayor ingesta de fósforo en los varones.
Parámetros dietéticos de la muestra de 186 pacientes, y estratificada por sexo
| Total | Hombre | Mujer | p | |
|---|---|---|---|---|
| n=186 | n=101 (54,3%) | n=85 (45,7%) | ||
| Energía (kcal/día) | 1.804 (434) | 1.934 (432) | 1.649 (18) | <0,001 |
| Proteínas (%IE) | 15,8 (3,4) | 16,0 (3,8) | 15,5 (2,9) | ns |
| Proteínas (g/día) | 70 (19) | 75 (19) | 65 (18) | <0,001 |
| Hidratos de carbono (%IE) | 45 (8) | 44 (9) | 47 (8) | ns |
| Lípidos (%IE) | 39 (8) | 40 (8) | 37 (8) | <0,05 |
| AGS (%IE) | 9,8 (3,0) | 10,2 (3,0) | 9,3 (3,0) | <0,05 |
| AGM (%IE) | 20,3 (5,7) | 20,5 (5,7) | 20,1 (5,8) | NS |
| AGP (%IE) | 5,5 (3,9) | 6,0 (4,9) | 4,9 (1,9) | NS |
| Potasio (mg/día) | 2.812 (932) | 2.950 (990) | 2.648 (835) | NS |
| Fósforo (mg/día) | 1.170 (353) | 1.239 (384) | 1.087 (92) | <0,01 |
Valores mostrados como media (desviación estándar).
AGM: ácidos grasos monoinsaturados; AGP: ácidos grasos poliinsaturados; AGS: ácidos grasos saturados; IE: ingesta energética; NS: no significativo.
Se analizó el estado nutricional mediante VGS y por criterios de DPE. En cuanto a los resultados por VGS: un 72,1% (134) estaba normonutrido (categoría A), un 27,9% (52) presentaba algún grado de desnutrición: un 25,8% (48) correspondía a la categoría B y solo un 2,2% (4) presentó desnutrición grave (categoríaC). No se encontraron diferencias por sexo en ninguna de las categorías.
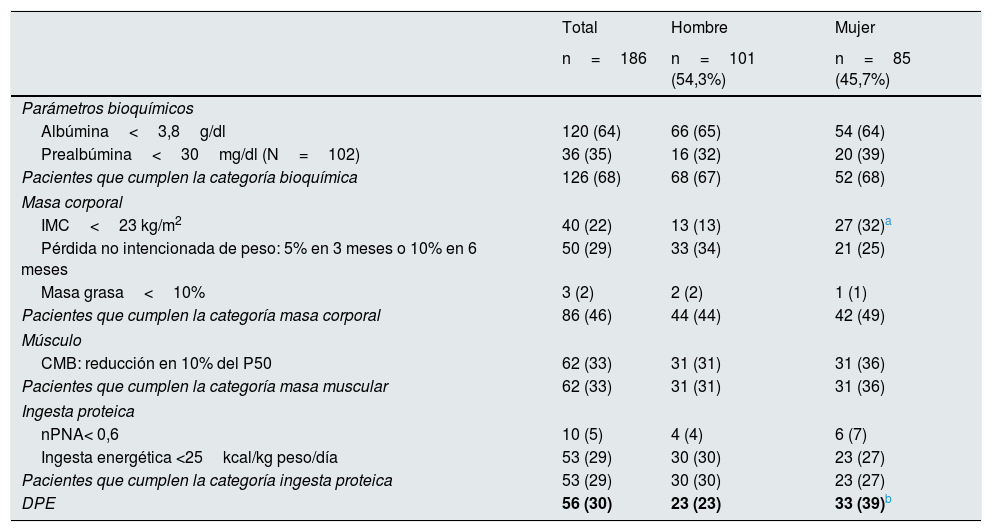
Según los criterios de ISRNM, 56 (30,10%) de los pacientes presentaban DPE (tabla 5), con diferencias significativas por sexos (las mujeres presentaban más DPE que los hombres). No se encontraron diferencias por categorías, y el único criterio que se presentó en mayor medida en las mujeres fue el IMC<23kg/m2 (31,8 vs. 12,9%; p<0,01).
Criterios de DPE de 186 pacientes estudiados, muestra global y categorizados por sexos. Los valores se expresan como N (%)
| Total | Hombre | Mujer | |
|---|---|---|---|
| n=186 | n=101 (54,3%) | n=85 (45,7%) | |
| Parámetros bioquímicos | |||
| Albúmina<3,8g/dl | 120 (64) | 66 (65) | 54 (64) |
| Prealbúmina<30mg/dl (N=102) | 36 (35) | 16 (32) | 20 (39) |
| Pacientes que cumplen la categoría bioquímica | 126 (68) | 68 (67) | 52 (68) |
| Masa corporal | |||
| IMC<23 kg/m2 | 40 (22) | 13 (13) | 27 (32)a |
| Pérdida no intencionada de peso: 5% en 3 meses o 10% en 6 meses | 50 (29) | 33 (34) | 21 (25) |
| Masa grasa<10% | 3 (2) | 2 (2) | 1 (1) |
| Pacientes que cumplen la categoría masa corporal | 86 (46) | 44 (44) | 42 (49) |
| Músculo | |||
| CMB: reducción en 10% del P50 | 62 (33) | 31 (31) | 31 (36) |
| Pacientes que cumplen la categoría masa muscular | 62 (33) | 31 (31) | 31 (36) |
| Ingesta proteica | |||
| nPNA< 0,6 | 10 (5) | 4 (4) | 6 (7) |
| Ingesta energética <25kcal/kg peso/día | 53 (29) | 30 (30) | 23 (27) |
| Pacientes que cumplen la categoría ingesta proteica | 53 (29) | 30 (30) | 23 (27) |
| DPE | 56 (30) | 23 (23) | 33 (39)b |
Valores mostrados como porcentajes.
CMB: circunferencia muscular del brazo; DPE: desgaste proteico energético; IMC: índice de masa corporal; nPNA: tasa de catabolismo proteico; P50: percentil cincuenta.
El 30,1% de los pacientes estudiados mostraron DPE, con una mayor proporción de secuelas físicas funcionalmente graves (12,5 vs. 1,5%; p<0,005); sin embargo, no mostraron diferencias en el resto de las comorbilidades estudiadas, ni en el tratamiento farmacológico.
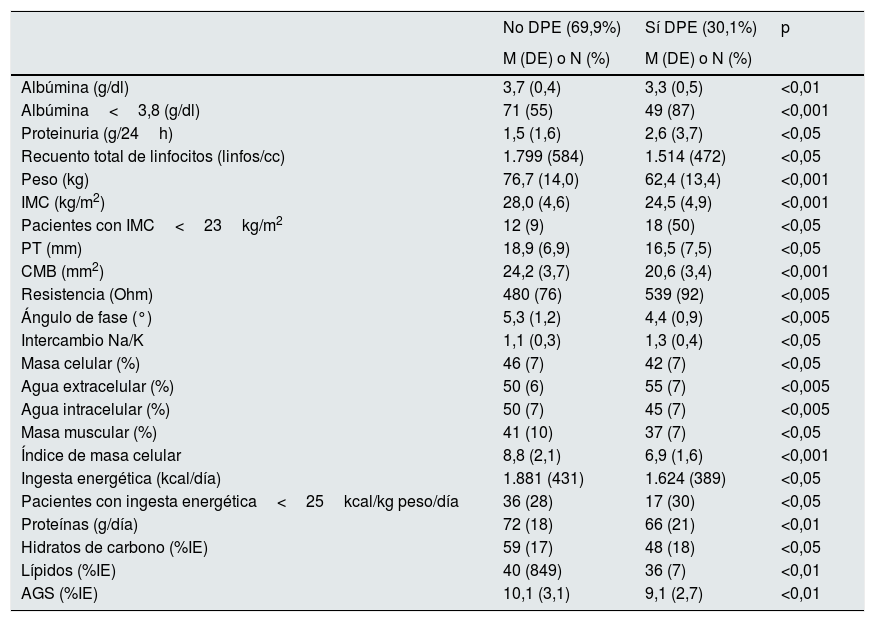
En la tabla 6, se recogen todas las variables que mostraron significación al comparar los pacientes según la presencia o no de DPE.
Parámetros bioquímicos, antropométricos, de composición corporal y dietéticos en función de la presencia o no de DPE
| No DPE (69,9%) | Sí DPE (30,1%) | p | |
|---|---|---|---|
| M (DE) o N (%) | M (DE) o N (%) | ||
| Albúmina (g/dl) | 3,7 (0,4) | 3,3 (0,5) | <0,01 |
| Albúmina<3,8 (g/dl) | 71 (55) | 49 (87) | <0,001 |
| Proteinuria (g/24h) | 1,5 (1,6) | 2,6 (3,7) | <0,05 |
| Recuento total de linfocitos (linfos/cc) | 1.799 (584) | 1.514 (472) | <0,05 |
| Peso (kg) | 76,7 (14,0) | 62,4 (13,4) | <0,001 |
| IMC (kg/m2) | 28,0 (4,6) | 24,5 (4,9) | <0,001 |
| Pacientes con IMC<23kg/m2 | 12 (9) | 18 (50) | <0,05 |
| PT (mm) | 18,9 (6,9) | 16,5 (7,5) | <0,05 |
| CMB (mm2) | 24,2 (3,7) | 20,6 (3,4) | <0,001 |
| Resistencia (Ohm) | 480 (76) | 539 (92) | <0,005 |
| Ángulo de fase (°) | 5,3 (1,2) | 4,4 (0,9) | <0,005 |
| Intercambio Na/K | 1,1 (0,3) | 1,3 (0,4) | <0,05 |
| Masa celular (%) | 46 (7) | 42 (7) | <0,05 |
| Agua extracelular (%) | 50 (6) | 55 (7) | <0,005 |
| Agua intracelular (%) | 50 (7) | 45 (7) | <0,005 |
| Masa muscular (%) | 41 (10) | 37 (7) | <0,05 |
| Índice de masa celular | 8,8 (2,1) | 6,9 (1,6) | <0,001 |
| Ingesta energética (kcal/día) | 1.881 (431) | 1.624 (389) | <0,05 |
| Pacientes con ingesta energética<25kcal/kg peso/día | 36 (28) | 17 (30) | <0,05 |
| Proteínas (g/día) | 72 (18) | 66 (21) | <0,01 |
| Hidratos de carbono (%IE) | 59 (17) | 48 (18) | <0,05 |
| Lípidos (%IE) | 40 (849) | 36 (7) | <0,01 |
| AGS (%IE) | 10,1 (3,1) | 9,1 (2,7) | <0,01 |
Valores mostrados como media (desviación estándar), a excepción de las variables no cuantitativas que se muestran como N (%).
AGS: ácidos grasos saturados; CMB: circunferencia de masa muscular; DPE: desgaste proteico energético; IE: ingesta energética; IMC: índice de masa muscular; PT: pliegue triccipital.
Con relación a los parámetros bioquímicos, los pacientes con DPE presentaban menores valores de albúmina y RTL, así como una mayor proteinuria que los pacientes sin DPE; en el resto de los parámetros estudiados, no encontramos diferencias significativas.
Al observar los parámetros antropométricos y de bioimpedancia, los pacientes con DPE se caracterizaban por presentar menor peso corporal, con un menor IMC y, en cuanto a su composición corporal, tenían menor PT, CMB y MM. El ACT fue muy similar en los 2grupos, aunque su distribución era diferente: los pacientes con DPE presentaban mayores niveles de AEC, con menor AIC. El AP°, masa celular e BCMI fueron también menores en el grupo con DPE.
En el análisis del patrón alimentario, la ingesta energética fue menor en el grupo con DPE, así como la del resto de los macronutrientes: proteína, porcentaje de HC y de ingesta lipídica, sin embargo, a pesar del menor consumo en ácidos grasos monoinsaturados (AGM) (19,3±5,1 vs. 20,8±5,9; p=ns) y de ácidos grasos poliinsaturados (AGP) (5,1±2,1 vs. 5,7±4,5; p = ns), solo los AGS mostraron significación. El grupo de DPE presentó una menor ingesta de los minerales, que no fue significativa: potasio (2.661, 3 ± 105,7 vs. 2.876,8 ± 868,1) y fósforo (1.101,2 ± 326, 9 vs. 1.199,6 ± 360,1).
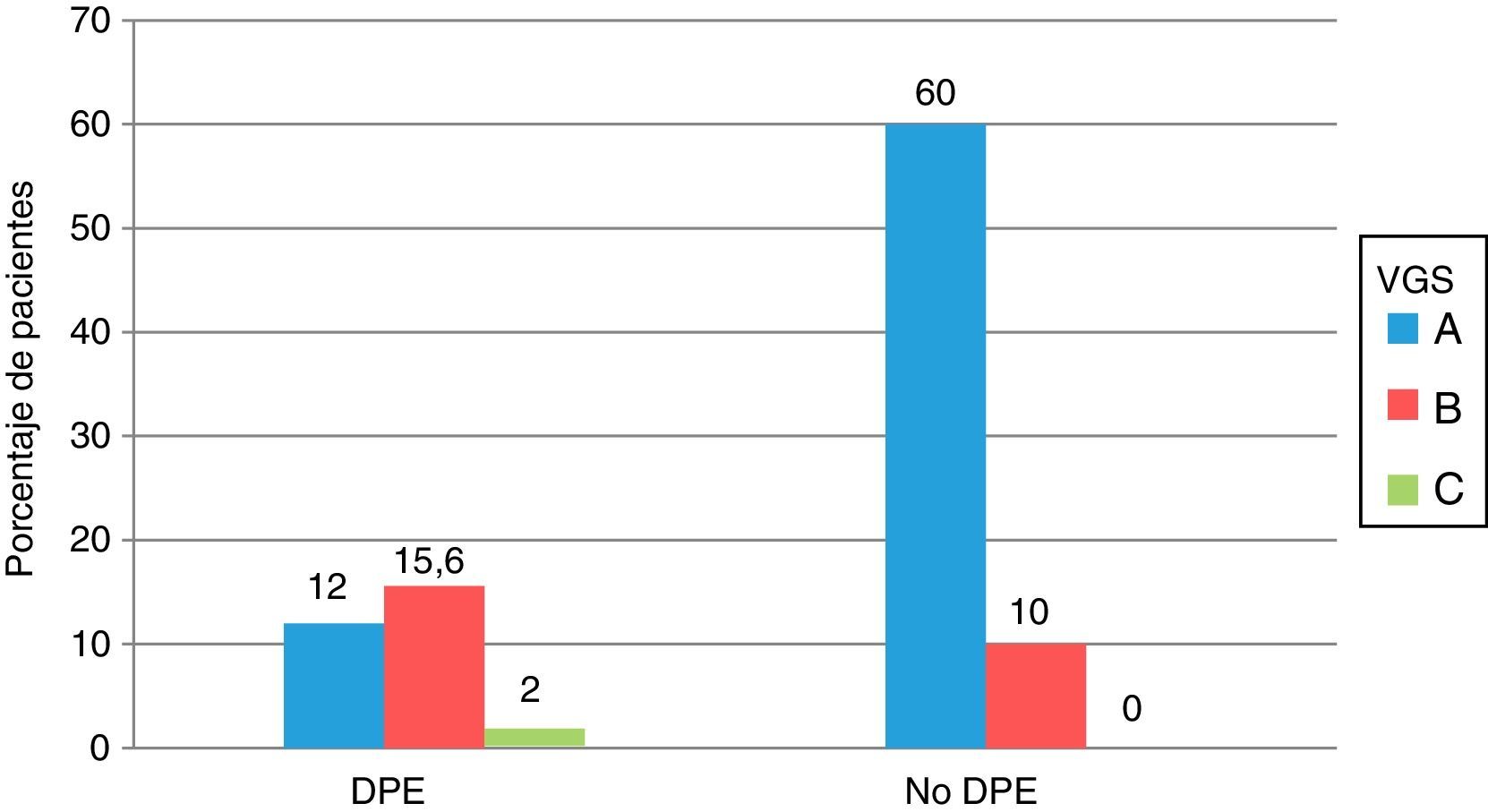
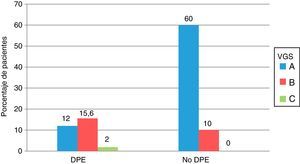
En la figura 1, comparamos el estado nutricional según VGS y por criterios de DPE: 17 de los 56 pacientes con DPE estaban normonutridos según VGS (categoría A) y 19 de los 130 pacientes sin DPE se encontraban moderadamente desnutridos (categoría B), aunque las diferencias no fueron significativas.
Comparación del estado nutricional de los 186 pacientes con ERCA, valorados según los criterios de desgaste proteico energético del ISRMN y por valoración global subjetiva.
Todos los valores se expresan como porcentajes.
DPE: desgaste proteico energético; VGS: valoración global subjetiva.
Los criterios del ISRNM respecto a la VGS presentan una sensibilidad del 82,2% (IC 95%: 75,6-88,3), así como una especificidad del 62% (IC 95%: 48,2-74,1) y una OR diagnóstica de 7,87 (IC 95%: 3,81-16,28).
Con relación a los criterios que definen la DPE, encontramos diferencias significativas en los relativos a albúmina, IMC e ingesta energética, pero, sin embargo, no hubo diferencias al analizar las diferentes categorías entre sí.
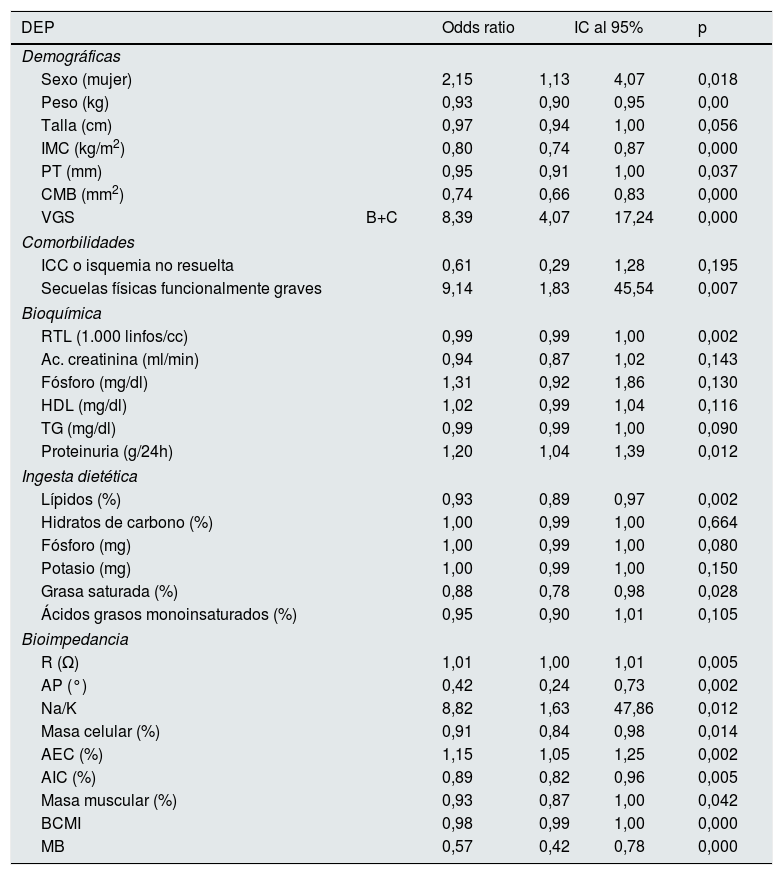
En la tabla 7 y en la tabla 8, se muestran los resultados del análisis de regresión logística univariante y multivariante.
Modelo de regresión univariante. Odds ratios e intervalos de confianza al 95% para la presencia de desgaste proteico energético en 186 pacientes en consulta de ERCA
| DEP | Odds ratio | IC al 95% | p | ||
|---|---|---|---|---|---|
| Demográficas | |||||
| Sexo (mujer) | 2,15 | 1,13 | 4,07 | 0,018 | |
| Peso (kg) | 0,93 | 0,90 | 0,95 | 0,00 | |
| Talla (cm) | 0,97 | 0,94 | 1,00 | 0,056 | |
| IMC (kg/m2) | 0,80 | 0,74 | 0,87 | 0,000 | |
| PT (mm) | 0,95 | 0,91 | 1,00 | 0,037 | |
| CMB (mm2) | 0,74 | 0,66 | 0,83 | 0,000 | |
| VGS | B+C | 8,39 | 4,07 | 17,24 | 0,000 |
| Comorbilidades | |||||
| ICC o isquemia no resuelta | 0,61 | 0,29 | 1,28 | 0,195 | |
| Secuelas físicas funcionalmente graves | 9,14 | 1,83 | 45,54 | 0,007 | |
| Bioquímica | |||||
| RTL (1.000 linfos/cc) | 0,99 | 0,99 | 1,00 | 0,002 | |
| Ac. creatinina (ml/min) | 0,94 | 0,87 | 1,02 | 0,143 | |
| Fósforo (mg/dl) | 1,31 | 0,92 | 1,86 | 0,130 | |
| HDL (mg/dl) | 1,02 | 0,99 | 1,04 | 0,116 | |
| TG (mg/dl) | 0,99 | 0,99 | 1,00 | 0,090 | |
| Proteinuria (g/24h) | 1,20 | 1,04 | 1,39 | 0,012 | |
| Ingesta dietética | |||||
| Lípidos (%) | 0,93 | 0,89 | 0,97 | 0,002 | |
| Hidratos de carbono (%) | 1,00 | 0,99 | 1,00 | 0,664 | |
| Fósforo (mg) | 1,00 | 0,99 | 1,00 | 0,080 | |
| Potasio (mg) | 1,00 | 0,99 | 1,00 | 0,150 | |
| Grasa saturada (%) | 0,88 | 0,78 | 0,98 | 0,028 | |
| Ácidos grasos monoinsaturados (%) | 0,95 | 0,90 | 1,01 | 0,105 | |
| Bioimpedancia | |||||
| R (Ω) | 1,01 | 1,00 | 1,01 | 0,005 | |
| AP (°) | 0,42 | 0,24 | 0,73 | 0,002 | |
| Na/K | 8,82 | 1,63 | 47,86 | 0,012 | |
| Masa celular (%) | 0,91 | 0,84 | 0,98 | 0,014 | |
| AEC (%) | 1,15 | 1,05 | 1,25 | 0,002 | |
| AIC (%) | 0,89 | 0,82 | 0,96 | 0,005 | |
| Masa muscular (%) | 0,93 | 0,87 | 1,00 | 0,042 | |
| BCMI | 0,98 | 0,99 | 1,00 | 0,000 | |
| MB | 0,57 | 0,42 | 0,78 | 0,000 | |
AEC: agua extracelular; AF: ángulo de fase; AIC: agua intracelular; BCMI: índice de masa celular; CMB: circunferencia muscular del brazo; ICC: insuficiencia cardiaca congestiva; IMC: índice de masa corporal; MB: metabolismo basal; PT: pliegue triccipital; R: resistencia; RTL: recuento total de linfocitos; TG: triglicéridos; VGS: valoración global subjetiva.
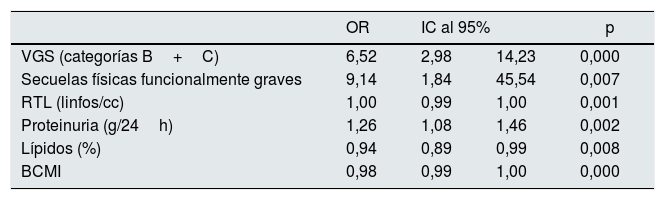
Modelo de regresión multivariante. Odds ratios e intervalos de confianza al 95% para la presencia de desgaste proteico energético en 186 pacientes en consulta de ERCA
| OR | IC al 95% | p | ||
|---|---|---|---|---|
| VGS (categorías B+C) | 6,52 | 2,98 | 14,23 | 0,000 |
| Secuelas físicas funcionalmente graves | 9,14 | 1,84 | 45,54 | 0,007 |
| RTL (linfos/cc) | 1,00 | 0,99 | 1,00 | 0,001 |
| Proteinuria (g/24h) | 1,26 | 1,08 | 1,46 | 0,002 |
| Lípidos (%) | 0,94 | 0,89 | 0,99 | 0,008 |
| BCMI | 0,98 | 0,99 | 1,00 | 0,000 |
BCMI; índice de masa celular; RTL: recuento total de linfocitos; VGS: valoración global subjetiva.
Este estudio pone de manifiesto la presencia de malnutrición en la población española con ERCA mediante diferentes herramientas de valoración nutricional, así como los principales factores asociados al DPE en estos pacientes. El análisis multivariante demostró que el RTL, la proteinuria, el porcentaje de ingesta lipídica, el BCMI y la presencia de secuelas físicas funcionalmente graves son variables predictivas de DPE en la población estudiada. Ninguna de estas variables está recogida en la definición clásica de DPE, pero sí está relacionada con cada una de sus categorías.
Aspectos epidemiológicos comparativosLa prevalencia de malnutrición en nuestros pacientes por criterios del ISRNM es del 30,1% y por VGS del 27,9%, superior a la encontrada por otros autores en diferentes poblaciones no europeas. En pacientes australianos, Campbell et al.19 encontraron en 56 pacientes una prevalencia del 12% y Lawson11, usando la misma herramienta en 122 pacientes, un 28%. Cuppari et al.20, utilizando la VGS, encontraron que un 11% de los 922 pacientes estudiados presentaban malnutrición, pero que un 32% se encontraban en riesgo; sin embargo, otros grupos brasileños no han encontrado malnutrición en sus pacientes, valorados mediante parámetros antropométricos, bioquímicos y de ingesta21,22. El reciente estudio de Amparo et al.23 encontró valores superiores al nuestro en los 300 pacientes con ERCA estudiados, ya que un 63,7% presentaba cifras del MIS>3 y un 19%, MIS>8.
En población europea, la prevalencia de malnutrición observada también ha sido inferior a la que hemos encontrado en nuestro estudio. Kovesdy et al.13 estudiaron a 1.220 pacientes e indicaron que un 44,83% presentaba niveles de albúmina inferiores a 3,7mg/dl, cifra inferior a la encontrada por nosotros, si atendemos al criterio de presentar niveles de albúmina < 3,8mg/dl, donde nos encontramos cifras del 68,8%. Westland24 encontró porcentajes de malnutrición medidos por VGS en población noruega del 11%. Los datos de prevalencia de malnutrición oscilan, pues, dependiendo de la herramienta de valoración nutricional utilizada y del estadio de la enfermedad renal, pero constatamos, al igual que otros autores2,25, que factores geográficos y culturales determinan también su aparición.
Incidencia de malnutrición en enfermedad renal crónica avanzada y diálisis (tratamiento renal sustitutivo). Su relación secuencialEn población española se ha estudiado la presencia de malnutrición en TRS, que es elevada cuando consideramos solamente parámetros bioquímicos. Yuste et al.26 estudiaron la prevalencia de malnutrición durante un año de seguimiento en 124 pacientes en hemodiálisis, y encontraron un 71,9% cuando se empleaba como criterio valores de albúmina<3,8mg/dl; un 64,6% si el criterio era prealbúmina<30mg/dl y solo un 3,4% si era colesterol total<100mg/dl. Ruperto et al.27 unificaron los criterios de malnutrición en la suma de albúmina, CMB y peso corporal, y encontraron malnutrición en un 52,5% de los 80 pacientes estudiados. En diálisis peritoneal los estudios existentes indican que su incidencia es del 21%28. En ERCA los datos señalan que la incidencia es mayor según progresa la insuficiencia renal, y que alcanza su máxima al final de ella, en diálisis. Se deduce pues, una proyección temporal desde la ERCA hasta la diálisis, por lo que el conocimiento del estado nutricional y su tratamiento podrían evitar la llegada a diálisis con un estado nutricional deficiente instaurado en el tiempo, lo que conlleva una mayor dificultad en su tratamiento y un peor pronóstico29.
Elementos que completan la definición del estado nutricional en nuestra serie de enfermedad renal crónica avanzadaHemos valorado el estado nutricional utilizando los criterios del ISRNM y los parámetros utilizados en la práctica clínica habitual en la consulta de ERCA, donde hemos podido encontrar la existencia de nuevos elementos que identifican a nuestra población con ERCA desnutrida. La proteinuria >10g/24h se considera una de las causa de DPE30, sin embargo, nosotros encontramos que el DPE se asocia también a valores muy inferiores de proteinuria (≥2,5g/24h). El RTL es uno de los marcadores clásicos de estado nutricional deficiente31 y de riesgo de mortalidad en pacientes con ERCA13: nuestros datos confirman este hecho.
El papel de la utilidad de la biompedancia monofrecuencia como marcador nutricional está comprobado32,33. En nuestro estudio, la mayoría de las variables de composición corporal estudiadas confirmaban la existencia de malnutrición: con un patrón de composición corporal caracterizado por bajos depósitos de MG, de MM, cociente AEC/AIC invertido, menores niveles de BCMI y AP° bajos; todas estas diferencias están matizadas por el sexo del individuo, como está descrito en la bibliografía34. El panel de expertos del ISRNM, en su definición de criterios de DPE, propone que se podrían unir a estos criterios parámetros de bioimpedancia y parámetros bioquímicos, como el porcentaje de linfocitos1. Los datos encontrados en nuestra población confirman lo deseable de la inclusión de estos parámetros para el diagnóstico de DPE en ERCA.
A pesar de las limitaciones del IMC como la edad, género, estado de hidratación en los pacientes con ERC, y que este no discrimina entre MG y masa magra35, en nuestros pacientes consideramos adecuado su uso, debido a que la mayoría presentaban un adecuado estado de hidratación, reflejado en un porcentaje de ACT de 54,3 ± 6,7.
Los valores de prealbúmina se encuentran aumentados en los pacientes en diálisis36, pero no se ha establecido su punto de corte en población con ERCA. A pesar de esto, un 35,3% presentaban valores <30mg/dl, sin diferencias por grupos. Consideramos, al igual que la literatura, que la prealbúmina no es un marcador definitorio de DPE, y que sería necesario utilizarla conjuntamente con otros marcadores para la valoración del estado nutricional en pacientes con ERCA37.
A pesar de la relación existente entre malnutrición e inflamación38, nosotros no la hemos encontrado en este estudio; consideramos que este hecho puede ser debido a que los pacientes estudiados presentaban un grado inflamación bajo, con una PCR media de 4,3±6,1mg/l.
El desgaste proteico energético modifica el diagnóstico de malnutrición hecho por valoración global subjetivaLa VGS en sus diferentes modalidades ha sido el método usado mayoritariamente para diagnosticar malnutrición, ya que su relación con marcadores nutricionales y con mortalidad en pacientes con ERCA ha sido comprobada39. En nuestro estudio no encontramos diferencias en cuanto al diagnóstico de malnutrición realizado por criterios del ISRNM y de VGS, pero sí consideramos que sería conveniente utilizar alguna medida objetiva, como la composición corporal, para una valoración más completa40. A pesar de las pequeñas diferencias encontradas en el diagnóstico del estado nutricional, DPE (30,1%) vs. VGS (27,9%), creemos que los estados de inflamación mantenidos, la proteinuria y la propia escala utilizada para la VGS —en este caso la clásica de Detsky14, donde la práctica clínica juega un papel clave—, pueden haber contribuido a estos resultados.
De las 4categorías diagnósticas de DPE, la mayoría de nuestros pacientes cumplen la bioquímica y la que menos se cumple es la referida a ingesta, con la característica de que solo el 5,4% de los pacientes presentan baja ingesta proteica. En nuestra opinión, este hecho puede ser debido a la dificultad que conlleva una ingesta proteica tan baja, y consideramos que la ingesta energética jugaría un papel conservador, basado en la ingesta lipídica.
En resumen, nuestros datos permiten considerar que las herramientas nutricionales deben validarse según el estadio de la enfermedad23, el área geográfica2,7 y otros factores como la proteinuria, otorgando una gran importancia a la composición corporal y teniendo en cuenta el carácter dinámico de la desnutrición reflejado en los criterios de DPE1,2.
Las principales limitaciones que presenta nuestro estudio son no haber dispuesto de todas las variables en los sujetos estudiados —como por ejemplo las variables de bioimpedancia (N=80), prealbúmina (N=102)— y la inclusión de parámetros de fuerza muscular, así como no haber podido mostrar variables dinámicas del DPE (pérdida de masa muscular) ni de actividad física.
En conclusión, nuestro estudio demuestra que existe DPE en población española con ERCA, medida por diferentes herramientas, en un porcentaje mayor al reportado en otros países. Creemos que es conveniente considerar nuevos elementos diagnósticos para una mejor valoración nutricional de los pacientes, así como adecuar los criterios de DPE, no solo al estadio de la enfermedad, sino también al área geográfica, y que tanto la proteinuria como el BCMI son variables indispensables para monitorizar el estado nutricional en pacientes con ERCA.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses potenciales relacionados con los contenidos del artículo.
A Nutrición Médica, que apoyó con una beca al equipo de la Unidad de Nutrición en las actividades de investigación.
Al Dr. Cigarrán por su apoyo y motivación en la realización del artículo.