INTRODUCCIÓN
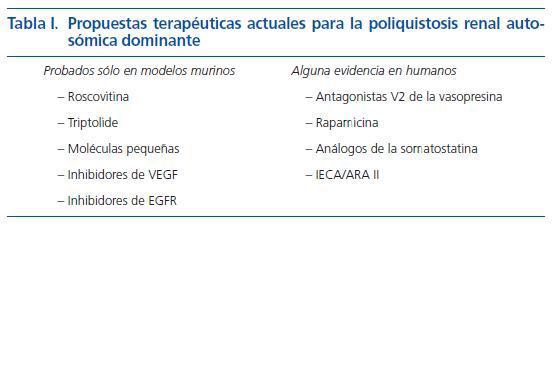
La poliquistosis renal autosómica dominante (PQRAD) es una causa frecuente de IRCT en adultos. Actualmente no tiene un tratamiento específico pero en los últimos años se han hecho grandes progresos en el conocimiento del proceso de quistogénesis y en la comprensión de la patogenia de la enfermedad. Existen claras evidencias que apoyan un papel preponderante de la proliferación de las células epiteliales, de la secreción de fluido transepitelial así como del remodelaje de la matriz extracelular. Basándose en estas evidencias y utilizando como parámetro de eficacia, la progresión del volumen renal, se están ensayando diversas aproximaciones terapéuticas para la PQRAD (tabla I).
ALTERACIONES FENOTÍPICAS DE LA CÉLULA EPITELIAL POLIQUÍSTICA QUE CONSTITUYEN NUEVAS DIANAS TERAPÉUTICAS
Las alteraciones descritas en la célula epitelial poliquística son múltiples, a pesar de ello queda aun bastante por conocer. Nos centraremos solo en aquellas alteraciones que redundan en posibilidades terapéuticas.
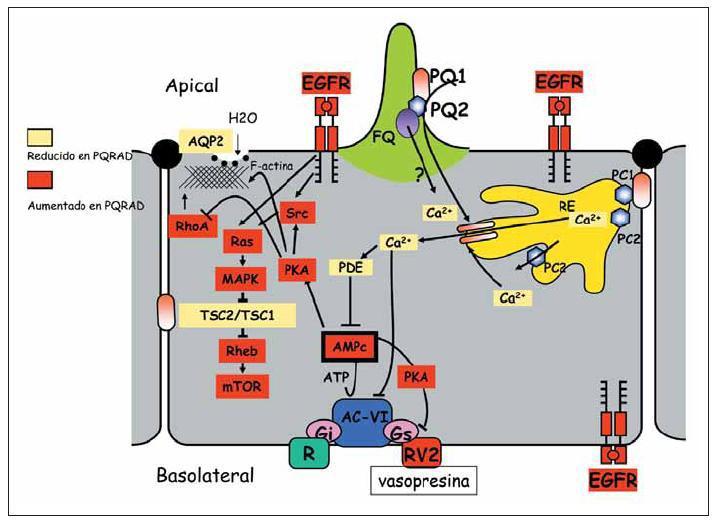
Las poliquistinas 1 y 2 (PQ1, PQ2) se han localizado, entre otros lugares, en los cilios primarios. Se ha sugerido que estos cilios actúan como sensores de flujo en el túbulo renal, y como respuesta al flujo, provocan una entrada de calcio a la célula mediado por la PQ2, la cual actúa como un canal catiónico. Una PQ2 anómala (o una PQ1 anómala, debido a la interacción entre ambas) daría lugar a una reducción del calcio intracelular. Por otra parte, es una evidencia que los niveles de AMPc están elevados en esta enfermedad. El calcio bajo intracelular puede causar una respuesta proliferativa a los niveles elevados de AMPc, el cual se comporta como antiproliferativo en una célula epitelial normal. También se ha demostrado que el AMPc elevado tiene un papel importante en la secreción de fluido. La PQ1 se une a proteínas G, las cuales normalmente actúan sobre receptores unidos a proteínas que tienen como función inhibir el AMPc. Por lo tanto un déficit de PQ1 o una PQ1 anómala condiciona un aumento del AMPc. Este AMPc a través de diversos mecanismos facilita la migración de aquaporina 2 a la membrana apical, aumentando la permeabilidad osmótica de la membrana1 (fig. 1).
En la PQRAD existe un defecto de concentración precoz, antes de la desestructuración renal por los quistes, que se cree debido a una traslocación inadecuada a la membrana apical de la aquaporina2, seguramente secundaria a un defecto en la despolimerización de la actina F. Recientemente Wang X y cols., han demostrado el papel deletéreo de la vasopresina en los riñones poliquísticos. Utilizando ratas knock out para el gen de la vasopresina y cruzándolos con ratas poliquísticas han demostrado que las ratas poliquísticas sin vasopresina no desarrollan prácticamente la enfermedad, mientras que si se les administra vasopresina exógena desarrollan poliquistosis2. Esta observación apoya el papel clave de la vasopresina en la quistogénesis.
Por otra parte se ha evidenciado una interacción entre la PQ1 y la tuberina.La tuberina es la proteína codificada por el gen TSC2, causante de una de las 2 formas de esclerosis tuberosa. Parece ser que la PQ1 regula mTOR (mammalian target of rapamycin) a través de la MAP y Ser quinasas3. mTOR estimula el crecimiento y proliferación celular y por otra parte la inhibición de mTOR favorece la apoptosis. El complejo tuberina-hamartina (proteína codificada por el gen TSC1) mantiene inhibido mTOR. Existen evidencias mostrando que la PQ1 interactúa con la tuberina pero también con mTOR directamente. De esta manera, la disfunción de la PQ1 daría lugar a una activación de mTOR. Las células epiteliales renales muestran una elevada actividad de mTOR en el desarrollo postnatal mientras que éste está prácticamente inactivo en la edad adulta, estando solo activado en casos de «reparación» renal (ej. hipertrofia renal compensadora, obstrucción renal...). La demostración de la activación de mTOR en riñones poliquísticos hace pensar que se trata de un mecanismo continuo de reparación «inútil» favoreciendo el depósito de matriz extracelular, la proliferación y la fibrosis4.
EL VOLUMEN RENAL COMO MEDIDA DE LA EFICACIA DE UN TRATAMIENTO PARA LA PQRAD
El lento deterioro de la función renal en la PQRAD así como la probable ineficacia del tratamiento en fases de insuficiencia renal avanzada, han hecho necesario validar una medida objetiva de progresión de la enfermedad. El NIH ha auspiciado un amplio estudio multicéntrico norteamericano con este fin: CRISP (Consortium for Radiologic Imaging Studies of PKD). El resultado más relevante ha sido la evidencia que la RNM es la mejor técnica para estimar los cambios de volumen quístico y renal en esta enfermedad, en caso de periodos de seguimiento cortos. Se ha visto que la tasa de «crecimiento» renal permanece constante para un paciente determinado, que a una edad determinada progresa más rápido el paciente con unos riñones de mayor volumen y que un volumen renal superior a 750 cc es un factor de mal pronóstico para la progresión de la enfermedad5, 6.
PROPUESTAS TERAPÉUTICAS
Antagonistas del receptor de la vasopresina
Los receptores V2 están situados en la membrana basolateral de las células principales de la parte final del túbulo distal y a lo largo del túbulo colector. Estos receptores están unidos a una proteína G que estimula la producción de AMPc.
El efecto de la vasopresina, a través de los receptores V2, sobre los niveles de AMPc de las células epiteliales provenientes de túbulos colectores, junto al efecto quistogénico del AMPc, ha propiciado la idea de tratar modelos poliquístico animales con antagonistas de los receptores V2 de la vasopresina. Inicialmente se utilizó el antagonista V2: OPC-31260 en modelos animales de poliquistosis dominante, recesiva y de nefronoptisis con resultados alentadores7. Posteriormente se utilizó el antagonista OPC-41061 (Tolvaptan), por ser el de mayor afinidad con los receptores V2 humanos, en ratas PCK. Se demostró su gran eficacia en reducir los niveles de AMPc, el peso renal, el volumen quístico, la fibrosis y los índices apoptótico y mitótico. Al no haber receptores V2 en el hígado, no se objetivó ninguna mejoría de la patología quística hepática8.
En un estudio en fase IIb en pacientes poliquísticos con función renal normal se demostró una excelente tolerancia y eficacia con dosis entre 60 y 480 mg al día9. El volumen de diuresis, la frecuencia de la nicturia, la osmolaridad en orina de 24 h y la natremia se correlacionaron con la dosis de Tolvaptán administrada.
En la actualidad se está llevando a cabo el ensayo clínico TEMPO III/IV (Tolvaptan Efficay and safety in Management of Polycystic kidney disease and its Outcomes). Se trata de ver el efecto sobre el volumen renal, medido por RNM, a los 3 años de tratamiento, con una escalada de dosis de 60 a 120 mg de Tolvaptan. El estudio es multicéntrico (125 hospitales de Europa, Norte y Sudamérica, Australia y Japón) y prevé reclutar 1.500 pacientes adultos (entre 18 y 50 años) con filtrado glomerular superior a 60 ml/min y evidencia de rápida progresión de la enfermedad (volumen renal > 750 cc). La primera inclusión fue en marzo del 2007 y se espera finalizar durante el 2011. España quedó excluida de este ensayo clínico por un desacuerdo del laboratorio promotor (OTSUKA) con un aspecto legal de los ensayos clínicos en nuestro país.
Análogos de la somatostatina
La somatostatina es un péptido cíclico de 14 aminoácidos secretado por las células D de los islotes pancreáticos, del tracto gastrointestinal, del sistema nervioso y de la glándula tiroides. La evidencia de que la somatostatina disminuye el AMPc junto a la observación de la disminución tamaño renal de un paciente poliquístico con un adenoma de hipófisis que recibía somatostatina sugirió su posible utilidad en la PQRAD10. A diferencia de los antagonistas de la vasopresina, los análogos de la somatostatina sí tienen acción sobre la poliquistosis hepática.
En un estudio realizado por Ruggeneti y cols., en 12 pacientes se demostró una clara eficacia del tratamiento con Octreotide en la reducción del volumen renal10.
Actualmente existen 2 ensayos clínicos con Octreotide en marcha: Fase III en el Instituto Mario Negri para evaluar la eficacia en el enlentecimiento del deterioro renal y Fase II/III en la Clínica Mayo para valorar la eficacia en la poliquistosis hepática masiva.
Inhibidores de mTOR
Debido a la evidencia de la activación de mTOR en las células poliquísticas, los inhibidores de esta molécula se han convertido en una atractiva opción terapéutica para la PQRAD.
El Sirolimus es una lactona macrocíclica aislada del Streptomyces hygroscopicus, desarrollada como agente inmunosupresor para la profilaxis del rechazo de órganos en pacientes adultos de bajo a moderado riesgo inmunológico, que reciben un trasplante renal.
El Everolimus es un antibiótico macrólido que se une a la proteína intracelular FKBP inhibiendo mTOR. Es un derivado oral activo del Sirolimus, con una vida media más corta y una mayor biodisponibilidad.
Tanto el Sirolimus como el Everolimus inhiben el crecimiento y la proliferación celular a la vez que potencian la apoptosis inhibiendo la cascada de señales mediada por mTOR. Estos fármacos, utilizados inicialmente en la prevención del rechazo, se están introduciendo en el tratamiento de algunas glomerulonefritis, tumores, uveítis refractaria y como recubrimiento de stents para evitar la reestenosis coronaria. Recientemente se ha publicado la efectividad de los inhibidores de mTOR para reducir el volumen renal en modelos murinos de poliquistosis11, 12. También se ha demostrado una reducción de volumen renal de los riñones propios en pacientes poliquísticos trasplantados tratados con Sirolimus3. En los estudios con modelos animales se ha objetivado una pérdida de peso con dosis altas de Sirolimus. Al igual que ocurre con los análogos de la somatostatina, los inhibidores de mTOR actúan también sobre el hígado. Recientemente Qian Q y cols., han demostrado la eficacia del Sirolimus en la reducción del volumen hepático en pacientes poliquísticos trasplantados tratados con Sirolimus, mientras que no han hallado diferencias significativas respecto al volumen renal13.
Actualmente hay 3 ensayos clínicos en marcha con Sirolimus para frenar la progresión de la enfermedad renal: Fase I y II, en Cleveland Clinic (30 pacientes), Fase III en Universidad de Zurich (100 pacientes), Fase II en el Instituto Mario Negri (16 pacientes) y uno con Everolimus esponsorizado por Novartis, Alemania (430 pacientes).
Roscovitina
Ante la evidencia de que la disfunción del cilio primario parece estar implicada en la regulación del ciclo celular, las anomalías en proteínas localizadas en el cilio o en el centriolo pueden afectar el ciclo celular y la proliferación dando lugar a poliquistosis20-22. La intervención terapéutica a este nivel del ciclo celular puede ser efectiva en la poliquistosis. Bukanov NO y cols., demostraron que la roscovitina (CYC202), inhibidor de la quinasa ciclín dependiente, frena la progresión de la enfermedad poliquística en ratones JCK y CPK23. El tratamiento con pulsos de este fármaco consigue un efecto duradero deteniendo el ciclo celular, inhibiendo la transcripción y disminuyendo la apoptosis. Asimismo se ha demostrado esta efectividad en quistes originados desde cualquier segmento de la nefrona, a diferencia de los antagonistas V2 que actúan sobre el túbulo colector.
Curiosamente se ha evidenciado que la roscovitina disminuye el AMPc y la aquaporina 2, potenciando así su acción en la poliquistosis renal.
Este fármaco está siendo actualmente utilizado en ensayos clínicos como anticancerígeno a dosis superiores a las estimadas para la poliquistosis.
Moléculas pequeñas (Small molecules)
Se trata de unos nuevos fármacos, muy prometedores con capacidad de tratar algunas enfermedades hasta ahora sin tratamiento.
O. Ibraghimov-Beskrovnaya y cols., demuestran el papel de la PQ1 en la unión intercelular y mediante cultivos celulares de túbulos renales identifican moléculas pequeñas que inhiben selectivamente la quistogénesis sin inhibir la tubulogénesis. Hay que estudiar la utilidad real que tendrán estas moléculas pequeñas, candidatas a mejorar el pronóstico de la PQRAD20.
Triptolide
Leuenroth SJ y cols., han demostrado recientemente la utilidad del triptolide en el tratamiento de la PQRAD24. Se trata de una hierba tradicional china utilizada durante siglos en procesos neoplásicos y autoinmunes: se ha demostrado que el triptolide induce apoptosis y detiene el crecimiento celular dependiendo de la concentración que alcance en la estirpe celular deseada. También actúa inhibiendo muchas proteínas implicadas en los procesos inflamatorios y en el crecimiento celular. Los autores demuestran la eficacia del triptolide al aumentar la liberación de calcio a través de la PQ2, detener el crecimiento celular y reducir la progresión de la poliquistosis en un modelo animal.
De este trabajo hay que destacar dos hechos prometedores: el potencial uso del triptolide como tratamiento bien tolerado en la PQRAD y por otra parte la evidencia de que la liberación de calcio mediada por la PQ2 puede ser una diana terapéutica, especialmente para las moléculas pequeñas.
Inhibidores del VEGF
El vascular endothelial growth factor (VEGF) fue descrito inicialmente como un factor de crecimiento específico endotelial que promueve la vasculogénesis, la angiogénesis, y aumenta la permeabilidad vascular. Recientemente se ha descrito la existencia de receptores para este factor en células epiteliales tubulares. Tao Y y cols., han demostrado que inhibiendo el VEGF, con ribozimas, en un modelo murino de PQRAD (Han:SPRD) se retarda la enfermedad poliquística25.
Inhibidores del EGFR
Está demostrado que en la PQRAD existe una activación del epidermal growth factor receptor (EGFR) que favorece la proliferación celular y la quistogénesis. Un mismo grupo de investigadores ha mostrado resultados discordantes, según el tipo de modelo murino utilizado, con inhibidores del EGFR. En las ratas Han/SPRD han resultado efectivos26 mientras que su efecto es mas bien deletéreo en las ratas CPK27. Parece ser que en estas ratas aumenta el AMPc en las células del túbulo colector. Por lo tanto esta aproximación terapéutica está aun en fase de investigación precoz.
IECAS/ARA II
Aunque en la PQRAD está presente una activación del SRAA (sistema renina angiotensina) y hay evidencia de la reducción eficaz de la proteinuria y de la hipertrofia ventricular izquierda con el bloqueo del SRAA14-16, no hay evidencias de un efecto renoprotector de los IECA o ARAII en la PQRAD. En 222 individuos poliquísticos que participaron en el estudio MDRD no se halló ningún beneficio terapéutico de estos fármacos, con una tasa de deterioro del filtrado glomerular de 5,9 ml/min por año17. Pero este estudio no fue diseñado para tratar aleatoriamente a pacientes con IECA. Otro estudio de ramipril contra placebo en 64 pacientes con PQRAD no demostró ninguna reducción del tiempo necesario para duplicar las cifras de creatinina18. En un ensayo clínico de 7 años randomizado (IECA vs antagonistas del calcio en 72 pacientes con PQRAD, hipertensión, hipertrofia ventricular izquierda y filtrado glomerular mayor de 30 ml/min) no se objetivó ningún efecto beneficioso de los IECA19. Todos estos estudios evaluaron una cantidad relativamente pequeña de pacientes durante períodos de tiempo cortos y una vez establecida la insuficiencia renal. Para tratar de valorar el posible efecto beneficiosos de la inhibición del SRAA en la PQRAD se está llevando a cabo un ensayo clínico, a doble ciego, aleatorizado, financiado por el NIH, con 1.200 pacientes con poliquistosis temprana (TFG > 60 ml/min) o avanzada (TFG entre 30 y 60 ml/min). El objetivo es ver si el control estricto tensional con doble bloqueo del SRAA ofrece ventajas en cuanto a la progresión de la enfermedad poliquística (medida como aumento del volumen renal por RNM) respecto a los IECA solos. Se trata del estudio HALT.
CONCLUSIONES
El mejor conocimiento de la PQRAD permite proponer nuevos fármacos que pueden mejorar el curso natural de la enfermedad. De todas maneras, además de la efectividad por probar de los mismos, quedan muchas preguntas por contestar: ¿Serán todos los fármacos útiles tanto en pacientes PKD1 como en pacientes PKD2?, ¿Se debería tratar solo a aquellos individuos que tengan signos de crecimiento renal rápido?, ¿Deberán ser tratamientos para toda la vida o quizá un tratamiento corto puede proteger durante largo tiempo del crecimiento y de la proliferación quística?, ¿a que edad o en que fase de la enfermedad debería iniciarse el tratamiento?, ¿cuál será la combinación de medicamentos adecuada para tratar las manifestaciones sistémica de la enfermedad?, ¿es posible que los antagonistas V2 pierdan eficacia con el tiempo por la «down regulation» de los receptores V2?, ¿es asumible la toxicidad de algunos fármacos en individuos jóvenes tratados indefinidamente?
Todas estas preguntas deben ser respondidas antes no empecemos a tratar a pacientes con PQRAD. Por lo tanto, la perspectiva de tratamiento para una enfermedad renal tan devastadora como la PQRAD es alentadora pero hay que ser cautos y no iniciar tratamientos con fármacos cuya efectividad, indicación y seguridad no han sido probadas para esta enfermedad en concreto.
Finalmente, nuestra especialidad debería congratularse por hallarse ante un fantástico ejemplo de traslación de la investigación básica a ensayos clínicos y a una muy probable terapia efectiva para la PQRAD.
Roser Torra es miembro del Independent Data Monitoring Committee del Estudio TEMPO 3⁄4 y de REDINREN (ISCIII).
Tabla 1.
Figura 1.