La prevalencia de la infección crónica por el virus de la hepatitis C (VHC) en pacientes con enfermedad renal crónica es mayor que en la población general. En hemodiálisis, se estima una prevalencia del 13%, con una amplia variabilidad geográfica y entre las unidades de un mismo país. La biopsia hepática es una herramienta útil para decidir el inicio de la terapia antiviral y excluir causas concomitantes de disfunción hepática, como la hepatopatía grasa no alcohólica, cuya incidencia está en auge, y la hemosiderosis, que pueden afectar a la progresión de la enfermedad y condicionar la respuesta al tratamiento antiviral; además, la vía transyugular se puede utilizar para medir el gradiente de presión venoso hepático y confirmar la existencia de hipertensión portal. La hepatitis crónica por el VHC ha demostrado reducir la supervivencia en hemodiálisis y en el trasplante renal, así como la supervivencia del injerto. Constituye la cuarta causa de mortalidad y la principal causa de disfunción hepática postrasplante renal. El VHC se comporta como un factor de riesgo independiente para la aparición de proteinuria, aumenta el riesgo de desarrollar diabetes, una glomerulonefritis de novo o una nefropatía crónica del injerto, de empeorar la enfermedad hepática y de provocar un mayor número de infecciones. También se ha descrito un incremento de la frecuencia de hepatitis colestásica fibrosante que, junto a la evolución acelerada a cirrosis, puede elevar significativamente la morbimortalidad y conllevar la necesidad de un trasplante hepático. Además, la inmunosupresión en el trasplante renal predispone a la reactivación del VHC. Sin embargo, como la farmacocinética del interferón y la ribavirina está alterada en la insuficiencia renal y su uso tiene efectos adversos sobre la función y la supervivencia del injerto, la terapia combinada se limita a los individuos no trasplantados con un filtrado glomerular estimado mayor de 50 ml/min y en diálisis suele emplearse el interferón en monoterapia. El hecho de que una cuarta parte de los pacientes VHC-positivos evaluados para trasplante renal tenga fibrosis en puente o cirrosis en la biopsia hepática puede renovar el planteamiento del tratamiento pretrasplante renal.
The prevalence of chronic infection with the hepatitis C virus (HCV) in patients with chronic kidney disease is higher than in the general population. The estimated prevalence is 13% in haemodialysis, with wide variations geographically and between units in the same country.
A liver biopsy is a useful tool for deciding whether to start antiviral therapy and to exclude concomitant causes of liver dysfunction. Examples of this include non-alcoholic fatty liver disease, whose incidence is on the rise, and haemosiderosis, which may affect the progression of the disease and determine the response to antiviral therapy. In addition, the transjugular approach can be used to measure the hepatic venous pressure gradient and confirm the existence of portal hypertension.
Chronic hepatitis due to HCV has been shown to reduce survival in haemodialysis, renal transplantation and graft survival. It is the fourth leading cause of death and the leading cause of post-renal transplantation liver dysfunction. HCV behaves as an independent risk factor for the occurrence of proteinuria; it increases the risk of developing diabetes mellitus, de novo glomerulonephritis and chronic allograft nephropathy; it leads to a deterioration in liver disease and causes a greater number of infections. An increased frequency of fibrosing cholestatic hepatitis has also been described which, together with the rapid evolution to cirrhosis, can significantly increase morbidity and mortality and lead to the need for liver transplantation. In addition, immunosuppression in renal transplantation predisposes a reactivation of HCV. However, as the pharmacokinetics of interferon and ribavirin is impaired in kidney failure and their use has adverse effects on function and graft survival, a combination therapy must be limited to non-transplanted individuals with an estimated glomerular filtration rate greater than 50ml/min, and with the interferon being used as monotherapy in dialysis. The fact that a quarter of HCV-positive patients evaluated for a renal transplant have bridging fibrosis or cirrhosis in the liver biopsy may renew renal pre-transplant treatment planning.
INTRODUCCIÓN
infeccLa Organización Mundial de la Salud estima la prevalencia global de la infección crónica por el virus de la hepatitis C (VHC) en el 3%, con una amplia variabilidad geográfica: menor del 5% en la mayor parte de los países del norte de Europa, alrededor del 10% en el sur de Europa y Estados Unidos y del 10-50% y hasta el 70% en muchos países en vías de desarrollo, incluyendo algunas zonas de Asia, Latinoamérica y norte de África. Se ha logrado disminuir la incidencia de la infección por el VHC a menos del 1-2% en países desarrollados1-3.
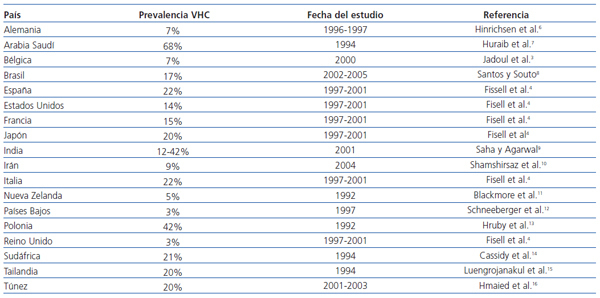
La infección por el VHC en pacientes con enfermedad renal crónica (ERC) estadio 5 es mayor que en la población general. En hemodiálisis, se observa una prevalencia del 13%, con una variabilidad del 1-70%4 (tabla 1). Asimismo, la prevalencia del VHC es altamente variable entre las unidades de hemodiálisis de un mismo país5. En España, la prevalencia de la infección por el VHC en hemodiálisis en 1997-2001 se estimó en el 22%4.
En los trasplantados renales, la prevalencia de la infección por el VHC varía entre el 7 y el 40%, también con una amplia variabilidad geográfica y demográfica4,17-19.
Hasta un 55-85% de los infectados por el VHC evoluciona hacia la cronicidad20-23 y, de éstos, el 5-25% desarrolla cirrosis a los 25-30 años20,24. Los sujetos con cirrosis tienen un riesgo mayor de presentar un hepatocarcinoma que la población no cirrótica. En España, el VHC es actualmente el principal factor de riesgo asociado con la aparición de hepatocarcinoma25, aunque el riesgo varía según el grado de afectación hepática: es menor del 1% anual en pacientes con hepatitis crónica sin fibrosis significativa y se incrementa del 3 al 7% anual en la cirrosis26. Una vez que se presenta la cirrosis hepática, el riesgo de que el hepatocarcinoma se desarrolle continúa a pesar de obtener una respuesta viral sostenida al tratamiento27. Se han identificado varios factores de progresión a cirrosis: edad avanzada, obesidad, inmunosupresión, consumo de alcohol mayor de 50 g al día28-31, y se ha descrito una evolución más rápida a cirrosis en los trasplantados renales32-34.
HISTOLOGÍA HEPÁTICA: PAPEL DE LA BIOPSIA
La biopsia hepática tiene un valor sustancial en la evaluación de la gravedad de la enfermedad hepática en la infección crónica por el VHC, en relación con el grado de fibrosis y la actividad necroinflamatoria, así como para excluir otras causas concomitantes de disfunción hepática, como la hepatopatía grasa no alcohólica, cuya incidencia está en auge, y la hemosiderosis; estas entidades pueden afectar a la progresión de la enfermedad y condicionar la respuesta al tratamiento35-38. Las Guías KDIGO (Kidney Disease Improving Global Outcomes)39 recomiendan la biopsia hepática en el estudio de hepatopatía de los pacientes candidatos a trasplante renal; la Guía de la AASLD (American Association for the Study of Liver Diseases) la limita a los pacientes VHC-positivos con genotipos 1 y 4, pero la considera innecesaria en los genotipos 2 y 340, dado que más del 80% de los pacientes (con función renal normal) consiguen una respuesta viral sostenida.
El índice METAVIR evalúa la actividad necroinflamatoria (grado) y la fibrosis (estadio). Consiste en un sistema de codificación de dos letras y dos números: A = actividad histológica (A0 = ausencia de actividad, A1 = actividad leve, A2 = actividad moderada, A3 = actividad intensa) y F = fibrosis (F0 = ausencia de fibrosis, F1 = fibrosis portal sin tabiques, F2 = fibrosis portal con pocos tabiques, F3 = numerosos tabiques sin fibrosis, F4 = fibrosis)41. Se requiere una biopsia hepática de alta calidad, de al menos 2 cm de longitud y con más de 5 espacios porta, para calcular un adecuado índice METAVIR42,43.
Según las Guías KDIGO, los pacientes en lista de espera de trasplante renal que no responden o rechazan el tratamiento antiviral deben someterse a una biopsia hepática cada 3-5 años según el índice METAVIR que presenten al inicio (cada 3 años para un índice METAVIR de 3 y cada 5 años para un índice METAVIR de 1-2)39. No hay evidencia que apoye esta recomendación, aunque se ha demostrado que la enfermedad hepática progresa en los pacientes en diálisis17,34. Los marcadores de daño hepático (por ejemplo, la GPT) no reflejan exactamente la gravedad histológica de la hepatopatía en la población con ERC y hasta un 25% de los pacientes con infección por el VHC evaluados para trasplante renal tiene fibrosis en puente o cirrosis inen la biopsia hepática (METAVIR > 3)44-49. No hay estudios definitivos que hayan analizado si el estadio histológico de la biopsia pretrasplante predice la enfermedad hepática postrasplante y sus resultados; sin embargo, la presencia de cirrosis en la biopsia hepática pretrasplante se ha asociado con un 26% de supervivencia a los 10 años50. Varios estudios han demostrado que el 19-64% de los trasplantados renales con infección por el VHC tiene enfermedad hepática postrasplante, en comparación con sólo el 1-30% de los pacientes no infectados18,50-56. La mayoría de los estudios son retrospectivos y tratan de pacientes sin biopsia hepática pretrasplante, lo que podría resultar en una infraestimación de enfermedad hepática avanzada, dado el aumento en el índice de hepatopatía descompensada. Los estudios sin biopsia hepática pretrasplante pero con biopsia hepática secuencial en el postrasplante han demostrado que la histología hepática puede progresar en un 20% de los pacientes57,58. Dado que existe un 6-8% de riesgo de mortalidad anual en los pacientes en lista de espera de trasplante renal59, parece razonable establecer una monitorización de su enfermedad hepática para constatar que siguen siendo candidatos a trasplante renal en las mismas condiciones. El daño hepático antes del trasplante renal es un factor predictor independiente de una pobre supervivencia a largo plazo50.
La coagulopatía secundaria a la disfunción hepatocelular y la trombocitopenia por hipertensión portal e hiperesplenismo conllevan un mayor riesgo de sangrado60. En pacientes con ERC, en presencia de ascitis y debido al riesgo añadido de hemorragia incrementado por la disfunción plaquetaria asociada a la uremia, la anticoagulación en hemodiálisis y el frecuente tratamiento antiagregante, se recomienda la biopsia hepática por vía transyugular o transfemoral, que además puede aportar información diagnóstica adicional, como el gradiente de presión venoso hepático, para confirmar la existencia de hipertensión portal39,40.
Se ha constatado un empleo aumentado de desmopresina (DDAVP, 0,3 µg/kg) inmediatamente antes de la biopsia hepática en pacientes con ERC, aunque no se ha determinado el nivel de creatinina sérica o el filtrado glomerular a partir del cual se debe indicar su uso61.
No se conoce en la actualidad la utilidad de los marcadores no invasivos (Índice de Forns, APRI, FIB-4) en el estudio del daño hepático en los pacientes con ERC e infección por el VHC62. Se habían creado expectativas referentes a la elastografía transitoria (FibroScan), que no ha logrado reemplazar a la biopsia: no ha sido aprobada por la FDA (Food and Drug Administration), su índice de error es mayor en pacientes obesos y puede estar sobrestimada en la hepatitis aguda, que se acompaña de gran actividad necroinflamatoria y baja o nula fibrosis63,64.
TRATAMIENTO
El tratamiento de elección en la hepatitis crónica por el VHC es el interferón convencional o pegilado, en monoterapia o combinado con ribavirina. La indicación de tratamiento antiviral debe hacerse de forma individualizada, según la gravedad de la enfermedad hepática, la posibilidad de efectos adversos graves, la variabilidad en la respuesta al tratamiento, la presencia de comorbilidad (sobre todo insuficiencia renal) y la decisión del paciente40. Los individuos con ERC tienen niveles de transaminasas menores o incluso normales45,65-67 con respecto a la población sin ERC. Clásicamente se ha considerado que los sujetos con genotipo 1 y transaminasas persistentemente normales tenían una fibrosis hepática mínima y por ello no eran subsidiarios de tratamiento; hoy día se ha demostrado que hasta un 25% de estos pacientes tieneuna fibrosis significativa y su respuesta al tratamiento es similar a la de los pacientes con transaminasas elevadas68-74. Los pacientes con manifestaciones extrahepáticas han de ser tratados, independientemente de la gravedad de su enfermedad hepática75.
En los individuos con una función renal normal, la terapia antiviral tieneR como objetivo erradicar la infección por el VHC para mejorar la histología hepática, que a largo plazo resulta en una menor tasa de morbilidad y una mayor supervivencia. En los pacientes con ERC, el tratamiento del VHC es aún más relevante, pues la hepatitis crónica ha demostrado reducir la supervivencia en hemodiálisis y en trasplantados renales, así como la supervivencia del injerto renal18,50-56,76-78, en comparación con los pacientes no infectados, lo que se debe en parte a la progresión de la enfermedad hepática, la evolución acelerada a cirrosis y/o la aparición de carcinoma hepatocelular18,32-34,50,56,79. La infección por el VHC es la principal causa de disfunción hepática postrasplante renal y la cuarta causa de mortalidad en esta población33. El VHC se comporta como un factor de riesgo independiente para la aparición de proteinuria53,80, aumenta el riesgo de desarrollar una diabetes postrasplante81-83, una glomerulonefritis de novo84-87 o una nefropatía crónica del injerto, de empeorar la enfermedad hepática y de provocar un mayor número de infecciones39. Además, la inmunosupresión en el trasplante renal predispone a la reactivación del VHC. En particular, los esteroides se han asociado con un incremento de 10 a 100 veces de la carga viral88, por lo que deberían evitarse o minimizarse en los pacientes VHC-positivos89. También se ha descrito un aumento de la frecuencia de hepatitis colestásica fibrosante que, junto a la evolución acelerada a cirrosis, puede elevar significativamente la morbimortalidad y conllevar la necesidad de un trasplante hepático90,91.
Sin embargo, la terapia antiviral en la ERC sigue siendo controvertida. No existen estudios comparativos sobre los que basar la decisión de un adecuado tratamiento antiviral. La mayoría de los estudios realizados en hemodiálisis han investigado el uso de interferón alfa convencional (3 MUI x tres veces/semana) o interferón alfa pegilado (αlfa2a, 135 µg/semana, o a2b, 50 µg/semana o 0,5-1 µg/kg/semana) en monoterapia y arrojan resultados variables, en general una respuesta viral sostenida reducida (19-75%) y una intolerancia farmacológica considerable (el 30-50% de los pacientes en diálisis interrumpe la terapia)92-95. La AGA (American Gastroenterological Association) y la AASLD recomiendan el uso de dosis reducidas de interferón alfa pegilado en monoterapia, considerando la asociación de ribavirina como una contraindicación en los sujetos con un filtrado glomerular estimado menor de compl50 ml/min40,96,97-104. Hay escasa experiencia con el tratamiento combinado con ribavirina (200 mg x tres veces/semana o 200 mg/24 h) en diálisis, pero se han sugerido mejores resultados, aunque los estudios realizados son series de casos, escasas y con un número muy limitado de pacientes105-110. En un reciente metanálisis de los ensayos clínicos existentes sobre la terapia combinada en diálisis, alrededor de la mitad de los pacientes obtenían una respuesta viral sostenida111. El riesgo de anemia severa por hemólisis secundaria dificulta su uso; algunos investigadores la han empleado basándose en los niveles séricos del fármaco y han obtenido resultados dispares106-110,112, aunque los datos disponibles son alentadores y su uso puede estar indicado en centros en los que el tratamiento del paciente lo lleven a cabo entre hepatólogos y nefrólogos. El tratamiento antiviral en trasplantados renales es excepcional salvo en casos de alternativas terapéuticas limitadas o hepatitis colestásica severa90,91. El inconveniente principal del tratamiento antiviral antes del trasplante es el retraso de la inclusión del paciente en lista de espera, sin que además pueda asegurarse la erradicación del VHC por los bajos índices de respuesta.
Por tanto, todos los pacientes en hemodiálisis con ARN del VHC detectable y un índice METAVIR F0-F2 deberían considerarse candidatos para el tratamiento con interferón alfa. Los pacientes con fibrosis en puente cirrosis compensada deberían recibir también terapia antiviral y convertirse en candidatos a trasplante renal si consiguen una respuesta viral sostenida; los pacientes con cirrosis descompensada deberían ser valorados para trasplante combinado de riñón e hígado40.
A la luz del impacto que la infección crónica por el VHC tiene en el trasplante renal, se recomienda que los pacientes con ERC sean tratados antes de ser sometidos a trasplante113,114. Sin embargo, a pesar de la evidencia que existe sobre los beneficios del tratamiento antiviral en los pacientes con hepatitis crónica por VHC y ERC antes del trasplante renal, sólo algunos protocolos de trasplante renal recomiendan el tratamiento frente al VHC y no suele estar catalogado como un criterio previo al trasplante115-117. De hecho, la evaluación pretrasplante renal de los pacientes VHC-positivos en tratamiento sustitutivo renal es la que pone de manifiesto que, además de no realizarse el tratamiento frente al VHC antes del trasplante, el seguimiento hepatológico de estos pacientes en diálisis puede ser en muchos casos casi inexistente. Es posible que esto se deba a que la complejidad que trae consigo el tratamiento de ERC haga que el nefrólogo asuma toda la patología del paciente en hemodiálisis.
Son necesarios más estudios para evaluar la situación clínica y el seguimiento de la hepatitis por VHC de los pacientes en hemodiálisis, con el fin de detectar mejoras e implicar tanto a nefrólogos como a hepatólogos en su manejo.
Tabla 1. Prevalencia de la infección por el VHC en hemodiálisis