El déficit de 25-OH-vitamina D (25-OH-D) es común en los pacientes en hemodiálisis (HD). Por otra parte, es bien conocida la elevada incidencia de hiperparatiroidismo secundario en este grupo de pacientes, y lo importante que es su adecuado control. La 25-OH-D está implicada en la regulación de la homeostasis del calcio, por lo que tener niveles adecuados puede contribuir en el control del metabolismo óseo-mineral.
ObjetivosEvaluar el efecto de la repleción de 25-OH-D en pacientes en HD con déficit vitamínico (niveles<20ng/ml), en el control del hiperparatiroidismo secundario y en el estado de microinflamación.
Pacientes y métodosEstudio observacional, prospectivo en el que se trataron pacientes estables en HD con déficit de 25-OH-D (<20ng/ml), con calcifediol 0,266mcg/15 días vía oral durante 3 meses. Los datos de HD, parámetros bioquímicos y las dosis de fármacos administrados fueron analizados antes y después de la corrección del déficit.
ResultadosUn total de 45 pacientes estables en HD con edad media 74,08±12,49 años completaron el tratamiento. Del total, 27 pacientes (60%) alcanzaron niveles de 25-OH-D>20ng/ml (en 23 fueron>30ng/ml, y 4 entre 20-30ng/ml). Las cifras de hormona paratiroidea descendieron en 32 de los 45 pacientes, alcanzando en 23 (51% de tratados) un descenso>30% respecto al valor basal. En cuanto al tratamiento concomitante, se objetivó un descenso significativo de la dosis de activador selectivo del receptor de vitamina D; sin evidenciarse cambios en la dosis de calcimimético ni de quelantes. Respecto al estado de malnutrición-inflamación, destaca un descenso de la proteína C reactiva, aunque no se modificaron otros parámetros de microinflamación como los monocitos activados (CD14+/CD16+ y CD 14++/CD16+). Tampoco se observaron cambios en los niveles de FGF-23.
ConclusionesLa corrección del déficit de 25-OH-D en pacientes en HD se asocia a un mejor control del hiperparatiroidismo secundario con menores dosis de análogos de vitamina D y a una mejoría en el estado inflamatorio de estos pacientes. Nuestros resultados apoyan la recomendación de determinar niveles de 25-OH-D y corregir el déficit en pacientes en HD.
Patients on haemodialysis (HD) have a high prevalence of 25-OH-vitamin D (25-OH-D)deficiency. Secondary hyperparathyroidismis a common condition in these patients, which is very important to control. 25-OH-D is involved in regulating calcium homeostasis. As such, appropriate levels of this vitamin could help to control bone mineral metabolism.
ObjectiveTo evaluate the effect 25-OH-D repletion in HD patients with 25-OH-D deficiency (<20ng/ml) on the control of secondary hyperparathyroidism and microinflammation status.
Patients and methodsProspective observational study in which stable patients on HD with 25-OH-D deficiency (<20ng/ml) were treated with oral calcifediol 0.266mcg/every 2 weeks for three months. Dialysis characteristics, biochemical parameters and drug doses administered were analysed before and after the correction of the deficiency.
ResultsForty-five stable HD patients with a mean age of 74.08±12.49 years completed treatment. Twenty-seven patients (60%) achieved 25-OH-D levels above 20ng/ml (23 with levels>30ng/ml and 4 between 20-30ng/ml). Parathyroid hormone levels decreased in 32 of the 45 patients, 23 of which (51%) achieved a>30% decrease from baseline. In terms of concomitant treatment, we observed a significant reduction in the selective vitamin D receptor activator dose, but no changes in calcimimetic or phosphate binders administration. In terms of malnutrition-inflammation status, a decrease in C-reactive protein was noted, although other microinflammation parameters, such as activated monocytes (CD14+/CD16+ and CD 14++/CD16+) were unchanged. No changes were observed in the levels of FGF-23.
ConclusionsCorrecting 25-OH-D deficiency in HD patients is associated with better secondary hyperparathyroidism control with lower doses of vitamin D analogues, as well as an improvement in inflammatory status. Our results support the recommendation to determine 25-OH-D levels and correct its deficiency in these patients.
El sistema hormonal de la vitamina D nativa (25-OH-D) está relacionado con la regulación de la homeostasis del calcio y el metabolismo óseo. El déficit de 25-OH-D es muy común, no solo en determinados grupos de pacientes, sino incluso en la población general1. En los pacientes con enfermedad renal crónica en sus diferentes estadios, el déficit de 25-OH-D es muy prevalente, pudiendo determinarse hasta en el 90% de la población, cuando hablamos de pacientes en estadio 5D-hemodiálisis (HD)2,3.
El déficit de 25-OH-D se ha relacionado con una mayor prevalencia de enfermedades como el cáncer4 y enfermedad cardiovascular5,6, y esto posiblemente venga explicado no solo por su relación con el metabolismo óseo-mineral, sino por los efectos pleiotrópicos de esta vitamina7.
Dentro de estos efectos pleiotrópicos de la 25-OH-D destaca su papel en el sistema inmune y su posible relación con los estados inflamatorios crónicos. Los pacientes en HD presentan un estado de microinflamación crónica8, que desempeña un papel muy importante en la elevada tasa de morbimortalidad que presentan. Este estado inflamatorio relacionado con la uremia se puede determinar por parámetros bioquímicos clásicos (albúmina, ferritina o proteína C reactiva [PCR]9), aunque estos no siempre se ven alterados, y es necesario recurrir a métodos más sensibles. Recientes trabajos han puesto de manifiesto que la determinación de monocitos activados (CD14+/CD16+ y CD 14++/CD16+) en sangre periférica de pacientes con insuficiencia renal crónica es más sensible que los métodos convencionales10 para determinar el estado inflamatorio en estos pacientes, y para valorar la respuesta a tratamientos o a diferentes técnicas de diálisis11–13 utilizadas para mejorar el estado inflamatorio. Actualmente no es conocido si la repleción del déficit de 25-OH-D modifica estos parámetros de inflamación en pacientes en HD.
En esta misma línea, con respecto a la anemia y su tratamiento, si el déficit de 25-OH-D tiene un efecto proinflamatorio en los pacientes en HD como se ha puesto de manifiesto14, la corrección del déficit podría influir en una mejor respuesta al tratamiento de la anemia, con menores requerimientos de fármacos.
Por último, la relación del déficit de 25-OH-D con la homeostasis del metabolismo calcio-fósforo es clara, pero su influencia en el control del hiperparatiroidismo secundario (HPTS) no está bien definida15. Recientes trabajos han apuntado a que una repleción del déficit de esta vitamina puede ayudar a mejorar el control de esta enfermedad16,17, pero en otros esta relación no se objetiva18,19.
El objetivo de nuestro trabajo fue tratar a pacientes estables en HD, con déficit de 25-OH-D (con niveles<20ng/ml), y valorar si su repleción se relacionaba con el control del HPTS, anemia y/o con el proceso microinflamatorio crónico relacionado con la uremia.
Pacientes y métodosEstudio observacional, prospectivo, monocéntrico en pacientes estables en HD. Se incluyeron 45 pacientes, 27 varones y 18 mujeres con una edad media de 74,08±12,49 (intervalo 39-85 años) que se encontraban en programa de HD con un promedio de 25±17 meses. La etiología de la insuficiencia renal crónica fue: 12 nefropatía vascular (26,6%), 4 glomerulonefritis crónica (8,8%), 8 nefropatía diabética (17,7%), 5 poliquistosis (11,1%), 6 causas urológicas (13,3%), 2 enfermedades sistémicas (3,6%), 3 nefropatía tubulointersticial (6,6%) y 5 de etiología no filiada (11,1%).
Todos los pacientes tenían déficit de 25-OH-D, con niveles<20ng/ml. Cada paciente recibió tratamiento con calcifediol (Hidroferol®) una ampolla de 0,266mcg cada 2 semanas, durante 3 meses. El resto de los tratamientos que recibía el paciente se mantuvieron, modificándose a criterio del clínico responsable, según los controles analíticos o clínicos del paciente; los cambios en los tratamientos fueron recogidos a lo largo del estudio. Con relación a la dieta que los pacientes realizaron durante el estudio, no hubo modificaciones respecto a la que llevaban a cabo previamente.
Los pacientes se dializaban 3 veces a la semana con una membrana de alto flujo de polisulfona (HF80S; Fresenius Medical Care®, Bad Homburg, Alemania). La tasa de flujo de sangre era de 300-400ml/min, y la duración de la diálisis se ajustó individualmente para mantener un Kt/V por encima de 1,2. Todos los pacientes fueron dializados en la misma unidad de diálisis utilizando el mismo sistema de dializado.
Todas las muestras se obtuvieron en tubos de heparina de litio y tubos de bioquímica. Los niveles de hemoglobina se midieron con un analizador automático (Abbott Cell-Dyn 4000; Abbott Laboratories®, Abbott Park, IL, EE. UU.). Los niveles de PCR de alta sensibilidad se determinaron por inmunoturbidimetría; los reactivos fueron suministrados por Abbott Laboratories® (Abbott Park, IL, EE. UU.). El rango normal de PCR fue<5mg/L. Los niveles de 25-OH-vitamina D se determinaron mediante el método de radioinmunoanálisis Immunodiagnostic Systems IDS® Gamma-B kit, en medicina nuclear. Los niveles de hormona paratiroidea (PTH) intacta se determinaron por RIA (Nichols Institute®, Holanda).
La determinación de monocitos activados (CD14+/CD16+ y CD 14++/CD16+) en la sangre periférica se realizó tras incubar la sangre con el mAb M5E2 contra la molécula CD14 conjugado con proteína peridinina clorofila, y 3G8 contra la molécula CD16 conjugado con FITC. Ambos anticuerpos y los controles de isotipo apropiados fueron proporcionados por Becton Dickinson® (San Jose, CA, EE. UU.). El análisis de citometría de flujo se realizó con un citómetro de flujo FACSCalibur (Becton Dickinson®). El número de monocitos CD14+ CD16+ absoluto se obtuvo utilizando BD TruCOUNT Tubos (Becton Dickinson®). Para el cálculo de la intensidad media de fluorescencia de los receptores, el citómetro de flujo se calibró con BD Calibrite 3 bolas (Becton Dickinson®) para ajustar la compensación de fluorescencia conjunto.
En un grupo de pacientes se determinaron los niveles de FGF-23, por ELISA.
Se recogieron las dosis de fármacos que el paciente tomaba durante el tiempo de estudio, y se analizaron los cambios de dosis durante el periodo de estudio.
El protocolo se adhirió a la Declaración de Helsinki y fue aprobado por la junta de revisión institucional del Hospital Universitario Reina Sofía (Córdoba, España). Se obtuvo el consentimiento informado de todos los pacientes, antes de la inclusión en el estudio.
El análisis estadístico se realizó en el programa estadístico SPSS versión 20.0 y los resultados se expresaron como la media aritmética±desviación típica. Para el análisis de la significación estadística de parámetros cuantitativos se ha empleado el test de la t-Student para datos pareados. Se ha considerado estadísticamente significativa una p<0,05.
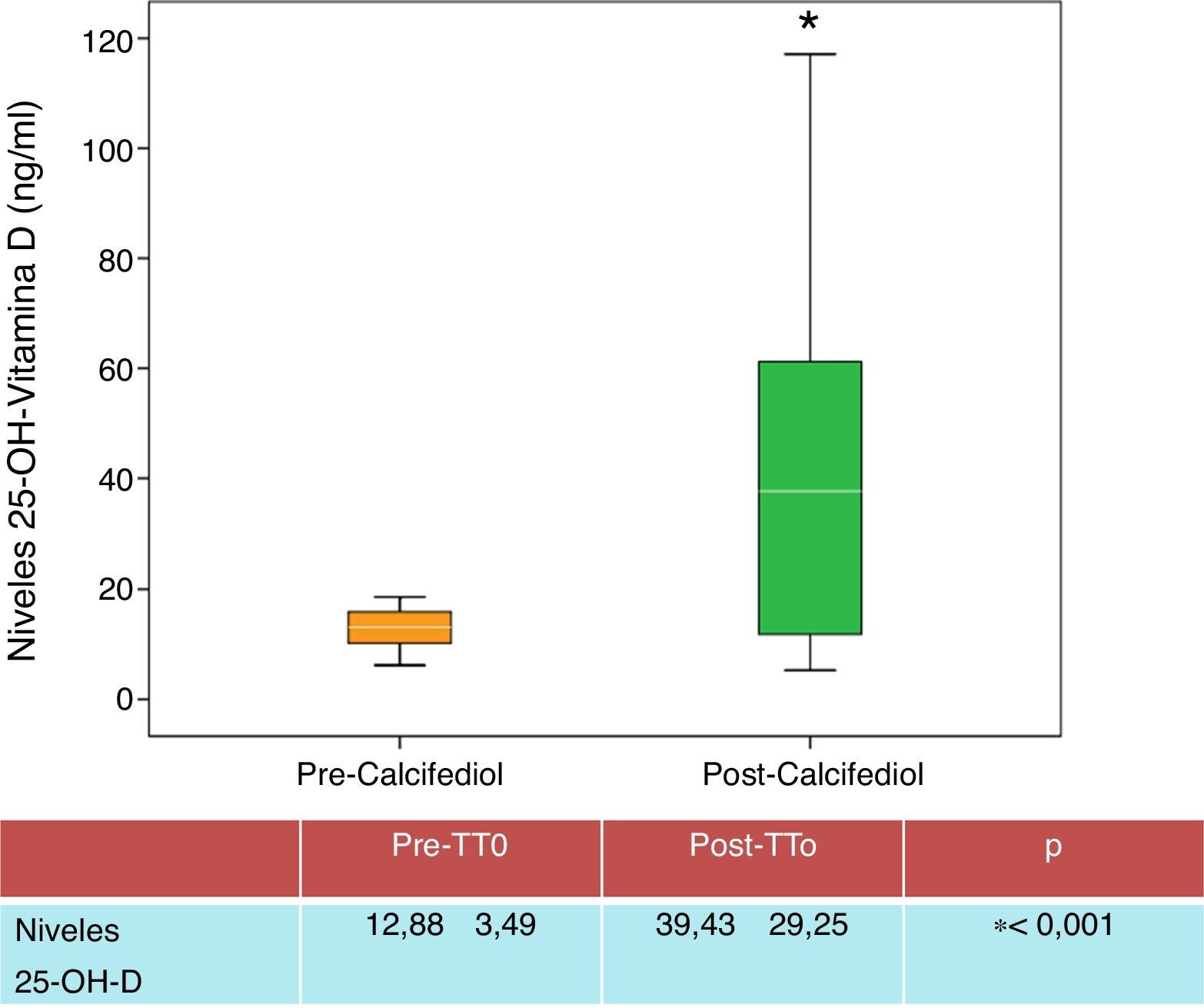
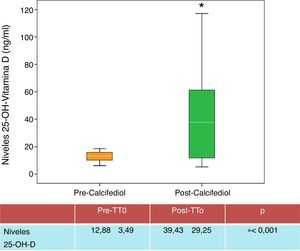
ResultadosTras tratar durante 3 meses con calcifediol quincenal, de los 45 pacientes tratados, 27 (60%), alcanzaron los niveles de 25-OH-D deseados (>20ng/ml) (fig. 1).
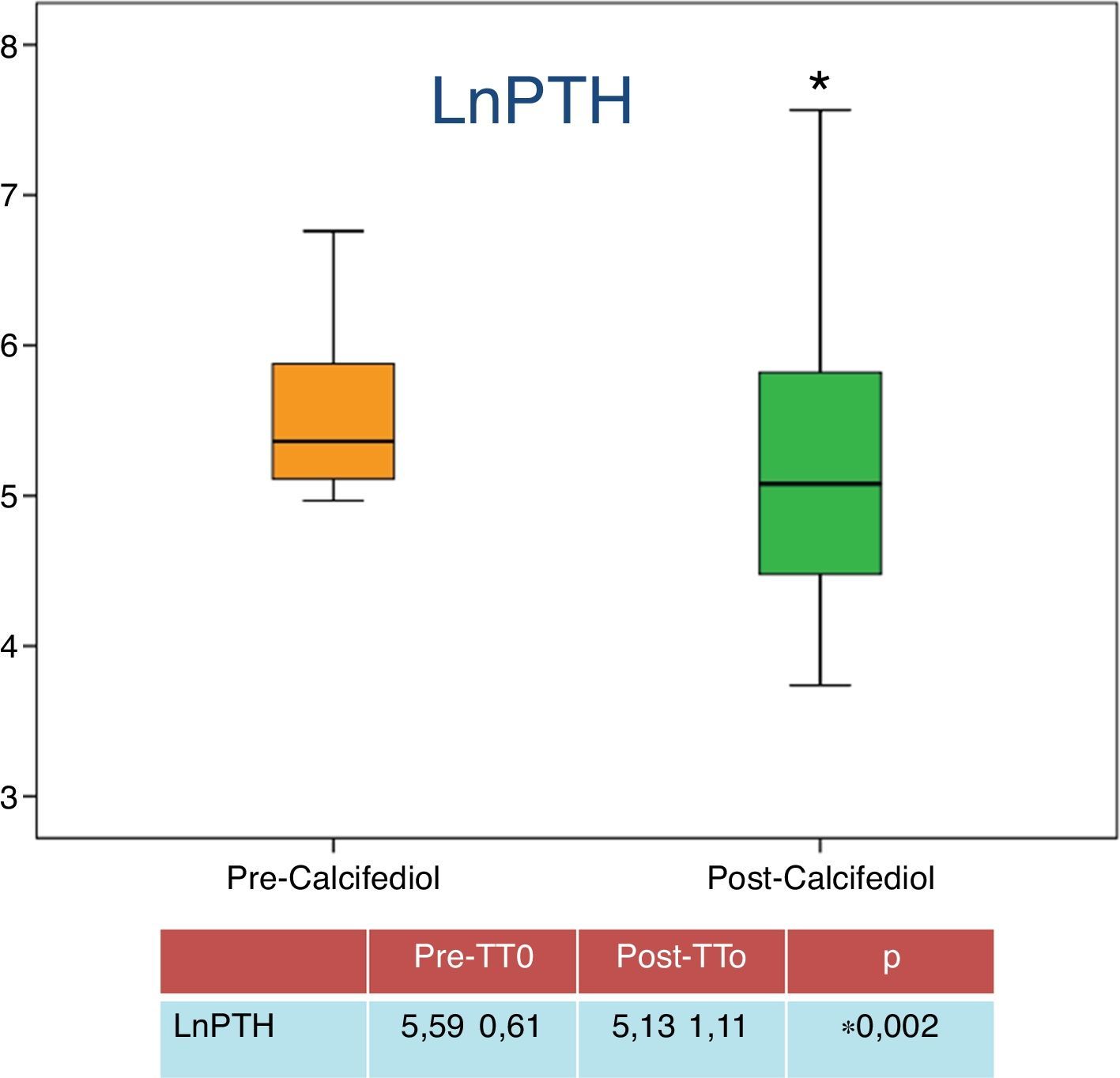
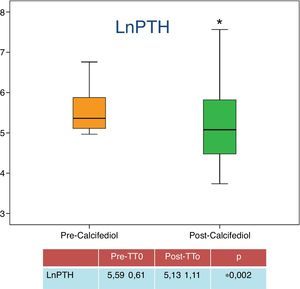
Respecto a la relación entre la repleción de 25-OH-D y el control el HPTS, del total de pacientes, 32 (71%) presentaron un descenso de las cifras de PTH tras el tratamiento, siendo en 23 (50% del total de pacientes, y el 71% de los que alcanzaron niveles superiores a 20ng/ml) la reducción de PTH superior al 30% sobre las cifras de PTH basal. Las cifras medias de PTH antes y después del tratamiento vienen recogidas en la figura 2.
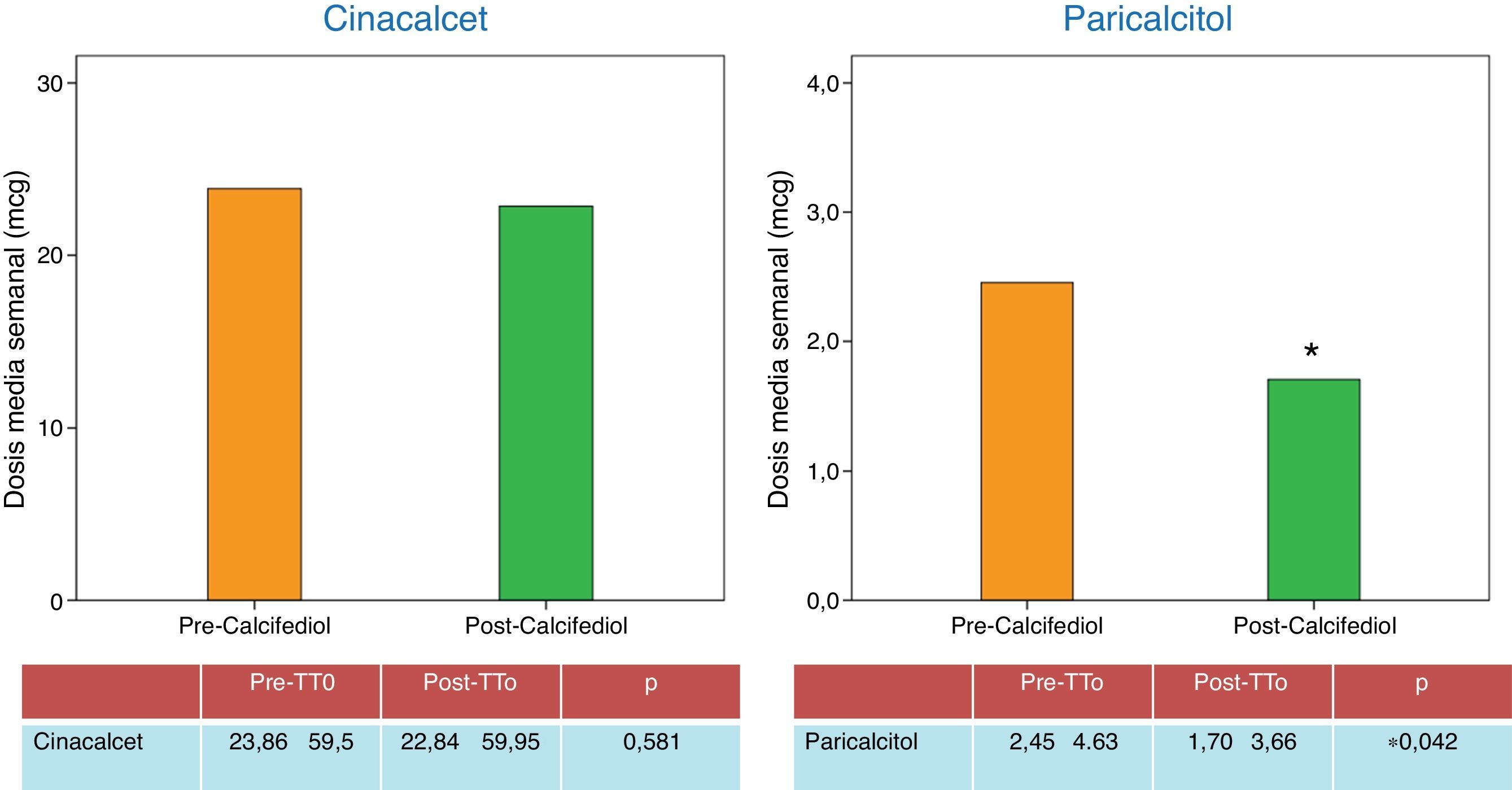
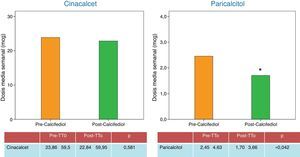
Este mejor control de las cifras de PTH se consiguió a lo largo del estudio, destacando el descenso medio de dosis de análogos de vitamina D (paricalcitol), sin que la dosis de calcimimético cambiara a lo largo del estudio(fig. 3). Las cifras medias de calcio aumentaron durante el estudio, pero este incremento no alcanzó diferencias estadísticamente significativas. En cuanto a las cifras de fósforo en suero, descendieron, sin llegar a alcanzar diferencias estadísticamente significativas (los niveles medios de calcio y fósforo se recogen en la tabla 1). El descenso de la fosforemia se consigue durante el estudio sin modificar las dosis de fármacos quelantes del fósforo, destacando que el descenso se objetivó en mayor medida en aquellos pacientes a los que a lo largo del estudio se les disminuyó la dosis de análogos de vitamina D, pero la correlación entre descenso de fosforemia-descenso dosis de análogos de vitamina D no alcanzó significación estadística. Este mejor control de los niveles de fósforo puede estar relacionado con un mejor control del HPTS.
Principales hallazgos determinados antes y después de la corrección del déficit de 25-OH-D
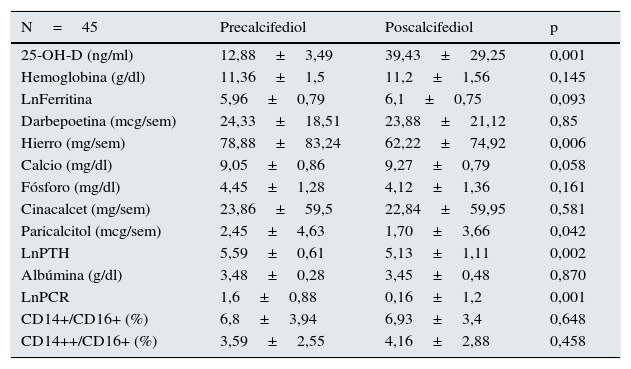
| N=45 | Precalcifediol | Poscalcifediol | p |
|---|---|---|---|
| 25-OH-D (ng/ml) | 12,88±3,49 | 39,43±29,25 | 0,001 |
| Hemoglobina (g/dl) | 11,36±1,5 | 11,2±1,56 | 0,145 |
| LnFerritina | 5,96±0,79 | 6,1±0,75 | 0,093 |
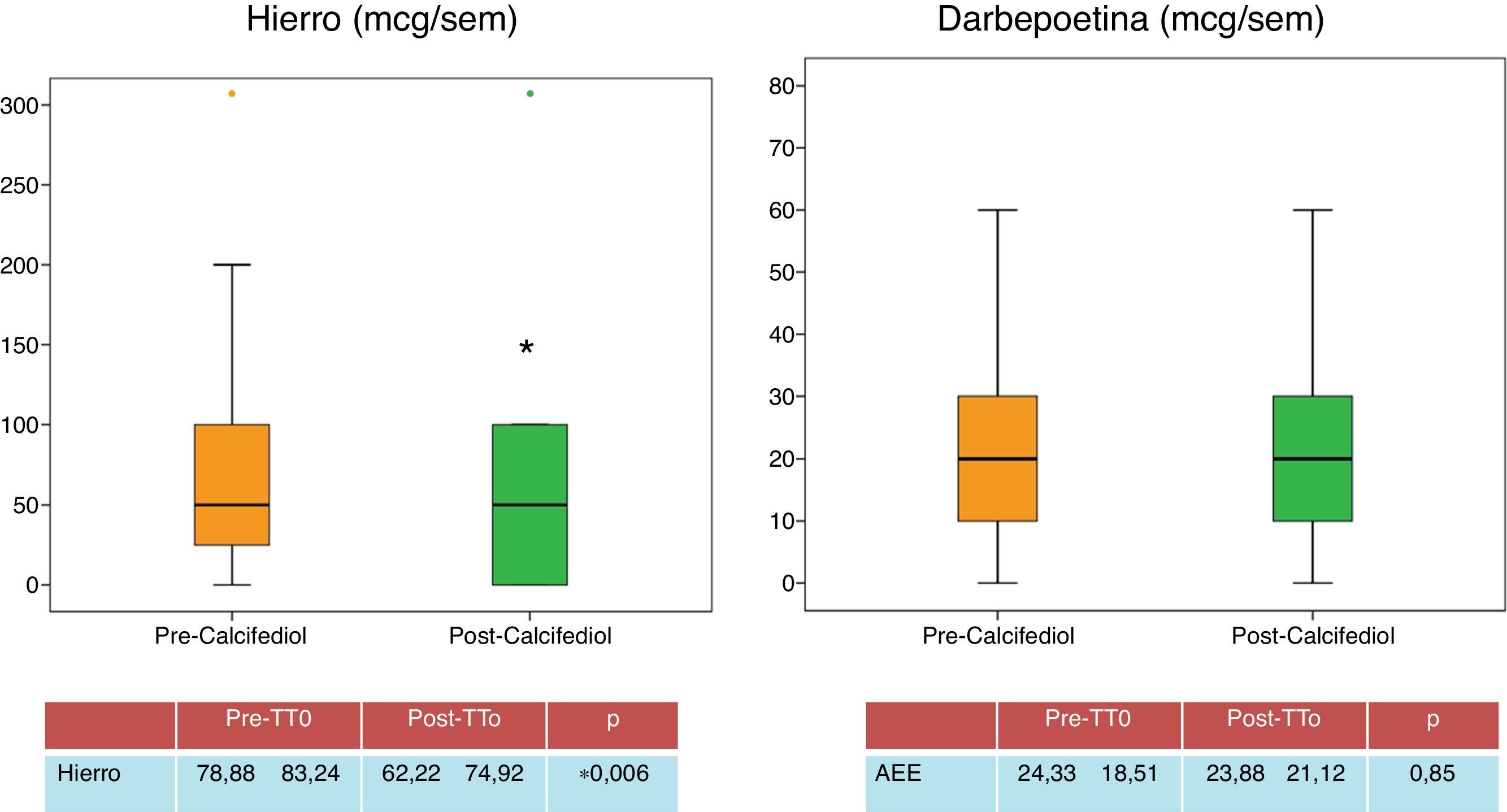
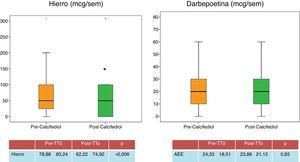
| Darbepoetina (mcg/sem) | 24,33±18,51 | 23,88±21,12 | 0,85 |
| Hierro (mg/sem) | 78,88±83,24 | 62,22±74,92 | 0,006 |
| Calcio (mg/dl) | 9,05±0,86 | 9,27±0,79 | 0,058 |
| Fósforo (mg/dl) | 4,45±1,28 | 4,12±1,36 | 0,161 |
| Cinacalcet (mg/sem) | 23,86±59,5 | 22,84±59,95 | 0,581 |
| Paricalcitol (mcg/sem) | 2,45±4,63 | 1,70±3,66 | 0,042 |
| LnPTH | 5,59±0,61 | 5,13±1,11 | 0,002 |
| Albúmina (g/dl) | 3,48±0,28 | 3,45±0,48 | 0,870 |
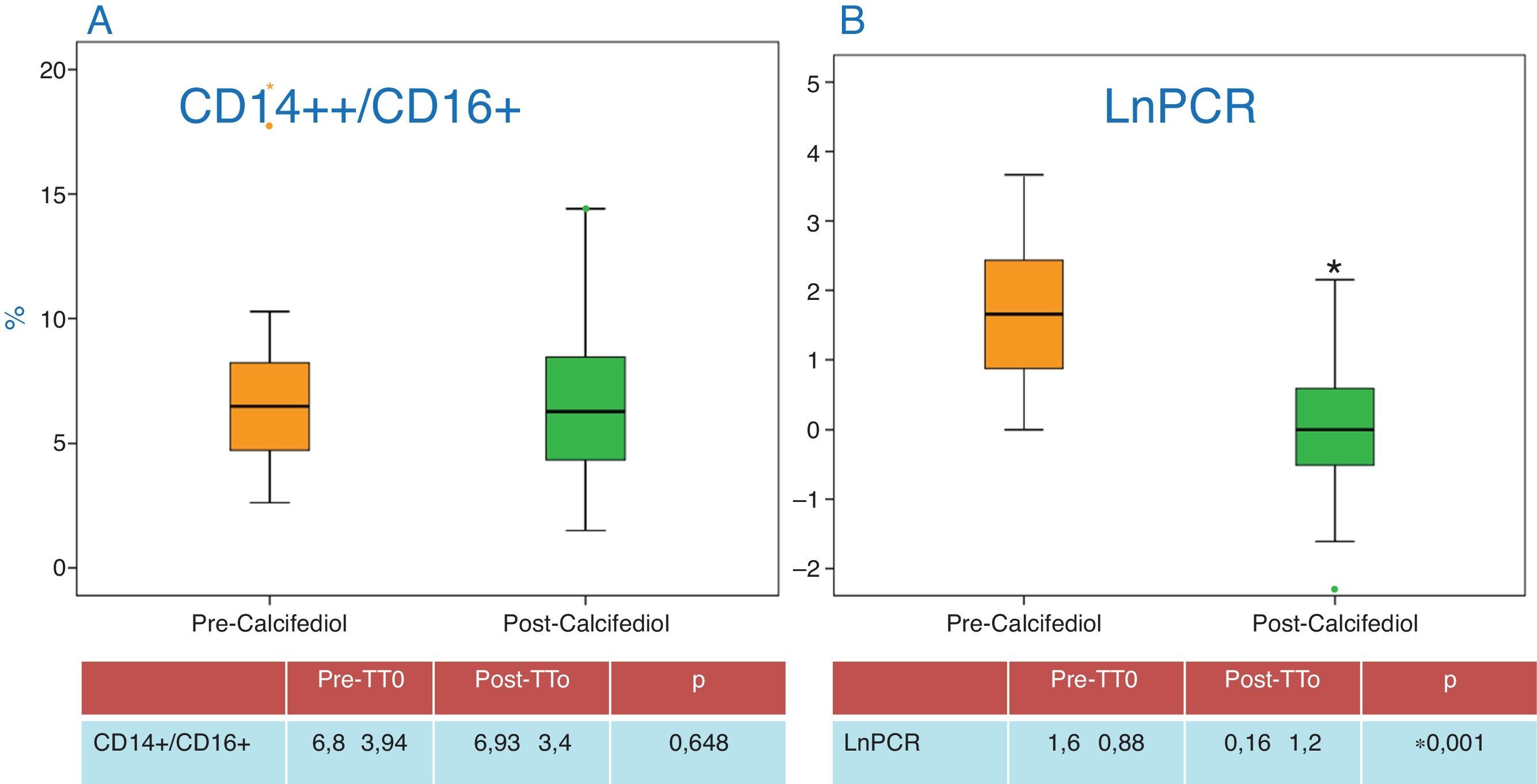
| LnPCR | 1,6±0,88 | 0,16±1,2 | 0,001 |
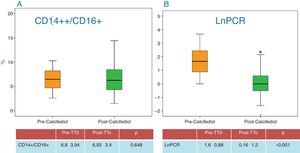
| CD14+/CD16+ (%) | 6,8±3,94 | 6,93±3,4 | 0,648 |
| CD14++/CD16+ (%) | 3,59±2,55 | 4,16±2,88 | 0,458 |
PCR: proteína C reactiva; PTH: hormona paratiroidea; 25-OH-D: 25-OH-vitamina D.
Ante los hallazgos de nuestro estudio respecto al mejor control del HPTS, se determinaron niveles solubles de FGF-23, molécula relacionada con la homeostasis del fósforo y con el control del HPTS, que en pacientes en HD se encuentra en cifras muy elevadas respecto a sujetos sanos. En nuestros pacientes los niveles medios de FGF-23 no se modificaron antes y después de replecionar 25-OH-D (media pretratamiento de 432,157361 vs. 541,852406 postratamiento, p=0,47), estos mismos datos ya se habían observado en estudios previos20.
Los resultados obtenidos en este estudio con relación al estado de microinflamación crónica de pacientes en HD, se determinaron tanto por parámetros bioquímicos convencionales como la PCR, albúmina y ferritina, como por parámetros obtenidos por citometría de flujo como es el porcentaje de monocitos activados (CD14+/CD16+ y CD14++/CD16+).
En cuanto a las cifras de PCR, se objetivo un descenso significativo (fig. 4B), lo que indica un menor estado inflamatorio de los pacientes. Respecto a otros parámetros relacionados con el estado de inflamación como la albúmina o la ferritina, no se objetivaron cambios durante el estudio. Los datos vienen recogidos en la tabla 1.
Tampoco se objetivaron cambios en el porcentaje de monocitos activados (CD14+/CD16+ y CD14++/CD16+) a lo largo del estudio (fig. 4A), antes y después de replecionar con calcifediol.
En relación con la anemia, las cifras de hemoglobina se mantienen estables a lo largo del estudio (tabla 1), conservándose estables las cifras de darbepoetina (fig. 5), aunque cabe destacar un descenso de las dosis semanales de hierro (fig. 5), lo que puede estar relacionado con la mejoría en estado inflamatorio de los pacientes, determinada por el descenso significativo de PCR.
Durante el estudio se recogieron los fármacos tomados por los pacientes y las dosis, y se recogieron los cambios.
DiscusiónTras 3 meses de tratamiento con vitamina D nativa (calcifediol), el 60% de los pacientes presentas cifras adecuada (>20ng/ml) de 25-OH-D. Esto se consigue sin que ningún paciente presentara ningún evento adverso relacionado con el fármaco durante el tratamiento, con muy buena tolerancia por parte del paciente.
La corrección del déficit de 25-OH- D se ha relacionado, en este grupo de pacientes, con un mejor control del HPTS, acompañado de un menor requerimiento de análogos de vitamina D (paricalcitol). Las dosis de otros fármacos utilizados habitualmente para el tratamiento de HPTS, como los calcimiméticos o quelantes de fósforo, no cambiaron a lo largo del estudio. Estos mismos datos ya han sido publicados previamente16,17, solo que con pautas de tratamiento diferentes. Al igual que en trabajos previos20, tampoco en nuestros pacientes se objetivó un descenso significativo de los niveles plasmáticos de FGF-23.
En cuanto al proceso de microinflamación crónica, destaca que tras el tratamiento descienden de forma significativa los niveles PCR, parámetro que se ha relacionado con el estado de microinflamación de los pacientes en HD9. Por lo tanto este descenso de PCR se relaciona con un menor estado inflamatorio. En cuanto a parámetros como ferritina o albúmina, relacionados también con este estado de microinflamación, no se ven modificados durante el estudio.
En cuanto a la corrección de la anemia, no se objetivaron diferencias en las cifras de hemoglobina antes y después de replecionar con 25-OH-D, ni se objetivaron cambios en las dosis de agentes estimulantes de la eritropoyesis; pero sí se evidenció un descenso de la dosis semanal de hierro intravenoso, posiblemente relacionado con el menor estado inflamatorio de los pacientes, tras la repleción del déficit de 25-OH-D. Estos datos van en la misma línea que trabajos previos14, que relacionan el déficit de 25-OH-D con mayor inflamación, y por tanto, peor respuesta al tratamiento de la anemia.
El trabajo presenta limitaciones, siendo la tasa de respuesta al fármaco de solo 60% al final del estudio el mayor limitante; esta tasa es menor que en otros trabajos publicados, y ello a pesar de que la cumplimentación del tratamiento está asegurada porque se le administraba al final de una sesión de diálisis. Posiblemente esta baja tasa de respuesta se relacione con la edad media de los pacientes (74 años), que es mayor que en otros trabajos publicados; o con el tiempo de tratamiento, posiblemente para obtener una mayor tasa de respuesta al fármaco, se debería haber ampliado el tiempo de tratamiento.
A pesar de ello, y a pesar de las limitaciones del trabajo, los resultados obtenidos con relación al control del HPTS y al estado inflamatorio en este grupo de paciente son alentadores, ya que ambos procesos están muy relacionados con la elevada tasa de morbimortalidad en este grupo de pacientes. La corrección del déficit de 25-OH-D en pacientes en HD se asocia a un mejor control del HPTS con menores dosis de análogos de vitamina D, y a una mejoría en el estado inflamatorio de estos pacientes. Por tanto podemos decir que nuestros resultados apoyan las recomendaciones actuales de las guías de buena práctica clínica de determinar niveles de 25-OH-D y corregir el déficit en pacientes en HD.
FinanciaciónEste trabajo fue financiado en su totalidad por Amgen® España S.A. Amgen no tuvo ningún papel en el diseño del estudio; recogida, análisis e interpretación de datos, la redacción del informe, ni en la decisión de publicar los resultados del estudio.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.