El acceso vascular para hemodiálisis es esencial para el enfermo renal tanto por su morbimortalidad asociada como por su repercusión en la calidad de vida. El proceso que va desde la creación y mantenimiento del acceso vascular hasta el tratamiento de sus complicaciones constituye un reto para la toma de decisiones debido a la complejidad de la patología existente y a la diversidad de especialidades involucradas. Con el fin de conseguir un abordaje consensuado, el Grupo Español Multidisciplinar del Acceso Vascular (GEMAV), que incluye expertos de las cinco sociedades científicas implicadas (nefrología [S.E.N.], cirugía vascular [SEACV], radiología vascular e intervencionista [SERAM-SERVEI], enfermedades infecciosas [SEIMC] y enfermería nefrológica [SEDEN]), con el soporte metodológico del Centro Cochrane Iberoamericano, ha realizado una actualización de la Guía del Acceso Vascular para Hemodiálisis publicada en 2005. Esta guía mantiene una estructura similar, revisando la evidencia sin renunciar a la vertiente docente, pero se aportan como novedades, por un lado, la metodología en su elaboración, siguiendo las directrices del sistema GRADE con el objetivo de traducir esta revisión sistemática de la evidencia en recomendaciones que faciliten la toma de decisiones en la práctica clínica habitual y, por otro, el establecimiento de indicadores de calidad que permitan monitorizar la calidad asistencial.
Vascular access for haemodialysis is key in renal patients both due to its associated morbidity and mortality and due to its impact on quality of life. The process, from the creation and maintenance of vascular access to the treatment of its complications, represents a challenge when it comes to decision-making, due to the complexity of the existing disease and the diversity of the specialities involved. With a view to finding a common approach, the Spanish Multidisciplinary Group on Vascular Access (GEMAV), which includes experts from the five scientific societies involved (nephrology [S.E.N.], vascular surgery [SEACV], vascular and interventional radiology [SERAM-SERVEI], infectious diseases [SEIMC] and nephrology nursing [SEDEN]), along with the methodological support of the Cochrane Center, has updated the Guidelines on Vascular Access for Haemodialysis, published in 2005. These guidelines maintain a similar structure, in that they review the evidence without compromising the educational aspects. However, on one hand, they provide an update to methodology development following the guidelines of the GRADE system in order to translate this systematic review of evidence into recommendations that facilitate decision-making in routine clinical practice, and, on the other hand, the guidelines establish quality indicators which make it possible to monitor the quality of healthcare.
El acceso vascular (AV) utilizado para efectuar la hemodiálisis (HD) es un aspecto fundamental para el paciente con enfermedad renal y, actualmente, ya no se pone en duda que condiciona su morbimortalidad. Por lo tanto, debido a su gran trascendencia para estos pacientes, es necesario disponer de una guía en el campo del AV para utilizarla en la toma de decisiones durante la práctica clínica habitual. Esta no solo ha de recoger toda la evidencia disponible, sino que, además, ha de transmitirla al profesional de un modo que permita su aplicación clínica diaria.
En 2005 se publicó la primera edición de la Guía del Acceso Vascular de la Sociedad Española de Nefrología con la colaboración del resto de sociedades implicadas. Esta Guía ha sido todo un referente desde entonces para los profesionales vinculados al campo de la HD. Se ha convertido en un documento de consulta básico en las unidades de diálisis y ha tenido un alto impacto en las referencias bibliográficas. La edición actual tiene el objetivo de renovarla, actualizando todos los temas que incluía y añadiendo los nuevos conceptos surgidos desde entonces.
El formato de la Guía actual mantiene una estructura similar, al basarse en los mismos apartados. Es de destacar el tema “Indicadores de calidad”, que de ser un anexo en la edición previa, con solo 5 indicadores, se ha convertido en el apartado 7 con 29 indicadores. Por lo que respecta al contenido, se ha mantenido un enfoque mixto, es decir, por una parte se han desarrollado las recomendaciones derivadas del análisis de la evidencia científica actual y por otra, no se ha renunciado a la vertiente docente presente en la anterior edición.
COMPOSICIÓN DEL GRUPO DE DESARROLLO DE LA GUÍATras una reunión en Madrid el 29 de junio de 2012, se decidió la actualización de la Guía Clínica Española del Acceso Vascular para Hemodiálisis por representantes de la Sociedad Española de Nefrología (S.E.N.), Sociedad Española de Angiología y Cirugía Vascular (SEACV), Sociedad Española de Radiología Vascular e Intervencionista-Sociedad Española de Radiología Médica (SERVEI-SERAM), Sociedad Española de Enfermería Nefrológica (SEDEN) y, también, en una siguiente reunión del Grupo de Estudio de la Infección Relacionada con la Asistencia Sanitaria/Grupo de Estudio de la Infección Hospitalaria-Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (GEIRAS/GEIH-SEIMC). El grupo de trabajo multidisciplinar estaba integrado por miembros de las cinco sociedades científicas implicadas. Se escogieron teniendo en cuenta la experiencia, tanto clínica como de investigación, en el área del AV. En la reunión del 6 de octubre de 2014, el grupo pasa a denominarse Grupo Español Multidisciplinar del Acceso Vascular (GEMAV), denominación por la que se identificará al grupo a partir de ese momento. Se decidió, asimismo, utilizar el apoyo metodológico del Centro Cochrane Iberoamericano para la revisión sistemática de la literatura de las preguntas clínicas de la guía priorizadas por el GEMAV. Todos los autores tienen una relación con la edición de la Guía de un modo estrictamente profesional, siendo independiente de ningún tipo de conflicto de interés. Algunos de ellos realizan, además, alguna labor de representación de sus respectivas sociedades científicas. A continuación se mencionan los coordinadores de la Guía, los editores, los miembros del GEMAV (en representación de las cinco sociedades), los revisores externos y los representantes de asociaciones de enfermos renales.Coordinadores de la Guía
- •
José Ibeas. Parc Taulí Hospital Universitari, Institut d’Investigació i Innovació Parc Taulí I3PT, Universitat Autònoma de Barcelona, Sabadell, Barcelona
- •
Ramon Roca-Tey. Hospital de Mollet, Fundació Sanitària Mollet, Mollet del Vallès, Barcelona
- •
José Ibeas. Parc Taulí Hospital Universitari, Institut d’Investigació i Innovació Parc Taulí I3PT, Universitat Autònoma de Barcelona, Sabadell, Barcelona
- •
Ramon Roca-Tey. Hospital de Mollet, Fundació Sanitària Mollet, Mollet del Vallès, Barcelona
- •
Joaquín Vallespín Aguado. Parc Taulí Hospital Universitari, Institut d’Investigació i Innovació Parc Taulí I3PT, Universitat Autònoma de Barcelona, Sabadell, Barcelona
- •
Carlos Quereda Rodríguez-Navarro. Editor de la revista Nefrología para Guías de Práctica Clínica
- •
Dolores Arenas. Vithas Hospital Internacional Perpetuo, Alicante
- •
Pilar Caro. Hospital Ruber Juan Bravo, Madrid
- •
Milagros Fernández Lucas. Hospital Universitario Ramón y Cajal, Universidad de Alcalá, Madrid
- •
Néstor Fontseré. Hospital Clínic, Universitat de Barcelona, Barcelona
- •
Enrique Gruss. Hospital Universitario Fundación Alcorcón, Alcorcón, Madrid
- •
José Ibeas. Parc Taulí Hospital Universitari, Institut d’Investigació i Innovació Parc Taulí I3PT, Universitat Autònoma de Barcelona, Sabadell, Barcelona
- •
Secretario del Grupo de Trabajo de Acceso Vascular de la Sociedad Española de Nefrología
- •
José Luis Merino. Hospital Universitario del Henares, Coslada, Madrid
- •
Manel Ramírez de Arellano. Hospital de Terrassa, Consorci Sanitari de Terrassa, Barcelona
- •
Ramon Roca-Tey. Hospital de Mollet, Fundació Sanitària Mollet, Mollet del Vallès, Barcelona
- •
Representante Oficial de la Sociedad Española de Nefrología. Coordinador del Grupo de Trabajo de Acceso Vascular de la Sociedad Española de Nefrología y del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV)
- •
María Dolores Sánchez de la Nieta. Hospital General Universitario de Ciudad Real, Ciudad Real
- •
Ángel Barba. Hospital Galdakao-Usansolo, Bizkaia
- •
Natalia de la Fuente. Hospital Galdakao-Usansolo, Bizkaia
- •
Fidel Fernández. Complejo Hospitalario Universitario de Granada, Granada
- •
Antonio Giménez. Parc Taulí Hospital Universitari, Institut d’Investigació i Innovació Parc Taulí I3PT, Universitat Autònoma de Barcelona, Sabadell, Barcelona
- •
Cristina López. Complejo Hospitalario Universitario de Granada, Granada
- •
Guillermo Moñux. Hospital Clínico Universitario San Carlos, Madrid
- •
Representante Oficial de la Sociedad Española de Angiología y Cirugía Vascular (SEACV). Coordinador de la Sección de Acceso Vascular de la Sociedad Española de Angiología y Cirugía Vascular
- •
Joaquín Vallespín. Parc Taulí Hospital Universitari, Institut d’Investigació i Innovació Parc Taulí I3PT, Universitat Autònoma de Barcelona, Sabadell, Barcelona
- •
Secretario de la Sección de Acceso Vascular de la Sociedad Española de Angiología y Cirugía Vascular
- •
José García-Revillo García. Hospital Universitario Reina Sofía, Córdoba
- •
Teresa Moreno. Hospital Juan Ramón Jiménez, Complejo Hospitalario Universitario de Huelva, Huelva Representante Oficial de la Sociedad Española de Radiología Vascular e Intervencionista (SERVEI), Sección de la Sociedad Española de Radiología Médica (SERAM)
- •
Pablo Valdés Solís. Hospital de Marbella, Málaga
- •
José Luis del Pozo. Clínica Universidad de Navarra, Pamplona Representante Oficial de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (Grupo de Estudio de la Infección Relacionada con la Asistencia Sanitaria/ Grupo de Estudio de la Infección Hospitalaria [GEIRAS/GEIH])
- •
Patricia Arribas. Hospital Infanta Leonor, Madrid
- •
David Hernán. Fundación Renal Íñigo Álvarez de Toledo, Madrid
- •
Anna Martí. Consorcio Hospital General Universitario, Valencia Representante Oficial de la Sociedad Española de Enfermería Nefrológica (SEDEN)
- •
María Teresa Martínez. Hospital General Universitario Gregorio Marañón, Madrid
- •
Fernando Álvarez Ude. Hospital de Segovia, Segovia
- •
José Antonio Herrero. Hospital Clínico Universitario San Carlos, Madrid
- •
Fernando García López. Centro Nacional de Epidemiología. Instituto de Salud Carlos III
- •
Sergi Bellmunt. Hospital Vall d’Hebron, Barcelona
- •
Melina Vega. Hospital Galdakao-Usansolo, Bizkaia
- •
José Luis del Cura. Hospital de Basurto, Vizcaya
- •
Antonio Segarra. Hospital Vall d’Hebron, Barcelona
- •
Jesús Fortún Abete. Hospital Universitario Ramón y Cajal, Madrid
- •
Isabel Crehuet. Hospital General Universitario Gregorio Marañón, Madrid
- •
Fernando González. Hospital General Universitario Gregorio Marañón, Madrid
ADER
- •
Sr. Antonio Tombas. Presidente
- •
Daniel Gallego Zurro. Vocal de la Junta Directiva
Justificación de la edición de la Guía
El objetivo de esta Guía es proporcionar una orientación en el manejo integral del AV para el paciente en HD. Se ha desarrollado con el fin de proporcionar información y ayuda para la toma de decisiones en el ámbito de la práctica clínica. Esta Guía se ha desarrollado como un proyecto conjunto de las cinco sociedades científicas referidas, que han sido representadas por especialistas con experiencia en este campo. Las cinco sociedades convinieron en la necesidad de realizar una actualización de la primera edición de la Guía del Acceso Vascular que fue editada por la Sociedad Española de Nefrología, con la colaboración de las otras cuatro sociedades y que fue publicada en 2005.A quién va dirigida la Guía
La Guía supone un apoyo en la toma de decisiones para cualquier profesional involucrado en el área del AV para HD. Esto incluye a nefrólogos, cirujanos vasculares, radiólogos intervencionistas, infectólogos y a enfermería nefrológica. Además, debido a la vertiente docente de la Guía, va dirigida también a los profesionales en formación de estas especialidades. De este modo, se ha considerado de especial interés sintetizar la información necesaria para poner a disposición del usuario el conocimiento imprescindible para conocer los fundamentos de los diferentes aspectos que trata la Guía. Por ello, se incluyen apartados con las explicaciones complementarias que se han considerado apropiados. Y, por último, pretende ser una herramienta para los gestores asistenciales, responsables de la administración y del ámbito de la política sanitaria. Con este fin, el apartado de indicadores pretende no solo dotar al profesional de las herramientas necesarias para ayudar a mejorar la calidad de la asistencia, sino dar soporte a los responsables de la gestión de los recursos para poder optimizarlos, al mismo tiempo que se tiene el mismo objetivo con la calidad asistencial.Alcance de la Guía
La Guía trata sobre el paciente con insuficiencia renal avanzada en fase prediálisis o ya en programa de diálisis que necesita un AV y el tratamiento de sus complicaciones, así como todo el conocimiento asociado a su mantenimiento y cuidados. La Guía no incluye a la población infantil, al entender el grupo que se trata de un tipo de paciente que requiere un conocimiento específico.
METODOLOGÍA PARA EL DESARROLLO DE LA GUÍAEstablecimiento del grupo de desarrollo de la Guía
Las juntas directivas de las cinco sociedades participantes, S.E.N., SEACV, SERVEI, SEDEN y SEIMC, aprobaron la selección de los expertos que iban a representar a tales sociedades. Los coordinadores de la Guía seleccionaron, de modo consensuado, a su vez, a los responsables de cada apartado, los cuales coordinaron a los miembros de cada apartado que eran integrantes de todas las sociedades implicadas. El grupo consistió en expertos con experiencia en el terreno de la creación del AV, en el tratamiento de las complicaciones, tanto desde el punto de vista quirúrgico como endovascular, en el área de la colocación de catéteres y del tratamiento de las complicaciones asociadas, en el área de la prevención y tratamiento de las infecciones, en la preparación, monitorización, cuidado y mantenimiento del AV, en indicadores de calidad y en metodología de las revisiones sistemáticas y de la medicina basada en la evidencia. Se solicitó el apoyo metodológico del Centro Cochrane Iberoamericano para el desarrollo de la revisión sistemática de la evidencia de las preguntas clínicas priorizadas por el GEMAV, y en otras etapas del desarrollo de la Guía.Selección de las preguntas clínicas
Por un lado, se priorizaron las preguntas clínicas más relevantes para la práctica habitual, y por otro se aplicó a estas preguntas clínicas una metodología sistemática y rigurosa para la formulación de recomendaciones. Para esta actualización, el GEMAV priorizó las preguntas clínicas de la versión original con una mayor relevancia para la práctica clínica o nuevas preguntas interpretadas como necesarias para la nueva Guía.
Teniendo en cuenta el ámbito de la Guía se identificaron preguntas clínicas específicas, para las que se realizó una revisión sistemática:
- I.
¿La preservación de la red venosa evita complicaciones/facilita la creación de la fístula arteriovenosa?
- II.
En los pacientes con enfermedad renal crónica, ¿cuáles son los parámetros demográficos, clínicos y analíticos para determinar el momento de creación de una fístula arteriovenosa, ya sea una fístula arteriovenosa nativa o protésica?
- III.
¿Qué criterios se requieren para planificar la fístula arteriovenosa (en función de diferentes tipos de fístula)?
- IV.
¿Qué factores de riesgo se ha demostrado que pueden influir en el desarrollo de isquemia de la extremidad tras realizar la fístula arteriovenosa?
- V.
¿Se puede aconsejar un orden en la realización de la fístula arteriovenosa?
- VI.
¿Son útiles los ejercicios en el desarrollo de las fístula arteriovenosa nativa?
- VII.
¿Cuál es el tiempo mínimo de maduración de una fístula arteriovenosa nativa o protésica para ser puncionada?
- VIII.
¿Cuál es la técnica de elección de punción para los diferentes tipos de fístula arteriovenosa: las tres clásicas y autopunción?
- IXa.
¿En qué situaciones es necesario realizar profilaxis antitrombótica tras la realización-reparación de la fístula arteriovenosa?
- IXb.
¿El uso de antiagregantes previamente a la creación de la fístula arteriovenosa ¿tiene una repercusión en la supervivencia y reduce el riesgo de trombosis?
- X.
¿Cuál es el rendimiento de la ecografía Doppler frente a los métodos dilucionales de screening para determinar el flujo sanguíneo de la fístula arteriovenosa?
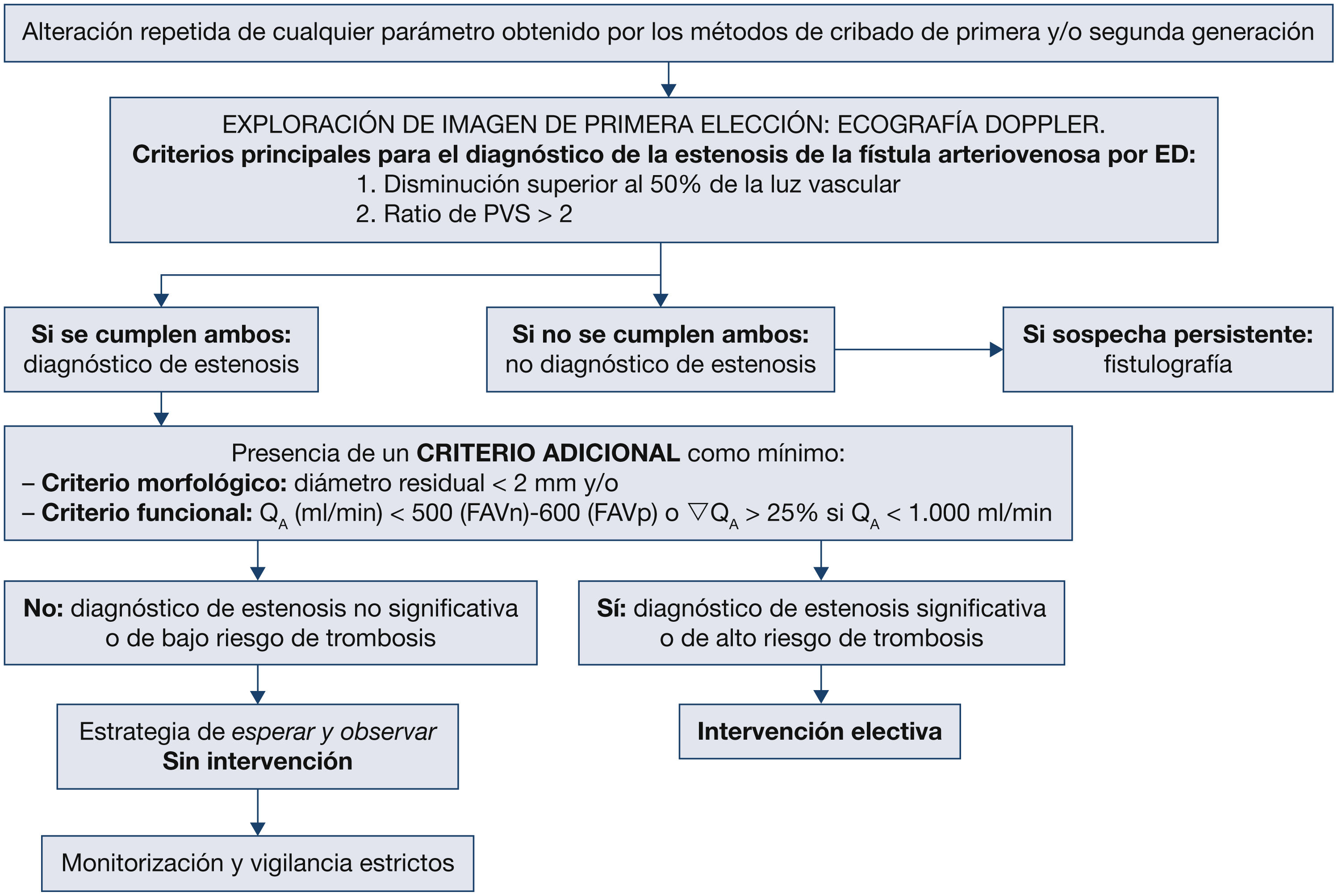
- XI.
¿La ecografía Doppler reglada efectuada por un explorador experimentado puede sustituir a la angiografía como gold standard para el diagnóstico de confirmación de la estenosis significativa de la fístula arteriovenosa?
- XII.
¿Qué método de monitorización o de vigilancia no invasivo de cribado de la fístula arteriovenosa presenta poder predictivo de estenosis o de trombosis o de aumento de la supervivencia de la fístula arteriovenosa protésica en el enfermo prevalente y con qué periodicidad?
- XIII.
¿Qué método de monitorización o de vigilancia no invasivo de screening de la fístula arteriovenosa presenta poder predictivo de estenosis o de trombosis o de aumento de la supervivencia de la fístula arteriovenosa nativa en el enfermo prevalente y con qué periodicidad?
- XIV.
¿Cuáles son los factores y variables demográficos, clínicos y hemodinámicos con poder predictivo de trombosis en una fístula arteriovenosa que presenta estenosis?
- XV.
¿Hay un tratamiento con mejores resultados (angioplastia transluminal percutánea frente a cirugía) en la estenosis yuxtaanastomótica, valorado en supervivencia y/o trombosis y coste-beneficio?
- XVI.
¿Hay un criterio de indicación de en qué casos, el momento y cómo tratar la estenosis central, valorado en supervivencia, fístula arteriovenosa utilizable y/o trombosis?
- XVII.
En la trombosis de la fístula arteriovenosa nativa, ¿cuál sería la indicación inicial (angioplastia transluminal percutánea frente a cirugía) valorada en términos de supervivencia de la fístula arteriovenosa y/o trombosis? ¿Depende de la localización?
- XVIII.
En la trombosis de la fístula arteriovenosa protésica, ¿cuál sería la indicación inicial (angioplastia transluminal percutánea frente a cirugía o fibrinólisis) valorada en términos de supervivencia de la fístula arteriovenosa y/o trombosis? ¿Depende de la localización?
- XIX.
Ante la presencia de estenosis en la fístula arteriovenosa ¿hay diferencia significativa entre intervenir electivamente o realizar el tratamiento postrombosis?
- XX.
¿Hay un tratamiento con mejores resultados (angioplastia transluminal percutánea frente a cirugía o frente a interposición de prótesis) en el manejo de la fístula arteriovenosa no desarrollada, valorado en fístula arteriovenosa que permita su uso en diálisis, supervivencia y/o trombosis?
- XXI.
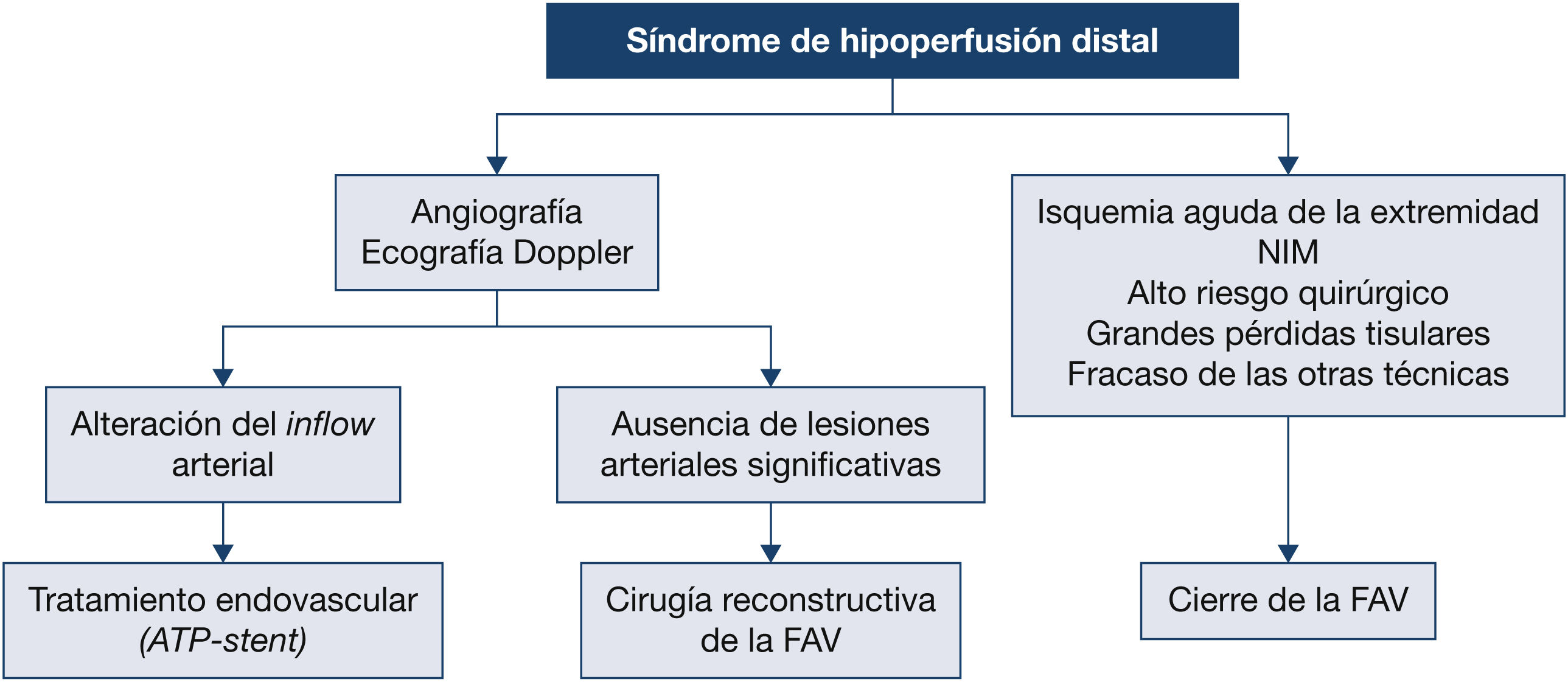
¿Cuál es el abordaje de la fístula arteriovenosa nativa o de la protésica diagnosticadas con síndrome de robo?
- XXII.
En el seudoaneurisma de la fístula arteriovenosa nativa y de la protésica, ¿cuándo se establece la indicación de cirugía frente a intervención percutánea o frente a manejo conservador, valorada en complicaciones hemorrágicas graves o muerte?
- XXIII.
En la fístula arteriovenosa de alto flujo, ¿qué actitud terapéutica hay que tomar y cuáles son los criterios (factores de riesgo)?
- XXIV.
En el paciente sin posibilidad de fístula arteriovenosa nativa, ¿es el catéter venoso central el acceso vascular de elección frente a la fístula arteriovenosa protésica?
- XXV.
¿Existen diferencias en la indicación de utilizar catéteres venosos centrales no tunelizados frente a los tunelizados?
- XXVI.
¿Cuál es el mejor material y diseño para un catéter venososo central tunelizado?
- XXVII.
¿Deben utilizarse los ultrasonidos como estándar de referencia en la colocación del catéter venoso central?
- XXVIII.
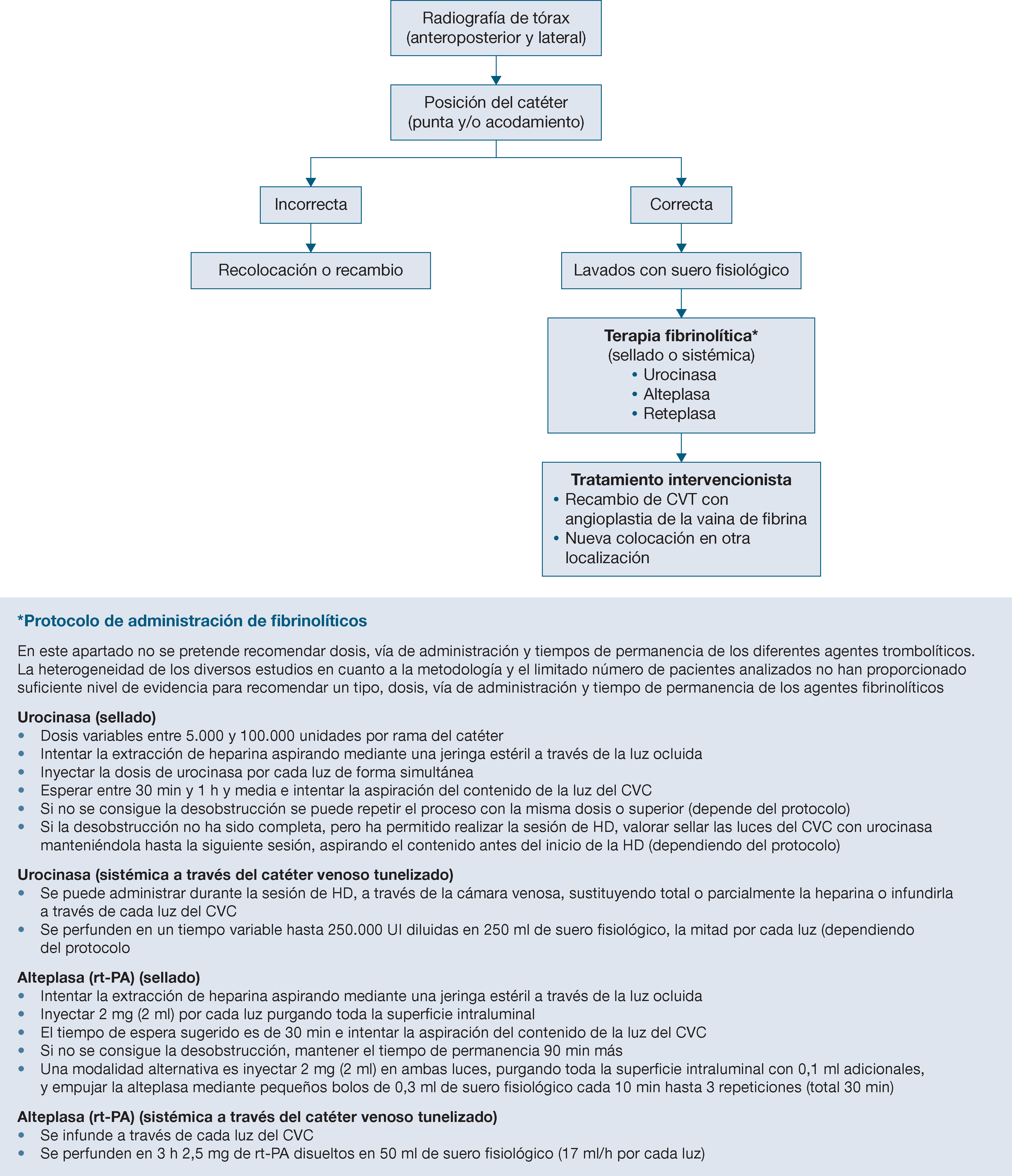
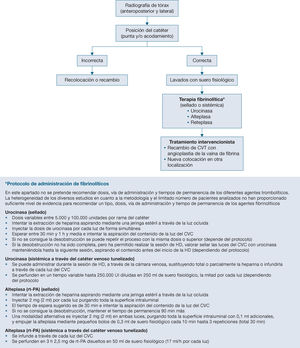
¿Cuál es el mejor tratamiento de la disfunción persistente del catéter venoso central tunelizado (stripping, angioplastia de la vaina, fibrinolíticos, recambio del catéter)?
- XXIX.
¿Qué influencia tienen los diferentes tipos de cebado o sellado de las luces del catéter venoso central en la disfunción y en la infección de este?
- XXX.
¿Está justificado el uso de profilaxis antibiótica en el cebado del catéter venoso central tunelizado para hemodiálisis?
- XXXI.
La bacteriemia relacionada con el catéter secundaria a infección por Staphylococcus aureus, Pseudomonas sp. o Candida sp. ¿obliga a la retirada del catéter venoso central y, por lo tanto, contraindica el tratamiento mediante la técnica antibiotic lock para intentar conservarlo?
- XXXII.
El tratamiento antibiótico empírico para cubrir grampositivos en bacteriemia en un portador de catéter venoso central tunelizado en hemodiálisis, cuando se conserva dicho catéter, ¿debe ser de inicio cefazolina (vancomicina si valor de SARM > 15%) o daptomicina, asociada al tratamiento para gramnegativos y el sellado a la concentración adecuada?
- XXXIII.
La detección y erradicación de Staphylococcus aureus en los portadores nasales, ¿reduce los episodios de bacteriemia relacionada con el catéter venoso central? ¿Es coste-efectiva?
En cada apartado de la Guía se pueden consultar las recomendaciones originales de la anterior versión del documento que no han producido una actualización sustancial y que, por tanto, el GEMAV ha asumido como propias.
Por último, el GEMAV identificó una serie de preguntas sin tanto impacto para la práctica clínica, pero para las cuales los mismos miembros del GEMAV elaboraron una actualización a partir de una revisión narrativa de la literatura. Estos apartados pueden generar recomendaciones por consenso del GEMAV.Desarrollo de preguntas clínicas
Estas preguntas tienen un formato estructurado para identificar el tipo de paciente, la intervención o prueba diagnóstica a evaluar, las comparaciones en los casos en los que fue necesario y los desenlaces de interés (formato PICO). Como se detalla en el apartado de metodología, las recomendaciones para estas preguntas clínicas se han elaborado siguiendo las directrices del sistema GRADE.
El grupo de trabajo colaboró en el desarrollo de estas preguntas enmarcándolas en un formato que permitiera la búsqueda sistemática de la evidencia, siguiendo la metodología PICO con la rutina establecida al efecto. Es decir, la especificación en primer lugar del tipo de paciente (P), del tipo de intervención (I), el comparador(C) y el resultado (O —outco-mes—) para las cuestiones en intervención y pruebas diagnósticas. Para cada pregunta, el grupo acordó unos criterios de revisión sistemática incluyendo unas características determinadas en función del diseño de los estudios buscados.Clasificación de la importancia relativa de los resultados (outcomes)
Para cada pregunta de intervención, el grupo recopiló un listado de posibles resultados, reflejando tanto los beneficios como los daños o estrategias alternativas. Estos resultados se clasificaron en clave, importantes o poco importantes con relación al proceso de toma de decisiones. Por ejemplo, los resultados asociados a variables de salud importantes como la mortalidad en el paciente o la trombosis en el AV se consideraron clave, y resultados como el flujo, de menor importancia.Identificación de las preguntas clínicas, recomendaciones de la versión previa de la Guía y actualizaciones narrativas de la literatura
A lo largo del documento, las recomendaciones correspondientes a las preguntas clínicas y a las actualizaciones están marcadas con la etiqueta “nueva”. Además, las recomendaciones correspondientes a las preguntas clínicas, elaboradas a partir de un proceso sistemático y riguroso de formulación de recomendaciones, se identifican con el símbolo (•). El contenido que expresan el resto de las recomendaciones procede de la versión anterior de la Guía.Estructura de los distintos apartados de la guía
El contenido de la guía se ha estructurado en las áreas de conocimiento que se indican a continuación. Para coordinar el trabajo en cada una de ellas se nombró a uno o dos coordinadores de área y a varios expertos, según el volumen y las características de la materia a analizar. Las áreas estudiadas y los coordinadores y expertos de cada una de ellas se indican a continuación.
La actividad profesional actual de los autores de la Guía y un resumen de su trayectoria, que los acredita como expertos, se muestran en el anexo 1.
1. PROCEDIMIENTOS PREVIOS A LA REALIZACIÓN DEL ACCESO VASCULAR
Joaquín Vallespín, Fidel Fernández (coordinadores), José Ibeas, Teresa Moreno
2. CREACIÓN DE LA FÍSTULA ARTERIOVENOSA
Guillermo Moñux (coordinador), Joaquín Vallespín, Natalia de la Fuente, Fidel Fernández, Dolores Arenas.
3. CUIDADOS DE LA FÍSTULA ARTERIOVENOSA
Néstor Fontseré (coordinador), Pilar Caro, Anna Martí, Ramon Roca-Tey, José Ibeas, José Luis del Pozo, Patricia Arribas, María Teresa Martínez.
4. MONITORIZACIÓN Y VIGILANCIA DE LA FÍSTULA ARTE-RIOVENOSA
Ramon Roca-Tey (coordinador), José Ibeas, Teresa Moreno, Enrique Gruss, José Luis Merino, Joaquín Vallespín, David Hernán, Patricia Arribas.
5. COMPLICACIONES DE LA FÍSTULA ARTERIOVENOSA
José Ibeas, Joaquín Vallespín (coordinadores), Teresa Moreno, José García-Revillo, Milagros Fernández Lucas, José Luis del Pozo, Antonio Giménez, Fidel Fernández, María Teresa Martínez, Ángel Barba.
6. CATÉTERES VENOSOS CENTRALES
Manel Ramírez de Arellano, Teresa Moreno (coordinadores), José Ibeas, María Dolores Sánchez de la Nieta, José Luis del Pozo, Anna Martí, Ramon Roca-Tey, Patricia Arribas.
7. INDICADORES DE CALIDAD
Dolores Arenas (coordinadora), Enrique Gruss, Ramon Roca-Tey, Cristina López, Pablo Valdés.
Los contenidos de cada uno de estos apartados y su relevancia se justifican en un “preámbulo”. Posteriormente, los “aspectos clínicos” desarrollan el contenido clínico de los apartados y recogen las recomendaciones, en los siguientes apartados:
- •
Recomendaciones: cada apartado se encabeza con la recopilación de las recomendaciones acompañadas de una numeración correlativa para facilitar su identificación. Como se ha comentado, las nuevas recomendaciones se identifican con la etiqueta “nueva” y las correspondientes a las preguntas clínicas, con el símbolo (•).
- •
Razonamiento: discusión sobre la relevancia y razonamiento de cada apartado clínico.
- •
Las preguntas clínicas se identifican de manera correlativa con números romanos (I, II, III, etc.). Para estas preguntas se ha seguido un proceso formal de revisión de la literatura científica y formulación de recomendaciones siguiendo la metodología GRADE, como se detalla más adelante en el apartado de metodología. El apartado muestra un resumen de los resultados recogidos en la revisión de la literatura valorada para cada pregunta clínica, con un enlace electrónico a las versiones originales de las revisiones. A continuación, en un apartado denominado “De la evidencia a la recomendación”, se detalla una justificación de los aspectos valorados a la hora de formular las recomendaciones y graduar su fuerza y el proceso de acuerdo de los miembros del GEMAV, que se produjo en algunas situaciones mediante votación a partir de un proceso formal. Finalmente, cada pregunta clínica se cierra con las recomendaciones derivadas de la valoración de la literatura y el proceso de justificación descritos.
- •
En el caso de las actualizaciones se ha desarrollado un apartado en el que se describe el contenido clínico de cada aspecto de interés, seguido de un cuadro con las recomendaciones derivadas del consenso por el GEMAV.
Como se ha descrito en el apartado anterior, la actualización de esta Guía se inició con un proceso de priorización en el que se identificaron: a) los apartados de la versión original que el GEMAV asumiría como propios; b) los aspectos para los que el GEMAV realizaría una actualización a partir de una revisión narrativa de la literatura, y c) las preguntas clínicas que seguirían un proceso sistemático y riguroso de análisis de la literatura científica. Para el desarrollo de las diferentes fases se han seguido directrices metodológicas estandarizadas, que toman como referencia el Manual Metodológico para la elaboración de Guías de Práctica Clínica del Sistema Nacional de Salud1.
En una reunión de trabajo inicial, dos metodólogos introdujeron a los miembros clínicos del GEMAV en las bases teóricas para la formulación de preguntas contestables2. A continuación se valoró el alcance de los contenidos abordados en la versión inicial de la Guía y se transformaron en preguntas clínicas, añadiendo los aspectos que los miembros del GEMAV consideraron oportunos. Durante la reunión y en rondas posteriores de comentarios electrónicos mediante la plataforma Google Drive se priorizaron las preguntas clínicas más relevantes que debían ser desarrolladas en un proceso sistemático, y se identificaron los desenlaces de interés para cada una de ellas.
Las preguntas clínicas identifican el tipo de paciente, la intervención o prueba diagnóstica a evaluar, las comparaciones en los casos en los que fue necesario y los desenlaces de interés (formato PICO). Los desenlaces de interés se definieron para evaluar el beneficio y efectos indeseados de los diferentes procedimientos y se clasificaron de acuerdo a su importancia para la toma de decisiones2.
Posteriormente se realizaron búsquedas exhaustivas para las preguntas clínicas, definiendo términos relacionados con el alcance de cada pregunta e identificando lenguaje controlado y natural que pudiera tener un rendimiento adecuado para recuperar estudios relevantes en las bases de datos bibliográficas. En el caso de las actualizaciones, un metodólogo con experiencia en el diseño de búsquedas exhaustivas de literatura diseñó una estrategia de búsqueda en MEDLINE (accedida a través de PubMed) y entregó los resultados de búsqueda a los miembros del GEMAV responsables de cada uno de los apartados.
Para las preguntas clínicas priorizadas se diseñó una búsqueda inicial de otras guías, revisiones de la literatura y ensayos clínicos para valorar las preguntas para las que existieran menos estudios para apoyarlas y que requirieran de búsquedas más exhaustivas. Posteriormente se diseñó para cada pregunta clínica una estrategia de búsqueda en MEDLINE (accedida a través de PubMed) y The Cochrane Library. En el caso en el que no se identificaron los diseños de estudio mencionados, se valoraron estudios observacionales, y de no identificar estudios, se perfeccionaron las búsquedas a partir de redes de citaciones de estudios relevantes en ISI Web of Science (Thomson Reuters). Los algoritmos de búsqueda bibliográfica utilizados en este trabajo pueden consultarse en el siguiente enlace electrónico. No se aplicaron límites relevantes a estos algoritmos que se ejecutaron entre los meses de octubre de 2013 y octubre de 2014. Desde esta fecha hasta su edición, los coordinadores de la Guía han realizado una tarea de búsquedas centinelas sistematizadas para identificar aquellos estudios que pudieran tener un impacto mayor para las recomendaciones, y se identificó el último estudio relevante en abril de 2016 (pregunta clínica VI).
Se realizó un resumen estructurado de los resultados de los estudios más relevantes que respondían al alcance de cada pregunta clínica. Para cada desenlace de interés se clasificó la calidad de la evidencia de acuerdo a los criterios estandarizados definidos en el sistema GRADE, que permiten establecer la confianza de los estimadores del efecto disponibles en la literatura científica para apoyar las recomendaciones3. La calidad de la evidencia puede clasificarse como alta, moderada, baja y muy baja. Se consideraron los siguientes factores que pueden modificar la confianza en los resultados disponibles en la literatura científica: riesgo de sesgo, consistencia entre los resultados de los estudios disponibles, disponibilidad de evidencia directa y precisión de los estimadores del efecto3. En el caso de los estudios observacionales se tuvieron además en cuenta: tamaño del efecto, relación dosis-respuesta y el posible impacto en los resultados de los factores de confusión. Cada pregunta clínica se acompaña de un resumen de los hallazgos derivados de la revisión de la literatura, sintetizados al final de cada pregunta en una sección denominada “Resumen de la evidencia”. El resumen de los hallazgos se acompaña en cada caso de la clasificación de la calidad de la evidencia. Este proceso también se recoge en tablas de resumen de los resultados, disponibles para cada pregunta clínica en los anexos electrónicos.
A partir de los resultados de las revisiones de la literatura se formularon recomendaciones para cada pregunta clínica. Estas pueden ser a favor o en contra de una determinada intervención, y se gradúan como fuertes o débiles. La fuerza de las recomendaciones que acompañan a las preguntas se refleja en su propio enunciado. De esta manera, las recomendaciones fuertes se formulan usando el enunciado “se recomienda…” o “se recomienda no...”, y las recomendaciones débiles o en las que existe más incertidumbre usan el enunciado “se sugiere...” o “se sugiere no...”.
Para la graduación de la fuerza de las recomendaciones se valoran una serie de aspectos que determinan la confianza en que la implantación de las recomendaciones repercute en más efectos deseables que indeseados en los pacientes4. Para graduar la fuerza de las recomendaciones se realiza un balance entre los beneficios y riesgos de las intervenciones, sus costes derivados, la calidad de la evidencia y los valores y preferencias de los pacientes. La gradación de la fuerza de las recomendaciones depende del balance más o menos favorable y relevante entre estos factores. Las recomendaciones derivadas de las preguntas clínicas se acompañan de un apartado denominado “De la evidencia a la recomendación”, en el que el GEMAV ha justificado las razones por las cuales se ha formulado una recomendación de una determinada manera. De manera excepcional, en las preguntas clínicas en las que no se obtuvo el acuerdo suficiente en la discusión y justificación sobre la fuerza de las recomendaciones, se procedió a un método de consenso estructurado por votación5.
Las recomendaciones que se derivan de los apartados de actualizaciones no siguieron un proceso estructurado como el descrito hasta el momento. Las recomendaciones correspondientes a estos apartados se formularon por el consenso del GEMAV. El contenido de la Guía debería actualizarse en un máximo de 5 años, o en un plazo de tiempo inferior en el caso de aparecer nueva literatura científica que aportara datos relevantes para las recomendaciones actuales. En el proceso de actualización se seguirían las directrices del manual metodológico correspondiente1.Perspectiva de los usuarios de la Guía. Revisión externa
Un borrador de la Guía se sometió a revisión externa por dos expertos seleccionados por cada una de las sociedades científicas. Se remitió también un borrador a cada una de las dos principales sociedades de enfermos renales del país, ALCER y ADER. Finalmente, el texto resultante estuvo expuesto en las webs de las sociedades para valoración de los socios. Se respondió a todos los comentarios y sugerencias. Tanto las observaciones de los revisores como las respuestas están disponibles en el siguiente enlace electrónico.
CONFLICTOS DE INTERÉSLos miembros expertos de cada grupo fueron propuestos de forma independiente por cada una de las sociedades sin recibir compensación económica alguna.
Las personas que han integrado el GEMAV han firmado un formulario en el que declaran las relaciones externas de carácter personal, profesional, docente o laboral que pudieran interpretarse como conflictos de interés en relación con el tema de la Guía. Un resumen de estos puede verse en el anexo 2. Por otra parte, los formularios de declaración de conflicto de interés de cada uno de los expertos pueden encontrarse en el siguiente enlace electrónico.
Todas las sociedades profesionales participaron directamente en la financiación de esta Guía. La Sociedad Española de Nefrología (S.E.N.), a través de la Fundación para la Ayuda a la Investigación y Formación en Nefrología (Fundación SENEFRO), recibió una ayuda parcial y no condicionada para la edición final de esta Guía de los laboratorios AMGEN, BARD, BAXTER, COVIDIEN, FRESENIUS, HOSPAL, IZASA, MEDCOMP, NOVARTIS y RUBIO. La Sociedad Española de Radiología Intervencionista (SERVEI), además de su financiación directa, recibió también una colaboración económica de la empresa BARD. La Sociedad Española de Enfermería Nefrológica (SEDEN) recibió una ayuda no condicionada de la Fundación sin ánimo de lucro Íñigo Álvarez de Toledo (FRIAT). Las otras sociedades profesionales: Sociedad Española de Cirugía Vascular (SEACV) y Sociedad Española de Enfermedades Infecciosas (SEIMC) participaron directamente en la financiación de esta obra.
DESARROLLO DE LOS APARTADOS DE LA GUÍA1PROCEDIMIENTOS PREVIOS A LA REALIZACIÓN DEL ACCESO VASCULARCONTENIDO
1.1. Historia clínica
1.2. Cuándo realizar la fístula arteriovenosa
1.3. Evaluación preoperatoriaPreámbulo
Los servicios de nefrología deben disponer de un programa de atención a los pacientes con enfermedad renal crónica avanzada (ERCA), con la finalidad de proporcionarles tanto a ellos como a sus familiares información detallada acerca de los sistemas integrados de tratamiento sustitutivo renal (TSR), así como una propuesta en función de sus características clínicas. La modalidad de TSR debe ser finalmente acordada según las preferencias y circunstancias específicas de cada paciente6.
La morbilidad y mortalidad del paciente en programa de hemodiálisis (HD) tienen relación directa con el tipo de acceso vascular (AV), tanto al inicio como en el seguimiento del TSR. El riesgo de complicaciones infecciosas al inicio de HD se multiplica por 4 cuando se utiliza un catéter venoso central (CVC) comparado con la fístula arteriovenosa (FAV) nativa (FAVn) o protésica (FAVp) y hasta por 7 cuando el CVC es el AV prevalente. Asimismo, hay un significativo incremento en el riesgo de mortalidad asociado con el uso del CVC, especialmente en el primer año de HD7.
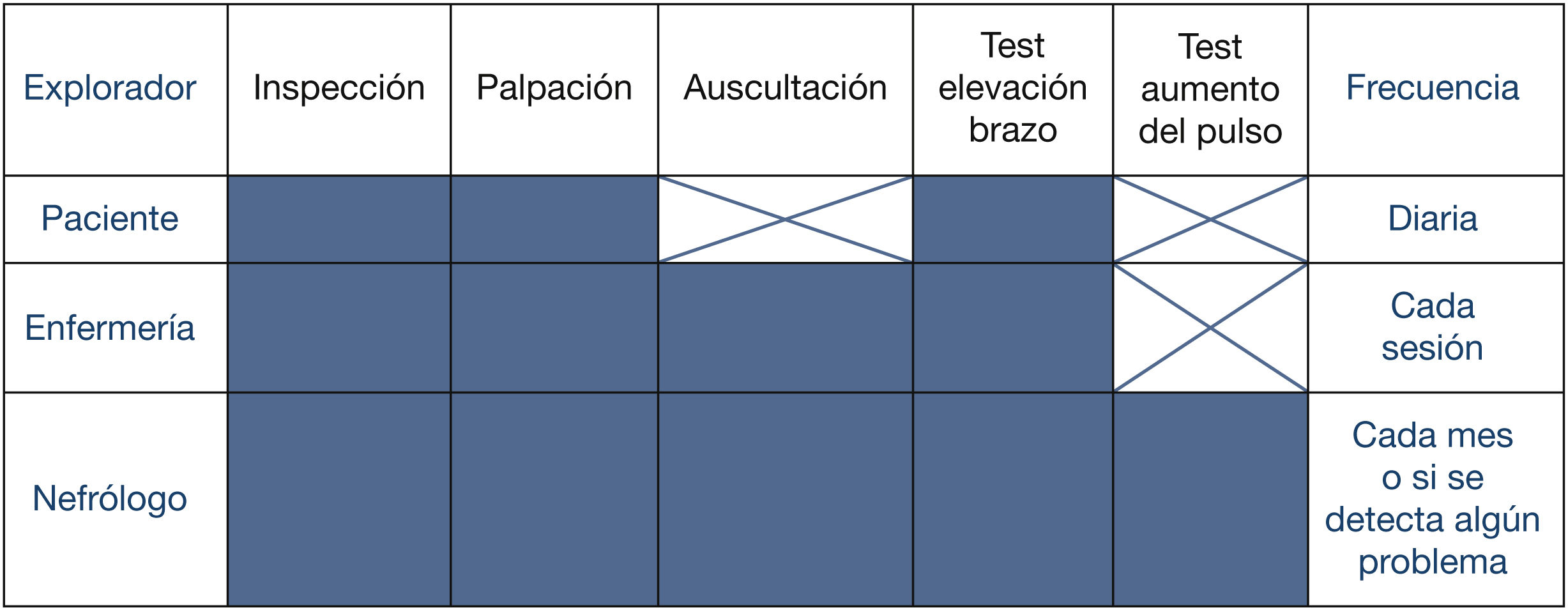
Por ello, son fundamentales los programas en los que el manejo del AV del paciente HD se hace desde una perspectiva multidisciplinar, involucrando a todas las especialidades directamente relacionadas: nefrología, cirugía vascular, radiología intervencionista, enfermería y enfermedades infecciosas, con el objetivo de mantener la máxima incidencia y prevalencia de AV nativo8. Pero tan importante es un equipo multidisciplinar del AV como su coordinación: se ha demostrado que una eficiente gestión del equipo puede redundar en un descenso de la prevalencia de catéteres9.
Esta primera fase previa a la creación del AV tiene una particular trascendencia, ya que el pronóstico del paciente y su enfermedad estarán condicionados, en gran medida, por el manejo y las medidas que se adopten. En esta fase es cuando se debe informar al paciente de las modalidades de TSR de cara a la elección más adecuada en cada caso, y cuando se debe instaurar una política de preservación del capital venoso de las extremidades superiores. Asimismo, es necesario determinar los factores implicados en la elección del AV idóneo, mediante una historia clínica orientada y una correcta evaluación preoperatoria, así como una evaluación del riesgo de desarrollar complicaciones asociadas al AV. Finalmente, se habrá de determinar el mejor momento para la realización del AV para minimizar, por un lado, el riesgo de inicio de HD por CVC y, por otro, evitar intervenciones prematuras realizando AV innecesarios.
1.1Historia clínicaRecomendacionesR 1.1.1) Se recomienda que todos los centros de nefrología que generan enfermos para tratamiento sustitutivo renal dispongan de programas educacionales, con participación multidisciplinar. Su finalidad debe ser instruir al paciente y a sus familiares sobre los diferentes aspectos relacionados con la enfermedad renal crónica avanzada, sus modalidades de tratamiento y la trascendencia de disponer de una fístula arteriovenosa para iniciar la hemodiálisis
R 1.1.2) Se recomienda, para seleccionar el tipo de acceso vascular apropiado, realizar una historia clínica del paciente, conocer la comorbilidad asociada y poder estimar los factores de riesgo de fracaso relacionados con el desarrollo del acceso vascular, así como la posible morbilidad generada tras la creación de este
(•) nueva R 1.1.3) Se recomienda que para facilitar la creación de la fístula arteriovenosa en los pacientes con enfermedad renal crónica avanzada, se extreme la conservación de la red venosa superficial de ambas extremidades superiores, que deben preservarse libres de punciones y canulaciones. Para ello es preciso instruir al personal sanitario e informar al paciente
Son numerosas las circunstancias asociadas a la comorbilidad del paciente con ERCA que pueden influir en un adecuado desarrollo del AV, lo que obliga a un conocimiento previo de todos los factores implicados. En la revisión de la historia clínica se deben contemplar los antecedentes patológicos que puedan aumentar de algún modo el riesgo de fallo del AV o predisponer a la aparición de morbilidad secundaria a dicho AV10.
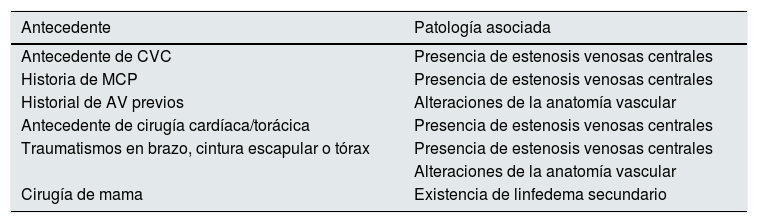
Con respecto a los antecedentes que conllevan un riesgo de fracaso del AV se encuentran, en primer lugar, la presencia de comorbilidades asociadas a un peor pronóstico del AV en general (tabla 1): edad avanzada, presencia de diabetes mellitus (DM), arteriopatía periférica, tabaquismo u obesidad, y, en segundo lugar, la presencia de antecedentes a considerar a la hora de planificar la óptima localización del acceso (tabla 2): antecedente de CVC o marcapasos (MCP), historia de AV previos, traumatismos o cirugías previas en brazo, cintura escapular o tórax, o canulaciones venosas previas10.
Factores locales a valorar en la indicación de la fístula arteriovenosa
| Antecedente | Patología asociada |
|---|---|
| Antecedente de CVC | Presencia de estenosis venosas centrales |
| Historia de MCP | Presencia de estenosis venosas centrales |
| Historial de AV previos | Alteraciones de la anatomía vascular |
| Antecedente de cirugía cardíaca/torácica | Presencia de estenosis venosas centrales |
| Traumatismos en brazo, cintura escapular o tórax | Presencia de estenosis venosas centrales |
| Alteraciones de la anatomía vascular | |
| Cirugía de mama | Existencia de linfedema secundario |
AV: acceso vascular; CVC: catéter venoso central; MCP: marcapasos.
Asimismo, es necesario tener en cuenta la presencia de determinada patología de base que puede ser agravada por la presencia del nuevo AV, como es la presencia de una insuficiencia cardíaca previa susceptible de agravarse o de prótesis valvulares que tienen riesgo de sobreinfección en caso de usar CVC. Por otro lado, es importante tener en cuenta la dominancia de las extremidades superiores para minimizar la repercusión en la actividad diaria, o factores como el tratamiento con anticoagulantes.
Por último, también se deberían considerar otros factores que pueden condicionar la elección del tipo de AV (tabla 3), como la expectativa de vida asociada a la comorbilidad del paciente, que puede hacer aconsejable una planificación más conservadora, mediante el uso del CVC, o el caso de pacientes candidatos a trasplante de donante vivo, en el que también un CVC puede ser la opción más recomendable.
Otros factores condicionantes de la elección del tipo de acceso vascular
| Antecedente | Patología asociada |
|---|---|
| Insuficiencia cardíaca congestiva | Empeoramiento de la función cardíaca |
| Prótesis valvulares | Riesgo de sobreinfección |
| Expectativa de vida limitada | Valorar colocación de CVC |
| Candidato a trasplante de donante vivo | Valorar colocación de CVC |
CVC: catéter venoso central.
La alta prevalencia de cardiopatía isquémica en el paciente en HD en nuestro medio11 obliga a tener presente que tanto la situación sistémica como la del árbol vascular de los pacientes sometidos a HD es sensiblemente peor que la de la población general. Por lo tanto, se deberán establecer estrategias encaminadas a la selección del mejor territorio para realizar el AV teniendo en cuenta tanto el futuro del AV como el del paciente.
→ Pregunta clínica I ¿La preservación de la red venosa evita complicaciones/facilita la creación de la fístula arteriovenosa?
(Ver ficha de la Pregunta cínica I en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| No se ha encontrado evidencia científica en estudios observacionales o ensayos clínicos controlados y aleatorizados que responda a la pregunta de si la preservación de la red venosa evita complicaciones o facilita la creación del AV | Calidad muy baja |
| La evidencia actual disponible se basa en la revisión de la bibliografía12 en la que se presentan los cuidados preoperatorios previos a la creación de una FAV, dentro de los cuales está la preservación venosa, así como en las recomendaciones de grupo realizadas en las diferentes guías clínicas publicadas6,10,13–15 | |
Para crear una FAV se ha de disponer de un lecho vascular adecuado, tanto arterial como venoso: se precisa la integridad anatómica y funcional de ambos lechos. El arterial depende fundamentalmente de la comorbilidad del paciente y está menos expuesto a agresiones externas que el venoso, dada su localización más profunda. El lecho venoso superficial, al estar sujeto a la posibilidad de deterioro que puede repercutir en el éxito del futuro AV, obliga a plantear la necesidad de medidas orientadas a su protección. La ausencia de estas condiciones es una de las causas por las que muchos de los pacientes no disponen de un AV que haya madurado en el momento de iniciar HD.
Las venas superficiales de las extremidades superiores son el punto de acceso venoso más habitual en el ámbito hospitalario. Este hecho, precisamente, es el que provoca que en pacientes con múltiples ingresos hospitalarios se dé con frecuencia un agotamiento de la red venosa, fruto del traumatismo repetido de múltiples punciones y de la administración de medicación que provoca una respuesta inflamatoria a nivel de la vena (flebitis química).
Pese a ello, no hay disponible una evidencia en forma de estudios observacionales o ensayos clínicos controlados y aleatorizados que responda a la pregunta de si la preservación de la red venosa evita complicaciones o facilita la creación del AV, por lo que las recomendaciones que se realizan, tanto en las guías de práctica clínica (GPC) como en la bibliografía, se basan en la opinión de distintos grupos de expertos12.
En la mayoría de GPC en uso actualmente10,13–15, así como en la bibliografía16, se recomienda una política agresiva encaminada a la preservación de la red venosa del paciente candidato a HD, mediante una serie de medidas dispuestas a este fin (tabla 4), resumidas en 2 directrices:
- 1.
Educación al paciente sobre la trascendencia y las medidas para la preservación de venas de la extremidad superior.
- 2.
Información y compromiso entre los profesionales sanitarios sobre la importancia de la preservación del capital venoso.
Recomendaciones para la preservación de la red venosa en el paciente candidato a hemodiálisis10,13–16
| • Evitar venopunciones innecesarias y accesos venosos periféricos en la extremidad superior destinada a la creación del AV • Favorecer el uso de las venas del dorso de la mano para muestras de sangre, inyecciones y transfusiones • Evitar la inserción de CVC en venas subclavias, planteando como alternativa su colocación en venas yugulares o femorales • Evitar la colocación de CVC de inserción periférica (PICC, del inglés peripheric insertion central catheter) • Evitar en todo caso la punción de la vena cefálica del brazo y antebrazo no dominante |
AV: acceso vascular; CVC: catéter venoso central.
No existe evidencia científica de calidad para poder hacer una recomendación fundamentada en dicha evidencia. Por tanto, el GEMAV, basándose en los criterios de buena práctica clínica, tras someter a votación la recomendación, acordó por unanimidad formular una recomendación fuerte a favor de una estricta política de preservación del lecho vascular, dada la evidente relación existente entre la preservación de dicho lecho y la viabilidad del futuro AV.
R 1.1.3) Se recomienda que para facilitar la creación de la fístula arteriovenosa en los pacientes con enfermedad renal crónica avanzada se extreme la conservación de la red venosa superficial de ambas extremidades superiores, que deben preservarse libres de punciones y canulaciones. Para ello es preciso instruir al personal sanitario e informar al paciente
Dentro de la información que se proporcione sobre la técnica de HD se incluirá la referida al AV, la necesidad de su creación, su importancia, sus cuidados y sus complicaciones. Esta información se irá reforzando en consecutivas visitas de la consulta de ERCA y se deberá continuar cuando se realice el AV y durante el programa de HD17. Si un paciente requiere iniciar HD de forma aguda, se le ha de informar sobre la necesidad de un AV en el momento en el que se detecta esta situación. Esta información se irá completando en función de su evolución y necesidades.Momento para iniciar la información sobre el tratamiento sustitutivo renal
El inicio óptimo del TSR requiere una planificación adecuada. Existe un aumento del riesgo de mortalidad en relación con el inadecuado control nefrológico en la fase prediálisis y al uso de CVC como primer AV18. La ausencia de organización en esta fase provoca una mayor incidencia de inicio de HD por catéter con la morbilidad que lleva asociada. La remisión del paciente al nefrólogo con un tiempo prudencial implica que el paciente podrá recibir el tratamiento y la preparación adecuados de la fase prediálisis, así como la información sobre las diferentes técnicas de TSR: HD, diálisis peritoneal (DP) y trasplante renal. En el documento de consenso de la Sociedad Española de Nefrología para el manejo de la ERCA, la preparación del paciente para el TSR se plantea a partir del filtrado glomerular (FG) estimado (FGe) < 30ml/min/1,73 m2, en el caso de que proceda. En este momento, además de la información acerca de las diferentes técnicas de TSR, recibirá la relacionada con el AV19. Esta remisión adecuada se traduce en la menor incidencia de complicaciones, especialmente infecciosas y cardiovasculares.
El TSR se plantea cuando el FG < 15ml/min/1,73 m2 y, en general, seiniciadiálisiscon un FGedeentre 8 y 10ml/min/1,73 m2, siendo el límite alrededor de los 6ml/min/1,73 m219. La previsión del inicio de HD irá relacionada con la decisión de cuándo proporcionar al paciente la información necesaria de un modo detallado acerca de la preparación para el AV. Si bien hay que tener en cuenta que en la capacidad de predicción del nefrólogo del momento de inicio de la diálisis suele haber tendencia a infravalorar la función renal que mantiene el paciente, es decir, puede demorarse el inicio de HD en relación con el momento estimado20. Esta demora es más frecuente en pacientes de edad avanzada, fundamentalmente a partir de los 85 años. Se ha demostrado un número de procedimientos quirúrgicos innecesarios en este grupo de pacientes, al poder llegar a fallecer antes de entrar en diálisis21. De este modo, el FGe de modo aislado puede ser un criterio insuficiente para decidir el momento de la realización del AV.
La decisión de elegir el momento para proporcionar al paciente la información relacionada con la ERCA y las diferentes posibilidades de TSR hay que coordinarla con la realización del AV. La propia creación del AV puede condicionar la decisión hacia la elección de HD en detrimento de las otras técnicas, como la DP o incluso el manejo conservador. Una revisión sistemática acerca del momento de la toma de decisiones en el TSR de los pacientes y sus cuidadores22 demuestra que, desde la perspectiva del paciente, esperar a la fase final de la ERCA puede ser inadecuado de cara a la toma de decisiones. De ello se derivan consecuencias importantes, como la realización de un procedimiento quirúrgico que el paciente no desea o que el paciente vea cómo la decisión del tipo de TSR ya se ha tomado sin su participación. Una vez que la FAV se ha realizado, el paciente tiende a rechazar otro tipo de TSR, por la preferencia de mantener el statu quo, que explica que frecuentemente se continúe con el tipo de tratamiento inicial. Por ello, la información en relación con la creación del AV debe darse una vez el paciente haya sido informado de las diferentes opciones de TSR y haya elegido la HD22.Contenido y forma de proporcionar la información
En el momento de proporcionar la información al paciente acerca del AV hay que tener presente que desde su perspectiva, entre las principales preocupaciones, además de la enfermedad renal y de las opciones del TSR, se encuentra el AV23. Para el paciente que va a necesitar una FAV, vivir con ella supone un aspecto relevante, dada la dependencia que supone tener que proporcionar los cuidados necesarios para mantenerla. Al paciente le puede crear la sensación de vulnerabilidad, dependencia, desconfianza o incluso convertirse en un estigma. Por ello, a la hora de informar de la necesidad de un AV se ha de tener en cuenta la gran respuesta emocional que puede provocar24. De hecho, una de las mayores barreras a la creación de la FAV es el propio rechazo del paciente25.
Por todo ello, el nefrólogo ha de tener una especial sensibilidad en el proceso de informar al paciente. Hay estudios que destacan que el rechazo a la realización de una FAV puede estar en relación con una mala experiencia previa, así como que la información que reciben de otros pacientes y cuidadores puede no estar bien transmitida. A esto se une la posibilidad de que en el momento de recibir la información no sea asimilada de forma adecuada, dado que se incluye con toda la relacionada con el inicio de la diálisis. Paralelamente, es de destacar que no suelen ser conscientes del riesgo de mortalidad que lleva asociado la HD por CVC26. Los programas orientados a ayudar al paciente a elegir la técnica de TSR hacen que el paciente que opta por la HD la inicie con una probabilidad significativamente mayor por una FAV27. Esto se consigue motivando tanto al paciente como a la familia desde la fase de la creación hasta el cuidado posterior. Por otro lado, la participación de otros pacientes en la orientación de nuevos pacientes puede ser beneficiosa. Se ha demostrado que más pacientes con una FAV recomiendan este AV que los que utilizan el CVC tunelizado28.
Por último, en el momento de proporcionar la información al paciente de todo lo concerniente al AV, al igual que se informa de las distintas modalidades de TSR, el nefrólogo debe informar de los diferentes tipos de AV definitivo y sus características (FAVn, FAVp y CVC tunelizado). Se explicarán las ventajas e inconvenientes de cada uno de ellos, destacando que el CVC tunelizado no es un alternativa aceptable a la FAV, cuando esta es posible, dada su elevada asociación con morbilidad y mortalidad (apartado 6). Se explicarán sistemáticamente, de este modo, los riesgos del CVC tunelizado, dejando clara la indicación de este AV únicamente como temporal hasta la realización de una FAV o cuando esta no sea posible.Consideraciones eticolegales
En algunas revisiones de la bibliografía se plantea que al problema ético se puede llegar a añadir una evidente implicación legal, en el caso de sufrir complicaciones graves de un CVC tunelizado en el paciente que puede ser candidato a una FAV. En este contexto, al igual que el paciente firma el consentimiento informado previamente a la realización del procedimiento quirúrgico, algunos grupos sugieren que debería hacerlo previamente a la colocación de un CVC tunelizado, aceptando todos sus riesgos29.
1.2Cuándo realizar la fístula arteriovenosaRecomendaciones(•) nueva R 1.2.1) Se recomienda en los pacientes con enfermedad renal crónica progresiva considerar la creación del acceso vascular cuando el FGe < 15 ml/min/1,73 m2 y/o una estimación de entrada en diálisis en 6 meses
(•) nueva R.1.2.2) Se recomienda que la fístula arteriovenosa nativa se realice con una antelación previa al inicio de la hemodiálisis de 6 meses
(•) nueva R. 1.2.3) Se sugiere que la fístula arteriovenosa protésica esté realizada con una antelación previa al inicio de la hemodiálisis de entre 3 y 6 semanas
(•) nueva R.1.2.4) Se recomienda la realización de fístula arteriovenosa con carácter preferente en los pacientes con enfermedad renal crónica de rápida evolución, falta de maduración de la fístula arteriovenosa o portadores de catéter venoso central no tunelizado
→ Pregunta clínica II En los pacientes con enfermedad renal crónica, ¿cuáles son los parámetros demográficos, clínicos y analíticos para determinar el momento de creación de una fístula arteriovenosa, ya sea fístula arteriovenosa nativa o fístula arteriovenosa protésica?
(Ver ficha de la Pregunta clínica II en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| La derivación temprana al nefrólogo del paciente con ERCA para preparar el AV mejora la tasa de éxito en el inicio de HD por una FAV madura | Calidad muy baja |
| Se aconseja que la planificación de la realización de un AV sea determinado por el ritmo de disminución de la función renal del paciente a partir de ERCA grado 4: FGe < 30 ml/min/1,73 m2, ajustado según edad, sexo y superficie corporal, y sus posibles comorbilidades | |
| La indicación del inicio de diálisis se establece con valores de FG < 10 ml/min/1,73 m2 o mayor si hay otros factores que recomiendan un inicio más temprano | |
Para el paciente con ERCA tiene gran importancia poder disponer de un AV funcional en el momento de comenzar la HD, y evitar así la utilización de CVC y su comorbilidad asociada. Ello requiere una correcta planificación de su creación.
Para decidir el momento adecuado de crear un AV definitivo no existen ensayos clínicos al respecto, únicamente se encuentran estudios observacionales. Las guías clínicas basan sus recomendaciones en este tipo de estudios y opiniones de expertos, estableciendo rangos de deterioro de la función renal que indican el nivel de proximidad del inicio de HD. Enfatizan la importancia de utilizar estos parámetros analíticos ajustados en función de la edad, el sexo y la superficie corporal del paciente. En la revisión de la bibliografía se han identificado 6 GPC que evalúan cuál es el momento adecuado para la creación de un AV6,10,13–15,30.Recomendaciones de las guías de práctica clínica
La edición previa de la presente guía, así como las guías japonesas y canadienses, consideran la creación del AV cuando el FGe sea < 20ml/min/1,73 m2. Las guías KDOQI (Kidney Disease Outcomes Quality Initiative), las europeas y las británicas aconsejan la planificación del AV a partir de un FGe de 30ml/min/1,73 m2. Cuando se establece el tiempo mínimo aconsejable entre la creación y el inicio de diálisis, las españolas aconsejan entre 4 y 6 meses, las KDOQI y las europeas entre 2 y 3 meses, las británicas entre 3 meses y 1 año y las japonesas entre 2 y 4 semanas. Todas tienen en común valorar la mayor precocidad en la realización del AV en caso de ERCA de rápida evolución, fracaso del AV o portadores de CVC. Respecto a la FAVp, todas coinciden en que al estar su maduración alrededor de las 3 semanas, hay que usar esta fecha como límite de su realización. Y por último, en cuanto al CVC, el hecho de caracterizarse por su uso inmediato hace que no se requiera una preparación específica, salvo la relacionada con el propio procedimiento.Evidencia disponible
Tras las últimas revisiones de las guías clínicas sigue sin haber ensayos clínicos al respecto, únicamente se encuentran estudios observacionales. Estos resaltan la derivación temprana al nefrólogo como garantía de una información adecuada de los diversos aspectos del TSR y la posibilidad de que el paciente inicie HD por una FAV. Diferentes estudios observacionales en los últimos años presentan datos sobre la influencia e importancia que tiene el tiempo de derivación del paciente al nefrólogo o cirujano sobre el momento adecuado de la construcción del AV10,13–15,30.
Estos estudios observacionales muestran una relación entre el tiempo de control nefrológico previo al inicio de HD y una proporción significativamente mayor de FAV, que va desde los 431,32 a los 12 meses33,34, pasando por los 6 meses35,36.
Sin embargo, las últimas recomendaciones para iniciar el TSR se han ido modificando. Durante los últimos años, estos criterios han evolucionado desde unos valores de FGe más altos, > 15ml/min, a unos mucho más ajustados, aproximándose a los 5ml/min. Tras la publicación de varios ensayos clínicos que demostraron no solo la ausencia de beneficio, sino incluso mayor morbilidad con el inicio precoz de diálisis37–39, las guías KDIGO40 (Kidney Disease Improving Global Outcomes) sugieren que la HD debería iniciarse cuando comienzan a aparecer síntomas clínicos de IRC (insuficiencia renal crónica) terminal, es decir, con rangos de FGe entre los 5 y 10ml/min/1,73 m2. En el documento de consenso de la Sociedad Española de Nefrología para el manejo de la ERCA, el TSR se plantea cuando el FG < 15ml/min/1,73 m2, aunque pueda plantearse iniciarlo de forma más precoz ante la aparición de sintomatología urémica, hiperhidratación, hipertensión arterial de difícil control o empeoramiento del estado nutricional. En general, se inicia diálisis cuando el FG está situado entre 8 y 10ml/min/1,73 m2 y sería obligatorio con FGe < 6ml/min/1,73 m2, incluso ante la ausencia de clínica urémica19. Aunque en pacientes de riesgo, el planteamiento de un inicio precoz de HD se deberá realizar de modo individualizado.De la evidencia a la recomendación
Ante la ausencia de ensayos clínicos que aborden los criterios asociados al momento indicado para la creación del AV, de estudios observacionales respecto al momento de dicha creación y de ensayos clínicos respecto a la recomendación del inicio de diálisis, el GEMAV sometió a votación esta recomendación. Se creyó conveniente plantear 2 opciones. Para la opción < 15ml/min y/o estimación de entrada a 6 meses hubo 15, para la opción < 20ml/min y/o estimación de entrada a 6 meses 2 a favor y 3 abstenciones. Por lo que, teniendo en cuenta la mayoría de tres cuartos favorable a una de las opciones, el grupo de trabajo decidió formular como recomendación fuerte que el momento en que se debe solicitar la creación del AV definitivo viene determinado por una tasa de FGe ≤ 15ml/min, o una estimación de inicio de diálisis inferior a los 6 meses.
Los pacientes con una ERC de rápida evolución, con una FAV realizada pero sin una maduración adecuada o portadores de un CVC no tunelizado se deben contemplar como pacientes tributarios de ser atendidos de modo preferente.
Respecto a las FAVp, dado que requieren un período de maduración antes de la punción de entre 3 y 6 semanas (excepto en las de punción inmediata), se sugiere este período como el estimado para realizar su creación previamente al inicio previsto de HD (apartado 3).
R 1.2.1) Se recomienda en los pacientes con enfermedad renal crónica progresiva considerar la creación del acceso vascular cuando el FGe < 15 ml/min/1,73 m2 y/o una estimación de entrada en diálisis en 6 meses
R.1.2.2) Se recomienda que la fístula arteriovenosa nativa se realice con una antelación previa al inicio de la hemodiálisis de 6 meses
R.1.2.3) Se sugiere que la fístula arteriovenosa protésica se realice con una antelación previa al inicio de la hemodiálisis de entre 3 y 6 semanas
R.1.2.4) Se recomienda la realización del fístula arteriovenosa con carácter preferente en los pacientes con enfermedad renal crónica de rápida evolución, falta de maduración de la fístula arteriovenosa o portadores de catéter venoso central no tunelizado
(•) nueva R 1.3.1) En la planificación del acceso vascular se sugiere no decidir teniendo en cuenta aisladamente ningún factor clínico o sociodemográfico, ni ningún modelo de predicción de riesgo. Se recomienda que la decisión se base en una evaluación global de la historia clínica, del examen físico vascular y de la ecografía preoperatoria de cada paciente y en sus preferencias individuales
R 1.3.2) Durante la exploración física arterial se recomienda la valoración de pulsos periféricos, el test de Allen y la toma de presión arterial humeral. Durante la exploración física venosa se recomienda identificar la presencia de una vena candidata visible después de la colocación de un torniquete, con trayecto superficial en tejido subcutáneo y ausencia de tortuosidades importantes
(•) nueva R 1.3.3) Se recomienda realizar un mapeo vascular ecográfico preoperatorio de forma rutinaria antes de la realización del acceso vascular, el cual debe evaluar el diámetro y la calidad de la pared arterial y la anatomía y la permeabilidad del sistema venoso profundo y superficial de la extremidad
(•) nueva R 1.3.4) En pacientes de alto riesgo de isquemia (diabéticos, edad > 60 años, presencia de arteriopatía periférica, sexo femenino) se sugiere la priorización de fístulas arteriovenosas distales y de anastomosis lateroterminales, evitando las anastomosis de gran tamaño (> 7mm). En estos pacientes se recomienda una estrecha monitorización clínica para poder detectar precozmente la presencia de signos de isquemia
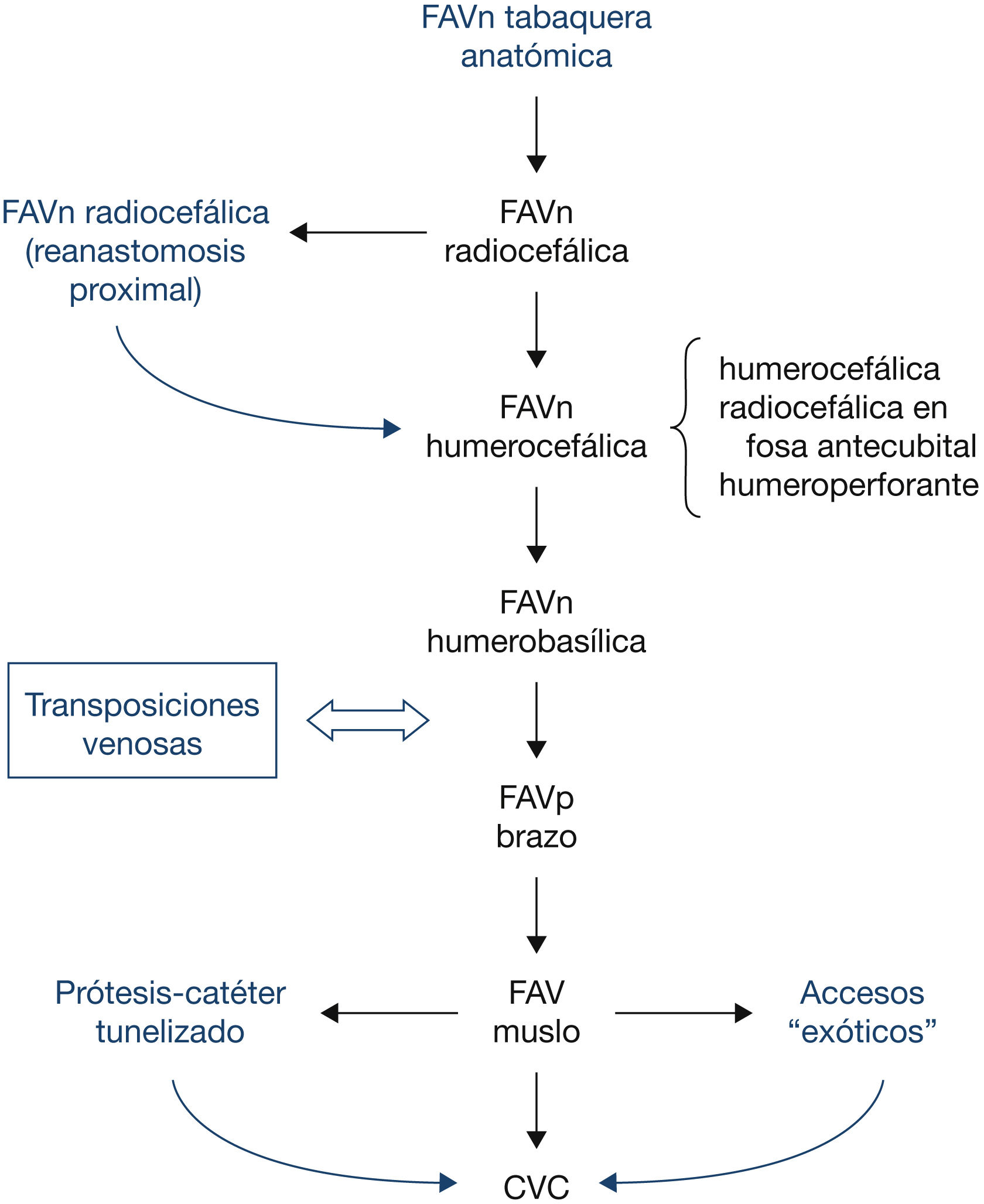
Un factor importante a tener en cuenta para elegir la localización óptima del AV a realizar es la influencia que este tendrá sobre accesos posteriores. El cirujano ha de planificar una estrategia a largo plazo considerando las posibles alternativas sucesivas a utilizar. Pese a que no se han publicado ensayos clínicos aleatorizados (ECA) sobre el orden a seguir en la realización del acceso, en la actualidad hay un amplio consenso entre la mayoría de los grupos10,23,24 en que la localización del acceso en la extremidad sea tan distal como sea posible, para no limitar la realización de futuros accesos en la misma, usando preferiblemente la extremidad no dominante, por criterios de comodidad del paciente. Asimismo, se recomienda la creación de una FAVn con preferencia a la FAVp, si bien las condiciones individuales pueden aconsejar otra actitud.
En la evaluación del paciente será necesario realizar una cuidadosa historia clínica en la que se identifiquen los factores de riesgo de fracaso inicial y de falta de maduración de la FAVn; así como una exploración física que valore la existencia de limitaciones articulares, déficits motores o sensitivos, grosor de la piel y grasa subcutánea, edema de la extremidad, existencia de circulación colateral en brazo u hombro, y cicatrices o trayectos venosos indurados.
La exploración física debe incluir la palpación de pulsos señalando la existencia y calidad de estos, incluyendo la maniobra o test de Allen, la toma de presiones arteriales en ambas extremidades superiores y la exploración del sistema venoso mediante la palpación venosa con y sin torniquete41 (tabla 5).
Criterios clínicos necesarios en la exploración física para la realización de una fístula arteriovenosa6
| Exploración venosa |
| Vena cefalica visible tras la colocacion de un torniquete |
| Trayecto venoso superficial visible y/o palpable en tejido subcutaneo |
| Ausencia de tortuosidad significativa |
| Exploración arterial |
| Pulso radial facilmente palpable |
| Permeabilidad del arco palmar (test de Allen) |
| Ausencia de una diferencia de PAS > 15 mmHg entre extremidades superiores |
PAS: presion arterial sistolica.
La realización de exploraciones complementarias deberá plantearse como ayuda necesaria e imprescindible para definir la estrategia a seguir en el orden de realización del AV.
→ Pregunta clínica III ¿Qué criterios se requieren para planificar la fístula arteriovenosa (en función de diferentes tipos de fístula)?
(Ver ficha de la Pregunta clínica III en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Un metaanálisis de 3 ECA con 402 pacientes, como se muestra más adelante, encuentra una diferencia no estadísticamente significativa en cuanto a conseguir el éxito de la fístula para HD en los pacientes que habían sido estudiados con mapeo ecográfico además de la exploración física | Calidad baja |
| En la planificación del AV, la evidencia proveniente de series clínicas no es concluyente como para poder recomendar que se tengan en cuenta factores clínicos o sociodemográficos aislados, ni modelos multivariantes concretos de predicción de probabilidad de éxito del AV | Calidad baja |
Desde su incorporación a la práctica clínica diaria ha habido distintas publicaciones que han intentado evaluar la utilidad de la ecografía Doppler (ED) en la valoración preoperatoria de los pacientes candidatos a la realización del AV.
Ferring et al42, en una revisión, concluyen que para evaluar un lugar adecuado para la cirugía de la FAV se debe utilizar inicialmente el examen físico en todos los pacientes y reservar la ED preoperatoria para determinados casos: pacientes con examen clínico insuficiente (obesos, ausencia de pulsos, cirugías múltiples anteriores en la extremidad), pacientes con posible enfermedad arterial (edad avanzada, diabetes, enfermedades cardiovasculares) o pacientes con posible enfermedad venosa (canalización previa).
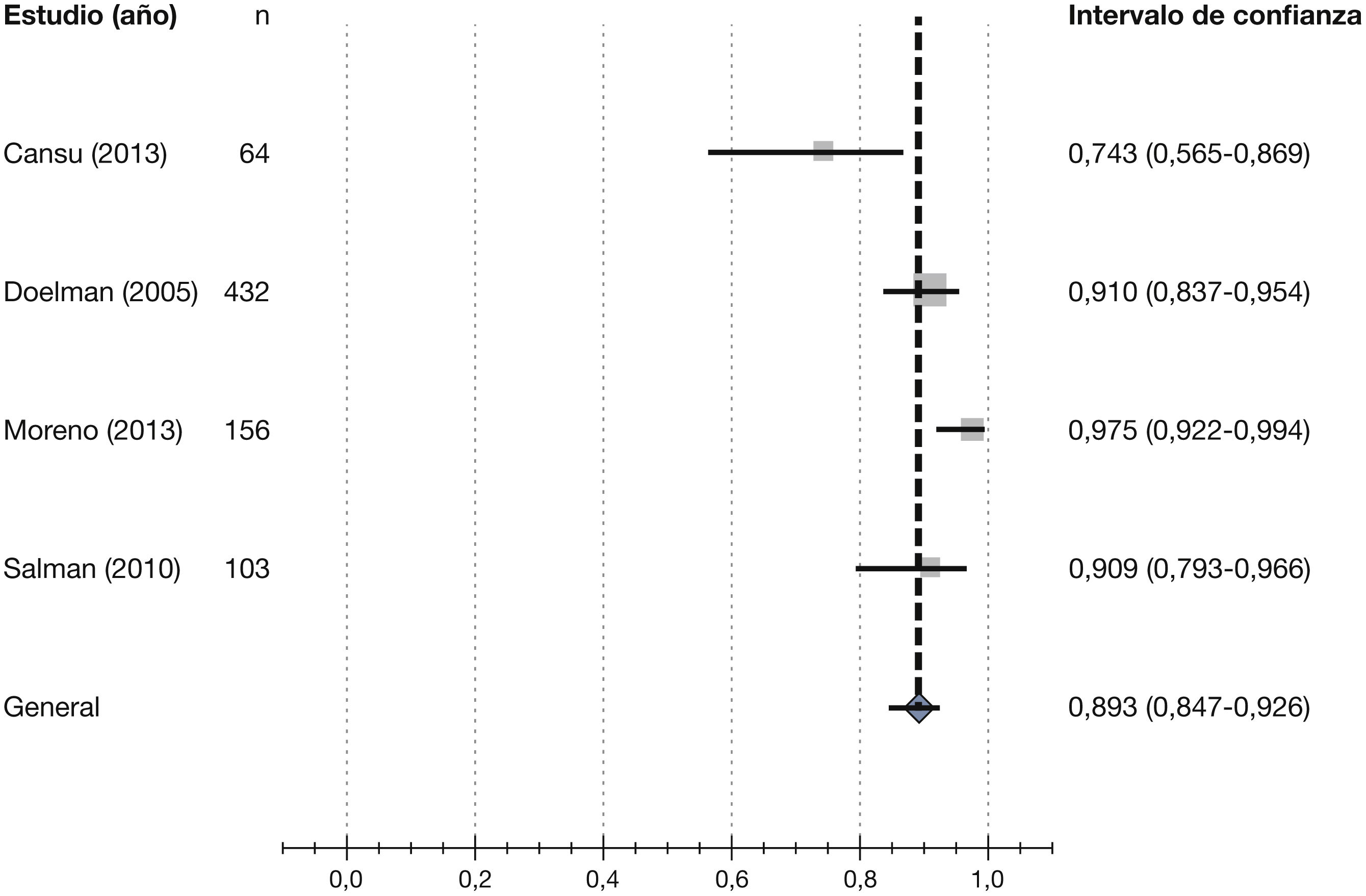
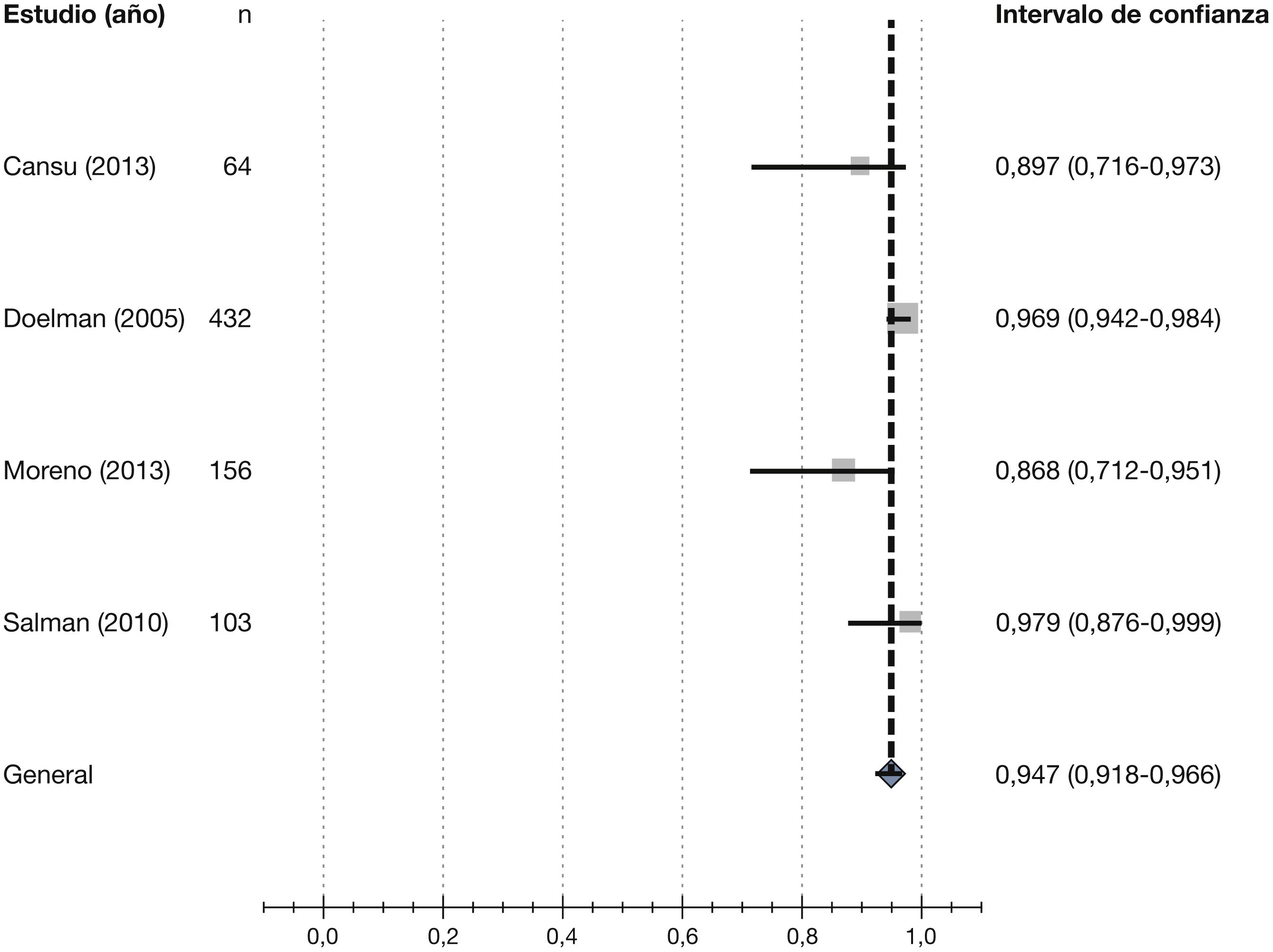
Posteriormente, Wong et al43 publican una revisión sistemática de la literatura, basada en los 3 ECA publicados hasta la fecha sobre el uso del mapeo ecográfico preoperatorio realizado de forma sistemática44–46, y en 2 de ellos encuentran un beneficio significativo de la ED preoperatoria usada sistemáticamente, mientras que en el tercero no se demostró beneficio en términos de uso efectivo del acceso para realizar HD. Los autores concluyen que la revisión sugiere resultados positivos en los pacientes a los que se les realizó mapeo ecográfico previo a la creación del AV, lo que podría llevar a mejores tasas de permeabilidad a largo plazo.
Además de las revisiones evaluadas en el desarrollo de las recomendaciones en este apartado, recientemente han aparecido otras revisiones sistemáticas con resultados discrepantes. Aunque un metaanálisis de 5 ensayos clínicos sugiere un beneficio del uso de la ED de forma rutinaria en la exploración preoperatoria47, al igual que la revisión evaluada de Wong et al43, una revisión sistemática Cochrane48 destaca que la evaluación por imagen preoperatoria no mejora los resultados de la FAV y que se requieren nuevos estudios con un mejor diseño para confirmar los resultados.1.3.2. Diámetro del vaso como criterio para planificar la fístula arteriovenosa
Distintos estudios publicados han intentado delimitar los parámetros ecográficos implicados en el pronóstico de la futura FAV16,42,49–51 y se ha llegado a demostrar cierto grado de correlación en los siguientes: diámetro de la arteria, presencia de arteriosclerosis (medida de la relación de grosor entre íntima y media), características del flujo a nivel de la arteria (medición del índice de resistencia tras hiperemia reactiva, velocidad de pico sistólico), diámetro de la vena y distensibilidad venosa52.
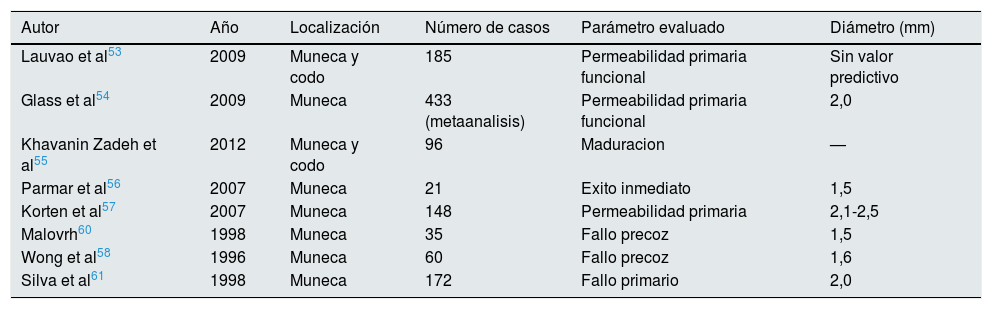
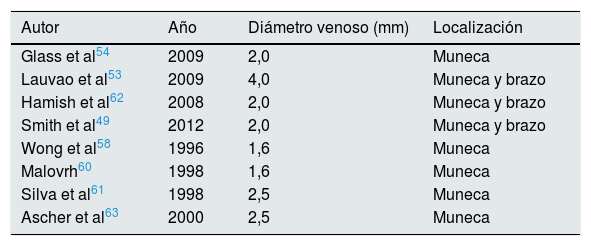
De todos ellos, el más ampliamente documentado y en el que se ha hallado mayor nivel de evidencia ha sido el diámetro vascular interno, tanto a nivel de la arteria como de la vena, medido mediante ecografía53–59.
Distintos artículos han publicado series intentando documentar el diámetro mínimo, tanto de la arteria como de la vena, que se relaciona con un buen pronóstico de la FAV (tablas 6 y 7)49,53–58,60–63.1.3.3. Comorbilidad del paciente como criterio para planificar la fístula arteriovenosa
Diámetro arterial mínimo y pronóstico de la fístula arteriovenosa
| Autor | Año | Localización | Número de casos | Parámetro evaluado | Diámetro (mm) |
|---|---|---|---|---|---|
| Lauvao et al53 | 2009 | Muneca y codo | 185 | Permeabilidad primaria funcional | Sin valor predictivo |
| Glass et al54 | 2009 | Muneca | 433 (metaanalisis) | Permeabilidad primaria funcional | 2,0 |
| Khavanin Zadeh et al55 | 2012 | Muneca y codo | 96 | Maduracion | — |
| Parmar et al56 | 2007 | Muneca | 21 | Exito inmediato | 1,5 |
| Korten et al57 | 2007 | Muneca | 148 | Permeabilidad primaria | 2,1-2,5 |
| Malovrh60 | 1998 | Muneca | 35 | Fallo precoz | 1,5 |
| Wong et al58 | 1996 | Muneca | 60 | Fallo precoz | 1,6 |
| Silva et al61 | 1998 | Muneca | 172 | Fallo primario | 2,0 |
Diámetro venoso mínimo y pronóstico de la fístula arteriovenosa
| Autor | Año | Diámetro venoso (mm) | Localización |
|---|---|---|---|
| Glass et al54 | 2009 | 2,0 | Muneca |
| Lauvao et al53 | 2009 | 4,0 | Muneca y brazo |
| Hamish et al62 | 2008 | 2,0 | Muneca y brazo |
| Smith et al49 | 2012 | 2,0 | Muneca y brazo |
| Wong et al58 | 1996 | 1,6 | Muneca |
| Malovrh60 | 1998 | 1,6 | Muneca |
| Silva et al61 | 1998 | 2,5 | Muneca |
| Ascher et al63 | 2000 | 2,5 | Muneca |
Existe importante evidencia acerca de la influencia de la patología de base, las comorbilidades y los parámetros propios del paciente en el pronóstico del AV a realizar42,49,59.Edad avanzada
La evidencia disponible en la actualidad sugiere un marcado peor pronóstico en el AV en los pacientes de mayor edad64. Estos autores sugieren evitar las FAV distales en paciente de edad avanzada.Sexo femenino
Frente a la opinión generalizada, y de lo publicado por algunos autores65, la mejor evidencia disponible no demuestra que el sexo femenino sea un factor de riesgo en el pronóstico de la FAV66; se atribuye al menor calibre de los vasos los peores resultados hallados en las pacientes de sexo femenino.Diabetes
Distintas series prospectivas demuestran el efecto negativo de la presencia de diabetes en el pronóstico de la FAV, de menor repercusión en las FAV proximales67,68.Hipotensión
La evidencia proveniente de series prospectivas sugiere un efecto negativo de la hipotensión mantenida en el pronóstico de la FAV, en forma de un mayor riesgo de trombosis del acceso69,70.Tabaquismo
La presencia de tabaquismo se ha asociado a un peor pronóstico de la FAV en las series prospectivas publicadas71–73.Obesidad
Si bien no se ha conseguido demostrar un peor pronóstico en pacientes obesos con índice de masa corporal (IMC) > 30, la evidencia disponible sí que sugiere la obesidad con IMC > 35 como factor de riesgo en el pronóstico de la FAV74.Otros factores
Diversos estudios publicados han intentado determinar la influencia de otros factores en el pronóstico del acceso. Estos factores se consideran como de menor influencia, bien sea por la falta de evidencia clínica (uso de heparina sistémica durante la cirugía, tipo de anastomosis, técnica de sutura), bien porque pese a haber demostrado su trascendencia en estudios limitados faltan ulteriores estudios que demuestren su utilidad en la práctica clínica (dosis de heparina intraoperatoria, uso de nitratos transdérmicos, amplitud de distribución de hematíes)42,49,59,75–77.1.3.4. Modelos/reglas de predicción del fracaso de la fístula arteriovenosa
Lok et al78, basándose en datos de 422 pacientes, desarrollaron una regla de predicción de riesgo de fracaso de la FAV, encontraron que los factores de mal pronóstico son la edad ≥ 65 años, la enfermedad vascular periférica y la enfermedad coronaria, en tanto que la raza blanca era un factor de buen pronóstico; a partir de ello realizan una estratificación de riesgo de fallo de la FAV.
Pese a la buena capacidad de predicción mostrada en dicho estudio, no ha habido series posteriores que confirmen su utilidad clínica y, de hecho, se han publicado otros estudios que la ponen en duda79.1.3.5. Factores determinantes del éxito de una fístula arteriovenosa protésica
La evidencia proviene del artículo publicado por Rosas et al80, donde hallaron como factores de mal pronóstico la presencia de claudicación intermitente, el número de injertos implantados previamente, la dependencia de diálisis en el momento de la cirugía y el uso de clamps (pinzas oclusoras) vasculares durante la intervención; en cambio describen como factores de buen pronóstico el uso de la arteria humeral y de la vena axilar, el uso de anastomosis en ángulo agudo y la utilización de FAVp de una determinada marca comercial (Gore-Tex®).De la evidencia a la recomendación
La introducción de la ED portátil en la exploración preoperatoria de los pacientes candidatos a una FAV ha supuesto una indudable ayuda para el clínico a la hora de plantear la realización del AV.
La posibilidad de disponer de una prueba de imagen fiable de los vasos en el mismo momento de la visita preoperatoria, junto a la información hemodinámica que aporta, la han convertido en una herramienta imprescindible en las unidades que tienen disponibilidad de ella.
El progresivo aumento en la edad de los pacientes candidatos a FAV, con el consiguiente incremento de las comorbilidades asociadas, así como la gran prevalencia de pacientes con distintos grados de obesidad, condicionan que la exploración física en estos pacientes sea a menudo incompleta y no permita llegar a determinar los criterios imprescindibles requeridos para la realización de la FAV (tabla 5). En estos casos, tanto en la práctica clínica como en la evidencia disponible, hay unanimidad en la indicación de la ED como prueba de imagen de elección, por delante de otras exploraciones radiológicas (flebografía, resonancia magnética)16,42,81,82.
En los casos en los que la exploración física es favorable es donde no hay unanimidad en la bibliografía existente. Si bien hay series documentadas en las que la ecografía preoperatoria rutinaria aumenta la supervivencia del AV10,44,46,47,49,65,83, en la mayoría de dichas series el beneficio no alcanza el grado de significación necesaria como para poder recomendarse su uso de forma sistemática42,43,45. De hecho, estos autores no recomiendan su uso rutinario porque no se ha demostrado beneficio, tanto por el retraso que puede provocar la realización de más exploraciones como por la posibilidad de descartar FAV con vasos de diámetro límite. Por contra, entre las razones argumentadas a favor de su uso sistemático están la disminución de intervenciones quirúrgicas innecesarias debido al escaso calibre de los vasos, el evitar realizar FAV con mal drenaje venoso, la detección de patología arterial subclínica y la mejor utilización del lecho vascular disponible.
Este último punto, junto a la tendencia descrita en la bibliografía, es el principal argumento por el que el GEMAV ha decidido, por unanimidad, recomendar el uso sistemático de la ED en la exploración preoperatoria de todo paciente candidato a FAV, ya que permite realizar, de forma incruenta y durante la visita preoperatoria, un mapa completo del capital venoso del paciente, así se puede planificar de forma racional la localización del AV en función de las alternativas reales de futuros accesos.
Durante dicha exploración se deberá evaluar el diámetro y la calidad de la pared arterial y la anatomía y la permeabilidad del sistema venoso profundo y superficial de la extremidad, mediante la realización de un mapa del mencionado capital venoso del paciente16,42,52,81,82,84.
La actual evidencia no permite realizar una recomendación sobre el diámetro mínimo de los vasos utilizados para la FAV; la decisión de considerar una arteria o una vena como aptas para la realización de la FAV se debe tomar en función de su diámetro, considerando el mejor pronóstico de los vasos de mayor calibre, y de las alternativas de AV disponibles. En todo caso, las arterias inferiores a 1,5mm y las venas de diámetro < 1,6mm tras la colocación de un manguito proximal, se consideran de dudosa viabilidad, de acuerdo con las series publicadas.
Por último, aunque se deben tener en cuenta los factores pronósticos presentes en cada caso, se sugiere no decidir la localización del AV teniendo en cuenta ningún factor clínico o sociodemográfico aislado, ni ningún modelo multivariante concreto de predicción de riesgo, y se recomienda que la decisión se base en una evaluación global de la historia clínica, del examen físico vascular y de la ED preoperatoria de cada paciente y en sus preferencias individuales.
R 1.3.1) En la planificación del acceso vascular se sugiere no decidir teniendo en cuenta aisladamente ningún factor clínico o sociodemográfico, ni ningún modelo de predicción de riesgo. Se recomienda que la decisión se base en una evaluación global de la historia clínica, del examen físico vascular y de la ecografía preoperatoria de cada paciente y en sus preferencias individuales
R 1.3.3) Se recomienda realizar un mapeo vascular ecográfico preoperatorio de forma rutinaria antes de la realización del acceso vascular, en el que se debe evaluar el diámetro y la calidad de la pared arterial, y la anatomía y la permeabilidad del sistema venoso profundo y superficial de la extremidad
→ Pregunta clínica IV ¿Qué factores de riesgo se ha demostrado que pueden influir en el desarrollo de isquemia de la extremidad tras realizar la fístula arteriovenosa?
(Ver ficha de la Pregunta clínica IV en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| No se han encontrado en la evidencia revisiones sistemáticas ni ECA. La evidencia se basa en GPC y estudios observacionales prospectivos y retrospectivos | |
| En el estudio de Rocha et al85 en una población en su gran mayoría de ancianos, la asociación entre el síndrome de robo y la presencia de enfermedad arterial coronaria y enfermedad vascular periférica no fue evidente. El sexo femenino se asoció con mayor riesgo de isquemia. Sin embargo se trata de 2 comorbilidades significativamente asociadas con la diabetes que sí fue un predictor independiente del síndrome de robo. La diabetes representa el principal factor de riesgo para el síndrome de isquemia asociado a AV. La edad, el tipo de FAV, la duración de la terapia de reemplazo renal y los factores implicados en el daño endotelial no se asociaron significativamente con el síndrome de robo. Los resultados ponen de relieve la necesidad de una estrecha vigilancia de las FAV, sobre todo en las mujeres y los diabéticos, y se recomienda el uso preferente de anastomosis terminolateral en la técnica quirúrgica | Calidad baja |
La creación de una FAV a nivel de la extremidad superior condiciona cambios drásticos en la hemodinámica de dicha extremidad. La comunicación directa creada entre los sistemas arterial y venoso, que evita el paso por el lecho capilar, provoca un shunt de un gran volumen de flujo entre ambos sistemas, lo que puede comprometer la vascularización del lecho arterial distal al acceso. Asimismo, en muchos casos se añade el efecto negativo de la presencia de patología arterial previa presente en los territorios proximal o distal, agravando la situación de isquemia efectiva en la extremidad.
Todo ello puede provocar el desarrollo de un síndrome isquémico de hipoperfusión distal en la extremidad, conocido como “robo de fístula”; este cuadro es una complicación poco frecuente tras la realización del acceso, con una incidencia que varía entre el 1 y el 20%85-87b, pero que puede tener graves consecuencias, y puede derivar en una pérdida tisular importante y amputación.
Es por ello que diversos autores han intentado determinar los distintos factores epidemiológicos y clínicos que puedan estar asociados al desarrollo de dicho cuadro, para poder detectar los pacientes en riesgo de presentar isquemia tras la realización del AV.Tipo de fístula arteriovenosa
El factor pronóstico principal aceptado por todos los autores es el tipo de AV10,85–89. Los accesos con mayor riesgo de isquemia son las FAVn realizadas sobre la arteria humeral (humerocefálica, humerobasílica y humeroperforante) y el 10-25% de los pacientes con dichos AV presenta isquemia clínicamente relevante. Este porcentaje disminuye hasta el 4,36% en las FAVp, mientras que las FAVn realizadas en antebrazo y muñeca son las que presentan menor riesgo de isquemia (1-1,8%)87. Dichos autores asocian esta variabilidad al hecho del mayor flujo presente en las FAV proximales y a la presencia de circulación colateral a través de arteria cubital, que disminuye la gravedad de la isquemia en las FAV a nivel de muñeca y antebrazo.Enfermedad arterial periférica
La gran prevalencia de factores de riesgo cardiovascular en la población en HD comporta una alta incidencia de pacientes con enfermedad arterial periférica sintomática. Pese a que la afectación de dicha enfermedad en las extremidades superiores suele ser menor a la de otros territorios, se ha descrito la presencia de lesiones hemodinámicamente significativas hasta en un 62-100% de pacientes con síndrome de hipoperfusión distal86. La existencia previa de dichas lesiones, tanto en el territorio arterial proximal como en troncos distales, es un importante factor predisponente a la aparición de síntomas isquémicos en la extremidad tras la realización del AV86–88,90.Diabetes mellitus
La presencia de DM se considera por todos los autores uno de los principales factores de riesgo de desarrollar clínica isquémica86–88,90,91. Asimismo, es factor predictivo de desarrollo de isquemia en los estudios observacionales publicados85,92. La afectación del territorio arterial distal que provoca condiciona la falta de capacidad de vasodilatación de dicho territorio y la aparición de hipoperfusión tisular distal.Edad avanzada
La edad avanzada, considerada como pacientes > 60 años, se considera ampliamente como factor predisponente en la aparición de isquemia, por un mecanismo similar al presente en los pacientes diabéticos87,88,90,91.Sexo femenino
Existe unanimidad entre la bibliografía publicada en considerar el sexo femenino como factor de riesgo aislado de presentar isquemia85,87,88,90,91. Dichos autores no determinan los mecanismos implicados, aunque se sugieren factores hormonales y de calibre vascular.Otros factores
Distintas publicaciones describen la influencia de otros factores en el desarrollo de la isquemia, como el tiempo en HD73, las anastomosis laterolaterales85, los AV previos en la misma extremidad87,88,90 o factores raciales92. En estos casos, sin embargo, su posible influencia no se acepta unánimemente.
Con respecto a la vena de drenaje en las FAVn de codo, la comparación directa entre FAVn humerocefálicas y FAVn humerobasílicas no ha demostrado diferencia en cuanto a incidencia de isquemia85.
Por último, pese a la evidente relación entre la cantidad de flujo derivado al AV y el desarrollo de isquemia, no se ha conseguido demostrar una relación directa entre ambos, debido probablemente a la intervención de otros factores en la fisiopatología del cuadro; pese a lo cual, algunos autores recomiendan la realización de anastomosis < 7mm para poder limitar el caudal derivado hacia el AV87.De la evidencia a la recomendación
La ausencia de revisiones sistemáticas o ensayos clínicos sobre este tema limita el grado de evidencia disponible a las series observacionales publicadas y a la opinión de expertos plasmada en las distintas guías clínicas.
Si bien hay factores de riesgo de isquemia bien definidos, cuya influencia es unánimemente considerada (tipo de acceso, enfermedad arterial periférica, DM, edad avanzada y sexo femenino), hay otros factores cuyo papel no está bien definido.
Asimismo, en la bibliografía tampoco se pueden hallar propuestas sobre la actitud a seguir en la práctica clínica ante la presencia de estos factores, que son de una gran prevalencia en los pacientes en HD.
Así pues, únicamente cabe destacar un amplio consenso entre autores en la necesidad de una estrecha monitorización en el postoperatorio de los pacientes considerados de riesgo (diabéticos, edad > 60 años, presencia de arteriopatía periférica, sexo femenino), para poder detectar y tratar precozmente la isquemia y así poder tratar el cuadro, evitando sus graves consecuencias, así como priorizar en estos pacientes la creación de accesos distales sobre los basados en la arteria humeral10,85–88,92.
Por todo ello, pese a la ausencia de revisiones sistemáticas o ensayos clínicos sobre el tema, y sobre la base de los estudios publicados, a la opinión de expertos antes citada y al criterio de buena práctica clínica, el GEMAV sugiere, en primer lugar, promover las técnicas quirúrgicas destinadas a minimizar el riesgo de isquemia y, en segundo lugar, recomienda asimismo un estrecho seguimiento clínico de los pacientes considerados de riesgo tras la realización del AV, con el objetivo de evitar la aparición de complicaciones irreversibles.
R 1.3.4) En pacientes de alto riesgo de isquemia (diabéticos, edad > 60 años, presencia de arteriopatía periférica, sexo femenino) se sugiere la priorización de fístulas arteriovenosas distales y de anastomosis lateroterminales, evitando las anastomosis de gran tamaño (> 7 mm). En estos pacientes se recomienda una estrecha monitorización clínica, para poder detectar precozmente la presencia de signos de isquemia
CONTENIDO
2.1. Tipos de fístula arteriovenosa
2.2. Fístula arteriovenosa nativa
2.3. Fístula arteriovenosa protésica
2.4. Técnicas de recurso
2.5. Orden en la creación del acceso vascular
2.6. Profilaxis antibiótica en la creación de la fístula arteriovenosaPreámbulo
La misión del equipo multidisciplinar en el paciente en programa de hemodiálisis (HD) ha de ser conseguir una fístula arteriovenosa (FAV), a ser posible nativa, con la máxima supervivencia y las menores complicaciones. Para ello han de establecerse las estrategias necesarias para que el paciente con enfermedad renal crónica avanzada (ERCA) inicie diálisis con una FAV madura y que las FAV posteriores, en caso de requerirse, se hagan de un modo planificado con la participación de todos los profesionales implicados y del propio paciente.
2.1Tipos de fístula arteriovenosaRecomendacionesR 2.1.1) Se recomienda que el acceso vascular a considerar como primera opción sea la fístula arteriovenosa nativa
R 2.1.2) En el caso de que no existan venas adecuadas que permitan realizar una fístula arteriovenosa nativa se recomienda realizar una fístula arteriovenosa protésica
R 2.1.3) Se recomienda la implantación de un catéter venoso central tunelizado cuando no sea viable la realización de una fístula arteriovenosa nativa ni protésica, o cuando sea preciso iniciar el tratamiento con hemodiálisis sin disponer de un acceso vascular definitivo maduro
R 2.1.4) Aunque la fístula arteriovenosa nativa es la primera opción de acceso vascular, el acceso vascular adecuado y su localización en un paciente determinado debe individualizarse según las características clínicas del mismo y el resultado del mapa vascular
La priorización de la FAV nativa (FAVn) frente a la FAV protésica (FAVp) es una recomendación fundamental en numerosas guías clínicas y opiniones de expertos, dada la baja tasa de complicaciones y la excelente permeabilidad a largo plazo una vez que la FAVn ha madurado.Permeabilidad de la fístula arteriovenosa
Las FAVn presentan una permeabilidad primaria a los 6 y 18 meses del 72 y el 51% y una permeabilidad secundaria del 86 y el 77%, respectivamente, mientras que en las FAVp la permeabilidad primaria a los 6 y 18 meses es del 58 y el 33% y la secundaria, del 76 y el 55%, respectivamente93. La principal desventaja de la FAVn con respecto a la FAVp reside en su alto riesgo de fallo primario, debido tanto a la alta tasa de trombosis inmediata (5-30% para las FAVn radiocefálicas) como al fracaso en la maduración (28-53%), frente a solo un 0-13% de fallo primario para las FAVp en antebrazo y 0-3% para las FAVp en brazo8.
Asimismo, el cambio demográfico que se ha ido produciendo en los últimos años en el paciente incidente que inicia tratamiento sustitutivo renal (TSR) hace que se describa en la bibliografía una tendencia progresiva a la disminución en las tasas de permeabilidad reportadas94. De esta forma, AlJaishi et al94, analizando los resultados de 46 artículos entre los años 2000 y 2012, estiman una tasa de fallo primario para las FAVn del 23% —significativamente mayor en las FAVn distales (28%) que en las proximales (20%)—, hallando una permeabilidad primaria (incluyendo los fallos primarios) del 60% al año y del 51% a los 2 años, con una diferencia significativa según la localización de la FAVn (distal o proximal) al año, pero no a los 2 años. Estos mismos autores encontraron una tasa de permeabilidad secundaria del 71% al año y del 64% a los 2 años, sin diferencias en cuanto a la localización de la FAVn94. Se ha descrito, asimismo, que el uso rutinario de un estudio ecográfico preoperatorio podría disminuir los fracasos inmediatos de la FAVn46.Tasa de complicaciones
Las FAVn se asocian a una menor morbilidad y mortalidad con respecto a las FAVp y con los CVC95. Según Ravani et al96, el uso de FAVp y CVC frente a FAVn se asocia a un incremento en la mortalidad del 18 y el 53%, respectivamente. Además, las FAVn presentan una menor tasa de infecciones que las FAVp, y estas, menor que los CVC96,97.
Como resultado de todo ello, en comparación con las FAVn, el riesgo de hospitalización aumenta un 26% con las FAVp y un 68% con los CVC96.
Otra ventaja de las FAVn es que presentan una menor tasa de reintervenciones que las FAVp, lo que conlleva un mantenimiento con menor coste económico98.
Así pues, en todo paciente que requiera TSR mediante HD, hay que buscar la creación del AV ideal, que será aquel que permita una diálisis adecuada, con mayor permeabilidad y menor tasa de complicaciones. El AV que reúne todas esas características es la FAVn10,99–102 y, por tanto, debe ser el primer AV a considerar. Cuando no exista posibilidad de realizar una FAVn por ausencia o desgaste del capital venoso periférico, deben utilizarse FAVp99–101, mientras que la implantación de un CVC ha de considerarse únicamente cuando no sea posible realizar ninguna de las anteriores o cuando sea preciso iniciar el tratamiento con HD sin disponer de un AV maduro103,104.
La indicación de un determinado tipo de AV permanente debe ser individualizada, en función de la exploración vascular y los AV previos del paciente, así como de otros factores como la edad, la comorbilidad y la urgencia en la utilización del AV10,82,99–101,105–108.
2.2Fístula arteriovenosa nativaDentro de las FAVn, con el fin de preservar el máximo de la red venosa periférica para futuros AV del paciente, a la hora de planificar un AV hay que considerar como primera opción la localización más distal posible. A igualdad de condiciones, se debe priorizar la extremidad no dominante, por comodidad del paciente tanto durante las sesiones de HD como en su actividad diaria109.2.2.1. Fístula arteriovenosa nativa de muñeca y antebrazoFístula arteriovenosa radiocefálica en muñeca (fístula arteriovenosa de Brescia-Cimino)
La FAV radiocefálica en la muñeca, descrita por BresciaCimino en 1966, sigue constituyendo el patrón de referencia de los AV para HD10,110,111, ya que preserva capital venoso proximal para futuros AV, tiene una baja tasa de complicaciones, especialmente de isquemia inducida por AV e infecciones, y las que maduran correctamente presentan una excelente tasa de permeabilidad99–101,109. La mayor limitación de esta técnica es la tasa relativamente alta de fallo inmediato, que oscila entre el 10 y el 30%, y en algunos grupos llega casi al 50%, especialmente en diabéticos, ancianos y mujeres100,112,113. Otra desventaja de las FAV radiocefálicas es su alta incidencia de fallo en la maduración, de manera que aproximadamente el 30% de estas FAV no han madurado lo suficiente a los 3 meses como para ser utilizadas100,102,105. La permeabilidad primaria a los 6 meses oscila entre el 65 y el 81%, que resulta inferior al 79-89% de las FAVp, aunque se igualan a partir del primer año, con menos complicaciones100,101.Fístula arteriovenosa en la tabaquera anatómica
La FAV en la tabaquera anatómica, usando como donante la rama posterior de la arteria radial localizada entre los tendones del extensor largo y corto del pulgar, se utiliza con menor frecuencia debido a la mayor complejidad de la técnica quirúrgica. Pese a ello, en las unidades donde se realiza de forma habitual se asocia a buenos resultados114, con un 11% de trombosis inmediata, una maduración del 80% a las 6 semanas y una permeabilidad a 1 y 5 años del 65 y el 45%, respectivamente. En este caso, su mayor beneficio radica en que no excluye la posibilidad de realizar una FAVn radiocefálica en la misma extremidad al agotarse este acceso. Ambas localizaciones permiten reconstrucciones proximales en el antebrazo ante estenosis o trombosis yuxtaanastomóticas.Fístula arteriovenosa radiocefálica en antebrazo
La disposición de esta técnica difiere de la anterior en que se realiza en una zona más proximal; está indicada como tratamiento quirúrgico en las estenosis yuxtaanastomóticas de FAV en muñeca, y en los casos de inviabilidad de vena cefálica en muñeca, usualmente debido a bifurcaciones precoces.Transposición radiobasílica
Cuando la vena cefálica en el antebrazo no resulta adecuada para una FAV radiocefálica, una alternativa posible antes de usar venas más proximales es la transposición radiobasílica115,116. La vena basílica se ha de movilizar desde la muñeca en sentido proximal hasta la fosa antecubital y tunelizarla subcutáneamente hasta la arteria radial para realizar la anastomosis. La vena basílica antebraquial suele hallarse libre de punciones venosas previas. Sin embargo, su menor consistencia la hace más vulnerable a posibles lesiones durante el proceso de transposición, con mayor tendencia a la torsión, por lo que su realización en la práctica clínica se encuentra limitada por el desarrollo de dicha vena y por la experiencia del equipo quirúrgico.Otras transposiciones venosas
Cuando es la arteria radial la que no es adecuada para una FAV radiocefálica, otras transposiciones venosas posibles en el antebrazo son las de vena cefálica o basílica, dispuestas en forma de asa en la cara palmar del antebrazo, a la arteria radial proximal o humeral en la fosa antecubital117. Así, se han descrito distintas posibilidades de transposición cubitobasílica en antebrazo, humerobasílica en forma de loop y distintas configuraciones usando la vena safena interna111. Su uso está limitado en la práctica a situaciones anatómicas concretas en pacientes determinados.2.2.2. Fístulas arteriovenosas nativas de fosa antecubital (codo)
Según las directrices de la Kidney Disease Outcomes Quality Initiative (KDOQI)10, la FAV radiocefálica y la FAV humerocefálica son la primera y la segunda opciones para crear un AV, respectivamente10. A nivel de fosa antecubital se hallan vasos de mayor calibre, que suelen proporcionar flujos más elevados y tener tasas menores de fallo primario y de alteraciones en la maduración, mientras que su principal inconveniente es el menor trayecto disponible para la punción y que limitan el posterior uso de accesos más distales.Fístula arteriovenosa humerocefálica
La FAV humerocefálica es el acceso vascular de elección en esta localización6,10,109; tiene la ventaja sobre la FAV radiocefálica de que alcanza mayores flujos; además, la vena cefálica en el brazo suele ser accesible a la punción y estéticamente más discreta que en el antebrazo. Sin embargo puede provocar mayor edema de la extremidad y tiene mayor riesgo de provocar isquemia distal inducida por el AV.Fístula arteriovenosa humeroperforante (fístula arteriovenosa de Gracz)
Una variante de la técnica anterior de uso extendido consiste en la creación de la FAV entre la arteria humeral y la vena perforante en la fosa antecubital (FAV humeroperforante), mediante la técnica descrita por Gracz118 y modificada posteriormente por Konner et al67,119, con el objetivo de conseguir la arterialización tanto de la vena cefálica como de la vena basílica120.Fístula arteriovenosa de arteria radial proximal
Como alternativa a la arteria humeral se puede usar como donante la arteria radial proximal en la fosa antecubital113,119,121–123. Esta técnica se asocia a ciertas ventajas funcionales. El riesgo de isquemia distal relacionada con el AV es menor cuando la arteria donante es la radial, respecto a los procedimientos realizados con la arteria humeral. Al tratarse de una anastomosis construida sobre la arteria radial, su menor calibre favorece la adecuada resistencia del nuevo AV y minimiza el riesgo de isquemia distal. Asimismo, como se obtiene menor flujo en la FAV, limita el impacto cardiológico en los pacientes de riesgo. Por otro lado, la confluencia venosa en esta localización permite la posibilidad de establecer un flujo bidireccional en el drenaje venoso.
En casos con escasa disponibilidad de venas puncionables se han propuesto variantes técnicas para favorecer el flujo bidireccional en las venas distales a la FAV, principalmente en codo, con el objeto de aumentar el trayecto disponible para su canulación124, mediante la valvulotomía retrógrada de las venas de drenaje125.
La fosa antecubital presenta múltiples anastomosis entre venas que pueden permitir realizar dicha intervención. Descrito en la bibliografía sobre la base de series cortas de casos, no hay documentada la suficiente evidencia como para poder determinar su utilidad en la práctica y evaluar la trascendencia clínica de la hipertensión venosa derivada de esta técnica, por lo que su uso se limita a casos con escaso trayecto de punción en los que anatómicamente sea factible su realización111.Fístula arteriovenosa humerobasílica
Los pacientes sin posibilidad de realizar una FAV radiocefálica o humerocefálica, y como alternativa a la implantación de una prótesis vascular, pueden optar a una FAV humerobasílica con superficialización o transposición venosa126.
La profundidad de la vena basílica la protege frente a venopunciones de repetición, por lo que suele estar preservada en el paciente candidato a HD; sin embargo, esta mayor profundidad puede provocar dificultades en la punción que requieran su superficialización. Además, el curso de la vena basílica es adyacente al paquete vasculonervioso de la extremidad, lo que deja a estas estructuras vulnerables a posibles lesiones por punción durante la diálisis. Por ello, para alejarse de estas estructuras, y por comodidad del paciente durante la diálisis, además de superficializarse se puede transponer a una localización anterior y lateral en el brazo.
Dado que habitualmente se requieren dos tiempos quirúrgicos, en la práctica clínica se pueden realizar bien en la misma intervención o bien en dos procedimientos separados en el tiempo.
Cuando se realiza en una intervención se diseca y moviliza la vena basílica, a continuación se crea el nuevo trayecto y seguidamente la anastomosis arteriovenosa. La ventaja de realizarse en un mismo procedimiento es que se acorta el tiempo requerido antes de poder efectuar la canulación del AV; la desventaja reside en que aumenta la posibilidad de complicaciones mecánicas durante el acto quirúrgico, ya que la movilización y/o transposición de la vena debe realizarse con una vena no arteriolizada.
Cuando se realiza en dos procedimientos, en un primer tiempo se construye la anastomosis entre la vena basílica y la arteria humeral, y a partir de los 30-90 días, tras haber comprobado mediante ED la correcta maduración de la FAV y la ausencia de estenosis, se lleva a cabo el segundo tiempo y se procede a su superficialización y/o transposición127.
Hay descritas tres posibilidades técnicas de superficialización para poder permitir la canulación en este tipo de accesos128: a) transposición anterior en el brazo, mediante la creación de un nuevo túnel subcutáneo; b) transposición anterior en el brazo mediante la creación de un flap lateral de piel y tejido subcutáneo, y c) superficialización simple sin transposición.Fístula humerohumeral
Una alternativa postulada en los casos de ausencia de venas superficiales disponibles es la de realizar una fístula arteriovenosa entre la arteria humeral y la vena humeral129–131.
La vena humeral se encuentra acompañando a la arteria, y puede ser única o doble. Al tratarse de una vena correspondiente al sistema venoso profundo está preservada de punciones previas, por lo que, pese a ser una intervención compleja, si existe un buen desarrollo de dicha vena puede ser factible técnicamente su realización.
El procedimiento quirúrgico se describe análogo al de la FAV humerobasílica realizando la anastomosis en fosa antecubital, movilizando la vena humeral con ligadura de colaterales y efectuando su superficialización y/o transposición129.
Pese a que una vez conseguida la maduración del AV, los resultados en cuanto a permeabilidad y complicaciones son similares a los de la FAV humerobasílica, la gran limitación de esta técnica es el elevado índice de fallos primarios, que puede llegar al 53%, y la baja permeabilidad primaria al año (35-40%)129,131, probablemente en relación con el aumento de la complejidad técnica que representa la movilización y transposición de la vena humeral. Por ello, a falta de estudios más amplios, dicha técnica no se suele plantear como opción alternativa válida al uso de prótesis sintéticas en el brazo128.Otras transposiciones venosas
Al igual que en la región del antebrazo, existen distintas posibilidades de transposiciones venosas; su uso está limitado a determinadas situaciones clínicas con disposiciones anatómicas particulares111.
2.3Fístula arteriovenosa protésicaRecomendaciónEl uso de material protésico para la realización de un AV para HD ha demostrado ser una solución viable y efectiva para conseguir un AV permanente93,99,132,133.
Sin embargo, tanto su alto coste económico como la morbilidad asociada y el deterioro en la calidad de vida debido a la necesidad de procedimientos para mantenerlo permeable hacen que no se considere como técnica de primera elección a la hora de planificar el AV, papel reservado a la FAVn10.93,98,109,132–135.
Desde el punto de vista técnico destaca por su menor complejidad, lo que puede contribuir a que cirujanos poco expertos en la realización de AV se puedan inclinar de entrada por este procedimiento99.
Pese a no ser el AV de primera elección, el cada vez mayor número de pacientes que requieren HD durante períodos muy largos de su vida, con el consiguiente riesgo de agotamiento del lecho vascular, junto con el progresivo aumento de la edad media de los pacientes en programa de HD, hace que estos accesos tengan hoy en día un papel muy relevante. Además, las FAVp ofrecen algunas ventajas teóricas, como un menor tiempo de maduración o una mayor facilidad para su punción en determinados casos, como sucede en pacientes obesos. También pueden facilitar la realización de un AV nativo secundario, al facilitar la dilatación de venas en los brazos que previamente no eran aptas para la realización de una FAVn132.2.3.2. Planificación y creación de la fístula arteriovenosa protésica
Antes de su implantación deben identificarse las arterias y venas con un diámetro adecuado para su colocación (no inferior a 4mm)63,116,133. En la mayoría de los casos, con un lecho venoso distal ya agotado, la anastomosis arterial deberá ser lo más distal posible; la anastomosis venosa, asimismo, deberá ser lo más distal posible, siempre que quede garantizado un correcto drenaje hacia troncos venosos centrales.
Cabe destacar que el uso de venas de fosa antecubital para la anastomosis implica la integridad de dicho territorio y de sus correspondientes venas de drenaje, por lo que en estos casos la indicación prioritaria sería la realización de una FAVn usando dichas venas. Por ello, hay autores136 que recomiendan evitar los loops protésicos en el antebrazo, dado que consideran que en estos casos existe la posibilidad de realizar una FAVn.Polifluoroetileno expandido
El material recomendado para la prótesis es el PTFE, dado que ofrece mejores tasas de infección e integración que el Dacron10. Aparte de este material estándar, existen otras prótesis que pueden ser empleadas en circunstancias especiales137,138.Prótesis de punción inmediata
Las prótesis de punción inmediata son prótesis de doble capa de PTFE que se encuentran reforzadas con una tercera capa de elastómero entre ambas, con lo que no se requiere su integración en los tejidos de cara a la punción. Ofrecen resultados similares a las prótesis convencionales, con la ventaja de permitir una punción a las 24h en caso de que sea necesario139.Prótesis biosintéticas
También se han publicado buenos resultados con prótesis creadas mediante bioingeniería. Se trata de una prótesis fabricada a partir de una matriz de poliéster, en la que se cultiva colágeno procedente de oveja, con un posible beneficio en cuanto a presentar una menor incidencia de infecciones cuando no es posible realizar una FAVn140. La principal evidencia sobre el uso de este tipo de prótesis es la publicada por Morosetti et al, que compara el acceso protésico con la FAV humerobasílica en pacientes sin otras alternativas; si bien se demostraron mejores resultados con el acceso autólogo, los resultados de permeabilidad y de índice de complicaciones fueron similares a los de otras series descritas con PTFE135.Técnica quirúrgica
La prótesis se puede implantar mediante una configuración en forma recta o en forma de asa, esta última disposición es la preferida en el antebrazo141. Estas disposiciones están condicionadas, en última instancia, por las características del paciente.
La localización de la anastomosis arterial por orden de preferencia es: arteria humeral en fosa antecubital, arteria humeral en brazo, arteria humeral próxima a axila y arteria axilar; aunque, puesto que una FAVp suele realizarse tras varias FAVn fallidas, la localización dependerá del lecho vascular conservado. La anastomosis venosa puede realizarse en las venas de la fosa antecubital o por encima del codo, y es posible realizarla en venas cefálica, basílica, axilar, subclavia y yugular.
La anastomosis arterial de la prótesis preferiblemente debe ser lateroterminal. No existen estudios que demuestren diferencias según el tipo de anastomosis entre la vena y la prótesis. La longitud de la prótesis debe tener entre 20 y 40cm para garantizar una gran longitud de punción. El diámetro de las prótesis debe oscilar entre 6 y 8mm. Según algunos autores142, la utilización de diámetros mayores se asocia a unos mejores resultados a largo plazo en este tipo de AV.
2.4Técnicas de recursoLos pacientes que han agotado todo su capital venoso para el AV en las extremidades superiores, incluyendo la FAVn y la FAVp, son un pequeño, pero creciente, porcentaje de los pacientes en HD.
Dado la comentada mayor morbimortalidad que representa efectuar la HD mediante un CVC, se han descrito técnicas quirúrgicas denominadas de recurso, que permiten disponer de un acceso permanente en ausencia de venas viables en las extremidades superiores. Estas técnicas permiten evitar el uso de CVC a cambio de un mayor nivel de complicaciones, mayor morbilidad operatoria y permeabilidad menor que los AV convencionales93,97,122,132,133,143.2.4.1. Accesos vasculares en miembros inferiores
Es amplia la evidencia disponible sobre la realización del AV en las extremidades inferiores, sobre la base de una prótesis vascular (a nivel proximal del muslo o en su porción media) o bien mediante una FAVn (FAV en la vena femoral con transposición de esta). De todas las técnicas de recurso descritas, la realización de una FAVp en la extremidad inferior suele ser la opción más ampliamente utilizada, ya que presenta unas tasas de supervivencia aceptables y se trata de la técnica de menor complejidad quirúrgica111,122,132,133.2.4.2. Dispositivo prótesis-catéter tunelizado
El dispositivo híbrido prótesis-catéter tunelizado (Hemodialysis Reliable Outflow —HeRO— device) se encuentra indicado en los casos en los que existe una obstrucción venosa central que impide la realización de cualquier otro AV en la extremidad superior. Consiste en un AV que se crea de forma mixta. Por una parte, se trata de un catéter permanente que entra por la vena yugular interna hasta la aurícula y por otra se halla conectado a una prótesis de PTFE que se anastomosa a nivel de la arteria humeral, de modo que la zona de punción es la prótesis que se encuentra tunelizada subcutáneamente y el drenaje distal se efectúa directamente en la aurícula. El objetivo es evitar estenosis u oclusiones de venas centrales que impedirían la realización de una FAV.
En la práctica clínica presenta la ventaja de ser un AV que se puede implantar en pacientes sin drenaje venoso central adecuado en los que todas las opciones de FAVn o FAVp se han agotado, sin comprometer futuros AV, mientras que sus principales inconvenientes son el tratarse de una intervención compleja técnicamente y de un coste económico elevado.2.4.3. Accesos vasculares “exóticos”
Se consideran como AV “exóticos” los planteados en casos de oclusiones extensas de troncos venosos, tanto en extremidades superiores como inferiores. Presentan la gran ventaja de permitir un nuevo AV sobre un territorio teóricamente agotado y, en ocasiones, se pueden realizar para recuperar AV que han fracasado por oclusión en las venas de drenaje en los que el tratamiento endovascular no ha sido efectivo144,145.
Dado el agotamiento del lecho venoso presente en estos pacientes, se realizan mediante injertos protésicos de PTFE, en forma de bypass entre la arteria donante y la vena receptora.
A su ventaja inicial de proporcionar un AV sobre un lecho venoso agotado se contrapone una mayor incidencia de complicaciones que la FAVn, debido a estar compuestos de material heterólogo, y es particularmente grave en el caso de infección, por hallarse implicados vasos centrales y de difícil acceso quirúrgico.
Asimismo, se trata de intervenciones quirúrgicas complejas no exentas de morbimortalidad, que se efectúan en pacientes con comorbilidades asociadas importantes, y que habitualmente acumulan múltiples AV fallidos.
Por todo ello, es norma general que en cada caso se individualice el riesgo/beneficio de la intervención quirúrgica en función del paciente, de la intervención necesaria y de las opciones de AV existentes.Accesos protésicos en la pared anterior del tórax
Estos AV se disponen, bien en forma de loop, interponiendo una prótesis entre la vena y la arteria axilar del mismo lado, o bien de forma recta, interponiendo la prótesis entre la vena y la arteria axilar contralateral. Estos AV se pueden plantear en los pacientes con lecho venoso agotado, pero con permeabilidad de venas centrales, beneficiándose sobre todo los pacientes con alto riesgo de isquemia de la extremidad. Los resultados reportan unas tasas de permeabilidad similares a las FAVp más convencionales del brazo146,147.Bypass a venas centrales
En el caso de trombosis de vena axilar distal, la técnica consiste en realizar un bypass entre la arteria humeral y la vena axilar proximal, mientras que en casos de trombosis extensa axilosubclavia, con permeabilidad de vena yugular interna y tronco braquiocefálico, la técnica de elección es realizar un bypass entre la arteria humeral y la vena yugular interna144.Bypass a venas de miembros inferiores
Si la oclusión está presente en ambos troncos venosos braquiocefálicos o bien en la vena cava superior, la alternativa quirúrgica pasa por realizar un bypass entre la arteria axilar y la vena ilíaca144,148 o bien la vena poplítea145,149.Otras técnicas derivativas
Se han descrito otras técnicas derivativas alternativas, como el bypass a aurícula derecha150, bypass femorofemoral cruzado145, bypass axilorrenal151 o bien el bypass axilo-vena cava inferior144. En todos los casos son técnicas que se consideran de carácter extraordinario, cuya evidencia se restringe a unos pocos casos documentados.Tipos de acceso vascular
- •
FAVn en muñeca y antebrazo.
- –
FAV radiocefálica en muñeca (FAV de Brescia-Cimino).
- –
FAV en tabaquera anatómica.
- –
FAV radiocefálica en antebrazo.
- –
Transposición radiobasílica.
- –
Otras transposiciones venosas.
- –
- •
FAVn en fosa antecubital (codo) y brazo.
- –
FAV humerocefálica.
- –
FAV humeroperforante (FAV de Gracz).
- –
FAV de arteria radial proximal.
- –
FAV humerobasílica.
- –
FAV humerohumeral.
- –
Otras transposiciones venosas.
- –
- •
FAVp en miembros superiores.
- –
Injerto radioantecubital recto.
- –
Loop húmero/radioantecubital.
- –
Injerto humerohumeral/axilar recto.
- –
Loop humerohumeral/axilar.
- –
- •
Técnicas de recurso.
- –
AV en miembros inferiores.
- –
Injerto femorofemoral proximal (ingle).
- –
Injerto femorofemoral en el tercio medio del muslo.
- –
Transposición de la vena femoral.
- –
Dispositivo prótesis-catéter tunelizado (HeRO).
- –
Accesos vasculares “exóticos”.
- –
- •
Catéter venoso central.
(•) nueva R 2.5.1) Como primer acceso vascular se recomienda crear una fístula arteriovenosa nativa lo más distal posible, en la extremidad superior no dominante
(•) nueva R 2.5.2) Tras agotar el acceso vascular radiocefálico a lo largo del antebrazo, se recomienda la fístula arteriovenosa nativa realizada con las venas disponibles a nivel de codo, siendo la fístula arteriovenosa humerocefálica o radiocefálica proximal la primera alternativa a considerar
(•) nueva R 2.5.3) Si no se puede realizar una fístula arteriovenosa radiocefálica o humerocefálica, se recomienda la realización de una fístula arteriovenosa humerobasílica con superficialización o transposición venosa en el brazo o antebrazo, como opción previa a la utilización de una fístula arteriovenosa protésica
(•) nueva R 2.5.4) Se recomienda que la fístula arteriovenosa protésica en la extremidad superior se limite a los siguientes supuestos:
A. Pacientes sin venas anatómicamente adecuadas en el brazo o antebrazo
B. Pacientes que requieren hemodiálisis de modo inmediato y se quiere evitar la implantación de un catéter venoso central tunelizado
(•) nueva R 2.5.5) Si ha fracasado una fístula arteriovenosa previa, se recomienda que la decisión del lugar anatómico de la creación de la siguiente fístula arteriovenosa sea consensuada con el paciente, para decidir si se da prioridad al criterio de cuanto más distal mejor o al criterio de extremidad no dominante
(•) nueva R 2.5.6) En los casos en los que se han agotado los accesos vasculares a nivel de ambas extremidades superiores, se sugiere el empleo de las técnicas de recurso, priorizando la fístula arteriovenosa protésica a nivel de muslo y el dispositivo prótesis-catéter tunelizado como primeras opciones a considerar
→ Pregunta clínica V ¿Se puede aconsejar un orden en la realización de la fístula arteriovenosa?
(Ver ficha de la Pregunta clínica V en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| FAVn frente a FAVp | |
| Varios ensayos clínicos aleatorizados (ECA) publicados muestran mejores resultados para las FAVn que para las FAVp en cuanto a mayor duración funcional y menores tasas de complicaciones | Calidad moderada |
| Orden de creación de los distintos AV | |
| No se han encontrado estudios comparativos, aleatorizados o no, que comparen entre sí la eficacia y seguridad de distintos órdenes en la realización de sucesivos AV para HD | Calidad baja |
Los expertos y las guías coinciden en señalar que se debe iniciar colocando una FAV lo más distal posible para preservar la opción de futuros accesos más proximales en caso necesario6,10,109,111. No obstante, no se ha encontrado ningún estudio que compare los resultados de distintas localizaciones de realización de la FAV para HD en pacientes en los que cualquiera de esas opciones pareciera viable de entrada.
Según las directrices de las guías clínicas publicadas6,10,111, las FAVn arteriovenosas radiocefálica y humerocefálica son la primera y segunda opciones para el AV, respectivamente. Si estas opciones no son posibles, recomiendan considerar la realización de una FAVn humerobasílica autóloga en la parte superior del brazo o una FAVp en el antebrazo a nivel radioantecubital.Uso de la extremidad no dominante
Pese a que es general la recomendación de realizar el primer AV por FAV en la extremidad superior no dominante, no se han encontrado estudios que comparen expresamente la opción de priorizar la mano dominante o la contralateral.
En este sentido, Koksoy et al152, en un ECA sobre la eficacia y seguridad entre FAVn humerocefálicas y FAVn humerobasílicas, documentan que el uso del brazo dominante puede aumentar el riesgo de fracaso de la FAVn; esta tendencia no se ha podido confirmar en ningún otro estudio realizado hasta la fecha.Localización distal frente a proximal
Por otro lado, no se han encontrado estudios que comparen específicamente si es más eficaz o seguro priorizar el criterio de las localizaciones más distales posibles, alternando entre extremidad no dominante y dominante, o, por el contrario, seguir en la misma extremidad hasta agotar el resto de opciones quirúrgicas. Ante la falta de evidencia sólida que favorezca claramente alguna de las opciones, parece razonable dejar a elección del paciente, con el asesoramiento de los profesionales, la decisión sobre si la siguiente FAV debe hacerse en una localización más proximal de la misma extremidad que la FAV previa o en la localización más distal posible de la otra extremidad.
Reinhold et al8 señalan que el primer AV se debe colocar lo más distal posible. Las principales desventajas de la FAVn radiocefálica distal en la tabaquera anatómica o en la muñeca son las tasas relativamente altas de oclusión y no maduración, que están influidas por factores de riesgo del paciente tales como la edad, la diabetes mellitus y las enfermedades cardiovasculares.
Una revisión previa con metaanálisis66, basada en 38 estudios observacionales, estimaba para la FAVn radiocefálica en la muñeca una tasa de fracaso primario del 15,3% y unas tasas de permeabilidad primaria y secundaria del 62,5 y el 66,0%, respectivamente.Opciones previas a la colocación de una fístula arteriovenosa protésica: papel de la fístula arteriovenosa nativa humerobasílica
Como opción previa a la utilización de una FAVp está indicado realizar una FAVn humerobasílica con superficialización o transposición venosa en el brazo.Fístula arteriovenosa humerobasílica. Resultados
La revisión sistemática de Dukkipati et al128 analiza los resultados de las FAVn humerobasílicas basándose en numerosos estudios observacionales y un ECA134. Esta revisión encuentra unas tasas aceptables de fallo primario (del 15 al 20%), de permeabilidad primaria al año (72%) y a 2 años (62%).Fístula arteriovenosa humerobasílica frente a fístula arteriovenosa protésica
Existen dos ECA y dos estudios retrospectivos que comparan los resultados entre ambos procedimientos134,135,153,154; en todos ellos se describen unos resultados similares, y son significativamente mejores las tasas de permeabilidad primaria y permeabilidad primaria asistida en el grupo de los pacientes portadores de FAV humerobasílica, mientras que al analizar los resultados de la permeabilidad secundaria estas diferencias desaparecen, si bien el número de intervenciones requeridas para mantener dicha permeabilidad secundaria es marcadamente mayor en el caso de las FAVp134.
Con respecto a las complicaciones, estas se presentan con mayor frecuencia en las FAVp134,135,153, especialmente las infecciosas; por contra, el tiempo de maduración es mayor en las FAV humerobasílicas154.Fístula arteriovenosa humerobasílica frente a fístula arteriovenosa humerocefálica
El ECA de Koksoy et al152, que comparó la eficacia y la seguridad de FAV humerocefálicas frente a FAV humerobasílicas, no encontró diferencias en relación con la mortalidad, complicaciones de la herida, trombosis inmediata, hemorragia postoperatoria, maduración de la FAV y tiempo hasta la maduración de la FAV, sin hallar diferencias significativas con respecto a las tasas de permeabilidad. Otros autores155,156 describen similares resultados. En los estudios citados, asimismo, se constata una tendencia de las FAV humerobasílicas a presentar mejores tasas de maduración del AV, aunque sin diferencias con significación estadística, hecho probablemente relacionado con que la vena basílica se halla mejor preservada que la vena cefálica en la mayoría de pacientes.
Todos estos resultados colocan a la fístula humerobasílica como una técnica segura y con buenos resultados a la hora de plantear el AV permanente.Fístula arteriovenosa humerobasílica frente a fístula arteriovenosa humerocefálica frente a fístula arteriovenosa protésica
Asimismo, se han publicado varios estudios que analizan los resultados comparando los 3 principales tipos de FAV en el brazo156–159. Todos ellos coinciden en describir una mejor permeabilidad estadísticamente significativa en los AV autólogos, a pesar de que presentan una mayor tasa de fallo primario.
Igualmente, encuentran un mayor índice de complicaciones y de intervenciones necesarias para mantener la permeabilidad del acceso en las FAVp, mientras que no encuentran diferencias significativas entre ambos tipos de FAVn.
No hay unanimidad entre los diferentes grupos con respecto a la conveniencia o no de realizar la transposición de la vena basílica en el mismo acto quirúrgico o bien tras su dilatación y arterialización, ni de cuál es la técnica de elección (transposición con túnel subcutáneo, transposición con flap o superficialización simple)128.Procedimiento en un tiempo frente a dos tiempos quirúrgicos
En el ECA de El Mallah160, que constituye la mejor evidencia hasta la actualidad, se describe una significativa mejor supervivencia primaria tras la cirugía en dos tiempos (el 50 frente al 80%), si bien el número de pacientes no es elevado (n = 39). Similares resultados se describen posteriormente por Ozcan et al161, que encuentran un mayor índice de maduración y menor número de complicaciones cuando se realiza en dos tiempos. Por último, en la serie publicada por Pflederer et al158 se destaca que la mayor parte de complicaciones de la cirugía en dos pasos se produjo en el intervalo entre ambos, por lo que los autores recomiendan esta técnica por minimizar la agresión quirúrgica.Superficialización frente a transposición
Hay coincidencia entre los autores en considerar la transposición mediante la creación de un túnel subcutáneo como la que se asocia a un menor índice de complicaciones117,162, pero sin asociarse a una mejor tasa de maduración. Por último, Hossny117 describe una mayor satisfacción entre el personal de enfermería responsable de la punción en los casos en los que se realizó la transposición mediante la creación de un túnel subcutáneo.Fístula arteriovenosa protésica de miembro superiorResultados de la fístula arteriovenosa protésica
La permeabilidad primaria de las FAVp está entre el 20 y el 50% a los 24 meses y, mediante sucesivas intervenciones quirúrgicas, se puede alcanzar una permeabilidad asistida de entre el 45 y el 70% a los 2 años163–167.
La mejor evidencia disponible viene de la revisión sistemática con metaanálisis de Huber et al93, que encontró 34 estudios, la mayoría series de casos y algún estudio controlado no aleatorizado, que comparaba los resultados de la FAVn y la FAVp en extremidad superior. Las tasas de permeabilidad primaria para las FAVn eran del 72% a los 6 meses y del 51% a los 18, y para las FAVp del 58 y el 33%, respectivamente. Las tasas de permeabilidad secundaria para las FAVn eran del 86 y el 77%, y para las FAVp del 76 y el 55%, respectivamente. Cabe destacar que la mayor permeabilidad en las FAVn se manifiesta de forma significativa en todas las categorías analizadas (brazo/antebrazo y permeabilidad primaria/secundaria).
Para mejorar esta permeabilidad se han introducido mejoras técnicas en las prótesis, como la inclusión de superficie bioactiva con heparina en estas. Hasta el momento, no se han podido demostrar mejoras en la permeabilidad o en la necesidad de un menor número de reintervenciones168,169.Indicación de fístula arteriovenosa protésica
Hay un consenso global entre los autores sobre la superioridad de la FAVn sobre la FAVp93, y así queda reflejado en las distintas guías de práctica clínica publicadas6,10,111. Así pues, actualmente no hay controversia en cuanto a la indicación de la FAVp en los casos en que se ha producido un agotamiento del capital venoso del paciente y no existe la posibilidad de crear una FAVn93,132,136.
En cambio, sí existe debate entre los autores a la hora de plantear la posibilidad de una FAVp como primera elección en pacientes en los que no se ha agotado el lecho venoso132,136,170.
En los últimos años se ha apreciado un progresivo aumento en la edad media de los pacientes que inician TSR con HD, así como de la patología de base que presentan, lo que se ha traducido en un cada vez mayor porcentaje de FAVn con alteración en la maduración y de FAVn que no llegan a ser funcionales78, que en algunas series ha llegado a un 60%171. Ello se traduce inevitablemente en un aumento de la dependencia del CVC en estos pacientes, con lo que aumenta el riesgo de sepsis y de las complicaciones derivadas de ella132.
Este hecho ha llevado a varios autores a replantearse la idoneidad del planteamiento de priorizar en todos los casos la FAVn por delante de la FAVp78,132,136,170 y, en todo caso, valorar situaciones clínicas en las que puede estar indicada una FAVp como técnica de primera elección, en las cuales las potenciales ventajas de la FAVp (menor tiempo de maduración, menor tasa de fallo primario) superarían a las ventajas de las FAVn (mayores permeabilidades, menor índice de complicaciones).
Según Sgroi et al136, las situaciones clínicas en las que una FAVp se considera de primera elección serían la ausencia de venas anatómicamente adecuadas en el antebrazo o brazo, el paciente con enfermedad renal en fase terminal, con una esperanza de vida limitada, la necesidad de inicio de HD de forma urgente y pacientes con factores clínicos de riesgo de fracaso de la FAVn.
Urbanes132 recomienda una decisión individualizada en cada caso, y aconseja considerar la FAVp en los casos de esperanza de vida limitada, ausencia de vasos adecuados en el antebrazo y FAVn previas fallidas. Asimismo, plantea la posibilidad de realizar FAVp “puente” en pacientes con necesidad urgente de HD para evitar el paso por un CVC.
Otros autores170,172 proponen un algoritmo de decisión entre FAVn y FAVp en función del cálculo de la probabilidad de fallo primario sobre la base de tres parámetros básicos: haber iniciado HD, esperanza de vida superior o inferior a los 2 años y antecedente de AV previos fallidos.Técnicas de recurso
Como se ha mencionado previamente, una vez que los AV “convencionales” se han agotado, cabe la posibilidad de realizar otros AV de recurso. Es escasa la evidencia disponible sobre los resultados de dichas técnicas, por lo que sigue siendo incierto su rol a la hora de decidir el AV de elección en la práctica clínica.Acceso vascular en miembro inferior
La principal evidencia registrada proviene de la revisión sistemática realizada por Antoniou et al173 en 2009. Se valoró la permeabilidad y las complicaciones de los siguientes tipos de FAV: FAVp en la parte superior del muslo (región inguinal), FAVp en el tercio medio del muslo y FAVn con transposición de vena femoral. Estos estudios obtuvieron unos resultados aceptables en términos de permeabilidad de estas técnicas, con una permeabilidad primaria a los 12 meses del 48, 43 y 83%, y una permeabilidad secundaria a los 12 meses del 69, 67 y 93%, respectivamente. El estudio de permeabilidad encontró una mayor permeabilidad en la FAVn con vena femoral frente a la FAVp, con diferencias estadísticamente significativas, mientras que entre ambos tipos de FAVp no las hubo. Las complicaciones infecciosas se describen con mayor frecuencia en la FAVp, mientras que la FAVn de vena femoral presenta la tasa más elevada de isquemia de la extremidad.
Otros trabajos publicados de carácter observacional comparan la permeabilidad y complicaciones de las FAVp de las extremidades inferiores con las efectuadas en las extremidades superiores; así, Miller et al174 informan de unas permeabilidades similares entre ambos territorios, pero con una mayor incidencia de fallo primario y de complicaciones infecciosas en los AV de las extremidades inferiores. A su vez, Harish y Allon175 describen mayor gravedad en las infecciones derivadas de las iFAVp en dichas extremidades inferiores.Dispositivo prótesis-catéter tunelizado
En el primer estudio publicado176 se describió una disminución en la incidencia de infección con respecto a los CVC tunelizados, obtenida mediante una revisión de la bibliografía realizada por los mismos autores (0,70/1.000 frente a 2,3/1.000 días).
Steerman et al143 realizaron un estudio comparativo entre este dispositivo y las FAVp en el muslo, sin hallar diferencias en términos de permeabilidad secundaria, infección y tasa de mortalidad; por ello se considera que la principal ventaja de este dispositivo radica en el empleo del brazo, lo que permite preservar el muslo para futuros accesos, y en la posibilidad de empleo en pacientes con enfermedad arterial periférica.
Actualmente, la mejor evidencia disponible se refiere a un metaanálisis publicado por Al Shakarchi et al177, en el que se referencian distintas series de casos publicadas. Asimismo, en dos estudios se comparan sus resultados con respecto a las FAVp a nivel de extremidades inferiores143,178. Los resultados globales descritos en cuanto a la supervivencia del AV son de una permeabilidad primaria del 21,9% y una permeabilidad secundaria del 59,4%, mientras que en la comparativa respecto a las FAVp no hubo diferencias significativas de permeabilidad. Con respecto a la tasa de infección del dispositivo, los autores reportan una incidencia de 0,13-0,7 bacteriemias asociadas al AV por 1.000 días, siendo significativamente mejores que las tasas asociadas a los CVC177.Acceso vascular “exótico”
Como se ha mencionado previamente, una vez que los AV “convencionales” se han agotado cabe la posibilidad de realizar AV de recurso. Entre estos hay que destacar la FAVp en la pared anterior del tórax, los bypass a venas centrales, los bypass a venas de miembros inferiores o bien otras técnicas derivativas.
En todos los casos, la evidencia disponible se refiere a la publicación de series de casos144–151. Todos ellos aportan resultados aceptables teniendo en cuenta que se trata de técnicas de recurso, pero no existen estudios que muestren con un nivel suficiente de evidencia cuál es el de primera elección en cada caso.Valoración del acceso vascular preferente en el paciente de edad avanzada
Tal y como se ha referido previamente, el AV de elección es la FAVn, debido esencialmente a presentar unas tasas de permeabilidad primaria, primaria asistida y secundaria muy superiores a las FAVp y a los CVC93. Asimismo, presentan una incidencia de complicaciones inferior a la de los otros accesos, especialmente en cuanto a infecciones y trombosis. Por contra, el principal inconveniente de la FAVn radica en su baja tasa de maduración y en el prolongado período que requiere para hacerla, sobre todo en los casos en que necesita procedimientos secundarios para favorecerla.
Esta alta incidencia de fallo primario que presenta la FAVn, que en algunas series llega a ser del 60%171, se considera el auténtico talón de Aquiles de esta, y se encuentra todavía más acentuada en el paciente de edad avanzada, presentando un aumento del riesgo de fallo primario de una odds ratio de 1,79 con respecto al paciente no anciano64.
A ello hay que añadir la baja supervivencia que presenta este tipo de paciente, debido a la edad y a la frecuente presencia de importantes comorbilidades, con una mortalidad > 50% a los 2 años de los pacientes mayores de 75 años al inicio de HD179, y se ha descrito una mortalidad del 30% en octogenarios antes siquiera de haber iniciado el TSR180.
Por todo lo mencionado, es opinión común entre varios autores replantear la idoneidad de la FAVn en el paciente geriátrico y/o con limitada esperanza de vida, ya que en estos casos el hecho de intentar iniciar el TSR a través de una FAVn puede llevar a condicionar una mayor dependencia del CVC, con las complicaciones asociadas a este64,128,132,136,170,180.
Por ello, uno de los debates vigentes hoy en día debido al aumento de la edad media de la población en HD, es si en el paciente anciano es preferible intentar la realización de una FAVn, con los posibles problemas de maduración, o una FAVp con sus problemas infecciosos y de permeabilidad a medio plazo. Incluso se plantea la posibilidad de la colocación directa de un CVC tunelizado en estos pacientes con expectativa de vida limitada.
Al realizar una búsqueda sistemática no se han encontrado estudios controlados aleatorizados sobre esta cuestión. La mejor evidencia disponible actualmente se compone de un metaanálisis64, un estudio retrospectivo con una cohorte de pacientes del United States Renal Data System181, así como de varias revisiones de la bibliografía y opiniones de expertos132,136,170.En un estudio retrospectivo de una cohorte de 82.202 pacientes con edad de 70 años o más al inicio de la HD y cuyos datos estaban recogidos en el Sistema de Datos Renales de Estados Unidos, DeSilva et al181 analizan la mortalidad global y la supervivencia de estos pacientes y encuentran una menor mortalidad y mejor supervivencia en los pacientes que iniciaron la HD con FAVn. Asimismo, constatan los mejores resultados de la FAVp con respecto al CVC. Únicamente en el grupo de pacientes mayores de 90 años, pese a mantenerse la tendencia descrita, las diferencias entre FAVn y FAVp no alcanzaron el grado de significación estadística, lo que hace considerar que la opción de la FAVn primero es válida, en general, también para la mayoría de los ancianos, incluso para aquellos con comorbilidades.
En cuanto a la FAVn de elección en el anciano, la revisión con metaanálisis de Lazarides et al64 basada en estudios de cohortes retrospectivas encuentra un mayor riesgo de fracaso de la FAVn radiocefálica en pacientes ancianos en comparación con los más jóvenes. Al comparar los resultados según la localización de la FAVn, detectan una tasa de fracaso menor en la FAVn braquiocefálica que en la FAVn radiocefálica. Consideran que la ventaja de la conservación de sitios proximales para posibles accesos futuros que aportan las FAVn distales tiene una importancia mínima en pacientes con esperanza de vida corta. Por ello, los autores consideran que la FAVn braquiocefálica debe ser la primera opción en pacientes ancianos con corta esperanza de vida o con inicio tardío de la HD. La principal limitación del estudio es la heterogeneidad de los estudios a la hora de definir edad avanzada, que oscila entre 50 y 70 años según cada trabajo.
Por último, los artículos basados en la revisión de la bibliografía y en la opinión de expertos coinciden en considerar como principal parámetro la expectativa de vida del paciente más que un criterio de edad determinado a la hora de plantear el AV de elección. En este sentido recomiendan la realización de FAVp en los casos de pacientes con esperanza de vida inferior a los 2 años, dado que esta es la supervivencia media acumulada de la FAVp para HD132,136,170.De la evidencia a la recomendaciónLocalización preferente de la fístula arteriovenosaUso de la extremidad no dominante
Pese a la ausencia descrita de estudios al respecto, la práctica generalizada es realizar como primer AV una FAVn en la extremidad superior no dominante, basada en la suposición razonable de que el paciente preferirá tener la mano dominante libre durante la sesión de HD y también por el hecho de que interferirá menos en su actividad diaria una FAV en la extremidad no dominante.Localización distal frente a proximal
Como se ha mencionado anteriormente, en la actualidad no hay estudios que permitan una indicación inequívoca de cuál debe ser el primer AV a plantear, pese a lo que expertos y guías coinciden unánimemente en recomendar la realización de la FAV lo más distal posible para preservar la opción de futuros AV más proximales en caso necesario6,10,109,111; este criterio basado en la buena práctica clínica y de amplia aceptación es el que ha primado en la recomendación efectuada, considerando, no obstante, la posibilidad de la existencia de situaciones clínicas en las que se puedan priorizar otras consideraciones (pacientes de edad avanzada, pacientes con limitada expectativa de supervivencia en HD).
Como lógica excepción se consideran los casos en los que en la realización de una FAV proximal se pueda aprovechar la maduración del lecho venoso desarrollado con motivo de una anterior FAV de localización más distal, en cuyo caso se debe priorizar el uso de dicho lecho.Acceso vascular de elección en brazo
Tras el agotamiento de las posibilidades de FAVn en el antebrazo, el siguiente acceso a plantear es la FAV a nivel del brazo/fosa antecubital. Existen tres opciones convencionales: FAVn humerocefálica, FAVn humerobasílica o FAVp.
Actualmente, no hay discusión entre los autores acerca de la idoneidad de la FAVn (FAV humerocefálica y FAV humerobasílica) sobre la FAVp, dado sus mayores permeabilidades y su menor tasa y gravedad de las complicaciones. No obstante, actualmente existe el debate sobre los casos concretos en que la FAVp puede ser una razonable primera indicación. De acuerdo con la revisión de la bibliografía y con la opinión mayoritaria de los autores, el GEMAV ha decidido considerar la recomendación de plantear la FAVp en los casos de:
- 1.
Pacientes sin venas anatómicamente adecuadas en el brazo o el antebrazo.
- 2.
Pacientes que requieren HD urgente (implantación de una FAVp de punción inmediata).
El primer supuesto es la principal indicación para una FAVp, dada la mayor permeabilidad y el menor índice de complicaciones con respecto al CVC; en el caso de pacientes que requieran HD urgente en ausencia de una FAVn madura, la indicación de FAVp se circunscribe a los casos en que el estado general del paciente no permita asumir las consecuencias de una potencial complicación a nivel del CVC, en cuyo caso se puede indicar la realización de una FAVp de punción inmediata; no obstante se debe realizar una cuidadosa valoración del estado del paciente, ya que la colocación de una FAVp sin haber agotado el lecho venoso puede conducir al agotamiento precoz de las venas de la extremidad.
En los casos con una limitada esperanza de vida, tal y como se ha descrito previamente, hay opiniones de expertos que plantean la posible idoneidad de una FAVp electiva; la elección también se realizará de forma cuidadosa, ya que la evidencia disponible no permite establecer un valor mínimo de expectativa de vida a partir del cual indicar una FAVp, por lo que será necesario individualizar en cada situación la conveniencia de tal elección. En todo caso, no es recomendable la indicación de una FAVp en detrimento de una FAVn en casos de esperanza de vida superior a los 2 años, ya que esta es la supervivencia secundaria media de la FAVp.
Sobre la conveniencia de priorizar la FAVn humerocefálica con respecto a la humerobasílica, la evidencia disponible no detecta diferencias significativas en permeabilidad, por lo que la decisión de proponer la FAV humerocefálica como primera opción se ha basado en su menor agresividad quirúrgica, mayor comodidad para el paciente y el menor período de maduración que requieren, sobre todo cuando se comparan con las FAV humerobasílicas realizadas en dos tiempos quirúrgicos.
Por último, con respecto al acceso de segunda elección en el brazo (tras la FAV humerocefálica), estudios publicados dejan patente unas mejores tasas de permeabilidad primaria y primaria asistida para las FAV humerobasílicas, así como una menor incidencia y gravedad de infecciones, por lo que, pese a que algunos grupos no han documentado diferencias en la permeabilidad secundaria y a su mayor período de maduración, la evidencia recomienda el uso de las FAV humerobasílicas de forma prioritaria a las FAVp.Técnicas de recurso
Tras haber agotado las posibilidades de acceso a nivel de antebrazo y brazo, como alternativa al CVC tunelizado, existe la posibilidad de plantear un AV de recurso. Excepto en el caso de las FAV en el muslo, el resto de técnicas carece de la suficiente casuística para poder haber una evidencia que respalde su utilidad y seguridad en la práctica, por lo que se recomienda su uso de forma selectiva, individualizando para cada caso su indicación.Acceso vascular en miembros inferiores
Según lo comentado, el uso de FAV a nivel del muslo es una alternativa válida, avalada por la evidencia disponible, al CVC, con unos resultados de permeabilidad superponibles a las FAVp en la extremidad superior.
De entre las tres técnicas descritas (transposición de vena femoral, loop protésico en ingle y loop protésico en tercio medio de muslo), la transposición de la vena femoral superficial es la que presenta mejores permeabilidades, a costa de un mayor riesgo de isquemia y una mayor complejidad técnica, mientras que con respecto a las FAVp, el loop a nivel del tercio medio del muslo presenta, de forma no significativa, menor índice de infecciones. En todo caso, al tener cada técnica distintas ventajas e inconvenientes, no se ha establecido una recomendación sobre la técnica de elección de forma general, y son la situación clínica del paciente y sus preferencias individuales las que aconsejan su utilización.Dispositivo prótesis-catéter tunelizado
Al tratarse de una técnica relativamente reciente, no se dispone de ECA que avalen su utilidad y seguridad. La evidencia existente reporta unas tasas de complicaciones menores que los CVC, por lo que debe valorarse su indicación tras haberse agotado todas las opciones de FAV previo a la colocación de dicho catéter.
El único metaanálisis publicado hasta la fecha describe unas tasas de complicaciones sin diferencias significativas con respecto a las FAVp a nivel de extremidades inferiores, por lo que se plantea su indicación como alternativa a estas.
No obstante, al igual que con otras técnicas de recurso, actualmente no existe la suficiente evidencia como para poder indicar su uso de forma generalizada.
El orden en la secuencia de realización del AV en función de la localización y tipo de AV se resume en la figura 1.Acceso vascular preferente en el paciente de edad avanzada
Como se ha comentado en el desarrollo de la síntesis de la evidencia, hay un debate sobre el AV de primera elección en el paciente de edad avanzada, de forma que, ante la elevada tasa de fallo primario de las FAV autólogas en muñeca y dada la limitada expectativa de vida del paciente geriátrico, se discute la conveniencia de priorizar el uso de la FAVp sobre la FAVn, y de la FAVn en brazo sobre la FAVn en muñeca.
La FAVp se plantea, a priori, como una buena opción en estos pacientes, ya que presenta una baja tasa de fallo primario y acorta de forma drástica el complejo proceso de maduración; el inconveniente de sus peores tasas de permeabilidad y mayor incidencia de complicaciones quedaría minimizado por tratarse de pacientes con baja o muy baja esperanza de vida; por ello se ha incluido en las propuestas de varios autores. Pese a ello, las series en las que se validan son de un número limitado de pacientes, y los trabajos con gran número de pacientes de avanzada edad siguen confirmando los beneficios de la FAVn en todos los grupos de edad con respecto a la FAVp y al CVC, incluso en casos con importantes comorbilidades, con la posible excepción del paciente nonagenario. Por este motivo, el GEMAV considera importante establecer de forma cuidadosa las indicaciones en este grupo de enfermos, pero teniendo siempre en cuenta que el objetivo primordial sigue siendo intentar lograr una HD a través de una FAVn, incluso en los casos de edad avanzada.
Sobre la posibilidad de plantear de entrada el AV en el brazo, la evidencia disponible confirma el peor pronóstico de las FAVn de antebrazo con respecto a la población general; en cambio, es difícil y subjetivo valorar si este hecho justifica una recomendación generalizada en este sentido. En cambio, el GEMAV plantea una valoración cuidadosa del paciente de edad avanzada, mapeo ecográfico incluido, antes de decidir el tipo de FAVn a realizar; se considera que no existe la suficiente evidencia como para poder recomendar la realización de una FAVn en el brazo como primera opción en todos los casos de este grupo, si bien se aconseja de igual manera intentar evitar en la medida de lo posible la realización de FAV de dudosa viabilidad, dada la mayor trascendencia que tiene en este grupo de pacientes la morbimortalidad asociada al fracaso primario del AV. Como ya se ha comentado, se considera el mapeo ecográfico como la herramienta de mayor utilidad en este sentido.
Por último, el GEMAV considera que no se puede establecer un límite cronológico para la inclusión del paciente en la categoría de edad avanzada; esto se debe, por un lado, a la gran heterogeneidad en los criterios de inclusión de los principales estudios, que oscilan entre 50 y 90 años de edad, y, por otro, a la subordinación del criterio de edad al criterio de expectativa de vida; este último es el factor que más trascendencia tendrá en el momento de la indicación del AV.
R 2.5.1) Como primer acceso vascular se recomienda crear una fístula arteriovenosa nativa lo más distal posible, en la extremidad superior no dominante
R 2.5.2) Tras agotar el acceso vascular radiocefálico a lo largo del antebrazo, se recomienda la fístula arteriovenosa nativa realizada con las venas disponibles a nivel de codo, siendo la fístula arteriovenosa humerocefálica o radiocefálica proximal la primera alternativa a considerar
R 2.5.3) Si no se puede realizar una fístula arteriovenosa radiocefálica o humerocefálica, se recomienda la realización de una fístula arteriovenosa humerobasílica con superficialización o transposición venosa en el brazo o antebrazo, como opción previa a la utilización de una fístula arteriovenosa protésica
R 2.5.4) Se recomienda que la fístula arteriovenosa protésica en la extremidad superior se limite a los siguientes supuestos:
- A.
Pacientes sin venas anatómicamente adecuadas en el brazo o antebrazo
- B.
Pacientes que requieren hemodiálisis de modo inmediato y se quiere evitar la implantación de un catéter venoso central tunelizado
R 2.5.5) Si ha fracasado una fístula arteriovenosa previa, se recomienda que la decisión del lugar anatómico de la creación de la siguiente fístula arteriovenosa sea consensuada con el paciente, para decidir si se da prioridad al criterio de cuanto más distal mejor o al criterio de extremidad no dominante
R 2.5.6) En los casos en los que se han agotado los accesos vasculares a nivel de ambas extremidades superiores, se sugiere el empleo de las técnicas de recurso, priorizando la fístula arteriovenosa protésica a nivel de muslo y el dispositivo prótesis-catéter tunelizado como primeras opciones a considerar
Una de las complicaciones más importantes asociada al AV es la infección, que en muchas ocasiones deriva en la pérdida de este. A este hecho se añade que, al tratarse de estructuras superficiales, la infección de la herida quirúrgica puede condicionar la infección de la FAV con relativa facilidad.
La FAVn, no obstante, presenta una tasa muy baja de infección perioperatoria, por lo que no hay evidencia que justifique la profilaxis preoperatoria sistemática en estos pacientes.
En cambio, en las FAVp se describe una mayor incidencia y gravedad de las infecciones, que en muchos casos obliga a su retirada en un paciente que tiene unas posibilidades muy limitadas para realizar nuevos AV. Los microorganismos que con mayor frecuencia colonizan o infectan la FAVp suelen formar parte de la microbiota cutánea (estafilococos, estreptococos y corinebacterias), el más frecuente es Staphylococcus aureus. Por esta razón, numerosos estudios abogan por la administración preoperatoria de antibióticos profilácticos; la pauta más aceptada es una dosis única de vancomicina133,182.
3CUIDADOS DE LA FÍSTULA ARTERIOVENOSACONTENIDO
3.1. Cuidados en el período posquirúrgico inmediato
3.2. Cuidados en el período de maduración
3.3. Utilización de la fístula arteriovenosa
3.4. Cuidados de la fístula arteriovenosa por parte del paciente en el período interdiálisis
3.5. Tratamiento antiagregante de la fístula arteriovenosaPreámbulo
Los cuidados de la fístula arteriovenosa (FAV), tanto la nativa (FAVn) como la protésica (FAVp), incluyen todas las actuaciones realizadas por el equipo multidisciplinar y el propio paciente, que tienen como principal objetivo conseguir el desarrollo óptimo y el mantenimiento adecuado del acceso arteriovenoso (AV). Los cuidados han de comenzar en el período posquirúrgico inmediato, y continuar durante el
3.1Cuidados en el período posquirúrgico inmediatoRecomendaciónLa monitorización estricta del paciente con una FAV recién creada debe permitir la prevención y el diagnóstico precoz de todas las complicaciones que puedan aparecer y aplicar el tratamiento oportuno. Entre las principales complicaciones asociadas con la creación del AV se encuentran la hemorragia, el seroma, la infección, la isquemia distal, la neuropatía y la trombosis.
En el quirófano, una vez realizada la FAV, antes de dar por concluido el procedimiento quirúrgico, el cirujano debe comprobar la presencia del pulso periférico y la función de la FAV mediante la palpación del thrill (vibración o frémito)183.
Una FAV funcionante tiene un frémito palpable y un soplo audible a la auscultación a nivel de la anastomosis. Si existe duda sobre su funcionamiento, puede realizarse una ecografía Doppler (ED)183 para demostrar su permeabilidad. En este sentido, algunos autores han propuesto la flujometría intraoperatoria184. Asimismo, se ha descrito que la ausencia de soplo al finalizar el procedimiento junto con valores de velocidad final diastólica < 24,5cm/s, obtenidos mediante ED intraoperatoria, constituyen un test predictivo eficaz de trombosis de la FAV, mejor que la ausencia de frémito185.
Es importante que el cirujano incluya en la historia clínica del paciente un esquema claro del AV que acaba de construir. Cuanto mejor sea el conocimiento de la FAV por parte del personal de enfermería, más posibilidades de conseguir una canulación exitosa y una mayor supervivencia del AV184.
La mayoría de las FAV pueden implantarse en régimen de cirugía mayor ambulatoria sin requerir ingreso hospitalario. Durante el tiempo que el paciente permanezca en el centro sanitario hay que vigilar principalmente la aparición de alguna de las tres complicaciones más importantes: hemorragia, isquemia y trombosis de la FAV.Cuidados en el postoperatorio inmediato
- 1.
Monitorizar las constantes vitales. Debe determinarse la presión arterial (PA), la frecuencia cardíaca y la temperatura corporal. Nunca se medirá la PA en el brazo de la FAV183,186. Hay que mantener siempre la estabilidad hemodinámica del paciente minimizando el riesgo de trombosis de la FAV183,186.
- 2.
Exploración física de la FAV (v. apartado “Monitorización y vigilancia del acceso vascular”). Se debe comprobar la existencia de soplo y frémito de la FAV para detectar fallos y trombosis precoz de esta. Existen diferentes factores preoperatorios asociados con una menor permeabilidad inmediata tras la creación de una FAVn, asociados a la edad mayor de 65 años, al sexo femenino, la diabetes, la enfermedad coronaria o los antecedentes patológicos del paciente relacionados con vasculopatía periférica, que se discuten en el apartado 1 de esta guía58,185,187,188.
En el caso de la FAVp, Monroy-Cuadros et al observan una menor supervivencia en pacientes con los antecedentes clínicos anteriormente mencionados y un flujo de acceso (QA) < 650ml/min al inicio de las primeras punciones189. Valores de QA < 500ml/min en la FAVn suponen un factor de riesgo independiente asociado a una menor permeabilidad primaria71.
- 3.
Control del apósito para la detección de signos de hemorragia. No se colocarán apósitos compresivos en el brazo de la FAV.
- 4.
Mantener elevada la extremidad de la FAV reposando sobre una almohada, para favorecer la circulación de retorno y evitar la aparición de edema183,186.
- 5.
Examinar la extremidad de la FAV y el estado circulatorio del paciente. Se deben palpar los pulsos distales de la extremidad donde está localizada la FAV y comprobar el relleno capilar de los dedos. Observar las zonas distales de la extremidad para descartar signos de isquemia como aparición de dolor, frialdad, palidez y alteraciones sensitivas y motoras de la mano afectada.
El síndrome de hipoperfusión distal (síndrome de robo) asociado al AV durante el postoperatorio es una complicación infrecuente pero importante. Está causado por un descenso brusco de la presión de perfusión distal debido a la aparición de un flujo preferente o desvío del flujo arterial por el AV, que produce una isquemia sintomática en la extremidad afectada. Es más frecuente en la FAVn de brazo, con una incidencia superior a la de la FAV de antebrazo o radiocefálica, siendo la incidencia de entre el 1 y el 20%85,87,87a,87b (v. apartado “Complicaciones del acceso vascular”). Aunque menos frecuente, puede estar ocasionado por una obstrucción de la arteria proximal a la anastomosis debida a un fallo técnico.
Si se palpa un pulso distal a la FAV, se debe hacer el diagnóstico diferencial con la neuropatía monomiélica isquémica (NMI). Se trata de una patología neurológica que afecta a los tres nervios del antebrazo, nervio radial, ulnar y mediano, sin otros signos sugestivos de isquemia arterial. Los principales factores de riesgo para el síndrome de robo arterial y la NMI son comunes (diabetes, sexo femenino y flujo arterial braquial). En cualquier caso, la mano isquémica de una FAV, ya sea por síndrome de robo arterial o por la existencia de una NMI, puede hacer necesaria la realización de un procedimiento de revascularización o la ligadura completa de la FAV190.
- 6.
Vigilar la aparición de hemorragia y/o hematoma quirúrgico (tema que se trata en el apartado 5), y valorar si es necesaria una revisión quirúrgica inmediata. Aunque las complicaciones hemorrágicas son poco frecuentes, no se ha de olvidar que se trata de una cirugía en la que se ve implicada una anastomosis vascular y, por tanto, es importante verificar la ausencia de hematoma en la zona intervenida, que podría obligar a la revisión urgente del AV antes del alta hospitalaria191.
Cuidados iniciales durante el seguimiento ambulatorio
El primer control ambulatorio se efectuará a partir de los 7 días de la intervención. Según el estado de la herida, se puede sustituir la sutura por tiras adhesivas de aproximación durante unos días más o bien retirar la mitad de los puntos de forma alterna. Conviene revisar y ajustar la medicación antihipertensiva para evitar episodios de hipotensión arterial y reducir al máximo el riesgo de trombosis de la FAV191.
En esa visita se debe valorar la permeabilidad de la FAV y descartar la presencia de complicaciones. Se realizará la exploración de la piel y tejido subcutáneo para descartar signos de infección, que puede ocurrir entre el 1 y el 5% de los casos192. Si se observa tumefacción, eritema, celulitis o induración de la piel, la ED nos puede ayudar a diagnosticar la patología concreta existente. El tratamiento de las complicaciones se discute en el apartado 5.
En el caso de edema en el brazo de la FAV, es conveniente descartar la existencia de una hipertensión venosa. Esta complicación ocurre en el 3% de los pacientes y está normalmente relacionada con una estenosis venosa central secundaria a la implantación previa de un CVC190.
Por otro lado, en pacientes con ERCA estadio prediálisis, los episodios de descompensación de insuficiencia cardíaca tras la realización de una FAVn no son infrecuentes. Se han reportado tras la cirugía del AV hasta un 17% de casos de insuficiencia cardíaca en pacientes con ERC estadios 4-5 en relación con un aumento del gasto cardíaco10,193. Se debe sospechar cuando el flujo de la FAV es > 2 l/min o ≥ 30% del gasto cardíaco190,194. En el apartado 5 se encuentra descrito con detalle.
El personal médico y de enfermería es el encargado de informar al paciente de las características de la FAV, la importancia que tiene para el futuro tratamiento de hemodiálisis (HD) y de los autocuidados que deben prestar a su FAV recién creada (v. plan de autocuidados en la sección 3.4. de este apartado)191.
3.2Cuidados en el período de maduraciónRazonamiento
Una maduración insuficiente de la FAVn puede aumentar la incidencia de las complicaciones relacionadas con su punción (hematomas, trombosis) y reducir su supervivencia. Además, una FAVn inmadura en el momento de la primera punción puede obligar a implantar un CVC en el paciente incidente para iniciar el programa de HD o bien retrasar la retirada de este en el paciente prevalente. Por tanto, es importante establecer estrategias que favorezcan el proceso de maduración para que la FAVn sea puncionable en el momento oportuno.
Recomendaciones(•) nueva R 3.2.1) Se sugiere la realización de ejercicios antes y después de la creación de la fístula arteriovenosa nativa para favorecer su maduración
(•) nueva R 3.2.2) Se recomienda no iniciar la punción antes de las 2 semanas de la creación de la fístula arteriovenosa nativa e individualizar en cada paciente el momento idóneo para efectuar la primera punción
(•) nueva R 3.2.3) Se recomienda iniciar la punción de una fístula arteriovenosa protésica entre las 2 y 4 semanas de su construcción excepto en las de punción inmediata
→ Pregunta clínica VI ¿Son útiles los ejercicios en el desarrollo de las fístulas arteriovenosas nativas?
(Ver ficha de la Pregunta clínica VI en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Son muy pocos los estudios que presentan datos de la eficacia del ejercicio para mejorar la maduración o la supervivencia de la FAVn. De las guías de práctica clínica existentes, solo las K/DOQI recomiendan los ejercicios de dilatación en la FAVn10 | |
| Respecto al ejercicio previamente a la cirugía hay descritos tres estudios de diseño observacional y con la participación de pocos pacientes. En dos de estos estudios se basa la guía K/DOQI. Todos ellos presentan un aumento del calibre venoso | Calidad muy baja |
| En cuanto al ejercicio tras la realización de la FAVn, un ensayo clínico aleatorizado nacional ha objetivado recientemente una maduración significativamente superior mediante criterios clínicos, pero sin diferencias en los criterios de maduración por ED | |
En el estudio de Leaf et al195 se demostró que la realización de un programa simple de ejercicios puede producir un aumento significativo en el diámetro de la vena cefálica previamente a la creación del AV (n = 5). El diámetro de la vena cefálica del brazo ejercitado aumentó significativamente en comparación con el brazo control cuando se medía tanto con la ausencia (0,048 ± 0,016 frente a 0,024 ± 0,023cm2) como con la presencia de torniquete (0,056 ± 0,022 frente a 0,028 ± 0,027cm2).
Oder et al196 analizaron la repercusión del ejercicio físico en 20 pacientes previamente a la cirugía. El cambio medio observado en el diámetro de la FAVn fue de 0,051cm o del 9,3% (p < 0,0001).
En el estudio de Uy et al197 se incluyeron 15 pacientes con pequeño diámetro de la vena cefálica (< 2,5mm). Tras 4 semanas de ejercicio, la media en el diámetro de la vena aumentó significativamente (p < 0,05), tanto a nivel proximal (1,66 a 2,13mm) como distal (2,22 a 2,81mm).
En el estudio prospectivo y aleatorizado de Salimi et al198 se analizó la influencia de una tabla reglada de ejercicios sobre la maduración de la FAVn en 50 pacientes en programa de HD (25 pacientes en grupo control). Se realizaron controles mediante ED a las 24h y a las 2 semanas tras la creación del AV. En el grupo de estudio se observaron, tras la realización de ejercicio, aumentos significativos del diámetro de la vena eferente, del grosor de la pared, del área venosa y del QA. A pesar de que no se obtuvieron diferencias significativas en cuanto a los criterios de maduración ecográfica, se observó una significativa mayor maduración por criterios clínicos. Entre sus efectos beneficiosos destaca además del aumento del diámetro venoso, la masa muscular, así como la disminución en la cantidad de tejido adiposo.
Fontseré et al199 efectuaron un estudio prospectivo aleatorizado y controlado sobre el efecto de un programa postoperatorio en la maduración de la FAVn al cabo de 1 mes de su construcción en 69 enfermos con ERC en la fase de prediálisis (65,2%) o en programa de HD crónica. Al cabo de 1 mes se realizó una valoración utilizando criterios de adecuada maduración clínica (enfermera especializada) y ecográfica (QA > 500ml/min, diámetro > 5mm y profundidad < 6mm) en todos los pacientes. Las tasas de maduración clínica y ecográfica después de 1 mes de la construcción de la FAVn fueron del 88,4 y el 78,3%, respectivamente (índice kappa = 0,539). El grupo de ejercicio presentó una tendencia no significativa a una mejor maduración clínica y ecográfica respecto al grupo control (el 94,7 frente al 80,6%; p = 0,069; el 81,6 frente al 74,2%; p = 0,459). El análisis de regresión logística identificó la localización de la FAVn como un factor de confusión, de modo que en las FAVn distales el grupo de ejercicio presentó una maduración clínica significativamente superior, aunque no ecográfica (odds ratio [OR]: 5,861, intervalo de confianza [IC] del 95%, 1,00634,146, y OR: 2,403, IC del 95%, 0,66-8,754, respectivamente)199.De la evidencia a la recomendación
A pesar de que existen pocos estudios al respecto, el ejercicio isométrico de la extremidad de la FAVn, antes y/o después de su construcción, puede favorecer el proceso de maduración de la FAVn.
El GEMAV sugiere aconsejar a los pacientes con ERCA la realización de ejercicios antes y después de la realización de la FAVn, con el objetivo de favorecer el desarrollo muscular y vascular y, en consecuencia, poder acelerar el proceso de maduración, aumentar la permeabilidad y el desarrollo del AV y reducir la morbilidad asociada al déficit de maduración.
No obstante, se necesitan más estudios que analicen las ventajas de la realización de ejercicio como factor favorecedor del correcto proceso de maduración de la FAVn.
Recomendación→ Pregunta clínica VII ¿Cuál es el tiempo mínimo de maduración de una fístula arteriovenosa nativa o protésica para ser puncionada?
(Ver ficha de la Pregunta clínica VII en enlaces electrónicos)Razonamiento
El período de maduración del AV es el tiempo necesario que transcurre desde la creación de la FAV hasta el momento de poder realizar una primera sesión de HD con el mínimo riesgo de complicaciones derivadas de la punción. A pesar de que el momento de inicio de la punción resulta un tema controvertido, tanto en la FAVn como en la FAVp, se acepta que la utilización excesivamente precoz de cualquier FAV puede ocasionar una reducción significativa de su supervivencia en relación con las complicaciones asociadas. Por tanto, es muy importante determinar el momento idóneo para iniciar la punción de la FAV.
En el apartado 2 se discuten los criterios de la FAV madura. La falta de maduración de una FAVn se ha relacionado con: a) insuficiente dilatación arterial, presente en pacientes con enfermedad vascular grave y diabetes mellitus en el contexto de arteriosclerosis acelerada; b) déficit en la vasodilatación venosa secundaria a la existencia de circulación venosa colateral; c) presencia de una estenosis central, y d) desarrollo de hiperplasia neointimal acelerada secundaria a la estenosis yuxtaanastomótica tras el procedimiento quirúrgico en áreas de baja fuerza tangencial58,187,188.
| Resumen de la evidencia | |
|---|---|
| Solo existen dos estudios observacionales, que sugieren que, mientras que la canalización de una FAVn no sería aconsejable antes de 2 semanas de su creación, una primera punción entre 2 y 4 semanas podría ser valorada tras una estrecha evaluación clínica, sin que ello aumentase necesariamente el riesgo de fracaso de la FAVn. En el caso de las FAVp, teniendo en cuenta su habitual composición de politetrafluoruroetileno expandido, no se recomienda su punción antes de las 2 semanas, por el elevado riesgo de ocasionar hematomas. A partir de esta fecha, las punciones de la FAVp deben iniciarse entre las 2 y las 4 semanas de su construcción, excepto las de punción inmediata, una vez que ya ha desaparecido la tumefacción del tejido subcutáneo y se puede palpar sin dificultad todo el trayecto de esta | Calidad baja |
Desarrollo de la síntesis de la evidencia
Respecto a esta pregunta, tan solo existen dos estudios observacionales200,201. El primero, basado en los datos aportados por el estudio DOPPS (Dialysis Outcomes and Practice Patterns Study), evidenció que la primera punción de las FAVn se realizó antes de transcurridos 2 meses de su construcción en el 36% de los pacientes norteamericanos, el 79% de los europeos y el 98% de los japoneses200. En el estudio de Rayner et al201, la punción de una FAVn antes de 2 semanas tras su creación se asoció a una disminución significativa de su supervivencia, con un riesgo relativo de 2,27 (p = 0,02). Los estudios DOPPS200,201 sugieren que, mientras que la canalización de una FAVn no sería aconsejable antes de 2 semanas de su creación, una primera punción entre 2 y 4 semanas podría ser valorada tras una estrecha evaluación clínica, sin que ello aumentase necesariamente el riesgo de fracaso de la FAVn.
En el caso de las FAVp, según los datos aportados por el estudio DOPPS200, el inicio de la punción ocurre entre las 2 y 4 semanas en el 62% de los pacientes norteamericanos, el 61% de los europeos y el 42% de los japoneses. En dicho estudio no se evidenciaron reducciones significativas de su supervivencia tras el inicio de las punciones antes de 2 semanas o después de 4 semanas tras la implantación quirúrgica, tomando como referencia el subgrupo de 2-3 semanas. Sin embargo, no se recomienda la punción de una FAVp de politetrafluoruroetileno antes de las 2 semanas de su construcción, por el alto riesgo de provocar un hematoma. Excepto las FAVp de punción inmediata, el resto de FAVp pueden puncionarse habitualmente entre 2 y 4 semanas de su construcción una vez ya ha desaparecido el edema subcutáneo y el injerto puede palparse con facilidad en toda su extensión.De la evidencia a la recomendación
En el caso de las FAVn se recomienda que no se inicien las punciones antes de las 2 semanas tras su creación. A partir de esta fecha hay que individualizar los riesgos de cada paciente para decidir el momento idóneo para realizar la primera punción.
En los pacientes portadores de FAVp se recomienda que el inicio de las punciones sea entre 2 y 4 semanas de su construcción, excepto en las de punción inmediata. En este subgrupo de pacientes resulta importante conocer el tipo de material protésico utilizado.
R 3.2.2) Se recomienda no iniciar la punción antes de las 2 semanas de la creación de la fístula arteriovenosa nativa e individualizar en cada paciente el momento idóneo para efectuar la primera punción
R 3.2.3) Se recomienda iniciar la punción de una fístula arteriovenosa protésica entre las 2 y 4 semanas desde su construcción, excepto en las de punción inmediata
nueva R 3.3.1) Se recomienda efectuar una exploración física completa de la fístula arteriovenosa en todos los controles de la consulta de enfermedad renal crónica avanzada, para valorar su grado de maduración y detectar precozmente cualquier patología intercurrente antes de la primera punción
nueva R 3.3.2) Se recomienda efectuar una ecografía Doppler ante toda fístula arteriovenosa nativa con un desarrollo insuficiente evidenciado mediante la exploración física en la consulta de enfermedad renal crónica avanzada
nueva R 3.3.3) Se recomienda seguir estrictamente todas las medidas universales de asepsia durante las punciones de la fístula arteriovenosa para evitar la aparición de infecciones
(•) nueva R 3.3.4) Se recomienda utilizar la técnica de punción escalonada como método de punción de la fístula arteriovenosa protésica
(•) nueva R 3.3.5) Se recomienda utilizar la técnica de punción escalonada como método de punción preferente de la fístula arteriovenosa nativa
(•) nueva R 3.3.6) Se recomienda reservar la técnica de punción en ojal (buttonhole) como método de punción para las fístulas arteriovenosas nativas tortuosas, profundas y/o con un tramo venoso de longitud muy limitado
Se ha descrito una relación directa entre un inicio demasiado prematuro de la punción de una FAVn y una menor supervivencia202,203. Únicamente debe puncionarse una FAV cuando ha alcanzado un nivel óptimo de maduración. Por todo ello hay que monitorizar la FAVn en todas las visitas de la consulta de ERCA y, si se evidencia un desarrollo insuficiente, es preciso explorar la FAVn mediante ED para efectuar el diagnóstico y aplicar el tratamiento correctivo mediante angioplastia transluminal percutánea (ATP) y/o cirugía.Exploración básica previa a realizar antes de la primera punción de la fístula arteriovenosa
La exploración física es el método utilizado más frecuentemente para monitorizar la FAVn en la consulta de ERCA para la detección precoz de un déficit de maduración e intentar identificar su causa. Diferentes estudios han evidenciado que su realización exhaustiva muestra tanto una elevada capacidad diagnóstica como una extraordinaria relación costebeneficio en la detección de estenosis significativas o de circulación venosa colateral204,205. La sistemática de la exploración física se describe en el apartado 4.
La ED es una herramienta imprescindible en la consulta de ERCA, que debe utilizarse tanto para efectuar el mapeo vascular prequirúrgico como para identificar la causa de todo déficit de maduración posquirúrgico evidenciado mediante la exploración física. Ante toda FAVn con una insuficiente maduración clínica y que presenta una alta probabilidad de no poder utilizarse para efectuar la primera sesión de HD, el GEMAV considera la necesidad de efectuar la ED para diagnosticar la causa concreta de la falta de maduración. El objetivo es efectuar la reparación endovascular y/o quirúrgica de toda FAVn inmadura en la fase prediálisis, para que pueda ser puncionada en la primera sesión de HD.Asepsia en la punción de la fístula arteriovenosa. Uso de anestésicos locales
No hay que olvidar que la canulación de la FAV es un procedimiento invasivo y, por tanto, hay que extremar las medidas de asepsia. Antes de la colocación del campo estéril y de la desinfección de la zona de punción, es necesario lavar, con agua y jabón, el brazo o el área de punción en la pierna haciendo mayor hincapié en el caso de que los pacientes hayan utilizado pomada anestésica y ante la presencia de aneurismas muy prominentes. Para la desinfección se puede utilizar clorhexidina alcohólica, alcohol al 70% o povidona yodada. La primera hace efecto a los 30 s y persiste su efecto hasta 48h. El alcohol tiene un efecto bacteriostático más corto y debería aplicarse 1min antes de la punción. La povidona requiere 2-3min para desarrollar plenamente su capacidad bacteriostática. En una encuesta internacional realizada en 171 centros de HD sobre 10.807 canulaciones con dos agujas en pacientes dializados mayormente por FAVn (91%), se utilizó un desinfectante a base de alcohol para la mayoría de canulaciones (69,7%) y se evidenciaron ciertas preferencias específicas según el país considerado: la clorhexidina en Reino Unido, Irlanda, Italia y Sudáfrica, y la povidona yodada en España206.
Algunos enfermos con hipersensibilidad al dolor en la punción de la FAV pueden beneficiarse de los anestésicos locales de uso tópico. Los más utilizados son la asociación de lidocaína con prilocaína (crema) y el cloruro de etilo (espray), que tienen que aplicarse, en relación con el momento de la punción, 1h antes como mínimo y 20 s antes, respectivamente. En el mismo estudio de Gauly et al, el uso de anestésicos locales fue infrecuente (globalmente, en el 8,5% de los casos), excepto en Reino Unido, Irlanda y España, donde el 29,4, 31,7 y 27,2% de punciones fueron realizadas con la aplicación previa de estos, respectivamente206.Características de las agujas de diálisisTipos de agujas
Las agujas de HD pueden tener la punta afilada o bien roma. Tienen un revestimiento de silicona para facilitar su inserción y reducir su resistencia al QA207. El acceso a la circulación sanguínea a través de la FAV para efectuar la sesión de HD puede alcanzarse mediante dos agujas de estructura distinta207: a) aguja convencional de acero inoxidable; es el tipo de aguja más utilizada; b) catéter-fístula; compuesta por una cánula de poliuretano y una aguja metálica interior destinada a la punción de la FAVn. Tras la retirada de la aguja, la cánula queda introducida en el interior de la vena arterializada durante toda la sesión de HD208–210. Este tipo de cánula puede reducir el dolor, tanto durante la punción como en la retirada de la aguja209, así como disminuir el riesgo de extravasaciones y hematomas208, sobre todo en caso de FAVn en la flexura del codo en pacientes de edad avanzada.Calibre y longitud de las agujas
La prescripción de la HD debe adaptarse al tipo de aguja utilizado211. Como regla general se debe seleccionar siempre la aguja de menor calibre y de menor longitud que permita un flujo sanguíneo (QA) adecuado para las necesidades específicas de cada paciente212.
En relación con el calibre de la aguja, están disponibles agujas desde 17 G hasta 14 G, siendo su numeración inversa al calibre, es decir, la aguja de 17 G presenta el calibre mínimo y, por contra, la aguja de 14 G presenta el calibre máximo213. Después de efectuar las primeras punciones de una FAVn sin complicaciones, la elección de un calibre superior de aguja (numeración inferior) depende del diámetro de la vena arterializada y del QA existente213. En el estudio de Gauly et al, el calibre de aguja utilizado con mayor frecuencia fue el de 15 G (61,3%), seguido del de 16 G en un tercio de los casos; las agujas de 14 y 17 G fueron utilizadas en menos del 3% de los casos206.
Por otra parte, la longitud de la aguja que debe seleccionarse debe ser la más corta necesaria para alcanzar la zona central de la luz de la FAV y reducir de esta forma el riesgo de perforar su pared posterior213.
Solo si tenemos en cuenta la relación existente entre un calibre determinado de aguja, la velocidad máxima de la bomba de sangre y la duración de la sesión de HD podremos utilizar una FAVn de forma aceptable sin causar hematomas211. De nuevo, en la encuesta de Gauly et al, cuando se utilizaron calibres mayores de aguja (14 G), la mayoría de enfermos fueron dializados mediante un flujo de la bomba (QB) elevado (> 400ml/min) y, por contra, cuando se utilizaron calibres de aguja pequeños (17 G), más del 80% de los pacientes se dializaron con un QB ≤ 300ml/min206.Fenestración de la aguja arterial
En el estudio de Gauly et al, la aguja arterial utilizada fue fenestrada en la mayoría de los casos (65%)206. La aguja arterial con fenestración debería utilizarse siempre para maximizar el flujo aspirado por esta y evitar la adhesión del bisel a la pared del vaso por la presión negativa, con el riesgo de lesión de este10,212.Primeras punciones de una nueva fístula arteriovenosa nativa
Utilizar la aguja de menor calibre disponible (habitualmente, 17 G)10. La elección de este calibre de aguja “arterial” asegura un flujo de sangre suficiente para satisfacer una demanda de 200ml/min desde la bomba de la máquina de HD y, simultáneamente, se minimiza el hematoma resultante si se produce extravasación durante la sesión de HD213. Se recomienda la monitorización de la presión arterial prebomba (–250mmHg o menor) para asegurar que la velocidad de la bomba de sangre no exceda la que pueda proporcionar la aguja “arterial”10.Punción de la fístula arteriovenosa. MetodologíaPunción de la fístula arteriovenosa
Todos los profesionales dedicados al cuidado del enfermo renal son conscientes de la dificultad existente para lograr que el paciente incidente se dialice mediante una FAVn madura desde la primera sesión de HD214. Quizá el mayor escollo se encuentra en el período de maduración pero, sin duda, el último obstáculo realmente decisivo que hay que salvar para que la FAVn se pueda utilizar para la HD es su canulación214. Una punción inadecuada de la FAVn nos puede obligar a implantar un CVC para efectuar la primera sesión de HD y, por tanto, todo el trabajo previo realizado en la fase prediálisis para conseguir el mejor AV para iniciar programa de HD se habrá perdido.
Existe una interrelación entre las prácticas de canulación (técnica utilizada, calibre de la aguja, dirección de la aguja arterial), los factores propios del paciente (edad, comorbilidad) y el factor centro (QB, duración de la sesión), todos los cuales pueden influir sobre uno de los aspectos clave en todo programa de HD en el enfermo prevalente: la supervivencia de la FAV215,216. En este sentido, Parisotto et al217, aplicando un modelo de regresión multivariado de Cox sobre los resultados de una encuesta internacional referida a las prácticas de canulación (n = 7.058, mayoría de FAVn), evidenciaron que la supervivencia de la FAV fue significativamente inferior en caso de HD a través de FAVp, tamaño pequeño de la aguja (16 G), quizá debido al daño endotelial generado por la mayor velocidad de la sangre de retorno, dirección retrógrada de la aguja arterial y punción con el bisel hacia abajo, QB < 300ml/min, presión venosa < 100mmHg (quizá por presencia de una estenosis del inflow) o progresivamente creciente (quizá por presencia de una estenosis del outflow) y, finalmente, compresión del brazo en el momento de la canulación ausente o utilizando un torniquete (en relación con la compresión del brazo por el propio paciente). Por otra parte, la supervivencia de la FAV fue significativamente mayor si la punción se efectuó mediante la técnica escalonada o bien el método del ojal en relación con el método del área217.
La canulación venosa repetida por sí sola puede llegar a dañar la FAV debido al microtraumatismo directo de la punción y/o al incremento del daño endotelial ocasionado por las fuerzas de cizallamiento creadas durante el retorno sanguíneo207,211,212,218. Estos factores pueden estimular el desarrollo de la hiperplasia de la íntima, que puede repercutir en la disminución de la permeabilidad de la FAV y, probablemente también, en la supervivencia del paciente207,211,212,218. En este sentido, el Frequent Hemodialysis Network Trial Group ha efectuado dos ensayos controlados y aleatorizados: a) ensayo diurno, que compara pacientes en HD en un centro durante el día (6 días a la semana) y pacientes en HD convencional (3 días a la semana) durante 1 año; b) ensayo nocturno, que compara pacientes en HD domiciliaria durante la noche (6 noches por semana) y pacientes en HD convencional (3 días por semana) durante 1 año218. En ambos ensayos, diurno y nocturno, la pauta de HD de 6 veces por semana aumentó significativamente el riesgo de complicaciones de la FAV en relación con la pauta de HD de 3 veces por semana. La conclusión de los autores es que la HD frecuente aumenta el riesgo de complicaciones del AV, en gran parte a causa de la necesidad de más procedimientos de reparación en pacientes con FAV. Es decir, el uso más frecuente de la FAVn por sí mismo causa disfunción del AV218.
Las prácticas de canulación son factores clave en el proceso de cuidado y atención de la FAV. Una técnica inadecuada de canulación de la FAV puede provocar complicaciones a corto y largo plazo, como infiltración-hematoma, infección, formación de aneurismas y dolor en el sitio de la punción que ocasiona situaciones de ansiedad y miedo en el paciente, que se traducen a menudo en una negativa para retirar el CVC207,211,212. Estas complicaciones tienen una serie de consecuencias directas como la necesidad de punciones extra adicionales, sesiones de HD subóptimas o perdidas, malestar del paciente por la interrupción de su régimen de tratamiento regular y la necesidad de sesiones más largas, necesidad del uso del CVC como puente para la creación y maduración de una nueva FAV, aumento de hospitalizaciones e intervenciones y mayores costes de tratamiento de HD207,211,212. Estas complicaciones y sus consecuencias pueden disminuir la permeabilidad del AV y la supervivencia del paciente207,211,212.
Lee et al analizaron los factores de riesgo y las consecuencias de las extravasaciones ocasionadas por la punción de la FAVn comparando 47 pacientes con una infiltración de la FAVn suficientemente importante para prolongar la dependencia del CVC para HD y 643 pacientes en el grupo de control sin infiltración de la FAVn208. Estos autores evidenciaron que la infiltración de la FAVn ocasionada por las agujas es más común en pacientes ancianos (edad igual o superior a 65 años) y con FAVn recientes (inferior a 6 meses)208. Además, como consecuencia de estas infiltraciones se efectuaron numerosos estudios diagnósticos e intervenciones sobre la FAVn, se registró un porcentaje no despreciable de trombosis (26%) y se necesitó prolongar la dependencia del CVC durante más de 3 meses208. Finalmente, se estimó en 8 millones de dólares anuales la repercusión económica de la bacteriemia por CVC relacionada con el aumento de los días de dependencia al CVC secundaria a la infiltración grave de la FAVn208.
Van Loon et al publicaron en el año 2009 dos estudios observacionales prospectivos (desde la primera canalización hasta los 6 meses de seguimiento) en pacientes incidentes en HD con FAVn y FAVp utilizando la técnica de punción escalonada219,220. En la mayoría de los pacientes se registraron errores en la punción (definidos como la necesidad de utilizar más de una aguja para la conexión arterial o venosa) entre 1 y 10 veces, siendo siempre mayor el porcentaje de estos errores para FAVn que para FAVp219. A pesar de que en el 37% de los pacientes con FAVn y en el 19% de los pacientes con FAVp se registraron errores en la punción en más de 10 ocasiones, la punción ecodirigida de la FAV se utilizó solo en el 4% de los pacientes219. El porcentaje de pacientes con hematoma secundario a la canulación inadecuada fue siempre mayor para FAVn que para FAVp, así como también mayor para la FAV del brazo en relación con el antebrazo219. En el modelo de regresión múltiple aplicado, las complicaciones relacionadas con la canulación (necesidad de utilizar un CVC o de efectuar la sesión de HD mediante unipunción) fueron predictivas de trombosis de la FAV219. Además, estos autores demostraron que estas complicaciones dependen del tipo de FAV existente, de modo que el porcentaje de FAV sin complicaciones fue siempre significativamente menor para FAVp que para FAVn220.
Desde hace varios años se recomienda la utilización del ED portátil en todas las unidades de HD de España216. No cabe duda de que la punción ecodirigida es una herramienta de inestimable ayuda para la canulación exitosa de toda FAVn dificultosa y, por tanto, permite reducir los errores en la punción221,222. En una serie nacional referida a 119 exploraciones por ED portátil realizadas por un mismo nefrólogo sobre 67 FAV, se identificaron 31 estenosis no sospechadas previamente sobre 44 casos de dificultad en la punción223.Metodología de la punción de la fístula arteriovenosa
- •
La FAV debe utilizarse exclusivamente para efectuar el tratamiento de HD.
- •
La punción de toda FAV debe efectuarse exclusivamente por el personal de enfermería especializado de las unidades de HD, que ha demostrado un nivel elevado de conocimiento y habilidad específica222.
- •
Las punciones iniciales de toda FAV nueva deben ser realizadas exclusivamente por miembros experimentados del personal de enfermería de la unidad de HD212,213,222,224,225.
- •
Todas las incidencias relacionadas con la punción deben ser registradas para ser investigadas y adoptar las medidas correctoras oportunas que garanticen que el paciente reciba la mejor atención nefrológica posible213,225.
- •
Múltiples intentos infructuosos de punción efectuados por un mismo canulador constituyen una práctica inaceptable213.
- •
Previamente a la punción de la FAV es preciso conocer su tipo, su anatomía y la dirección del QA para programar las zonas de punción. Para ello, es de gran utilidad la existencia de un mapa de la FAV en la historia clínica del paciente. Todo el personal de enfermería que punciona por primera vez una FAV debe conocer previamente el mapa de esta para realizar una punción adecuada.
- •
Antes de iniciar cada sesión de HD es necesario un examen exhaustivo de la FAV mediante la exploración física, tal como se detalla en el apartado 4.
- •
No debe realizarse la punción sin comprobar antes el funcionamiento de la FAV225.
- •
Se evitarán en todo momento punciones en zonas enrojecidas o con signos de infección, en zonas con hematoma, costra o piel alterada y en zonas apicales de aneurismas.
- •
En las punciones dificultosas o en las primeras punciones, se aconseja la comprobación de la canalización correcta de la FAV utilizando una jeringa con suero fisiológico, para evitar la extravasación sanguínea y la subsiguiente formación de un hematoma.
- •
Topografía de las agujas. La aguja “venosa” debe insertarse siempre proximal a la aguja “arterial” para evitar la recirculación.
- •
Sentido de las agujas. La punta de la aguja “venosa” debe orientarse siempre en el mismo sentido del QA (dirección anterógrada) para asegurar un retorno venoso óptimo222. La orientación de la punta de la aguja “arterial” en el mismo sentido (dirección anterógrada) o en sentido opuesto al QA (dirección retrógrada) ha sido motivo de controversia213. En la serie de Gauly et al, la aguja “arterial” se situó en dirección anterógrada en la mayoría de los casos (63%)206 y esta situación no tiene por qué aumentar el riesgo de recirculación, siempre y cuando el QA de la FAV sea significativamente mayor que el QB222. Según datos recientes, la dirección anterógrada de la aguja “arterial” se asocia con una mayor supervivencia de la FAV217, ya que provoca un menor QA turbulento y, probablemente, una menor lesión de la íntima vascular212.
- •
Orientación del bisel de la aguja. En la serie de Gauly et al, el bisel se orientó hacia arriba en la mayoría de los casos (72,3%)206. Aunque la orientación del bisel hacia arriba o hacia abajo se ha asociado con el grado de dolor en el momento de la punción226, recientemente se ha demostrado que la orientación del bisel hacia arriba se asocia con una mayor supervivencia de la FAV217.
- •
Rotación de la aguja (180°) en el momento de la canulación. En la encuesta de Gauly et al se efectuó esta maniobra en, aproximadamente, la mitad de los casos206, pero actualmente está desaconsejada, ya que causa el ensanchamiento del agujero de entrada de la aguja y puede rasgar el cuerpo de la FAVp o lesionar el endotelio de la vena arterializada, y llegar a producir infiltraciones de sangre en la pared lateral de la vena durante la sesión de HD212,213. Además es innecesario efectuar esta rotación si se utilizan agujas fenestradas10,213.
- •
Tras preparar la piel se deberá efectuar una compresión (manual, torniquete) proximal para provocar una estasis venosa y estirar la piel en dirección opuesta a la canulación, con el objetivo de fijar pero no obliterar la vena arterializada. Esta compresión se efectuará siempre, aunque la vena esté muy bien desarrollada y/o se utilice el método del ojal213,217. En el estudio de Parisotto et al, la compresión por el propio paciente en el momento de la canulación de la FAVn tuvo un efecto favorable sobre la supervivencia de esta en relación con la ausencia de compresión o la utilización de un torniquete217.
- •
Utilizando el método escalonado de punción, el ángulo de inserción de las agujas en la FAVn debe ser aproximadamente de 25°, que puede variar según la profundidad de la vena arterializada, deben ubicarse a una distancia de 2,5cm de la anastomosis como mínimo y deben mantener una distancia entre sus puntas de al menos 2,5cm2070,212. En una encuesta internacional referida a más de 10.000 canulaciones con dos agujas en pacientes dializados en su mayoría por FAVn (91%), la distancia media entre ambas agujas fue de 7,0 ± 3,7cm y muy similar a la distancia registrada en una serie nacional (7,3 ± 3,1cm)206,227.
- •
El ángulo de inserción de las agujas en la FAVp debe ser de 45°, aproximadamente, que puede variar según su profundidad, estas deben ubicarse a una distancia de 5cm de la anastomosis como mínimo y deben mantener una distancia entre sus puntas de al menos 2,5cm207,212. El cambio de sitio de la punción en cada sesión de HD es especialmente importante en las FAVp, de forma que deben seleccionarse los sitios nuevos de punción entre 0,5 y 1,25cm de los sitios anteriores para conservar al máximo la integridad de la pared de la FAVp212.
- •
Una vez puncionada la FAVp se disminuirá el ángulo, con el objetivo de evitar puncionar la pared posterior, y se realizará la canalización, asegurándose de que la punta de la aguja quede situada en el centro de la luz de la FAVp.
- •
No debe efectuarse la compresión proximal para su punción.
- •
Las agujas se fijarán de forma segura sobre la piel del brazo, para evitar salidas accidentales y permanecerán visibles durante todo el tratamiento. Se debe comprobar que el extremo distal de la aguja no dañe la pared vascular.
- •
Las líneas se pueden fijar en la extremidad del AV. No se recomienda sujetarlas a ninguna parte móvil (sillón, cama o almohada). El principal objetivo es evitar extravasaciones con los movimientos del paciente.
- •
Salida accidental de una aguja durante la sesión de HD228–230. Es una complicación grave que puede tener resultados catastróficos228. Los motivos que pueden provocar la salida accidental de las agujas son los siguientes: deficiente fijación de las agujas a la piel, esparadrapo con adherencia defectuosa, tracción de alguna de las líneas del circuito o el movimiento súbito de la extremidad de la FAV230. Para prevenir la salida de la aguja es necesario fijar adecuadamente las agujas y las líneas sanguíneas con un margen de espacio suficiente para evitar tracciones peligrosas230. Hay que mantener siempre la extremidad a la vista y, si es necesario, inmovilizada. Ante la salida de una de las agujas hay que proceder con rapidez, comprimiendo en seguida el punto de punción sangrante, detener la bomba de sangre si esto no se ha producido automáticamente y pinzar la línea correspondiente230. Siempre hay que hacer una estimación del volumen de sangre perdido y comprobar la estabilidad hemodinámica del paciente.
→ Pregunta clínica VIII ¿Cuál es la técnica de elección de punción para los diferentes tipos de fístula arteriovenosa: las tres clásicas y autopunción?
(Ver ficha de la Pregunta clínica VIII en enlaces electrónicos)Razonamiento
Se han descrito tres tipos diferentes de técnicas de canulación de la FAV207,211–213,231.Técnica de la punción escalonada o rotatoria (aguja de punta afilada)
Es el método de punción de elección para la mayoría de los pacientes. Las punciones se distribuyen regularmente a lo largo de toda la longitud de la vena arterializada de FAVn o el cuerpo de FAVp. En cada sesión de HD se escogen dos nuevos sitios para la colocación de la aguja permitiendo de este modo la cicatrización de la piel entre las sesiones de HD. Con esta técnica se produce un aumento moderado del diámetro a lo largo de toda la longitud de la vena arterializada con ausencia o desarrollo mínimo de aneurismas (se evita el debilitamiento progresivo de la pared de la vena secundario al flujo de retorno sanguíneo cuando este incide siempre en el mismo punto). El problema principal es que se requiere una vena arterializada que tenga un trayecto suficientemente largo para permitir esta punción rotatoria.Técnica del área o de la punción circunscrita en la misma área (aguja de punta afilada)
Los motivos principales para el uso de este método son: longitud limitada de la vena arterializada, ruta difícil para la canulación, valoración por parte de la enfermera de que la punción en otra zona será fallida o negativa del paciente a ser puncionado en otra zona. Esta técnica consiste en la punción repetida en una zona muy circunscrita de la vena arterializada, lo que produce la lesión de la pared venosa con la formación de aneurismas en la FAVn, riesgo de seudoaneurismas y trombosis en la FAVp. Por tanto, este método debe evitarse siempre que sea posible. Sin embargo, la situación actual en el “mundo real” es decepcionante: según una encuesta internacional mencionada anteriormente, la técnica utilizada con mayor frecuencia (61%) fue el método del área206.Técnica del ojal obuttonholeo de punción constante en el mismo sitio (aguja de punta roma)
Este método tiene que ser utilizado exclusivamente en las FAVn y nunca en las FAVp. Las punciones se realizan siempre a través del mismo orificio en todas las sesiones de HD (la misma entrada en la piel, el mismo ángulo de entrada y la misma profundidad de entrada a la vena). Después de la creación de un túnel subcutáneo de tejido fibroso cicatricial, el acceso a la circulación se consigue con una aguja de punta roma que elimina el riesgo de desgarros y hemorragia dentro de este.
Esta técnica se basa en la inserción de una aguja de punta afilada en el mismo sitio y en el mismo ángulo de entrada de forma repetida, de preferencia por un único canulador, en el transcurso de 6 a 10 sesiones de HD. Esta estrategia permite construir un túnel de tejido fibroso cicatricial hasta la pared de la vena, que posteriormente se podrá canular con agujas de punta roma. Se crea un ojal arterial y un ojal venoso. Una vez que el túnel ya está bien formado, cualquier miembro del personal de enfermería entrenado o el propio paciente pueden puncionar la FAVn. Además de la aguja de punta afilada convencional, se ha descrito la construcción del túnel subcutáneo mediante otros métodos232,233.
Es muy importante seguir un estricto protocolo de asepsia, que debe contemplar, antes de introducir la aguja de punta roma en el túnel subcutáneo, la desinfección cuidadosa de ambos ojales antes y después de extraer completamente la costra que se forma sobre los mismos después de cada sesión de HD (método de doble asepsia). Nunca se quitará la costra con la misma aguja roma que se utilizará a continuación para la canulación. La mayoría de las agujas romas llevan incorporado un capuchón especialmente diseñado para la retirada de la costra de forma segura, sin tener que utilizar una aguja adicional y sin lesionar las paredes del orificio.
A todos los pacientes altamente motivados y con capacidad suficiente, tratados en una unidad de HD o bien en HD domiciliaria, se les ofrecerá la posibilidad de la autopunción mediante el método de punción escalonada y, en algunos casos seleccionados, mediante el método del ojal213,224.
| Resumen de la evidencia | |
|---|---|
| La revisión de la evidencia se basa en diversos estudios observacionales y varios ensayos clínicos aleatorizados (ECA). En ellos la calidad de la evidencia contrastada ha sido baja para los estudios observacionales y moderada para los ECA | |
| No hay diferencias en la supervivencia de la FAVn al comparar las técnicas escalonada y en ojal | Calidad baja |
| La punción en ojal se asocia con menores tasas de hematoma y formación de aneurismas en comparación con la punción escalonada | |
| El dolor producido por la punción no se reduce significativamente mediante el método del ojal | |
| El método de punción en ojal se asocia con un mayor riesgo de eventos infecciosos locales y sistémicos en comparación con la punción escalonada | Calidad moderada |
| El método del ojal debe reservarse para puncionar únicamente FAVn seleccionadas que presentan tortuosidad y/o un segmento corto de vena disponible para la punción | |
El entusiasmo inicial originado por el método del ojal, que incluso se reflejó en alguna guía clínica13, se ha visto frenado por la evidencia que ha aparecido posteriormente234,235. Por ejemplo, en relación con el grado de dolor percibido por el paciente mediante el método del ojal, se han publicado estudios que reportan menor dolor236–238, mayor dolor239,240 o igual dolor en relación con la punción escalonada241,242. Es decir, hay evidencias equívocas respecto al grado de dolor mediante la punción en ojal, de modo que, considerando conjuntamente todos los estudios observacionales combinados, el método del ojal se asocia a una reducción significativa del dolor, pero este beneficio desaparece al analizar los ensayos controlados aleatorizados235. Por tanto, con la evidencia disponible actualmente, no podemos afirmar que el dolor producido por la punción se reduce significativamente mediante el método del ojal ni en una unidad de HD ni en la HD domiciliaria con autopunción235.
Van Loon et al publicaron un estudio observacional prospectivo de 9 meses de seguimiento en el año 2010, que comparó 145 pacientes prevalentes en HD utilizando la punción escalonada (n = 70) y la punción en ojal (n = 75)240. A pesar de evidenciarse un número significativamente mayor de errores de canulación en el grupo de punción en ojal en relación con el grupo de punción escalonada, el número de hematomas fue significativamente menor en el grupo de punción en ojal, probablemente porque una canulación no exitosa con una aguja de punta roma causa menor lesión tisular que una aguja de punta afilada240. Además, los enfermos del grupo de punción en ojal requirieron un número significativamente inferior de intervenciones sobre la FAVn a expensas de un número significativamente menor de ATP, no se objetivaron diferencias en el número de trombectomías y de revisiones quirúrgicas entre ambos grupos de pacientes240. La formación de aneurismas fue significativamente menor en el grupo de punción en ojal, pero, por contra, este grupo de enfermos recibió tratamiento antibiótico de la infección relacionada con la FAVn con una frecuencia significativamente mayor240. Finalmente, los enfermos en el grupo de punción en ojal experimentaron significativamente mayor dolor y miedo en relación con el grupo de punción escalonada, aunque en este último grupo fue significativamente más frecuente la aplicación de crema anestésica local240.
MacRae et al efectuaron en 2012 un ensayo controlado aleatorizado que comparaba 140 pacientes prevalentes en HD utilizando la punción estándar (escalonada, n = 70) y la punción en ojal (n = 70), sin evidenciarse ninguna diferencia en la percepción del dolor en el momento de la punción entre ambos grupos de enfermos241. En el mismo estudio, aunque la formación de hematomas fue significativamente mayor en el grupo de la punción estándar, los signos de infección local y los episodios de bacteriemia fueron significativamente mayores para el grupo de punción en ojal; no se encontraron diferencias en la hemorragia posdiálisis entre ambos grupos241. Finalmente, el grado de dificultad en la punción por parte de enfermería fue significativamente mayor en el grupo de punción en ojal (tanto para la aguja arterial como para la venosa) en comparación con la punción estándar a partir de las 4 semanas, lo que coincidió con el uso de la aguja roma por múltiples enfermeras241.
Posteriormente, MacRae et al publicaron en el año 2014 el resultado del seguimiento de estos pacientes (17,2 meses con punción estándar y 19,2 con punción en ojal) y no evidenciaron diferencias en la supervivencia de la FAVn entre los enfermos en HD mediante la punción estándar (escalonada, n = 69) y punción en ojal (n = 70)243. Sin embargo, el número total de infecciones, tanto locales como bacteriemia por Staphylococcus aureus fue significativamente mayor en el grupo de punción en ojal243. No encontraron diferencias en las tasas de trombosis, fistulografía, ATP e intervención quirúrgica al comparar ambos grupos de pacientes243. Las conclusiones de este ECA fueron que la ausencia de beneficio en la supervivencia de la FAVn y el mayor riesgo de infección existente deben tenerse muy en cuenta a la hora de promocionar la punción en ojal243.
Vaux et al efectuaron en el año 2013 un ensayo clínico aleatorizado que comparaba 140 pacientes prevalentes en HD utilizando el método habitual de punción (n = 70) y la punción en ojal (n = 70) durante 1 año de período de seguimiento, y evidenciaron una supervivencia significativamente mayor de la FAVn, un número significativamente menor de intervenciones para mantener la función de la FAVn (a expensas de menor número de ATP en estenosis) y ningún episodio de bacteriemia relacionada con la FAVn en el grupo de punción en ojal233. Estos efectos beneficiosos del método de punción en ojal objetivados en este estudio podrían explicarse por la distinta metodología empleada en la construcción del túnel subcutáneo, ya que se utilizó un accesorio de policarbonato a modo de tutor insertado en el túnel entre las sesiones de HD durante la fase de la creación del túnel con la aguja de punta afilada233,241,244.
Muir et al realizaron una revisión retrospectiva de 90 pacientes consecutivos en HD domiciliaria, que comparaba las técnicas de punción escalonada (n = 30) y en ojal (n = 60), sin evidenciarse ninguna diferencia entre ambos grupos en relación con la pérdida definitiva de la FAVn o bien en la necesidad de intervención quirúrgica (cualquier revisión quirúrgica o episodio que requirió el abandono definitivo de la FAVn y/o la creación de una nueva FAVn)245. Sin embargo, el número total de infecciones fue significativamente menor en el grupo de punción escalonada en relación con punción en ojal: 0,10 frente a 0,39 episodios por 1.000 días de utilización de la FAVn, respectivamente245. Además, estos autores también realizaron una revisión sistemática de 15 estudios (cuatro ensayos controlados aleatorizados y once estudios observacionales) y objetivaron que, en relación con el método escalonado de punción, el riesgo de infección fue aproximadamente tres veces mayor utilizando el método del ojal245.
La tasa de infecciones totales registradas en el grupo de pacientes dializados mediante el método del ojal en el estudio de Muir et al245 fue muy similar a la tasa de bacteriemia relacionada por el CVC (0,40 episodios de bacteriemia por 1.000 días de CVC) registrada en unidades de HD con un manejo óptimo del CVC246. Por tanto, uno de los principales beneficios de la FAVn en relación con el CVC, es decir, su baja tasa de infección, se cuestiona seriamente utilizando el método del ojal244.
El riesgo incrementado de infección local y sistémica utilizando el método de punción en ojal se ha confirmado en otros estudios y revisiones sistemáticas234,235,239,247,248 y pone en entredicho el uso de este método en la práctica clínica rutinaria245. Aunque se han descrito resultados favorables en la prevención de la bacteriemia por S. aureus mediante la aplicación de mupirocina tópica en cada ojal después de efectuar la hemostasia249, se considera que el pilar fundamental para reducir los episodios infecciosos mediante esta técnica es la educación continuada del personal de enfermería y/o el paciente mediante la revisión periódica, paso por paso, del protocolo de asepsia empleado248.
Grudzinski et al efectuaron en el año 2013 una revisión sistemática de 23 artículos a texto completo y 4 abstracts sobre el método de punción en ojal: 3 eran ensayos abiertos y el resto eran estudios observacionales de diferente diseño y calidad metodológica234. Las principales conclusiones de estos autores fueron: a) no existieron diferencias cualitativas en los resultados obtenidos entre los pacientes en HD domiciliaria y en el centro de HD que se dializaban con este método; b) los estudios que consideraron la supervivencia de la FAVn, la hospitalización, la calidad de vida, el dolor y la formación de aneurismas tenían serias limitaciones metodológicas que influyeron en el análisis de los resultados considerados; c) las tasas de bacteriemia fueron generalmente mayores mediante la canulación en ojal; d) el método del ojal puede estar asociado con un mayor riesgo de infección234.
Más recientemente, Wong et al publicaron otra revisión sistemática de 23 artículos, 5 ensayos aleatorizados y 18 estudios observacionales sobre el método de punción en ojal, y los principales aspectos que resaltaron estos autores fueron235: a) este método no disminuye significativamente el dolor durante la canulación y parece asociarse con un mayor riesgo de infecciones locales y sistémicas; b) considerando la supervivencia de la FAVn, las intervenciones sobre la FAVn, las hospitalizaciones o mortalidad relacionadas con la FAVn, la hemostasia, o las hospitalizaciones o mortalidad por todas las causas, no hay datos que impongan una técnica de punción sobre la otra; c) el método del ojal es beneficioso únicamente en la reducción de la formación de hematomas y aneurismas. La conclusión final de estos autores235 fue que: a) la evidencia no apoya el uso preferente del método del ojal sobre el método escalonado de punción, ni en la unidad de HD convencional ni en la HD domiciliaria; b) la evidencia no excluye a la canulación en ojal como apropiada para algunos pacientes con FAVn de punción dificultosa.
Aunque con experiencia limitada, existe un dispositivo250 de implantación quirúrgica que permite la punción de FAVn profundas mediante el método del ojal sin necesidad de realizar superficialización quirúrgica, con un límite de profundidad de 15mm. Se trata de una guía de titanio a modo de embudo suturada encima de la vena. También está indicada su utilización en FAVn con muy poco espacio de punción y de difícil canalización. Este dispositivo solo puede aplicarse con la técnica de punción en ojal.De la evidencia a la recomendación
Según la evidencia revisada no hay datos concluyentes para recomendar una técnica de punción para todos los pacientes en HD; sin embargo se demuestra que la técnica de punción escalonada es la que presenta menos complicaciones tanto en FAVn como en FAVp. Los resultados de la técnica del ojal en términos de reducción de aneurismas, duración de la FAV, infecciones locales y sistémicas, dolor a la punción y tiempo de hemorragia posdiálisis varían de unos estudios a otros; datos que refuerzan la idea de que es una técnica de punción “centro y canulador dependiente”. Sin embargo, la incidencia de infecciones reportada en los estudios controlados contraindica su uso sistemático en la FAV, y el GEMAV considera que el método del ojal debe reservarse para puncionar únicamente FAVn seleccionadas que presentan tortuosidad y/o un segmento corto de vena disponible para la punción.
R 3.3.4) Se recomienda utilizar la técnica de punción escalonada como método de punción de la fístula arteriovenosa protésica
R 3.3.5) Se recomienda utilizar la técnica de punción escalonada como método de punción preferente de la fístula arteriovenosa nativa
R 3.3.6) Se recomienda reservar la técnica de punción en ojal (buttonhole) como método de punción para las fístulas arteriovenosas nativas tortuosas, profundas y/o con un tramo venoso de longitud muy limitado
La técnica de unipunción se utiliza ocasionalmente en la práctica clínica rutinaria cuando es imposible la canulación de la FAVn con dos agujas. Con el objetivo de evitar la implantación de un CVC, la unipuntura es una técnica de punción de recurso que se efectúa de forma transitoria cuando la vena arterializada solo presenta un tramo de escasa longitud para la bipunción al haberse producido alguna complicación durante la canulación y/o retirada de las agujas (hematoma) en la sesión de HD precedente, o bien porque se intenta aumentar un desarrollo incompleto de la vena arterializada, sobre todo de localización braquial. Se requiere una aguja de doble salida en Y de calibre 14 o 15 G y un sistema de doble bomba en el monitor de HD. Debe efectuarse un control estricto de la adecuación de la HD aumentando la superficie del dializador y/o la duración de la sesión de HD si es preciso.Retirada de las agujas
La técnica de retirada de las agujas es tan importante como la punción, ya que debe proteger a la FAV evitando cualquier lesión adicional (desgarros) y facilitar una hemostasia apropiada207. Cada aguja debe retirarse aproximadamente en el mismo ángulo en que fue insertada10. La presión en el lugar de la punción no debe iniciarse hasta que la aguja se ha eliminado por completo para no dañar a la FAV207.
En el momento de la canulación se crean dos orificios para cada aguja: uno que atraviesa la piel (externo) y otro que atraviesa la pared de la vena arterializada de la FAVn o del cuerpo de la FAVp (interno)207. Por tanto, aunque no estén en el mismo plano, ambos agujeros, externo e interno, deben comprimirse después de retirar la aguja para asegurarse de que la hemorragia se detiene a través de estos207. Si el orificio interno no se comprime adecuadamente se producirá hemorragia en el tejido subcutáneo, con el consiguiente desarrollo de un hematoma207,251. Como ya se ha mencionado anteriormente en la metodología de la punción de la FAV208, este hematoma puede poner en riesgo la FAV, ya que puede dificultar las posteriores punciones, puede limitar las opciones de futuras canulaciones y puede provocar su trombosis debido al incremento de la presión extrínseca o al desarrollo de estenosis207. Por lo tanto deben utilizarse siempre dos dedos para efectuar la hemostasia después de retirar la aguja, uno destinado a comprimir el orificio externo y otro a comprimir el agujero interno207. Durante el tiempo de hemostasia, la presión ejercida debe ser constante, sin interrupciones y lo suficientemente intensa para detener la hemorragia en los puntos de punción, pero sin interrumpir el QA de la FAV207,251. Para reducir al mínimo el riesgo de resangrado a través del orificio de la aguja “arterial” una vez alcanzada la hemostasia en este punto (debido a un incremento retrógrado brusco de la presión en el interior de la FAV secundario a la compresión del orificio de la aguja “venosa”), es preferible retirar primero la aguja “venosa”, efectuar la hemostasia correspondiente a este nivel y, a continuación, retirar la aguja “arterial”251.
La compresión manual tiene que mantenerse como mínimo 10min antes de comprobar si todavía existe hemorragia en el punto de la punción252. En general, el tiempo de hemostasia es superior para FAVp que para FAVn207. En ausencia de anticoagulación excesiva, la presencia de un tiempo de hemostasia prolongado (superior a 20min) puede indicar una presión incrementada en el interior de la FAV secundaria a una estenosis, como se detalla en el apartado 4251–253. Si existen problemas de hemorragia y/o pacientes con un tiempo de sangría prolongado, pueden ser eficaces los apósitos hemostáticos251. Recientemente se ha introducido un apósito transparente microperforado que reduce significativamente el tiempo de hemostasia en ambos orificios, “arterial” y “venoso”, en relación con la compresión manual convencional254.
La hemostasia de las primeras punciones tiene que realizarla siempre personal de enfermería experto. Posteriormente, si las características del paciente y de su FAV lo permiten, se aconseja instruir al paciente y que él efectúe la hemostasia con guante no estéril251. Si esto no es posible, un miembro del staff de la unidad de HD debe encargarse de efectuar la hemostasia251. No se deben utilizar pinzas para efectuar la hemostasia de FAVp y se desaconseja utilizarlas en FAVn207. Si es preciso utilizarlas, solo deben aplicarse sobre una FAVn bien desarrollada con un QA adecuado y comprobando siempre la función persistente de la FAVn mientras la pinza esté colocada207.
Los apósitos o vendajes adhesivos deben aplicarse en los lugares de la punción, pero nunca antes de alcanzarse la hemostasia completa252. Este vendaje nunca debe cubrir toda la circunferencia de la extremidad207. Siempre debe comprobarse la permeabilidad de la FAV después de colocar el apósito207. Se instruirá al paciente a retirar el vendaje a las 24h de su colocación207.
3.4Cuidados de la fístula arteriovenosa por parte del paciente en el período interdiálisisRazonamiento
El plan de autocuidados de la FAV incluye la formación adecuada del paciente en todas las actuaciones que ha de realizar, para contribuir a su buen funcionamiento, prolongar su permeabilidad y adquirir los hábitos necesarios que le permitan detectar, evitar y prevenir las complicaciones de esta.Educación del enfermo respecto a su fístula arteriovenosa
En este apartado se describe el plan de autocuidados de la FAV desde su creación y los relativos al período interdiálisis10,255.Monitorización de la función de la fístula arteriovenosa
En la medida de lo posible, según las características de cada enfermo, debemos enseñarle a efectuar diariamente la exploración física de la FAV tal como se detalla en la figura 2 del apartado 4.Detección de las posibles complicaciones
- •
Signos y síntomas de infección como enrojecimiento, calor, dolor y supuración.
- •
Signos y síntomas de isquemia en el brazo de la FAV como frialdad, palidez y dolor.
- •
Signos y síntomas de trombosis como la aparición de endurecimiento o dolor, ausencia de soplo y frémito.
- •
Signos y síntomas de disminución del retorno venoso, como la presencia de edema.
- •
En la FAV recién creada mantener la zona quirúrgica seca hasta la retirada de los puntos de sutura.
- •
A partir de las primeras 24-48h de la creación de la FAV es conveniente realizar movimientos suaves con los dedos y brazo de la FAV para favorecer la circulación sanguínea, pero evitando los ejercicios bruscos, ya que pueden favorecer la hemorragia de la herida o dificultar el retorno venoso. En la FAVn en el codo y en la FAVp implantada en la flexura se debe evitar la flexión completa del brazo.
- •
Se debe mantener en todo momento el apósito limpio y seco, cambiándolo si estuviera sucio o húmedo.
- •
En estas primeras fases se evitarán las situaciones que puedan favorecer la contaminación de la herida quirúrgica, o en su caso se protegerá adecuadamente (trabajo en el campo o con animales).
- •
Tras la retirada de los puntos de sutura, realizar una higiene adecuada y diaria de todo el brazo de la FAV con agua templada y jabón. Mantener la piel hidratada para evitar la aparición de heridas.
- •
Cuando el paciente haya iniciado el tratamiento con HD se retirará el apósito que cubre los sitios de punción al día siguiente de la sesión de HD. Si el apósito queda pegado a la piel es conveniente humedecerlo con suero fisiológico, para evitar lesiones que favorezcan sangrado o infección de la FAV. Nunca ha de levantarse la costra de la herida.
- •
Si aparece hemorragia por el orificio de la piel correspondiente a la punción, se debe presionar con una gasa, comprimiendo suavemente con los dedos del mismo modo que en la sesión de HD. Si la hemorragia no cede en un tiempo prudencial, se debe acudir a un centro sanitario para su valoración. Nunca se colocará un vendaje circular compresivo.
- •
No permitir que le registren la PA ni le efectúen venopunciones en el mismo brazo de la FAV.
- •
Evitar golpes y cualquier compresión sobre la FAV. No hay que usar ropa apretada, relojes, pulseras, vendajes oclusivos ni dormir apoyado sobre el brazo de la FAV.
- •
No levantar peso ni realizar ejercicios bruscos con ese brazo.
- •
Evitar cambios bruscos de temperatura.
Ante la detección de complicaciones hay que ponerse en contacto con su centro sanitario de referencia.
3.5Tratamiento antiagregante de la fístula arteriovenosaRecomendaciones(•) NUEVA R 3.5.1) Se sugiere individualizar la indicacion del tratamiento antiagregante en la profilaxis de la trombosis de la fistula arteriovenosa nativa, dado que, aunque se demuestra una disminucion en el riesgo de trombosis, se considera que los efectos adversos no se han estudiado con suficiente exactitud
(•) NUEVA R 3.5.2) En pacientes con fistula arteriovenosa protesica se sugiere no utilizar profilaxis antitrombotica dada la ausencia de beneficio en la prevencion de la trombosis y el hecho de que no se hayan estudiado con suficiente exactitud los efectos adversos
El fallo de la FAV puede ser precoz o tardío. El fallo precoz de la FAV es frecuente, con una incidencia del 9 al 53%94,256. El fallo tardío se relaciona con estenosis adquiridas en el territorio arterial y principalmente venoso. La fisiopatología del fallo no está del todo bien definida, pero se ha relacionado con diferentes desencadenantes que provocan inicialmente una estenosis que puede desencadenar una trombosis y la pérdida del AV257. La trombosis es, por lo tanto, el factor en común del fallo tanto precoz como tardío.
Hay enfermedades vasculares donde el territorio afectado por una trombosis tiene una grave repercusión clínica, como es el caso de arterias coronarias o cerebrales258. A partir de aquí se ha postulado que el beneficio que puede tener la medicación antitrombótica en estas patologías podría también reducir la trombosis en la FAV y, por lo tanto, la pérdida del AV. La primera vez que se propuso este tipo de fármacos en la prevención de la trombosis en el AV fue con la cánula de Scribner, en 1967259. Esta cánula conectaba los vasos a nivel de la muñeca (arteria radial y vena cefálica o arteria cubital y vena basílica) o en el tercio inferior de la pierna (tibial posterior y safena interna), a través de un puente externo de material sintético (FAV externa) permanentemente instalado, de modo que el riñón artificial pudiera ser conectado tan a menudo como fuera necesario. Desde entonces, el resultado de la utilización de antiagregantes para reducir el fallo de la fístula no ha sido concluyente. Los salicilatos se han relacionado con un descenso del fallo precoz, pero estudios observacionales como el DOPPS no encontraron que se consiguiera aumentar la proporción de FAV utilizables para la HD260. Un ensayo clínico que comparó clopidogrel con placebo demostró una reducción en las trombosis precoces en FAV incidentes, pero no se modificó la proporción de FAV útiles para la HD171. Por otro lado, otra revisión del DOPPS encontró un menor riesgo de fallo de la FAV en pacientes que recibían ácido acetilsalicílico durante al menos 1 año261 y un metaanálisis que incluye estudios con diferentes antiagregantes a corto plazo demostró también una reducción en las trombosis en FAVn y FAVp262.
Sin embargo, el período de seguimiento en estos estudios es limitado, habitualmente menor de 1 año, y sin demostrar claramente el beneficio en la supervivencia sin presentar un riesgo aumentado de hemorragia.
El paciente en HD presenta un mayor riesgo de hemorragia en relación con múltiples factores, que incluyen la disfunción plaquetaria, la anemia o el uso de heparina durante la HD. A esto se añade la incertidumbre del riesgo añadido por el uso de antiagregantes o anticoagulantes orales, sabiendo que los scores de riesgo de hemorragia desarrollados para la población general no se han validado en el paciente en HD.
Esta mayor tendencia a la hemorragia se ha observado en una de las revisiones del estudio DOPPS en el paciente con indicaciones específicas de antiagregación, como trastornos del ritmo, en el que el uso tanto de antiagregantes como de anticoagulantes se asoció con un riesgo elevado de mortalidad, tanto por causa cardiovascular como por cualquier tipo263. En un estudio retrospectivo, que incluyó 5 años de seguimiento en 41.000 pacientes, también se encontró una asociación a mayor mortalidad con los antiagregantes o anticoagulantes en el paciente en HD, si bien no se podía descartar totalmente el factor confusor de la indicación del tratamiento264. Cuando se analizan estudios que evalúan el riesgo de hemorragia en el entorno de los resultados de la antiagregación en la permeabilidad de la FAV, estos son escasos y sin resultados concluyentes. Una revisión sistemática que evalúa el riesgo de hemorragia en el paciente en HD, aunque parece demostrar una disminución en el riesgo de trombosis en la FAVn y no en la FAVp, es incapaz de consensuar una indicación en la antiagregación ante el elevado riesgo de hemorragia en el paciente renal265.
Por ello se considera necesario evaluar si se puede establecer una indicación del tratamiento antitrombótico en la prevención de la disfunción de la FAV.
→ Pregunta clínica IXa ¿En qué situaciones es necesario realizar profilaxis antitrombótica tras la realización-reparación de la fístula arteriovenosa?
(Ver ficha de la Pregunta clínica IX en enlaces electrónicos)
→ Pregunta clínica IXb El uso de antiagregantes previamente a la creación de la fístula arteriovenosa, ¿tiene una repercusión en la supervivencia y reduce el riesgo de trombosis?
(Ver ficha de la Pregunta clínica IX en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| En pacientes de HD con FAVn, el tratamiento con antiagregantes tras la cirugía y durante 6 meses después de su realización reduce el riesgo de fracaso (por trombosis o pérdida de la permeabilidad) y no se acompaña de efectos negativos en otras medidas de resultados | Calidad moderada |
| En pacientes en los que se va a crear una FAV como AV, la profilaxis antitrombótica previa a la cirugía y prolongada de 4 a 6 semanas tras la cirugía reduce el riesgo de fracaso de la fístula (por trombosis o pérdida de la permeabilidad) y no se acompaña de efectos negativos en otras medidas de resultados | Calidad baja |
| En pacientes de HD con FAVp, el tratamiento con antiagregantes no muestra efecto en la prevención de la trombosis, el mantenimiento de la permeabilidad del AV, ni en ninguno de los desenlaces de interés | Calidad moderada |
| En pacientes a los que se va a realizar una FAVp, la profilaxis antitrombótica previa y varias semanas después no muestra efecto positivo en ninguna de las medidas de resultado | Calidad baja |
¿En qué situaciones es necesario realizar profilaxis antitrombótica tras la realización-reparación de la fístula arteriovenosa?
La revisión sistemática de Palmer et al266 (derivada de la revisión Cochrane de Palmer et al267) analiza el efecto del tratamiento antiagregante en la tasa de trombosis y permeabilidad del AV en pacientes de HD, incluyendo tanto FAVn nativas como FAVp. En doce ensayos (con 3.118 participantes), el tratamiento antiagregante comenzó al tiempo de la realización de la cirugía, en seis ensayos 1-2 días antes, en dos ensayos 7-10 días antes, en dos ensayos 1-2 días después, en un ensayo 1 mes después y en otro no se especificó. La mediana de intervención fue de 3 meses (rango intercuatílico, 1,25-6). La ticlopidina, el ácido acetilsalicílico y el clopidogrel fueron los antiagregantes más utilizados.
Limitación: riesgo de sesgo alto o poco claro en la mayoría de los ensayos y escasos datos para el análisis de algunos efectos, especialmente en la FAVp y en la adecuación del AV para HD.Resultados
- •
Fallo de la FAV por trombosis o pérdida de permeabilidad. En la FAVn, el tratamiento antiagregante redujo la trombosis o la pérdida de permeabilidad a la mitad (seis ensayos, 188 eventos, 1.242 participantes; riesgo relativo [RR]: 0,49; IC del 95%, 0,30-0,81; I2 = 29%). En términos absolutos, el tratamiento de 100 individuos con agentes antiplaquetarios durante 1-6 meses (ácido acetilsalicílico, ticlopidina o clopidogrel) prevendría entre 6 y 21 individuos del fracaso de la fístula, asumiendo un riesgo basal del 30% de uno o más eventos.Sin embargo, el tratamiento antiagregante tuvo poco o ningún efecto sobre la trombosis de la FAVp o la permeabilidad (tres ensayos, 374 eventos, 956 participantes; RR: 0,94; IC del 95%, 0,80-1,10).
- •
Fallo de la FAV por trombosis o pérdida de permeabilidad temprana. En cinco ensayos (1.105 participantes) se evaluó el fallo del AV en las 8 semanas después de realizada la cirugía. En este subgrupo, el tratamiento con antiagregante redujo significativamente la trombosis precoz o el fallo en la permeabilidad de la FAV en un 57%, en comparación con el tratamiento con placebo o no tratamiento (177 eventos; RR: 0,43; IC del 95%, 0,26-0,73; I2 = 25%). La revisión no mostró datos respecto a los pacientes con FAVp.
- •
Fallo para conseguir un AV adecuado para la HD. En cinco ensayos (1.503 participantes) se evaluó el efecto del tratamiento antiagregante sobre la adecuación del AV para realizar la HD. Las diferencias no fueron estadísticamente significativas, tanto en FAVn (dos ensayos, 470 eventos, 794 participantes; RR: 0,57; IC del 95%, 0,13-2,51) como en FAVp (un ensayo, 12 eventos, 649 participantes; RR: 0,51; IC del 95%, 0,16-1,68).
- •
Necesidad de intervención para mantener la permeabilidad o la maduración de la FAV. No hubo diferencias estadísticamente significativas en la necesidad de intervención para mantener la permeabilidad o la maduración de la FAV, en FAVn (un estudio, 17 eventos, 866 participantes; RR: 0,69; IC del 95%, 0,26-1,83) y en FAVp (un estudio, 196 eventos, 649 participantes; RR: 0,89; IC del 95%, 0,64-1,25).
- •
Riesgo de hemorragia. En diez ensayos (3.930 participantes) se da información sobre eventos hemorrágicos. No se encontraron diferencias estadísticamente significativas en hemorragias graves —retroperitoneal, intraocular, intraarticular, cerebral o gastrointestinal— (diez estudios, 3.930 participantes; RR: 0,93; IC del 95%, 0,58-1,49) o leves (cuatro estudios, 237 participantes; RR: 1,22; IC del 95%, 0,51-2,91).
- •
Abandono del tratamiento. No hubo diferencias estadísticamente significativas en el abandono del tratamiento con respecto el grupo control (ocho estudios, 1.973 participantes; RR: 1,01; IC del 95%, 0,84-1,20).
- •
Profilaxis antitrombótica tras la reparación del AV. No se han encontrado estudios que analicen los efectos de la profilaxis antitrombótica tras la reparación del AV.
En relación con el uso de antiagregantes previamente a la realización del AV y su repercusión en la supervivencia y en el riesgo de trombosis tras el análisis de las mismas publicaciones de Palmer et al266,267, no se han encontrado estudios que comparen dar solo antes con dar solo después, o dar antes y después frente a solo después. Dado que los estudios encontrados analizan tratamiento perioperación en todos los casos, esto es antes y después, se ha considerado que la evidencia disponible es indirecta.Resultados
- •
Fracaso de la FAV (por trombosis o la pérdida de la permeabilidad). Las revisiones dan información sobre 5 ECA en los que la terapia antitrombótica se inicia antes de la operación de creación de una FAV como AV y se continúa hasta 4 o 6 semanas después, pero hay gran variabilidad en relación con el número de días previos a la operación en los que se usa el fármaco en cada estudio: en uno, 1 día antes y luego durante 28 días; en otro empezando 2 días antes y durante 1 mes; en otros dos empezar 7 días antes y luego durante 28 días; en otro empezar 7 a 10 días antes y luego 6 semanas. Se ha incluido también en este metaanálisis otro estudio donde empiezan el día 1 de la operación y luego 6 semanas.El tratamiento antiplaquetario redujo el riesgo de trombosis o de fracaso en la permeabilidad a cerca de la mitad (seis ensayos, 218 eventos, 1.365 participantes; RR: 0,54, IC del 95%, 0,39-0,74; I2 = 10%).
- •
Trombosis precoz del AV (antes de 8 semanas) en FAV. El tratamiento antiplaquetario redujo el riesgo de trombosis precoz del acceso a cerca de la mitad (seis ensayos, 218 eventos, 1.365 participantes; RR: 0,54; IC del 95%, 0,39-0,74; I2 = 10%).No encuentran diferencias significativas entre tratamientos en relación con: mortalidad por todas las causas, mortalidad por causa cardiovascular, infartos fatales o no fatales, accidentes cerebrovasculares fatales o no fatales, hemorragia menor, mayor o fatal, pérdida de permeabilidad primaria, necesidad de intervención para mantener la permeabilidad, u hospitalización.
- •
FAVp. En pacientes a los que se realiza un AV por medio de un injerto no encuentran diferencias entre tratamientos para ninguna medida de resultados.
- •
Fracaso de la FAVp (por trombosis o pérdida de la permeabilidad). No encuentran diferencias significativas entre tratamientos (dos ensayos, 266 eventos, 756 participantes; RR: 0,94; IC del 95%, 0,79-1,11; I2 = 0%).
En una revisión sistemática Cochrane sobre el uso de tratamiento médico para mejorar la permeabilidad de la FAVn o de la FAVp268, el antiagregante ticlopidina mostró una reducción significativa del riesgo de fallo de la FAVn por trombosis en comparación con placebo, que en términos relativos fue del 48% (tres ensayos clínicos, 339 participantes; OR: 0,45; IC del 95%, 0,25-0,82). No se observaron diferencias significativas al comparar otros tratamientos como ácido acetilsalicílico, clopidogrel o warfarina con placebo. De acuerdo con los autores de la revisión, la calidad de la evidencia fue baja por el limitado seguimiento de los estudios y la limitada disponibilidad de estudios para probar la eficacia del tratamiento.De la evidencia a la recomendación
La trombosis del AV es la consecuencia tanto del fallo precoz como del tardío que provoca la pérdida de este. Procedente de otros territorios vasculares, en que el tratamiento antiagregante es eficaz en la disminución del riesgo de trombosis, se ha postulado que este beneficio podría extenderse a mejorar la permeabilidad de la FAV. Sin embargo, el paciente en HD presenta mayor riesgo de hemorragia de componente multifactorial, que hace que la introducción del tratamiento antiagregante incremente potencialmente este riesgo.
La revisión de la evidencia demuestra que en el paciente en HD con FAVn, el tratamiento antiagregante reduce el riesgo de trombosis, sin existir diferencias en los efectos sobre la maduración y la utilización de la FAVn para la HD. Es de destacar que el análisis de los riesgos de hemorragia es incierto. Los autores señalan que no se reportaron con exactitud todos los efectos adversos, porque el número de eventos señalados en ambos grupos fue escaso. Además, los episodios de eventos hemorrágicos graves fueron definidos a priori y descritos sistemáticamente en solo dos de 21 ensayos. Por ello, el GEMAV interpreta que la utilización del tratamiento antiagregante debería individualizarse por los potenciales efectos secundarios en esta población.
Por otro lado, en el paciente de HD con FAVp, la efectividad del tratamiento antiagregante no existe en la prevención de la trombosis o el mantenimiento de la permeabilidad del AV.
R 3.5.1) Se sugiere individualizar la indicación del tratamiento antiagregante en la profilaxis de la trombosis de la fístula arteriovenosa nativa, dado que, aunque se demuestra una disminución en el riesgo de trombosis, se considera que los efectos adversos no se han estudiado con suficiente exactitud
R 3.5.2) En pacientes con fístula arteriovenosa protésica se sugiere no utilizar profilaxis antitrombótica, dada la ausencia de beneficio en la trombosis y el hecho de que no se hayan estudiado con suficiente exactitud los efectos adversos
CONTENIDO
4.1. Razonamiento
4.2. Monitorización clínica
4.3. Monitorización y vigilancia de la presión de la fístula arteriovenosa
4.4. Recirculación de la fístula arteriovenosa
4.5. Disminución inexplicable de la adecuación de la hemodiálisis
4.6. Métodos de cribado dilucionales para la determinación indirecta del flujo sanguíneo de la fístula arteriovenosa
4.7. Pruebas de imagen. Vigilancia de la fístula arteriovenosa mediante ecografía Doppler
4.8. Poder predictivo de los métodos de primera y segunda generación para la detección de la estenosis y la trombosis de la fístula arteriovenosa
4.9. Factores predictivos de trombosis de la fístula arteriovenosa con estenosisPreámbulo
El objetivo de la monitorización y vigilancia de la fístula arteriovenosa (FAV) es diagnosticar precozmente la patología, tanto de la FAV nativa (FAVn) como protésica (FAVp). El seguimiento de la FAV debe permitir la prevención de la trombosis mediante la detección precoz de la estenosis significativa y aumentar su supervivencia.
4.1RazonamientoRecomendacionesR 4.1.1) Se recomienda que las unidades de hemodiálisis dispongan de programas protocolizados de seguimiento de la fístula arteriovenosa y con participación multidisciplinar. Estos programas deben incluir métodos para diagnosticar precozmente la disfunción de la fístula arteriovenosa y localizar su origen, así como efectuar el tratamiento electivo
R 4.1.2) Se recomienda que la aplicación de programas de seguimiento de la fístula arteriovenosa implique la evaluación periódica de los parámetros obtenidos por cada método de monitorización y/o vigilancia aplicado
R 4.1.3) Se recomienda que la alteración repetida de cualquier parámetro de monitorización y/o vigilancia se utilice como criterio para efectuar una exploración de imagen de la fístula arteriovenosa ante la sospecha de patología
Para obtener una FAV válida que pueda utilizarse para iniciar un programa de hemodiálisis (HD) crónica hay que sortear numerosos obstáculos214. El mayor de todos ellos es conseguir una adecuada maduración, sobre todo en el caso de la FAVn, ya que, actualmente, el porcentaje de fracasos en la maduración de esta es aproximadamente del 40%214. Una vez alcanzado este difícil objetivo, hay que seguir en estado de alerta y utilizar todos los medios disponibles a nuestro alcance para evitar la trombosis y mantener la permeabilidad de la FAV en el enfermo prevalente.
La trombosis irreversible de la FAV ocasiona una serie de consecuencias negativas para el paciente prevalente que sigue un programa de HD269: reducción del capital venoso, necesidad de la implantación de un catéter venoso central (CVC), menor eficacia de la HD, posible estenosis o trombosis de venas centrales, inflamación crónica en el caso de las FAVp y la construcción de una nueva FAV. Todo ello incrementa la frecuencia de hospitalización, la morbimortalidad y el gasto sanitario del paciente en HD crónica270. Por tanto, evitar la trombosis de la FAV es primordial para estos pacientes.
En relación con la trombosis de la FAV hay que tener en cuenta que:
- •
No siempre es técnicamente posible la repermeabilización de todos los casos de trombosis de la FAV, incluso en manos de especialistas experimentados271.
- •
La permeabilidad secundaria de la FAV es significativamente inferior después de la repermeabilización postrombosis de la FAV si se compara con la reparación electiva de la estenosis de la FAV antes de la trombosis (apartado “Complicaciones del acceso vascular”, recomendación 5.2.6)272,273.
Por tanto, es muy importante destacar que el tratamiento de elección de la trombosis de la FAV no es su rescate mediante radiología intervencionista o cirugía vascular, sino su prevención mediante el diagnóstico y tratamiento precoz de la estenosis significativa.
La causa más frecuente de trombosis es la estenosis severa de la FAV10,253. Actualmente, para poder calificar a una estenosis como significativa es preciso demostrar la presencia de una reducción de la luz vascular > 50% mediante ecografía y/o angiografía, junto con la alteración repetida de uno o varios parámetros obtenidos por los métodos de monitorización y/o vigilancia10. El diagnóstico de la estenosis significativa es indicación de efectuar su tratamiento correctivo mediante la angioplastia transluminal percutánea (ATP) y/o la cirugía de forma electiva o preventiva para evitar su trombosis10.
Los programas de seguimiento de la FAV contemplan dos aspectos fundamentales: a) el diagnóstico precoz de la estenosis significativa mediante la utilización de diversos métodos o técnicas de cribado, y b) su corrección electiva o preventiva para prevenir su trombosis y aumentar la supervivencia de la FAV10.
La filosofía de estos programas se basa en que la estenosis de la FAV se desarrolla, en la gran mayoría de los casos, durante intervalos variables de tiempo y, si se diagnostica y corrige a tiempo, la subdiálisis puede evitarse y la tasa de trombosis puede reducirse entre el 40 y el 75%10,274. Estos programas de seguimiento deben desarrollarse en cada unidad de HD de forma sistemática, protocolizada y con una participación multidisciplinar de enfermería, nefrología, radiología y cirugía vascular253. La tabla 8 muestra los objetivos de los programas de seguimiento de la FAV, tanto para FAVn como para FAVp275–277.
Objetivos teóricos de los programas de seguimiento de la fístula arteriovenosa (FAV), tanto para la nativa como para la protésica
| 1. Diagnostico precoz de la estenosis de la FAV |
| 2. Disminucion de la tasa de trombosis de la FAV |
| 3. Aumento de la supervivencia de la FAV |
| 4. Incremento de las intervenciones electivas sobre la FAV |
| 5. Disminucion de las intervenciones de rescate sobre la FAV y de la construccion de nuevas FAV |
| 6. Disminucion de la incidencia de hospitalizaciones |
| 7. Reduccion del numero de sesiones de hemodialisis perdidas |
| 8. Disminucion de la tasa de implantacion de cateteres |
| 9. Reduccion del gasto sanitario |
Según datos del estudio DOPPS (Dialysis Outcomes and Practice Patterns Study I y II, 1996-2004), la probabilidad de que un enfermo prevalente efectúe la sesión de HD mediante un CVC está en relación directa con el número de FAV permanentes implantadas previamente32. Es probable que, si se hubieran introducido previamente programas de seguimiento de la FAV en estos centros DOPPS, se habrían podido evitar muchos de los casos de trombosis; por tanto, se habría reducido la prevalencia de enfermos dializados mediante CVC32. En este sentido, en nuestro país se ha demostrado una relación inversa entre la tasa de intervención preventiva y la tasa de trombosis de la FAV tanto para FAVn como para FAVp278.
Los métodos o técnicas de cribado o screening para el diagnóstico precoz de la estenosis significativa se clasifican en 2 grandes grupos279 (tabla 9):
- 1.
Métodos de primera generación.
- •
Monitorización clínica:
- –
Exploración física.
- –
Problemas durante la sesión de HD.
- –
Test de sobrecarga de la FAVn por flujo de bomba (QB).
- –
- •
Monitorización y vigilancia de la presión de la FAV: presión venosa dinámica (PVD), presión intraacceso (PIA) estática equivalente o normalizada.
- •
Determinación del porcentaje de recirculación.
- •
Disminución inexplicable de la adecuación de la HD: índice Kt/V, porcentaje de reducción de la urea (PRU), índice Kt.
- •
- 2.
Métodos de segunda generación. Permiten calcular el flujo sanguíneo (QA) de la FAV.
- •
Métodos de cribado dilucionales.
- •
Ecografía Doppler (ED).
- •
Técnicas de monitorización y vigilancia de la fístula arteriovenosa (FAV)
| I. Técnicas de primera generación |
| 1. Monitorización clínica: |
| • Exploración física |
| • Problemas durante la sesión de HD |
| • Sobrecarga de la FAVn por QB |
| 2. Presión de la FAV: |
| • Presión venosa dinámica |
| • Presión intraacceso estática equivalente o normalizada* |
| 3. Recirculación de la FAV |
| 4. Disminución inexplicable de la adecuación de la diálisis: índice Kt/V, PRU, índice Kt |
| II. Técnicas de segunda generación |
| Permiten la estimación no invasiva del QA de la FAV de 2 formas: |
| 1. Directa: ecografía Doppler* |
| 2. Indirecta: métodos de screening dilucionales* |
FAVn: fístula arteriovenosa nativa; Kt/V y Kt: índices de diálisis —K: aclaramiento del dializador; t: tiempo de duración; V: volumen de distribución de la urea—; HD: hemodiálisis; PRU: porcentaje de reducción de la urea; QA: flujo sanguíneo; QB: flujo de bomba.
Además, estas técnicas también pueden clasificarse como el nefrólogo es conve-“métodos de monitorización” (monitoring) y “métodos de vigilancia” (surveillance), en función de que no se necesite o sí que se requiera una instrumentación especial, respectivamente. Dentro de los métodos de monitorización se agrupan todos los métodos de primera generación excepto la presión venosa estática274. Se consideran métodos de vigilancia la presión venosa estática (v. apartado 4.3.2.) y los métodos de segunda generación. En relación con la periodicidad de su determinación, aunque es deseable la aplicación mensual de estos métodos10, se acepta efectuar la medición del QA de la FAVn cada 2-3 meses14,15.
Respecto a las distintas técnicas de monitorización y vigilancia utilizadas, es importante considerar que:
- •
El análisis prospectivo de cualquier parámetro de monitorización o vigilancia utilizado tiene mayor poder predictivo para detectar la disfunción de la FAV que los valores aislados de este10. En este sentido, es básico disponer de un registro de cada FAV en la unidad de HD, que permita efectuar una evaluación de este a lo largo del tiempo.
- •
No son excluyentes, sino complementarias. La utilización de varios métodos de monitorización o vigilancia de forma simultánea aumenta el rendimiento del programa de seguimiento280,281. Además, se ha demostrado que la precisión de cada técnica de monitorización y vigilancia de la FAV está en relación con la localización de la estenosis282.
Muchos de los métodos de cribado descritos, tanto de primera como de segunda generación, pueden utilizarse para valorar de forma no invasiva el resultado funcional de la intervención electiva realizada sobre la estenosis de la FAV282–284. En este sentido, también se ha utilizado la determinación de QA in situ inmediatamente después de efectuar la ATP sobre la estenosis de la FAV, para comprobar el resultado funcional del tratamiento electivo285.
4.2Monitorización clínicaAunque la monitorización clínica perdió cierto protagonismo cuando se introdujeron los métodos dilucionales para la determinación no invasiva de QA y aumentó la difusión de la ED, actualmente su papel central en el seguimiento de la FAV es indiscutible282,286,287. La monitorización clínica de la FAV tiene en cuenta dos aspectos fundamentales: la exploración física y los problemas durante la sesión de HD253,270,282,286–293. Recientemente se ha descrito la prueba de sobrecarga de la FAVn según el QB (QBstress test), que parece eficaz en el diagnóstico de la denominada estenosis de inflow294.4.2.1. Exploración física
Debe efectuarse de forma periódica utilizando la inspección, la palpación y la auscultación10,282,286,293 (tabla 10). Es un método fácil de aprender y realizar, consume muy poco tiempo, no requiere ninguna instrumentalización especial ni personal adicional y, por tanto, es una técnica de bajo coste. Además del personal de enfermería y del nefrólogo es conveniente que esta exploración sea efectuada parcialmente por el propio paciente a diario (fig. 2)295. La detección de cambios en las características del pulso, soplo y el frémito de la FAV respecto a controles previos permite el diagnóstico de una estenosis, así como concretar su localización282,286,293. A diferencia de otros métodos de seguimiento de la FAV, la exploración física permite además identificar otras patologías distintas de la estenosis como los aneurismas o la infección286.
Sistemática de la exploración física de la fístula arteriovenosa (FAV)
| Inspección |
| • Además de la FAV propiamente dicha, debe incluir toda la extremidad ipsilateral y debe compararse con la extremidad opuesta |
| • En caso de una FAV localizada en la extremidad superior, debe incluir también el hombro, el tórax, las mamas, el cuello y la cara |
| • Debe evaluarse el diámetro de la FAV, su longitud útil (tramo disponible para la canulación) y la visualización de venas colaterales |
| • Test de elevación del brazo |
| • Presencia de cualquier signo de infección |
| • Edema en la extremidad superior ipsilateral a la FAV: es casi siempre indicativo de la presencia de la estenosis venosa central |
| • Cicatrices en el pecho y el cuello: pueden indicar la presencia de CVC previos o cirugías de la esfera otorrinolaringológica |
| • Presencia de un dispositivo electrónico cardiovascular implantado en la pared torácica (marcapasos) |
| • Dilataciones aneurismáticas |
| • Trastornos tróficos cutáneos por robo vascular o hipertensión venosa |
| Palpación |
| • Evaluación del pulso normal |
| • Detección de cualquier thrill anormal |
| • Test de aumento del pulso |
| • Test de oclusión secuencial |
| Auscultación |
| • Evaluación del soplo normal |
| • Detección de cualquier soplo anormal |
CVC: catéter venoso central.
Modificada de referencias 293 a 300.
La tabla 11 resume los hallazgos obtenidos por la exploración física para el diagnóstico diferencial entre la estenosis de inflow (localizada en la arteria nutricia o en la propia anastomosis o en el trayecto inicial de la vena arterializada hasta 5cm postanastomosis), la estenosis de outflow (localizada en el trayecto de la vena arterializada desde la zona de punción hasta la aurícula derecha) y la trombosis de la FAVn. La estenosis venosa central es una estenosis de outflow, que se localiza en el trayecto venoso desde el arco de la vena cefálica a nivel de la primera costilla hasta la aurícula derecha. Una FAVn sin estenosis presenta un pulso suave o blando de fácil compresión, un thrill predominante sobre la anastomosis y un soplo continuo (sistólico y diastólico) de baja intensidad (tabla 11).
- •
Inspección. La tabla 10 resume los datos básicos a tener en cuenta durante la inspección de la FAV. Es muy importante la observación de toda la extremidad donde está ubicado el acceso vascular (AV). En caso de FAV en las extremidades superiores, la presencia de edema y la circulación colateral son signos que sugieren estenosis venosa central total o parcial. La extensión del edema nos puede ayudar a localizar el nivel de la estenosis central: si el edema implica solo el brazo, esto sugiere que la estenosis está a nivel de la vena subclavia; si el edema incluye el tórax, mama y/o cara ipsilaterales, la estenosis es más probable a nivel de la vena braquiocefálica; el edema bilateral (tórax, mamas, hombros y facies) sugiere una estenosis de vena cava superior286. Hay que valorar también las zonas distales de la extremidad en busca de signos de isquemia (frialdad, palidez y úlceras digitales isquémicas) o bien la presencia de signos de hipertensión venosa (hiperpigmentación y úlceras digitales de estasis)286,296–298. Se inspeccionará todo el trayecto de la FAV para detectar la presencia de hematomas, dilataciones aneurismáticas y signos flogóticos299,300. Toda vena arterializada que no se colapse, al menos parcialmente, tras la elevación del brazo es probable que tenga una estenosis proximal (tablas 10 a 12)10,282,286,293.
- •
Palpación282,286,293,301. El pulso puede apreciarse mejor utilizando la yema de los dedos. En condiciones normales, el pulso de la FAVn es de baja intensidad, blando y fácilmente compresible. Habitualmente, un incremento del pulso de la FAVn es indicativo de estenosis proximal (FAVn hiperpulsátil) y la cuantía de este incremento es directamente proporcional al grado de estenosis existente. Por el contrario, un pulso excesivamente débil (FAVn hipopulsátil, flat access), con escaso aumento mediante la oclusión manual transitoria, sugiere la presencia de estenosis de inflow (test de aumento del pulso, tabla 12).
Tabla 12.Principales tests utilizados en la exploración física de la fístula arteriovenosa (FAV)
Test de elevación del brazo • Consiste en la elevación de la extremidad de la FAVn por encima del nivel del corazón y se visualiza si existe o no colapso de la vena arterializada • La prueba se considera normal cuando la FAVn se colapsa después de la elevación del brazo y permite descartar la estenosis de outflow • En presencia de una estenosis venosa, solo la parte de la vena arterializada proximal a la lesión se colapsará al efectuar este test, mientras que la parte distal a la estenosis permanecerá distendida sin colapsarse Test de aumento del pulso • El test de aumento del pulso permite evaluar el segmento inflow del acceso arteriovenoso • Consiste en la oclusión transitoria de la vena arterializada varios centímetros por encima de la anastomosis arterial con una mano, y la evaluación simultánea de la intensidad del pulso a nivel de la anastomosis con la otra • Este test se considera normal cuando la parte de la vena arterializada distal al dedo que ocluye (entre el dedo y la anastomosis) presenta un aumento de pulso • Este test se basa en el hecho de que, si el acceso se ocluye completamente a cierta distancia de la anastomosis arterial, el pulso suave o blando se verá aumentado de intensidad. El grado de este aumento es directamente proporcional al QA existente en el segmento de inflow de la FAVn • La presencia de patología del sistema arterial de forma retrógrada a la anastomosis (estenosis de la arteria nutricia) condiciona el grado de incremento del pulso obtenido al aplicar este test Test de oclusión secuencial • Es similar al test de aumento del pulso excepto en que este test está centrado en la desaparición del thrill con la oclusión de la vena arterializada de la FAVn • Su objetivo es detectar las ramas venosas colaterales que nacen de la vena arterializada. Con frecuencia, una vena colateral puede ser visible y, por tanto, detectada previamente mediante la inspección • Este test se basa en la relación existente entre el thrill y el QA de la vena arterializada • Consiste en la oclusión de la vena arterializada a corta distancia de forma proximal a la anastomosis con una mano, mientras que se palpa el thrill normal sobre la anastomosis con la otra. El thrill, normalmente palpable sobre la anastomosis arterial, indicativo de QA, desaparece cuando la vena arterializada es obstruida manualmente a nivel proximal al causar un paro transitorio del QA. A continuación, todo el trayecto de la vena arterializada se debe evaluar cambiando el punto de la oclusión progresivamente en sentido proximal. Si en algún punto del trayecto venoso el thrill no desaparece, significa que una vena colateral está presente por debajo del punto de la oclusión FAVn: fístula arteriovenosa nativa; QA: flujo sanguíneo.
El thrill o frémito es una vibración palpable de la FAVn, que se explora mejor usando la palma de la mano y que refleja el QA circulante por la vena arterializada282,286,293. La ausencia de frémito es indicativa del déficit de flujo. Este signo, junto con la ausencia de pulso, es característico de la trombosis de la FAV. Se pueden palpar dos tipos distintos de frémito:
- -
Un frémito basal difuso en una FAV normal. Es suave, continuo (sistólico y diastólico), palpable a lo largo de todo el trayecto de la FAV, pero más intenso a nivel de la anastomosis venosa.
Un frémito localmente aumentado. Refleja la presencia de flujo turbulento localizado sobre una zona de estenosis en la vena arterializada. A medida que aumenta progresivamente el grado de estenosis, con un aumento simultáneo de la resistencia al QA, el frémito se acorta y pierde su componente diastólico. Todo el trayecto de la vena arterializada debe examinarse para detectar la presencia de un frémito anormal. Ante una estenosis de la vena subclavia o del arco de la vena cefálica, el frémito puede detectarse por debajo de la clavícula286.
- •
Auscultación Se valorará el soplo normal de la FAV y los cambios temporales que puedan producirse en este, así como la aparición de soplos anormales282,286,293. Constituye la manifestación auditiva del frémito. Podemos escuchar dos tipos distintos de soplo:
- -
Un soplo basal difuso en una FAV normal. Es de tono bajo, como un rumor suave y continuo (sistólico y diastólico).
- -
Un soplo anormal asociado a la estenosis. El aumento de la resistencia ocasionado por una lesión estenótica progresiva dará lugar a la pérdida paulatina del componente diastólico del soplo y a un incremento simultáneo del tono de este. Todo el trayecto de la vena arterializada, incluyendo el área debajo de la clavícula, debe examinarse para valorar la presencia de un soplo anormal286.
- -
- -
Diagnóstico diferencial entre la estenosis de inflow, la estenosis de outflow, la estenosis venosa central y la trombosis según los datos de la exploración física
| Normal | Estenosis deinflow | Estenosis deoutflow | Estenosis venosa central | Trombosis | |
|---|---|---|---|---|---|
| Inspección | Vena arterializada normal | Vena arterializada mal definida Excesivo colapso con la elevación del brazo | Distendida Ausencia de colapso con la elevación del brazo | Edema Circulación colateral proximal Ausencia de colapso con la elevación del brazo | Puede visualizarse hiperemia sobre el segmento trombosado |
| Palpación: pulso | Blando y fácilmente compresible | Disminuido Test aumento del pulso: débil | Aumentado | Variablec | Ausente o aumentado |
| Palpación: frémito | Continuoa | Discontinuob Disminuido | Discontinuob Aumentado sobre la lesión | Variablec Puede estar presente por debajo de la clavícula | Ausente |
| Auscultación: soplo | Continuoa | Discontinuob Disminuido | Discontinuob Tono alto o piante Aumentado sobre la lesión | Variablec Puede estar presente por debajo de la clavícula | Ausente |
La estenosis yuxtaanastomótica o perianastomótica de una FAVn, es decir, la estenosis localizada en un área de 2-3cm inmediatamente adyacente a la anastomosis, que puede afectar tanto a la arteria aferente como a la vena eferente, se comporta como una estenosis de inflow y puede diagnosticarse con facilidad explorando la anastomosis y el segmento más distal de la vena arterializada286. A nivel de la anastomosis, el frémito solo se palpa durante la sístole y el pulso está muy aumentado (definido como “water-hammer” según los autores anglosajones), pero desaparece bruscamente cuando el dedo del explorador se mueve en dirección proximal a lo largo del trayecto de la vena y encuentra la ubicación precisa de la estenosis; proximalmente a la estenosis, el pulso es muy débil y puede ser difícil de detectar. En ocasiones, la estenosis ya puede visualizarse como un hachazo en relación con una disminución brusca del calibre venoso.
Diversos estudios prospectivos observacionales han demostrado que la exploración física presenta una elevada sensibilidad, especificidad y precisión para el diagnóstico de la estenosis y, por tanto, debe ocupar una posición destacada entre los métodos de cribado de la FAV204,286,287,301–308. La eficacia de la exploración física efectuada por personal cualificado es equivalente a otros métodos de cribado más sofisticados287,301,302; la clave reside en el criterio del explorador302. En este sentido, en el estudio de Coentrão et al, efectuado en 177 pacientes prevalentes consecutivos con disfunción de la FAVn, la concordancia diagnóstica de la exploración física con la fistulografía para el diagnóstico de la estenosis en todas las localizaciones, fue siempre superior en el caso de un médico residente de nefrología entrenado durante 6 meses en comparación con varios nefrólogos generales sin ningún entrenamiento específico en la exploración de la FAVn (concordancia global: 86 frente a 49%, respectivamente)302.4.2.2. Problemas en la sesión de hemodiálisis
Pueden ser signos indirectos de estenosis de la FAV si aparecen de forma persistente (tres sesiones consecutivas de HD) en relación con las sesiones de HD previas253:
- •
Dificultad para la punción y/o canalización de la FAV.
- •
Aspiración de coágulos durante la punción.
- •
Aumento de la presión arterial negativa prebomba.
- •
Imposibilidad de alcanzar el QB prescrito.
- •
Aumento de la presión de retorno o venosa.
- •
Tiempo de hemostasia prolongado, en ausencia de anticoagulación excesiva.
4.2.3. Test de sobrecarga de la fístula arteriovenosa nativa según el flujo de bomba
Este test se ha demostrado eficaz para diagnosticar la estenosis de inflow de la FAVn (valor predictivo positivo del 76,3%) y se fundamenta en el descenso que se produce del QA con la elevación de la extremidad superior de 0 a 90° durante 30 s y un QB de 400ml/min294. Para su realización, con esta posición elevada del brazo, se disminuye el QB progresivamente a 300, 200 y 100ml/min y se considera el test positivo cuando se dispara la alarma en la máquina de HD al descender la presión arterial negativa por debajo de −250mmHg. La existencia de un test positivo a valores bajos de QB (100-200ml/min) implica la presencia de un QA disminuido y, por tanto, una alta probabilidad de estenosis relevante.
4.3Monitorización y vigilancia de la presión de la fístula arteriovenosaLa presencia de una estenosis significativa de la FAV puede provocar un incremento retrógrado de la presión dentro de este, que puede detectarse mediante los métodos de monitorización y vigilancia de la presión de la FAV10,274,283,303,309–315.
En la tabla 13 se detalla cómo determinar la presión de la FAV. Estos métodos son de utilidad preferente para el seguimiento de FAVn proximales y, sobre todo, de las FAVp10,283. Las venas colaterales de una FAVn radiocefálica pueden provocar una descompresión y disminuir la sensibilidad de estas técnicas en la detección de la estenosis de la FAVn distal10,283.
Determinación de la presión venosa
| Monitorización de la presión venosa dinámica |
| Características generales • De utilidad preferente para la fístula arteriovenosa protésica (FAVp) • Valores obtenidos por el transductor de presión de la línea venosa de la máquina de hemodiálisis (HD) • Agujas de 15 G • Flujo de bomba (QB) 200 ml/min • Hacer la determinación en los primeros 2-5 min del comienzo de la HD • Establecer un valor basal con la media de tres determinaciones en las primeras sesiones de HD • Periodicidad: mensual • Remitir a pruebas de imagen si en tres sesiones consecutivas > 150 mmHg o hay un incremento > 25% del valor basal La presión venosa dinámica (PVD) es la presión generada al realizar el retorno venoso de la sangre dializada por la fístula arteriovenosa (FAV) a través de la aguja venosa. Es medida por el transductor de presión venosa (PV) del monitor de HD. Refleja la presión del interior de la FAV y la resistencia que ofrece la aguja venosa. Sin embargo, la PVD puede estar influenciada por otros factores que inducen a un error en su medición, como son: a) el QB, que puede variar según los diversos estudios entre 50 y 425 ml/min; b) la longitud y el calibre de la aguja empleada; c) la viscosidad de la sangre (hematocrito), que influye en la PVD; d) la presión arterial (PA) del paciente, y e) el desarrollo de venas colaterales, en algunas FAV, que puede ocasionar un fallo en la detección de una estenosis mediante este método. Por estos motivos existe el convencimiento de que la PVD no refleja la presión intraacceso (PIA) y, por tanto, la resistencia causada por una estenosis, lo que conduce a una menor sensibilidad y especificidad que otros métodos, como la medición del flujo de la FAV (QA) y la PV estática |
| Vigilancia de la presión intraacceso o estática |
| En la actualidad, para la determinación de la presión venosa intraacceso (PVIA), se utiliza un método simplificado que no precisa un aparato especial ni costes adicionales y que es reproducible y fácil de realizar. Se basa en la determinación de la presión reflejada en el transductor de la máquina de HD y la presión hidrostática creada por la columna de sangre entre la FAV y la cámara venosa. La PVIA no depende de los cambios en el QB, de la viscosidad sanguínea ni del calibre ni disposición de las agujas; únicamente está en relación con la PA sistémica, por lo que se utiliza el valor de la PVIA normalizada (PVIAn) como el cociente entre la PVIA y la presión arterial media (PAM) sistémica determinada simultáneamente: PVIAn = PVIA / PAM La determinación de PVIAn no permite detectar estenosis localizadas distalmente a la aguja venosa, bien sea en el cuerpo o bien a nivel de la anastomosis arterial del injerto. Para ello, es útil la medición de la presión arterial intraacceso (PAIA), que considera la presión obtenida en el transductor de presión conectado a la línea arterial (simultáneamente a la medición de la presión en la línea venosa) y la altura en centímetros entre la aguja arterial y la cámara arterial Si una estenosis se desarrolla en el cuerpo de la prótesis, entre ambas agujas, la PVIA permanece normal o disminuida mientras que la PAIA está aumentada. Una diferencia entre la PAIA normalizada (PAIAn) y la PVIAn > 0,5 puede ser indicativa de una estenosis intraacceso |
| Requisitos para la determinación de la presión intraacceso |
| 1. Realizar la determinación en los primeros 60 min de la HD con el paciente en situación hemodinámica estable 2. Asegurarse de que el transductor de PA y PV de la máquina de HD está calibrado a cero 3. Establecer un valor basal con la media de tres determinaciones en las primeras sesiones de HD 4. Periodicidad mensual 5. De utilidad preferente en FAVp |
| Cálculo de la presión venosa estática o intraacceso |
| I. Presión venosa intraacceso |
| 1. Medir la PAM calculada por la fórmula: |
| PAM = PAS + 2 × PAD / 3 |
| Donde PAS es la presión arterial sistólica y PAD la presión arterial diastólica |
| 2. Detener la bomba de sangre |
| 3. Pinzar la línea venosa entre el dializador y la cámara venosa |
| 4. Esperar 30 s y la presión que muestre el transductor venoso de la máquina de HD la denominamos “P” (se expresa en mmHg) |
| 5. Despinzar el retorno venoso y programar el flujo de sangre previo |
| 6. Medir la presión hidrostática (PH) que supone la columna de sangre entre la FAV y la cámara venosa de la máquina de HD. PH se expresa en mmHg. Se aplica una de estas dos fórmulas: |
| PH = 0,35 × H + 3,4 |
| Donde H es la altura en centímetros entre el brazo del sillón donde apoya el brazo de la FAV y el punto más alto del nivel de sangre de la cámara venosa |
| PH = H × 0,76 |
| Donde H es la altura en centímetros entre la aguja venosa y el punto más alto del nivel de sangre de la cámara venosa |
| 7. Se calcula la PVIA: |
| PVIA = P + PH |
| Donde P es la presión a bomba parada y PH la presión hidrostática |
| 8. Cálculo de PVIAn: |
| PVIAn = PVIA / PAM |
| II. PA intraacceso |
| 1. Medir la PAM, según la fórmula: |
| PAM = PAS + 2 × PAD/3 |
| 2. Detener la bomba de sangre |
| 3. Pinzar la línea arterial entre la cámara arterial y el dializador |
| 4. Esperar 30 s y la presión que muestre el transductor arterial de la máquina de HD la denominamos “P” (se expresa en mmHg) |
| 5. Despinzar la línea arterial y programar el flujo de sangre previo |
| 6. Medir la PH que supone la columna de sangre entre la FAV y el punto más alto del nivel de sangre de la cámara arterial de la máquina de HD. La PH se expresa en mmHg. Se aplica una de las siguientes fórmulas: |
| PH = 0,35 × H + 3,4 |
| PH = H × 0,76 |
| 7. Se calcula la PAIA: |
| PAIA = P + PH |
| 8. Cálculo de la PAIA normalizada (PAIAn): |
| PAIAn = PAIA/PAM |
| III. Presión intraacceso entre ambas agujas |
| Se calcula la PIA: |
| PIAn = PAIAn – PVIAn |
| Valores umbral de presión indicativos de estenosis | |||
|---|---|---|---|
| a) Fístula arteriovenosa nativa | |||
| Grado y localización de la estenosis | Segmento arterial (PAIAn) | Segmento venoso (PVIAn) | |
| Estenosis ausente o < 50% | 0,13-0,43 | o bien y además | 0,08-0,34 |
| 1. Estenosis de outflow > 50% | > 0,43 | > 0,35 | |
| 2. Estenosis > 50% entre ambas agujas de la vena arterializada | > 0,43 | ≤ 0,35 | |
| 3. Estenosis de inflow > 50% | < 0,3 + hallazgos clínicos | Hallazgos clínicos | |
| b) Fístula arteriovenosa protésica | |||
| Grado y localización de la estenosis | Segmento venoso (PVIAn) | Segmento arterial (PAIAn) | |
| Estenosis ausente o < 50% | 0,35-0,74 | o bien y además | 0,15-0,49 |
| 1. Estenosis > 50% en la anastomosis venosa | > 0,75 | > 0,5 | |
| 2. Estenosis > 50% cuerpo de FAVp (entre ambas agujas) | ≥ 0,65 | < 0,5 | |
| 3. Estenosis > 50% en la anastomosis arterial | < 0,3 | Hallazgos clínicos | |
En la serie pionera de Besarab et al309, la sensibilidad para diagnosticar la estenosis significativa de la FAVp mediante la determinación de la presión estática normalizada (v. apartado 4.3.3.) fue del 91%. En presencia de la estenosis más frecuente diagnosticada en las FAVp, es decir, la estenosis localizada a nivel de la anastomosis entre el extremo venoso del injerto y la vena eferente, se produce un incremento retrógrado de la presión a lo largo de toda la FAVp y el nivel de presión alcanzado está en relación directa con el grado de estenosis existente316.4.3.1. Presión venosa dinámica
La PVD es la presión necesaria para retornar la sangre dializada al interior de la FAV a través de la aguja venosa registrada por el transductor de presión venosa del monitor de HD. En realidad es la suma de la presión necesaria para vencer la resistencia ejercida por la aguja venosa y la presión existente en el interior de la FAV (tabla 13)10.
Existen resultados contradictorios en la bibliografía en relación con la eficacia de la PVD para detectar las FAV con estenosis significativa y alto riesgo de trombosis311,312,317–321. En la serie clásica de Schwab et al312, la incidencia de trombosis que se obtuvo al comparar FAV con estenosis significativa corregida de forma electiva (PVD previa > 150mmHg) y FAV con PVD normal sin sospecha de estenosis fue similar (0,15 frente a 0,13 episodios/paciente/año). Smits et al311 demostraron una reducción significativa de la incidencia de trombosis de FAVp mediante la aplicación de un programa de seguimiento que incluyó determinaciones de la PVD, presión venosa estática y QA. En cambio, este mismo grupo holandés no pudo demostrar previamente la eficacia de la PVD en la predicción de la trombosis de FAVp322.
En resumen, los datos disponibles actualmente que sugieren la utilidad de la PVD para diagnosticar la estenosis o predecir la trombosis son limitados y no concluyentes. No es aceptable utilizar la PVD como método de cribado de la estenosis de la FAV de forma no estandarizada.4.3.2. Presión intraacceso o estática
Se determina en presencia de QB = 0ml/min (bomba detenida). A diferencia de la PVD, la PIA no está influenciada por el tipo de aguja utilizado, el QB o la viscosidad sanguínea.
Para su cálculo se utiliza actualmente la determinación simplificada de Besarab et al10,314, que tiene en cuenta la presión obtenida por el transductor de presión conectado a la línea venosa o arterial del monitor de HD (mmHg) y la altura existente entre la aguja venosa o arterial (o el brazo del sillón del enfermo) y el nivel de sangre de la cámara venosa o arterial (cm).
En una serie nacional, referida a 24 FAVp braquiales, los AV con estenosis presentaron una PIA significativamente superior que el resto de FAV (48,7 ± 22,2 frente a 27,6 ± 0,1mmHg)283. Se considera que una PVD ≥ 150mmHg con un QB = 200ml/min (PV200) se corresponde con una PIA > 60 mmHg313. En la serie ya mencionada de Besarab et al309, la vigilancia de FAVp mediante la presión estática consiguió un descenso de la incidencia de trombosis del 70%.4.3.3. Presión intraacceso estática equivalente o normalizada
Como la PIA está en relación con la presión arterial media (PAM), los resultados de esta se expresan de forma equivalente o normalizada mediante el cociente PIA/PAM10. En ausencia de estenosis significativa y debido a la circulación colateral existente, el cociente PIA/PAM siempre será inferior en la FAVn que en la FAVp. En otro estudio de Besarab et al315, el cociente PIA/PAM en casos sin estenosis fue superior en las FAVp (0,43 ± 0,02; n = 414) respecto a las FAVn (0,26 ± 0,01; n = 286), pero sin diferencias significativas con relación al QA. Se han descrito perfiles de la PIA normalizada según la situación de la estenosis en la FAVp a nivel de la anastomosis arterial, cuerpo (entre las dos agujas) o anastomosis venosa. Se considera que, ante una estenosis situada en la anastomosis venosa de la FAVp, el cociente PIA/PAM a nivel de las agujas venosa y arterial es > 0,5 y 0,75, respectivamente10,315. En la mencionada serie de Caro et al283 existió una diferencia significativa entre el cociente PIA/PAM determinada en las FAVp con y sin estenosis: 0,5 ± 0,2 y 0,3 ± 0,1, respectivamente.
Ante la presencia de una estenosis significativa situada en la anastomosis venosa de una FAVp se produce una relación inversa entre la PIA normalizada y el QA del AV315,323. En esta situación funcional de PIA normalizada elevada y QA bajo, la FAV entra de lleno dentro de la zona de alto riesgo de trombosis274.
4.4Recirculación de la fístula arteriovenosaEn presencia de una estenosis significativa, el QA de la FAV disminuye y aumenta el porcentaje de sangre ya dializada que entra de nuevo al dializador a través de la aguja arterial. En ausencia de errores técnicos, la recirculación aparece como consecuencia de una estenosis grave de la FAV cuando el QA está próximo o desciende por debajo del QB programado (300-500ml/min)10,313,315.
Por tanto, la determinación de la recirculación no es el mejor método para detectar la estenosis de forma precoz279,324. Sobre todo, no se recomienda su aplicación para monitorizar FAVp10,274. En este tipo de FAV, la recirculación aparece de forma tardía en presencia de estenosis severas y riesgo muy alto de trombosis274. Además conviene recordar que la presencia de una estenosis localizada entre las dos agujas de la FAV no causa recirculación324.
La determinación del porcentaje de recirculación puede efectuarse mediante los dos métodos siguientes10:
- •
Determinación de la recirculación de la urea325. Se describe en la tabla 14. La presencia de un porcentaje de recirculación de la urea > 10% es un criterio para investigar una posible estenosis de la FAV mediante una exploración de imagen10.
Tabla 14.Determinación de la recirculación de la urea
• Debe efectuarse al inicio de la sesión de hemodiálisis —HD— (durante los 30-60 min iniciales), siempre y cuando se compruebe la estabilidad hemodinámica del enfermo
• Para su cálculo hay que disminuir la tasa de ultrafiltración (UF) hasta alcanzar el valor cero. En caso de usar la técnica de hemodiafiltración online, habrá que desactivarla
• Obtención de las muestras. Extraer las muestras sanguíneas simultáneamente de la entrada al dializador en línea arterial y a la salida del dializador en la línea venosa al flujo de bomba (QB) programado. Inmediatamente después, reducir el QB hasta 50 ml/min, esperar 20 s y extraer otra muestra de la línea arterial para la determinación de la urea periférica o sistémica (método del flujo bajo). A continuación, proseguir con la pauta de HD programada
• El cálculo del porcentaje de recirculación (R) se realiza según la siguiente fórmula:
R = (UREAp – UREAa/UREAp – UREAv) × 100UREAa: urea de la línea arterial; UREAp: urea periférica; UREAv: urea de la línea venosa.
- •
Determinación de la recirculación mediante técnicas de cribado dilucionales (tabla 15)326–330. Presenta mayor sensibilidad y especificidad que la determinación de la recirculación de la urea328,329. Se han publicado estudios mediante el método de dilución ultrasónica, el método de termodilución utilizando el sensor BTM (blood temperature monitor) y el método de perfusión de glucosa327,328,330. En este sentido, Wang et al330 demostraron que los valores de recirculación superiores al 15% obtenidos mediante el sensor BTM proporcionaban una elevada sensibilidad (81,8%) y especificidad (98,6%) en la detección de FAVn tributarias de intervención electiva. Debe investigarse la presencia de estenosis de la FAV ante un porcentaje de recirculación superior al 5 y al 15% utilizando los métodos de dilución ultrasónica y de termodilución, respectivamente10,330.
Tabla 15.Principales técnicas de cribado dilucionales para la determinación indirecta del flujo sanguíneo (QA) de la fístula arteriovenosa
Con inversión de las líneas sanguíneas de hemodiálisis • Método de dilución por ultrasonidos335
• Método por dilución del hematocrito o de ultrafiltración o Delta-H336
• Método por diferencia de conductividad337
• Método de dialisancia iónica338
• Método de termodilución339
• Método por gradiente de temperatura340
• Método per dilución de la hemoglobina341Sin inversión de las líneas sanguíneas de hemodiálisis • Método óptico transcutáneo342
• Método de perfusión de glucosa343
La disminución sin motivo aparente de la adecuación de la HD evaluada mediante el índice Kt/V o bien por el PRU, puede ser un signo indirecto de disfunción del AV279,331. En un estudio referido a pacientes con estenosis significativa de la FAVn (n = 50), estos presentaron un índice Kt/V inferior (1,15 ± 0,20) con relación al resto de enfermos (1,33 ± 0,16) (p < 0,0001)303. Se considera que la eficacia de la HD se afecta de forma tardía durante la historia natural de la estenosis de la FAV, cuando se pone de manifiesto un porcentaje elevado de recirculación279. Sin embargo se ha publicado que el descenso mantenido del índice Kt, determinado online mediante el método de dialisancia iónica en cada sesión de HD, permite detectar precozmente la recirculación ocasionada por una estenosis significativa de la FAV332.
4.6Métodos de cribado dilucionales para la determinación indirecta del flujo sanguíneo de la fístula arteriovenosaFundamento de los métodos dilucionales
El control objetivo de la función del AV debería efectuarse de forma regular mediante la determinación del QA de la FAV14. En presencia de una estenosis significativa, el QA disminuye siempre independientemente del tipo de FAV (FAVn o FAVp), su localización (extremidad superior o inferior) o la topografía de la estenosis (arteria nutricia, anastomosis, vena arterializada, vena central)10,279,333,334. Esto es muy importante y constituye una ventaja notable respecto a los métodos de primera generación. Por ejemplo, en presencia de una estenosis significativa en la vena arterializada de la FAVn, el QA disminuirá, pero, en cambio, según la posición de la aguja venosa sobre la vena arterializada, es posible que la presión venosa (determinada mediante la PVD) no aumente279.
La introducción en el año 1995 del método de dilución por ultrasonidos por Nicolai Krivitski significó un cambio cualitativo en el campo de estudio de la FAV, ya que por primera vez era posible efectuar la estimación no invasiva de QA335. Desde entonces se han descrito diversas técnicas dilucionales que permiten determinar de forma indirecta el QA durante la HD y, por tanto, efectuar el seguimiento funcional de la FAV (tablas 15 y 16)336–343.
Determinación del flujo (QA) de la fístula arteriovenosa (métodos que precisan de la inversión de las líneas sanguíneas)335,336,338–340
| 1. Método de dilución por ultrasonidos |
| Fue el primer método dilucional descrito. Para el cálculo de QA se precisa de un monitor externo, de la colocación de un sensor Doppler en cada línea de hemodiálisis (HD) y de la administración de un bolo de suero fisiológico isotónico (indicador) durante 6-8 s en la línea arterial, con las líneas de HD en posición normal e invertida. El QA se calcula automáticamente a través del software incorporado al monitor externo (Transonic) mediante la siguiente fórmula: QA = QB × (Sv / Sa – 1) = QB × (1 / R-1) Donde QB es el flujo efectivo de sangre, Sv / Sa es la ratio entre las áreas registradas por los dos sensores Doppler en las líneas venosa y arterial, respectivamente, después de la inyección del bolo del indicador, y R es la recirculación existente con las líneas sanguíneas revertidas 2. Método por dilución del hematocrito o Delta-H |
| Es un método optodilucional que utiliza el monitor Crit-Line III (ABF-mode). Se trata de una técnica fotométrica fundamentada en la relación inversa existente entre la volemia y el hematocrito. El QA se determina durante la primera hora de la sesión de HD a partir de los cambios del hematocrito en relación con cambios bruscos de la ultrafiltración (UF), desde 0,1 hasta 1,8 l/h, con las líneas de HD en configuración normal e invertida. Los cambios del hematocrito son registrados continuamente por un sensor óptico en forma de pinza, que se acopla a una cámara sanguínea insertada entre el dializador y la línea arterial. El QA se calcula mediante la siguiente fórmula: QA = (UFmax – UFmin) × Htomax inv / D Hto inv – D Hto nor Donde UFmax es la UF máxima, UFmin es la UF mínima, Htomax inv es el hematocrito máximo obtenido con las líneas de HD en posición invertida, D Hto inv es el cambio en el hematocrito con las líneas invertidas, y D Hto nor es el cambio en el hematocrito con las líneas de HD en situación normal 3. Método de termodilución |
| El QA se determina utilizando el sensor de temperatura sanguínea BTM incorporado en algunas máquinas de HD. Este método dilucional calcula QA a partir de los valores de recirculación obtenidos con las líneas de HD en posición normal e invertida. El proceso de determinación se inicia a partir de la producción de un bolo de temperatura secundario a la disminución autolimitada (2°C durante 2 min) de la temperatura del líquido de HD. Inicialmente, este descenso térmico es captado por el sensor de temperatura de la línea venosa y, después de viajar por la circulación cardiopulmonar del paciente, regresa ya reducido hacia el dializador y es captado por el sensor de temperatura de la línea arterial. La cuantificación del último bolo de temperatura arterial, en relación con el bolo de temperatura venoso generado inicialmente, permite calcular el porcentaje de recirculación existente con las líneas de HD en configuración normal; el mismo procedimiento se efectúa con las líneas de HD en configuración invertida. A partir de ambos valores de recirculación, el QA se calcula mediante la siguiente fórmula: QA = (QS – TUF) × (1 – RX – RN + RX × RN) / RX – RX × RN – (QS – TUF / QS) × (RN – RX × RN) Donde QS es el flujo efectivo de sangre (ml/min), TUF es la tasa de ultrafiltración (ml/min), RN es la recirculación obtenida con las líneas de HD en posición normal y RX es la recirculación obtenida con las líneas de HD en posición invertida. Para la correcta obtención de los valores de recirculación, es preciso que se mantengan constantes durante todo el tiempo de la determinación tanto QS como TUF 4. Técnica de gradiente de temperatura |
| El QA también se determina utilizando el sensor BTM incorporado en algunas máquinas de HD. La técnica del gradiente de temperatura permite calcular el QA partir de los valores de temperatura obtenidos con las líneas de HD, en posición normal e invertida, sin necesidad de generar ningún bolo de temperatura. El valor de QA se obtiene aplicando la siguiente fórmula: QA = (QB,x – TUF) × Tart,x – Tven,x / Tart,n – Tart,x Donde QB,x es el flujo efectivo de sangre con las líneas de HD en posición invertida (ml/min), TUF es la tasa de ultrafiltración (ml/min), Tart,n es la temperatura de la línea arterial con las líneas de HD en posición normal, Tart,x es la temperatura de la línea arterial con las líneas de HD en posición invertida y Tven,x es la temperatura de la línea venosa con las líneas de HD en posición invertida. Para calcular correctamente el QA se precisa que se mantengan constantes el QB, la TUF y la temperatura del líquido de HD (35,5°C) durante todo el tiempo de la determinación 5. Método de dialisancia iónica |
| La dialisancia iónica es el equivalente al aclaramiento “efectivo” de urea. Para su aplicación se requieren máquinas de HD con sensores incorporados, que permitan la lectura automática de la dialisancia iónica mediante el análisis de la conductividad del líquido de HD a la entrada y a la salida del dializador. Una vez obtenidas mediciones de la dialisancia iónica o aclaramiento de urea (K), tanto en líneas en posición normal como en posición invertida, aplicando la siguiente fórmula se puede obtener el valor de QA: QA = Dinv × (Dnor – TUF) / (Dnor – Dinv) Donde Dinv es el valor de la dialisancia iónica con las líneas de HD en situación invertida, Dnor es la lectura de la dialisancia iónica con las líneas de HD en posición normal y TUF es la tasa de ultrafiltración en ml/min |
El QA se calcula mediante la cuantificación de la diferencia de recirculación existente antes y después de la dilución de un indicador determinado (hematocrito, temperatura), con o sin inversión de las líneas sanguíneas de HD. Si ambas agujas, arterial y venosa, se han insertado en la misma vena arterializada, al invertir las líneas sanguíneas se crea una recirculación artificial con la dilución del indicador que permite calcular el QA según las fórmulas de la tabla 16.
Los métodos dilucionales que precisan de la inversión de las líneas sanguíneas de HD son los más utilizados en la actualidad, pero, en algunos casos, no pueden aplicarse: cuando puncionamos la aguja venosa de retorno sanguíneo en una vena distinta a la arterializada de la FAVn, la recirculación de la FAV es cero y, por tanto, el cálculo de QA es imposible338,344.
En relación con las técnicas dilucionales que calculan el QA durante la HD deberían realizarse dentro de la primera hora de la sesión, para evitar los cambios hemodinámicos secundarios a la ultrafiltración270.
Según las guías europeas, no existe una clara preferencia por ninguno de estos métodos14 y la mayoría de estudios han evidenciado valores equivalentes de QA tras aplicar simultáneamente distintas técnicas dilucionales345–348. En realidad, todas ellas tienen ventajas e inconvenientes en el momento de su aplicación. Por ejemplo, el tiempo necesario para efectuar la determinación de QA mediante el método Delta-H es prolongado (más de 20min), pero, por el contrario, es un método totalmente independiente del explorador y el valor del QA aparece automáticamente en la pantalla del monitor crit-line inmediatamente después de finalizada la exploración270,348. Otros métodos, como el de termodilución o el de gradiente de temperatura, tienen la ventaja de tener el sensor (BTM) incorporado a la máquina de HD, pero, por el contrario, no se obtiene automáticamente el valor del QA obtenido y es preciso efectuar su cálculo posteriormente345,348; ambos métodos solo están validados para la HD de alto flujo con QB de 300ml/min349. La utilización de ciertos dispositivos permite la inversión instantánea de las líneas sanguíneas de HD y, por tanto, reducir significativamente el tiempo necesario para obtener el valor de QA348.Interpretación de los resultados
Cuando se detecta alguna alteración funcional de la FAV mediante cualquiera de estos métodos de cribado debe efectuarse una exploración de imagen ante la sospecha de una estenosis de la FAV. Los criterios funcionales para indicarla son10,15,350:
- •
Valor absoluto de QA. El valor umbral o punto de corte de QA considerado para indicar una prueba de imagen es distinto según las curvas ROC de sensibilidad-especificidad obtenidas en diversos estudios: < 500, 650, 700 o 750ml/min269,288,327,350,351. La guía KDOQI considera un QA < 600ml/min para la FAVp y < 400-500ml/min para FAVn10. La guía europea considera la indicación para efectuar la intervención electiva en caso de un QA < 600ml/min en FAVp o < 300ml/min en FAVn de antebrazo14.
- •
Disminución temporal de QA > 20-25%, indistintamente para FAVn o FAVp, en relación con el QA basal10,15,227,352,353.
Como se ha mencionado previamente, el análisis prospectivo de la evolución temporal de QA tiene un valor superior para diagnosticar la estenosis de la FAV que determinaciones aisladas10. En un estudio longitudinal de Neyra et al353, referido a 95 FAV, la disminución temporal de QA era una potente variable predictiva de trombosis, de forma que el riesgo relativo (RR) de trombosis aumentaba a partir de un descenso de QA > 15% y era máximo (34,7%) cuando el descenso de QA era > 50%. Paulson et al354 consideran que los porcentajes de descenso de QA del 20-25% pueden ser secundarios únicamente a cambios hemodinámicos y que solo debe considerarse significativo un descenso de QA superior al 33%.
Se ha evidenciado que el QA está en relación con el tipo de FAV (p. ej., FAVn radiocefálica frente a humerocefálica), así como con diversos factores demográficos y clínicos propios del paciente345,349,352,355,356. Se ha demostrado una relación inversa entre el QA de la FAV y la edad de los pacientes269,349, de forma que la aplicación de un modelo de regresión lineal múltiple objetivó una disminución de 11,6ml/min del QA basal de la FAV por cada año de vida del paciente manteniendo constantes el resto de variables consideradas269. El perfil funcional de la FAV también depende de su localización, como se demostró en una serie de Treacy et al356 referida a 53 FAVn estudiadas mediante el método de termodilución: el resultado funcional obtenido fue diferente según la topografía de la FAVn en la tabaquera anatómica, antebrazo distal, antebrazo proximal, humerocefálica y humerobasílica, de menor a mayor QA.
En algunas series se ha demostrado una mejor función de la FAV, es decir, un mayor QA, en los enfermos con antecedente de alguna FAV previa ipsilateral345,357. La existencia de una arterialización venosa previa puede explicar esta diferencia funcional. Es decir, el antecedente de una FAV funcionante de localización más distal en la misma extremidad puede condicionar la función de una nueva FAVn secundaria de localización proximal. En este sentido, en una serie de Begin et al357, referida a 45 enfermos portadores de FAVn, el QA de los pacientes con FAVn humerocefálica, objetivado mediante el método de dilución ultrasónica, fue superior en caso de antecedente de una FAVn radiocefálica previamente funcionante en el mismo brazo con relación al resto de enfermos (1.800 ± 919 frente a 1.167 ± 528ml/min).
El control funcional de la FAV mediante determinaciones de QA ha permitido demostrar una incidencia de patología de la arteria nutricia superior a la reportada en series históricas y cifrada actualmente en alrededor del 30% del total de casos de FAV disfuncionante333,358,359. Además, mediante esta vigilancia de la FAV se ha podido tipificar la patología de la arteria radial en la FAVn radiocefálica en 3 grupos bien diferenciados333.
La vigilancia de la FAV mediante mediciones periódicas de QA permite, además de efectuar el diagnóstico de la estenosis de la FAV, identificar a las FAV hiperdinámicas con un QA excesivo capaces de provocar insuficiencia cardíaca360,361. Existe un riesgo elevado de insuficiencia cardíaca secundaria a la FAV cuando el QA de este es ≥ 2.000ml/min o al 20% del gasto cardíaco194. En estos casos es razonable efectuar un seguimiento cardiológico estricto mediante ecocardiogramas periódicos. Por otra parte, también puede producirse descompensación cardíaca ante un QA < 2.000ml/min en pacientes con una reserva miocárdica reducida360.
En algunos casos, la estimación del QA de la FAV y de la presión arterial pulmonar sistólica de forma conjunta por métodos no invasivos (método Delta-H y ecocardiograma Doppler, respectivamente) ha permitido efectuar el diagnóstico, sentar la indicación quirúrgica (banding) y efectuar el seguimiento postoperatorio de la FAV con repercusión cardíaca361.
4.7Pruebas de imagen. Vigilancia de la fístula arteriovenosa mediante ecografía DopplerRecomendaciones(•) nueva R 4.7.1) Se recomienda utilizar indistintamente tanto la ecografía Doppler como los métodos de cribado dilucionales para evaluar la función de la fístula arteriovenosa, ya que presentan un rendimiento equivalente en la determinación del flujo sanguíneo
(•) nueva R 4.7.2) Se recomienda la ecografía Doppler como exploración de imagen de primera elección en manos de un explorador experimentado, sin necesidad de fistulografía confirmatoria, para indicar el tratamiento electivo ante toda sospecha de una estenosis significativa
(•) nueva R 4.7.3) Se recomienda reservar la fistulografía como exploración diagnóstica de imagen únicamente para los casos de resultado no concluyente de la ecografía Doppler y sospecha persistente de estenosis significativa
La ED es una técnica de imagen que permite la exploración, tanto de las FAVn como de las FAVp, mediante un transductor lineal emisor y receptor de ultrasonidos aplicado en los distintos planos de la FAV (tabla 17). A pesar de algunos inconvenientes (técnica dependiente del operador, imposibilidad de su utilización en caso de vendajes y/o heridas y dificultades de valoración en caso de calcificación vascular), el uso de la imagen ecográfica junto con el Doppler presenta una difusión creciente para la vigilancia de la FAV, ya que se trata de un método de segunda generación no invasivo, que no utiliza radiaciones ionizantes ni medios de contraste yodados y que, además, es barato y de fácil disponibilidad362. En la tabla 18 se comentan otras exploraciones por imagen de la FAV.
Vigilancia la fístula arteriovenosa (FAV) mediante ecografía Doppler (ED)
| • La exploración ecográfica comienza con el correcto posicionamiento del paciente y del explorador. Aunque es recomendable realizar el estudio con el paciente en decúbito supino, en los pacientes con disminución de su movilidad es posible realizarlo en sedestación. El miembro estudiado debe situarse más próximo al explorador, con una angulación de unos 45° con respecto al cuerpo del paciente y siempre en una posición cómoda. Situar el miembro estudiado sobre las rodillas del explorador facilita su movilización y el posicionamiento de la sonda ecográfica. Siempre que sea posible, el estudio debe realizarse durante los días en que el paciente no realiza la hemodiálisis (HD) para evitar apósitos o puntos sangrantes, salvo indicación de estudio ecográfico urgente. Si se realiza durante la sesión de HD, en el caso de que el paciente se dialice por un catéter venoso central, la exploración deberá realizarse durante la primera hora para evitar el sesgo de la depleción de volumen |
| • La sonda exploratoria a utilizar debe ser de tipo lineal multifrecuencia, con frecuencias de estudio de entre 7,5 y 12,5 mHz. Es necesario que el ecógrafo incorpore, junto al modo B (escala de grises), el modo Doppler color y Doppler pulsado y que sea capaz de realizar el cálculo de velocidades y del flujo. La disponibilidad de sondas con mayor resolución espacial, aunque con menor penetración, es muy útil para valorar las alteraciones en las paredes vasculares, medición de anastomosis y estudio de los tejidos blandos yuxtaanastomóticos y perivasculares. |
| El estudio se inicia en modo B (escala de grises) valorándose la arteria aferente, la anastomosis arteriovenosa y la vena eferente. La exploración en escala de grises nos proporciona una rápida y valiosa información sobre los siguientes aspectos: |
| 1. Estudio de la pared y diámetros de las estructuras vasculares |
| 2. Diámetro de la anastomosis quirúrgica |
| 3. Presencia de hematomas, fibrosis, edema, calcificaciones vasculares, aneurismas y seudoaneurismas |
| 4. Detección de estenosis morfológicas o venas de calibre reducido |
| 5. Visualización de venas colaterales |
| 6. Tortuosidad de los vasos |
| 7. Proximidad de la vena eferente a la arteria aferente |
| 8. Presencia de trombosis parcial o total de la FAV |
| • El estudio Doppler, tanto en color como en el análisis espectral, confirma los hallazgos que ya han sido detectados en el estudio con escala de grises y aporta datos hemodinámicos de la FAV: morfología de la curva velocimétrica, velocidad de pico sistólica (VPS), velocidad diastólica (VD), índice de resistencia (IR), índice de pulsatilidad (IP) y flujo sanguíneo (QA) |
| • El estudio se realiza a lo largo de todo el miembro, comenzando en la arteria aferente y terminando en las venas centrales, incluyendo la vena yugular interna. Las venas yugular y subclavia se deben explorar en búsqueda de estenosis o trombos secundarios a cateterizaciones previas; es muy importante la valoración de sus ondas espectrales en busca de una fasicidad respiratoria y la transmisión de la pulsatilidad cardíaca que descartarían una oclusión o estenosis central |
| • La onda de análisis espectral debe obtenerse con un ángulo ≤ 60° dado que las medidas de las velocidades obtenidas por encima de ese ángulo darán resultados incorrectos, por el error generado por la fórmula de cálculo de velocidades que se aplica. Un cálculo inadecuado de la velocidad media originaría errores en la medición del flujo. El ángulo de insonación, sin embargo, no afecta al cálculo del IR. La VPS, la VD, el IP y el IR se miden sobre la arteria aferente proximal a la anastomosis a unos 5 cm de esta, para evitar los artefactos producidos por las turbulencias de la anastomosis. La medición del QA por ED, que se realiza sobre la vena eferente, suele proporcionar un valor inexacto y con amplias variaciones, que no se correlacionan con las mediciones realizadas por otros métodos. Las causas de esta inexactitud son: la tortuosidad del vaso venoso, las amplias variaciones en su diámetro, la facilidad de compresión con la sonda ecográfica y las características hemodinámicas (la velocidad del flujo sanguíneo en la vena eferente no es uniforme, no presenta un flujo laminar y, aunque se amplíe el tamaño de la muestra, la curva de velocidades mostrará un espectro amplio de frecuencias). La arteria aferente mantiene un diámetro constante y un recorrido rectilíneo, con una curva espectral limpia y un flujo laminar que permite una medición de su flujo mucho más exacta. La arteria humeral es la de elección para la realización de medidas de QA dada su mejor disposición anatómica en proximidad al codo, que permite conseguir un ángulo < 60° en el momento de la obtención de las curvas de velocidad. La medición de QA en la arteria radial, aunque posible, es fuente de errores dada la dificultad de obtener un ángulo de insonación adecuado; a esto se suma la inexactitud en el cálculo cuando existe un robo (normalmente silente) y aferencia de flujo hacia la fístula desde la arteria cubital vía la arcada palmar desarrollada e invertida, que puede provocar una infraestimación de las medidas |
Otras exploraciones por imagen del acceso vascular
| La angiografía o fistulografía con medio de contraste yodado es una técnica precisa en el diagnóstico de las estenosis de las FAV, que explora todo el trayecto venoso hasta los vasos centrales. Esta exploración permite, además, el tratamiento percutáneo inmediato si las características de la lesión cumplen criterios para este. Por otra parte, se trata de una exploración por imagen invasiva en comparación con la ED, que expone a radiaciones ionizantes, así como a posibles efectos secundarios del contraste yodado y que, en los casos prediálisis, puede provocar un deterioro de la función renal por nefrotoxicidad. Además, no aporta información sobre la función de la FAV (QA) ni sobre las posibles lesiones de los tejidos blandos subyacentes (p. ej., hematomas, abscesos y seromas). Por todo ello, la fistulografía con fines exclusivamente diagnósticos debería evitarse si no se contempla la posibilidad de un tratamiento mediante abordaje terapéutico en el mismo acto. En enfermos alérgicos al contraste yodado o riesgo de nefrotoxicidad, utilizar CO2 como medio de contraste es una alternativa válida al contraste yodado, aunque presenta porcentajes inferiores de precisión, sensibilidad y especificidad en la estimación del grado de estenosis Entre las ventajas de la fistulografía respecto a otras técnicas de imagen, especialmente la ED, destacan la valoración de los vasos centrales y la posibilidad de realizar en un mismo acto el estudio diagnóstico y el tratamiento. Las indicaciones de su realización serían: 1. Sospecha de estenosis o trombosis de vasos centrales con el subsiguiente tratamiento mediante angioplastia (ATP) 2. Estenosis significativa confirmada mediante ED susceptible de tratamiento 3. Sospecha persistente de estenosis significativa a pesar del resultado negativo de la ED En relación con la fistulografía convencional, la tomografía computarizada y la resonancia magnética presenta un perfil coste-beneficio desfavorable. Además, se ha descrito el desarrollo de fibrosis sistémica nefrogénica tras la administración de gadolinio como medio de contraste de la resonancia magnética en pacientes con insuficiencia renal |
ATP: angioplastia transluminal percutánea; ED: ecografía Doppler; FAV: fístula arteriovenosa; QA: flujo sanguíneo.
La ED presenta las siguientes prestaciones en la vigilancia de la FAV52,363,364:
- •
Método de diagnóstico rápido que se puede utilizar in situ en la sala de HD (ecógrafo portátil) ante cualquier alteración de la FAV detectada por algún método de primera generación o por un descenso de QA registrado por alguna técnica dilucional223. En una serie nacional referida a 119 exploraciones mediante ED portátil efectuadas por el nefrólogo en 67 FAV, se diagnosticaron 31 estenosis en 44 casos de dificultad en la punción, sin ningún otro signo de alarma de estenosis223, demostrando la utilidad de la ED utilizada por cualquier profesional bien entrenado.
- •
Método reglado de vigilancia para la evaluación periódica de la FAV. La ED permite la visualización directa de la FAV y, por tanto, permite efectuar la vigilancia morfológica de esta365–368.
- •
Información hemodinámica de la FAV. La ED permite la determinación directa del QA y, por tanto, la vigilancia funcional de la FAV369. El cálculo de QA (ml/min), preferentemente sobre la arteria humeral, se efectúa aplicando la siguiente fórmula367:
QA = Promedio de la velocidad media (m/s) × área transversal (mm2) × 60
Diversos autores han constatado que el QA determinado por ED es significativamente inferior en las FAV con estenosis que en el resto de las FAV303,369. Se ha demostrado una correlación positiva del QA de la vena arterializada de la FAVn determinada por ED con su diámetro y con parámetros de la arteria nutricia (diámetro y QA arteriales)369. También se ha evidenciado una correlación significativa entre el QA obtenido por ED y por diversos métodos dilucionales369,370.
- •
Prueba de imagen de elección para confirmar, localizar y cuantificar la estenosis de la FAV detectada mediante los métodos de cribado antes de efectuar el tratamiento electivo303,371–373. En este sentido se ha descrito una correlación lineal entre la ED y la fistulografía para diagnosticar la estenosis significativa de la FAV373,374. Además, permite efectuar la vigilancia de estenosis consideradas no significativas375. Los criterios ecográficos descritos para el diagnóstico de la estenosis significativa de la FAV se muestran en la tabla 1952,84,376.
Tabla 19.Criterios ecográficos descritos de la estenosis significativa de la fístula arteriovenosa
Criterios morfológicos • Reducción de la luz vascular ≥ 50% Criterios funcionales • Fenómeno de “aliasing” pronunciado como signo de flujo turbulento. Criterio de sospecha, no diagnóstico
PVS > 400 cm/s. No valorable en la zona de la anastomosis
• Ratio de PVS. Es el cociente entre el PVS en la zona de la estenosis y el PVS de la zona preestenótica. Se considera diagnóstico si es > 2
• Características indirectas en la arteria humeral: onda Doppler de alta resistencia, índice de resistencia > 0,6
• Valores de QA obtenidos preferentemente a nivel de la arteria humeral: absoluto < 500 (FAVn) o < 600 (FAVp) ml/min, o bien disminución temporal de QA > 25%FAVn: fístula arteriovenosa nativa; FAVp: fístula arteriovenosa protésica; PVS: pico de velocidad sistólica; QA: flujo sanguíneo.
- •
Permite la valoración morfológica y funcional de otras disfunciones de la FAV no relacionadas con la estenosis o trombosis como aneurismas y seudoaneurismas, hematomas, abscesos, etc.
→ Pregunta clínica X ¿Cuál es el rendimiento de la ecografía Doppler frente a los métodos dilucionales de screening para determinar el flujo sanguíneo de la fístula arteriovenosa?
(Ver ficha de la Pregunta clínica X en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| No se han encontrado estudios comparativos de distintos métodos de determinación de QA en relación con parámetros de la FAV (supervivencia, permeabilidad, trombosis), efectos adversos o mortalidad | Calidad baja |
| Los estudios disponibles proporcionan preferentemente información sobre el resultado de distintas técnicas (curvas ROC), o sobre la concordancia de resultados entre ellas | |
| Los estudios comparativos de las determinaciones de QA muestran una alta concordancia de los valores de QA entre el método de dilución por ultrasonidos y la ED, por una parte, y entre la dilución por ultrasonidos y la termodilución, por otra | Calidad baja |
En el estudio de Weitzel et al377 se evaluó la comparabilidad de las mediciones de QA por ED con las realizadas por dilución con ultrasonidos en 24 pacientes con FAVp. En este estudio también se evaluó la reproducibilidad de la ED en 54 pares de mediciones. Las variaciones de medición por ED eran del 4% para FAVp con Q < 800ml/min (n = 17), del 6% para FAVp con flujo QA entre 801 y 1.600ml/min (n = 22) y del 11% para FAVp con QA > 1.600ml/min (n = 15). El coeficiente de variación medio de la medición fue del 7% para ED en comparación con el 5% para la dilución por ultrasonidos. Los coeficientes de correlación (r) entre las mediciones de QA por ED y por ultrasonografía dilucional fueron 0,79 (n = 24; p < 0,0001), 0,84 para FAVp con QA < 2.000ml/min (n = 20; p < 0,0001) y 0,91 para FAVp con QA < 1.600ml/min (n = 18; p < 0,0001). Concluyeron que la ED produce mediciones reproducibles de QA que se correlacionan con las mediciones por dilución por ultrasonidos377.
El estudio de Schwarz et al378 comparó ambas técnicas usando la fistulografía como referencia. Evaluaron 59 pacientes de HD con FAVn de antebrazo mediante la técnica de dilución con ultrasonidos, la ED y la fistulografía, por este orden, y diagnosticaron estenosis de la FAVn en 41 pacientes que fueron tratados con ATP. La precisión de ambas técnicas, evaluadas por curvas ROC, fue similar: las áreas promedio bajo la curva eran de 0,79 (intervalo de confianza [IC] del 95%, 0,66-0,91) para la dilución con ultrasonidos y de 0,80 (IC del 95%, 0,65-0,94) para la ED. La correlación entre la medición por dilución con ultrasonidos y por ED de los valores obtenidos de QA fue de 0,37 (Spearman = 0,004). El valor de corte óptimo calculado para la predicción de la estenosis fue de 465ml/min para la dilución con ultrasonidos y de 390ml/min para la ED. Ambas técnicas de ultrasonido fueron válidas para predecir la estenosis de la FAVn (p < 0,01). En 13 pacientes se produjo reestenosis en los primeros 6 meses después de la ATP. El QA obtenido medido por dilución con ultrasonidos después de la ATP fue significativamente menor en estos 13 pacientes en comparación con los otros 21 pacientes. Los autores concluyeron que la vigilancia del QA de FAVn para HD mediante técnicas de ultrasonidos proporciona una predicción razonable de estenosis y reestenosis378.
El estudio de Lopot et al379 proporcionó datos de comparación de las mediciones por ED y por ultrasonografía dilucional, que usaban como técnica de referencia en 27 pacientes, y encontró una buena correlación entre ambas técnicas (r = 0,8691).
El estudio de Lin et al380 comparó la reproducibilidad y correlación de las mediciones QA por un método Doppler de QB variable combinado con el análisis espectral de las imágenes Doppler color (VPFDUM), con el método de dilución ultrasónica y el método de ED convencional, en 73 pacientes en HD, 70 con FAVn y 3 con FAVp. El valor medio de QA por VPFDUM (870,8 ± 412,0ml/min) era muy similar al de las mediciones por dilución ultrasónica (868,6 ± 417,9ml/min), pero mayor que el de las mediciones por ED convencional (685,1 ± 303,6ml/min; p < 0,005). Los valores medios de coeficiente de variación fueron similares por VPFDUM (1,6%) y dilución ultrasónica (1,4%), pero inferiores a los de ED convencional (6,8%, p < 0,01). El coeficiente de correlación y el coeficiente de correlación intraclase (CCI) de las mediciones repetidas QA por VPFDUM (0,985 y 0,993; p < 0,001) fueron también similares a los de la dilución ultrasónica (0,992 y 0,995; p < 0,001), pero ligeramente superiores a los de ED convencional (0,917 y 0,948; p < 0,005). La reproducibilidad de la técnica VPFDUM (r = 0,98; p < 0,0001) y la correlación entre la VPFDUM y la dilución ultrasónica (r = 0,99; p < 0,0001) en las mediciones de QA fueron buenas. La permeabilidad no asistida de la FAV a los 6 meses fue significativamente inferior en pacientes con un QA < 500ml/min que en aquellos con un QA > 500ml/min (el 13,6 frente al 92,2%; p < 0,0001). Concluyeron que la técnica VPFDUM es un procedimiento no invasivo, preciso y fiable para la medición de QA y con poder predictivo en la supervivencia de la FAV380.Ecografía Doppler frente a otros métodos dilucionales
Roca-Tey et al369 efectuaron un estudio funcional comparativo entre los métodos ED y Delta-H en la determinación de QA de la FAV (84,8% de FAVn) en 33 pacientes prevalentes en HD crónica. En el análisis de concordancia diagnóstica, el CCI entre los valores de QA de la FAV obtenidos mediante ambos métodos fue de 0,74 (p < 0,0001). Los autores concluyeron que los métodos ED y Delta-H son superponibles para la determinación del QA de la FAV369.
Fontseré et al381 compararon la termodilución en la medición del QA respecto a la ED, que utilizan como técnica de referencia, en un estudio transversal realizado en 64 pacientes en programa de HD mediante FAVn (54) y FAVp (10). El QA medio obtenido por ED fue de 1.426 ± 753ml/min para FAVn y de 1.186 ± 789ml/min para FAVp. Los valores obtenidos por termodilución fueron 1.372 ± 770 para FAVn (sesgo: 54,6; CCI: 0,923) y 1.176 ± 758 para FAVp (sesgo: 10,2; CCI: 0,992). En el subgrupo de 28 pacientes portadores de FAVn radiocefálica lateroterminal, el QA obtenido por ED fue de 1.232 ± 767ml/min. A nivel de la arteria radial, 942 (CCI: 0,805); arteria radialcubital, 1.103 (CCI: 0,973); vena cefálica, 788 (CCI: 0,772), y con termodilución, 1.026 (CCI: 0,971). Concluyeron que la termodilución es un método indirecto útil para la medición de QA. En el subgrupo de pacientes con FAVn radiocefálicas resultó más preciso el sumatorio de QA obtenido en arterias radial y cubital. Sin embargo, la termodilución también presentó una excelente correlación con la arteria humeral381.
Sacquépée et al382 estudiaron la correlación de los valores de QA obtenidos mediante termodilución y ED en 15 pacientes dializados a través de FAVn (14) y FAVp (1). El promedio de QA fue 1.088 ± 576 l/min medido por ED y 1.094 ± 570 medido por termodilución. La comparación de los valores de QA obtenidos por ambas técnicas mostró una fuerte relación lineal.De la evidencia a la recomendación
Debido a su elevada concordancia para la determinación del QA de la FAV, los métodos de cribado dilucionales como la dilución por ultrasonidos o el Delta-H o la termodilución son equivalentes a la ED369,370,377–382.
→ Pregunta clínica XI ¿La ecografía Doppler reglada efectuada por un explorador experimentado puede sustituir a la angiografía comogold standardpara el diagnóstico de confirmación de la estenosis significativa de la fístula arteriovenosa?
(Ver ficha de la Pregunta clínica XI en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Los valores de sensibilidad y especificidad de la ED efectuada por un explorador experimentado para el diagnóstico de confirmación de la estenosis significativa de la FAV son elevados (el 89,3 y el 94,7%, respectivamente) en relación con la fistulografía, pero no lo suficiente para poder sustituirla | Calidad baja |
| No se dispone de estudios controlados que hayan evaluado las consecuencias clínicas de estudiar a los pacientes con disfunciones en la FAV para la HD que hagan sospechar una posible estenosis significativa, por medio de solo ED o por medio de angiografía |
Para la formulación de recomendaciones en esta guía se realizó un metaanálisis (utilizando el programa MetaAnalyst, 11-11-2013), que incluyó 4 estudios realizados en los últimos 10 años que proporcionan datos completos para poder calcular la sensibilidad y especificidad de la ED reglada frente a la fistulografía, para el diagnóstico de confirmación de la estenosis significativa de la FAV en pacientes con sospecha clínica de estenosis364,374,383,384. El metaanálisis, con datos de 755 pacientes, de los cuales 319 fueron diagnosticados de estenosis significativa por fistulografía (prevalencia: 42,3%), proporcionó unos valores globales elevados de sensibilidad del 89,3% (IC del 95%, 84,7-92,6) y de especificidad del 94,7% (IC del 95%, 91,8-96,6) para la ED (figs. 3 y 4). Esos valores son altos, pero insuficientes para poder considerar a la ED como sustituta de la fistulografía como gold standard para el diagnóstico de confirmación de la estenosis significativa de la FAV. Ninguna prueba diagnóstica que deje sin detectar el 10% de los casos puede ser considerada como gold standard.
– Sensibilidad de la ecografía Doppler frente a la fistulografía para el diagnóstico de confirmación de la estenosis significativa de la fístula arteriovenosa ante la sospecha clínica de estenosis obtenida en un metaanálisis de cuatro estudios: 89,3% (intervalo de confianza del 95%, 84,7-92,6).
– Especificidad de la ecografía Doppler frente a la fistulografía para el diagnóstico de confirmación de la estenosis significativa de la fístula arteriovenosa ante la sospecha clínica de estenosis obtenida en un metaanálisis de cuatro estudios: 94,7% (intervalo de confianza del 95%, 91,8-96,6).
Sin embargo, la respuesta a esta pregunta clínica nos conduce a plantear otras cuestiones: ¿cuál es la prueba inicial con la que se debe evaluar a los pacientes con sospecha de estenosis de la FAV: la ED o la fistulografía?, ¿es suficiente el resultado de la ED para indicar la intervención electiva en los pacientes con una sospecha de estenosis generada tras aplicar otros métodos de cribado?
Las decisiones clínicas no dependen únicamente de la sensibilidad y especificidad de la ED para diagnosticar correctamente la estenosis significativa, sino que también dependen, en gran medida, de la prevalencia real de estenosis significativa entre los pacientes con sospecha de estenosis generada tras aplicar métodos de monitorización y/o vigilancia de la FAV. Para una sensibilidad y especificidad fijas, los errores y aciertos diagnósticos van a ser muy influenciados por la prevalencia de la patología estudiada. Como se puede observar en la tabla 20, el valor predictivo positivo de la ED, es decir, el porcentaje de pacientes que presentan realmente una estenosis significativa entre los diagnosticados por ED, aumenta progresivamente a medida que aumenta la prevalencia de estenosis significativa entre los pacientes con sospecha de presentarla. De esta forma, cuando la prevalencia de estenosis significativa es del 50%, el valor predictivo positivo de la ED es del 94,4% y este porcentaje se incrementa a medida que se alcanzan prevalencias superiores.
Valores predictivos positivos (VPP) y negativos (VPN) de la ecografía Doppler según la prevalencia de estenosis significativa
| Prevalencia de estenosis significativa (%) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| VPP (%) | 0,0 | 65,2 | 80,8 | 87,8 | 91,8 | 94,4 | 96,2 | 97,5 | 98,5 | 99,3 | 100,0 |
| VPN (%) | 100,0 | 98,8 | 97,3 | 95,4 | 93,0 | 89,8 | 85,5 | 79,1 | 68,9 | 49,6 | 0,0 |
| Acierto (%) | 94,7 | 94,16 | 93,62 | 93,08 | 92,54 | 92 | 91,46 | 90,92 | 90,38 | 89,84 | 89,3 |
La opción de utilizar la ED como prueba diagnóstica inicial para evaluar una posible estenosis significativa tendría, de entrada, una gran repercusión: se dejaría de realizar la angiografía siempre a todos los pacientes, prueba invasiva, con posibles efectos secundarios y de mayor coste.
Es indudable que hay dos grupos de pacientes en los que hay una ganancia clara en usar la ED sin efectuar la fistulografía, ya que se llegaría a la misma conclusión que usando la fistulografía, se expondría a los pacientes a menores riesgos y es económicamente más barato. Por un lado, estarían los verdaderos positivos, pacientes con estenosis significativa en los que se indicaría directamente la intervención preventiva de la estenosis. Por otro lado, estarían los verdaderos negativos, pacientes sin ninguna estenosis que se mantendrán en el programa de seguimiento habitual.
Hay que considerar especialmente los casos falsos negativos, es decir, FAV con estenosis significativa en los que la ED no ha sido capaz de establecer el diagnóstico. En estos casos seleccionados, la sospecha persistirá, a pesar del resultado de la ED y, por tanto, parece razonable efectuar entonces la fistulografía, que acabará proporcionando el diagnóstico de certeza de la estenosis.
Por tanto, el uso de la ED como prueba diagnóstica de imagen de primera elección en pacientes con sospecha de estenosis significativa parece una decisión sensata, tanto desde el punto de vista clínico como económico. Dado que los porcentajes de falsos positivos son bajos, se podría tratar de forma electiva a quienes dieran positivo en la ED, sin realizarles fistulografía de confirmación. En pacientes con sospecha persistente de estenosis significativa en los que una ED previa no ha sido concluyente sería recomendable realizar una fistulografía y efectuar el tratamiento preventivo si se confirma entonces la estenosis.
No se dispone de estudios controlados que hayan evaluado las consecuencias clínicas de estudiar a los pacientes con disfunciones en la FAV que hagan sospechar una posible estenosis significativa, por medio de solo ED o por medio de angiografía.
No se han identificado estudios relevantes relacionados con las preferencias de los pacientes. Parece lógico pensar que, si se diera igualdad de rendimientos clínicos, los pacientes preferirían las técnicas no invasivas y que no supongan exposición a radiaciones.
Tampoco se han identificado estudios relevantes relacionados respecto al uso de recursos y costes. La ED es una técnica más barata que la fistulografía. La estrategia diagnóstica de iniciar el estudio con ED y reservar la fistulografía para los casos de sospecha repetida que han dado negativo en la ED es más coste-efectiva que realizar la fistulografía a todos los pacientes con sospecha de estenosis.De la evidencia a la recomendación
Aunque no puede sustituir a la fistulografía como gold standard, la ED es un método diagnóstico de imagen no invasivo, inocuo para el paciente, presenta unas elevadas sensibilidad y especificidad para el diagnóstico de la estenosis significativa, aporta una valiosa información funcional adicional, su versión portátil puede utilizarse in situ en la sala de HD y, además, presenta un perfil de coste-efectividad favorable. Por todo ello, de forma unanime, el GEMAV considera que la mejor estrategia diagnóstica es realizar la ED como exploración de imagen inicial ante toda sospecha de estenosis y reservar a la fistulografía para los casos de resultado negativo y sospecha persistente de estenosis.
R 4.7.2) Se recomienda la ecografía Doppler como exploración de imagen de primera elección en manos de un explorador experimentado, sin necesidad de fistulografía confirmatoria, para indicar el tratamiento electivo ante toda sospecha de una estenosis significativa
R 4.7.3) Se recomienda reservar la fistulografía como exploración diagnóstica de imagen únicamente para los casos de resultado no concluyente de la ecografía Doppler y sospecha persistente de estenosis significativa
(•) nueva R 4.8.1) Según el concepto vigente de estenosis significativa, no se recomienda efectuar la vigilancia de la fístula arteriovenosa protésica mediante los métodos de cribado de segunda generación, tanto con las técnicas dilucionales para estimar el flujo sanguíneo como con la ecografía Doppler
(•) nueva R 4.8.2) Según el concepto vigente de estenosis significativa se recomienda efectuar la monitorización de la fístula arteriovenosa protésica mediante los métodos de cribado de primera generación
(•) nueva R 4.8.3) Según el concepto vigente de estenosis significativa se recomienda utilizar tanto los métodos de primera como de segunda generación para la monitorización y vigilancia de la fístula arteriovenosa nativa
→ Pregunta clínica XII ¿Qué método de monitorización o de vigilancia no invasivo de cribado de la fístula arteriovenosa para hemodiálisis presenta poder predictivo de estenosis o de trombosis o de aumento de la supervivencia de la fístula arteriovenosa protésica en el enfermo prevalente, y con qué periodicidad?
(Ver ficha de la Pregunta clínica XII en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| En el año 2008 se publicaron dos metaanálisis que cuestionaban el papel de los métodos de vigilancia del AV según el criterio vigente (KDOQI) de estenosis significativa385,386. El beneficio atribuido por los estudios observacionales a los métodos de vigilancia de FAVp, en relación con la disminución de la incidencia de trombosis y al aumento de su supervivencia, desaparece en los ensayos clínicos controlados y aleatorizados354 | Calidad moderada |
| No se han evidenciado diferencias significativas en la estimación del riesgo de trombosis o de pérdida definitiva de la FAVp si a la monitorización habitual mediante los métodos de primera generación se añade la vigilancia de la FAVp mediante determinaciones periódicas de QA. La vigilancia activa mediante ED implica una mayor utilización de los recursos sanitarios | |
| El metaanálisis de Tonelli et al385 mostró que el cribado activo con ultrasonidos se asocia a un mayor uso de ATP y a un menor riesgo de inserciones de CVC, siendo las diferencias no significativas en relación con el número de fistulografías, intervenciones electivas u hospitalizaciones | |
| No hay estudios sobre el coste-efectividad ni sobre el impacto presupuestario que supondría la generalización del uso continuado y periódico de técnicas de cribado activo en pacientes en HD con una FAVp en nuestro medio | |
| No se han identificado estudios relevantes relacionados con las preferencias de los pacientes | |
Se han encontrado 2 revisiones sistemáticas con metaanálisis, ambas publicadas en 2008, que abordan los efectos clínicos de la monitorización y de la vigilancia de la FAVp385,386. La revisión de Tonelli et al385 solo incluye ensayos clínicos aleatorizados (ECA), mientras que la de Casey et al386 incluye también estudios no aleatorizados. Ambos estudios localizan los mismos ensayos clínicos y llegan a similares conclusiones. Para esta guía se han recogido los metaanálisis de Tonelli et al385, por proporcionar datos más completos en el análisis estratificado para pacientes con FAVp.Beneficio clínico del cribado frente a la práctica habitual
La revisión sistemática con metaanálisis de Tonelli et al385 incluyó seis ensayos clínicos, que compararon el cribado activo de FAVp (usando mediciones de QA o ED) frente al seguimiento habitual mediante los métodos de monitorización en 446 pacientes. En este estudio, no se encontraron diferencias significativas en la tasa de trombosis de FAVp entre los métodos activos de vigilancia y los de monitorización habitual (RR: 0,94; IC del 95%, 0,77-1,16). Con datos de un ensayo clínico y 126 pacientes, no se encontraron diferencias estadísticamente significativas en el tiempo hasta la trombosis de la FAVp entre las dos opciones de seguimiento (hazard ratio [HR]: 1,13; IC del 95%, 0,71-1,80). El metaanálisis con datos de cuatro ensayos clínicos y de 381 pacientes no mostró diferencias estadísticamente significativas en la pérdida de la FAVp entre los métodos activos de vigilancia y los de monitorización habitual (HR: 1,08; IC del 95%, 0,83-1,40). Los datos de dos ensayos clínicos y de 315 pacientes, tampoco mostraron diferencias en el tiempo hasta la pérdida de la FAVp (HR: 0,51; IC del 95%, 0,15-1,74; alta heterogeneidad estadística I2: 85%).
Se han descrito algunas causas que pueden explicar estos decepcionantes resultados obtenidos por los ensayos clínicos en la vigilancia de la FAVp316,354,387–394:
- •
Diámetros de la arteria y de la vena implicados en la anastomosis. Este diámetro controla la relación entre el QA (o la presión venosa) y la estenosis. En caso de una baja ratio arteria/vena, la progresión de la estenosis es tan rápida que la vigilancia periódica es incapaz de detectar una disminución de QA (o un aumento de la presión venosa) antes de la trombosis.
- •
PAM. La disminución significativa de la presión arterial puede jugar un papel central en algunos casos de trombosis de FAVp sin sospecha previa de estenosis.
- •
Intervención preventiva mediante ATP. La ATP de una lesión estenótica estable o de crecimiento lento puede estimular la hiperplasia de la íntima, ocasionar una reestenosis de rápido desarrollo e influir negativamente sobre la supervivencia de la FAVp.
- •
Tamaño de la muestra. Un tamaño insuficiente de la muestra en los estudios publicados podría explicar los resultados obtenidos.
No hay diferencias significativas en el riesgo de trombosis o en la supervivencia de la FAVp si se añaden los métodos de vigilancia a los métodos habituales de monitorización. Por tanto, según el concepto vigente de estenosis significativa recogido en la guía KDOQI10, no podemos recomendar la vigilancia de la FAVp mediante los métodos de cribado de segunda generación, tanto las técnicas dilucionales para estimar el QA como la ED. La aplicación de estos métodos en las FAVp no es predictiva de trombosis ni permite aumentar la supervivencia de estas respecto a los métodos de primera generación, según los criterios actuales de estenosis significativa. Se recomienda la monitorización de la FAVp mediante los métodos de cribado de primera generación287.
R 4.8.1) Según el concepto vigente de estenosis significativa, no se recomienda efectuar la vigilancia de la fístula arteriovenosa protésica mediante los métodos de cribado de segunda generación, tanto con las técnicas dilucionales para estimar el flujo sanguíneo como con la ecografía Doppler
R 4.8.2) Según el concepto vigente de estenosis significativa, se recomienda efectuar la monitorización de la fístula arteriovenosa protésica mediante los métodos de cribado de primera generación
→ Pregunta clínica XIII ¿Qué método de monitorización o de vigilancia no invasivo de screening de la fístula arteriovenosa para hemodiálisis presenta poder predictivo de estenosis o de trombosis o de aumento de la supervivencia de la fístula arteriovenosa nativa en el paciente prevalente y con qué periodicidad?
(Ver ficha de la Pregunta clínica XIII en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| La monitorización clínica por medio del examen físico es una prueba con alta sensibilidad y una aceptable especificidad, que proporciona altos valores predictivos positivos y negativos para el diagnóstico de la estenosis significativa de la FAVn. La vigilancia activa mediante los métodos dilucionales y la ED disminuye el riesgo de trombosis y la necesidad de utilizar CVC para la HD. Actualmente, no existe evidencia en contra de la aplicación rutinaria de los métodos de cribado de segunda generación (técnicas dilucionales para determinar el QA y la ED) para la vigilancia de la FAVn. Tanto los métodos de primera como de segunda generación son eficaces para reducir la incidencia de trombosis de FAVn | Calidad baja |
| No hay evidencia fiable para efectuar ninguna recomendación sobre la periodicidad de la aplicación de los métodos de segunda generación | |
| No hay estudios sobre el coste-efectividad ni el impacto presupuestario que supondría la generalización del uso continuado y periódico de técnicas de cribado activo por mediciones de QA y ED en estos pacientes en nuestro medio |
Un estudio prospectivo de Asif et al204 con 142 pacientes con FAVn analizó la precisión del examen físico para detectar lesiones estenóticas comparándolo con la fistulografía, que se considera la prueba de referencia. La sensibilidad y la especificidad del examen físico fueron del 92 y el 86%, respectivamente, para estenosis de outflow, y del 85 y el 71% para estenosis de inflow.
Un estudio de Campos et al303 analizó la precisión del examen físico y la medición de presión para detectar lesiones estenóticas comparándolos con la ED, que usan en el estudio como técnica de referencia. De los 84 pacientes analizados, 50 de ellos, esto es el 59%, dieron positivo a estenosis en el estudio por ED. En el examen físico dieron positivo 56 pacientes, suponiendo para la prueba una sensibilidad del 96%, una especificidad del 76%, un valor predictivo positivo del 86% y un valor predictivo negativo del 93%. En la medición de presión intraacceso dieron positivo 34 pacientes, el 40%, suponiendo para la prueba una sensibilidad del 60%, una especificidad del 88%, un valor predictivo positivo del 88% y un valor predictivo negativo del 60%.Métodos de segunda generación
Respecto a los métodos de segunda generación hay que destacar varios metaanálisis publicados385,386,395. Al valorar los datos de cuatro ensayos clínicos controlados y de 360 pacientes, Tonelli et al385 describen que el cribado activo por ultrasonidos disminuye de manera estadísticamente significativa el riesgo de trombosis de la FAVn (RR: 0,47; IC del 95%, 0,280,77). Además, el tiempo transcurrido hasta llegar a la trombosis de la FAVn fue significativamente mayor en el grupo “vigilancia” respecto al grupo “control” (HR: 0,30; IC del 95%, 0,16-0,56). Respecto a la pérdida de la FAV, al hacer metaanálisis con datos de dos ECA y de 141 pacientes, no se encuentran diferencias estadísticamente significativas (RR: 0,65; IC del 95%, 0,28-1,51) y, por último, respecto al tiempo a la pérdida del acceso, con datos de un ECA y de 60 pacientes, se encuentran diferencias estadísticamente ligeramente significativas (HR: 0,38; IC del 95%, 0,14-0,99)385.
Por otro lado, después de analizar los criterios funcionales escogidos para el diagnóstico de la estenosis en diversos ensayos clínicos controlados y no controlados, así como estudios observacionales, Tessitore et al395 llegaron a la conclusión de que la vigilancia de la FAVn mediante determinaciones de QA disminuye de forma significativa el riesgo de trombosis. En este sentido se ha publicado en nuestro país un estudio de casos y controles que demuestra una incidencia de trombosis de la FAV (mayoría de FAVn) significativamente inferior en pacientes dializados en una unidad de HD hospitalaria y cotrolados mediante determinaciones de QA, en relación con pacientes sin seguimiento por QA que se dializaban en un centro periférico de HD352. Salman analizó cuatro ECA (n = 395) para valorar el beneficio de los métodos de vigilancia en la FAVn mediante determinaciones de QA y el resultado fue positivo para los tres estudios que tenían como objetivo primario la reducción de la tasa de trombosis396. Muchayi et al397 efectuaron un metaanálisis utilizando estos mismos cuatro estudios y demostraron una reducción no significativa del 36% en el riesgo de trombosis mediante la vigilancia de la FAVn.
Por lo que respecta a la supervivencia de la FAVn, el metaanálisis de Tessitore et al395, efectuado sobre dos ensayos clínicos controlados, demostró una reducción a la mitad del riesgo de pérdida de la FAVn utilizando un cribado mediante determinaciones de QA, pero sin alcanzar la significación estadística dado que se trata de dos estudios unicéntricos (Verona, Italia), con un tamaño de la muestra y un seguimiento limitados276,398. Recientemente se han presentado los resultados preliminares de un ensayo clínico controlado y multicéntrico efectuado en España (METTRO) sobre el efecto de los métodos de segunda generación en relación con la monitorización convencional sobre la incidencia de trombosis y la supervivencia de la FAVn, y se demuestra de forma significativa una menor tasa de trombosis y una mayor supervivencia primaria asistida después de 1 año de seguimiento399.
La aplicación de las técnicas de cribado de segunda generación para la vigilancia de la FAVn posibilita disminuir la incidencia de trombosis y, por tanto, disminuir la tasa de implantación del CVC y su morbimortalidad asociada269,368,385.Uso de recursos y costes
No se han encontrado estudios específicos de coste-efectividad que analicen esas intervenciones en el entorno de aplicación de la guía. Tampoco hay estudios sobre el impacto presupuestario, que podría suponer la generalización del uso continuado y periódico de técnicas de cribado activo por ED en pacientes con FAVn en nuestro medio.
De la evidencia a la recomendación
Se recomienda la aplicación periódica de los métodos de cribado de segunda generación (tanto las técnicas dilucionales para estimar el flujo de la FAV o QA como la ED) para la vigilancia de la FAVn, ya que la evidencia existente indica un efecto beneficioso en relación con la reducción de la incidencia de trombosis y de la tasa de implantación de CVC. No existen argumentos en contra de estos métodos en relación con la tasa de trombosis y la supervivencia de la FAVn.
4.9Factores predictivos de trombosis de la fístula arteriovenosa con estenosisRecomendaciones(•) nueva R 4.9.1) Se recomienda considerar una estenosis como significativa ante toda disminución de la luz vascular en una fístula arteriovenosa nativa o en una fístula arteriovenosa protésica demostrada mediante ecografía Doppler que cumple con todos los criterios de alto riesgo de trombosis (los dos criterios principales y, como mínimo, un criterio adicional)
(•) nueva R 4.9.2) Se recomienda efectuar sin demora la intervención electiva mediante angioplastia transluminal percutánea y/o cirugía ante el diagnóstico de una estenosis significativa en una fístula arteriovenosa por presentar alto riesgo de trombosis
(•) nueva R 4.9.3) Se recomienda considerar una estenosis como no significativa ante toda disminución de la luz vascular en una fístula arteriovenosa nativa o en una fístula arteriovenosa protésica demostrada mediante ecografía Doppler que no cumple con todos los criterios de alto riesgo de trombosis
(•) nueva R 4.9.4) Se recomienda no efectuar la intervención electiva ante el diagnóstico de una estenosis no significativa en una fístula arteriovenosa por presentar bajo riesgo de trombosis
(•) nueva R 4.9.5) Se recomienda efectuar siempre un control estricto mediante los métodos de cribado de segunda generación ante toda fístula arteriovenosa con estenosis no significativa por el riesgo de progresión a significativa
→ Pregunta clínica XIV ¿Cuáles son los factores y variables demográficos, clínicos y hemodinámicos con poder predictivo de trombosis en una fístula arteriovenosa que presenta estenosis?
(Ver ficha de la Pregunta clínica XIV en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| No se han encontrado estudios que analicen distintos posibles factores de riesgo de trombosis, tanto por separado como no, expresamente en pacientes con estenosis de la FAV | Calidad baja |
| No se ha encontrado ningún factor que por separado sea un buen predictor de riesgo de trombosis de la FAV | |
| Los resultados de estudios que analizan la utilidad de distintas mediciones del QA para predecir trombosis en el acceso y utilizan análisis de curvas ROC, indican que los métodos de vigilancia del QA son pobres en la predicción de la trombosis de la FAVp y llevarían a que muchos pacientes pueden someterse a procedimientos innecesarios y costosos | |
| Respecto a otros factores no relacionados con el seguimiento de la FAV, ninguno de los estudios publicados encuentra riesgo aumentado de trombosis en pacientes con valores más altos de homocisteinemia | |
| No se han identificado estudios relevantes relacionados con valores y preferencias de los pacientes | |
| No se han identificado estudios relevantes relacionados con el uso de recursos y costes | |
| Sin embargo, a partir de los datos existentes en la actualidad, existen algunos factores morfológicos y funcionales que se consideran criterios adicionales con suficiente poder predictivo para discernir si una FAVn o una FAVp con estenosis tienen un riesgo alto o bajo de trombosis. Por tanto, el concepto de estenosis significativa debería modificarse e incluir únicamente a las FAV con elevado riesgo de trombosis por cumplir criterios de riesgo adicionales y, por tanto, tributarios de intervención correctiva | |
La aplicación de diversos métodos de vigilancia de la FAV en la práctica clínica habitual ha puesto de manifiesto casos de trombosis de la FAV precedidas de un registro de QA > 600ml/min sin estenosis aparente, así como casos de estenosis > 50% estables en el tiempo que nunca se llegan a trombosar400–403. Por tanto, ante toda reducción de la luz vascular > 50% de FAVn o FAVp es necesario conocer el riesgo de trombosis de esta. Es preciso identificar si esta estenosis tiene alto riesgo de trombosis, es decir, una elevada probabilidad de progresar en el tiempo y provocar la oclusión total de la luz vascular de la FAV si no se efectúa de modo precoz la intervención electiva mediante ATP o cirugía. En el otro lado de la balanza, si se efectúa un tratamiento preventivo en caso de una reducción de la luz vascular > 50% con bajo riesgo de trombosis en FAVn o FAVp, además de ser un procedimiento innecesario y de coste económico remarcable, podemos producir una indeseada reestenosis acelerada y provocar la trombosis de la FAV que no se hubiera producido con la abstención terapéutica.
Es necesario identificar los factores o variables (demográficos, clínicos, hemodinámicos) predictivos de trombosis en toda FAV con estenosis. Su presencia o su ausencia definirá el riesgo de trombosis existente y, por tanto, permite distinguir si cualquier reducción de la luz vascular > 50% de FAVn o FAVp tiene un alto o un bajo riesgo de trombosis.
En este sentido, Paulson et al403 ya demostraron, en un estudio prospectivo en el año 2000, mediante el análisis de la curva ROC, que utilizar únicamente la variable funcional QA no proporcionaba suficiente valor predictivo de trombosis de FAVp para ser utilizado como criterio aislado en la toma de decisiones, y concluyeron que la inclusión de otras variables predictivas adicionales en asociación con el QA podría proporcionar el valor predictivo necesario.
Malik et al367 publicaron, en el año 2005, un ECA en 192 pacientes con FAVp con el objetivo de comparar la supervivencia de la FAVp (seguimiento medio, 392 ± 430 días) entre dos subgrupos de pacientes, que se clasificaron según la distinta estrategia de monitorización y vigilancia aplicada: grupo 1 (n = 97) mediante cribado tradicional (monitorización clínica, presión venosa y QA) asociado a la vigilancia mediante ED cada 3 meses y grupo 2 (n = 95) únicamente mediante cribado tradicional. La supervivencia acumulada de la FAVp fue significativamente superior en el grupo 1 en relación con el grupo 2, que los autores atribuyeron al diagnóstico precoz de la estenosis y, por tanto, a intervenciones electivas más frecuentes sobre la estenosis de la FAVp367. A diferencia de otros ensayos clínicos en FAVp con resultados negativos404, ¿por qué se obtuvo este resultado positivo en este estudio? La respuesta está en la metodología, ya que las indicaciones de la ED para efectuar la fistulografía y/o el procedimiento terapéutico mediante ATP o cirugía fueron:
- •
Hallazgo de una estenosis significativa, definida por la presencia de una ratio de pico de velocidad sistólica (PVS) > 2, con o sin disminución de QA.
- •
Hallazgo de una estenosis no significativa en apariencia, pero asociada con descenso temporal de QA > 25%.
En caso de incertidumbre de estenosis significativa o no significativa, la existencia de un diámetro residual < 2,0mm fue una indicación adicional para la fistulografía. Los pacientes que solo cumplían uno de los criterios mencionados se exploraron a las 4-6 semanas mediante ED367. Es decir, en este estudio ya se introdujeron una serie de factores ecográficos adicionales que permiten actuar de forma preventiva sobre estenosis significativas con riesgo de trombosis y prolongar la supervivencia de la FAVp.
El mismo grupo publicó, en el año 2009, un estudio retrospectivo en el que clasificaban las estenosis de la FAVp por ED en dos grupos diferentes375:
- •
Estenosis significativa de la FAVp o de alto riesgo de trombosis definida por la combinación de los siguientes criterios: reducción de la luz vascular > 50% + ratio de PVS > 2 + un criterio adicional como mínimo (diámetro residual < 2mm o bien QA < 600ml/min o descenso de QA > 25%).
- •
Estenosis borderline de la FAVp o de bajo riesgo de trombosis (n = 102): definida con los mismos criterios, pero sin ningún criterio adicional.
El primer grupo de estenosis se trató electivamente mediante ATP y el segundo se sometió a una estrategia de “esperar y observar” (wait and see), con repetición de la ED en 6-8 semanas. Al cabo de 14 ± 6 semanas, el seguimiento de las 102 estenosis borderline fue: 55 sin progresión de la estenosis, 38 con aumento del grado de estenosis, 8 tratados mediante ATP por indicación clínica y un solo caso de trombosis375; es decir, en el momento de efectuar la nueva ED (14 ± 6 semanas), más de la mitad de las estenosis borderline se mantenían estables a lo largo del tiempo, con un riesgo de trombosis < 1%. Los factores de riesgo significativos para la progresión de estenosis borderline a estenosis significativa fueron el antecedente de ATP previa y el sexo femenino. Los autores concluyeron que retrasar la ATP en caso de estenosis borderline asintomáticas es seguro utilizando esta conducta expectante y las estenosis permanecen estables al menos a corto plazo, pero con alto riesgo de progresión, especialmente si existe el antecedente de ATP previa375. En nuestro país, aplicando un protocolo similar de selección de las FAV con mayor riesgo de trombosis, se ha conseguido una tasa de trombosis < 0,05/paciente/año52.
En resumen, según los datos actuales, la optimización de los métodos de vigilancia de la FAV, tanto para FAVn como para FAVp, se produciría a través de la redefinición del concepto de estenosis significativa, que incluiría únicamente las FAV con elevado riesgo de trombosis y, por tanto, tributarios de intervención electiva (fig. 5)405. De esta forma, además de los criterios de estenosis, según la vigente guía KDOQI, habría que constatar la repercusion hemodinámica de la estenosis y añadir algunos criterios adicionales, tanto morfológicos como funcionales, con poder predictivo suficiente para discernir si una FAVn o una FAVp con estenosis tiene un riesgo alto o bajo de trombosis394. Estos criterios son:
- •
Dos criterios principales: porcentaje de reducción de la luz vascular > 50% + ratio de PVS > 2.
- •
Uno de los siguientes criterios adicionales como mínimo: criterio morfológico (diámetro residual < 2mm) o criterio funcional (QA [ml/min] < 500 [FAVn]-600 [FAVp] o ▿QA > 25%, si QA < 1.000ml/min).
La optimización de los métodos de vigilancia de la FAV requiere la redefinición de estenosis significativa. Se han descrito algunas variables ecográficas, tanto morfológicas como funcionales, que permiten clarificar el riesgo de trombosis de una estenosis y, por tanto, poder considerar si esta es tributaria de intervención electiva. El nuevo concepto de estenosis significativa incluiría únicamente a las estenosis con alto riesgo de trombosis. De esta forma, se establecerían unos criterios que la definirían (fig. 5): unos principales (reducción de la luz vascular > 50% + ratio de PVS > 2) al que debería añadirse algún criterio adicional (diámetroresidual< 2 mmy/o QA < 500ml/min en FAVn/< 600ml/min en FAVp y/o descenso de QA > 25% si QA < 1.000ml/min). Esta redefinición de estenosis significativa se traduciría en una serie de beneficios sobre la FAV como la reducción de procedimientos innecesarios que pueden poner en peligro a la misma FAV, la disminución de la tasa de trombosis y el aumento de la supervivencia (tabla 21).
R 4.9.1) Se recomienda considerar una estenosis como significativa ante toda disminución de la luz vascular en una fístula arteriovenosa nativa o en una fístula arteriovenosa protésica demostrada mediante ecografía Doppler que cumple con todos los criterios de alto riesgo de trombosis (los dos criterios principales y, como mínimo, un criterio adicional)
R 4.9.2) Se recomienda efectuar sin demora la intervención electiva mediante angioplastia transluminal percutánea y/o cirugía ante el diagnóstico de una estenosis significativa en una fístula arteriovenosa por presentar alto riesgo de trombosis
R 4.9.3) Se recomienda considerar una estenosis como no significativa ante toda disminución de la luz vascular en una fístula arteriovenosa nativa o en una fístula arteriovenosa protésica demostrada mediante ecografía Doppler que no cumple con todos los criterios de alto riesgo de trombosis
R 4.9.4) Se recomienda no efectuar la intervención electiva ante el diagnóstico de una estenosis no significativa en una fístula arteriovenosa por presentar bajo riesgo de trombosis
R 4.9.5) Se recomienda efectuar siempre un control estricto mediante los métodos de cribado de segunda generación ante toda fístula arteriovenosa con estenosis no significativa por el riesgo de progresión a significativa
Implicaciones teóricas en el diagnóstico, tratamiento y pronóstico de la redefinición de la estenosis significativa de la fístula arteriovenosa (FAV) para hemodiálisis
| • Diagnóstico de las estenosis con riesgo elevado de trombosis • Intervención electiva únicamente sobre las estenosis de alto riesgo de trombosis • Selección del momento idóneo para efectuar la intervención electiva • Reducción de los procedimientos innecesarios sobre estenosis estables • Reducción del gasto sanitario al evitar intervenciones indiscriminadas • Evitar la aparición de reestenosis aceleradas ocasionadas por la corrección mediante ATP de estenosis con bajo riesgo de trombosis • Disminución de la tasa de trombosis • Contribuir a aumentar la supervivencia de la FAV |
ATP: angioplastia transluminal percutánea.
CONTENIDO
5.1 Tratamiento de la estenosis
5.2 Tratamiento de la trombosis
5.3 Manejo de la fístula arteriovenosa no madura
5.4 Tratamiento de la infección
5.5 Síndrome de hipoperfusión distal (“síndrome de robo”)
5.6 Aneurismas y seudoaneurismas
5.7 Síndrome de hiperaflujoPreámbulo
El objetivo del tratamiento de las complicaciones de la fístula arteriovenosa (FAV) es abordar los diferentes tipos de patología que esta puede sufrir. Por un lado, los relacionados con el tratamiento de la estenosis y trombosis para conseguir el mayor tiempo de permeabilidad posible y, por otro, con las complicaciones no relacionadas directamente con la permeabilidad como la infección, la hipoperfusión distal, los aneurismas o los seudoaneurismas y las derivadas del alto flujo sanguíneo (QA).
5.1Tratamiento de la estenosisRecomendaciones(•) NUEVA R 5.1.1) Se sugiere el tratamiento quirurgico en las estenosis yuxtaanastomoticas de las fistulas arteriovenosas nativas, siempre que no requiera la colocacion de un cateter venoso central
(•) NUEVA R 5.1.2) Se sugiere el tratamiento de las estenosis yuxtaanastomoticas venosas de las fistulas arteriovenosas protesicas mediante angioplastia o tratamiento quirurgico indistintamente
NUEVA R 5.1.3) Se sugiere inicialmente el tratamiento mediante angioplastia de la estenosis no yuxtaanastomoticas de la fistula arteriovenosa nativa por ser menos invasiva que la cirugia
R 5.1.4) Se recomienda la realizacion de una fistulografia ante la sospecha clinica de una estenosis venosa central
(•) NUEVA R 5.1.5) Se recomienda tratar solo las estenosis de venas centrales que sean sintomaticas
(•) NUEVA R 5.1.6) Se recomienda como primera opcion de tratamiento en las estenosis centrales la terapia endovascular mediante angioplastia transluminal percutanea con balon
(•) NUEVA R 5.1.7) Se sugiere limitar la utilizacion de stents a casos seleccionados de fracaso tecnico de la angioplastia y recidiva frecuente de la estenosis, y se recomienda no utilizarlos en confluentes venosos
NUEVA R 5.1.8) En las estenosis del arco de la vena cefalica se sugiere el tratamiento inicial mediante angioplastia; asimismo se puede considerar el tratamiento mediante la colocacion de endoprotesis vasculares o mediante la transposicion quirurgica de la vena cefalica
El objetivo de corregir las estenosis que se consideren tributarias de tratamiento electivo es asegurar un QA suficiente, una correcta adecuación de la hemodiálisis (HD), prevenir la aparición de trombosis y aumentar la supervivencia de la FAV. Únicamente debe tratarse de forma electiva la estenosis significativa, tal como se describe en el apartado 4.Tipos de estenosis
Desde un punto de vista anatómico y funcional, las estenosis vasculares con repercusión hemodinámica en la funcionalidad de una FAV pueden localizarse en el segmento previo a la anastomosis arteriovenosa (estenosis arteriales), en la propia anastomosis o bien en la vena de salida de la FAV (estenosis venosas).
- •
Estenosis arteriales. Lesiones vasculares localizadas en el árbol arterial que alimenta el acceso vascular (AV). La alteración hemodinámica que provocan es una disminución en el flujo de la FAV. Se deben principalmente a la presencia de lesiones estenosantes u oclusivas a causa de la progresión de una arteriosclerosis existente de base.
- •
Estenosis a nivel de la anastomosis arteriovenosa. Se suelen deber a un problema técnico durante la realización de la anastomosis. Clínicamente se manifiestan en forma de trombosis inmediata o precoz del acceso o bien en forma de alteraciones en la maduración (fístula no madura).
- •
Estenosis venosas. Son la causa más frecuente de disfunción del acceso. Según su localización a lo largo del trayecto venoso varía su etiología, frecuencia y respuesta al tratamiento. Por ello se suelen clasificar en cuatro grupos:
- –
Estenosis yuxtaanastomótica o perianastomótica. Es la localizada en un área que comprende desde la zona inmediatamente adyacente a la anastomosis hasta los 5cm postanastomosis. Son de etiopatogenia compleja, y en su desarrollo se han involucrado factores hemodinámicos y alteraciones en la respuesta inflamatoria del endotelio.
- –
Estenosis del trayecto de punción. Estenosis localizadas en áreas de punción. Suelen producirse en respuesta al traumatismo mecánico provocado por la punción del vaso.
- –
Estenosis del arco de la vena cefálica (AVC). Estenosis localizadas en el segmento de vena cefálica inmediatamente adyacente a su confluencia en vena axilar. Al igual que las localizadas en la región yuxtaanastomótica, suelen deberse a factores hemodinámicos y presentan una mala respuesta al tratamiento percutáneo.
- –
Estenosis venosas centrales. Estenosis localizadas en el sector venoso desde la vena subclavia hasta su drenaje en la aurícula derecha; comprenden la vena axilar, subclavia, tronco braquiocefálico y vena cava superior. Se suelen asociar al traumatismo endotelial provocado por la presencia de catéteres venosos en el interior del vaso.
- –
Otra clasificación usada en distintas publicaciones consiste en priorizar un criterio de funcionalidad con respecto al punto de punción, clasificándolas entre estenosis del inflow (estenosis arteriales, de la anastomosis arteriovenosa y del segmento venoso yuxtaanastomótico) y estenosis del outflow (estenosis venosas del trayecto de punción, AVC y estenosis venosas centrales)374,406.
Tal y como se ha descrito, la localización de la estenosis es el principal factor determinante al considerar el tipo de opción terapéutica. En este contexto, en el balance del éxito de los resultados se debe considerar no solo la eficacia del tratamiento, sino la comorbilidad y complicaciones que puede llevar asociado.
Hay varios ejemplos que pueden demostrar este factor, como se verá más adelante. Existe un consenso en la realización de un tratamiento endovascular de las estenosis de vasos centrales (arteriales o venosas), por la dificultad en el acceso quirúrgico y la alta morbimortalidad que conlleva10,407. El tratamiento de las estenosis venosas del segmento de punción se ha realizado tradicionalmente mediante angioplastia transluminal percutánea (ATP), por la posibilidad de continuar realizando la HD por el AV y por no precisar la colocación de un catéter venoso central (CVC). Por contra, en el tratamiento de las estenosis yuxtaanastomóticas, que suponen la mayor parte de las estenosis de la FAV, ha presentado mayor controversia, tanto en FAV nativa (FAVn) como en FAV protésica (FAVp), al poder ser abordadas tanto desde un punto de vista quirúrgico como intervencionista, aunque suele ofrecer el primero mejores resultados globales con respecto al tratamiento percutáneo.Tipos de tratamiento
Las estenosis pueden tratarse bien mediante un tratamiento endovascular, que consiste en una ATP y/o la colocación de endoprótesis, o bien mediante una revisión quirúrgica.
En términos generales, el tratamiento percutáneo es la alternativa menos invasiva, con menor morbilidad y que no requiere la colocación de un CVC para continuar la HD, presentando no obstante la significativa desventaja de presentar una alta tasa de reestenosis, lo que condiciona la necesidad de realizar de forma periódica procedimientos intervencionistas adicionales para mantener la permeabilidad del acceso.
Por otro lado, el tratamiento quirúrgico suele ser el tratamiento con mejor permeabilidad primaria a medio y largo plazo y su principal inconveniente es el hecho de ser más invasivo y de requerir en ocasiones el consumo de capital venoso y la colocación de CVC para la HD tras la intervención. Así pues, pese a ser la técnica con mejores resultados en términos generales, en la práctica clínica diaria es necesario individualizar el tratamiento en cada caso, delimitando de forma precisa si la mayor permeabilidad del procedimiento justifica el posible consumo de segmento venoso y la posibilidad de requerir un CVC.Angioplastia transluminal percutánea
La ATP es una técnica percutánea de dilatación intravascular mediante la utilización de un balón que permite el tratamiento de la estenosis vascular. Además del uso del balón convencional, las mejorías técnicas surgidas en los últimos años para el tratamiento de las estenosis han permitido el desarrollo del balón de alta presión, los balones de corte y los balones impregnados con fármacos.
La ATP tiene las ventajas de poder realizarse en el mismo acto diagnóstico de la fistulografía, sobre todo en el caso de las estenosis venosas centrales, y preservar el árbol vascular en comparación con la cirugía. Por otro lado, sin embargo, tiene una mayor tasa de recidivas en comparación con la revisión quirúrgica. El éxito del procedimiento se puede considerar desde el punto de vista anatómico o funcional. Anatómico, cuando la estenosis residual es < 30% tras la retirada del balón y, desde el punto de vista funcional, con la mejoría de los parámetros hemodinámicos de la FAV durante la HD o con la recuperación del flujo de esta (QA).
La única contraindicación absoluta de este procedimiento es la infección activa de la FAV. Como contraindicaciones relativas se incluiría la alergia al contraste, el shunt de la circulación pulmonar hacia la sistémica y la enfermedad pulmonar grave.Balones de alta presión
Se denominan balones de alta presión aquellos que soportan una presión de inflado superior a las 25-30atm. Su utilización está indicada en el tratamiento de estenosis sintomáticas que no han respondido a la dilatación con balones convencionales semi compliance. La utilización de balones de alta presión no proporciona inicialmente mejores resultados en lo referente a permeabilidad al compararse con los balones convencionales408. Su elevado precio, la necesidad de utilizar introductores de mayor grosor, la dificultad para su vaciamiento y su menor compliance y flexibilidad hacen aconsejable que no se utilicen como primera opción en el tratamiento de las estenosis.Balón de corte (cutting balloon)
La incorporación de pequeñas cuchillas o aterotomos a un balón convencional se denomina balón de corte (cutting balloon). Su utilización es controvertida y no se encuentra justificado su uso como tratamiento inicial de las estenosis. En un estudio aleatorizado reciente409 no se encuentran diferencias significativas en el tratamiento de las estenosis entre el balón de corte y el balón convencional, a excepción de una mayor permeabilidad primaria asistida a 6 y 12 meses a favor del balón de corte en el tratamiento de las estenosis venosas yuxtaanastomóticas de las FAVp (el 86 y el 63% frente al 56 y al 37%). Sin embargo, su mayor coste, las dificultades en el manejo (precisan guías más finas) y el mayor calibre del introductor los hacen menos indicados en el tratamiento de inicio del acceso disfuncionante.
El 85% de las estenosis responde satisfactoriamente a la angioplastia con balón convencional410. En el resto, que no presenta una respuesta adecuada, encontrarían su utilidad ambos dispositivos, balón de alta presión y balón de corte. Los estudios existentes que comparan ambos procedimientos no encuentran diferencias significativas en los resultados inmediatos410–413, pero sí un aumento de la permeabilidad asistida a los 6 meses de las estenosis tratadas con balón de corte frente al balón de alta presión (el 66,4 frente al 39,9%)410–413.Angioplastia con balón farmacoactivo
En relación con los balones con fármacos, los impregnados con paclitaxel han aparecido recientemente como una alternativa en el tratamiento de las estenosis arteriales. Su aplicación en las estenosis de las FAV es muy escasa, aunque se han comunicado algunos ensayos clínicos aleatorizados (ECA) con resultados satisfactorios a los 6 meses414 y al año de seguimiento415.Stents
Las indicaciones de colocación de stents son limitadas, dada la ausencia de evidencia en lo referente a la mejoría de la supervivencia secundaria de la FAV tras su uso. Su utilización, controvertida, queda relegada al tratamiento de estenosis con recoil, roturas vasculares tras ATP o en disecciones que condicionan estenosis > 30%.
Se considera candidata a su uso a la FAV con refractariedad al tratamiento realizado por la recidiva temprana (< 3 meses) tras varias ATP o la debida a recoil vascular (estenosis elásticas) tras ATP416. Aunque el uso de stent es muy controvertido en estas dos indicaciones dado que, por un lado, hay un cierto número de FAV que mantienen una función adecuada aun existiendo una estenosis residual post-ATP hasta del 50% y, por otro, se observan recidivas precoces (< 3 meses) en ATP con buenos resultados inmediatos417,418.
Respecto al uso del stent para el tratamiento de la rotura del vaso, es de destacar que esta es la complicación más frecuente de la ATP. El tratamiento inicial es el taponamiento con inflado prolongado a baja presión y la compresión manual externa sobre el punto de rotura. Después de tres intentos fallidos, se considera indicada la colocación de prótesis recubiertas417,418.Endoprótesis vasculares
Recientemente ha aumentado la utilización de stent graft como intento de mejorar los resultados. Un estudio multicéntrico controlado encontró una permeabilidad a los 6 meses de los stents recubiertos significativamente mayor (el 51 frente al 23%) frente a la ATP simple en el tratamiento de las estenosis venosas anastomóticas de las FAVp419. Su utilización en otras localizaciones se ha comunicado en varias ocasiones420,421, con resultados superiores a los obtenidos con ATP aislada o con colocación de prótesis metálicas no recubiertas422,423. El estudio más reciente de Schmelter et al424, realizado en 66 AV (41 FAVp y 25 FAVn), encuentra buenos resultados iniciales, pero sin observarse aumento en la permeabilidad global. Observa una tasa elevada de reestenosis y trombosis, aunque no asociadas al stent graft, siendo este responsable solo de una minoría de los nuevos casos de disfunción. Los autores concluyen que la colocación de prótesis recubiertas se puede utilizar para solucionar problemas locales, pero que no mejoran la supervivencia media del AV por asociarse estas a lesiones situadas en otras localizaciones.
En cuanto a los inconvenientes relacionados con la endoprótesis, es de destacar el impedimento en la realización de nuevos accesos en el segmento de la vena tratada y poder asociarse a un porcentaje no despreciable de complicaciones420,425. Si bien la colocación de un stent podría aumentar el intervalo entre la primera dilatación y la recidiva de la estenosis, una vez establecida la estenosis intra-stent por hiperplasia neointimal, su tratamiento es de gran dificultad. A esto hay que sumar estudios recientes, en donde se observa un elevado porcentaje de complicaciones poststent (28,9%)426, y otros que describen migraciones427, fracturas428 e infecciones429,430.
En definitiva, puede concluirse que se necesitan más estudios multicéntricos, aleatorizados, prospectivos y multidisciplinares que valoren adecuadamente las ventajas de los nuevos materiales frente a los tradicionales en la realización de angioplastias y la utilidad de los stents y sus ventajas o inconvenientes frente al tratamiento quirúrgico.Tratamiento quirúrgico
Hay numerosas técnicas quirúrgicas descritas para la corrección de las estenosis de la FAV. La gran ventaja de este tipo de tratamiento es que suele presentar mejores tasas de permeabilidad que el endovascular, pero presenta los inconvenientes de su mayor morbilidad, del consumo de segmento venoso, de la posibilidad de requerir la colocación de un CVC y de su mayor complejidad técnica, sobre todo a nivel de vasos centrales.Estenosis arteriales
En el caso de las estenosis localizadas en el segmento arterial previo a la anastomosis arteriovenosa, el tratamiento endovascular mediante ATP presenta una baja morbilidad y aceptables resultados, por lo que se considera la cirugía como opción terapéutica de recurso. La revascularización quirúrgica consiste en la revascularización mediante la interposición de un bypass de material autólogo, presentando una excelente permeabilidad a medio y largo plazo.Estenosis anastomóticas
En el caso de estenosis localizadas en la anastomosis arteriovenosa (relacionadas con la cirugía de creación del acceso), el tratamiento quirúrgico indicado es la revisión quirúrgica de dicha anastomosis y la corrección del defecto técnico subyacente.Estenosis yuxtaanastomóticas
La reanastomosis entre la arteria y la vena de salida en el sector inmediatamente proximal a la FAV es, en muchos casos, la técnica quirúrgica de elección; asimismo se ha descrito la interposición de un bypass con material protésico entre la arteria y el sector proximal de la vena de salida.Estenosis del trayecto de punción
Ante estenosis del trayecto venoso de punción, el tratamiento quirúrgico de elección consiste en la interposición de un bypass de material protésico, que se puede realizar en forma de loop para permitir la punción del nuevo segmento implantado.Estenosis del arco de la vena cefálica
Como se comenta más adelante, la técnica quirúrgica de elección consiste en la transposición de la vena cefálica y su anastomosis con la vena humeral proximal o axilar. Asimismo, también se ha descrito el reimplante quirúrgico de dicho AVC.Estenosis venosas centrales
La complejidad y agresividad de un abordaje quirúrgico de venas centrales hace que la cirugía se considere un tratamiento de recurso, y se han descrito intervenciones consistentes en técnicas derivativas extraanatómicas para permitir el drenaje hacia troncos venosos centrales.
→ Pregunta clínica XV ¿Hay un tratamiento con mejores resultados (angioplastia transluminal percutánea frente a cirugía) en la estenosis yuxtaanastomótica, valorado en supervivencia y/o trombosis y coste/beneficio?
(Ver ficha de la Pregunta clínica XV en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| No se dispone de pruebas concluyentes para FAVn maduras con estenosis. Los datos disponibles provienen de dos comparaciones de series clinicas431,432, con resultados no homogeneos. Ambos articulos encuentran mejores resultados de la cirugia, aunque solo en lo que se refiere a la supervivencia primaria. Un metaanalisis de cuatro series clinicas ha mostrado resultados similares para la supervivencia primaria de la FAV a los 12 y 18 meses de seguimiento433 | Calidad baja |
| Respecto a las estenosis de la anastomosis venosa de las FAVp, lesion prevalente en las trombosis de estos accesos, existen escasas evidencias en la bibliografia con un solo ECA que compara los resultados de la cirugia y la ATP; el estudio esta datado en 1987434 y los resultados son favorables para la cirugia. Sin embargo, dadas las dificultades quirurgicas, estas estenosis se han venido tratando tradicionalmente con ATP, con buenos resultados primarios, pero con un elevado porcentaje de recidivas. La utilizacion de stent graft podria mejorar su permeabilidad si bien son precisos estudios a mas largo plazo para recomendar su utilizacion419 | |
No se han identificado ensayos clínicos que comparasen la ATP frente a la cirugía en el tratamiento del AV estenosado en pacientes con FAVn. Se han identificado dos publicaciones donde se comparan series de pacientes tratados con cirugía y pacientes tratados con ATP.
En el estudio de Napoli et al432, realizado sobre 66 ATP y 68 intervenciones quirúrgicas en estenosis yuxtaanastomótica de la FAV, se evaluó la eficacia de las intervenciones midiendo el flujo arterial braquial. El análisis comparativo entre ambas opciones mostró una significativamente mejor permeabilidad primaria para la cirugía, pero sin diferencias en la permeabilidad primaria asistida, aunque la ATP demostró una mayor tendencia a la reestenosis.
Tessitore et al431 realizaron un análisis retrospectivo de datos clínicos de 64 pacientes con estenosis yuxtaanastomótica de la fístula en la parte distal del antebrazo, de los cuales 43 fueron tratados con ATP y 21 con cirugía. La tasa de reestenosis fue de 0,168 y 0,519 eventos por año de seguimiento de la fístula para la cirugía y la ATP, respectivamente (p = 0,009), con un riesgo relativo ajustado 2,77 veces mayor para la ATP que para la cirugía. El perfil de costes fue similar para los dos procedimientos. Ambos procedimientos muestran similar permeabilidad primaria asistida y costes.
El resto de los estudios evalúan de forma individual las dos técnicas. Así, en un artículo del año 2012435, que evaluó los resultados de la cirugía en las estenosis yuxtaanastomóticas de 96 FAVn radiocefálicas a medio y largo plazo, los autores encontraron resultados de permeabilidad inmediata muy elevados, sin necesidad de uso de CVC. La permeabilidad primaria fue superior a la recomendada en guías internacionales (el 89 frente al 50%), con una baja tasa de procedimientos de mantenimiento (0,035 procedimientos/paciente/año). Estos datos de permeabilidad son superiores a los mostrados en el estudio de Mortamais et al436, donde se evalúan los resultados de la angioplastia en 147 procedimientos realizados sobre 75 FAVn radiocefálicas. Obtienen una permeabilidad primaria a 1 y 3 años del 46,6 y el 25,5%, respectivamente, con permeabilidad asistida en los mismos períodos del 81,3 y el 63,2%. Asocian los peores resultados y la recidiva temprana de las estenosis a la presencia de estenosis residuales post-ATP > 50%. Consideran que en estos casos se encontraría indicada la evaluación y reparación quirúrgica.
Aunque ninguno de los dos estudios realiza un análisis comparativo con la otra técnica de reparación, sus resultados avalan la utilización de la cirugía como técnica inicial en el tratamiento de las estenosis yuxtaanastomóticas, siempre y cuando se disponga de un equipo quirúrgico con disponibilidad durante las 24h y sea posible la reparación sin uso de CVC. Recientemente, un metaanálisis que incluye las series clínicas comentadas en este apartado ha mostrado resultados similares a los de los estudios originales. Los resultados combinados de los datos de las series de casos mostraron de modo significativo una mejor permeabilidad primaria de la FAV en los pacientes tratados con cirugía a los 12 (odds ratio [OR]: 0,42) y 18 meses (OR: 0,33), efecto que parece moderarse a los 24 meses de seguimiento (OR: 0,53)433.Fístula arteriovenosa protésica
Solamente se ha identificado un ECA en la bibliografía que compare la cirugía y la angioplastia en pacientes con FAVp y estenosis yuxtaanastomótica434. Se trata del ECA de Brooks et al434, en el que se incluyeron 43 pacientes con estenosis venosas en el acceso con FAVp en antebrazo, 19 se trataron con cirugía y 24 con angioplastia. Obtienen mayor permeabilidad mediana a largo plazo los tratados con cirugía (12 meses) frente a ATP (4 meses) (p < 0,01). No se menciona si ha sido necesaria la colocación de CVC para la realización de alguno de los procedimientos.
No se han encontrado estudios más recientes que comparen ambos procedimientos, si bien existen varios trabajos en la bibliografía que avalan la realización de ATP en el tratamiento de estas lesiones437 frente a la cirugía167, por permitir un ahorro del capital venoso proximal, ser mejor aceptado por el paciente y existir dificultades quirúrgicas en el tratamiento de las anastomosis proximales localizadas sobre venas braquial y axilar8. Se reserva el tratamiento quirúrgico para tratamientos fallidos tras ATP y previo a la colocación de un stent o en casos de recidiva167,438.
La utilización de stent en la recidiva de la estenosis no ha aportado mejoras en su permeabilidad439, al igual que la utilización de otras mejoras técnicas como los balones de alta presión408 o los de corte440, entre otras. Sin embargo, recientemente, un estudio multicéntrico controlado ha encontrado en el tratamiento de las estenosis venosas anastomóticas una mayor permeabilidad, de modo significativo, a los 6 meses de los stents recubiertos frente a la ATP simple (el 51 frente al 23%)419. El estudio se encuentra limitado por no realizarse un seguimiento a largo plazo. En un artículo más reciente424, donde se realiza un estudio retrospectivo en 41 pacientes portadores de FAVp con estenosis complejas (definidas como estenosis rígidas y resistentes, estenosis con recoil o estenosis intra-stent) tratadas con endoprótesis vasculares (stent graft) se obtienen buenos resultados en permeabilidad primaria, pero tasas de reestenosis y trombosis elevadas. Las reestenosis, sin embargo, no se sitúan dentro del stent graft colocado y son solamente responsables en una minoría de los casos de las nuevas disfunciones. Los autores concluyen que la colocación de prótesis recubiertas se puede utilizar para solucionar problemas locales, pero que no mejoran la supervivencia media del acceso por asociarse esta a lesiones situadas en otras localizaciones.
Siendo controvertido el uso de stents, sí parece existir un acuerdo en la utilización del stent graft frente a los stents no recubiertos. Varios artículos existentes en la bibliografía han encontrado una mejoría en las permeabilidades primarias de estos dispositivos frente a la ATP y los stents no recubiertos420,421,441,442. El aumento de la permeabilidad primaria, según algunos autores, parece estar relacionado con una menor presencia o ausencia de hiperplasia neointimal en el interior del stent graft442,443.De la evidencia a la recomendación
Con respecto a la FAVn, y aunque en los estudios observacionales no hay diferencias entre ambas técnicas, en ausencia de estudios aleatorizados que comparen coste-beneficio, y a pesar de que ambas tienen sus ventajas e inconvenientes (la ATP no agota el lecho, pero requiere repetir los procedimientos, y la cirugía pierde vaso, pero puede seguir permitiendo su punción y tiene mejor supervivencia primaria), los estudios coinciden en la mejor supervivencia primaria de la cirugía, aunque la asistida sea similar. La cirugía, por lo tanto, puede considerarse la indicación inicial si técnicamente es posible, basándose en la justificación de requerir menos procedimientos para mantener la supervivencia. Sin embargo, si la cirugía requiere de la colocación de un CVC se valorará la técnica endovascular como primera opción.
Esta recomendación se sometió a votación del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV). El enunciado de la recomendación se aceptó por unanimidad. En cambio, el número de miembros del grupo de trabajo que opinaba que la recomendación debía ser fuerte (un tercio) no fue suficiente para otorgarle esta fuerza. El resto de los miembros opinó que era débil o se abstuvo.
En FAVp, la terapia endovascular tiene la ventaja de ser menos invasiva que la cirugía, no agota el lecho venoso y no excluye el procedimiento quirúrgico, por lo que, pese a su mayor coste y a la menor tasa de supervivencia primaria, puede considerarse una opción terapéutica igualmente válida a la cirugía. Sin embargo, hasta que no existan estudios comparativos con la cirugía no puede establecerse un grado de evidencia en favor de una u otra técnica.
La utilización de prótesis recubiertas (stent graft) en el tratamiento de la recidiva precoz de las estenosis venosas en fístulas protésicas parece proporcionar una mejora en la supervivencia a medio plazo, pero son necesarios más estudios y la valoración a más largo plazo para recomendar su utilización.
R 5.1.1) Se sugiere el tratamiento quirurgico en las estenosis yuxtaanastomoticas de las fistulas arteriovenosas nativas, siempre que no requiera la colocacion de un cateter venoso central
R 5.1.2) Se sugiere el tratamiento de las estenosis yuxtaanastomoticas venosas de las fistulas arteriovenosas protesicas mediante angioplastia o tratamiento quirurgico, indistintamente
Las estenosis venosas no perianastomóticas, es decir, las situadas proximalmente al área yuxtaanastomótica, también denominadas del trayecto medio o del área de punción, se consideran provocadas habitualmente en respuesta al traumatismo mecánico en relación con la canulación de la FAV, y se caracterizan por poder asociarse a degeneración aneurismática de la vena444, con riesgo de necrosis cutánea, o bien de hemorragia después de las sesiones de HD445. Pueden no asociarse a alteraciones durante la HD ni a problemas de QB (f lujo de la bomba), por lo que pueden pasar desapercibidas si no se realiza una cuidadosa valoración clínica o seguimiento.
Las opciones de tratamiento incluyen la reparación quirúrgica realizando un bypass protésico o la percutánea mediante ATP. Aunque existen estudios en la bibliografía que comparan ambas técnicas, no los hay aleatorizados y no pueden establecer una mejor opción de tratamiento. La mayor parte de estos, a pesar de mostrar que los resultados de la cirugía son mejores en cuanto a la tasa de permeabilidad446, sin embargo, avalan la utilización inicial del tratamiento percutáneo del AV, puesto que presenta menor agresividad en el tratamiento del AV disfuncionante.
Aunque el tratamiento endovascular no es una solución permanente, es efectivo para aumentar la permeabilidad; es una técnica poco invasiva, repetible, raramente precisa de la colocación de un CVC y preserva la integridad del lecho vascular sin comprometer procedimientos quirúrgicos posteriores.
El tratamiento quirúrgico de las estenosis en esta localización incluye la realización de un bypass con la exclusión del segmento estenótico; asimismo puede considerarse su disposición en forma de loop, permitiendo de esta forma ampliar el trayecto de punción. El abordaje quirúrgico en el área de canulación del acceso puede provocar la necesidad de realizar de forma temporal la HD mediante un CVC, y esta es la principal limitación de la técnica. Por contra, cuando la estenosis se asocia a una dilatación aneurismática con trastornos cutáneos, el tratamiento quirúrgico presenta la ventaja de poder tratar ambas mediante la misma intervención.
En los estudios existentes en la bibliografía, los resultados de la cirugía frente al tratamiento endovascular son mejores en cuanto a la tasa de permeabilidad primaria446, pero similares en la permeabilidad asistida. Estos mismos estudios avalan la utilización inicial del tratamiento percutáneo por ser poco invasivo, ambulatorio, evitar el uso del CVC y conservar el lecho vascular, pudiendo permitir nuevos procedimientos quirúrgicos. Sin embargo, la ATP y la cirugía deben considerarse técnicas complementarias y no competitivas.
No existe evidencia que avale la utilización de stents en el tratamiento de las estenosis y se recomienda no utilizarlos excepto en recidivas tempranas y repetidas tras ATP de segmentos medios de la FAVn y en roturas de la vena eferente que no responden a las compresiones con balón.
Es recomendable tener presente, en el paciente de riesgo, evitar la aparición de insuficiencia cardíaca o de una isquemia distal tras la realización de la ATP, en especial si el flujo es elevado194,447. En estos casos es importante no sobredilatar la estenosis, fundamentalmente en la primera ATP y en las localizadas en el brazo, para no provocar un aumento excesivo del QA. En los pacientes de riesgo, como diabéticos o de edad avanzada, se deberá actuar con precaución, y es aconsejable evitar el uso de balones con diámetro > 7mm. En los casos de recidiva, y si no se ha presentado clínica isquémica, puede sobredilatarse la estenosis 1mm más425. Por ello, en la indicación terapéutica es imprescindible conocer el QA del AV. Si los problemas de hemostasia post-HD son importantes, estaría indicada la dilatación de la estenosis, infradilatando y valorando riesgos-beneficios. En este sentido se ha propuesto una doble técnica de dilatación asociada a reducción quirúrgica del QA448.
En resumen, en las estenosis del trayecto de punción tanto el tratamiento quirúrgico como el endovascular han demostrado ser técnicas seguras, con buenas tasas de éxito técnico y clínico. Sin embargo, pese a existir una mejor tasa de permeabilidad primaria con la cirugía, aunque la asistida sea similar, la opinión mayoritaria de expertos, así como la del GEMAV, lleva a sugerir plantear de entrada el tratamiento percutáneo debido a la menor agresividad de dicha técnica. En las FAV que requieran de un procedimiento quirúrgico adicional, como las FAV aneurismáticas, con abundante trombo mural o asociadas a lesiones tróficas, se sugiere utilizar la cirugía como primera técnica de reparación; pese a poder utilizarse técnicas endovasculares con colocación de endoprótesis, no hay experiencia que las pueda avalar en la actualidad en esta indicación.Tratamiento de la estenosis del arco de la vena cefálica
La vena cefálica forma parte del sistema venoso superficial de la extremidad superior, que sigue un trayecto subcutáneo anterolateral a lo largo del brazo; en su porción proximal al brazo continúa en una posición superficial localizada en el surco deltopectoral hasta su desembocadura en el sistema venoso profundo a nivel de la vena axilar en el sector previo a la clavícula. Dicha confluencia se realiza a través de la región anatómica conocida como AVC, que es el segmento en que la vena cefálica, de una posición superficial, cambia de dirección profundizándose a través de la fascia clavipectoral hasta desembocar finalmente en la vena axilar, que es el tronco venoso de drenaje de la extremidad superior449,450.
Al tratarse de un segmento de transición anatómica entre el sistema venoso superficial y el profundo, las estenosis en relación con el acceso presentan una serie de características particulares que obligan a tener que ser consideradas de forma aparte a las estenosis que se producen en el trayecto de la vena cefálica en el brazo.
En primer lugar, se trata de una de las causas más frecuentes de disfunción en la FAVn451–453, disfunción que se suele manifestar con significativos cambios hemodinámicos334 y una marcada asociación con las FAVn de brazo (39%) con respecto a las FAVn de antebrazo (2%)451,452.
Asimismo, respecto a las estenosis de otras localizaciones, se trata de lesiones con una significativa peor respuesta al tratamiento mediante ATP, con mayor resistencia a la dilatación (el 4,8 frente al 1,3%), mayor tasa de rotura vascular (el 14,9 frente al 8,3%) y menor intervalo libre entre angioplastias (10,6 frente a 18,3 meses)449,451. Por último, se ha encontrado una mayor tasa de trombosis en los pacientes con estenosis localizada en el AVC334,454.
Se han propuesto varios posibles mecanismos fisiopatológicos en el desarrollo de este tipo de estenosis, como la falta de adaptación a la situación de hiperaflujo, la presencia de válvulas en el confluente cefalicoaxilar, alteraciones debidas al ángulo de dicho confluente, la ausencia de elasticidad a nivel de la fascia clavipectoral o alteraciones intrínsecas en la pared venosa debidas a la uremia449,454–456. Hasta la fecha, no se ha podido identificar la secuencia de mecanismos que conduce al desarrollo de la estenosis, lo que lleva a algunos autores a plantear la posibilidad de que intervengan de forma variable todos los agentes señalados453.Opciones terapéuticas de la estenosis del arco de la vena cefálica
Como se ha comentado, el manejo de este tipo de estenosis comporta una mayor complejidad, dado la peor respuesta al tratamiento y el mayor índice de recidiva y de complicaciones que presentan.Angioplastia transluminal percutánea
Se trata de la modalidad terapéutica más usada, en muchos casos debido a la no disponibilidad de otras opciones técnicas en la práctica. El estudio de Rajan et al452 describe una tasa de éxito técnico del 76%, y en el 58% de los casos necesitó el uso de balones de alta presión (> 15 atm), con un 6% de roturas del vaso tratado. La permeabilidad primaria a los 6 meses fue del 42%, y del 23% a los 12 meses, con una permeabilidad primaria asistida del 83 y el 75% a los 6 y 12 meses, respectivamente, requiriendo un promedio de 1,6 procedimientos por año para tal fin, resultados similares a los publicados posteriormente por Vesely y Siegel440. Dukkipati et al457, en un estudio sobre los resultados de las ATP en el AVC, describen un promedio de 91,5 días entre ATP para mantener la permeabilidad del AV. Así pues, los resultados de la ATP sobre las estenosis del AVC demuestran una efectividad marcadamente menor que en el resto de territorios venosos, con mayor tasa de complicaciones y con una permeabilidad primaria inferior a los estándares recomendados por algunas guías de práctica clínica10. Por contra, se trata de una modalidad terapéutica mínimamente invasiva y de amplia disponibilidad, lo que justifica su amplio uso en la práctica clínica. A pesar de ello, se han planteado nuevas opciones de tratamiento en distintos trabajos publicados.Angioplastia transluminal percutánea con colocación de stent
Con el objetivo de mejorar el éxito clínico y la permeabilidad del procedimiento, se ha propuesto la colocación de stents intravasculares449,453. Como ya se ha comentado, se trata de una técnica utilizada de forma habitual en la práctica clínica para el tratamiento de las complicaciones de la ATP, en casos de rotura del vaso, y también para estenosis recidivantes, siendo un procedimiento seguro y de mínima invasividad. Por contra, se trata de un procedimiento complejo desde el punto de vista técnico, ya que requiere una colocación adyacente al confluente venoso cefalicoaxilar, con lo que existe el riesgo de comprometer la permeabilidad de la vena axilar con el despliegue del stent o con posteriores migraciones de este, lo que limitaría la realización de nuevos accesos en la extremidad453. Además, en el caso de venas periféricas, la colocación de stents no ha demostrado aumentar la permeabilidad del AV458.
La evidencia disponible actualmente sobre la colocación de stents en el AVC proviene de dos estudios publicados, en comparación con la ATP simple457 y en comparación con el despliegue de endoprótesis442, y se ha descrito una permeabilidad primaria del procedimiento del 39% a los 6 meses. El estudio de Dukkipati et al457, que compara la ATP simple frente a la ATP con colocación de stents, encontró una asociación entre el despliegue de stents y un incremento en la permeabilidad, consiguiendo reducir el número de ATP necesarias tras el procedimiento para mantenerla.
Pese a ofrecer una discreta mejoría en la permeabilidad primaria y primaria asistida con respecto a la angioplastia simple, los resultados globales del despliegue de stents en el AVC difícilmente justifican el coste-beneficio de su uso de forma sistemática, excepto en los casos de complicación técnica durante la ATP442.Balón de corte (cutting balloon)
Al tratarse de estenosis con mala respuesta a la ATP simple se ha planteado, asimismo, la posibilidad de tratamiento mediante ATP con cutting balloon.
Pese al teórico beneficio que esta técnica podría ofrecer, la evidencia proveniente de un estudio prospectivo aleatorizado con 340 pacientes (incluyendo estenosis de varias localizaciones)440, no encontró beneficio con respecto a la permeabilidad primaria del procedimiento y, en cambio, sí se observó un mayor índice de complicaciones (5,2%) con respecto a la ATP con balón convencional. Posteriormente, otro estudio459 tampoco encontró mejor permeabilidad del cutting balloon con respecto a la ATP simple.Endoprótesis
La colocación de una endoprótesis vascular —stent recubierto con material protésico (politetrafluoretileno [PTFE])— puede prevenir el desarrollo de la hiperplasia endotelial presente en la recidiva de las estenosis del AVC. Presenta, no obstante, el inconveniente de tratarse de una técnica con un elevado coste sanitario449.
El ECA de Shemesh et al442, que compara entre la colocación de stents y de endoprótesis, describe una tasa de éxito técnico del 100%, con una permeabilidad primaria del 82% a los 6 meses, significativamente mayor respecto a la reportada en el grupo de stents no recubiertos. Resultados similares presentan Shawyer et al460 con una permeabilidad primara a los 6 y 12 meses del 82 y el 73%, respectivamente, y secundaria del 91% a los 6 meses.
Pese a la mejoría encontrada con esta técnica, dado el alto coste económico del procedimiento, son necesarios nuevos estudios que puedan confirmar los resultados para poder recomendar su uso generalizado en la práctica clínica.Transposición quirúrgica
Dado los subóptimos resultados obtenidos mediante ATP en este tipo de estenosis, distintos autores han planteado la transposición quirúrgica de la vena cefálica en la vena humeral o basílica449,453. La técnica descrita consiste en la desconexión del AVC con ligadura de la vena proximal y reanastomosis en vena basílica o humeral a la altura del hueco axilar, mediante una tunelización subcutánea, de forma que el drenaje al sistema venoso profundo se produce a este nivel. Se trata de una intervención de moderada complejidad técnica, que puede realizarse con anestesia locorregional.
La evidencia actualmente disponible proviene de varias series de casos publicadas461–463, sin existir comparativas directas con respecto a otros tipos de tratamiento. Los resultados muestran una permeabilidad primaria del procedimiento del 70-79% a los 6 meses y del 60-79% a los 12 meses, con una tasa de complicaciones del 8%453,463.
Asimismo, se ha publicado una significativa mejor permeabilidad en los procedimientos de ATP realizados tras la intervención quirúrgica, de forma que hay autores462 que recomiendan su utilización de forma combinada.
Así pues, la transposición quirúrgica del AVC es una opción terapéutica segura, que ofrece unos resultados de permeabilidad superiores a la ATP con o sin colocación de stent, y presenta la desventaja de ser una técnica invasiva de una complejidad intermedia. Son necesarios, por lo tanto, estudios mayores que puedan confirmar su utilidad en la práctica clínica.Otras técnicas
Dada la asociación entre flujo turbulento y desarrollo de hiperplasia endotelial, se ha propuesto indicar técnicas de reducción del flujo con el objetivo de reducir dicha turbulencia. En el estudio retrospectivo de Miller et al456 en un grupo de pacientes portadores de una intervención (minimally invasive limited ligation endoluminal-assisted revision [MILLER]) para reducir el flujo por otros motivos (síndrome de hipoperfusión distal [SHD] o hiperaflujo), se encuentra una significativa mejoría en la permeabilidad de las angioplastias tras haber reducido el flujo del acceso. No existen, sin embargo, posteriores estudios sobre el papel que la reducción del flujo pueda tener en el tratamiento de estas lesiones.
Asimismo, finalmente se ha propuesto la posibilidad de realizar una intervención quirúrgica mediante angioplastia quirúrgica con parche a través de un abordaje directo del AVC464. Si bien se trata de una técnica relativamente compleja técnicamente, son necesarios ulteriores estudios para determinar su papel en la práctica clínica.Estenosis del arco de la vena cefálica: manejo terapéutico
Las distintas modalidades de tratamiento de la estenosis del AVC, pese a su significativa prevalencia, actualmente disponen de un número relativamente bajo de estudios que avalen su uso en la práctica clínica, por lo que la evidencia disponible se basa, en la mayoría de casos, en pequeñas series de casos publicados sin comparación entre distintas técnicas; es por ello que las recomendaciones efectuadas se fundamentan principalmente en la opinión de los miembros del GEMAV, basándose en los estudios actualmente disponibles y en los criterios de buena práctica clínica (tabla 22).
Tratamiento de la estenosis del arco de la vena cefálica
| Estudio | Tipo de tratamiento | n | Permeabilidad primaria 6 meses (%) | Permeabilidad primaria 12 meses (%) | Reintervenciones paciente/año |
|---|---|---|---|---|---|
| Rajan et al., 2003452 | ATP | 26 | 42 | 23 | 1,6 |
| Kian et al., 2008462 | ATP | 13 | 8 | 0 | 3,5 |
| Shemesh et al., 2008442 | ATP + stent | 12 | 39 | 0 | 1,9 |
| Heerwagen et al., 2010459 | ATP + cutting balloon | 17 | 81 | 38 | 0,9 |
| Shemesh et al., 2008442 | ATP + endoprótesis | 13 | 82 | 32 | 0,9 |
| Shawyer et al., 2013460 | ATP + endoprótesis | 11 | 82 | 73 | NC |
| Chen et al., 2005461 | Transposición quirúrgica | 7 | 80 | 70 | NC |
| Sigala et al., 2014463 | Transposición quirúrgica | 25 | 79 | 79 | 0,1 |
| Kian et al., 2008462 | Transposición quirúrgica + ATP | 13 | 69 | 39 | 1,0 |
| Miller et al., 2010456 | Reducción de flujo + ATP | 33 | 76 | 57 | 0,9 |
La ATP ha sido el tratamiento de elección en los casos de estenosis del AVC, debido a que es una técnica segura, de baja complejidad y con aceptables resultados en otros sectores venosos453. Además se trata de un procedimiento de amplia disponibilidad en la práctica, que en muchos casos carece de alternativas terapéuticas factibles. Siendo conscientes de que tanto la opinión de expertos como los estudios realizados confirman los resultados subóptimos, con peor permeabilidad y mayor índice de complicaciones que en otras localizaciones452,462, a pesar de ello, la ATP se continúa considerando como técnica de primera línea en el tratamiento de estas lesiones, dada su buena relación coste-beneficio, su mínima agresividad y las aceptables tasas tanto de permeabilidad asistida como del número de procedimientos requeridos para mantenerla.
En cambio, el uso de stents no ha demostrado un aumento paralelo en la efectividad de la técnica442, por lo que actualmente no se justifica su uso de forma generalizada y sistemática dado su mayor coste económico. Se reservaría su colocación para los casos de fallo técnico en la ATP simple (rotura del vaso o estenosis persistentes).
En este mismo sentido, por lo que respecta a la incorporación del dispositivo de cutting balloon, un estudio no ha demostrado mayor supervivencia que la ATP simple459 y los resultados del mayor estudio hasta la fecha (340 pacientes en todas las localizaciones del trayecto de salida de la FAV)440 tampoco ofrecen mejoría de resultados a cambio de un mayor índice de complicaciones, por lo que su uso generalizado plantea dudas en cuanto al coste del procedimiento y a la seguridad de este.
Los resultados de los estudios sobre la colocación de endoprótesis sí han demostrado unos mejores resultados con respecto a la ATP simple442,460. Si bien al tratarse de una técnica de reciente introducción con poca evidencia disponible que la avale y al ser un procedimiento de un coste económico notoriamente superior al resto, su uso sistemático está condicionado a la evidencia surgida de nuevos estudios.
Con respecto a las técnicas quirúrgicas, la transposición de la vena cefálica, aunque con una evidencia relativamente limitada, también ha demostrado ser un tratamiento útil, tanto al aumentar la permeabilidad primaria como al disminuir la necesidad de angioplastias tras la intervención461,462, por lo que, asimismo, puede considerarse un tratamiento de primera línea en el tratamiento de la estenosis del AVC.
Por último, se ha considerado que la muy escasa evidencia existente con respecto a las técnicas de reducción de flujo y de angioplastia quirúrgica no permite poder hacer ningún tipo de recomendación con respecto a su uso, siendo necesaria la realización de futuros estudios para poder determinar su utilidad en la práctica clínica.
→ Pregunta clínica XVI ¿Hay criterios de indicación de qué casos, en qué momento y cómo tratar la estenosis central, valorados en supervivencia de la fístula arteriovenosa utilizable y/o trombosis?
(Ver ficha de la Pregunta clínica XVI en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Estudios observacionales encuentran que la vigilancia continuada sin intervención puede ser suficiente para los casos en los que se haya producido un desarrollo adecuado de venas colaterales y no haya sintomatología grave | Calidad baja |
| Estudios observacionales encuentran que el tratamiento endovascular muestra resultados subóptimos a medio y largo plazo. Pueden provocar lesiones hiperplásicas en la íntima y neoproliferativas en zonas reestenóticas más agresivas que las encontradas en las lesiones originales | Calidad baja |
| Aunque se constatan altas tasas de éxito técnico, que van desde el 70 al 90%, estudios observacionales encuentran que la angioplastia percutánea consigue tasas de permeabilidad primaria a los 12 meses de entre el 12 y el 50%, y de permeabilidad acumulada de entre el 13 y el 100% | |
| Estudios observacionales encuentran que la permeabilidad primaria al año tras la colocación de un stent variaba entre estudios del 14,3 al 100% y la permeabilidad secundaria del 33 al 91% | Calidad baja |
| Varios estudios han encontrado casos de complicaciones debidas al stent (como la migración, la fractura, la hiperplasia neointimal intra-stent y la aparición de estenosis no relacionadas con la inicial) | |
| Estudios observacionales hallan permeabilidades similares para angioplastia frente a stent | Calidad baja |
Se consideran venas centrales la vena subclavia, el tronco braquiocefálico venoso (también llamado vena innominada) y la vena cava superior. La vena subclavia es continuación de la vena axilar y se inicia en el borde lateral de la primera costilla. Por su situación intratorácica, con arcos costales, clavícula y esternón que las protegen, las venas centrales son menos accesibles a la cirugía que las venas periféricas del brazo; además, son de mayor calibre, soportan más QA y son más elásticas465,466.
La estenosis u oclusión en las venas centrales de un miembro superior en el que se ha realizado un AV puede dar lugar a un cuadro de hipertensión venosa que curse con sintomatología, a expensas de edema progresivo del brazo que puede llegar a hacerse refractario, disfunción del AV, trastornos tróficos de la extremidad y aumento de la circulación colateral en cuello y tórax. Este cuadro puede aparecer en el 15-20% de los pacientes en HD, a menudo con historia previa de manipulación o canalización de las venas centrales, vena subclavia o yugular427,428. Independientemente de la localización del CVC, a mayor número y duración de este, mayor riesgo de desarrollar estenosis. También se describe una mayor prevalencia de estenosis en CVC colocados en el lado izquierdo debido al trayecto más largo y tortuoso de las venas centrales de este lado466. Se aconseja que en pacientes con desfibriladores o marcapasos que precisen de una FAV, esta se realice en el brazo contrario al de la localización del dispositivo cardíaco. En el paciente en HD suele ocurrir que las estenosis de las venas centrales permanecen asintomáticas hasta que se realiza una FAV en el miembro ipsilateral, momento en el que, al incrementarse el QA, la estenosis se hace sintomática466.
La causa principal de estenosis venosa central en pacientes en diálisis es el desarrollo de una hiperplasia intimal, cuyo origen suele ser secundario al trauma crónico ocasionado por un CVC, al que se puede añadir en pacientes portadores de FAV en el brazo el alto flujo y sus turbulencias secundarias467. El 90% de los pacientes con estenosis centrales ha tenido un catéter venoso468. Un 40% de los CVC en subclavia y un 10% de los CVC implantados vía yugular originan estenosis de venas centrales14.
Ante la sospecha clínica de estenosis venosa central, la prueba de imagen de elección es la fistulografía o flebografía. Si el paciente ya tiene una FAV, el estudio se puede realizar mediante punción directa de la vena de la FAV (segmento outflow). La imposibilidad de visualizar directamente con ED los vasos centrales relega esta prueba de imagen a un segundo lugar, si bien debe realizarse antes de la fistulografía para descartar una estenosis en cualquiera de los segmentos del acceso accesibles a los ultrasonidos. La fistulografía permite además la realización durante el mismo procedimiento del tratamiento del AV si este se encuentra indicado.
Otros medios diagnósticos para el estudio de las venas centrales son la angiotomografía computarizada (angio-TC) y la angiorresonancia magnética (angio-RM). La angio-TC presenta la ventaja frente a la angio-RM de tener una mayor resolución en la imagen, aunque ambas técnicas presentan inconvenientes (v. apartado “Monitorización y vigilancia del acceso vascular”), ya que tienen un alto coste y no evitan la realización de una fistulografía en caso de existir estenosis central. En casos de alergias al contraste yodado podría indicarse realizar una angio-RM, aunque existe riesgo de fibrosis sistémica nefrogénica.Desarrollo de la síntesis de la evidencia
Existe unanimidad en la bibliografía en que solo se deben tratar los casos sintomáticos14,15,466,469. En la revisión de Levit et al469 de pacientes en HD asintomáticos, con estenosis central > 50% en el 28% de ellos, no se realizó angioplastia y ninguno desarrolló posteriormente sintomatología. Sin embargo, en un 8% de los pacientes tratados se evidenció un agravamiento de la estenosis que se hizo sintomática, lo que, según los autores, se debería a un empeoramiento de la estenosis por daño endotelial producido por el balón. Chang et al470 describen hallazgos similares.
El tratamiento de elección en las estenosis de venas centrales es la dilatación con catéter balón14,15,466. La ATP en venas centrales tiene una alta tasa de éxito técnico, que varía del 70 al 90% según las series466. Buriánková et al471 obtienen un 96% de éxito en las estenosis y solo un 50% en las oclusiones. En cuanto a la permeabilidad tras la ATP, los resultados varían (según autores) entre un 12 y un 50% de permeabilidad primaria al año y un 13 y un 100% de permeabilidad secundaria466, aunque estos resultados pueden mejorar con el uso sistemático y cada vez más extendido de balones de mayor diámetro y alta presión466,471. La complicación más grave tras una ATP de venas centrales es la rotura de la vena que, aunque excepcional, se debe identificar inmediatamente y tratar inicialmente mediante compresión con balón a baja presión durante 6min 3 veces consecutivas. Si no se consigue cerrar la hemorragia, la otra opción es el implante de un stent recubierto465.
Las diferentes guías y las revisiones bibliográficas más recientes recomiendan el implante de un stent en aquellas estenosis elásticas resistentes a la dilatación y en recidivas de menos de 3 meses tras la última ATP14,15,466. Cuando se coloca un stent es muy importante no ocluir zonas de confluencia venosa, como el ostium de la yugular interna o el tronco braquiocefálico contralateral, para evitar problemas en la colocación de futuros AV.
En cuanto a los resultados de los stents, al igual que en el caso de las ATP, los resultados varían según los autores, con tasas de permeabilidad primaria al año que fluctúan entre el 14,3 y el 100% y de permeabilidad secundaria entre el 33 y el 91%466. En algunos estudios comparativos entre ATP e implante de stents no parecen existir diferencias significativas en cuanto a permeabilidad primaria y secundaria472,473. Es posible que, en un futuro, con el desarrollo de nuevos stents específicos para venas de diámetros adecuados y alta fuerza radial, estos resultados mejoren. Los stents recubiertos pueden ser otra opción, con resultados iniciales prometedores, aunque faltan series prospectivas y estudios aleatorizados467. En teoría, los stents recubiertos ocasionan menos hiperplasia intimal que los no recubiertos. Como factor en contra, al ser recubiertos pueden ocluir más fácilmente zonas de confluencia venosa que impidan en un futuro la colocación de un CVC. En cuanto a complicaciones, las más frecuentes son el acortamiento, la fractura y la migración del stent467. El acortamiento y la migración son menos frecuentes desde que se utilizan stents de nitinol que, por su memoria térmica, se adaptan mejor a zonas venosas tortuosas418.De la evidencia a la recomendación
Si durante el seguimiento del AV del paciente en HD surge la sospecha clínica de una estenosis venosa central, para su diagnóstico de confirmación se requiere la realización de una fistulografía, que es el método diagnóstico que va a permitir además localizar la lesión y preparar el abordaje terapéutico.
En los cuadros de estenosis central en que —como compensación a la estenosis— se ha desarrollado circulación colateral y en ausencia de clínica significativa, no sería necesario su tratamiento, dada la ausencia de un balance positivo riesgo-beneficio. Por tanto, solo se recomendaría tratar las estenosis con repercusión clínica.
En caso de considerarse la estenosis tributaria de tratamiento, el abordaje de elección sería el tratamiento endovascular mediante la realización de ATP con balón, reservando la colocación de stent para los casos de estenosis que presenten resistencia a la dilatación o recidiva frecuente o precoz de la estenosis, antes de los 3 meses. En la colocación del stent se debe evitar ocluir zonas de confluencia venosa para evitar problemas con futuros AV.
R 5.1.4) Se recomienda la realización de una fistulografía ante la sospecha clínica de una estenosis venosa central
R 5.1.5) Se recomienda tratar solo las estenosis de venas centrales que sean sintomáticas
R 5.1.6) Se recomienda como primera opción de tratamiento en las estenosis centrales la terapia endovascular mediante angioplastia transluminal percutánea con balón
R 5.1.7) Se sugiere limitar la utilización de stents a casos seleccionados de fracaso técnico de la angioplastia y recidiva frecuente de la estenosis, y se recomienda no utilizarlos en confluentes venosos
R 5.2.1) Se recomienda intentar la repermeabilización de la fístula arteriovenosa trombosada potencialmente recuperable de forma prioritaria, preferentemente dentro de las primeras 48 h. La prioridad debe ser, en todos los casos, el rescate de la fístula arteriovenosa y evitar la colocación de catéteres venosos centrales
R 5.2.2) Se recomienda la realización de una prueba de imagen tras la repermeabilización de la fístula arteriovenosa, que se debe realizar inmediatamente tras la trombectomía, para detectar posibles estenosis que precisen tratamiento
(•) NUEVA R 5.2.3) Se recomienda inicialmente el tratamiento quirúrgico en la fístula arteriovenosa nativa con trombosis secundarias a estenosis yuxtaanastomóticas, siempre y cuando la técnica no requiera la colocación de un catéter venoso central
(•) NUEVA R 5.2.4) En las trombosis no asociadas a estenosis yuxtaanastomóticas de la fístula arteriovenosa nativa se recomienda su repermeabilización mediante tratamiento quirúrgico o mediante terapia endovascular con la utilización, si es necesario, de dispositivos de trombectomía mecánica o por aspiración
(•) NUEVA R 5.2.5) Se recomienda intentar la repermeabilización de la fístula arteriovenosa protésica trombosada mediante tratamiento quirúrgico o endovascular
(•) NUEVA R 5.2.6) Se recomienda la intervención electiva en la fístula arteriovenosa disfuncionante con estenosis significativa frente a la intervención postrombosis
NUEVA R 5.2.7) Se recomienda intentar la repermeabilización de la fístula arteriovenosa trombosada frente a la realización de una nueva fístula arteriovenosa y colocación de un catéter venoso central al asociarse a un menor coste sanitario, menor tasa de hospitalización y menor morbimortalidad
La sospecha inicial de trombosis aparece cuando en la exploración física se constata la ausencia, mediante auscultación y palpación de la FAV, del soplo o frémito, que se debe confirmar con una prueba de imagen.
La trombosis es la principal complicación de la FAV. El principal factor predisponente es la presencia de estenosis venosa, que es responsable del 80-90% de las trombosis291,474. La mayor parte de las estenosis suelen localizarse en el segmento proximal de las anastomosis arteriovenosas en las FAVn y en la anastomosis venosa en las FAVp14. Toda FAV trombosada se debe evaluar de forma urgente, realizándose la repermeabilización del acceso cuando se encuentre indicado, en las primeras 24-48h tras el evento. Sea el procedimiento de rescate endovascular o quirúrgico, al finalizar la extracción del trombo se debe realizar una fistulografía para localizar las estenosis, y en el mismo procedimiento solucionar la causa subyacente para evitar episodios de retrombosis475,476. Otras causas de trombosis son las estenosis arteriales y factores no anatómicos como la compresión excesiva del AV tras la HD, la hipotensión, los valores elevados de hematocrito, hipovolemia y los estados de hipercoagulabilidad477–480.
Dada la trascendencia del AV para la evolución clínica del paciente, la morbilidad asociada a los CVC y la limitación anatómica para la realización de múltiples AV, se debe intentar el rescate de toda FAV potencialmente recuperable. La única contraindicación absoluta es la infección activa del AV. Contraindicaciones relativas son la alergia al contraste yodado, una situación clínica inestable o que ponga en peligro la vida del paciente; las alteraciones bioquímicas o hidroelectrolíticas que requieran tratamiento con diálisis urgente como edema pulmonar, hipercalemia o acidosis metabólica graves; el shunt cardíaco derecha-izquierda; la enfermedad pulmonar grave, y la FAV aneurismática con trombosis de una gran extensión del AV.
La trombosis del AV para HD debe considerarse como una urgencia terapéutica que precisa solución inmediata. Se deberán establecer las estrategias necesarias para que tengan dicha consideración y para que en cada centro todos los profesionales implicados participen en un abordaje multidisciplinar del problema. El rescate urgente del acceso permite, en primer término, evitar la colocación de un CVC temporal, con la morbilidad que ello supone. Sin embargo, antes de cualquier procedimiento terapéutico se deberá realizar una valoración clínica del paciente y un estudio analítico que descarten situaciones de potencial riesgo o gravedad (edema pulmonar e hipercalemia grave). En el caso de que el paciente precise una HD urgente se procederá a la colocación de un CVC, demorando el procedimiento de la trombectomía. Esta demora deberá ser menor de 48h desde que se produjo la trombosis14,481. Los trombos se fijan progresivamente a la pared de la vena o de la prótesis de PTFE haciendo la trombectomía más difícil cuanto más tarde se intente la desobstrucción14. No obstante, el factor “tiempo” no tiene por qué ser excluyente dada la descripción de rescates de accesos trombosados, aun habiendo transcurrido varias semanas tras la trombosis271.Trombectomía endovascular
El primer objetivo de la técnica endovascular es la recanalización del trombo, utilizando para ello guías hidrofílicas preferiblemente con punta angulada, menos traumáticas, que evitan la disección venosa. El aspirado del trombo se realiza con sistemas de tromboaspiración manual con presión negativa271,482, con catéter grueso de 7 a 9 Fr o tromboaspirado por succión. Para evitar complicaciones relacionadas con el procedimiento se aconseja la administración de heparina sódica. Finalizado el procedimiento, no existe una indicación estandarizada para el tratamiento farmacológico, aunque algunos autores recomiendan heparina de bajo peso molecular en días alternos a la HD, para prevenir la retrombosis de la FAV271, y otros, antiagregación con aspirina o clopidogrel durante las 72h postrombectomía475.
Wen et al475, revisan sus resultados empleando el sistema de aspirado de trombos AngioJet en 109 pacientes con trombosis de FAVn, y obtienen unos resultados de éxito técnico del 76% (80% antes de los 3 días y 63% después de los 3 días), con unas tasas de permeabilidad primaria del 67, 57 y 39% a los 30, 90 y 180 días, respectivamente. Los resultados son similares a los obtenidos con otros dispositivos de tromboaspiración (Arrow-Trerotola, Hydrolyser y trombectomía con balón) o trombólisis farmacológica475,483. Estos mismos autores consideran más dificultosa la revascularización de FAVn que la de las FAVp, ya que, en su experiencia, las venas nativas son más susceptibles de lesión o rotura y presentan una anatomía más compleja con aparición, en ocasiones, de múltiples estenosis y/o formaciones aneurismáticas. Junto con estos datos, varios autores recomiendan la utilización de la tromboaspiración manual con catéter en la FAVn al ser los catéteres más flexibles, estar preformados y tener menor calibre que otros dispositivos de trombectomía, siendo por ello menos lesivos sobre el endotelio vascular271,484.
Las complicaciones descritas durante el procedimiento son: tromboembolia pulmonar, embolia arterial, rotura o disección de la vena o hematoma en el lugar de la punción, que puede llegar a ser anemizante271,475. El empleo de stents en los casos de trombosis está poco documentado, aunque podría tener su utilidad en dilataciones aneurismáticas con trombos residuales tras tromboaspiración271.Trombectomía quirúrgica
Clásicamente, la trombosis de la FAVn se ha tratado quirúrgicamente485,486, y se continúa realizando en numerosas unidades487 mediante catéter de embolectomía, revisión quirúrgica precoz del acceso y de sus vasos aferentes y eferentes, más evaluación radiológica intraoperatoria para tratar las lesiones subyacentes encontradas, con buenos resultados y bajo coste. El tratamiento incluye la reparación con la reconstrucción o creación de una nueva anastomosis unos centímetros más proximal, o el bypass de la zona estenótica con interposición de un segmento de PTFE. Si la trombosis está localizada en el área adyacente a la anastomosis de FAV radiocefálicas y braquiocefálicas, la vena puede estar preservada y se recomienda la creación de una nueva anastomosis, incluso aunque hayan transcurrido varios días291,485. A la técnica quirúrgica habitual de realizar una reanastomosis proximal, hay autores que han propuesto la interposición de un segmento de PTFE, con el objeto de evitar el consumo de trayecto venoso inherente a la cirugía. Los resultados publicados por dichos autores demuestran unas tasas de permeabilidad similares a la reanastomosis proximal, si bien presentan la desventaja de introducir material protésico en el AV273,488.
Se han propuesto nuevas técnicas quirúrgicas mediante extracción manual del trombo seguida de ATP de las lesiones estenóticas que muestran buenos resultados (éxito técnico en el 87% de los procedimientos). Los autores consideran que se trata de un procedimiento más simple y barato que la trombectomía percutánea o la trombólisis y, además, permite la eliminación del trombo agudo y crónico, así como del existente en los segmentos aneurismáticos489.
Por último, una de las indicaciones de la revisión y tratamiento quirúrgico se plantea en la trombosis precoz de las FAVn (primeras horas o días), al estar principalmente relacionada con problemas técnicos.Fibrinólisis farmacomecánica
La fibrinólisis farmacomecánica percutánea es un método mínimamente invasivo, que utiliza fármacos trombolíticos y un balón de ATP para el tratamiento de la trombosis. Los fármacos trombolíticos comúnmente utilizados son la urocinasa y el activador tisular del plasminógeno recombinante (rt-PA). El procedimiento consiste en la combinación de la liberación del fibrinolítico localmente, que puede realizarse de varios modos, y la ATP del trombo. La liberación del fibrinolítico se realiza tras conseguir sobrepasar el trombo y la zona estenótica responsable de la trombosis con la guía hidrofílica, siendo el sistema más utilizado el pulse-spray490. Tras conseguir una repermeabilización parcial, se procede a la realización de la trombectomía y ATP del trombo491,492 mediante catéter de balón, realizándose en el mismo procedimiento el tratamiento de la o las lesiones responsables de la oclusión.
En la bibliografía existen cuatro ECA493–496 y un estudio retrospectivo497 que comparan fibrinólisis con urocinasa y tromboplastia mecánica percutánea. No se evidenciaron diferencias estadísticamente significativas entre ambas técnicas en relación con el éxito técnico, la permeabilidad y las complicaciones493–495,497, a excepción del estudio realizado por Vogel et al496, donde los autores encuentran un mayor porcentaje de complicaciones hemorrágicas, principalmente en el punto de punción, con el uso de fibrinolíticos. A este inconveniente hay que añadir la imposibilidad de lisar la totalidad del trombo.
Por otro lado, si bien la mayor parte de los estudios encuentran como inconveniente de la fibrinólisis tiempos más largos en la realización del procedimiento, el estudio realizado por Vashchenko en el año 2010, donde estudia 563 procedimientos que comparan fibrinólisis del acceso trombosado mediante la técnica de “inyección de urocinasa y esperar” frente a trombectomía mecánica con dispositivo mecánico497, encuentra como ventaja de la fibrinólisis su menor coste, dado el elevado precio de los dispositivos mecánicos de trombectomía. No existe ningún estudio que compare, desde el punto de vista económico, la fibrinólisis del AV con la trombectomía con catéter.
En la revisión realizada por Bush et al en 2004498, en la que los autores comparan las diferentes técnicas de revascularización, endovasculares y quirúrgicas, incluyendo la fibrinólisis, tampocon encontraron diferencias entre los distintos métodos utilizados.
A pesar de sus inconvenientes, la fibrinólisis es una herramienta terapéutica que puede ser de utilidad en determinados casos cuando la trombectomía mecánica o por aspiración no sea suficiente para la eliminación completa de trombos14. Su mayor utilidad es combinada con trombectomía mecánica, permitiendo el uso de menores dosis de fibrinolítico y disminuyendo las complicaciones sistémicas derivadas de su utilización.
1.5.3 Tratamiento de la trombosis de la fístula arteriovenosa nativa
→ Pregunta clínica XVII En la trombosis de la fístula arteriovenosa nativa, ¿cuál sería la indicación inicial (angioplastia transluminal percutánea frente a cirugía) valorada en términos de supervivencia de la fístula arteriovenosa y/o trombosis? ¿Depende de la localización?
(Ver ficha de la Pregunta clínica XVII en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| No hay ECA que comparen el tratamiento quirúrgico respecto al endovascular. Solo hay publicadas series clínicas que muestran en conjunto resultados mejores para la cirugía en relación con éxito técnico y porcentajes de permeabilidad al año | Calidad muy baja |
| Aunque en pocas series, se encuentran mejores resultados tanto en éxito técnico como en permeabilidad de las FAV en las localizadas en el antebrazo que en las de brazo, independientemente del método utilizado para la reparación (endovascular o quirúrgica) | |
Hasta la actualidad no existen ECA que comparen los resultados obtenidos con los tratamientos quirúrgicos y la terapia endovascular. Sí existen estudios retrospectivos recientes. Ito et al476 comparan ambas técnicas en una muestra de 587 pacientes, de los que el 25% tenía FAVn. En este subgrupo destaca una permeabilidad a los 2 años del 33,7% con tratamiento endovascular comparada con un 37,5% con trombectomía quirúrgica y un 59,8% si se realiza cirugía con un injerto adicional o un nuevo AV (p = 0,0005).
En la revisión de Tordoir et al499, en la que solo se encuentra estudios observacionales para describir el comportamiento de ambas técnicas en la FAVn, la cirugía mantiene mejores resultados en permeabilidad primaria al año (el 74 frente al 40%) y permeabilidad secundaria (el 87 frente al 72%); los resultados son similares en éxito técnico (el 90 frente al 89%).
En las FAVn del antebrazo encuentran una ligera ventaja del tratamiento quirúrgico respecto a la ATP cuando se comparan las permeabilidades primaria y secundaria a largo plazo. El estudio no establece una separación entre estenosis en distintas localizaciones, por lo que los mejores resultados en el antebrazo pueden estar en relación con el tratamiento de la estenosis yuxtaanastomótica.
Se han constatado hallazgos similares en cuanto a resultados según la localización en dos estudios que analizan el tratamiento endovascular en el brazo y en el antebrazo500,501 y en un estudio con pacientes tratados con cirugía502. Todos ellos describen una mayor permeabilidad primaria para las FAVn localizadas en el antebrazo.De la evidencia a la recomendación
Los resultados obtenidos de los estudios retrospectivos y en ausencia de ECA indican una moderada mejor permeabilidad primaria de la cirugía respecto al tratamiento endovascular. Cuando se analizan los resultados en las fístulas trombosadas secundarias a estenosis yuxtaanastomóticas se encuentran mejores permeabilidades primaria y secundaria a largo plazo, lo que permite recomendar el tratamiento quirúrgico en esta localización, dados los mejores resultados en el tratamiento de estas estenosis. Esta decisión deberá asociarse a la prioridad de evitar la colocación de un CVC, por lo que si la cirugía no lo garantiza podrá contemplarse el procedimiento endovascular.
En el tratamiento de las trombosis no asociadas a estenosis yuxtaanastomóticas, tanto el tratamiento endovascular como el quirúrgico presentan una alta tasa de éxito clínico, sin que actualmente haya evidencia que permita recomendar una alternativa terapéutica determinada; por ello, la decisión sobre la técnica de elección deberá realizarse en función del contexto clínico del paciente, priorizando el hecho de evitar la colocación de un CVC cuando ello sea posible.
En cualquier caso, la evidencia existente sobre el tratamiento de la trombosis de las FAVn es difícil de interpretar dado que no solo no existen estudios que comparen directamente los procedimientos, sino que las series presentan una heterogeneidad técnica considerable, tanto en el abordaje endovascular como incluso en el quirúrgico, sin poder descartarse, asimismo, que en esta variabilidad pueda participar el uso de dispositivos diferentes en circunstancias diferentes. Por ello, la limitada evidencia disponible permite una orientación terapéutica también parcial, fundamentándose las recomendaciones con la interpretación del GEMAV.
R 5.2.3) Se recomienda inicialmente el tratamiento quirúrgico en la fístula arteriovenosa nativa con trombosis secundarias a estenosis yuxtaanastomóticas, siempre y cuando la técnica no requiera la colocación de un catéter venoso central
R 5.2.4) En las trombosis no asociadas a estenosis yuxtaanastomóticas de la fístula arteriovenosa nativa se recomienda su repermeabilización mediante tratamiento quirúrgico o terapia endovascular con la utilización, si es necesario, de dispositivos de trombectomía mecánica o por aspiración
5.2.2 Tratamiento de la trombosis de la fístula arteriovenosa protésica
Razonamiento
A pesar de presentar una mayor tasa de complicaciones que las FAVn, las FAVp son una buena solución en los pacientes con el lecho vascular venoso agotado y en pacientes ancianos, siendo la trombosis la principal complicación, la mayor parte de la cual se sitúa en la anastomosis venosa14 y es secundaria a una hiperplasia intimal derivada de mecanismos hemodinámicos por falta de ajuste entre la vena y la prótesis de PTFE503,504.
Como en las FAVn, la evaluación urgente con posterior trombectomía en las FAVp recuperables se encuentra indicada a realizar, si es posible, en las primeras 24-48h tras el evento, para evitar así la colocación de un CVC y la morbilidad asociada. Se establecen las mismas estrategias que se han mencionado en el apartado anterior (apartado 5.2.1.). Tras la recanalización deben realizarse estudios de imagen (ED o fistulografía) para localizar las estenosis, y en el mismo procedimiento realizar tratamiento de las lesiones condicionantes de episodios de retrombosis475,476.
Las estenosis y trombosis se pueden tratar endovascular o quirúrgicamente. Numerosos estudios han evaluado ambos métodos concluyendo que una combinación de ambos puede ser realmente beneficiosa. A finales de los años noventa, los accesos protésicos trombosados se trataban fundamentalmente de forma quirúrgica, seguida de una valoración angiográfica para identificar la causa de la trombosis y la presencia de trombo residual. El desarrollo de nuevos dispositivos endovasculares y la menor invasividad de este tipo de procedimientos han dado lugar a un predominio de estos últimos. En cualquier caso, ambos tipos de tratamiento en la detección y tratamiento de las estenosis subyacentes tienen el objetivo de asegurar la permeabilidad a largo plazo.
→ Pregunta clínica XVIII En la trombosis de la fístula arteriovenosa protésica, ¿cuál sería la indicación inicial (angioplastia transluminal percutánea frente a cirugía o fibrinólisis) valorada en términos de supervivencia de la fístula arteriovenosa y/o trombosis? ¿Depende de la localización?
(Ver ficha de la Pregunta clínica XVIII en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Las revisiones sistemáticas y ECA publicados que comparan la cirugía con la angioplastia transluminal percutánea describen resultados clínicos similares en el manejo de las FAVp trombosadas | Calidad alta |
| Respecto del tratamiento mediante trombectomía frente a trombólisis química se han identificado tres ECA que comparan la fibrinólisis con urocinasa y 3 opciones distintas de tromboplastia mecánica percutánea, que han mostrado resultados clínicos similares | Calidad moderada |
Clásicamente, en la trombosis de la FAVp se ha utilizado la trombectomía quirúrgica, seguida de reparación con bypass con interposición de injerto o bien asociando una reanastomosis en un segmento proximal de vena sin estenosis. El tratamiento percutáneo de las trombosis del AV es una opción terapéutica que tiene la ventaja frente a la cirugía de ser menos invasiva475 y permitir el ahorro de territorio venoso proximal. Como desventaja está la necesidad de un mayor número de procedimientos para mantener permeable la FAVp451,474.
Un metaanálisis realizado por Green et al en 2002474 concluyó en la superioridad de la cirugía, tanto en los fracasos técnicos como en la permeabilidad primaria. Por otro lado, en un metaanálisis reciente realizado por Kuhan et al505, en que se analizaron seis ECA que comparaban la terapia endovascular y la cirugía en la trombosis de la FAVp, los resultados fueron comparables entre ambas técnicas. Las tasas de éxito técnico resultaron, por término medio, del 74,5% con tratamiento endovascular frente al 80,3% con cirugía (p = 0,13); la permeabilidad primaria a los 30 días fue del 64,6% para el tratamiento endovascular y del 66,8% para la cirugía (p = 0,46); al año, el 14,2% con el abordaje endovascular frente al 23,9% con cirugía (p = 0,06); la permeabilidad primaria asistida al año se analizó en un único estudio, con el 20,5% con tratamiento endovascular frente al 43,9% con cirugía (p = 0,03); sin embargo, la permeabilidad secundaria al año, analizada también en un único estudio, fue del 86% para el tratamiento endovascular frente al 62,5% para el quirúrgico (p = 0,14).
A diferencia del metaanálisis realizado por Green et al474, en el que los resultados eran claramente favorables a la cirugía, el estudio de Kuhan et al505 equipara el tratamiento endovascular al quirúrgico, y el primero fue menos agresivo. Las técnicas endovasculares, con la utilización de dispositivos de trombectomía mecánica y por aspiración, y la incorporación de nuevos balones para angioplastia con más prestaciones técnicas, han nivelado la balanza entre cirugía y tratamiento endovascular; este último tiene la ventaja de ser menos invasivo. En relación con la comparación de las técnicas mecánicas percutáneas con la fibrinólisis farmacológica en tres ECA493–495, no se encuentran diferencias significativas en los resultados de permeabilidad.
En este sentido, sin embargo, a pesar de su invasividad, el tratamiento quirúrgico urgente que evita la colocación de un CVC con posterior evaluación y tratamiento de forma endovascular se ha comunicado recientemente con muy buenos resultados167. Los autores obtienen una tasa de permeabilidad del 67% a los 3 años y una tasa de trombosis de 0,45 episodios por paciente y año.
Por último, la utilización de prótesis metálicas no recubiertas es muy controvertida, y se han obtenido resultados similares a los descritos para el tratamiento de las estenosis del AV no asociadas a trombosis (apartado 5.1.). Respecto al uso de prótesis metálicas recubiertas (stent graft), en el estudio de Nassar et al505a, donde analizan los resultados en 66 pacientes con FAVp trombosadas, los autores encuentran peores resultados que los observados en otros estudios referidos al tratamiento de las estenosis venosas sin trombosis del AV419–421, con una pobre permeabilidad primaria (47 y 21% a 3 y 12 meses), similar a la observada tras trombectomía sin tratamiento de la estenosis498. Las trombosis no se asociaron al desarrollo de una estenosis intra-stent, por lo que los autores concluyen que deben existir otros factores que condicionan la trombosis del AV diferentes a la estenosis de la anastomosis venosa, y no recomiendan su utilización en caso de FAVp trombosadas.De la evidencia a la recomendación
Los estudios y ensayos clínicos revisados no muestran diferencias significativas en los resultados de permeabilidad entre la cirugía y el tratamiento endovascular, y en todos los casos son inferiores a los obtenidos en la FAVn. El tratamiento quirúrgico tiene mejores tasas de éxito técnico, permeabilidad primaria y primaria asistida (aunque de modo no significativo), mientras que el tratamiento percutáneo ofrece la ventaja de generar una menor agresividad con el procedimiento y, además, puede evitar la colocación de un CVC.
Por lo tanto, en el abordaje de la FAVp trombosada la orientación terapéutica puede plantearse indistintamente desde el punto de vista endovascular o quirúrgico. La elección de la técnica deberá realizarse teniendo en cuenta el contexto clínico del paciente, priorizando en la medida de lo posible el hecho de evitar la colocación de un CVC.
Consideración aparte merecen las trombosis debidas a estenosis en el territorio de la vena axilar, donde la complejidad técnica de la exposición quirúrgica de un segmento venoso proximal hace que el tratamiento percutáneo se considere de primera elección.
Por último, conviene señalar, al igual que en el caso de la FAVn, que la heterogeneidad, tanto de los estudios como de las condiciones técnicas, hace que en la interpretación de la evidencia haya contribuido la opinión del GEMAV.
5.2.3. Tratamiento electivo de la estenosis frente a postrombosis de la fístula arteriovenosa
Razonamiento
Como se viene mencionando, la trombosis es la principal complicación de la FAV y la principal causa de pérdida definitiva de esta. El principal factor predisponente es la presencia de estenosis venosa, que es responsable del 80-90% de las trombosis291,474. La mayor parte de las estenosis suelen localizarse en el segmento próximo a las anastomosis arteriovenosas en la FAVn y en la anastomosis venosa en la FAVp14.
La trombosis irreversible de la FAV va a condicionar una serie de consecuencias negativas para el paciente prevalente que realiza HD269, incrementando la morbimortalidad, la frecuencia de hospitalización y el gasto sanitario270. En relación con la trombosis del acceso hay que tener en cuenta:
- •
No siempre es posible la repermeabilización de todas las FAV271.
- •
Varios estudios señalan que la permeabilidad secundaria de la FAV después de la repermeabilización postrombosis es inferior a la reparación electiva de la estenosis de la FAV previo a la trombosis272,273.
Ante estos datos parece apropiado realizar tratamiento electivo de las estenosis previo a la trombosis de la FAV y de este hecho deriva la importancia de la vigilancia y el seguimiento de las FAV, tanto FAVn como FAVp.
→ Pregunta clínica XIX Ante la presencia de estenosis en la fístula arteriovenosa, ¿hay diferencia significativa entre intervenir electivamente o realizar el tratamiento postrombosis?
(Ver ficha de la Pregunta clínica XIX en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| No se ha encontrado ningún estudio prospectivo, aleatorizado o no, que compare la opción de realizar cirugía electiva para corregir la estenosis de la FAV frente a la opción de esperar e intervenir una vez que esta se ha trombosado. Se han localizado dos estudios retrospectivos que comparan los resultados de la cirugía de FAV con estenosis, pero sin oclusión por trombosis, frente a la cirugía de FAV con trombosis ya desarrollada273,506 | Calidad baja |
| Calidad baja Uno de ellos, realizado en FAVn complicadas con estenosis, no encuentra diferencias relevantes significativas entre los tratados con cirugía electiva o con cirugía tras la trombosis en relación con la reestenosis, pero sí en cuanto a la tasa de pérdida del AV, menor para cirugía electiva. El otro estudio no halla diferencias entre ambas opciones en relación con permeabilidad primaria y/o secundaria a los 12 meses | |
| Por último, un estudio prospectivo sí encuentra diferencias significativas a favor de la intervención electiva en la FAV disfuncionante272 | |
Dos estudios retrospectivos comparan resultados de cirugía electiva de la FAVn con estenosis, pero sin oclusión frente a la cirugía de FAV trombosada273,506.
El estudio retrospectivo de Lipari et al273 proporciona resultados de 64 pacientes con estenosis de FAV de antebrazo, 32 tratados con cirugía electiva y 32 con cirugía tras la trombosis. No encuentra diferencias en la tasa de reestenosis del acceso: 0,189 por año de FAV, igual para ambos tipos de cirugía, pero sí en la pérdida del AV: tasa de 0,016 por año de FAV para el grupo de cirugía electiva y de 0,148 para el de cirugía tras trombosis (p = 0,048). El éxito técnico fue del 100% para cirugía electiva y del 84% para cirugía tras trombosis.
El estudio retrospectivo de Cohen et al506 informa de 43 pacientes con FAV en brazo a quienes se había realizado 48 intervenciones en FAV estenosadas y 15 en FAV ya trombosadas. No encuentran diferencias significativas en cuanto a la permeabilidad del acceso a los 12 meses:
- •
Permeabilidad primaria del acceso a los 12 meses: el 56% para FAV con estenosis y el 64% para FAV ya trombosadas (p = 0,22).
- •
Permeabilidad secundaria del acceso a 12 meses: 64% para FAV con estenosis y 63% para FAV ya trombosadas (p = 0,75).
Globalmente, el éxito técnico de la cirugía fue del 95% (60 de 63; dos fallos en la trombólisis y uno en la cirugía primaria para la estenosis).
En un estudio prospectivo se compara la opción de realizar cirugía electiva para corregir la estenosis de la FAV frente a la opción de esperar y operar cuando se desarrolla trombosis de la FAV272. Los investigadores describen una mayor permeabilidad en las FAV reparadas después de una disfunción que en las reparadas después de una trombosis, tanto en su conjunto como cuando se analizan de manera desagregada por cada tipo (nativas o protésicas). En este estudio prospectivo con un seguimiento de 5 años se evaluaron 317 FAV (73% FAVn y el resto FAVp [PTFE]) en 282 pacientes. Se produjeron 88 trombosis, correspondientes a una tasa de trombosis/ acceso/año de 0,06 para FAV y 0,38 en PTFE. El 66,6% de reparaciones de la FAV fueron electivas, y en el 76% de las trombosis se realizó cirugía urgente. La supervivencia añadida de todas las FAV incidentes reparadas tras disfunción fue de 1.062 ± 97 días frente a 707 ± 132 en las reparadas por trombosis (p < 0,02). El incremento del riesgo para la pérdida de la FAV en las reparadas tras trombosis frente a disfunción fue de 4,2 (p < 0,01).De la evidencia a la recomendación
A pesar de la ausencia de estudios aleatorizados y de ser escasos y limitados metodológicamente, los estudios que analizan la evolución del tratamiento electivo frente al tratamiento postrombosis orientan con sus resultados a favor de la primera, con a una menor pérdida de la FAV y una mayor supervivencia.
Por otro lado, se ha de tener en cuenta el escenario en que se encuentra un paciente con un AV trombosado respecto al de una actuación de modo electivo. La mayor probabilidad de que presente factores menos controlables como la situación clínica del paciente, el grado de extensión de la trombosis o el requerimiento de un CVC, hace que las garantías de éxito puedan encontrarse comprometidas.
Por ello, el GEMAV recomienda realizar la intervención electiva o preventiva de la estenosis frente a la intervención de rescate postrombosis, siguiendo los criterios expuestos en el apartado 4, asociados al alto riesgo de trombosis.
La trombosis de la FAV origina un considerable número de hospitalizaciones, el uso de CVC y, como consecuencia, un aumento del gasto sanitario. Junto a ello se suma la morbimortalidad asociada al CVC y la limitación anatómica para la realización de múltiples accesos, por lo que las guías clínicas actualmente en vigor consideran la trombosis de la FAV una urgencia médica6.
Ante la trombosis de un AV, las opciones posibles son:
- •
Proceder a colocar un CVC para dializar al paciente y posteriormente remitirlo para realizar una nueva FAV.
- •
Intentar la reparación urgente de la FAV para su uso posterior, intentando evitar el ingreso del paciente y la colocación de un CVC.
Ambos procedimientos suponen un coste y un gasto sanitarios, siendo necesario realizar estudios de análisis de costes de estos procedimientos.
Con respecto al tratamiento del FAVp, parece existir un acuerdo en la bibliografía de una mayor ventaja de la trombectomía urgente, ya sea quirúrgica o endovascular, frente a la realización de un nuevo AV272,507. No es así en el caso de los accesos nativos. Si bien las FAVn se consideran superiores a las FAVp como AV, no están exentas de problemas. Durante la última década, el manejo de las FAVn trombosadas se ha llevado a cabo quirúrgica o endovascularmente. A pesar de ello, los intentos para salvarlas no están ampliamente establecidos. Aunque el tratamiento percutáneo de la FAVn trombosada es altamente exitoso, suele precisar de intervenciones repetidas para el mantenimiento de la permeabilidad a largo plazo507. Los datos publicados en relación con el gasto sanitario que supone la vigilancia y tratamiento electivo de la estenosis para prevenir la trombosis del AV son controvertidos281,508, con escasos estudios de coste-efectividad.
Sin embargo, sí existen varios estudios en relación con los importantes gastos sanitarios que suponen los AV en el paciente en HD prevalente509. En el estudio de Manns et al510 se muestra el elevado coste en los pacientes incidentes en HD con fallo primario en su AV debido, en parte, al incremento en el número de procedimientos diagnósticos: imagen y procedimientos intervencionistas. Para los sistemas de salud con un control estricto en el gasto económico es extremadamente relevante.
Bittl et al508, tras realizar un análisis económico del gasto que supone el mantenimiento del AV, concluyen que este es superior al que conllevaría la realización en la población prevalente de mayor número de FAVn (con menor porcentaje de trombosis y de disfunciones). El artículo no hace referencia a qué ocurriría con una población prevalente con un porcentaje muy elevado de FAVn.
Por otro lado, en el estudio de Coentrao511 se realizó un análisis retrospectivo de costes y gastos sanitarios comparativo entre el tratamiento de la FAVn trombosada y su posterior seguimiento con la creación de un nuevo AV, y se observó que la trombectomía percutánea y el tratamiento de las estenosis frente a la creación de un nuevo AV y espera a su maduración se asocian a una reducción en los costes. El grupo en que se realiza este procedimiento se relaciona con una mayor hospitalización y problemas de manejo del AV (4 veces superior), con una menor supervivencia del nuevo AV y la consecuente comorbilidad asociada al CVC.
Por último, en un estudio muy reciente donde se analiza de forma retrospectiva y durante un período de 11 años el tratamiento quirúrgico urgente de 268 episodios de trombosis de AV frente a la cirugía programada487, los autores obtienen un beneficio económico de 5.397 € a favor de la reparación urgente del AV frente a la realización de un nuevo acceso. Este beneficio viene derivado del mayor gasto hospitalario asociado a la realización de un nuevo AV (complicaciones del CVC) y a la necesidad de realizar intervenciones para conseguir la maduración. La extrapolación del ahorro al conjunto de la población española con 23.000 pacientes en HD supondría 9.930.480 €/año. Sin embargo, el estudio no analiza las diferencias entre FAVn y FAVp ni incluye el tratamiento endovascular del AV trombosado.
Por todo ello, aunque no se han encontrado estudios prospectivos ni ensayos clínicos que comparen ambos procedimientos, los datos obtenidos de la bibliografía parecen sugerir que la creación de un nuevo AV conlleva un mayor gasto y morbilidad asociada a la colocación de un CVC que la reparación urgente del AV trombosado.
5.3Manejo de la fístula arteriovenosa no maduraRecomendaciones(•) NUEVA R 5.3.1) Se recomienda realizar un control clínico a las 4-6 semanas para detectar de modo definitivo las fístulas arteriovenosas nativas con retraso o ausencia de maduración desde su creación hasta este momento y plantear su tratamiento electivo. Se recomienda la confirmación de la sospecha de falta de maduración mediante ecografía Doppler
(•) NUEVA R 5.3.2) Se sugiere realizar un tratamiento precoz de la fístula arteriovenosa nativa inmadura para favorecer su maduración y evitar su trombosis y pérdida definitiva
(•) NUEVA R 5.3.3) Se recomienda no utilizar de manera sistemática técnicas percutáneas ni quirúrgicas para favorecer la maduración de la fístula arteriovenosa nativa
(•) NUEVA R 5.3.4) Se sugiere la opción quirúrgica como primera opción de tratamiento (reanastomosis proximal) en las fístulas arteriovenosas nativas con fallo en la maduración asociado a estenosis yuxtaanastomóticas. En los casos en que esta no sea posible se planteará tratamiento endovascular (angioplastia transluminal percutánea)
(•) NUEVA R 5.3.5) Se sugiere la desconexión mediante ligadura percutánea, quirúrgica o embolización endovascular con coils en el caso de presencia de venas accesorias significativas asociadas a fallo en la maduración. En caso de presencia de estenosis se sugiere el tratamiento endovascular y, en ausencia de estenosis, se sugiere el tratamiento quirúrgico como primera opción, dados su menor complejidad y coste sanitario
(•) NUEVA R 5.3.6) Se recomienda la angioplastia en los casos de fístulas arteriovenosas nativas inmaduras con estenosis venosas proximales
(•) NUEVA R 5.3.7) Se sugiere la angioplastia de las estenosis arteriales cuando la inmadurez de la fístula arteriovenosa nativa venga determinada por estas, en los casos en que no se comprometa la vascularización de la extremidad
Se estima que entre un 28 y un 53% de las FAV no maduran lo suficiente para su uso en la HD512. En general, se necesita un QA de 500ml/min y un diámetro de al menos 4mm para que una FAV sea adecuada para la diálisis. En fístulas exitosas, estos parámetros se cumplen en 4 a 6 semanas. En otros casos hay que esperar hasta los 4-6 meses para concluir que la FAV ha fallado. En el intervalo, si se necesita la HD se inserta un CVT (catéter venoso tunelizado), exponiendo al paciente a la morbilidad y la mortalidad asociadas con el uso de este AV.
Este problema podría resolverse hipotéticamente mediante la detección precoz de los casos de falta de maduración y el tratamiento mediante métodos quirúrgicos o endovasculares para inducir la maduración de la FAV.
Dos factores, por separado o combinados, suelen ser culpables de la mayoría de los casos de falta de maduración de la FAVn: la estenosis venosa y la presencia de una vena accesoria significativa (una rama venosa que sale del canal venoso principal que compone la FAV). Ambos problemas se pueden sospechar durante las visitas de control clínico, y tras confirmarse con ED plantearse la intervención terapéutica.
El aumento en el QA y el incremento en el diámetro de la vena de salida se producen de manera precoz tras la realización de la FAVn513–515. Estos estudios han demostrado que la fístula que va a madurar lo hace en las primeras 2-4 semanas. Así pues, la buena práctica clínica aconsejaría la evaluación del AV a las 4-6 semanas de su realización512,516. La recomendación de este control precoz se fundamenta en el hecho de que la mayoría de las FAVn con retardo o ausencia de maduración va a presentar lesiones estenóticas en el circuito de la FAV, lo que, debido a que las estenosis vasculares suelen ser progresivas, llevará a la trombosis y a la pérdida del AV con el tiempo.
En la mayoría de casos, la detección de los posibles pacientes con FAVn inmadura se puede realizar mediante una exploración física cuidadosa, como se indica en el apartado 4, que puede permitir una orientación sobre la causa de la disfunción (tabla 23).
Madurez de la fístula arteriovenosa. Exploración física
| Fistula madura |
| Vena facilmente compresible |
| Thrill prominente en la anastomosis y presente en el trayecto |
| Colapso de la vena al elevar la extremidad |
| Estenosis yuxtaanastomotica |
| Pulso prominente en la anastomosis |
| Thrill disminuido |
| Escaso desarrollo de la vena tras la estenosis |
| Presencia de pulso debil tras la compresion de la vena de salida |
| Venas accesorias |
| Visualizables en la inspeccion |
| Presencia de thrill en su trayecto |
| Persistencia de thrill tras la compresion de la vena de salida |
| Estenosis vena proximal |
| Trayecto de la vena hiperpulsatil |
| Ausencia de colapso al elevar la extremidad |
| Edema de la extremidad |
Tras el diagnóstico de presunción, una exploración mediante ED confirmará el diagnóstico de fístula inmadura (diámetro < 0,4cm y QA < 500ml/m) y permitirá, asimismo, en la mayoría de casos, detectar la causa de la ausencia de maduración. En los casos en los que la ED no lo consiga se puede indicar la realización de una prueba de imagen (fistulografía)10,512,517,566
Diversos estudios han demostrado la utilidad del tratamiento precoz en los casos con alteraciones en la maduración de la FAV512,516,518,519, de forma que se puede aumentar en un 47% la probabilidad de maduración en estos pacientes520. Asimismo, los procedimientos realizados (quirúrgico y endovascular) han demostrado ser seguros, con una baja tasa de complicaciones521.
→ Pregunta clínica XX ¿Hay un tratamiento con mejores resultados (angioplastia transluminal percutánea frente a cirugía o interposición de prótesis) en el manejo de la fístula arteriovenosa no desarrollada, valorado en fístula arteriovenosa que permita su uso en diálisis, supervivencia y/o trombosis?
(Ver ficha de la Pregunta clínica XX en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Un estudio retrospectivo, con una muestra pequeña de pacientes, encuentra mejores resultados de la cirugía frente a la ATP en relación con la supervivencia de la FAV al año (FAV válida para HD) | Calidad baja |
| Numerosas series clínicas en FAV no desarrolladas tratadas por ATP encuentran altas tasas de éxito clínico (FAV válida para HD) y de permeabilidad secundaria al año | |
- •
Estenosis yuxtaanastomótica. La causa más frecuente de fallo en la maduración es la presencia de una estenosis en el trayecto de la vena que, en la mayoría de los casos, está localizada en la zona yuxtaanastomótica. Las alternativas terapéuticas son el tratamiento quirúrgico (reanastomosis proximal) y la ATP.
De forma general, se pueden aplicar las mismas consideraciones que para el tratamiento de las estenosis yuxtaanastomóticas en la FAV madura; así, varias revisiones517,519,521–523que incluyen distintas series clínicas, que han analizado la efectividad y seguridad de la angioplastia percutánea para tratar la FAV que no se desarrolla, muestran buenas tasas de resultados inmediatos. Sin embargo, la supervivencia acumulada de la FAV que se ha sometido a una o varias intervenciones para promover su maduración ha demostrado ser significativamente menor que la de las FAV que no han requerido dichas técnicas524, y en el único estudio en el que se ha comparado una técnica con la otra (reanastomosis frente a ATP), los resultados han demostrado una supervivencia acumulada al año de la fístula significativamente mayor en los pacientes tratados con cirugía (83%) que en los tratados con ATP (40%)525.
- •
Venas accesorias. La influencia de la presencia de venas accesorias dilatadas en la fístula inmadura no ha sido totalmente aclarada516. Si bien es un hallazgo frecuente en estos pacientes (46%), su desarrollo se ha interpretado por algunos autores más como consecuencia de una estenosis proximal que como causa de la ausencia de desarrollo de la FAV517,526.
Algunos autores han hallado buenos resultados mediante su desconexión aislada527, aunque en la mayoría de las series esta se indica como tratamiento complementario de las estenosis venosas512,516,517, habiéndose descrito mejores resultados en los casos en los que las venas accesorias se desconectaban526, lo que sugiere una cierta influencia en la falta de maduración de la FAV.
Tres son las técnicas descritas en la bibliografía: ligadura percutánea, desconexión quirúrgica o embolización endovascular mediante coils. Distintas publicaciones han demostrado su seguridad y buenos resultados, de forma aislada o bien en combinación con el tratamiento de estenosis coexistentes, si bien no hay ningún estudio que las compare entre sí516,519,527,528.
- •
Estenosis proximales. No hay series publicadas con casos de estenosis proximales aisladas; los principales artículos y revisiones son con datos conjuntos de estenosis proximales y yuxtaanastomóticas, siendo todas ellas tratadas de forma endovascular.
Los resultados describen una alta tasa de éxito inmediato y la seguridad del procedimiento, así como una alta tasa de reestenosis517,519,521,522. No hay series publicadas sobre tratamiento quirúrgico de este tipo de lesiones.
- •
Estenosis arteriales. La evidencia sobre el tratamiento aislado de lesiones en la arteria aferente en FAVn con alteraciones en la maduración proviene de un único estudio526. Los autores describen una alta tasa de éxito inmediato, así como de maduración del acceso, aunque hubo una alta incidencia de roturas arteriales durante el procedimiento (18%), un 7% de isquemia de la extremidad tras dicha técnica y un número no determinado tras el seguimiento.
No se hallaron estudios sobre el tratamiento quirúrgico o conservador en los casos de lesiones arteriales proximales a la FAVn.
Los resultados a medio y largo plazo de las intervenciones para favorecer la maduración del acceso se han evaluado en distintos trabajos519,524,525,529.
Lee et al524 encontraron un importante descenso en la supervivencia acumulada del acceso en FAV que habían requerido intervenciones de cualquier tipo para promover su maduración. La tendencia de estos procedimientos a la reestenosis parece deberse, según la mayoría de autores, a la agresión mecánica del balón de ATP sobre el endotelio vascular y la posterior hiperplasia intimal que conlleva512,530.
Un trabajo posterior525 identifica el grupo de menor supervivencia acumulada en los pacientes tratados mediante angioplastia, mientras que no encuentra diferencias significativas entre el grupo tratado con cirugía y el grupo de FAV que no requirieron de ningún procedimiento para su maduración525. Similares resultados fueron descritos por Long et al529.De la evidencia a la recomendación
La mayor parte de los cambios hemodinámicos y morfológicos producidos tras la realización del AV se producen durante las primeras 2-4 semanas, produciéndose a partir de entonces una ausencia de progresión o incluso un descenso progresivo del flujo del acceso en los casos de FAV inmadura; es por ello que se recomienda un control clínico precoz (4-6 semanas) para detectar los casos con alteraciones en la maduración del AV y la realización de una ED de las FAV inmaduras para confirmar el diagnóstico clínico y búsqueda de las lesiones asociadas.
Un tratamiento precoz de las lesiones subyacentes puede aumentar en un 47% la probabilidad de maduración del acceso, por lo que se recomienda actuar en los casos en que haya indicación. Considerando, por una parte, el mal pronóstico de la FAVn inmadura (diagnosticada como tal a las 4-6 semanas de su realización) y, por otra, el peor pronóstico que conlleva el acceso tratado mediante métodos percutáneos para favorecer su maduración (reestenosis precoz), se puede considerar que la mejor opción terapéutica en las estenosis yuxtaanastomóticas es la cirugía (reanastomosis proximal), dado que va a permitir el rescate del acceso sin condicionar un peor pronóstico con respecto a la FAV que no ha presentado problemas de maduración. En estos casos, la angioplastia percutánea es una opción segura y con alta tasa de éxito en la maduración de la FAV, si bien la mayor incidencia de reestenosis asociadas hace recomendable su uso en los casos en los que no esté indicada su corrección quirúrgica.
En cuanto a la opción defendida por algunos autores de realizar la ATP de forma sistemática y precoz en todas las fístulas para promover su maduración, no se recomienda este uso sistemático debido a la alta incidencia de reestenosis y a la peor supervivencia del acceso asociada a tales intervenciones, si bien son necesarios más estudios que puedan delimitar sus indicaciones en la práctica clínica. Por ello, actualmente solo se pueden recomendar las técnicas de asistencia a la maduración en los casos diagnosticados de inmadurez del AV.
En los casos de FAVn inmadura asociada a presencia de colaterales significativas, las tres opciones terapéuticas descritas en la bibliografía (ligadura percutánea, desconexión quirúrgica o embolización endovascular mediante coils) han demostrado ser técnicas fiables con baja morbilidad y alta tasa de éxito inmediato, por lo que la técnica de elección debería estar indicada por el procedimiento al que se asocie la intervención, como el caso en que coexistan estenosis venosas. En los casos de venas desarrolladas en ausencia de otras lesiones, la elección de la modalidad de tratamiento dependerá de las características de la vena accesoria (profundidad, accesibilidad quirúrgica, proximidad a áreas de punción, etc.), si bien se reconoce la mayor complejidad técnica y el mayor coste sanitario de las técnicas percutáneas529, por lo que no existiendo diferencias significativas en cuanto a éxito y complicaciones, el tratamiento debería decantarse por la ligadura quirúrgica o percutánea como primera elección.
En el tratamiento de las lesiones situadas en la vena de salida y en la arteria aferente, la escasa evidencia disponible en la actualidad hace referencia a series de FAVn tratadas con ATP.
Las estenosis en la vena proximal en la FAVn inmadura pueden tratarse de forma endovascular, por ser un procedimiento seguro y efectivo, aunque debe asociarse a un protocolo de seguimiento debido a la tendencia a la reestenosis.
En cuanto al tratamiento endovascular de las estenosis arteriales, la evidencia procede de la serie publicada por Turmel-Rodrigues et al531, en la que se consigue una alta tasa de éxito del procedimiento, asociada, no obstante, a rotura arterial y a un porcentaje no bien definido de isquemias de la extremidad. El hecho de que la ATP se realice sobre la arteria responsable de la vascularización de la extremidad hace que la ATP y la posibilidad de reestenosis y de trombosis arterial conlleven un riesgo de afectar negativamente la evolución natural de la enfermedad obliterante en estos pacientes y producir isquemia de la extremidad, riesgo que no se resuelve tras la desconexión de la FAV. La buena práctica clínica recomienda la indicación de estas técnicas únicamente en los pacientes en los que se haya demostrado la existencia de una vía compensatoria en la vascularización de la extremidad (ATP en arterias radiales con permeabilidad comprobada de arteria cubital y de arco palmar).
R 5.3.3) Se recomienda no utilizar de manera sistemática técnicas percutáneas ni quirúrgicas para favorecer la maduración de la fístula arteriovenosa nativa
R 5.3.4) Se sugiere la opción quirúrgica como primera opción de tratamiento (reanastomosis proximal) en las fístulas arteriovenosas nativas con fallo en la maduración asociado a estenosis yuxtaanastomóticas.
En los casos en que esta no sea posible, se planteará tratamiento endovascular (angioplastia transluminal percutánea)
R 5.3.5) Se sugiere la desconexión mediante ligadura percutánea, quirúrgica o embolización endovascular con coils en el caso de presencia de venas accesorias significativas asociadas a fallo en la maduración. En caso de presencia de estenosis se sugiere el tratamiento endovascular y, en ausencia de estenosis, se sugiere el tratamiento quirúrgico como primera opción, dados su menor complejidad y coste sanitario
R 5.3.6) Se recomienda la angioplastia en los casos de fístulas arteriovenosas inmaduras con estenosis venosas proximales
R 5.3.7) Se sugiere la angioplastia de las estenosis arteriales cuando la inmadurez de la fístula arteriovenosa nativa venga determinada por estas, en los casos en que no se comprometa la vascularización de la extremidad
NUEVA R 5.4.1) Se recomienda tratar la infección de una fístula arteriovenosa nativa con antibióticos adecuados durante 4-6 semanas. En los casos de presencia de fiebre > 38 °C y/o bacteriemia asociada se sugiere iniciar el tratamiento antibiótico por vía intravenosa
NUEVA R 5.4.2) Se recomienda realizar el desbridamiento quirúrgico de las colecciones existentes en la infección asociada a una fístula arteriovenosa nativa. Si hay afectación de la anastomosis o en los casos de tromboflebitis supurada o embolias sépticas se recomienda el cierre de la fístula arteriovenosa y la resección de la anastomosis
R 5.4.3) En los casos de infección parcial de la fístula arteriovenosa protésica se recomienda la exéresis quirúrgica del segmento afectado, además de antibioterapia adecuada. Cuando sea posible, se intentará mantener la permeabilidad del acceso vascular sustituyendo el segmento a través de un nuevo trayecto
R 5.4.4) Se recomienda la exéresis total de la fístula arteriovenosa protésica en las infecciones extensas o en los casos con afectación de las anastomosis, además de la administración de antibioterapia adecuada
La infección de una FAV se debe, normalmente, a una aplicación inadecuada de las técnicas asépticas para manejo del AV. Por ello es necesario reconsiderar todo el protocolo de actuación y realizar actividades de formación del personal sanitario en relación con las medidas higiénicas preventivas de la infección de los AV. El conocimiento de las actividades relacionadas con la higiene de las manos y con la desinfección de la piel antes de acceder a una FAV ha de ser reforzado.
La infección puede presentarse como una zona con dolor, calor y enrojecimiento o como un pequeño absceso o escara en la zona de punción. Ante la aparición de cualquier signo o síntoma que denote presencia de infección se pondrá en marcha el protocolo de control de infecciones.
Si la FAV se puede seguir utilizando habrá que tomar una serie de precauciones. Se debe aislar la zona de infección, para evitar la contaminación de la piel donde se va a realizar la punción, y alejar las punciones lo más posible de dicha zona. No se debe manipular la zona infectada o realizar curas durante la sesión de HD.Microbiología de las infecciones de la fístula arteriovenosa
Hay unanimidad en la bibliografía existente en considerar a los estafilococos como la causa más frecuente de infección asociada al AV. Se ha descrito una estrecha relación entre la higiene personal y la colonización nasal y/o cutánea por Staphylococcus aureus, y también una mayor incidencia de infecciones del AV en pacientes portadores nasales de S. aureus97,532. El segundo grupo en frecuencia corresponde a los bacilos gramnegativos, que son especialmente frecuentes en las infecciones de FAVp a nivel de extremidades inferiores, por lo que la cobertura antibiótica empírica ante casos de infección debería tener actividad frente a grampositivos y gramnegativos. Es importante conocer los datos de susceptibilidad local de los microorganismos para poder definir el tratamiento empírico adecuado en cada centro. Una vez aislado el microorganismo responsable se ajustará el tratamiento anti-biótico.Infección en la fístula arteriovenosa nativa
Las infecciones relacionadas con una FAVn son relativamente infrecuentes, siendo el tipo de AV con menor incidencia de dicha complicación. La clínica se corresponde a la de las infecciones de piel y partes blandas: dolor, eritema local, drenaje de material purulento o aparición de masas fluctuantes sobre el trayecto de la vena14,533.
El diagnóstico es esencialmente clínico y analítico, y su extensión es definida por la exploración física.
Estas infecciones habitualmente responden de forma adecuada al tratamiento antibiótico, que en presencia de fiebre y/o bacteriemia se debe iniciar de forma intravenosa. El tratamiento se mantendrá durante 6 semanas ajustado a la susceptibilidad de los microorganismos implicados.
La localización más frecuente es en el trayecto venoso debida a canulaciones previas, por lo que, además, debe suspenderse la canulación en la zona afectada.
Con el tratamiento médico adecuado, la gran mayoría de casos presenta una buena respuesta clínica, lo que permite habitualmente la conservación completa de la FAV.
En los casos en que la exploración física sea sugestiva de la presencia de colecciones líquidas, tras su confirmación ecográfica se deberá realizar una punción o drenaje quirúrgico de estas.
De forma infrecuente, la infección se puede localizar a nivel de la anastomosis arteriovenosa, en cuyo caso está indicado realizar la desconexión de la FAV, debido al alto riesgo de hemorragia a nivel de la anastomosis arteria-vena.
En los casos de trombo infectado y/o embolias sépticas, asimismo estará indicada la desconexión de la FAV.Infección en la fístula arteriovenosa protésica
La infección a nivel de las FAVp es de 2 a 3 veces más frecuente que en la FAVn, siendo asimismo más frecuente en las FAVp de la extremidad inferior. Factores de riesgo conocidos incluyen falta de higiene, presencia de diabetes mellitus, hipoalbuminemia, edad avanzada, dificultades de canulación, formación de hematomas periprótesis, hemorragias prolongadas posdiálisis y falta de esterilidad en la punción97. El cuadro clínico puede cursar con dolor local, exposición del injerto, aparición de un trayecto fistuloso con drenaje de material purulento o de una masa fluctuante sobre el trayecto protésico, eritema localizado o con una combinación de las anteriores, con o sin aparición de fiebre o septicemia14.
El diagnóstico es fundamentalmente clínico y se debe complementar con una ED del AV para descartar o delimitar la extensión de posibles colecciones periprotésicas. En los casos de duda diagnóstica o de infecciones subagudas o crónicas, estará indicada la realización de una gammagrafía con leucocitos marcados para detectar la presencia y extensión de la infección533.
La permeabilidad del AV no es condición necesaria para la infección protésica, de forma que puede producirse asimismo en FAVp antiguas no permeables; dicha posibilidad se debe descartar ante cualquier proceso de fiebre o sepsis en estos pacientes.
El tratamiento antibiótico se iniciará de forma empírica hasta la identificación del microorganismo causal, considerando la cobertura de los microorganismos más frecuentemente implicados (S. aureus, estafilococos coagulasa negativos y bacterias gramnegativas).
En el manejo del cuadro se debe priorizar en primer lugar la resolución completa del proceso infeccioso, pero a la vez hay que intentar, en los casos en que sea posible, preservar el AV. Es por ello que se debe realizar una prueba de imagen del FAVp, para poder determinar la presencia y extensión de colecciones líquidas y así delimitar la afectación de la infección533.
El único tratamiento resolutivo para el sector protésico infectado es su exéresis quirúrgica97,534. Sobre la base de ello se han descrito en la bibliografía varias posibilidades quirúrgicas:
- •
Exéresis total de la prótesis. Es la técnica clásica de tratamiento quirúrgico en la infección protésica. Se realiza una exéresis completa del injerto con cierre de la arteriotomía con parche de material autólogo. Implica colocación de CVC para la HD. Indicada en casos de afectación extensa de la prótesis. La zona anatómica no es utilizable en futuros AV.
- •
Exéresis subtotal de la prótesis. Técnica similar a la anterior. Se realiza una exéresis de la prótesis preservando los segmentos proximal y distal, que se ligan. Se practica para evitar la disección de los tejidos próximos a las anastomosis y la morbilidad que conlleva. Indicado en casos de infección extensa, pero con preservación del territorio perianastomótico. Implica colocación de un CVC para la HD533.
- •
Exéresis parcial de la prótesis. Indicada en casos de afectación segmentaria de la FAVp. Se realiza la resección de los segmentos infectados preservando los indemnes, y se sustituyen por otro segmento protésico situado en un nuevo trayecto a través de los tejidos. Puede evitar la colocación de un CVC. Se considera la técnica de elección en los casos en que sea técnicamente factible533,535–537.
- •
Exéresis y sustitución por injerto venoso criopreservado. Se realiza la exéresis total de la prótesis infectada con su sustitución por un injerto venoso criopreservado de donante cadáver. Técnica descrita por algunos autores con buenos resultados iniciales538; otras series publicadas han encontrado altas tasas de complicaciones graves en forma de infección, dilatación y rotura de la FAVp, por lo que desaconsejan su uso539.
- •
Exéresis de la prótesis con ligadura de arteria humeral. Indicada en casos de pacientes con compromiso del estado general, esta técnica ofrece la ventaja de eliminar gran parte de la morbilidad quirúrgica secundaria a la reparación arterial; realizando la ligadura distalmente a la salida de la arteria humeral profunda, los pacientes presentan una buena tolerancia a la isquemia540. Se considera como técnica de recurso.
La técnica de elección deberá decidirse de forma individualizada en cada paciente teniendo en cuenta el estado general, la extensión de la infección y la disponibilidad de AV alternativos. De forma general, en todos los casos será mandatoria la exéresis de todo el material infectado, intentado mantener la permeabilidad del AV mediante un nuevo trayecto y una nueva prótesis, sin poderse recomendar el uso de injertos criopreservados.
Como alternativa se ha propuesto el uso de prótesis con alta resistencia a la infección (prótesis biosintéticas de colágeno sobre matriz de Dacron) que, aunque en las primeras series publicadas, han presentado buenos resultados541,542, aún faltan estudios más amplios que puedan determinar su papel en el tratamiento de la infección protésica.
5.5Síndrome de hipoperfusión distal (“síndrome de robo”)Recomendaciones(•) NUEVA R 5.5.1) En el síndrome de hipoperfusión distal se recomienda el estudio angiográfico completo y mediante ecografía Doppler previos para plantear la intervención sobre la fístula arteriovenosa
(•) NUEVA R 5.5.2) Se sugiere indicar tratamiento quirúrgico/ endovascular en caso de síndrome de hipoperfusión distal con sintomatología invalidante o con pérdida tisular (estadios IIb-III-IV)
(•) NUEVA R 5.5.3) Ante la presencia de un síndrome de hipoperfusión distal se recomienda priorizar las técnicas que preserven la fístula arteriovenosa a su ligadura
(•) NUEVA R 5.5.4) Ante la presencia de estenosis arteriales significativas en el inflow proximal se sugiere su tratamiento mediante angioplastia transluminal percutánea
(•) NUEVA R 5.5.5) Para la elección de la técnica quirúrgica se sugiere tener en cuenta las características de cada paciente, el estadio de síndrome de hipoperfusión distal, la localización de la anastomosis arterial y el nivel de flujo sanguíneo de la fístula arteriovenosa
(•) NUEVA R 5.5.6) En caso de realizarse la técnica de banding se sugiere realizarla asociada al control intraoperatorio del flujo sanguíneo de la fístula arteriovenosa y se desaconseja su uso de forma aislada
Una de las complicaciones potencialmente más graves, pero afortunadamente poco frecuente, es el desarrollo de un cuadro de isquemia en el territorio distal de la extremidad tras la realización de la FAV. Su incidencia varía entre un 1 y un 20% de todas las FAV en las extremidades superiores85,87b; se presenta con mayor frecuencia en las FAVn a nivel del brazo (10-25%) y su incidencia en las FAVp (4-6%) es menor, y muy poco frecuente en las FAVn localizadas en el antebrazo (1-2%)87.Fisiopatología87b,88,543
Tras la realización de la FAV, la presencia de una comunicación entre los circuitos arterial y venoso provoca un shunt de flujo hacia este último, de mucha menor resistencia periférica, en detrimento del lecho vascular distal de la extremidad. Esto produce de forma efectiva un fenómeno de “robo” de gran parte del flujo procedente de la arteria braquial hacia el sector venoso de la FAV. Este es el motivo por el que se conoce el cuadro de isquemia de la extremidad como “síndrome de robo de la FAV”.
Dicho cortocircuito entre circulación arterial y venosa provoca una respuesta fisiológica en el organismo en forma de mecanismos compensatorios para mantener la perfusión tisular en el territorio distal de la extremidad, por lo que en la gran mayoría de pacientes no se llega a manifestar isquemia en dicho territorio. Únicamente en los casos en los que, debido a condicionantes previos del paciente, se encuentran alterados los mecanismos de compensación es cuando se llega a presentar la clínica de isquemia.
Estos mecanismos consisten, en primer lugar, en un aumento del calibre e hipertrofia en la arteria aferente del acceso, que permite el aumento en el flujo arterial necesario para el correcto desarrollo de la FAV; en segundo lugar, se produce un desarrollo de la circulación a través de colaterales, sobre todo a expensas de la arteria humeral profunda en las fístulas de brazo y de la arteria cubital y arco palmar en las fístulas de antebrazo; por último, en respuesta a la isquemia se produce una vasodilatación generalizada en el lecho vascular distal a la FAV, que provoca una disminución en las resistencias de dicho territorio y un aumento en la perfusión.
Así pues, en el desarrollo del SHD, además del fenómeno de “robo” hemodinámico, es habitual la presencia de otros factores que predisponen a su aparición, como es la presencia de estenosis u oclusiones en el territorio arterial proximal o una incapacidad en la adaptación del lecho vascular distal a la nueva situación hemodinámica creada. Es por ello por lo que la mayoría de autores, así como las guías clínicas, prefieren el uso del término “síndrome de hipoperfusión distal” al de “robo de fístula” para referirse a este cuadro 10,14,87,87b,88,543.Factores de riesgo
Se consideran factores de riesgo de desarrollar isquemia la diabetes mellitus, el uso de la arteria humeral, la presencia de arteriopatía periférica, la edad avanzada, el tabaquismo, el sexo femenino, la presencia de AV previos fallidos en la misma extremidad y el antecedente de haber desarrollado SHD en la extremidad contralateral88,92,544,545.
En cambio, no hay unanimidad entre los autores con respecto al diámetro de la anastomosis como factor de riesgo aislado87b, ya que si bien en FAV de pequeño tamaño parece haber una relación directa entre el diámetro de la anastomosis y el flujo, a partir de un determinado diámetro (75% de la arteria dadora) dicha relación desaparece544.Presentación clínica87b,545
La sintomatología se puede instaurar de forma aguda (tras la intervención), de forma subaguda (en los primeros días) o de forma crónica (a partir del mes tras realizarse la FAV). La forma aguda, poco frecuente, suele estar en relación con FAVp mientras que la crónica suele ser progresiva en el tiempo y relacionarse con FAVn a nivel de arteria braquial546. La clínica es superponible a la que se desarrolla en otros territorios con isquemia, con dolor, parestesias, parálisis, pérdida de pulso distal, frialdad y palidez545. En los casos con afectación más grave, puede llevar a la necrosis y a la pérdidatisular irreversible.
En la práctica clínica se determina la gravedad del cuadro según la clasificación análoga propuesta por Fontaine et al547 para la isquemia crónica en las extremidades inferiores87,87b,548,549(tabla 24).Diagnóstico
Clasificación clínica del síndrome de hipoperfusión distal87b
| Grado I | Palidez y/o frialdad de la mano sin presencia de dolor ni alteraciones motoras ni sensitivas |
| Grado IIa | Dolor tolerable durante el ejercicio y/o HD |
| Grado IIb | Dolor intolerable durante el ejercicio y/o HD |
| Grado III | Presencia de dolor en reposo o déficit motor |
| Grado IVa | Pérdida tisular limitada |
| Grado IVb | Pérdida tisular importante que afecta irreversiblemente la funcionalidad de la mano |
HD: hemodiálisis.
El diagnóstico del cuadro se basa en la anamnesis (antecedente de realización de un AV) y en la presencia de la sintomatología referida previamente.
Pese a que el diagnóstico del SHD es esencialmente clínico, es posible su confirmación mediante pruebas de laboratorio vascular. De todas las pruebas propuestas, la que ha demostrado más utilidad en la práctica es el índice de presión digital (IPD), consistente en la medición de la ratio entre la presión digital de una extremidad y la braquial contralateral550. Otras pruebas útiles en la práctica son el cálculo del índice de presión sistólica entre ambas extremidades, la fotopletismografía y la saturación de oxígeno87,87b,551.Diagnóstico diferencial. Neuropatía isquémica monomiélica
La sintomatología, junto con el antecedente de la realización del acceso, habitualmente no suele ofrecer dudas diagnósticas, planteándose el diagnóstico diferencial con pocas entidades: síndrome del túnel carpiano, lesión nerviosa asociada a la cirugía y artropatías destructivas, casos en los que una detallada anamnesis y exploración junto con la realización de un electromiograma suelen permitir el diagnóstico87,87b.
De especial trascendencia es el diagnóstico diferencial con la entidad conocida como neuropatía isquémica monomiélica (NIM). La NIM se presenta en relación con la intervención de creación del AV de forma aguda tras la cirugía, y es una patología exclusiva de pacientes diabéticos y de accesos a nivel de la arteria braquial87b.
Este cuadro se considera relacionado con una afectación isquémica selectiva del tejido nervioso a nivel de la fosa antecubital y, de forma global, afecta a los tres principales troncos nerviosos del antebrazo (nervios radial, cubital y mediano). La presentación clínica se produce inmediatamente tras la cirugía en forma de dolor refractario y déficit motor coincidiendo con una exploración física sin signos de isquemia y con pruebas de laboratorio que descartan la isquemia significativa. En caso de duda diagnóstica, la electromiografía demostrará de forma típica la afectación conjunta de los tres nervios mencionados552.
El principal riesgo del cuadro radica en el déficit sensitivo y motor irreversible que puede provocar; por ello, en estos casos está indicada la ligadura de la FAV de forma inmediata para minimizar tales secuelas87b,552.Prevención del síndrome de hipoperfusión distal
Una vez se ha desarrollado el cuadro de isquemia, pese a un correcto manejo médico y quirúrgico, existe un alto riesgo de pérdida del acceso; es por ello que la actitud idónea debería encaminarse a detectar los casos que tienen un alto riesgo de isquemia, para así poder realizar un AV con bajo riesgo de SHD.
En primer lugar, la posibilidad de presentar dicho cuadro está en relación con el número de factores de riesgo de isquemia presentes en el paciente88,546, por lo que algunos autores consideran la presencia de dos o más de dichos factores para identificar a los pacientes de alto riesgo de SHD87b.
Una correcta evaluación preoperatoria también debe servir para identificar a este grupo de pacientes. Dicha evaluación ha de incluir la determinación de la presión arterial sistólica en ambas extremidades, la palpación de los pulsos periféricos y la realización de un test de Allen. La presencia de diferencias tensionales > 20mmHg entre ambas extremidades, la falta de pulsos periféricos o un test de Allen patológico son signos de alto riesgo de presentar isquemia tras la realización del AV87b. Por último, la presencia de alteraciones en las pruebas hemodinámicas en la evaluación preoperatoria también es sugestiva de alto riesgo de isquemia, en especial las alteraciones en el IPD y en el test de hiperemia reactiva60,87b,553,554. Si bien hay coincidencia entre los autores para detectar a los pacientes en riesgo de desarrollar isquemia tras la realización del AV, hay escasa bibliografía publicada sobre la actitud a seguir en estos casos. Así pues, ante un paciente concreto no es posible determinar si presentará SHD87b,88. Asimismo, el progresivo aumento en la edad del paciente en HD conlleva la presencia de múltiples factores de riesgo de isquemia en la mayoría de pacientes candidatos a FAV555.
Pese a ello, la trascendencia clínica del SHD hace que, tras identificar al paciente en riesgo, sea necesario adoptar todas las medidas encaminadas a minimizar la posibilidad de presentar isquemia en la extremidad87b,88,113(v. apartado 1).
Así pues, ante la presencia de un paciente con alto riesgo de isquemia hay autores que recomiendan el uso de la arteria radial proximal (ARP) para las FAV realizadas en el antebrazo, dada la menor incidencia de SHD de dicho procedimiento87b,113. El uso de la ARP para las FAV a nivel de fosa antecubital ha demostrado ser una técnica segura sin morbilidad añadida, que presenta un menor riesgo de isquemia113,119, con menor complejidad técnica que las otras técnicas descritas, por lo que se considera de elección para la prevención del SHD en los casos en que es técnicamente factible87b.Objetivo del tratamiento
Hay coincidencia general en señalar que el objetivo del tratamiento debe ser doble: aliviar la isquemia y preservar el acceso. Se revisan las diferentes técnicas quirúrgicas orientadas a su tratamiento.
→ Pregunta clínica XXI ¿Cuál es el abordaje de la fístula arteriovenosa nativa o de la protésica diagnosticadas de síndrome de robo?
(Ver ficha de la Pregunta clínica XXI en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| La evidencia disponible proviene de opiniones de expertos basadas en su experiencia y en series clínicas, que señalan que la elección del tratamiento quirúrgico debe basarse en las características de cada paciente, su estado clínico y pronóstico, el estadio de la enfermedad, la localización de la anastomosis arterial y el nivel de QA dentro del AV | Calidad baja |
Tal y como se ha comentado, el SHD representa una complicación potencialmente grave tras la creación del AV. De ello se deriva la trascendencia de una detección precoz de la sintomatología y la necesidad de actuar de forma adecuada para evitar la aparición de lesiones irreversibles. Asimismo, dada la creciente evidencia disponible sobre técnicas quirúrgicas con repercusión hemodinámica que consiguen la preservación del acceso, hoy en día se debe considerar que el objetivo del tratamiento es doble: mejorar la isquemia y preservar el AV87b,88,543,545,549.
El manejo del cuadro debe ser adecuado al estadio clínico y a la gravedad de los síntomas, por lo que en casos leves (estadios I y IIa), en los que la intensidad de la sintomatología no incapacita al paciente ni representa un riesgo para la viabilidad de la extremidad, estará indicado instaurar tratamiento médico (pentoxifilina, naftidrofurilo, cilostazol, etc.), medidas físicas (protección y abrigo de la extremidad) y control evolutivo de la clínica. En los casos en los que la sintomatología sea incapacitante o haya riesgo de pérdida tisular (estadios IIb-IVa) estará indicada la intervención quirúrgica para solucionar la isquemia. Finalmente, en los casos de extensa necrosis irreversible (estadio IVb) o cuando la presentación sea en forma aguda, el tratamiento de elección debe ser el cierre del AV de forma prioritaria87b,88,545,549 (tabla 25).
Una vez identificado el cuadro, cuando el estadio clínico implique el tratamiento quirúrgico, debe realizarse de forma rutinaria un estudio mediante ED del AV y un estudio angiográfico de la vascularización de la extremidad.
La angiografía debe realizarse en todos los casos en que se plantee el tratamiento quirúrgico y es esencial la visualización de los troncos arteriales proximales desde su porción torácica, ya que hasta en el 50% de los pacientes con SHD pueden tener asociadas lesiones significativas en el inflow del AV543,556.
Asimismo, es necesario el estudio con ED del acceso, ya que proporcionará información esencial sobre el QA de la FAV, necesaria para poder indicar el procedimiento a realizar87b.
Tras el estudio individualizado de cada caso, estará indicada su corrección quirúrgica, habiéndose descrito varias técnicas en la bibliografía87b,545.Cierre del acceso
Se trata de la desconexión quirúrgica de la FAV creada con el objetivo de revertir la situación hemodinámica y la desaparición de la clínica isquémica. Dado que no cumple con el objetivo de preservar el acceso, se trata de una técnica de recurso, indicada únicamente en caso de fracaso de las demás técnicas, en casos de alto riesgo quirúrgico, ante la presencia de una isquemia de presentación aguda, de una NIM o bien ante la existencia de lesiones con importante pérdida tisular asociada87b,549,552(tabla 26).Tratamiento endovascular. Angioplastia transluminal percutánea
Ante la presencia de una estenosis en el inflow arterial significativa que se asocie a un SHD estará indicado su tratamiento en forma de ATP, con o sin colocación de stent, que puede realizarse en el mismo acto diagnóstico. Se trata de una técnica segura con una alta tasa de éxito inmediato y de éxito clínico, con resolución de la sintomatología, estando indicada en los casos de lesiones arteriales en la arteria nutricia359,556.Banding
La técnica de banding consiste en la restricción del flujo en la FAV mediante la limitación del diámetro en la anastomosis o en el segmento de vena yuxtaanastomótico. Existen múltiples técnicas descritas, pudiéndose realizar mediante una ligadura de material no reabsorbible, mediante una plicatura quirúrgica en la vena de salida, interponiendo un segmento de material protésico (PTFE, Dacron) o bien colocando una banda externa de dicho material protésico545,549. El objetivo del banding es limitar el QA a través del acceso, mejorando la perfusión del territorio distal, por lo que está indicado exclusivamente en las FAV con alto QA, y, en especial, recomendado en los casos de FAV con muy alto débito que requieren de una importante reducción de su QA88.
La principal limitación de esta técnica radica en poder determinar el grado de limitación del QA que se debe efectuar para mejorar la sintomatología de isquemia sin poner en peligro la viabilidad del acceso. Por ello se han propuesto varios métodos de monitorización intraoperatoria para servir de guía durante la intervención quirúrgica: monitorización mediante fotopletismografía, control del QA en la FAV, control clínico —recuperación del pulso radial—, determinación de la curva Doppler en la arteria radial, monitorización mediante pulsioxiometría o bien mediante la mejoría en la sintomatología del paciente87b,545. Asimismo, sus resultados a medio y largo plazo son controvertidos, y se han llegado a describir tasas de recurrencia del alto QA del 52% al año557.
El banding es la primera técnica descrita de tratamiento del SHD, por lo que está ampliamente documentada en la bibliografía; la mejor evidencia disponible procede de la revisión publicada por Scheltinga et al558, realizada en 39 series clínicas correspondientes a un total de 226 casos. Este autor encuentra diferencias significativas entre las 16 series en las que no se realizó monitorización intraoperatoria o solo de control del pulso radial, con una tasa de éxito clínico (recuperación de los síntomas isquémicos) del 60% y de permeabilidad del acceso del 53% con respecto a las series en las que se usó alguno de los métodos de monitorización descritos, entre las que hubo una tasa de éxito clínico del 89% y una tasa de permeabilidad del AV, tras un seguimiento medio de 17 meses, del 97%.
Con respecto al QA que se debe marcar como objetivo al realizar el banding, difiere discretamente según los autores, recomendándose de forma generalizada un valor de 400-600ml/min en FAVn y de 700-800ml/min en FAVp, existiendo un incremento en el riesgo de trombosis en FAVp con débitos < 700ml/min87b,545,559.Ligadura del intervalo con revascularización distal
Descrita en primer lugar por Schanzer et al en 1988560, el acrónimo DRIL (ligadura del intervalo con revascularización distal) hace referencia al procedimiento quirúrgico consistente en dos técnicas combinadas:
- •
Revascularización distal (distal revascularization [DR]): interposición de un bypass desde la arteria proximal a la distal al AV, con el objetivo de asegurar la perfusión del territorio distal.
- •
Ligadura del intervalo (interval ligation [IL]): ligadura de la arteria distal a la anastomosis AV, con el fin de evitar el fenómeno de robo hemodinámico (flujo retrógrado en la arteria distal a la FAV).
De esta forma, el efecto global que se intenta conseguir es evitar el fenómeno de robo del acceso a la vez que se favorece la perfusión distal de la extremidad mediante un bypass de menor resistencia periférica que el circuito arterial original.
Desde que se describió esta técnica se ha utilizado por gran número de grupos, y se han descrito buenos resultados en el tratamiento del SHD561.
Revisiones de las series de casos publicadas87b,561 ofrecen una tasa de éxito clínico del 78-90% (desaparición de la clínica de isquemia), manteniendo una permeabilidad del AV del 73-100%549.
El principal inconveniente de esta técnica viene dado, en primer lugar, por el hecho de que requiere la ligadura de una arteria axial, por lo que, pese a las excelentes tasas de permeabilidad publicadas87b, en caso de oclusión se puede producir un cuadro de isquemia incluso más grave que el previo. Y en segundo lugar, el hallazgo en algunos estudios de que el grado de mejoría clínica es dependiente del QA; es menos efectiva cuanto mayor es el QA del AV562. Es por ello por lo que su principal indicación se considera en el tratamiento del SHD en FAV de QA normal o disminuido87b.Variantes técnicas
Para minimizar el riesgo de la ligadura en la arteria axial, varios autores han propuesto la realización del procedimiento sin efectuar la ligadura del intervalo, es decir, realizar únicamente la DR563, mientras que para aumentar la perfusión distal y la efectividad de la técnica se ha propuesto realizar la anastomosis proximal del bypass en el sector arterial más proximal posible, aumentando la separación entre dicha anastomosis y la FAV87b,562.
Estas variantes técnicas están basadas en los hallazgos de modelos teóricos y experimentales562,564; no obstante, es necesaria la confirmación de su utilidad clínica en estudios con el suficiente grado de evidencia de cara a poder recomendar su uso sistemático.Proximalización del inflow arterial
En esta técnica (proximalization of the arterial inflow, PAI), descrita inicialmente por Zanow et al565, se realiza la ligadura de la FAV a nivel de la anastomosis y se vasculariza dicha FAV mediante un bypass de material protésico entre la arteria axilar o humeral proximal y la vena de salida de la FAV. Se aplica a accesos localizados en el brazo, consiguiendo mejorar la isquemia mediante una combinación de varios mecanismos hemodinámicos: en primer lugar, al usar como arteria nutricia un vaso proximal disminuye el descenso de presión en el lecho distal provocado por el acceso; en segundo lugar, se minimiza o se suprime por completo el flujo retrógrado en la arteria distal a la FAV (robo hemodinámico) y, en tercer lugar, al implantar un injerto protésico de reducido calibre (4-5mm) se consigue un efecto limitador del flujo, como el descrito en el banding562,566.
Al tratarse de una técnica relativamente reciente, se dispone de escasa evidencia en cuanto a sus resultados clínicos566. Hay únicamente dos series publicadas en la bibliografía con un total de 70 casos, que han descrito un éxito clínico (desaparición de la sintomatología de isquemia) en el 84-90% de los casos, con una permeabilidad primaria del 62-87% a los 2 años565,567.
Las principales ventajas de la PAI residen en que, como es una técnica que provoca un aumento en el flujo del acceso, puede realizarse en FAV con flujo disminuido y de SHD; asimismo representa la ventaja con respecto a la técnica DRIL de que no requiere ligadura de una arteria axial, con lo que no se provoca isquemia en los casos de oclusión del procedimiento. Sin embargo, el inconveniente reside en el hecho de que transforma una FAVn en una FAVp, con el aumento de complicaciones infecciosas y de trombosis que representa, y en la escasa evidencia de que se dispone en la actualidad sobre sus resultados87b,545,562,566.Revisión usando el inflow distal
Técnica inicialmente descrita por Andrade et al568 y por Minion et al569 (revision using distal inflow [RUDI]). Esta técnica consiste en la desconexión quirúrgica de la anastomosis AV procediendo seguidamente a su distalización mediante un bypass retrógrado —protésico o autólogo— desde un tronco arterial distal (arterias radial o cubital) a la vena de salida de la FAV.
Al usarse una arteria de menor calibre para el inflow del AV se consigue una reducción en el flujo de la FAV, por lo que está indicada en los SHD asociados a FAV de alto débito87b,557.
Al ser una técnica relativamente reciente, la evidencia disponible se fundamenta en series de casos; en la revisión publicada por Vaes se identifican tan solo 51 casos publicados hasta la fecha, habiéndose conseguido una mejoría de la sintomatología en todos ellos, con una tasa de trombosis del acceso del 20%570. Dichos autores, asimismo, describen en su serie una reducción del flujo del 60% en el acceso, junto con la potencial ventaja con respecto al banding de ser una técnica más duradera en el tiempo, debido a que no existe la tendencia que se produce en el banding del progresivo aumento del flujo en la FAV tras la intervención570.Ligadura de la arteria radial distal
Cuando el cuadro de SHD está provocado por una FAV a nivel de muñeca, es frecuente su asociación a una hipertrofia del arco palmar con flujo invertido a nivel de la arteria radial distal a la anastomosis AV571. En estos casos, tras haberse comprobado la permeabilidad del arco palmar y el flujo retrógrado en la arteria radial distal mediante angiografía y ED, la desconexión de dicha arteria radial distalmente a la FAV puede resolver el cuadro de isquemia (distal radial arteria ligation [DRAL])87b,88,549.
Dicha desconexión puede efectuarse de forma endovascular, mediante la colocación de coils o bien mediante una intervención quirúrgica mínimamente invasiva.
Esta técnica se limita a los casos poco frecuentes SHD asociados a FAV radiocefálicas y se considera una variante técnica de la DRIL, en la que la vascularización distal depende de la arteria cubital junto al arco palmar; es por ello la escasa evidencia acumulada en la bibliografía87b. Miller et al571 describen una serie de casos (15 pacientes) en los que se demuestra como una técnica segura que consigue la mejoría clínica en gran parte de estos pacientes.Banding endovascular
Técnica descrita por Beathard et al518 y Goel et al572, que consiste en realizar un banding de forma mínimamente invasiva (Minimally Invasive Limited Ligation Endoluminal-assisted Revision [MILLER]), mediante la introducción percutánea de un balón de angioplastia en la anastomosis AV (balón de 3 a 5mm de diámetro), procediendo a su inflado para posteriormente, mediante una incisión cutánea, realizar un banding manteniendo el balón inflado dentro del vaso573.
Desde el punto de vista técnico y hemodinámico se trata de una variante de la técnica de banding descrita, que aporta una menor agresividad quirúrgica y una mayor precisión en determinar el diámetro de la luz residual, mientras que su principal inconveniente reside en que la monitorización de la técnica se realiza en función de parámetros morfológicos (diámetro residual del vaso) más que hemodinámicos (QA a nivel de la FAV)87b.
La evidencia disponible se remite a dos series de casos publicadas572,573, con una tasa de éxito clínico inmediato del 89% y de permeabilidad primaria del 75% a los 6 meses, con una permeabilidad secundaria del acceso del 77% a los 36 meses573.Ligadura de la arteria radial proximal
Bourquelot et al574 describen esta técnica que consiste en la ligadura de la ARP (proximal radial artery ligation [PRAL]) adyacente a la anastomosis, como método para reducir el QA en las FAV radiocefálicas con SHD con alto débito. Mediante este procedimiento, se reduce significativamente el flujo en el acceso manteniendo la vascularización de la mano y de la FAV sobre la base de la arteria cubital vía arco palmar y por colaterales de la arteria interósea.
Planteado inicialmente como tratamiento para los casos de hiperaflujo en FAV radiocefálicas, el autor describe resolución del cuadro isquémico cuando este estaba asociado574. No se dispone de ulterior evidencia publicada con esta técnica.Manejo terapéutico del síndrome de hipoperfusión distal
Dada la profusión de técnicas descritas de tratamiento en el SHD, la mayor parte de ellas de carácter reconstructor (manteniendo la permeabilidad del AV), varios autores han publicado propuestas sobre la decisión terapéutica de elección en el tratamiento de la isquemia, en función de las características particulares que cada técnica presenta87b,88,543,545,549,556,566. Ante el diagnóstico de SHD, tal como se ha comentado previamente, se debe establecer el grado de gravedad del cuadro, y los estadios I-IIa son susceptibles de tratamiento médico y seguimiento evolutivo; por contra, los estadios IIb-IV son tributarios de estudio diagnóstico y de plantear su correcciónquirúrgica.
Es opinión unánime de los autores indicar la reconstrucción del acceso de forma preferente a la desconexión de este, salvo en los casos comentados previamente87b,88,549,566 (tabla 26).
Así pues, en los estadios IIb-IV se debe efectuar un estudio diagnóstico de cara a plantear la mejor opción terapéutica; dicho estudio debe comprender de forma necesaria una valoración angiográfica de la vascularización de la extremidad y un estudio mediante ED del AV87b,545.
La arteriografía es necesaria para poder descartar la presencia de patología estenosante u oclusiva en cualquier sector del árbol vascular, y debe comprender la valoración tanto del sector proximal (tronco braquicefálico, arterias subclavia, axilar y braquial) como del distal, con compresión de la FAV, para permitir la evaluación de los troncos distales y la permeabilidad y desarrollo del arco palmar87b,543,556. Asimismo, la precisa topografía del árbol vascular se considera necesaria para plantear cualquier tipo de cirugía reconstructiva del AV545.
La exploración con ED, además de ofrecer una valoración hemodinámica del acceso (inversión de flujo en arteria distal, presencia de aceleraciones, cálculo de índices de resistencia, diámetro de la anastomosis), debe incluir el cálculo del QA a nivel del AV, dato imprescindible para poder plantear el tratamiento adecuado en cada caso87b,88.Patología arterial
En el caso en el que se diagnostique la presencia de lesiones arteriales significativas en el segmento proximal a la FAV, los autores concuerdan en recomendar su tratamiento percutáneo, habitualmente durante el mismo procedimiento diagnóstico87b,543,545,556. Se ha descrito la resolución del cuadro isquémico en la mayoría de pacientes tratados con este tipo de lesiones556,575.Síndrome de hipoperfusión distal en el acceso vascular de alto flujo
La presencia de un SHD asociado a un AV de alto QA (> 800ml/min en FAVn y > 1.000ml/min en FAVp) traduce la presencia predominante de un fenómeno de robo hemodinámico, debido al cortocircuito provocado al conectar el sistema arterial de alta presión y alta resistencia al sistema venoso, de baja resistencia periférica. En estos casos, la propuesta lógica está en relación con proponer una técnica cuyo efecto sea la disminución del débito del AV, opción propuesta por la mayoría de autores87b,543,549,558,559.
Así pues, las técnicas que se postulan para el tratamiento del SHD en estos pacientes son el banding con monitorización de flujo, el banding endovascular (MILLER) y la revascularización usando el inflow distal (revision using distal inflow [RUDI]). Las tres han demostrado ser técnicas seguras, con un elevado porcentaje de éxito técnico y clínico87b,545, sin existir actualmente publicaciones que determinen diferencias entre sí con respecto a su efectividad, por lo que las recomendaciones de los distintos autores se basan eminentemente en la experiencia personal. No obstante, se ha sugerido la mayor efectividad en la reducción del QA del AV del banding con monitorización en los casos de FAV de muy alto débito, gracias al control intraoperatorio de la técnica, por lo que estaría especialmente recomendado en estos casos87b.Síndrome de hipoperfusión distal en el acceso vascular de bajo flujo
La fisiopatología de los casos de isquemia asociados a accesos de medio y bajo QA (< 800ml/min en FAVn y < 1.000ml/m en FAVp) no se considera en relación directa con el cortocircuito vascular existente, sino que depende primordialmente de un fallo en los procesos compensatorios fisiológicos que mantienen la perfusión tisular distal en este tipo de pacientes87b,88. Es por ello que el principal objetivo en estos casos no es la reducción efectiva del débito del acceso, sino la mejoría en la presión de perfusión en el lecho vascular distal.
Las técnicas propuestas a tal fin son la PAI y la revascularización distal, con DRIL o bien sin ligadura del intervalo arterial (DR).
En este caso, en la bibliografía tampoco hay series publicadas que comparen la efectividad de estas técnicas, por lo que la evidencia disponible se basa en series de casos y en opinión de expertos.
La técnica más ampliamente extendida, el DRIL, ha demostrado ser una técnica segura con buenos resultados87,561, además de ser la técnica que en modelos experimentales proporciona un mayor aumento en la presión de perfusión en el territorio distal564. Tiene como principal inconveniente, en primer lugar, la necesidad de disponer de material autólogo para la revascularización y, en segundo lugar, el hecho de realizar una desconexión sobre una arteria axial. Es por ello que algunos autores han planteado la posibilidad de no efectuar la ligadura del intervalo si se proximaliza la anastomosis del bypass87b.
Asimismo, la PAI es una técnica segura con buenos resultados y es la opción recomendada por varios autores87b,565, ya que no requiere la ligadura de la arteria. No obstante, presenta el inconveniente de la introducción de material protésico en una FAVn.Pese a todo lo mencionado anteriormente, el nivel actual de evidencia sobre estas técnicas hace necesaria la realización de ulteriores estudios que ayuden a definir su idoneidad en la práctica clínica.Síndrome de hipoperfusión distal en los accesos distales
La presentación de un SHD en los accesos distales (antebrazo y muñeca) es poco frecuente87b,545 debido, en primer lugar, a que el menor diámetro de la arteria radial predispone en menor medida a desarrollar un alto QA en el AV mientras que, en segundo lugar, las arterias cubital e interósea representan una excelente colateralidad que compensa el fenómeno de robo en estos pacientes. Debido a su baja incidencia es necesario hacer especial énfasis en su diagnóstico diferencial, de cara a descartar la presencia de otra patología, en especial de causa neurológica (síndrome de túnel carpiano, neuropatías posquirúrgicas). Asimismo, el grado de afectación de la isquemia suele ser leve en la mayoría de casos, por lo que en escasas ocasiones se requiere tratamiento específico545.
Las técnicas descritas de tratamiento son esencialmente dos: la ligadura de la arteria radial distal (distal radial artery ligation [DRAL]) y la PRAL. En ambas, la evidencia disponible a nivel de la bibliografía es escasa. La mejor evidencia disponible en el caso de la técnica DRAL es la serie de quince casos publicada por Miller et al571, donde se describe una tasa de éxito clínico a los 9 meses del 87%, sin haberse producido la pérdida del acceso en ningún caso. En el caso del PRAL, la mejor evidencia proviene de Bourquelot et al574 y consiste en una serie de casos en la que solo en dos de ellos se realiza la técnica a causa de un cuadro de SHD; su principal indicación es la existencia de un síndrome de hiperaflujo.De la evidencia a la recomendación
El SHD es un cuadro de etiología multifactorial y de compleja hemodinámica, cuyo factor desencadenante es la realización de una FAV a nivel de la extremidad, con el consiguiente cortocircuito entre sistemas arterial y venoso. Si bien se detecta flujo invertido en la arteria distal en la mayoría de pacientes portadores de FAV, solo en algunos casos se llega a desarrollar un cuadro de isquemia clínicamente relevante.Manejo terapéutico del síndrome de hipoperfusión distal
Ante el desarrollo de SHD, no hay diferencias entre los autores con respecto a la recomendación de tratamiento quirúrgico/intervencionista en los casos de isquemia grave, con sintomatología invalidante o que pone en riesgo la viabilidad tisular, opinión basada en la buena práctica clínica. Asimismo, también es opinión generalizada la indicación de tratamiento conservador y control evolutivo en los casos con sintomatología leve no invalidante, dado que en la mayoría de estos pacientes con clínica leve tras la realización del acceso, el cuadro mejora de forma progresiva, con tendencia a la resolución de forma espontánea87b.
La indicación de la técnica de elección en cada caso debe estar condicionada en función de la gravedad del cuadro, del QA del AV, de las características anatómicas y de la localización del AV. Varias de estas técnicas están documentadas como técnicas seguras con baja morbilidad, por lo que actualmente la buena práctica clínica recomienda la reconstrucción del acceso de forma prioritaria a la ligadura de este, técnica restringida a los casos antes indicados (fig. 6).
De entre las técnicas quirúrgicas en la reconstrucción del acceso, tal y como se ha comentado, la evidencia disponible se basa en series de casos y en opinión de expertos, sin haber estudios que comparen las distintas técnicas entre sí.Patología arterial
Basándose en la experiencia de series de casos, la mayoría de autores recomienda, en primer lugar, la valoración angiográfica del árbol arterial y el tratamiento percutáneo de las estenosis significativas presentes. Se ha decidido adoptar dicha recomendación dada la evidencia clínica de mejoría del cuadro isquémico tras la ATP de las estenosis significativas, su mínima invasividad, la alta tasa de éxito técnico y la ausencia de evidencia sobre la cirugía en el tratamiento de este cuadro.Síndrome de hipoperfusión distal en la fístula arteriovenosa de alto flujo
En la FAV de alto QA, la opinión de la mayoría de autores recomienda la realización de una técnica que tenga un efecto prioritario en disminuir el débito de la FAV. Así pues, son técnicas de elección el banding con monitorización de flujo, el MILLER y la RUDI. Siendo el banding quirúrgico (con monitorización de QA) la técnica más ampliamente documentada, no hay actualmente estudios que comparen entre dichas técnicas, por lo que no se puede emitir una recomendación sobre la base de la evidencia disponible acerca de cuál debe ser la técnica de elección.
Cuando se realice la técnica de banding, el GEMAV sí considera que la evidencia disponible desaconseja su uso de forma aislada (sin monitorización del QA), a causa de la baja permeabilidad del AV que presenta con respecto a las otras técnicas, recomendando realizar siempre dicha intervención asociada a un sistema de vigilancia intraoperatoria del QA del AV.Síndrome de hipoperfusión distal en la fístula arteriovenosa de bajo flujo
Cuando el SHD se presenta en un AV con flujo normal o bajo, el objetivo de su tratamiento ha de ser el de aumentar la presión de perfusión distal. De entre las técnicas descritas (DRIL, PAI y DR), el DRIL es la técnica que dispone de mayor grado de evidencia, consistente en series de casos publicadas, y se ha demostrado como una técnica segura con un elevado índice de éxito clínico y de permeabilidad del AV. Los resultados de la técnica PAI se presentan similares al DRIL pese a que existe menor número de series publicadas, mientras que la técnica de la DR tiene hasta la fecha escasa presencia en la bibliografía. Ante la falta de evidencia de series que comparen resultados entre dichos procedimientos, el grupo de trabajo considera que, si bien existe suficiente evidencia que justifica el uso de ambas técnicas (DRIL y PAI), actualmente no se puede efectuar una firme recomendación sobre la técnica de elección en estos casos; para ello son necesarios ulteriores estudios.Síndrome de hipoperfusión distal en los accesos distales
Como se ha comentado previamente, el desarrollo de un SHD en estos casos es una entidad muy poco frecuente que en la mayoría de casos tiene una presentación de leve intensidad. Es por ello que la evidencia disponible no permite realizar recomendación alguna sobre la técnica de elección para corregir el cuadro, si bien dentro de la escasa bibliografía existente, la técnica del DRAL es la más documentada, con buenos resultados en cuanto a su seguridad, éxito clínico y permeabilidad del AV.
R 5.5.1) En el síndrome de hipoperfusión distal se recomienda el estudio angiográfico completo y mediante ecografía Doppler previos para plantear la intervención sobre la fístula arteriovenosa
R 5.5.2) Se sugiere indicar tratamiento quirúrgico/endovascular en caso de síndrome de hipoperfusión distal con sintomatología invalidante o con pérdida tisular (estadios IIb-III-IV)
R 5.5.3) Ante la presencia de un síndrome de hipoperfusión distal se recomienda priorizar las técnicas que preserven la fístula arteriovenosa a su ligadura
R 5.5.4) Ante la presencia de estenosis arteriales significativas en el inflow proximal se sugiere su tratamiento mediante angioplastia transluminal percutánea
R 5.5.5) Para la elección de la técnica quirúrgica se sugiere tener en cuenta las características de cada paciente, el estadio de síndrome de hipoperfusión distal, la localización de la anastomosis arterial y el nivel de flujo sanguíneo de la fístula arteriovenosa
R 5.5.6) En caso de realizarse la técnica de banding se sugiere realizarla asociada al control intraoperatorio del flujo sanguíneo de la fístula arteriovenosa y se desaconseja su uso de forma aislada
R 5.6.1) Se recomienda el tratamiento de los aneurismas arteriales verdaderos mediante su resección quirúrgica y reconstrucción arterial
R 5.6.2) En caso de presencia de aneurismas venosos se sugiere indicar tratamiento quirúrgico si están asociados a estenosis significativa, necrosis o trastornos cutáneos con riesgo de rotura del aneurisma
(•) NUEVA R 5.6.3) En pacientes con seudoaneurisma del trayecto de punción de la fístula arteriovenosa nativa se sugiere intentar, en primer lugar, el tratamiento por medio de compresión manual externa, guiada por ecografía Doppler, antes de recurrir a tratamientos quirúrgicos o percutáneos
(•) NUEVA R 5.6.4) Se sugiere tratar con métodos percutáneos (inyección ecoguiada de trombina) los seudoaneurismas del trayecto de punción de las fístulas arteriovenosas nativas que no respondan al tratamiento por compresión externa, reservándose el tratamiento quirúrgico a los casos de fracaso de las otras técnicas
(•) NUEVA R 5.6.5) En pacientes con seudoaneurismas protésicos de pequeño tamaño no complicados se recomienda evitar su punción, monitorizando su estabilidad clínica mediante ecografía Doppler
(•) NUEVA R 5.6.6) Ante la presencia de un seudoaneurisma protésico con criterios de complicación se sugiere la exéresis quirúrgica del segmento afectado, manteniendo la permeabilidad del acceso si es técnicamente factible. Se sugiere individualizar en cada caso la posibilidad de colocación de una endoprótesis vascular
(•) NUEVA R 5.6.7) En pacientes con seudoaneurismas que afectan a la anastomosis de la fístula arteriovenosa se sugiere la revisión quirúrgica, considerando el caso como una infección del acceso vascular
La formación de dilataciones aneurismáticas y de seudoaneurismas es una complicación potencialmente grave que puede desarrollarse en cualquier FAV. Los aneurismas verdaderos se definen como dilataciones o ectasias en los vasos implicados en el territorio de una fístula que mantienen la estructura íntegra de la pared venosa o arterial. Por el contrario, como seudoaneurismas o falsos aneurismas se conocen las dilataciones expansibles provocadas por hemorragia persistente a través de una pérdida de continuidad de la pared de la FAVn o FAVp, que puede localizarse en el lugar de punción o a nivel anastomótico.5.6.1. Aneurismas verdaderos
Como aneurisma verdadero se entiende la dilatación de un vaso por encima de su calibre normal. Según su morfología pueden ser saculares (dilatación excéntrica) o fusiformes (dilatación concéntrica), siendo estos últimos los relacionados casi exclusivamente con el AV, pudiendo desarrollarse tanto en el territorio arterial correspondiente a la arteria dadora como en la vena de drenaje.Definición e incidencia
Tras la creación de la FAV, la respuesta fisiológica normal comprende el aumento de calibre, tanto a nivel de la arteria como del trayecto venoso, siendo asimismo frecuente que dicho aumento de calibre a nivel del sistema venoso no sea uniforme, sino según la alternancia de distintos segmentos de diámetro variable. Es por ello la dificultad para poder definir el término.
Existen definiciones basadas en el valor absoluto del diámetro del vaso (> 20-30mm)576,577, en el incremento de calibre con respecto al segmento previo (incrementos de 2-3 veces el diámetro previo)576,578, en la suma de los diámetros longitudinal y transversal de la dilatación579 o incluso en el cálculo del volumen del vaso580. Finalmente, otros autores recomiendan una acepción amplia del término y lo definen como una dilatación “anormal” del vaso581.
Dado los distintos criterios usados en su definición, la incidencia varía según las series publicadas entre un 5 y un 60%581.Aneurismas venosos
Tal y como se ha comentado, tras la realización de la FAV, la dilatación de las venas de drenaje constituye una respuesta fisiológica y necesaria para el correcto funcionamiento del AV.
No obstante, existen determinadas circunstancias que pueden provocar la anómala y excesiva dilatación de la vena. Ello se puede producir, en primer lugar, debido a una debilidad en la pared del vaso, como sucede en los pacientes con enfermedad poliquística renal y en el síndrome de Alport, o bien por un aumento en la presión endoluminal del vaso, como sucede cuando se desarrolla una estenosis en un segmento venoso proximal y en las FAV de largo tiempo de evolución579,581,582.
La canulación repetitiva del mismo segmento de la vena puede, asimismo, provocar una debilidad en la pared que predispone a la ectasia, fenómeno conocido como unipuncturitis (1-site-itis), que es un fenómeno usualmente detectado en la práctica10.
En distintas series publicadas se ha comunicado un posible efecto protector de la diabetes mellitus sobre la formación de aneurismas, probablemente en relación con la menor capacidad del sistema arterial de provocar un hiperaflujo que se produce en estos pacientes579. En cambio, se desconoce el mecanismo por el que la utilización de la técnica de buttonhole parece prevenir la aparición de aneurismas240,581.
El diagnóstico es esencialmente clínico, y es útil la exploración con ED para determinar el diámetro y la presencia de trombo endoluminal.
La presencia de una o varias dilataciones venosas en el trayecto de punción no suele requerir ningún tipo de intervención, dado el carácter benigno y estacionario del proceso, siendo habitualmente estables durante largo tiempo581.
La indicación de tratamiento viene dada por la presencia de cambios cutáneos como los signos de atrofia cutánea, las erosiones, la aparición de áreas de inflamación o la presencia de escaras, que son signos que predicen el riesgo de hemorragia. La hemorragia de la FAV es la principal complicación de los aneurismas venosos, que puede ser de características masivas, poniendo en riesgo la vida del paciente a corto plazo. Otras indicaciones de tratamiento incluyen la trombosis del aneurisma, la hipertensión venosa, el hiperaflujo o motivos estéticos576,583. La hemorragia por rotura del AV se trata de una emergencia vital, por lo que es indicación de cirugía urgente. La prioridad ha de ser el control de la hemorragia, intentando, si es posible, la preservación del AV581. En el resto de ocasiones, el principal objetivo de la corrección quirúrgica ha de ser preservar la correcta función del AV, excepto en los casos en los que dicho acceso no esté en uso, en los que estará indicada su ligadura576.
Se ha descrito una gran variedad de técnicas quirúrgicas encaminadas al tratamiento de los aneurismas venosos581, todas ellas descritas en publicaciones de series de casos, sin existir actualmente estudios que las comparen entre sí. La técnica de elección, por lo tanto, vendrá determinada por las características del paciente y por la anatomía del AV en cada caso.
Estas técnicas incluyen la exclusión del aneurisma (con o sin su exéresis) con interposición de injerto autólogo o protésico576,584, la exéresis con anastomosis directa terminoterminal585, la resección parcial del aneurisma584,586,587, así como distintos tipos de aneurismorrafia585,588–590.
El tratamiento percutáneo del aneurisma venoso consiste en la colocación de un stent recubierto (endoprótesis) en el segmento afectado581,591. La ventaja que ofrece es la posibilidad de realizar el tratamiento de las estenosis asociadas en el mismo acto, sin necesidad de la colocación de un CVC. Por contra, sus inconvenientes radican en la posible dificultad en la punción del segmento portador de una endoprótesis y en el hecho de que con frecuencia es necesario asociar un procedimiento de exéresis parcial del aneurisma o una aneurismorrafia para permitir la canulación del vaso. Pese a los buenos resultados descritos en las series de casos publicadas592, actualmente el grado de evidencia sobre el uso de estos dispositivos no permite recomendar su uso sistemático y es necesaria la publicación de ulteriores estudios para poder determinar las indicaciones de dicha técnica.Aneurismas arteriales
La degeneración aneurismática en la arteria aferente a la FAV es una complicación poco frecuente tras la realización del acceso, y se estima una incidencia aproximada del 4,5% de los accesos. Su localización preferente es en el segmento distal de la arteria braquial593.
El principal desencadenante en su aparición es el alto QA a nivel de la FAV, que también está en relación directa con el tiempo de evolución del acceso. Por último, en varios estudios se ha descrito una mayor frecuencia en pacientes portadores de un trasplante renal, que se ha relacionado con el posible efecto de los fármacos inmunosupresores sobre la pared del vaso. Asimismo, en estos pacientes la dilatación progresiva de la arteria se ha observado incluso tras la ligadura del acceso577,594.
La presentación clínica puede ser en forma de tumoración pulsátil asintomática en la tercera parte de los casos, mientras que en otras ocasiones la sintomatología puede comprender clínica derivada de la compresión del nervio mediano, en forma de dolor neuropático y/o parestesias, dolor por compresión de otras estructuras vecinas, edema o bien clínica isquémica asociada a la embolización distal. Al contrario de lo que sucede en otras localizaciones, la rotura del aneurisma es una complicación poco frecuente577,593,594.
El diagnóstico de sospecha se basa en la exploración física, mientras que la realización de una ED confirmará el diagnóstico y ofrecerá información sobre diámetro, longitud y presencia de trombo intraluminal.
La indicación de tratamiento quirúrgico viene dada por la presencia de complicaciones asociadas y en los aneurismas de gran tamaño (> 30mm) en los casos en que sea técnicamente factible577.
Al tratarse de una entidad poco frecuente, que en muchos casos cursa de forma asintomática, la evidencia acumulada en la bibliografía con respecto al tratamiento es escasa, circunscrita a series de casos con limitado número de pacientes.
La técnica quirúrgica de elección, según la mayoría de autores, es la resección del aneurisma manteniendo la continuidad arterial mediante sutura directa entre el segmento de arteria proximal y distal a la ectasia, evitando de esta forma la interposición de material autólogo o protésico. En el caso en que técnicamente no sea factible esta opción, se aconseja el uso de material autólogo (vena safena interna o venas de la propia extremidad afectada) para revascularizar el árbol arterial, mientras que la posibilidad de usar material protésico (PTFE) se suele reservar como última opción debido al riesgo de infección y a la peor permeabilidad que comporta. Los resultados publicados de las técnicas expuestas en cuanto a la permeabilidad y al éxito clínico son excelentes, y se ha conseguido la resolución de la sintomatología en todos los casos descritos577,593–595.5.6.2. Seudoaneurismas o falsos aneurismas
La denominación de seudoaneurisma hace referencia a la presencia de un hematoma con comunicación con la luz del vaso, y se diferencia del aneurisma verdadero en que la pared de la dilatación no se compone de las capas habituales que se pueden encontrar en el vaso, sino que se trata de una pared de tejido fibroso y hematoma organizado creado alrededor de una cavidad con flujo presente596. Es por ello que se suelen denominar falsos aneurismas o hematomas pulsátiles, que son términos sinónimos.
En la génesis del falso aneurisma se halla siempre la presencia de una pérdida de integridad en la pared del vaso o de la anastomosis, que conlleva una fuga de flujo al tejido adyacente, fuga contenida por la presencia del hematoma y del tejido fibroso mencionados, lo que condiciona la posibilidad de un crecimiento rápido y expansivo583.
La causa suele deberse a punciones traumáticas en los casos localizados en el trayecto venoso o bien a punciones repetidas en la misma área en FAVp. Cuando se presenta a nivel de la anastomosis arteriovenosa tras la creación del acceso suele estar provocado por falta de estanqueidad en dicha anastomosis, mientras que si la presentación es tardía, habitualmente se debe a la presencia de infección activa en el AV581.
El diagnóstico de sospecha es clínico (presencia de tumoración pulsátil de rápido crecimiento con presencia de hematoma/equimosis en la piel adyacente), mientras que la exploración con ED confirmará el diagnóstico, permitiendo asimismo cuantificar el tamaño de este.
→ Pregunta clínica XXII En el seudoaneurisma de fístula arteriovenosa nativa y protésica, ¿cuándo se establece la indicación de cirugía frente a intervención percutánea o frente a manejo conservador, valorado en complicaciones hemorrágicas graves o muerte?
(Ver ficha de la Pregunta clínica XXII en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Una serie clínica con tres pacientes mostraba que la compresión manual externa, guiada por ultrasonidos, puede ser eficaz en el tratamiento de seudoaneurismas, para conseguir la permeabilidad y funcionalidad completa de los AV y sin recurrencias en el seguimiento | Calidad muy baja |
| Distintas series clínicas que analizan por separado la cirugía y la intervención endovascular, con stents, demuestran que son técnicas eficaces de tratamiento en un alto porcentaje de pacientes para recuperar la permeabilidad y funcionalidad del AV | Calidad muy baja |
Los falsos aneurismas o seudoaneurismas acontecen entre un 2-10% de las FAVp. Pueden ser infecciosos o no, y localizarse en una anastomosis o relacionados con un lugar de punciones repetidas y deterioro del material protésico.
En cuanto al tratamiento, no se ha encontrado ningún estudio donde se comparen entre sí distintos abordajes del seudoaneurisma de la FAVn y la FAVp (cirugía frente a percutáneo frente a manejo conservador). Las pruebas disponibles son de muy baja calidad, porque provienen únicamente de series clínicas que analizan el efecto de una sola modalidad de tratamiento, sin grupo de comparación.
Asimismo, en la mayoría de series publicadas no se desagregan los resultados obtenidos en función del tipo de FAV (FAVn o FAVp) ni de la localización del seudoaneurisma (zona de punción o anastomótico).Tratamiento del seudoaneurisma pospunción en la fístula arteriovenosa nativaManejo conservador: compresión manual externa guiada por ultrasonido
La compresión guiada ecográficamente se usa de forma habitual en el tratamiento de los seudoaneurismas arteriales pospunción, y su utilidad se ha descrito de forma amplia en la bibliografía publicada597.
Pese a que el uso de dicha técnica para el tratamiento de los seudoaneurismas en el AV autólogo está ampliamente extendido, es muy escasa la evidencia disponible en la actualidad, referida a la publicación de series de casos597,598; en dichas series se describe como una técnica no invasiva, segura y efectiva que debiera ser intentada antes de recurrir a tratamientos quirúrgicos o endovasculares, con unos resultados exitosos de entre el 64 y el 90% de los pacientes.Cirugía
La técnica quirúrgica de elección se debe individualizar en cada caso, pese a que en la mayor parte de seudoaneurismas que requieran cirugía consistirá en el drenaje manual del hematoma y la sutura directa del punto de fuga, y se puede realizar con o sin colocación de torniquete proximal (cirugía con manguito de isquemia)599.
No hay series de casos publicadas con datos procedentes de seudoaneurismas pospunción en FAVn tratados exclusivamente con cirugía; en todos ellos se agregan los casos de seudoaneurismas pospunción, anastomóticos y de FAVp, amén de reportarse distintas técnicas quirúrgicas585,599–601. Así pues, el estudio de Zheng et al600 describe los resultados de la cirugía en 20 seudoaneurismas en FAV, con un éxito técnico en todos los casos y una permeabilidad primaria del 95%, por lo que los autores consideran la cirugía la mejor opción para reparar seudoaneurismas de fístulas. Georgiadis et al601 evalúan la cirugía en 28 seudoaneurismas, en FAVn y FAVp, con una permeabilidad primaria del 75% a los 6 meses, y en el caso de la serie de Belli et al585 tampoco se desagregan los resultados de los distintos procesos; no obstante, en toda la bibliografía los resultados de la cirugía del seudoaneurisma pospunción ofrecen una tasa de éxito técnico del 100%.Tratamiento percutáneo
Como en las otras modalidades de tratamiento, hay escasa evidencia acerca del tratamiento percutáneo ecoguiado con inyección de trombina para el tratamiento de seudoaneurismas en la FAVn, que está referida en su mayor parte al tratamiento de seudoaneurismas en otras localizaciones. Con un éxito técnico del 80%, Ghersin et al602 recomiendan esta modalidad de tratamiento en los casos favorables anatómicamente, basándose en la mínima invasividad y buen resultado técnico.Tratamiento endovascular
El tratamiento endovascular descrito consiste en la colocación de un stent o una endoprótesis en el punto de fuga para conseguir el sellado de esta603. Al igual que con las otras opciones terapéuticas, hay escasa evidencia publicada actualmente, con series de muy limitado número de casos, y únicamente se han comunicado 17 casos603–605.
En dichas series se describe un éxito técnico del 90-100%, con una permeabilidad primaria del 70-90% a los 6 meses, sin poder disponer de una estadística desagregada de la tasa de infección603–605.Tratamiento del seudoaneurisma pospunción en la fístula arteriovenosa protésica
La agresión producida por la punción repetida de una prótesis vascular ocasiona un daño estructural persistente a nivel de la pared en la estructura del PTFE, daño que al acumularse en el espacio y el tiempo (acumulación de punciones en el mismo segmento, en prótesis con prolongados períodos de uso) puede conducir a la pérdida de la integridad estructural en dicha pared protésica606.
Es por ello que en la práctica clínica se puede producir la aparición de seudoaneurismas asociados a la canulación repetida de una prótesis vascular, asociados o no a la infección de esta, que están sujetos a las mismas posibilidades de complicación que en el caso de las FAVn (crecimiento expansivo, compresión de estructuras vecinas, rotura espontánea)10.
En ocasiones, el diagnóstico se trata de un hallazgo casual, como es el caso de pequeños seudoaneurismas que pueden permanecer estables en el tiempo. En este caso se puede realizar un manejo conservador mediante controles ecográficos, evitando en toda circunstancia la punción de la zona afectada585.
En cambio, cuando el seudoaneurisma presenta riesgo de desarrollar potenciales complicaciones, tanto las distintas guías clínicas como la opinión de expertos recomiendan su tratamiento. En la tabla 27 se relacionan las indicaciones de tratamiento de los seudoaneurismas protésicos10,585,607.
Seudoaneurismas protésicos. Indicaciones de tratamiento10,585,607
| Rapido crecimiento |
| Tamano superior al doble del diametro de la protesis |
| Presencia de trastornos troficos cutaneos |
| Signos de infeccion |
| Acortamiento significativo del trayecto de puncion |
A causa de la presencia subyacente de una desestructuración en la pared de la prótesis, el objetivo del tratamiento es su corrección. Se han descrito técnicas tanto quirúrgicas como endovasculares.Tratamiento quirúrgico
La técnica consiste en la exclusión del segmento afectado manteniendo la continuidad del circuito mediante la realización de un bypass protésico entre el sector proximal y el distal a la lesión, a través de un nuevo lecho subcutáneo independiente del anterior585.
Pese a ser la primera técnica estandarizada en el tratamiento del seudoaneurisma protésico, la bibliografía existente al respecto es escasa y su evidencia está limitada a estudios de series de casos585,601. Georgiadis et al601 describen una permeabilidad primaria a los 6 meses del 78% en ausencia de complicaciones técnicas significativas.Tratamiento endovascular
El tratamiento endovascular de elección consiste en el despliegue por vía percutánea de una endoprótesis vascular, con el fin de conseguir el sellado del segmento protésico patológico. Algunos autores recomiendan proceder posteriormente con el drenaje del trombo del seudoaneurisma mediante punción percutánea o abordaje quirúrgico605,608. Las contraindicaciones son las lesiones tróficas cutáneas asociadas y la presencia o sospecha de infección607.
Característicamente, presenta la ventaja de no requerir abordaje quirúrgico, manteniendo intacta la funcionalidad de la prótesis desde el momento del procedimiento, mientras que el principal inconveniente radica en la tasa relativamente alta de infecciones asociadas (hasta de un 42%)609.
Distintos estudios avalan su utilidad clínica603–605,608–612, con una tasa de éxito técnico del 85-100%, una permeabilidad primaria del 20-36% a los 6 meses y una permeabilidad secundaria del 54-76%, discretamente inferior a las del tratamiento quirúrgico607. La tasa de infecciones protésicas relativas al procedimiento oscila entre un 23 y un 42%. Esta alta incidencia se cree debida, en la mayoría de ocasiones, a la presencia de una infección subclínica previa asociada al seudoaneurisma607,609.Tratamiento del seudoaneurisma anastomótico
La presencia de un seudoaneurisma en relación con la anastomosis arteriovenosa de la FAV se debe a la falta de estanqueidad a nivel de la línea de sutura. Puede producirse en dos tipos de circunstancias, según el momento en que se presente. En primer lugar, el seudoaneurisma anastomótico de aparición tras la intervención (horas o días tras la realización del acceso) está en relación con la técnica quirúrgica, mientras que pasado el período postoperatorio la presencia de una fuga en la anastomosis suele traducir la presencia de una infección de elevada agresividad con colonización de la línea de sutura581.
En ambas circunstancias estará indicada la reparación del seudoaneurisma, que se debe realizar mediante intervención quirúrgica. La colocación de una endoprótesis está contraindicada debido al alto riesgo de infección581. Si se produce en el postoperatorio, se debe indicar la revisión quirúrgica junto a la hemostasia del punto de fuga, mientras que si se produce en relación con una infección del AV se debe retirar el material infectado, asociando una técnica de reconstrucción de la FAV si ello es factible técnicamente607, según las recomendaciones efectuadas en el apartado sobre el tratamiento de la infección del AV.
En la serie publicada de Shojaiefard et al599 sobre ocho pacientes con seudoaneurismas anastomóticos tratados quirúrgicamente se describe un éxito técnico del 88%, con una permeabilidad primaria del 88% a los 15 meses. Al no haberse presentado complicaciones, hace considerar el procedimiento viable, seguro y rentable.De la evidencia a la recomendación
Tal y como se ha comentado, la evidencia disponible actualmente sobre las distintas modalidades terapéuticas en el caso de los falsos aneurismas se basa en series de casos publicadas de las diferentes técnicas, sin que haya estudios comparativos. Esto hace que no se pueda establecer un criterio basado exclusivamente en dicha evidencia sobre la opción de tratamiento recomendable en cada caso. Así pues, se han adoptado las recomendaciones basadas en los criterios de buena práctica de forma consensuada por los miembros del GEMAV. Al tratarse de técnicas con buenas tasas de éxito clínico, el factor determinante a la hora de sugerir su uso ha sido el grado de invasividad del procedimiento, y en primer lugar se sugiere el uso de las técnicas menos agresivas.Tratamiento del seudoaneurisma pospunción en la fístula arteriovenosa nativaCompresión manual externa guiada por ultrasonido
Esta técnica, que se usa de forma generalizada en la práctica clínica, es la opción que reviste menor complejidad, y se puede aplicar de forma inmediata en el mismo momento en que se efectúa el diagnóstico mediante ED. Pese a ser una de las opciones terapéuticas más extendidas, la evidencia disponible sobre su uso es paradójicamente escasa. A pesar de ello, por todo lo mencionado anteriormente, en particular por ser la técnica de realización más sencilla y la de menor invasividad, se ha decidido sugerir su uso en primer lugar en los casos en los que sea técnicamente factible.Tratamiento percutáneo
La inyección ecoguiada de trombina en la cavidad del seudoaneurisma se trata asimismo de una técnica mínimamente invasiva usada profusamente en la práctica. Pese a la escasa evidencia publicada sobre su uso, ha demostrado ser una técnica segura con una alta tasa de éxito técnico, por lo que se ha incluido como segunda opción terapéutica tras la compresión manual.Tratamiento quirúrgico
Es el primer tipo de tratamiento descrito, por lo que existe en la bibliografía un mayor número de series publicadas que en las anteriores. Se trata de una técnica segura y con buenos resultados en cuanto al éxito técnico y a la permeabilidad del procedimiento. Su principal inconveniente radica en que se trata de la técnica con un mayor grado de invasividad, por lo que se sugiere su indicación en el caso de que los anteriores procedimientos no sean técnicamente factibles o tras el fracaso de estos.Tratamiento endovascular
La colocación de stents intravasculares y/o endoprótesis es otro método que ha demostrado su utilidad en el tratamiento de los seudoaneurismas de las FAV. Se trata de una técnica mínimamente invasiva y con buenas tasas de éxito técnico; su inconveniente radica en la mayor complejidad con respecto a la inyección de trombina, en la menor permeabilidad con respecto al tratamiento quirúrgico, así como en la posibilidad de infección del material protésico implantado. Por último, la mayor limitación para la colocación de una endoprótesis en una FAVn se debe a la necesidad de una anatomía favorable para conseguir un correcto despliegue, lo que restringe su uso en la práctica clínica, por lo que no se puede recomendar su uso sistemático para el tratamiento en estos casos.Tratamiento del seudoaneurisma pospunción en la fístula arteriovenosa protésicaTratamiento quirúrgico
El tratamiento quirúrgico, pese a la escasa bibliografía existente, ha sido tradicionalmente la única opción terapéutica disponible, ofreciendo una alta tasa de éxito clínico, sin afectar al pronóstico de la FAVp en cuanto a permeabilidad, con una baja tasa de complicaciones. Asimismo, mediante la exclusión del segmento afectado y la creación de un nuevo túnel subcutáneo, se consiguen resolver de forma efectiva los casos en los que existe un componente no detectado de infección; por ello continúa siendo la técnica de elección en estos casos. Cuando el segmento protésico que permanece in situ es insuficiente para permitir una correcta canulación, se debería optar por la colocación de una prótesis de punción inmediata, con el fin de evitar la colocación de un CVC.Tratamiento endovascular
El despliegue de una endoprótesis para sellar el defecto estructural de la pared es una técnica de más reciente introducción, pese a lo que existen varias series de casos publicadas. Se trata de un procedimiento mínimamente invasivo, con alta tasa de éxito técnico y aceptable permeabilidad. Además, las características estructurales de las prótesis permiten su despliegue efectivo en la mayoría de casos.
La infección activa contraindica su uso y obliga a valorar el riesgo/beneficio de su colocación en el resto de ocasiones en que el defecto estructural no tenga descartado un origen infeccioso.Tratamiento del seudoaneurisma anastomótico
Actualmente, la única opción terapéutica viable en el caso de seudoaneurismas anastomóticos consiste en la revisión quirúrgica. Dado que se trata de un proceso que traduce la presencia de una infección activa, se recomienda plantear la intervención de forma acorde a ello, tal como se ha recomendado previamente en el apartado correspondiente al tratamiento de la infección de la FAV.
R 5.6.3) En pacientes con seudoaneurisma del trayecto de punción de la fístula arteriovenosa nativa se sugiere intentar, en primer lugar, el tratamiento por medio de compresión manual externa guiada por ecografía Doppler, antes de recurrir a tratamientos quirúrgicos o percutáneos
R 5.6.4) Se sugiere tratar con métodos percutáneos (inyección ecoguiada de trombina) los seudoaneurismas del trayecto de punción de las fístulas arteriovenosas nativas que no respondan al tratamiento por compresión externa, reservándose el tratamiento quirúrgico a los casos de fracaso de las otras técnicas
R 5.6.5) En pacientes con seudoaneurismas protésicos de pequeño tamaño no complicados se recomienda evitar su punción, monitorizando su estabilidad clínica mediante ecografía Doppler
R 5.6.6) Ante la presencia de un seudoaneurisma protésico con criterios de complicación se sugiere la exéresis quirúrgica del segmento afectado, manteniendo la permeabilidad del acceso si es técnicamente factible. Se sugiere individualizar en cada caso la posibilidad de colocación de una endoprótesis vascular
R 5.6.7) En pacientes con seudoaneurismas que afectan a la anastomosis de la fístula arteriovenosa se sugiere la revisión quirúrgica, considerando el caso como una infección del acceso vascular
La piel de las zonas superiores de los aneurismas es más propensa a perder sus propiedades de elasticidad, poder de cicatrización y pérdida del efecto barrera frente a las infecciones. Por ello es más recomendable puncionar en las zonas de piel no dañada y, en caso de tener que puncionar en la zona del aneurisma, se realizará en la base de este y así se evitarán complicaciones como riesgo de hemorragia, tanto en la punción como en la hemostasia, mala cicatrización con riesgo de formación de escara o necrosis e infecciones.
5.7Síndrome de hiperaflujoRecomendaciones(•) NUEVA R 5.7.1) Se sugiere la reducción del flujo de la fístula arteriovenosa mediante la revisión quirúrgica ante el paciente con ausencia de mejoría clínica tras manejo médico y con flujo sanguíneo > 2.000 ml/min y/o flujo/gasto cardíaco > 30%
(•) NUEVA R 5.7.2) En pacientes con fístula arteriovenosa de alto flujo e insuficiencia cardíaca atribuida a la fístula arterivenosa se sugiere intervenir usando la técnica de banding o la técnica RUDI
La insuficiencia cardíaca es la enfermedad cardiovascular más frecuente asociada a la ERC613 y está presente en un tercio de los pacientes incidentes en HD614, lo que supone un elevado riesgo de mortalidad cardiovascular para estos pacientes615. Paralelamente, hasta un 75% de los pacientes con ERC avanzada presenta una hipertrofia ventricular izquierda al inicio de la diálisis, lo que constituye también una variable predictiva de mortalidad616. La insuficiencia cardíaca en el paciente en HD se diferencia de la del paciente no urémico por diversos factores; entre ellos destaca la sobrecarga de volumen y el QA del AV, que podrían contribuir al desarrollo de la insuficiencia cardíaca.Consecuencias cardiovasculares de la fístula arteriovenosa
Se han propuesto diversos mecanismos que podrían conducir de la creación de la FAV a la generación de patología cardíaca. Tras la creación del AV aparece de modo inmediato una reducción persistente de la presión arterial, de la rigidez arterial y de la resistencia periférica, lo que incrementa la actividad nerviosa simpática. Esta, a su vez, con la intención de mantener la presión arterial, aumenta la frecuencia y contractilidad cardíacas, con el consiguiente aumento del volumen de eyección y por lo tanto del gasto cardíaco (GC), que se puede incrementar en un 10-25%617–620. En cuestión de días o semanas se incrementa el volumen sanguíneo y el volumen y presiones telediastólicos del ventrículo izquierdo. En unos 3 meses puede desarrollarse un aumento mayor del GC, con un incremento en la masa y tamaño ventricular izquierdo, así como en el tamaño auricular621. De modo progresivo puede aparecer entonces una disfunción sistólica y diastólica, dilatación ventricular y reducción de la fracción de eyección, con un incremento en el flujo pulmonar y una posterior hipertensión pulmonar194,622. De hecho, la incidencia de hipertensión pulmonar en el paciente en HD con FAV se ha descrito hasta en un 40%623, en el contexto de un QA elevado. Sin embargo, se ha sugerido que puede haber una disfunción basal en la vascularización pulmonar en un entorno urémico, lo que haría que la FAV precipitase la descompensación del circuito pulmonar al causar una disminución en la vasodilatación624.
Todo este proceso comenzaría con un remodelado cardíaco a expensas de una hipertrofia ventricular izquierda excéntrica, en relación con la sobrecarga de volumen, con un relativamente normal engrosamiento de la pared a diferencia de la concéntrica por sobrecarga de presión625. La hipertrofia y la dilatación del ventrículo izquierdo como fenómenos adaptativos en respuesta al incremento de presión y carga de volumen ocurren normalmente en atletas, embarazadas y en el crecimiento de la infancia a la edad adulta. La sobrecarga de volumen produce un incremento de la poscarga sistólica, que se asocia a un estrés en la pared de modo radial en la fase sistólica, dando lugar a la adición de sarcómeros a las fibras miocárdicas predominantemente con un patrón en serie más que en paralelo. Esta elongación miofibrilar contribuye al aumento de tamaño de la luz ventricular y a la hipertrofia excéntrica más que concéntrica626,627. Pero, aunque la dilatación del ventrículo puede ser inicialmente adaptativa, de acuerdo con el mecanismo de Frank-Starling, el progresivo aumento del volumen ventricular, la fibrosis miocárdica concomitante y la relativa isquémica celular miocárdica (incluso en ausencia de patología coronaria), eventualmente pueden resultar en una afectación de la contractilidad sistólica y producir con el tiempo el paso a un fallo cardíaco628. Este remodelado ventricular se ha relacionado con el mal pronóstico a largo plazo en la insuficiencia renal crónica629.
El riesgo es potencialmente más alto durante el período de maduración de la FAVn debido a los cambios hemodinámicos que se producen, secundarios al gran incremento de QA ocasionado por la FAVn193, así como durante los primeros 120 días después de iniciar la HD, ya que dentro de este período la tasa de mortalidad es máxima630.Flujo de la fístula arteriovenosa y gasto cardíaco
El alto GC en adultos se ha definido cuando es > 8 l/min o un índice cardíaco > 3,9 l/min/m2631. El incremento en el GC es proporcional al QA, que habitualmente se encuentra entre 1 y 2 l/min, para poder mantener una adecuada perfusión periférica. Si la contractilidad miocárdica se encuentra afectada, el exceso de volumen provocado por el QA en combinación con la inadecuada vasoconstricción compensatoria periférica para mantener la presión arterial sistémica puede conducir a la aparición de la clínica de fallo cardíaco632. Se han comunicado casos de pacientes con alto GC sintomático con QA 3-4 l/min y GC 7-10 l/min360,633, en los que es evidente establecer esta relación. Sin embargo, no hay criterios claros para definir una FAV de alto flujo, dado que la descripción de fallo cardíaco asociado a la insuficiencia renal crónica en alto GC es limitada y circunscrita a series de casos360,634.
Basile et al194, en un estudio prospectivo con 96 pacientes para describir la relación entre QA y GC, observan un mayor fallo cardíaco en la FAV proximal, describiendo el mejor modelo que explica esta relación, una regresión polinómica de tercer orden, en la que la insuficiencia cardíaca de alto gasto podría ocurrir a partir de valores > 2 l/min. Los 10 pacientes que desarrollaron fallo cardíaco presentaban un QA de 2,3 ± 0,3 l/min, y en el resto de los pacientes fue 1,0 ± 0,4 l/min. Otros autores sugieren que la ratio de QA/GC puede dar una estimación de la contribución del AV al GC y si es > 0,3 puede incrementar el riesgo de desarrollar fallo cardíaco de alto gasto635 o, de modo más específico, si es > 40%636. Aunque no se ha confirmado con estudios prospectivos, y a pesar de la escasa muestra, se sugiere como razonable pensar que a partir de los 2,0 l/min hay un poder predictivo de fallo cardíaco de alto GC, así como una ratio QA/GC > 0,3, lo que podría suponer un factor descompensador para un fallo cardíaco preexistente, o incluso flujos más bajos también podrían descompensar fallos cardíacos en pacientes con pobre reserva cardíaca637–639.
Pero esta relación de QA y GC no se demuestra lineal desde el punto de vista clínico. Wijnen et al640, al igual que Basile et al194, constatan que, en pacientes sin insuficiencia cardíaca, el GC es significativamente mayor en FAV proximales comparadas con FAV distales. Sin embargo, solo un pequeño porcentaje de estas FAV proximales se encuentra en zona de riesgo para el desarrollo de fallo cardíaco de alto débito. Paralelamente hay series que demuestran una escasa frecuencia de fallo cardíaco por FAV de alto QA (3,7%)641. No queda claro, de este modo, la causa del paso de la hipertrofia ventricular izquierda por sobrecarga a la insuficiencia cardíaca. Por ello, algunos autores sugieren, por un lado, la participación de una cardiopatía de base625 y, por otro, la posible participación de un elevado volumen telediastólico en el ventrículo izquierdo628. De hecho, se ha observado que un QA > 2 l/min presenta esta mayor tendencia a un mayor volumen telediastólico ventricular izquierdo642 y que flujos < 2,2 l no presentan repercusión en el GC194. No se conocen las causas de este comportamiento, pero se puede hipotetizar sobre la existencia de algún tipo de reserva miocárdica que puede permitir la adaptación capaz de soportar incrementos en el QA a largo plazo sin que se precipite la aparición de fallo cardíaco637. Por este motivo, el objetivo sería identificar al paciente con cardiopatía de base con mayor riesgo de sufrir la consecuencia de un alto flujo sobre la función cardíaca para intervenir sobre él639,643.
En este sentido, incluso, aunque se demuestra la relación entre el QA de la FAV y el GC635, y hay series que constatan como el factor más determinante para desarrollar fallo cardíaco la creación de una FAV193, desde el punto de vista epidemiológico no se ha demostrado un incremento en la mortalidad en relación con el flujo644, e incluso hay trabajos en que se ha relacionado un QA más elevado con un menor daño cardíaco645 y una disminución de las resistencias periféricas y de la presión arterial con un incremento paralelo de la fracción de eyección que podría ser potencialmente beneficioso620. En este contexto, en un estudio observacional de 4.854 pacientes646, se demuestra la asociación a largo plazo de la FAV con una menor mortalidad cardiovascular de cualquier tipo en comparación con el CVC (p < 0,004), independientemente de la comorbilidad de ambos grupos. Esto confirma la controversia de no quedar del todo claro hasta qué punto la función cardíaca se altera tras la creación de una FAV, dada la presencia de múltiples factores confusores en estos pacientes. Es decir, si es la FAV la que contribuye a la aparición de la insuficiencia cardíaca, pero a partir de un límite, o es realmente una enfermedad cardíaca de base la que es descompensada por la FAV647.Ligadura de la fístula arteriovenosa en el trasplantado renal
Existe evidencia para sostener el hecho de que hay una regresión en los índices cardíacos tras la ligadura o reducción en el QA de la FAV. Esto se ha demostrado en trasplantados a los que se les ha ligado la FAV y han presentando una regresión en la dilatación y en la masa ventricular izquierda648,649o una mejoría significativa de la fracción de eyección650. Además, cuando se compara los efectos de FAVn y FAVp no se encuentran diferencias en el aumento de las medidas del ventrículo izquierdo, lo que sugiere que el flujo, más que el tipo de AV, influye en el desarrollo de la elevación del QA651. Estos resultados favorables, sin embargo, no se han confirmado con ensayos clínicos, por lo que no se puede recomendar la ligadura de la FAV de modo estandarizado en el trasplantado asintomático.Estrategias para manejar el fallo cardíaco en relación con el alto flujo de la fístula arteriovenosa
El manejo del fallo cardíaco sintomático se debe dirigir, en primer lugar, a tratar el exceso de volumen y los síntomas mediante el tratamiento médico, como puede ser la corrección de la anemia u otros factores susceptibles de tratamiento. Ante la ausencia de éxito se deberá intentar corregir la causa del alto gasto. En este caso habría que plantear una reducción del flujo de la FAV intentando preservar el AV. Las técnicas quirúrgicas empleadas serían las mismas que se han revisado en el aparado anterior del SHD para las FAV de alto flujo. Incluirían principalmente, por un lado, el banding o variantes como el MILLER y, por otro, una nueva anastomosis distal (RUDI)559,572,573,650,652–655. El objetivo, al igual que en el SHD, es preservar el uso de la FAV y reducir el fallo cardíaco, pero teniendo en cuenta, en último caso, que cuando esto no se puede lograr habría que realizar la ligadura de la FAV.Selección del tipo de fístula arteriovenosa en el paciente con patología cardíaca
A la hora de planificar la creación de una FAV, teniendo presente que la FAV proximal presenta un mayor QA, hay que sopesar el riesgo en los pacientes con fallo cardíaco basal que van a presentar mayor probabilidad de empeorar la función cardíaca con este tipo de acceso que en los que se realiza un AV distal640. Esto obliga a la elección del AV más idóneo para cada paciente incidente con insuficiencia cardíaca, por lo que se debe evaluar el riesgo de descompensación de la insuficiencia cardíaca después de la creación de la FAV. En este sentido se ha sugerido que los pacientes con insuficiencia cardíaca clasificados según la New York Heart Association (NYHA) como de clases I-II podrían iniciar HD a través de una FAVn distal (carpo o en tabaquera anatómica)646,656; en los pacientes con clase III, la decisión de la creación de una FAVn distal frente a la implantación de un CVC tunelizado o el paso a otra técnica de diálisis, como la peritoneal, tendría que individualizarse según el grado de afectación cardíaca y, por último, los pacientes con insuficiencia cardíaca y reducción significativa en la función sistólica o en clase IV serían tributarios de la colocación de un CVC para iniciar el tratamiento de HD o la elección también de otra técnica de diálisis646,656.
→ Pregunta clínica XXIII En la fístula arteriovenosa de alto flujo, ¿qué actitud terapéutica hay que tomar y cuáles son los criterios (factores de riesgo)?
(Ver ficha de la Pregunta clínica XXIII en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| La evidencia se limita a algunas series clínicas, que muestran que la técnica de banding, la RUDI y otras técnicas reductoras del QA son eficaces para reducir el QA alto en la FAVn y conseguir la remisión de los síntomas en la insuficiencia cardíaca congestiva ligada a QA elevado | Calidad baja |
La FAV ideal para la HD debe funcionar con un QA necesario para prevenir la trombosis a la vez que proporcione la máxima eficiencia para la HD657. Se han considerado como óptimos, flujos en el rango entre 600 y 1.500ml/min, clasificándose como fístulas de alto flujo las que tienen flujos de entre 1.500 y 4.000ml/min657.
Otros autores658 consideran que un flujo de entre 400600ml/min en una FAV es, por lo general, suficiente para mantener una HD eficaz y, por otro lado, se apunta que, aunque no hay una definición consensuada sobre cuándo se puede considerar un flujo como alto, suele usarse un punto de corte de 2.000ml/min, dado que, como se ha visto, algunos estudios han encontrado que la insuficiencia cardíaca es más frecuente en los pacientes en HD con un AV con un QA por encima de este umbral.
La existencia de una fístula hiperfuncionante con QA elevado se ha asociado con distintos problemas potenciales: sobrecarga cardíaca, recirculación cardiopulmonar, crecimiento rápido del AV con formación de aneurismas, o estenosis venosa recurrente resultante en el fracaso del AV657. Como ya se ha mencionado en apartados anteriores, también puede ocasionar el SHD, así como un cuadro de hipertensión venosa en ausencia de estenosis venosas centrales. Tras el diagnóstico de alguna de estas situaciones se debe intervenir para solucionar o mitigar el problema, intentando al mismo tiempo preservar el AV.
La detección de un QA alto es a menudo un hallazgo casual que se obtiene en una medición de rutina658 que, si se confirma en ocasiones repetidas, plantea la cuestión de si realizar una intervención de reducción de flujo. No obstante, la decisión de realizar el tratamiento es controvertida debido a la ausencia de criterios absolutos para iniciarlo.
No se han encontrado estudios que comparen la evolución clínica de pacientes con fístula de alto QA según hayan sido tratados o no para reducir el QA. La evidencia disponible proviene de opiniones de expertos y series clínicas; por tanto, es de calidad baja.
Revisiones recientes consideran que la actitud terapéutica debe depender de la historia de cada paciente y de su situación clínica657,658. Por ejemplo, tiene sentido que un paciente con alto QA en la FAV y con un funcionamiento cardíaco comprometido haya de someterse a una intervención de reducción de QA del AV, dado que de lo contrario acabará desarrollando antes o después algún episodio cardíaco adicional. Pero parece también una decisión sensata no intervenir si se detecta un alto QA en una FAV en un paciente joven y con una función cardíaca normal, que se encuentra en lista de espera para recibir un trasplante renal.
No hay que olvidar que, además de en los casos relacionados con SHD o repercusión cardiológica de la FAV, pueden ser tributarios de intervención los pacientes con presencia de aneurismas o con desarrollos de FAV exagerados y en casos de estenosis venosa central o cuando la diferencia entre el flujo de entrada y salida origina inflamación en el brazo y disfunción del AV657,658.Opciones terapéuticas
Como ya se ha revisado de un modo exhaustivo en el apartado del SHD, las técnicas principales que se han desarrollado para reducir el QA alto en las FAV son la técnica del banding o alguna de sus variantes y la técnica de RUDI.Banding
En el estudio publicado por Miller et al573, ya comentado, con 183 pacientes tratados con banding, se consiguió, además de la completa remisión de los síntomas en 109 de los 114 pacientes que tenían SHD, que también se obtuviera en todos los 69 pacientes con alto flujo con patologías como insuficiencia cardíaca congestiva, aneurismas o presiones venosas elevadas. La permeabilidad primaria de la intervención a los 6 meses fue del 75 y del 85%, respectivamente, para el SHD y el alto flujo. La permeabilidad secundaria del AV a los 24 meses era del 90 y el 89% y las tasas de trombosis eran de 0,21, 0,10 y 0,92 por año con el acceso para FAVn de brazo, antebrazo y FAVp, respectivamente.
Por otro lado, dos series clínicas analizan la técnica de banding de MILLER en pacientes con estenosis venosa central. Jennings et al659 utilizaron el banding en 22 pacientes con alto flujo y oclusión venosa central con repercusión clínica a nivel de inflamación de la extremidad. La inflamación desapareció inmediatamente en 20 de los pacientes y mejoró bastante en los otros 2. La media de flujo bajó de 1.640 a 820ml/min después de la intervención (p < 0,01). Dos de las FAV fallaron, una a los 8 meses y otra a los 13 meses.
Miller et al456 también analizaron el efecto del banding en 33 pacientes con estenosis del arco braquiocefálico seguidos una media de 14,5 meses. La reducción del flujo fue de 2.226 a 1.225ml/min, con una media de un 42%. La permeabilidad a los 3, 6 y 12 meses era del 91, 76 y 57%, respectivamente. La tasa de intervenciones sobre el arco braquiocefálico bajó de 3,34 a 0,9 por año de acceso.
Schneider et al660 describen una modalidad diferente de banding (el T-banding), que pretende evitar posibles desplazamientos del injerto mediante una prótesis que rodea la vena, tanto en la zona postanastomótica como en la anastomótica. En una serie de 22 pacientes, 20 de ellos con insuficiencia cardíaca, 6 de ellos también con SHD y 2 únicamente con SHD, se consiguió una reducción media del flujo del 44% (rango, 27 a 71%), de un flujo medio de 1.956 a 983ml/min al mes de la cirugía. El 72% de los pacientes tuvo una completa mejoría de los síntomas y 4, de modo parcial, necesitaron una nueva intervención para conseguir la mejoría completa. La intervención fue exitosa en el 95% (19/20) de los pacientes con insuficiencia cardíaca y en el 83% (5/6) de los de SHD. El acceso siguió usándose en todos los pacientes, con una permeabilidad primaria del 90% y secundaria del 100% al mes y 3 meses.Revascularización usando el inflow distal
Al igual que la técnica del banding, la RUDI, como ya se ha comentado, se puede utilizar también para FAV con alto Qa. Chemla describe una serie de 17 pacientes con sintomatología de insuficiencia cardíaca (15 FAVn y 2 FAVp)641 con QA > 1.600ml/min, en los que se realiza la técnica, y consiguió una reducción del Qa de 3.135 ± 692 a 1.025 ± 551ml/min (p = 0,0001). El descenso del GC fue de 8 ± 3,1 a 5,6 ± 1,7 l/min (p = 0,001), consiguiendo la resolución de la sintomatología. Se desarrollaron 7 estenosis o trombosis, de las que 3 se sometieron a revisión quirúrgica.Ligadura de la arteria radial proximal
Bourquelot et al574, en un estudio prospectivo, incluyeron 37 pacientes (8 niños y 29 adultos) que se sometieron a la técnica de PRAL, para tratar alto Qa en FAV radiocefálicas: 2 por isquemia, 14 con la degeneración aneurismática de la vena, 7 por insuficiencia cardíaca y 14 para la prevención de la sobrecarga cardíaca. El Qa preoperatorio en los niños de 1.316ml/min y en los adultos de 1.736ml/min descendió un 50 y un 53%, respectivamente. Las tasas de permeabilidad primaria a 1 y 2 años fueron del 88 y el 74% y las de permeabilidad secundaria del 88 y el 78%, respectivamente.Transposición de la arteria radial
En otro estudio de Bourquelot et al448, en 47 pacientes con FAV realizada sobre la arteria braquial, a fin de conseguir una reducción en el Qa, realizaron la transposición de la arteria radial distal hasta la zona del codo, donde se anastomosa a la FAV, previamente desconectada de la arteria braquial. Las indicaciones para el tratamiento fueron isquemia de la mano (4), insuficiencia cardíaca (13), preocupación sobre la disfunción cardíaca futura (23) e hipertensión venosa crónica que resulta en la degeneración aneurismática de la vena (7). Se consiguió el éxito técnico en el 91%. La reducción media del Qa fue de un 66%, partiendo de un Qa medio de 1.681ml/min. El éxito clínico en pacientes sintomáticos fue del 75%. La FAV, sin embargo, tuvo que ser ligada en 3 casos de insuficiencia cardíaca debido a una mejoría clínica insuficiente. Las tasas de permeabilidad primaria a 1 y 3 años fueron del 61 y el 40% y las de permeabilidad secundaria a 1 y 3 años del 89 y el 7%.Cirugía reductora del flujo ecoguiada
Tellioglu et al661 analizaron el papel de la cirugía reductora del Qa mediante el control del Qa por medio de ED en 30 pacientes con FAV de alto Qa, 25 FAVn y 5 FAVp. Las indicaciones para la operación fueron insuficiencia cardíaca (n = 18) o SHD (n = 12). Las mediciones preoperatorias de la FAVn, de la FAVp y del diámetro de la anastomosis fueron: 2.663ml/min (rango, 1.856-3.440); 2.751ml/min (rango, 2.140-3.584) y 7,3mm (rango, 6,1-8,5), respectivamente. El QA se redujo a 615ml/min (rango, 552-810) para las FAVn y 805ml/min (rango, 745-980) para las FAVp. El diámetro medio de la anastomosis se redujo a 4mm (rango, 3,5-4,3mm). No hubo reintervenciones. Tras una mediana de 1 año de seguimiento, las tasas de permeabilidad fueron del 100% para las FAVn y del 80% para las FAVp. La tasa de GC se redujo de 8,5 a 6,1 l/min (p < 0,01).De la evidencia a la recomendación
El impacto del AV es proporcional al QA, mientras que el desarrollo de la sintomatología del fallo cardíaco y alto GC depende tanto del QA como de una adecuada capacidad de compensación cardíaca.
En caso de aparición de fallo cardíaco se debería sospechar que la FAV es, al menos, parcialmente responsable cuando al paciente le empeoran los síntomas cardíacos tras la creación de la FAV, en especial en AV de alto QA, habitualmente asociados con FAV proximales. Se considerarían unos valores elevados de QA cuando son > 2 l/min y una ratio QA/GC > 0,3. En el paciente asintomático puede incrementarse el riesgo de desarrollar un fallo cardíaco de alto gasto ante la presencia de estos valores, por lo que estos pacientes deberían ser estrechamente vigilados.
Asimismo, se debería vigilar la anemia, el peso seco y los factores adicionales que pueden causar una sintomatología similar en este tipo de pacientes, por lo que, en primer lugar, el enfoque terapéutico se debería basar en el manejo médico y en el tratamiento del exceso de volumen para, en una fase posterior, dirigirse a la reducción quirúrgica del QA y en caso de refractariedad a la ligadura de la FAV.
Aunque en series limitadas, las principales técnicas que han demostrado éxito en la reducción del Qa con mejoría de la clínica y supervivencia del AV de modo aceptable son las basadas en el banding o sus variantes y en la RUDI.
El estado cardiovascular basal del paciente debería tenerse en consideración previamente a la realización de una FAV. En pacientes en clase funcional III de la NYHA habría que individualizar la indicación de una FAV distal de modo preferible si no se puede hacer diálisis peritoneal o valorar la necesidad de un CVC, y los pacientes en clase IV de la NYHA serían tributarios de CVC así como de otra técnica de diálisis.
La ligadura rutinaria postrasplante, aunque ha presentado buenos resultados en la regresión de los índices de afectación cardíaca, no está estandarizada, por lo que, a pesar de los resultados favorables en este aspecto, se necesitan ensayos clínicos antes de hacer la ligadura de rutina en el paciente trasplantado estable.
R 5.7.1) Se sugiere la reducción del flujo de la fístula arteriovenosa mediante la revisión quirúrgica ante el paciente sin mejoría clínica tras manejo médico y con flujo sanguíeno > 2.000 ml/min y/o flujo/gasto cardíaco > 30%
R 5.7.2) En pacientes con fístula arteriovenosa de alto flujo e insuficiencia cardíaca atribuida a la fístula arteriovenosa se sugiere intervenir usando la técnica de banding o la técnica RUDI
CONTENIDO
6.1. Indicaciones
6.2. Selección del catéter
6.3. Inserción del catéter
6.4. Control de la cateterización
6.5. Manipulación del catéter
6.6. Seguimiento del catéter
6.7. Complicaciones del catéter
6.8. Disfunción del catéter
6.9. Infección relacionada con el catéterPreámbulo
La utilización de catéteres venosos centrales (CVC) ha aumentado progresivamente en los pacientes en hemodiálisis (HD); sin embargo, las indicaciones para su utilización deberían ser limitadas debido a las mayores complicaciones asociadas, tanto trombóticas como infecciosas.
A pesar de su morbimortalidad, el CVC continúa siendo un acceso vascular (AV) indispensable en todos los servicios de nefrología, debido, por un lado, a la posibilidad de utilización inmediata después de su inserción, lo que permite efectuar HD de urgencia en pacientes que presentan situaciones clínicas graves como la hiperpotasemia grave o el edema agudo de pulmón y, por otro, a que permite disponer de un acceso definitivo en los pacientes con el lecho vascular agotado.
6.1IndicacionesRecomendacionesR 6.1.1) Se recomienda la utilización de un catéter venoso central en pacientes con insuficiencia renal aguda o crónica agudizada cuando se precise de un acceso vascular para efectuar hemodiálisis de forma urgente
R 6.1.2) Se recomienda la colocación de un catéter venoso central ante una trombosis de la fístula arteriovenosa no recuperable hasta la realización de una nueva fístula arteriovenosa
(•) NUEVA R 6.1.3) En pacientes en los que no sea posible realizar una fístula arteriovenosa nativa se recomienda la realización de una fístula arteriovenosa protésica antes que la colocación de un catéter venoso central
R 6.1.4) Se sugiere la utilización de un catéter venoso central como acceso vascular en algunas circunstancias especiales: esperanza de vida inferior a 6 meses, estado cardiovascular que contraindique la realización de una fístula arteriovenosa, trasplante renal de donante vivo y deseo expreso del paciente
La utilización de un CVC constituye una alternativa a la fístula arteriovenosa (FAV) y, aunque el uso de un CVC es inadecuado, no hay duda que los CVC juegan un importante papel en el manejo de los pacientes que requieren HD. La primera razón para ello es que se pueden utilizar, al menos virtualmente, en cualquier paciente, que se colocan con facilidad y que están disponibles para su utilización inmediata tras la inserción. En la práctica clínica diaria encontramos dos tipos de CVC: a) catéteres venosos no tunelizados (CVNT), que se utilizan fundamentalmente en situaciones agudas, y b) catéteres venosos tunelizados (CVT), que se emplean habitualmente como AV de larga duración o permanente. Los CVNT ofrecen las siguientes ventajas: facilidad de colocación, inserción en la propia cama del paciente mediante la técnica de Seldinger estéril, no precisar tunelización, colocación rápida y mínimo trauma. Aunque proporcionan un menor flujo, la rapidez de acceso al lecho vascular y el no necesitar imagen los hacen muy útiles en situaciones de emergencia. Los CVT se desarrollaron en 1987 como una alternativa a los CVNT662,663. Son de mayor complejidad en su colocación y precisan de técnicas de imagen que aseguren la localización de su punta y la ausencia de acodamiento; pero presentan una menor tasa de complicaciones y alcanzan flujos más elevados, por lo que se consideran de elección para períodos prolongados.
Sin embargo, a pesar de las ventajas que puedan aportar los CVC, se asocian, asimismo, a una importante morbilidad. De ello se deriva la importancia de sentar claramente las indicaciones de uso y conocer las complicaciones derivadas y su tratamiento. Solo se deben utilizar en los pacientes en los que no sea posible el uso de una FAV nativa (FAVp) o una FAV protésica (FAVp), ya sea por imposibilidad de creación (ausencia de arterias con un flujo adecuado u oclusión del lecho venoso) o en espera de desarrollo y con contraindicación para diálisis peritoneal; ante una insuficiencia renal aguda, o en circunstancias especiales: deterioro reversible de la función renal que requiere HD temporal, esperanza de vida inferior a 6 meses, estado cardiovascular que contraindique la realización de AV, trasplante renal de donante vivo o deseo expreso del paciente.
Según diversas guías clínicas publicadas10,14, el CVC debe considerarse en la mayoría de los casos después de la FAVn y la FAVp a la hora de seleccionar el AV idóneo para iniciar programa de HD crónica. Además, algunas guías distinguen entre CVT y CVNT como “tercera opción” y “elección de necesidad”, respectivamente13. Si seguimos este orden de preferencia, la situación no es óptima en la mayoría de países industrializados32,664–667. El estudio multinacional europeo efectuado por Noordzij et al666 a partir de los datos del registro de la ERA-EDTA (European Renal Association-European Dialysis and Transplant Association) en 13.044 pacientes incidentes en HD, evidenció que la utilización de un CVC para iniciar programa de HD aumentó significativamente desde el 58% el año 2005 hasta el 68% el año 2009. En España, datos recientes procedentes del RMRC (Registre de Malalts Renals de Catalunya), referidos a casi 10.000 pacientes incidentes en HD, han puesto de manifiesto que aproximadamente el 50% de los enfermos con enfermedad renal crónica (ERC) inició el tratamiento mediante HD cada año en Cataluña a través de un CVC durante el período 2000-2011667. Los diversos factores involucrados en el exceso de CVC, tanto en el enfermo incidente como en el prevalente en HD, se han analizado previamente665 y algunos de ellos podrían neutralizarse incidiendo sobre los aspectos organizativos278,667. Por ejemplo, la tasa actual de CVC puede reducirse introduciendo la figura del coordinador del AV y/o priorizando la lista de espera quirúrgica668,669.
¿Por qué no debe considerarse el CVT como la primera opción de AV para la mayoría de pacientes? La respuesta es clara: por su mayor comorbilidad asociada95,630,670,671. Aplicando un modelo de riesgo competitivo multivariado se ha demostrado recientemente que, en relación con la FAVn, el riesgo de muerte por todas las causas a lo largo de los años es del 55 y el 43% superior para los enfermos que inician HD mediante un CVT y un CVNT, respectivamente630. Durante el período de máxima mortalidad de estos pacientes (primeros 120 días), el riesgo de muerte por todas las causas, de causa cardiovascular y de causa infecciosa es significativamente superior tanto para CVT como para CVNT en relación con la FAVn630.
En los últimos años se ha objetivado un cambio en el tipo de CVC utilizado para iniciar un programa de HD crónica. De esta forma, el uso del CVT en la primera sesión de HD aumentó progresivamente en Cataluña a partir del año 2002 a expensas de la disminución del porcentaje de CVNT667. De la misma manera, la proporción de pacientes incidentes en HD en Australia con un CVT aumentó desde el 39% en 2008 hasta el 42% en 2011 y, por el contrario, el porcentaje de enfermos que iniciaron HD con un CVNT disminuyó desde el 22% en 2008 hasta el 12% en 2011672. Este cambio en el tipo de CVC utilizado se puede atribuir, por una parte, a la generalización del procedimiento de tunelización del CVC y, por otro, a la demostración de un riesgo significativamente mayor de infección del CVNT con relación al CVT a los pocos días de su utilización, debido a la ausencia de túnel y de anclaje (cuff) al tejido subcutáneo667,673.
El CVC tiene sus indicaciones específicas como AV inicial. Se consideran tributarios de utilizar un CVT los enfermos con agotamiento o imposibilidad absoluta de cualquier tipo de FAV, arteriopatía periférica grave, hipotensión arterial crónica por su asociación con trombosis repetidas de la FAV (sobre todo de la FAVp), esperanza de vida inferior a 6 meses y miocardiopatía grave con función ventricular izquierda deprimida390,674,675. En este último caso, después de varias semanas de efectuar HD mediante un CVT, la función cardíaca se debe revalorar para identificar a los pacientes con mejoría de su estatus cardíaco que pueden beneficiarse de la construcción de una FAV675. Además, el CVT también se ha utilizado como un AV “puente” para dar tiempo a la maduración de una FAVn. En algunas ocasiones, debido a la premura existente, ha sido inevitable implantar un CVT y efectuar HD cuando el paciente incidente había escogido previamente la técnica de diálisis peritoneal o bien estaba pendiente de un trasplante de donante vivo.
El CVNT debería implantarse en el enfermo ERC, siempre de forma transitoria676, únicamente cuando es necesario efectuar tratamiento mediante HD sin demora en el paciente incidente sin FAV o con una FAV en período de maduración, o bien en el paciente prevalente que ha presentado una trombosis de su FAV sin posibilidad de rescate inmediato.
Es importante comprender y hacer comprender que un CVC es inferior a una FAV y no la sustituye. La realización precoz de una FAVn es la mejor manera de evitar las complicaciones producidas por los CVC.
→Pregunta clínica XXIV En el paciente sin posibilidad de fístula arteriovenosa nativa, ¿es el catéter venoso central el acceso vascular de elección frente a la fístula arteriovenosa protésica?
(Ver ficha de la Pregunta clínica XXIV en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Una revisión sistemática con metaanálisis de estudios observacionales muestra que, comparado con el uso de FAVp, el uso de CVC se asocia con peores resultados en mortalidad por cualquier causa, riesgo de infección mortal e infección no mortal, riesgo de padecer un episodio cardiovascular grave y de ser hospitalizado | Calidad baja |
La revisión sistemática de Ravani et al96 muestra la evidencia publicada hasta el año 2012 sobre el resultado de distintos tipos de AV; sin embargo, no hay ensayos clínicos que comparen directamente los diferentes tipos de AV.
En esta revisión se analizan distintos metaanálisis de estudios observacionales que muestran que los pacientes portadores de CVC tienen peores resultados que los que utilizan FAVp en cuanto a:
- •
Mortalidad por cualquier causa: 15 cohortes de 13 estudios, 394.992 pacientes (riesgo relativo [RR]: 1,38; intervalo de confianza [IC] del 95%, 1,25-1,52).
- •
Infección mortal: 11 cohortes de 10 estudios, 235.176 pacientes (RR: 1,49; IC del 95%, 1,15-1,93).
- •
Infección no mortal: 17 cohortes de 17 estudios, 13.121 pacientes (RR: 2,78; IC del 95%, 1,80-4,29).
- •
Episodio cardiovascular grave: 8 cohortes de 7 estudios, 234.819 pacientes (RR: 1,26; IC del 95%, 1,11-1,43).
- •
Hospitalización: 4 cohortes de 4 estudios, 56.734 pacientes (RR: 1,51; IC del 95%, 1,30-1,75).
Algunos autores destacan que en ocasiones la elección del AV no se realiza por criterios clínicos, sino por la experiencia de los profesionales y por la disponibilidad de cirujanos vasculares expertos y/o por equipos radiológicos, aumentando el número de CVC en pacientes incidentes y prevalentes677.
Se requieren estudios aleatorizados que comparen los resultados clínicos y los costes entre las FAVp y los CVC678.Uso de recursos y costes
James et al678 estimaban que, en el contexto canadiense, los costes medios de colocar y mantener el AV en pacientes incidentes para HD eran 13.543 dólares para una FVAp y 10.638 dólares para los CVC. Para el mantenimiento del AV, los costes eran de 5.866 y 3.842 dólares, respectivamente.De la evidencia a la recomendación
Aunque no se dispone de ensayos clínicos que comparen los resultados de la utilización de CVC y FAVp, tanto el estudio de Ravani et al como la bibliografía revisada, indican que el CVC debería ser la última elección como AV para pacientes con ERC debido a los peores resultados en todas las variables asociadas a morbilidad y mortalidad”. Por este motivo, ante la imposibilidad de construir una FAVn, el Grupo Español Multidisciplinar del Acceso Vascular (GEMAV) recomienda realizar una FAVp para evitar la colocación de un CVT.
6.2Selección del catéterRecomendacionesNUEVAR 6.2.1) Se recomienda que la longitud del catéter venoso central tunelizado colocado en las venas centrales superiores sea la adecuada para situar la punta en la aurícula derecha, y en las inferiores para colocar la punta al menos en el interior de la vena cava inferior
(•) nueva R 6.2.2) Se recomienda el uso de un catéter venoso central no tunelizado en situaciones en las que se prevea una permanencia de este no superior a las 2 semanas. Para períodos más prolongados se recomienda el uso del catéter venoso central tunelizado
(•) nueva R 6.2.3) No se puede recomendar de manera preferente ningún modelo o tipo de catéter venoso central tunelizado para hemodiálisis
El CVC para HD tiene como función acceder a la circulación sanguínea, para conseguir un flujo sanguíneo suficiente y continuo que facilite una HD adecuada. En las últimas décadas se han desarrollado nuevos diseños en los CVC que han facilitado su colocación y tunelización subcutánea, obteniendo flujos sanguíneos superiores y mejor adaptación para su utilización en períodos de larga duración.
En la actualidad, los CVC para HD se suelen clasificar en CVNT, para un uso inferior a 2 semanas, y CVT, con las mismas indicaciones para períodos prolongados. La razón de esta división se basa en el hallazgo de un mayor número de complicaciones infecciosas y no infecciosas en los CVNT673,679–681. El uso de CVNT se reserva para pacientes que necesiten HD en los que sea previsible una utilización inferior a 2 semanas, período a partir del cual aumenta la incidencia de infecciones673. Se ha sugerido, por otro lado, el uso preferente de CVT en vez de CVNT en casos de insuficiencia renal aguda, al proporcionar una mayor eficacia de HD, menos complicaciones y un menor número de recambios682, y reservar el CVNT para pacientes con sospecha de septicemia.
En los últimos años, también se ha sugerido que aplicar diferentes estrategias relacionadas con la colocación y cuidados del CVNT puede disminuir el número de complicaciones683.
Los CVNT suelen estar compuestos de materiales como el polivinilo, el polietileno o el poliuretano. Estos materiales son de consistencia relativamente dura a temperatura ambiente, lo que permite su progresión por el tejido subcutáneo y facilita su colocación mediante una guía metálica sin precisar vaina introductora, mientras que a temperatura corporal se reblandecen y se hacen más flexibles minimizando el riesgo de daño en la pared vascular684. En menor número están compuestos de silicona, material que les confiere menor rigidez pero mayor complejidad en su colocación. La longitud de los CVNT suele oscilar entre los 15 y los 25cm, con un diseño de doble luz y punta cónica (luz proximal de la rama arterial separada de 2 a 3cm de la luz distal de la rama venosa para disminuir la recirculación)685y de forma óptima pueden ofrecer f lujos sanguíneos > 300ml con presiones venosas < 200mmHg. Su forma puede ser recta o precurvada para disminuir el riesgo de acodamiento en el punto de salida cutáneo y con extensiones rectas o curvadas según la vena a canalizar (curvadas para yugular y subclavia y rectas en femoral). Tienen la ventaja de que pueden ser colocados en la cama del paciente y ser utilizados de forma inmediata.
Los CVT suelen ser de silicona o de poliuretano termoplástico y sus derivados, como el Bio-Flex o el carbotano (copolímero), cuyo uso es cada vez más generalizado. Su longitud es variable según la vena que se canaliza y el tipo de catéter. Suelen llevar un rodete de Dacron o poliéster en su parte extravascular, que tiene como objeto provocar fibrosis para impedir el paso de agentes infecciosos y actuar como anclaje en el tejido subcutáneo. Son CVC más blandos y flexibles que minimizan el daño sobre la íntima de las venas, biocompatibles, no trombogénicos y resistentes a los cambios químicos, lo cual aumenta su longevidad y disminuye en número sus complicaciones. Los nuevos copolímeros del poliuretano proporcionan flexibilidad, manteniendo la resistencia de sus paredes, lo que permite una mayor luz interna y mayor flujo que los CVC de silicona sin necesidad de aumentar su calibre686.
Es importante conocer el material utilizado para la fabricación del CVC, ya que existen determinadas soluciones antibióticas o antisépticas que se usan habitualmente y que son incompatibles con este. El alcohol, el polietilenglicol, que contiene la crema de mupirocina, o la povidona yodada interfieren con el poliuretano y pueden romper el CVC, mientras que copolímeros como el carbotano son resistentes al alcohol y al yodo. La povidona yodada también interfiere con la silicona, produciendo su degradación y rotura682,687.
Existen CVC con revestimientos de productos anticoagulantes, antisépticos o antibióticos que tienen como objeto minimizar los riesgos de trombosis y de infección. Se han comunicado experiencias que muestran la efectividad de esta estrategia, pero solo en CVNT utilizados en pacientes críticos y períodos limitados. No existen evidencias que apoyen su uso sistemático en población de HD con CVT de larga duración688.
La longitud de los CVC para HD dependerá de la vena a canalizar y la situación clínica del paciente. Los CVNT suelen medir entre 15 y 20cm para su colocación en vena yugular interna o subclavia derechas, y de 20 a 24cm en vena yugular interna o subclavia izquierdas. Longitudes inferiores podrían provocar riesgo de lesión por decúbito en la pared de la vena cava superior. Si se utiliza la vena femoral, el CVC debería ser lo suficientemente largo, entre 20 y 24cm, para evitar una recirculación significativa y poder alojar la punta en la vena cava inferior687.
Los CVT tienen longitudes superiores debido al tramo subcutáneo, que oscilan entre los 20 y los 50cm según la vena a canalizar. La longitud deberá ser la adecuada para situar la punta de este en la aurícula derecha (AD), en los colocados a través de las venas centrales superiores (en los CVNT de silicona también se ha sugerido que la punta se sitúe en esta localización)689y para los colocados por vía femoral, al menos en el interior de la vena cava inferior685.
El diseño del CVC puede ser de doble luz (con ambas luces simétricas en doble D o en doble O o con la luz arterial circular y la venosa en semiluna), de doble luz pero divididos en su parte distal, dos catéteres únicos separados, dobles sobre un anclaje común y dispositivos implantables con reservorios subcutáneos690. Las luces de sección circular tienen la ventaja de no colapsarse en los acodamientos o ante presiones muy negativas. Como desventaja, el calibre interno suele ser menor para un mismo calibre externo. La configuración de la luz en doble D sería la que permitiría obtener mejores flujos con menor resistencia por superficie de contacto682.
Actualmente existen en el mercado diferentes CVC precurvados con distintas longitudes para poder adecuarse al tamaño del paciente. La mejora y facilidad en su colocación, con disminución del tiempo de intervención, es una ventaja a tener en cuenta, así como la disminución en el número de acodamientos y la mejora en su funcionamiento.
Otras características del diseño están relacionadas con la punta del CVC. Pueden tener una configuración en doble O (cañón de escopeta), coaxial, puntas separadas, en escalón o espiral en “Z”, todas ellas con y sin orificios laterales686,690–692.
El diseño y material de las extensiones y conexiones debe ser muy resistente para evitar erosiones y roturas producidas por la acción de las pinzas de cierre. Dependiendo del tipo de CVC existen complementos de conexión, tanto para el momento dela inserción como para su sustitución en caso de desperfecto.
Aunque existen múltiples estudios comparativos entre diferentes tipos de catéteres que valoran la composición y la morfología de su punta, no han logrado demostrar diferencias significativas entre ellos que sugieran la utilización de un modelo frente a otro685,691,693–696.
Pacientes con una obstrucción venosa central que impida la realización de un AV en la extremidad superior, pueden beneficiarse de un dispositivo híbrido prótesis-catéter tunelizado (hemodialysis reliable outflow —HeRO— device). Consiste en un AV que se crea de forma mixta. Por una parte se trata de un catéter permanente que se tuneliza a través de una obstrucción o estenosis venosa central, que se halla conectado a una prótesis de PTFE (politetrafluoroetileno) que se anastomosa a nivel de la arteria humeral, de modo que la zona de punción es la prótesis que se encuentra tunelizada subcutáneamente y el drenaje distal se efectúa directamente en la aurícula. (v. punto 2.4.2. de la guía en el apartado 2).
Estudios observacionales han mostrado tasas inferiores de infección que los CVT, con permeabilidades primaria y secundaria similares a las observadas en las FAVp, pero al ser una técnica relativamente reciente no se dispone de ensayos clínicos aleatorizados (ECA) que avalen su utilidad y seguridad. De ello se deduce que su uso queda limitado a un reducido número de pacientes con imposibilidad de realizar una FAVn o una FAVp en miembros superiores y con estenosis y/u oclusiones centrales recuperables, preservando el lecho vascular venoso de los miembros inferiores143,177,697–700.
→ Pregunta clínica XXV ¿Existen diferencias en la indicación de utilizar catéteres venosos centrales no tunelizados frente a los tunelizados?
(Ver ficha de la Pregunta clínica XXV en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| La utilización de CVT y CVNT varía sustancialmente, dependiendo de la situación clínica de los pacientes. Este hecho dificulta el poder diseñar correctamente estudios que comparen el resultado de ambos tipos de CVC. Análisis observacionales muestran mayores tasas de complicación con el uso de CVNT en comparación con el CVT, principalmente a expensas de infecciones y retiradas adelantadas. En una de las series más amplias, Weijmer comparó 37 CVT con 235 CVNT; la necesidad de retirar el CVC por cualquier complicación y la tasa de infección fueron superiores en los CVNT, y la supervivencia del CVC y la supervivencia libre de infección fueron mejores para los CVT a partir de las primeras 2 semanas de la colocación | Calidad baja |
El estudio observacional de Weijmer et al673 analizó los resultados de 272 CVC (37 CVT y 235 CVNT) en 149 pacientes y con un tiempo de utilización de 11.612 días de catéter.
Los pacientes con CVNT presentaron como característica diferencial el diagnóstico de insuficiencia renal aguda (el 40 frente al 8% de los CVT; p < 0,001) y sus tasas de hospitalización más altas (el 54 frente al 14%; p < 0,001). Los resultados de comparación fueron:
- •
Retirada del CVC por cualquier complicación: retirados el 45,5% (107 de 235) de CVNT por el 28,7% (11 de 37) de los CVT (p < 0,001, análisis log-rank). Las tasas fueron de 1,80 por 1.000 días de catéter para los CVT y 19,48 para los CVNT (RR: 10,83; IC del 95%, 5,82-20,15; p < 0,0000001).
- •
Supervivencia del CVC: el análisis de la supervivencia actuarial fue mejor para los CVT (el 95% a los 14 días, el 95% a los 21 días y el 95% a los 28 días) que para los CVNT femorales (el 42% a los 14 días, el 37% a los 21 días y el 32% a los 28 días; p < 0,001 para todos los períodos) y que para los CVNT yugulares (el 75% a los 14 días, el 69% a los 21 días y el 58% a los 28 días; p < 0,05 para todos los períodos).
- •
Infección:
- –
Bacteriemia: tasas por 1.000 días de catéter: 1,6 para CVT y 4,6 para CVNT (RR: 2,67; IC del 95%, 1,28-5,59; p = 0,006).
- –
Infecciones en orificio de salida del catéter: tasas por
- –
días de catéter: 1,3 para CVT y 8,2 para CVNT (RR: 6,26; IC del 95%, 3,04-14,22; p < 0,000001).
- –
Supervivencia de catéter libre de infección: fue mejor para los CVT (el 91% a los 14 días, el 89% a los 21 días y el 89% a los 28 días; p < 0,05 para todos los períodos) que para los CVNT yugulares.
- –
Después de ajustar por distintas características clínicas de los pacientes, el factor de riesgo más importante para la retirada del catéter (RR: 9,69; p < 0,001) y para la infección (RR: 3,76; p < 0,001) era tener un CVNT.
Concluyen que, de acuerdo con esos resultados, debe utilizarse un CVT siempre que se pueda prever la necesidad de un CVC de HD durante más de 14 días.
La revisión de Frankel679 sobre el CVNT incide sobre las indicaciones en las que se requiere el acceso inmediato a la circulación sanguínea:
- •
Pacientes que presentan deterioro reversible de la función renal que requiere HD temporalmente.
- •
Pacientes cuya insuficiencia renal terminal no ha sido diagnosticada previamente y que requieren HD urgente o mientras se espera la realización o maduración de un AV permanente.
- •
Como una modalidad de transición cuando el acceso de un paciente ha fracasado, ya sea la FAV o la diálisis peritoneal.
Frankel señala que el uso de los CVT tiene una tasa significativamente menor de infección que los CVNT (8,42 frente a 11,98 casos por cada 100 meses de catéter, respectivamente) y debe ser el medio preferido para proporcionar un AV temporal por períodos de más de 2 semanas.
El estudio de Kukavica et al680 comparó 16 pacientes tratados con CVT frente a 15 tratados con CVNT (seguimiento durante 36 meses) y encontró la necesidad de recambiar 24 CVNT debido a complicaciones trombóticas frente a solo dos en los pacientes con CVT. Asimismo observó que el flujo medio en pacientes con CVT fue significativamente superior (296ml/min) comparado con los de CVNT (226ml/min) (p < 0,001).De la evidencia a la recomendación
Aunque no se han encontrado estudios aleatorizados que comparen directamente los resultados de ambos tipos de catéteres, análisis observacionales muestran mayores tasas de complicación con el uso de CVNT en comparación con los CVT. El GEMAV, a pesar de tratarse de una evidencia débil, decide recomendar la utilización de CVNT para períodos no superiores a las 2 semanas y de CVT para períodos más prolongados.
→ Pregunta clínica XXVI ¿Cuál es el mejor material y diseño para un catéter venoso central tunelizado?
(Ver ficha de la Pregunta clínica XXVI en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Los principales biomateriales para la construcción de los CVT son actualmente la silicona, el poliuretano y sus copolímeros como el carbotano. Suelen disponer de un manguito de Dacron para su anclaje subcutáneo y tienen diferentes diseños de luces y de puntas, con y sin agujeros laterales. En las revisiones generales de Tal y Ni686 y Ash691 se describen los diferentes materiales y diseños, así como las combinaciones posibles de las luces y las puntas. Se han localizado algunos ECA que comparan distintos tipos de CVC entre sí, o algún tipo de CVC frente a un sistema especial de acceso (LifeSite), pero la evidencia disponible que proviene de pocos ECA y pocos pacientes no permite recomendar de manera preferente ningún tipo de CVC de los comparados en los estudios, ni concluir que un material, modelo de CVC o marca concreta sea superior a otros | Calidad baja |
El ECA de Hwang et al701 comparó un CVC con diseño espiral en “Z” de la punta (Palindrome = 47) frente a un CVC con diseño escalonado (step-tip = 50) en 97 pacientes seguidos durante 2 meses. Los resultados mostraron:
- •
La tasa de supervivencia libre de disfunción del CVC fue significativamente mayor para el CVC Palindrome que para el CVC step-tip (el 78,9 frente al 54,4% a los 2 meses; p = 0,008).
- •
La tasa global de supervivencia del CVC fue también mayor para el CVC Palindrome que para el CVC step-tip (el 90,6 frente al 68,8% a los 2 meses; p = 0,015).
No se produjeron casos de bacteriemia durante el estudio.
Los autores concluyen que ambos CVC son igualmente efectivos en adecuación del flujo para la HD y que tienen baja recirculación.
El ECA de Trerotola et al693 comparó 2 CVC de poliuretano, uno con diseño de punta dividida o split-tip (AshSplit) y el otro con punta escalonada o step-tip (OptiFlow), en 132 pacientes seguidos durante 6 meses. Los resultados mostraron que:
- •
La supervivencia del CVC a los 6 meses fue superior para el CVC AshSplit (22 de 64 = 34,4%) que para el OptiFlow (16 de 68 = 23,5%), diferencia significativa (log-rank test p = 0,02).
- •
Las infecciones relacionadas con el CVC eran menores para el CVC AshSplit (9 de 64 = 14,1%) que para el OptiFlow (15 de 68 = 22,1%), pero la diferencia no era significativa (RR: 0,64; IC del 95%, 0,30-1,36; p = 0,24). Las tasas de infección por 100 días de catéter fueron de 0,12 y de 0,22, respectivamente.
- •
Las infecciones que ocasionaron retirada del CVC eran menores para el CVC AshSplit (6 de 64 = 9,4%) que para el OptiFlow (11 de 68 = 16,2%), pero la diferencia no era significativa (RR: 0,58; IC del 95%, 0,23-1,47; p = 0,26).
Ambos CVC conseguían flujos dentro del rango aceptable indicado por la Diálisis Outcomes Quality Initiative —DOQI— (300ml/min).
El ECA de Trerotola et al695 comparó un CVC de silicona con diseño de punta escalonada (Hickman 13,5 F) con un CVC de poliuretano de punta dividida (AshSplit 14,5 F) en 24 pacientes seguidos durante 6 semanas, de los cuales solo 19 terminaron el estudio. Los resultados mostraron que el catéter de punta dividida obtuvo flujos sanguíneos superiores y menor recirculación, aunque ambos CVC conseguían f lujos dentro del rango aceptable indicado por la DOQI (300ml/min) y recirculaciones medias < 6%. Las complicaciones derivadas de la inserción se limitaron al grupo del CVC AshSplit.
El ECA de Atherikul et al702 comparó 3 CVC con diferente diseño de sus luces: doble luz en cañón de escopeta (PermCath = 22), dos luces individuales separadas (Tesio = 24) y luz circular individual separada por un tabique central en doble D (VasCath Soft Cell = 18) en 64 pacientes. Se estudió el flujo sanguíneo medio, el porcentaje de sesiones de HD con flujo sanguíneo ≥ 350ml/min en 30 tratamientos consecutivos, la adecuación de las sesiones y la recirculación. Los resultados fueron los siguientes:
- •
Flujos medios de sangre: PermCath, 383,6ml/min; Tesio, 396,3ml/min; VasCath, 320,4ml/min. PermCath y Tesio tuvieron flujos similares y significativamente mayores que VasCath (p < 0,005).
- •
Porcentaje de sesiones con flujos ≥ 350ml/min: PermCath, 86,9%; Tesio, 81,6%; VasCath, 42,3%. PermCath y Tesio obtuvieron resultados similares, que fueron significativamente mayores que VasCath (p < 0,005).
- •
Recirculación y adecuación (Kt/V: cantidad de plasma depurado de la urea [K] durante el tiempo de la sesión de HD [t] en relación con el volumen de distribución de la urea [V]) adecuados en los 3: PermCath, 3,7% y 1,42; Tesio, 3,9% y 1,39; VasCath, 4% y 1,32.
No se proporcionan datos sobre infección o disfunción del CVC.
Los autores concluyen que los tres tipos de CVC proporcionan una HD adecuada, obtienen igual porcentaje de sesiones con flujo sanguíneo de 300ml/min y aceptables adecuación y recirculación.Sistema de acceso subcutáneo implantable de hemodiálisis LifeSite frente a catéter Tesio-Cath
El ECA de Rosenblatt et al694 comparó el sistema de acceso subcutáneo implantable de HD (LifeSite) frente al CVC de dos luces individuales separadas (Tesio), en 68 pacientes seguidos durante 1 año. Los resultados mostraron:
- •
Supervivencia del CVC al año: el 74% para el sistema LifeSite por el 48% para el CVC Tesio, diferencia no significativa (log-rank test p = 0,062). Tras ajustar por distintas covariables, la diferencia pasaba a ser significativa (p = 0,039).
- •
Tasa de infecciones por 1.000 días de catéter: 3,1 para el sistema LifeSite por 6,6 para el CVC Tesio (p = 0,008).
- •
Tasa de bacteriemia relacionada con el dispositivo por 1.000 días de catéter: 1,9 para el sistema LifeSite por 3,4 para el CVC Tesio (p = 0,013).
El ECA de Schwab et al696 comparó el sistema de acceso subcutáneo implantable de HD (LifeSite) frente al catéter Tesio en 70 pacientes seguidos durante 6 meses. Los resultados mostraron:
- •
Supervivencia del CVC a los 6 meses: inferior con el sistema LifeSite (64,8%) que con el CVC Tesio (69,1%), tras estratificar por diabetes y ajustar por edad.
- •
Tasa de bacteriemias relacionadas con el dispositivo por1.000 días de catéter: 3,4 para el sistema LifeSite por 3,3 para el CVC Tesio.
El flujo sanguíneo era ligeramente mayor con el sistema LifeSite que con el CVC Tesio (358,7 frente a 331,8ml/min).De la evidencia a la recomendación
La evidencia disponible, proveniente de comparaciones entre modelos de CVC con pocos ECA y pocos pacientes, no es suficiente para recomendar de manera preferente ningún modelo o tipo concreto de CVT para HD.
6.3Inserción del catéterLa inserción de un CVC para HD es una técnica no exenta de riesgos. La frecuencia de aparición de complicaciones es muy variable entre distintas unidades, dependiendo sobre todo de la experiencia y, en menor grado, de las condiciones del entorno en el que se implanta el CVC. La utilización de la ecografía para la canalización venosa central ha significado una disminución de las complicaciones.
RecomendacionesR 6.3.1) Se recomienda que el procedimiento de la colocación del catéter venoso central sea realizado por personal médico cualificado con experiencia y familiarizado con la técnica
R 6.3.2) Se recomienda que los catéteres venosos centrales tunelizados sean colocados en condiciones asépticas y en una sala con control de imagen (radioscopia en tiempo real y ecografía) y control de la posición definitiva con imagen radiológica
R 6.3.3) Se recomienda, como primera localización de un catéter venoso central tunelizado, la vena yugular interna derecha
R 6.3.4) Se sugiere como primera localización de un catéter venoso central no tunelizado la vena femoral común en situación de urgencia
R 6.3.5) Se recomienda evitar canalizar las venas subclavias en los pacientes que vayan a necesitar una fístula arteriovenosa
R 6.3.6) Se sugiere no colocar catéteres venosos centrales en las venas yugulares o subclavias ipsilaterales al miembro donde exista una fístula arteriovenosa en fase de maduración
(•) NUEVA R.6.3.7) Se recomienda que la colocación de un catéter venoso central para hemodiálisis se realice guiada por ultrasonidos
Los CVC deben ser implantados por personal médico cualificado y que haya demostrado suficiente experiencia; algunos autores cifran esta experiencia en al menos 50 cateterizaciones durante la formación y 30 procedimientos anuales, para el mantenimiento de la competencia703–705. La progresiva implicación de los radiólogos y el uso de técnicas de imagen en este campo706 se han traducido en buenos resultados, aunque limitados a países en los que previamente los colocaban los cirujanos707–712. Los mejores resultados obtenidos en estas series son achacables a las diferentes condiciones de realización y medios técnicos. La colocación por punción y no por disección, la utilización de ultrasonidos para la canalización venosa y el uso de imagen en tiempo real para control del posicionamiento de la punta del CVC y ausencia de acodamientos son los aspectos que pueden marcar esa diferencia713,714.Lugar del procedimiento
El posicionamiento correcto de los CVT ha mejorado con la utilización de la imagen como guía en su colocación. Permite confirmar la punción en la vena elegida y el preciso posicionamiento del CVC en su trayecto intravascular. Por ello es imprescindible contar con equipos de imagen fluoroscópica altamente cualificados no solamente para una exacta localización mediante la imagen, sino para emitir la mínima radiación, tanto para el paciente como para los profesionales implicados en el proceso. La sala donde se ubique el aparato de fluoroscopia digital debe contar con un equipo de ultrasonografía tecnológicamente adecuado para alcanzar con seguridad y precisión la vena elegida para ser puncionada713,714.
La inserción del CVT debe realizarse en un ambiente quirúrgico (quirófano o sala con condiciones similares de asepsia), para minimizar el riesgo de infección.
Además de los requisitos mencionados, y dado que este tipo de procedimiento precisa de una preparación previa del paciente, debe contarse también con los siguientes:
- •
Un área apropiada adyacente a la sala/quirófano con escopia digital, donde preparar al paciente antes del procedimiento y para su control posterior. Esta área debe contar con personal y equipo apropiados para resolver cualquiera de las posibles complicaciones agudas ocurridas tras el procedimiento.
- •
Acceso inmediato a un equipo de resucitación de emergencia incluyendo fármacos. Este equipamiento debe ser chequeado periódicamente para comprobar que está completo y actualizado.
- •
Medicación apropiada para el tratamiento de las posibles complicaciones agudas.
- •
Equipo para el tratamiento de un neumotórax.
- •
Apoyo en un tiempo razonable por parte de un equipo quirúrgico en caso de complicaciones agudas graves.
En los procedimientos en que se administren fármacos o se incluya sedación debe contarse con equipos de monitorización de frecuencia cardíaca, saturación de oxígeno y presión arterial. Debe contarse, asimismo, con suministro de gases médicos, equipos de intubación y de ventilación, desfibrilador y un equipo y fármacos de resucitación de emergencia.
La colocación de un CVNT femoral en la propia cama del paciente debe evitarse siempre que sea posible, tanto por asepsia como por las dificultades técnicas derivadas de la poca rigidez del colchón y de la mala postura del médico que realiza la inserción, y se debe reservar para situaciones de urgencia en las que no existe disponibilidad de una sala adecuadamente dotada.Localización
Las venas generalmente canalizadas en los CVT son, por este orden, venas yugulares internas derecha e izquierda, venas femorales derecha e izquierda y venas subclavias derecha e izquierda. Excepcionalmente se ha utilizado la vena cava inferior715, las colaterales tirocervicales716, la vena yugular externa717,718, la vena safena y la arteria aorta por punción translumbar719; otras venas a utilizar son las suprahepáticas y las venas gonadales.
En el paciente con ERC, la vena subclavia debe canalizarse solo cuando las demás vías hayan sido agotadas, ya que se asocia con un aumento de incidencia de estenosis685,717,720. La incidencia de estenosis en vena subclavia secundaria a la colocación de un catéter la han comunicado varios autores entre el 42 y el 50%. En contraste, el porcentaje de estenosis en el tronco innominado debido al uso de la vena yugular interna se comunica que es del 0-10%717,721. En los casos en los que se vaya a realizar una FAV en un brazo concreto debe evitarse la utilización de las yugulares (y mucho menos la subclavia) de ese lado.
La inserción del CVNT puede realizarse en la vena yugular interna o bien en la vena femoral común. Ambas localizaciones presentan potenciales beneficios y riesgos, como el menor riesgo de infección en el área yugular o el menor riesgo de complicaciones durante la colocación en el territorio femoral. Se ha sugerido utilizar en primer lugar la vena femoral común, por presentar principalmente menores complicaciones en relación con su colocación respecto a la vena yugular interna. En un ensayo clínico controlado en 750 pacientes con enfermedad grave, encamados y con requerimiento de colocación de un primer CVNT se observa que la cateterización de la vena yugular interna no parece reducir el riesgo de infección comparado con el acceso femoral, excepto en adultos con alto índice de masa corporal (IMC), y asimismo presenta un riesgo similar de complicaciones relacionadas con el catéter (trombosis, vainas de fibrina) y una mayor proporción de complicaciones en relación con la canalización, como la aparición de hematomas722.
Por otro lado, frente a estas recomendaciones, hay otros aspectos que deben tenerse en cuenta antes de la elección del acceso. En la revisión realizada por Clark y Barsuk683, en una serie de pacientes de diferente procedencia en los que se incluye el paciente renal, se establecen los factores a favor de los diferentes sitios de inserción:
Vena yugular interna derecha:
- •
Paciente crítico y encamado con IMC > 28.
- •
Postoperatorio de reparación de aneurisma aórtico.
- •
Paciente ambulatorio/necesidad de movilidad para su rehabilitación.
Venas femorales:
- •
Paciente crítico y encamado con IMC < 24.
- •
Portador de traqueostomía o con necesidad de realización.
- •
Necesidad de diálisis urgente junto a inexperiencia del operador o ausencia de control ecográfico.
Vena yugular interna izquierda:
- •
Contraindicaciones para accesos en vena yugular interna derecha y venas femorales.
Venas subclavias:
- •
Contraindicación de accesos yugulares y femorales.
- •
Utilizar preferentemente el lado derecho.
Por todo ello, en el paciente en condiciones de cierta gravedad o situación de urgencia, se podría considerar inicialmente la opción del abordaje femoral para la colocación del CVNT.
La vena yugular interna es la vena elegida más frecuentemente para la colocación del CVT debido a su fácil acceso y al menor número de complicaciones703,723,724. El segundo lugar de elección está sujeto a controversia y está en relación con las características anatómicas y funcionales del paciente, si bien muchos autores consideran la vena femoral común como una alternativa cuando no es posible la colocación en venas yugulares, aun siendo su permeabilidad primaria inferior (44% al mes) y mayor la tasa de infecciones (63/1.000 días de catéter)723,725. La flebografía y/o ecografía previas son muy recomendables en los casos en que se haya colocado CVC o se haya realizado FAV previas695,703,704,726.
Para evitar acodamientos del CVC en el caso de los CVT y molestias al mover el cuello en el caso de los CVNT es recomendable el abordaje de la yugular en su parte baja, por detrás del esternocleidomastoideo o por el hueco entre las inserciones esternal y clavicular de este músculo.Cuándo colocar el catéter venoso central
Los CVNT deben colocarse en el mismo día que vayan a ser utilizados para la HD; los CVT pueden colocarse inmediatamente antes de ser utilizados, pero parece prudente hacerlo de 24 a 48h antes685,687,690,712,727. Los CVC de poliuretano utilizados inmediatamente tras su colocación presentan a menudo dificultades para alcanzar un flujo adecuado, las cuales desaparecen espontáneamente a las 24h.Técnica de tunelización
En el caso de los CVT, la técnica empleada suele ser similar en función de la vena a canalizar, aunque varía según el tipo de CVC a emplear. Una vez localizada e identificada la vena y tras el empleo de antisépticos durante al menos 3min sobre el lecho quirúrgico (el uso de clorhexidina al 0,5% como preparatorio de la piel en cirugía limpia se asocia a una menor tasa de infecciones frente a la povidona yodada; RR: 0,47; IC del 95%, 0,27-0,82)728, se anestesia la piel y el tejido circundante. Se recomienda no rasurar la piel por el traumatismo ocasionado, anestesiar solamente el tejido cutáneo en las zonas de punción yugular y en la incisión previa a la realización del túnel. No suele precisarse la anestesia sobre el tejido celular subcutáneo al carecer de terminaciones nerviosas.
La sonda ecográfica, introducida en una bolsa estéril, localiza la vena a puncionar. La utilización de ultrasonidos es altamente recomendable dada la menor tasa de complicaciones durante la canalización y el mayor porcentaje de éxitos al valorar la situación y tamaño de la vena, su permeabilidad y confirmar la posición de la punta de la aguja en todo momento729–731.
La punción de la vena se realizará preferentemente con un set de micropunción y en proximidad, en el caso de elegirse la vena yugular interna, a la clavícula. Punciones más altas favorecen el acodamiento del CVC y resultan muy incómodas para el paciente.
Una vez verificada la posición de la aguja por aspiración y avanzada la microguía (0,021 in) se procede a recambiarla por el sistema introductor. Si es preciso medir la distancia entre punción y AD antes de la elección del CVC, puede utilizarse la microguía una vez posicionada su punta en el lugar elegido. Debe tenerse en cuenta que la posición debe ser al menos 2cm por debajo del sitio ideal al producirse un ascenso del CVC cuando el paciente cambie su postura a la bipedestación o la sedestación714.
Una vez elegido el sitio de entrada en el túnel sobre la pared del tórax (el manguito de Dacron debe quedar situado al menos a 3cm de la incisión; la curva de entrada en el sistema vascular debe ser suave para evitar acodamientos) y realizada una pequeña incisión de entrada para el túnel, se procede a tunelizar habiendo conectado previamente el CVC al extremo del tunelizador y empujando suavemente hasta posicionar el CVC adecuadamente.
Se introduce una guía de 0,035″ en el sistema introductor, retiramos este y procedemos a colocar un introductor pelable del calibre adecuado al CVC elegido una vez dilatado el trayecto de entrada. Muchos introductores pelables incorporan una válvula en el sitio de inserción, que previene la entrada de aire y de este modo la embolia gaseosa, por lo que se recomienda su uso.
Tras la retirada de la guía, se inserta la punta del CVC en el introductor avanzando hasta situarlo en AD y, a continuación, se retira el introductor pelable. Debe confirmarse mediante fluoroscopia la posición de la punta y la ausencia de acodamientos, y mediante aspiración de ambas luces su correcto funcionamiento. Tras el lavado, ambas luces deben ser purgadas y rellenadas con la solución de sellado elegida (heparina, citrato, etc.). Se finaliza el procedimiento tras la fijación a la piel con sutura no reabsorbible y colocación de vendaje estéril.
→ Pregunta clínica XXVII ¿Debe utilizarse los ultrasonidos como estándar de referencia en la colocación del catéter venoso central?
(Ver ficha de la Pregunta clínica XXVII en enlaces electrónicos)Razonamiento
La inserción de los CVC puede realizarse mediante el uso de los puntos anatómicos de referencia o con ayuda de la ecografía. Se ha sugerido que el uso de la colocación ecoguiada reduce las complicaciones inmediatas, principalmente las relacionadas con la punción arterial o neumotórax.
Algunos autores han demostrado un 27% de variaciones anatómicas de la vena yugular interna respecto a la arteria carótida732,733 y otros han reflejado la ausencia o la trombosis total de la vena yugular interna en el 18% de los pacientes en diálisis cuando han sido examinados con ultrasonidos685. Por ello, el empleo de técnicas de imagen en la colocación de accesos centrales (ecografía, fluoroscopia, etc.) es altamente recomendable.
| Resumen de la evidencia | |
|---|---|
| Un metaanálisis de 7 ECA muestra que la colocación del CVC guiada por ultrasonidos tiene mejores resultados que la inserción basada únicamente en puntos anatómicos de referencia con relación al número de CVC insertados con éxito en el primer intento, a la reducción del riesgo de punción arterial y hematomas y un menor tiempo necesario para la punción exitosa de la vena | Calidad alta |
La revisión Cochrane con metaanálisis de Rabindranath et al730 identificó 7 ECA que incluían a 767 pacientes con 830 inserciones de CVC, 5 de ellos realizados en territorio yugular, 1 en femoral y 1 en ambos. Tres de los 7 estudios describieron el método de generación de la secuencia aleatoria, ninguno describió el ocultamiento de la asignación, y el cegamiento de los participantes y el personal no era posible.
A continuación se presentan los resultados principales, que muestran para todas las variables analizadas que la colocación guiada por ultrasonidos es mejor técnica y clínicamente mejor que la inserción basada únicamente en puntos anatómicos de referencia; las diferencias son estadísticamente significativas en todos los casos excepto para el riesgo de neumotórax o hemotórax.
- •
Riesgo total de fracaso en la colocación del CVC: 7 estudios, 830 catéteres (RR: 0,11; IC del 95%, 0,03-0,35).
- •
Riesgo de fracaso en la colocación del CVC en el primer intento:5 estudios, 705 catéteres (RR: 0,40; IC del 95%, 0,30-0,52).
- •
Riesgo de punción arterial: 6 estudios, 785 CVC (RR: 0,22; IC del 95%, 0,06-0,81).
- •
Riesgo de hematomas: 4 estudios, 323 CVC (RR: 0,27: IC del 95%, 0,08-0,88).
- •
Riesgo de neumotórax o hemotórax: 5 estudios, 675 CVC (RR: 0,23; IC del 95%, 0,04-1,38).
- •
Tiempo necesario para la canulación exitosa: 1 estudio, 73 CVC (diferencia de medias –1,40min; IC del 95%, –2,17 a –0,63).
- •
Intentos de inserción/catéter: 1 estudio, 110 CVC (diferencia de medias –0,35; IC 95% –0,54 a –0,16).
La evidencia disponible proveniente de revisiones sistemáticas con metaanálisis ha demostrado una mayor efectividad y seguridad en la colocación de los CVC guiada mediante la utilización de ultrasonidos, en comparación con el uso de los puntos de referencia anatómica. Los ECA analizados incluyen tanto colocaciones en el territorio yugular como en el femoral, por lo que la recomendación del uso de la ecografía sería aplicable a ambos territorios.
Razonamiento
La longitud debe ser la adecuada para situar la punta del CVC en AD (en caso de los CVT). Los tramos intravasculares deberían ser de 20-24cm en yugular derecha y 24-28cm en yugular izquierda. La colocación en AD disminuye el riesgo de estenosis venosas asociadas al traumatismo sobre la vena producido por el golpeteo continuado del CVC durante las sesiones de HD y minimiza la formación/progresión de la vaina de fibrina682,789. Para los CVC colocados por vía femoral, la longitud precisada sería mayor, hasta 40-50cm. Aunque actualmente no se encuentran en la bibliografía artículos que justifiquen esta ubicación ni que avalen las ventajas del posicionamiento del extremo del CVC en aurícula frente a cava inferior, las justificaciones serían similares a las mencionadas en la inserción por vía yugular. La disponibilidad de dispositivos de mayor calibre de lumen posibilita altos flujos a pesar del aumento de su longitud.
6.4Control de la cateterizaciónRecomendacionesNUEVA R 6.4.1) Se sugiere no realizar de forma sistemática una radiografía de tórax postinserción para confirmar la correcta colocación y posicionamiento del catéter venoso central, a no ser que se sospeche mala colocación o aparición de complicaciones durante el procedimiento
R 6.4.2) Se recomienda comprobar el posicionamiento de la punta del catéter por fluoroscopia o radiografía en los casos en que se aprecie disfunción durante su uso
La colocación del CVC guiado por ultrasonidos, como ya se ha comentado, tiene mejores resultados que la inserción basada únicamente en puntos anatómicos de referencia. El número de CVC insertados con éxito en el primer intento es mayor y el número de complicaciones menor, al reducirse el riesgo de punción arterial y hematomas. La utilización de ultrasonidos reduce el tiempo necesario para la implantación, al reducirse el tiempo para la punción exitosa de la vena722,729.
Esto hace que en casos agudos, donde se precise la colocación urgente de un CVC por peligrar la vida del paciente y sin disponibilidad de técnicas de imagen, se colocará de forma preferente un catéter temporal en vena femoral común. La colocación en vena yugular, de segunda elección, deberá realizarse al menos con confirmación ecográfica de permeabilidad y, a ser posible, con conocimiento de tamaño y situación de la vena para detectar variables anatómicas.
En el caso de implantar un CVT se debe realizar un control fluoroscópico para comprobar la localización de la punta del CVC y verificar la ausencia de acodamientos. Es necesario comprobar su correcta ubicación en inspiración forzada o situarlo 2cm por debajo del sitio ideal, al producirse un ascenso de este cuando el paciente adquiera la bipedestación o la sedestación714, variando la posición y siendo causa de disfunción del catéter. Cuando son dos los catéteres (Tesio, Twin), la punta del catéter venoso debe estar situada en la AD y la punta del catéter arterial, nunca en la cava y, como máximo, en la unión de la vena cava superior con la AD dejando entre los extremos de los catéteres suficiente distancia para evitar la recirculación685,727,734,735. Algunos autores recomiendan en pacientes obesos o con grandes mamas que la colocación de ambas puntas del catéter quede bien introducida en la AD735. La colocación del catéter arterial en la vena cava inferior, junto a la salida de la suprahepática, es una opción interesante en pacientes obesos o broncópatas, para asegurar un mejor flujo. Cuando se emplean CVNT, se recomienda que la colocación de la punta del catéter alcance como máximo la unión entre la vena cava superior y la AD, ya que, debido al material con el que están fabricados y que les confiere una gran rigidez, algunos CVC pueden perforar la aurícula685.
La realización de una radiografía de tórax postinserción para confirmar la correcta colocación y posicionamiento del CVC y valorar la posibilidad de complicaciones es un procedimiento que se suele realizar de rutina, sobre todo en el caso de los CVNT. Sin embargo, desde hace unos años se cuestiona su necesidad.
En el ámbito de la radiología intervencionista, en una serie de 489 pacientes con colocación con fluoroscopia, sin complicaciones en el procedimiento, la radiografía posterior demostró únicamente un 1% de mala colocación de la punta736. Desde el punto de vista nefrológico, en una serie retrospectiva de 460 CVNT colocados con y sin ecografía Doppler (ED), de los 370 en que no se sospechó complicación clínica, solo se constató en el control radiográfico tras el procedimiento una mala colocación en el 1%. En los que se utilizó ED no se observaron complicaciones en la punción, y en los que la presentaron a expensas de hematomas, la radiografía fue normal737. En una serie publicada en el entorno de anestesia, en que se colocan 173 CVC sin control ecográfico, solo se constatan dos complicaciones en las que, o ya se sospechó o era un caso de alto riesgo, prediciéndose una correcta colocación en el 97%738.
De esto se deriva la consideración de que la necesidad de la realización de un control radiológico tras la colocación de un CVC sería suficiente contemplarla en el caso de sospecha de mala colocación o presentación de complicaciones durante el procedimiento.
6.5Manipulación del catéterRecomendacionesR 6.5.1) Se recomienda que los catéteres venosos centrales para hemodiálisis se utilicen únicamente para realizar las sesiones de hemodiálisis.
R 6.5.2) Se recomienda que las conexiones y desconexiones del catéter venoso central se realicen únicamente por enfermería especializada de las unidades de diálisis, y son necesarias dos personas, una de ellas enfermera
R 6.5.3) Se recomienda que toda manipulación del catéter venoso central se realice bajo estrictas medidas de asepsia
NUEVA R 6.5.4) Se recomienda cubrir el orificio de salida cutáneo del catéter venoso central y la piel del área pericatéter para preservar su integridad y contribuir a su sequedad
NUEVA R 6.5.5) Se recomienda valorar el apósito del orificio de salida del catéter venoso central en cada sesión de hemodiálisis y cambiarlo siempre que esté húmedo, manchado, despegado o presente algún signo de infección. Si no es así se recomienda
que se cambie una vez a la semana
NUEVA R 6.5.6) Se recomienda que todas las unidades de hemodiálisis dispongan de un registro de seguimiento de los episodios de infección del catéter venososo central
NUEVA R 6.5.7) Se recomienda que todas las unidades de hemodiálisis dispongan de protocolos específicos de manejo de los catéteres venosos centrales para hemodiálisis, así como de actuación ante episodios infecciosos
Independientemente de la causa, localización o tipo de CVC, los cuidados son esenciales para su mantenimiento, para minimizar los factores de riesgo y evitar las complicaciones potenciales, por lo que deben ser manipulados por personal especializado. Su utilización debe restringirse al tratamiento de HD y siempre deben mantenerse estrictas medidas de asepsia en su manipulación739,740.
Los cuidados irán dirigidos al punto de inserción u orificio de salida del CVC y piel circundante al catéter. Asimismo, los cuidados irán enfocados a la manipulación del catéter e incluirán la educación del paciente en sus autocuidados. Todo ello, con el objetivo de evitar infecciones relacionadas con el catéter, ya sean locales (orificio de salida, túnel subcutáneo) o bacteriemias.
Durante la manipulación se debe cuidar el ambiente, evitando corrientes de aire y actividades de contaminación ambiental.
El procedimiento de conexión, desconexión y manipulación por disfunción, que preferiblemente se realizará entre dos personas741, debe estar protocolizado en cada unidad742,743y debe incluir los siguientes pasos:
- •
Comprobación de la permeabilidad y flujo del CVC.
- •
Vigilancia del estado del CVC (ramas y parte visible).
- •
Medidas de seguridad para evitar la contaminación endoluminal (evitar que las luces del CVC permanezcan en el aire).
- •
Resolución de problemas (lavados en caso de disfunción).
- •
Sellado del CVC.
- •
Medidas de protección del CVC intradiálisis e interdiálisis.
El CVC debe manipularse con estrictas medidas de asepsia744–746. Las medidas de asepsia con las que se debe manipular el CVC implican al profesional que lo manipula, a las personas que están alrededor durante su manipulación y al propio paciente. Se deben extremar las medidas de barrera en las manipulaciones por disfunción. Esto consiste en el uso de mascarilla, tanto por parte del paciente como del profesional744, el lavado higiénico de manos y la utilización de guantes y de campo estéril. La manipulación de los extremos de las líneas de HD que se van a conectar al CVC se realizará con la máxima precaución posible para evitar su contaminación739,741,745.
Se recomienda realizar la cura del orificio semanalmente para minimizar la irritación de la piel y la entrada de agentes externos746–748, a no ser que el paciente acuda a la sesión de HD con el apósito incompleto o manchado. Según los resultados de la revisión sistemática que McCann y Moore749 realizaron para la Cochrane, no se encontró reducción significativa en la infección del orificio de salida ni bacteriemia asociada al CVC al utilizar un apósito transparente de poliuretano comparado con el de gasa seca, por lo que no hay evidencia suficiente para recomendar un tipo de apósito (poliuretano transparente o gasa seca). Se deben evitar los apósitos no transpirables. Diversos autores y guías sugieren el uso de apósitos impregnados con clorhexidina preferiblemente transparentes746,748,750–753, pero todavía no hay suficiente evidencia como para hacer ninguna recomendación a este respecto750–753.
En relación con los antisépticos, hay que valorar si se deben evitar los alcohólicos o de otro tipo que puedan dañar el material del que está fabricado el CVC, por lo que es aconsejable consultar la ficha técnica de este. El antiséptico recomendado será la clorhexidina, y su concentración puede ser al 0,5 o al 2%728. Es conveniente utilizar un doble apósito, para el orificio de salida cutáneo, y para los extremos del catéter, pinzas y tapones. En los primeros días tras su implantación se evitará levantar el apósito, así como realizar sobre él maniobras bruscas para facilitar la fijación del manguito de Dacron.
En la actualidad existen conexiones de barrera (bioconectores) específicos para HD, que se utilizan con el objetivo de evitar la contaminación endoluminal en el proceso de conexión y desconexión, aunque no existe evidencia suficiente para hacer alguna recomendación sobre su uso754–757. Durante la manipulación se debe cuidar el ambiente, evitando corrientes de aire y actividades de contaminación ambiental.
Con respecto a la educación sobre los autocuidados al paciente se le instruirá sobre:
- •
La necesidad de mantener una buena higiene y forma de hacer el aseo diario.
- •
La utilización de ropa adecuada y evitar elementos que puedan producir acodaduras en el CVC o roces en el túnel subcutáneo (tirantes, cadenas, etc.).
- •
La manera de realizarse la cura del orificio, por si fuera necesario realizarla.
- •
Abstenerse de realizar actividades de riesgo como baños de inmersión, tracciones sobre el CVC o el uso de objetos cortantes cerca de este.
- •
Se le informará de las posibles complicaciones, las causas que las producen y las acciones que deben llevar a cabo para intentar evitarlas.
- •
Deben saber que siempre que vaya a realizarse el tratamiento deben comunicar al personal de enfermería cualquier incidencia y que ante cualquier eventualidad grave (hemorragia, extracción accidental, fiebre, etc.) deben ponerse en contacto con el centro.
Existen múltiples posibilidades de registro758, pero al menos ha de incluir la siguiente información:
- •
Nombre del profesional que manipula el CVC.
- •
Fecha de implantación y localización.
- •
Tipo de CVC, longitud y volumen de cebado.
- •
Su funcionamiento (comprobación de la permeabilidad de las ramas, necesidad de fibrinólisis, flujo y presiones).
- •
Complicaciones (disfunción, signos de infección).
- •
Número de CVC y causas de recambio.
R 6.6.1) Se recomienda realizar un seguimiento clínico y funcional del catéter venoso central en cada sesión de diálisis y su evolución en el tiempo
R 6.6.2) Se recomienda que, ante una eficacia dialítica insuficiente, se tenga en cuenta el flujo proporcionado por el catéter veoso central y la recirculación de este
R 6.6.3) Se recomienda no realizar cultivos rutinarios en ausencia de signos de infección
La función de los CVC para HD es proporcionar un acceso al torrente circulatorio que permita una diálisis eficaz con el menor número de complicaciones. El seguimiento de estos tiene por objeto detectar cuanto antes las posibles complicaciones y, en este sentido, cabe destacar el seguimiento clínico y el seguimiento funcional.
El seguimiento clínico, que nos advertirá de las complicaciones en el paciente, se realizará en cada sesión de HD y deberá constar en los registros de enfermería. Debe basarse en la búsqueda de síntomas o signos físicos que hagan sospechar:
Infección: aparición de fiebre, signos inflamatorios en orificio de salida o en el túnel. En cada sesión de HD debe investigarse la integridad del apósito, que debe estar limpio, seco y sin ningún tipo de secreción759.
Edema en miembros superiores o cara que nos haga sospechar una trombosis de venas centrales708,709.
Dolor a nivel del hombro o cuello, que puede indicarnos rotura del CVC o cambios bruscos en la situación clínica del enfermo, que sugeriría una complicación grave726.
Alteraciones de la integridad cutánea: dermatitis producidas por alergias al material utilizado, curas excesivas o apósitos que favorezcan la maceración de la piel y úlceras por decúbito producidas por el manguito de Dacron o por el propio CVC a la salida del orificio.
Control periódico de la longitud de la parte externa del catéter. Esto permitirá determinar posibles desplazamientos del CVC y, en consecuencia, de la localización de la punta760.
El seguimiento funcional tiene como finalidad la detección de alteraciones que impidan la realización de una HD eficaz, es decir, conseguir el Kt/V adecuado. Este seguimiento se realizará en cada sesión y se valorará también su evolución en el tiempo, ya que cada paciente es control de sí mismo. Dichas determinaciones son las siguientes:
- •
Flujo sanguíneo. En la actualidad, los monitores proporcionan una lectura del flujo real. El flujo dependerá de la estructura del CVC (calibre, materiales, etc.) y de la situación de la punta (aurícula o cava superior/inferior). El flujo recomendado es > 300ml/min.
- •
Presiones del circuito. En los CVC solo se determinan las presiones dinámicas.
- •
Determinación del aclaramiento medio. La determinación del aclaramiento medido por dialisancia iónica (K) ayuda a realizar la monitorización de la adecuación de la HD mediante el uso del Kt. En la actualidad, lo aportan la mayoría de los monitores de HD, resultando útil para conocer el funcionamiento y rendimiento del CVC. Cualquier cambio en el Kt deberá tenerse en cuenta, ya que puede suponer un déficit funcional del CVC761,762.
- •
Recirculación. Es prácticamente mínima en catéteres colocados en venas yugular y subclavia (no existe recirculación cardiopulmonar como en las FAV), por lo que cualquier recirculación > 5-10% es sugestiva de alteraciones en el catéter: cambio de posición de la punta, coágulo en la luz, vaina de fibrina o trombosis pericatéter763. La recirculación va a estar determinada por la estructura y localización de la punta y, en algunos casos, por la inversión de las líneas693,701,764.
Las complicaciones surgidas tras la implantación de un CVC para HD pueden clasificarse en agudas o precoces y tardías.Agudas
Ocurridas dentro de los 30 días que siguen al procedimiento. Son infrecuentes703,726,765y están relacionadas con la punción venosa o con la inserción. Pueden ser subdivididas en las que se encuentran íntimamente relacionadas con el procedimiento o inmediatas, que se definen como las que tienen lugar en las 24h siguientes a la intervención, y en las que ocurren una vez ha transcurrido este intervalo de tiempo. Las complicaciones derivadas del procedimiento suelen consistir en daños a las estructuras vitales subyacentes y a mal posicionamientos del catéter. Las complicaciones más frecuentemente asociadas se enumeran en la tabla 28.
Complicaciones inmediatas tras implantación de un catéter venoso central
| Frecuentes |
| • Mal posicionamiento • Neumotórax/neumomediastino • Embolia aérea • Punción arterial • Sepsis relacionada con el procedimiento • Infección de la herida quirúrgica • Hematoma en el punto de punción venoso • Hemorragia por herida quirúrgica • Arritmias cardíacas • Parálisis transitoria del nervio recurrente laríngeo • Rotura/perforación del catéter • Reacciones a la anestesia local • Reacciones vagales |
| Excepcionales |
| • Perforación cardíaca o de los grandes vasos • Taponamiento cardíaco • Rotura cardíaca • Hematoma retroperitoneal • Parálisis permanente del nervio recurrente laríngeo |
Dichas complicaciones varían en función de la vena a canalizar, la experiencia del médico, la utilización o no de ultrasonidos para la canalización venosa729–731 y de técnicas de imagen714, así como de la condición clínica del paciente (inmunosupresión, trastorno de coagulación, obesidad, etc.).
Conviene mantener una vigilancia estricta las primeras horas pospunción para tratar de identificarlas y proceder al tratamiento correspondiente de forma inmediata, ya que pueden ser potencialmente mortales.
Entre las complicaciones más frecuentes, pero de menor gravedad, está la hemorragia por el orificio de entrada cutáneo. En la mayoría de casos, la hemorragia procede del punto de punción venosa debido a presiones venosas yugulares elevadas. Un error frecuente es el de comprimir el orificio de salida cutáneo cuando se produce la salida de sangre; el punto a comprimir es el de la zona de punción venosa, aunque lo más efectivo es evitar el decúbito manteniendo al paciente sentado para reducir la presión en la vena yugular. Debido al elevado grosor del sistema introductor, la embolia gaseosa no es una complicación muy infrecuente. Posicionar la cabeza del paciente lo más baja posible para aumentar la presión venosa, una cuidadosa sustitución del dilatador del introductor por el CVC y la utilización, más recientemente, de introductores pelables valvulados son medidas que hacen disminuir el riesgo.
La perforación de un vaso central es una complicación potencialmente mortal, resultado de atravesar la pared vascular con los dilatadores durante el procedimiento de inserción726. Una cuidadosa introducción del dilatador, siguiendo siempre el recorrido de la guía, sin forzar su avance para impedir su plegamiento y la utilización de técnicas de imagen fluoroscópicas en tiempo real, hace muy improbable esta complicación.
Otra complicación grave, aunque excepcional, es la fístula carotidoyugular. Se ha descrito en la bibliografía asociada a infartos cerebrales766.Tardías
Agrupa el conjunto de complicaciones que tienen lugar pasados 30 días de la realización del procedimiento. Las complicaciones tardías suelen estar en relación con el cuidado y función del catéter y se difieren en el tiempo desde la inserción de este. No suelen ser tan graves como las agudas, pero una de sus consecuencias es la retirada del CVC y, por tanto, la pérdida de un AV para HD. Entre las complicaciones más frecuentemente mencionadas en la bibliografía encontramos las siguientes685,726,767:
- 1.
Infección. Es la complicación más frecuente de los CVC. Los gérmenes implicados suelen ser estafilococos coagulasa negativos y Staphylococcus aureus. Puede ser a 3 niveles: del orificio, del túnel o bacteriemia.
- 2.
Trombosis relacionadas con el CVC. Estas se clasifican en:
- •
Extrínsecas:
- -
Trombosis mural.
- -
Trombosis venosa central.
- -
Trombosis auricular.
- -
- •
Intrínsecas:
- -
Formación de vaina de fibrina.
- -
Trombo en la punta del CVC.
- -
Intraluminal.
- -
- •
- 3.
Estenosis venosa central. La colocación de CVC se asocia a estenosis venosas. Estas son más frecuentes cuando se insertan por vía subclavia (estenosis entre el 42 y el 50%)685,717,720 que por vía yugular (0-10%)717,721 y mucho mayores con CVNT que con CVT. Aunque suelen ser asintomáticas, en ocasiones cursan con edema del miembro superior ipsilateral y pueden comprometer el futuro desarrollo de una FAV en ese miembro.
- 4.
Hemotórax, perforación auricular y taponamiento cardíaco. Complicaciones excepcionales y asociadas al uso inadecuado y prolongado de CVNT685. La rigidez del CVC mal posicionado condiciona la erosión y posterior perforación vascular. Se asocian a malposición de la punta (apoyando en AD) o migración proximal desde la vena cava superior.
- 5.
Pinzamiento y ruptura del CVC con migración hacia cavidades cardíacas o arterias pulmonares. El paso del CVC insertado por vena subclavia a través de la pinza costoclavicular suele ser responsable de esta ruptura. Aunque esta complicación puede darse en CVC implantados para quimioterapia o antibioterapia (fundamentalmente reservorios) es excepcional en los CVC para HD, dado que no se utiliza la vena subclavia como vena de acceso.
- 6.
Las roturas o desconexiones accidentales o voluntarias del catéter o sus tapones suelen producir embolias gaseosas y rara vez hemorragias (en los catéteres con punta intratorácica). Las pinzas de las extensiones no garantizan el cierre, por lo que los tapones deben ser de seguridad (con rosca). Debe evitarse que las pinzas actúen sobre la misma zona repetidamente para que no rompan las extensiones. Algunos equipos dejan habitualmente las pinzas abiertas por esta razón, utilizándolas solo para las maniobras de conexión a HD.
- 7.
La dificultad en la extracción de los CVT es una complicación infrecuente (1%)768 debida a la formación de una cápsula de fibrina, colágeno y células endoteliales, que en algunos pacientes provoca la fusión de la pared de la vena y el CVC. Por este motivo, el CVC queda fuertemente fijado provocando una elevada resistencia a la extracción769,770. Se ha sugerido que la retención del catéter podría estar en relación con el tiempo de permanencia (rango, 12-120 meses) y el estrecho calibre de las venas utilizadas771–773. La mayoría de los CVT pueden extraerse mediante maniobras locales que implican la disección y liberación de adherencias en el orificio de salida cutáneo o a nivel del manguito subcutáneo, ejerciendo posteriormente una tracción moderada para extraer el CVT. Si esto no fuese efectivo se aconseja efectuar una revisión de la zona a nivel del punto de entrada en el vaso sanguíneo (base del cuello para los colocados en la vena yugular), para poder realizar una disección más exhaustiva de la cápsula fibrosa pericatéter y liberar el catéter. Cuando el CVT se encuentra retenido, la excesiva tracción para su retirada puede comportar serias consecuencias como lesiones vasculares, rotura y fragmentación del CVC, y embolización en AD o arteria pulmonar770,773,774. Actualmente, no disponemos de evidencia respecto al manejo del catéter retenido. Si se opta por no retirarlo podemos extraer la porción extravascular, fijando la parte proximal y dejando la porción intravascular retenida in situ. En estos casos existirá un potencial riesgo de trombosis, embolia o infección, pero no hay consenso para recomendar la realización de profilaxis anticoagulante o antibiótica771,773. Si se decide retirarlo, una opción será la cirugía abierta, aunque recientemente se han descrito nuevas técnicas para la extracción de los CVT retenidos mediante radiología intervencionista. Esta técnica consiste en realizar dilataciones mediante balón de angioplastia a través de la luz del CVT, con el objeto de despegar las adherencias entre la pared del vaso y el catéter, y así poder liberarlo para facilitar su extracción o recambio775–777.
- 8.
Otras complicaciones. Oftalmoplejía y exoftalmos, hemorragia de varices esofágicas, rotura de la luz del CVC y embolizaciones.
Sin embargo, las complicaciones tardías más frecuentes son las trombóticas y las infecciosas, que se detallan en los apartados siguientes referidos al CVT.
6.8Disfunción del catéterRecomendacionesNUEVA R 6.8.1) Se sugiere sospechar la disfunción del catéter venoso central ante la imposibilidad de obtener o mantener un flujo de sangre extracorpóreo adecuado (flujo de la bomba < 300 ml/min) para realizar una sesión de hemodiálisis
R 6.8.2) Se sugiere que ante la disfunción precoz se sospeche acodamiento del catéter venoso central o malposición de la punta y ante la tardía, trombosis intraluminal o pericatéter
R 6.8.3) Se recomienda iniciar el tratamiento del catéter venoso central tunelizado trombosado o disfuncionante con infusión intraluminal de fibrinolíticos
(•) NUEVA R 6.8.4) Se sugiere, ante la necesidad de sustitución del catéter venoso tunelizado por fracaso del tratamiento fibrinolítico, el recambio del catéter sobre guía, siempre que no exista infección del túnel o sepsis relacionada con el catéter. Se sugiere asociar la angioplastia de la vaina de fibrina antes de la colocación del nuevo catéter
(•) NUEVA R. 6.8.5) Ante la disfunción del catéter venoso central tunelizado se sugiere no realizar tratamiento de la vaina de fibrina mediante pelado o stripping
(•) NUEVA R 6.8.6) Se sugiere que el sellado del catéter venoso central tunelizado durante los períodos entre sesiones de hemodiálisis se realice con heparina, con citrato o con activador tisular del plasminógeno alternado con heparina
La disfunción del CVC es una de las causas más importantes que influyen en su retirada junto a las infecciones. Desde las primeras series publicadas que describen este problema727 hasta la actualidad sigue suponiendo uno de los mayores problemas asociados a la supervivencia del CVC.
Se define la disfunción del CVC como la incapacidad de obtener o mantener un flujo de sangre extracorpóreo adecuado durante los primeros 60min de una sesión de HD, a pesar de haber realizado al menos un intento de mejorar el flujo. Las guías KDOQI10 establecieron como valor la cifra no inferior a 300ml/min; sin embargo, diseños actuales de CVC de HD que proporcionan flujos más elevados (> 400ml/min) sin aumentar las presiones en la bomba, hacen preciso detectar la disfunción antes de un descenso del flujo hasta 300ml/min. Además del descenso del flujo, un descenso del Kt/V, una presión arterial más negativa de 250mmHg y/o una presión venosa > 250mmHg, o una disminución de la conductancia (Qb/Pa) > 10% en controles sucesivos puede suponer una alerta10,778.
Las causas de disfunción pueden clasificarse en precoces o tardías. La disfunción precoz ocurre la primera vez que se realiza diálisis a través del CVC. Suele estar íntimamente relacionada con el proceso de inserción, en concreto con la mala posición de la punta o con acodamiento de este (kinking)714,778.
La malposición de la punta del CVC sucede cuando se sitúa en vena cava superior o cuando la luz arterial no está colocada en la AD, siendo más frecuente en obesos, en los que el cambio de posición de decúbito a bipedestación hace que la punta se desplace desde la aurícula a la vena cava735,779,780, y en las colocaciones que utilizan la vena yugular interna izquierda como punto de entrada. El desplazamiento desde la AD hacia la unión cavoatrial o a la vena cava superior es más frecuente en los CVC localizados en venas centrales izquierdas. Algunos autores han sugerido como causas de esta las inherentes a la anatomía mediastínica (elongación de los troncos venosos)781. Una posible solución sería recolocar el CVC con control fluoroscópico sobre guía rígida o, en caso de que no se corrija, realizar el recambio por un CVC de mayor longitud.
El acodamiento se produce en el momento de realizar la tunelización. Si al finalizar la inserción del catéter se comprueba falta de flujo o resistencia al aspirado con una jeringa, lo adecuado es introducir una guía metálica y recolocar el CVC782; en ocasiones no se logra debido a una defectuosa realización del túnel respecto a la punción venosa y debe realizarse el recambio por un nuevo túnel subcutáneo. Es recomendable que la curva principal del catéter se apoye en la clavícula.
La disfunción tardía se debe generalmente a trombosis. Su presencia, ya sea intraluminal o por la formación de una vaina de fibrina, supone un gran porcentaje de la disfunción de los CVC. La vaina de fibrina se inicia a las 24h de la colocación como respuesta a la agresión sufrida por el vaso. Se prolonga a lo largo de la superficie del CVC tras los primeros días de su colocación778,783,784, siendo la principal causa de disfunción tardía. La disfunción suele aparecer varias semanas tras la colocación709, si bien puede ocurrir incluso a las 24 h778,785. Las trombosis se han venido clasificando en extrínsecas e intrínsecas782. Las trombosis extrínsecas son secundarias a la formación de un trombo mural que puede ubicarse en la vena cava superior o en la AD. Suelen ser graves, ya que precisan de anticoagulación sistémica y retirada del CVC685,709. Las trombosis intrínsecas suelen ser la causa de déficit de flujo a través del CVC y suelen estar asociadas a la formación de la vaina de fibrina, un trombo en la punta del catéter o un trombo a nivel intraluminal. Esta clasificación, más clásica, hace referencia tanto a la disfunción del CVC como a las complicaciones derivadas de este. Actualmente, y si nos referimos a la disfunción, es más útil la clasificación establecida por Besarab y Pandey (tabla 29)778.Relevancia clínica de la vaina de fibrina
Tipo de disfunción del catéter venoso central y complicaciones derivadas
| Tipo | Hallazgos | Síntomas |
|---|---|---|
| Flap o cola de fibrina | La fibrina se extiende desde el extremo del catéter actuando a modo de válvula | Posibilidad de infundir, pero no de retirar sangre |
| Vaina de fibrina | La fibrina se adhiere a toda la longitud y superficie externa del catéter. Esto permite la presencia de trombo entre la vaina | Imposibilidad para infundir y/o retirar sangre y la punta |
| Trombo mural | La fibrina procedente de la pared vascular dañada se une a la fibrina que recubre el catéter, lo que aumenta el riesgo de trombosis venosa | Salida del líquido inyectado por el punto de inserción del catéter, edema, dolor, dilatación vascular |
| Trombo intraluminal | La vaina de fibrina se forma dentro de la luz del catéter, lo que causa oclusión parcial o total | Imposibilidad para infundir y/o retirar sangre |
La vaina de fibrina, inicialmente compuesta de fibrinógeno, albúmina, lipoproteínas y factores de coagulación, aparece 24h después de la colocación del CVC como respuesta del vaso a una lesión.
A continuación se extiende por la superficie del CVC durante los días siguientes y es la causa principal de la disfunción tardía778. La aparición de esta vaina está íntimamente relacionada con la presencia del biofilm. Este biofilm se define como una comunidad sésil, que se caracteriza por células que se adhieren a un sustrato o entre sí y que están protegidas por una matriz extracelular polimérica de sustancias que producen ellas mismas786. La mayor complicación del biofilm, además de la la infección en sí, es el desarrollo de la vaina de fibrina. La fisiopatología de la producción del biofilm no está clara, pero se ha planteado la hipótesis de que puede ocurrir debido al contacto inicial de las bacterias libres con una superficie extraña, el CVC. Esto puede ocurrir entre los días 1 y 14. Esta adherencia de la célula puede generar una señalización molecular y proliferar para formar microcolonias, de este modo genera un recubrimiento de exopolisacáridos que se adherirá a la superficie gracias a una matriz de glicocálix y rodearía la comunidad de microcolonias bacterianas. La presencia de la biopelícula no tiene por qué causar infección necesariamente; sin embargo, la complicación no infecciosa más importante es el desarrollo de la vaina de fibrina786.
No está claro en qué orden la vaina de fibrina, el biofilm y su interdependencia se desarrollan787, pero la evidencia actual sugiere que el biofilm evoluciona a vaina de fibrina en días o meses. Además de la fibrina se añaden otros componentes: laminina, fibronectina, colágeno, o células musculares lisas y células endoteliales. La vaina de fibrina comienza en el punto de contacto entre el catéter y la pared del vaso y avanza hasta que cubre la total longitud del CVC; de este modo crea una posible disfunción. Aunque la incidencia de la formación de la vaina es del 100%, su condición puede permanecer subclínica; sin embargo, en pacientes sintomáticos se puede deber a la formación de un trombo y/o a la infección786,788. En un estudio retrospectivo realizado en 2007789, los autores establecieron una íntima relación entre la vaina de fibrina y las disfunciones o complicaciones del CVC (infecciosas y falta de flujo), que se encontraban presentes en el 76% de las venografías realizadas para valoración de la disfunción. De ese modo, la vaina de fibrina y la trombosis asociada favorecen el sobrecrecimiento bacteriano y tienen un efecto claramente desfavorable sobre la permeabilidad y durabilidad del CVC790. Esta asociación entre vaina de fibrina y trombosis, disfunción e infecciones hace necesario su diagnóstico y manejo precoz.Evaluación clínica y radiológica del catéter malfuncionante
La secuencia de evaluación se inicia con la realización de una radiografía de tórax para evaluar la posición del CVC y descartar acodamientos. A continuación, debe evaluarse la permeabilidad del CVC mediante la infusión de 10ml de suero salino seguida de la aspiración de sangre. La imposibilidad de aspirar sangre, infundir suero o ambas conforman el diagnóstico de sospecha de vaina de fibrina (v. tabla 29).
El estudio mediante angiografía con sustracción digital con contraste es la técnica de elección para la realización del diagnóstico. Los hallazgos angiográficos en relación con la vaina de fibrina son defectos de relleno, reflujo de contraste hacia el extremo proximal del CVC con salida por agujeros en la vaina, excesivo jet de salida por los orificios laterales del CVC y ausencia de un flujo suave y adecuado desde el extremo del CVC hacia la AD783. Para el diagnóstico también se utiliza la venografía periférica tras punción de vena en el dorso de la mano o el pie. También se ha descrito la realización de venografía retrógrada a través del CVC, pero una vez retirado y posicionado proximal a la zona de entrada en la vena central789. La venografía retrógrada permite diagnosticar la vaina de fibrina o la presencia de trombo durante el procedimiento de recambio del CVC y la realización de angioplastia transluminal percutánea (ATP) de la vaina antes de la inserción de un nuevo CVC.
Tras detectar la disfunción hay que identificar y tratar inmediatamente el problema, ya que retrasar la solución predispone al paciente a una inadecuada diálisis y una mayor manipulación, que se traduce en un aumento del riesgo de infección782.Tratamiento del catéter disfuncionante (fig. 7)
Las recomendaciones de la National Kidney Foundation10 para el tratamiento de la disfunción de los CVT incluyen:
- •
Evaluación radiológica. Es imprescindible un estudio radiológico para diagnosticar la disfunción del CVC y documentar las condiciones del vaso (vena central). Debe incluirse la venografía con contraste a través del catéter.
- •
Instaurar el tratamiento adecuado.
- -
Reposicionamiento del CVC.
- -
Tratamiento del trombo y/o vaina de fibrina mediante medidas mecánicas o infusión de sustancias fibrinolíticas.
- -
Recambio del catéter disfuncionante.
- -
Pelado del CVT o stripping.
- -
ATP del vaso y/o de la vaina de fibrina.
- -
Ante la malposición, el acodamiento o la migración del CVC, se procederá inicialmente a la resolución del problema mediante la utilización de guías y, en caso de no obtener resultados, se procederá a la sustitución del CVC. Muchos autores realizan la sustitución del CVC sobre guía utilizando el mismo trayecto del túnel y acceso venoso central783,789,791. El recambio del CVC a través de una guía disminuye el tiempo de procedimiento y preserva los accesos venosos, si bien este recambio de CVC en el mismo sitio podría producir una mayor tasa de infección que cuando se procede a la colocación del nuevo CVC en una ubicación diferente, como se muestra en estudios en pacientes sin insuficiencia renal, con infección de catéter e inmunodeprimidos, en los que no es preciso preservar futuros sitios potenciales de inserción792. Estos autores concluyen, sin embargo, que el cambio sobre guía podría ser una opción aceptable en paciente en HD con bacteriemia o mal funcionamiento del CVC, siempre y cuando se haya establecido un tratamiento antibiótico adecuado792, opción ya constatada por otros autores en el paciente renal793 y, de hecho, ya propuesta a nivel de guía clínica10.Técnicas a aplicar ante la disfunción del catéter venoso central
- •
Lavados enérgicos con suero fisiológico. Debe realizarse en condiciones de asepsia para evitar complicaciones infecciosas794. Se debe emplear una jeringuilla de 10ml. Si tras tres intentos no se soluciona el problema y persiste el déficit de flujo se pasa a la pauta de instaurar una terapia fibrinolítica782.
- •
Terapia mecánica transcatéter. Consiste en extraer el trombo mediante una guía, un catéter de Fogarty o un cepillo de biopsia ureteral introducidos por su luz. No produce alteraciones sistémicas, pero es poco efectiva cuando la trombosis es secundaria a una vaina de fibrina782.
- •
Terapia fibrinolítica intraluminal (fig. 7). La infusión de agentes trombolíticos a través de las luces de los CVC se ha venido utilizando ampliamente con el fin de restaurar la permeabilidad y eliminar la vaina de fibrina y el trombo, y se ha recomendado por varias guías de práctica clínica6,10. Existen varios protocolos descritos en la bibliografía, tanto para el uso de fibrinolíticos en dosis altas y de forma sistémica como para la utilización intraluminal en dosis bajas. No existen ECA que avalen la utilización de un fibrinolítico sobre otro, pero sí estudios que comparan tratamientos trombolíticos a dosis bajas. En la revisión sistemática realizada por Hilleman y Campbell se observa una mayor permeabilidad de reteplasa (88 ± 4%) frente a alteplasa (81 ± 37%) y permeabilidades muy bajas para la tenecteplasa (41 ± 5%)795. La reteplasa presenta, además, la ventaja de un menor coste. La utilización de alteplasa en bajas dosis se evaluó en un ensayo clínico prospectivo en el que se incluyeron 1.064 pacientes de 80 centros (estudios COOL y COOL1)796,797. La administración de 2mg/2ml de alteplasa por cada luz del catéter, con mantenimiento del fibrinolítico in situ por un período de 2h seguido de otra dosis similar, en caso de no respuesta, obtuvo muy buenos resultados en cuanto a permeabilidad (el 92,4% para catéteres de doble luz) con muy escasos efectos secundarios (el 0,4% de sepsis, el 0,3% de hemorragia gastrointestinal y el 0,3% de trombosis venosa). Estudios más recientes obtienen resultados similares con la utilización de alteplasa (activador tisular del plasminógeno recombinante [rt-PA]) intraluminal a bajas dosis y con escasos, o prácticamente nulos, efectos secundarios795,798,799, sin considerar necesario una permanencia larga de la alteplasa en la luz de los catéteres para obtener tasas de permeabilidad similares. El purgado de las luces con alteplasa en una solución de 1mg/1ml, con empuje de la alteplasa por suero salino en pequeñas cantidades (0,3ml) cada 10min, permite mantener el fármaco activo en la punta y reducir el período de tratamiento a 30min799. Los resultados de permeabilidad son similares a los realizados con permanencias prolongadas, sin aumentar el riesgo de hemorragia ni incrementar el gasto del procedimiento al no utilizar dosis superior de fibrinolítico. La utilización de dosis bajas de urocinasa (UK) (5.000 y 9.000 U por luz) obtiene escasos resultados sobre la permeabilidad de los CVC800. Un ensayo clínico para valorar la eficacia a dosis altas, aleatorizó 2 grupos a 25.000 y 100.000 U por luz, respectivamente. En el primer grupo se requirió una dosis adicional (50.000 U por luz) en el 86% de los casos para conseguir una permeabilidad satisfactoria, que se hubo de repetir (con 75.000 U) en la siguiente sesión de HD. La utilización de altas dosis de UK (100.000 U) por luz desde el inicio en el segundo grupo consigue muy buenos resultados (100% de permeabilidad), requiriendo una segunda dosis de la misma cantidad de UK en el 33% de los casos. Es de destacar que ambos grupos recibían tratamiento preventivo con warfarina. No se registraron complicaciones hemorrágicas801. Desde 1999, la UK está retirada del mercado en Estados Unidos802 a causa de su procedencia humana, por lo que no existen estudios comparativos recientes norteamericanos entre la UK y la alteplasa. En la revisión realizada por la Cochrane803, tampoco se encuentran diferencias que avalen la utilización de UK frente a rt-PA, por lo que se considera que ambos protocolos podrían ser útiles, aunque con escasa evidencia, en el tratamiento del CVC trombosado.
- •
Terapia fibrinolítica sistémica (fig. 7). Para intentar mejorar los porcentajes de permeabilidad tras la infusión de UK, Twardowski propone en 1998 la utilización de UK en altas dosis y en infusión continua, 250.000 U durante 3 h800. Con esta pauta se consiguen resoluciones del 81% tras la primera infusión y del 99% tras la tercera, muy superiores a las obtenidas con infusiones locales a bajas dosis, pero precisan de un estricto control en su administración y suponen un mayor número de contraindicaciones y complicaciones y un gasto elevado derivado del tiempo de hospitalización y de la vigilancia por parte del personal sanitario cualificado800. La utilización de forma sistémica del factor rt-PA se ha informado en la bibliografía (2,5ml en 50ml de suero salino en 3h de HD) con un 100% de respuestas inmediatas y un 67% a los 30 días804,805. Los resultados son similares a los observados con infusión en períodos cortos, tanto en permeabilidad como en ausencia de complicaciones, pero supone un empleo mayor de tiempo para la realización del tratamiento. El tratamiento preventivo con anticoagulantes ha demostrado algún efecto en la reducción de la formación de trombos en pacientes portadores de CVC806,807. La permeabilidad de los CVC en pacientes anticoagulados es del 47,1%, frente al 8,1% en pacientes sin anticoagular (p = 0,01). Sin embargo, el riesgo de hemorragia y la necesidad de monitorización de los niveles la hacen una terapia escasamente ideal para utilizar habitualmente en pacientes en HD808.
- •
Terapia mecánica extraluminal y recambio del CVC. Ante el fracaso de la fibrinólisis para conseguir la permeabilidad del catéter, varias técnicas más agresivas se han venido diseñando, todas ellas con el propósito de eliminar la vaina de fibrina sin o con sustitución del CVC.
El pelado (stripping) percutáneo de la vaina de fibrina782 que rodea el catéter ha venido realizándose con aceptables éxitos en lo referente a la permeabilidad del CVC782,809. La técnica, aunque efectiva, conlleva una morbilidad asociada a un procedimiento invasivo, precisa de un personal cualificado para su realización y un gasto superior a la utilización de tratamientos fibrinolíticos. Estos datos vienen avalados por estudios más recientes que comparan el tratamiento fibrinolítico en altas dosis con el pelado de la vaina 810, con los que se obtienen mejores resultados para el primero en permeabilidad inicial (el 97 frente al 89%) y primaria (el 86 frente al 75% a los 15 días).
Frente a la utilización del stripping se encuentra también el ECA realizado por Merport et al811, que compara la eficacia del stripping frente al recambio de CVC sobre guía metálica. Los catéteres recambiados conseguían una mejor permeabilidad para HD durante 4 meses (el 23 frente al 0%; p = 0,05) y con un menor coste (2.586 frente a 3.022 dólares; p < 0,01).
En un estudio realizado con una muestra de 66 pacientes812, en el que se comparaban varias técnicas invasivas (trombectomía de la vaina mediante stripping, recambio del catéter y recambio asociado a la PTA de la vaina), no se encontraron diferencias significativas entre las tres técnicas ni en resultados inmediatos, complicaciones y durabilidad del catéter. A pesar de ello, la mayor parte de los estudios encontrados en la bibliografía concluyen que el stripping no debe considerarse como terapia rutinaria para el malfuncionamiento del catéter y debe realizarse, en caso de no respuesta a la terapia fibrinolítica, un recambio del catéter sobre guía811.
El recambio en los CVC utilizados para HD debe realizarse sobre guía manteniendo el mismo AV central para preservar al máximo el número de AV del paciente; es una opción aceptable en pacientes en HD con mal funcionamiento del CVC o bacteriemia, siempre y cuando se haya establecido un tratamiento antibiótico adecuado10,792,793.
La sustitución del CVC obtiene mejores resultados de permeabilidad cuando se asocia al tratamiento de la vaina mediante ATP con balón antes de la colocación de un nuevo CVC. En el ECA de Oliver et al813, la mediana de tiempo para repetir el recambio fue claramente superior cuando se realizaba ATP que cuando solamente se recambiaba el CVC (411 frente a 198 días; p = 0,17). Por último, hay que valorar como último recurso en el caso de repetidos problemas de disfunción el riesgo-beneficio de la colocación del nuevo CVC en otra localización para evitar la vaina de fibrina, dado el riesgo de poder provocar la pérdida de otro territorio vascular central. De hecho, hay autores que incluso tras el fracaso del tratamiento fibrinolítico recambian el CVC directamente en otra localización diferente801.
A continuación se analizan, entre los estudios revisados, los tributarios de análisis de la evidencia.
→ Pregunta clínica XXVIII ¿Cuál es el mejor tratamiento de la disfunción persistente del catéter venoso central tunelizado (stripping,angioplastia de la vaina, fibrinolíticos, recambio del catéter)?
(Ver ficha de la Pregunta clínica XXVIII en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Pelado (stripping) percutáneo de la vaina de fibrina frente a infusión de UK. Un ECA con 57 pacientes no encontró diferencias estadísticamente significativas en las curvas de supervivencia del CVC | Calidadmoderada |
| Pelado (stripping) frente a recambio de CVC. Un ECA de 15 intervenciones de stripping percutáneo de la vaina de fibrina percutánea frente a 22 recambios de CVC sobre guía metálica en 30 pacientes adultos, presenta una mayor permeabilidad con el recambio con menor coste, y concluye que el stripping no debe considerarse como terapia habitual para el malfuncionamiento del CVC | |
| Pelado (stripping) percutáneo de la vaina de fibrina frente a recambio del CVC. Un ECA con 30 pacientes encontró que el recambio de CVC era significativamente mejor que el stripping para conseguir la permeabilidad adecuada para HD durante 4 meses, y que conseguía mayores días de permeabilidad media del CVC | |
| Angioplastia con balón de la vaina frente a no intervención. Un ECA con 30 pacientes no encontró diferencias estadísticamente significativas entre las dos opciones en relación con la mediana de tiempo para repetir el recambio del CVC y la mediana de tiempo para repetir la intervención, pero sí en relación con el aumento de flujo de sangre (340 frente a 329ml/min) | |
| UK en alta dosis (100.000 UI) frente a dosis más baja (25.000 UI) para trombosis del catéter. Un ECA con 65 pacientes encontraba que la dosis inicial más alta conseguía mejores resultados en relación con conseguir un flujo adecuado para HD y un menor consumo final de UK. Ambos grupos recibían tratamiento preventivo con warfarina | |
| Tenecteplasa frente a placebo. Un ECA con 149 pacientes encontraba diferencias a favor de tenecteplasa en resultados a corto plazo en relación con el porcentaje de CVC permeables al cabo de 1h de la infusión y al aumento del flujo sanguíneo | |
| Alteplasa en tiempo corto frente a largo en el CVC. Un ECA con 60 pacientes no encontró diferencias estadísticamente significativas en relación con la tasa de permeabilidad del CVC (en la siguiente sesión de HD y a las 2 semanas) ni en supervivencia del catéter, y consideraba que la alteplasa es una opción a corto plazo que permite una ventana de 2 semanas durante la cual se deben instaurar tratamientos más definitivos | |
| Otro ECA, con 82 pacientes, comparaba dos opciones de administración de la alteplasa, push versus dwell (empujar frente a permanencia), y no encontró diferencias estadísticamente significativas en tasas de permeabilidad o en supervivencia del CVC hasta la siguiente intervención necesaria, ni en el flujo sanguíneo postrombólisis o los litros procesados por hora en la siguiente sesión de HD, considerando que el protocolo de empuje es eficaz y seguro y más práctico que el de permanencia más larga de la infusión | |
| Valores y preferencias de los pacientes. No se han identificado estudios relevantes relacionados con este aspecto | |
| Uso de recursos y costes. No se han identificado estudios relevantes relacionados con este aspecto | |
La utilización de fibrinolíticos introducidos por la luz del CVC ha venido utilizándose desde hace años con buenos resultados. Junto a estos tratamientos se han utilizado otros destinados a la eliminación mecánica de la vaina de fibrina.
En la bibliografía se han encontrado varias revisiones sistemáticas o narrativas de las que se han localizado los ECA cuyos resultados se presentan a continuación778,783,791,795,814.Pelado (stripping) percutáneo de la vaina de fibrina frente a infusión de urocinasa
En un ECA, Gray et al810 comparan 28 pacientes tratados con stripping percutáneo con 29 tratados con infusión de UK (30.000 U/h, para un total de 250.000 U), en CVT con tasas de flujo < 250ml/min y con flujo de referencia establecido como ≥ 300ml/min o tasas de flujo de 50ml/min menores de los valores más altos establecidos de flujos basales. Los resultados fueron los siguientes:
- •
El éxito clínico inicial: el 89% (25 de 28) para stripping percutáneo y el 97% (28 de 29) para UK.
- •
Las tasas de permeabilidad primaria a los 15, 30 y 45 días: el 75% (n = 20), el 52% (n = 13) y el 35% (n = 8) para stripping percutáneo y el 86% (n = 21), el 63% (n = 13) y el 48% (n = 9) para UK.
- •
La mediana de duración adicional de la función del CVC fue de 32 días (IC del 95%, 18-48 días) para stripping percutáneo y 42 días (IC del 95%, 22-153 días) para UK.
No encontraron diferencias estadísticamente significativas en las curvas de supervivencia del CVC (p = 0,236).Pelado (stripping) percutáneo de la vaina de fibrina frente al recambio del catéter venoso central
El ECA de Merport et al811 comparaba la eficacia de dos tratamientos para el mal funcionamiento del CVT para HD: 15 intervenciones de stripping percutáneo de la vaina de fibrina percutánea frente a 22 recambios de CVC sobre guía en 30 pacientes adultos con mal funcionamiento de CVC de HD (tasas de flujo < 200ml/min). La tasa de éxito técnico global fue del 97%.
Los CVC recambiados eran significativamente mejores para conseguir la permeabilidad adecuada para diálisis durante 4 meses (el 23 frente al 0%; p = 0,05); medida principal de resultados en ese estudio.
La media de duración del CVC era de 52 días para recambio de CVC frente a 25 días para stripping (p < 0,001).
La media de la permeabilidad del CVC era de 52,2 ± 43 días para el grupo de recambio de CVC y de 24,5 ± 29,3 días para el grupo tratado con stripping percutáneo (p < 0,0001). Después del recambio de CVC, las tasas de permeabilidad a los 1, 2, 3 y 4 meses fueron de 71, 33, 27 y 27%, en comparación con 31, 16, 7 y 0% después del stripping (p = 0,04).
Los costes eran mayores para el stripping (3.022 frente a 2.586 dólares; p < 0,01).
El ECA concluye que el stripping no debe considerarse como terapia habitual para el malfuncionamiento del CVC.Angioplastia con balón de la vaina frente a no intervención
El ECA de Oliver et al813 era un estudio piloto que analizaba la efectividad de la ATP de la vaina sobre la permeabilidad y sla función del CVC en 18 pacientes aleatorizados a ATP con balón frente a 12 pacientes aleatorizados a ningún tratamiento.
Los resultados fueron los siguientes:
- •
La mediana de tiempo para repetir el recambio del CVC fue de 411 y 198 días, respectivamente (p = 0,17).
- •
La mediana de tiempo para repetir la intervención fue de 373 y 97,5 días, respectivamente (p = 0,22).
- •
El flujo de sangre, 340 frente a 329ml/min (p < 0,001); fue estadísticamente significativa pero clínicamente pequeña (11ml/min).
No se ha identificado en la bibliografía ningún estudio que permita valorar este aspecto.Fibrinolíticos
No se han encontrado ECA que comparen directamente distintos trombolíticos entre sí.
UK en alta dosis (100.000 UI) frente a dosis más baja (25.000 UI) para trombosis del CVC.
En el ECA de Donati et al801 se comparaban dos dosis iniciales de UK para el tratamiento de la trombosis del CVC. Los resultados fueron:
- •
Dosis 25.000 UI (29 casos). Flujo adecuado (≥ 250ml/min): 4 casos (13,7%) y los 25 restantes (86,3%) requirieron posterior adición de 50.000 UI, y luego otras 75.000 UI en la siguiente sesión de HD.
- •
Dosis 100.000 UI (36 casos). Flujo adecuado (≥ 250ml/min): 36 casos (100%), y se necesitó tratar con 100.000 UI a 12 casos (33,3%) en la siguiente sesión de HD.
Ambos grupos recibían tratamiento preventivo con warfarina.Tenecteplasa frente a placebo
En el ECA de Tumlin et al794, con 149 pacientes, 74 tratados con tenecteplasa durante 1h y 75 con placebo, los resultados fueron los siguientes:
- •
CVC permeables al de 1h de la infusión: 22% de los pacientes en el grupo de tenecteplasa frente al 5% en el de placebo (p = 0,004).
- •
Cambio en flujo sanguíneo: aumento de 47ml/min en el grupo tenecteplasa frente a 12ml/min en el grupo de placebo (p = 0,008).
Se observaron cuatro infecciones del torrente sanguíneo relacionadas con el CVC (una con tenecteplasa, tres con placebo) y una trombosis (con tenecteplasa).Alteplasa en tiempo corto frente a largo
Un ECA798 con 60 pacientes evaluaba el tiempo óptimo de permanencia de la alteplasa en el catéter, comparando 1h (26 pacientes) con más de 48h antes de la siguiente sesión de HD (34 pacientes).
No se encontraron diferencias estadísticamente significativas en ninguna de las medidas de resultado siguientes:
- •
Tasa de permeabilidad del CVC: en la siguiente sesión de HD, el 76,9 frente al 79,4%; a las 2 semanas, el 42,3 frente al 52,9%.
- •
Supervivencia del CVC: mediana de 14 días para la opción de corto plazo y de 18 para la larga (p = 0,621).
Consideran que la alteplasa es una opción a corto plazo, que permite una ventana de 2 semanas durante la cual se deben instaurar tratamientos más definitivos.
Otro ECA799, con 82 pacientes, comparaba dos opciones de administración de la alteplasa, push versus dwell (empuje frente a permanencia; 30min frente a 2h).
No se encontraron diferencias estadísticamente significativas en ninguna de las medidas de resultado siguientes:
- •
Tasa de permeabilidad del CVC: el 82% (32 de 39) en el protocolo de empuje frente al 65% (28 de 43) de los CVC que reciben el protocolo de permanencia larga para superar los 300ml/min (p = 0,08).
- •
Supervivencia del CVC hasta la siguiente intervención necesaria en CVC: media de 65,5 frente a 59,3 días (p = 0,76).
- •
Flujo sanguíneo postrombólisis: diferencia de medias,
- •
–16,26ml/min (IC del 95%, –44,68 a 14,16; p = 0,29).
- •
Litros procesados por hora en la siguiente sesión de HD: diferencia de medias 0,026 (IC del 95%, –1,302 a 1,353; p = 0,969).
Consideran que el protocolo de empuje es eficaz y seguro y más práctico que el de permanencia de la infusión durante 2h.De la evidencia a la recomendación
Ante la disfunción del CVT existen diferentes estrategias que incluyen la utilización de fibrinolíticos, las maniobras intervencionistas como el stripping o la ATP de la vaina de fibrina y, por último, el recambio de CVC. Existen estudios realizados en forma de ECA, aunque los tamaños muestrales son limitados.
De los tratamientos evaluados, el basado en fibrinolíticos puede plantearse de un modo razonable como la primera aproximación terapéutica, debido a que no es invasivo y los resultados son aceptables en supervivencia y recuperación del flujo. En el caso de utilizarse UK, las dosis más altas presentan mejores resultados. No hay estudios comparativos con infusión continua.
De los tratamientos intervencionistas, el stripping ha demostrado peores resultados respecto al recambio de catéter. La ATP con balón de la vaina de fibrina, aunque las diferencias no son significativas, es capaz de aumentar en más del doble el período sin intervención sobre el CVC. Por lo que en el abordaje del CVC disfuncionante se sugiere que el primer paso sea el uso de un tratamiento no invasivo, como el tratamiento fibrinolítico, y si este se demostrase insuficiente, el siguiente sería el planteamiento del recambio de catéter con ATP de la vaina de fibrina.
La disfunción persistente del CVT obligaría a plantear la recolocación del CVC en otra localización en caso de que el paciente conserve sitios disponibles.
R 6.8.4) Se sugiere, ante la necesidad de sustitución del catéter venoso central tunelizado por fracaso del tratamiento fibrinolítico, el recambio del catéter sobre guía, siempre y cuando no exista infección del túnel o sepsis relacionada con el catéter. Se sugiere asociar la angioplastia de la vaina de fibrina antes de la colocación del nuevo catéter
R. 6.8.5) Ante la disfunción del catéter venoso central tunelizado se sugiere no realizar tratamiento de la vaina de fibrina mediante pelado o stripping
→ Pregunta clínica XXIX ¿Qué influencia tienen los diferentes tipos de cebado o sellado de las luces del catéter venoso central en la disfunción y en la infección de este?
(Ver ficha de la Pregunta clínica XXIX en enlaces electrónicos)Razonamiento
La relevancia de la vaina de fibrina y la trombosis debida a la asociación que comparten con el sobrecrecimiento bacteriano, así como con la permeabilidad y la longevidad del catéter, ha llevado a la búsqueda de múltiples medidas preventivas815. Las soluciones de sellado se han venido utilizando desde la introducción de los CVT en la década de los ochenta del siglo pasado para prevenir el componente intraluminal asociado a la disfunción. De estas, la solución más comúnmente utilizada en el período interdialítico ha sido la heparina816 y posteriormente el citrato817.
El procedimiento estándar para mantener la permeabilidad del catéter es el sellado con heparina. Se trata de un anticoagulante polisacárido que inactiva la trombina y el factor X activado. Actúa mediante su unión a la antitrombina formando entonces un complejo con la trombina. Este complejo heparina-antitrombina-trombina convierte a la trombina en inactiva; de este modo inhibe su capacidad de convertir el fibrinógeno en fibrina818. La dosis habitualmente utilizada va de 1.000 a 10.000 U/ml, con un volumen suficiente para llenar la luz hasta la punta778. La concentración de heparina se ha ido disminuyendo con el fin de reducir el riesgo de anticoagulación sistémica819,820. El uso de concentraciones menores (2.500 a 1.000 U/ml) ha demostrado una eficacia equiparable a las 5.000 U/ml808,816. La fuga de heparina por la luz del catéter tras el cebado o durante la siguiente hora (leak phenomenon) puede tener efecto a nivel sistémico y explicar episodios de hemorragia821,822. Aunque menos frecuentes, otras complicaciones asociadas a la heparina incluyen la tromocitopenia823 o las reacciones alérgicas824.
En este contexto se ha propuesto el citrato como una alternativa, dado que no produciría este efecto sistémico819,821,825 y dado su poder antitrombótico y sus potenciales propiedades antibacterianas817,826. El citrato es un anticoagulante que bloquea la cascada de la coagulación mediante su unión a los iones de calcio, lo que impide la activación de las vías de la cascada dependientes del calcio. Su primer uso fue como anticoagulante para preservar la sangre y también durante muchos años como anticoagulante en las técnicas de HD continuas827. La ventaja del uso del citrato en el cebado cuando sale de la luz del CVC es que se metabolizaría rápidamente a bicarbonatos sin provocar cuadros de hemorragia sistémica828. Esto, unido a su efecto antimicrobiano, ha renovado su interés en la prevención de las infecciones relacionadas con el catéter. Por otro lado, sin embargo, ha habido cierta inquietud por la toxicidad del citrato y la presencia de arritmias en caso de sellados con volumen excesivo, especialmente a altas concentraciones828. Tras la comunicación de un caso de una parada cardíaca fatal tras el uso de citrato trisódico al 46,7% se produjo la retirada del TriCitrasol por la Food and Drug Administration en 2000829. Sin embargo, a más bajas concentraciones, con el 4%, se ha utilizado ampliamente con resultados comparables a la heparina827.
Otras soluciones posteriores incluyen citrato trisódico a diferentes concentraciones, antibióticos, anticoagulantes como alteplasa, tecneplase o dicumarínicos, así como diferentes combinaciones de estos827,830. En relación con los antibióticos, algunas soluciones de sellado han demostrado una reducción en el riesgo de bacteriemias en comparación con la heparina831,832, pero no se recomiendan de modo rutinario, tanto por su falta de evidencia de eficacia (v. Pregunta clínica XXX) como por el riesgo de desarrollo de resistencias833. Como resultado de la aparición de cepas con susceptibilidad reducida o resistencia a antibióticos se han sugerido alternativas como la taurolidina. La taurolidina es un derivado del aminoácido taurina. Se trata de un antimicrobiano de amplio espectro contra bacterias y hongos834. Se cree que los derivados metilados interactúan con los componentes de las paredes bacterianas, provocando su destrucción, así como también parecen reducir la adherencia de las bacterias a las células epiteliales humanas in vitro835. No se ha documentado resistencia bacteriana, dado que el modo de actuar de la taurolidina se asemeja más a un desinfectante que a un antibiótico836.
Se ha realizado una revisión de la bibliografía en la búsqueda de los estudios controlados con diferentes soluciones de sellado frente a heparina para comparar la eficacia en la prevención de la disfunción, trombosis o pérdida del CVC y prevención de la infección.
| Resumen de la evidencia | |
|---|---|
| Sellado con citrato frente a heparina. Metaanálisis de ECA no encuentran diferencias estadísticamente significativas entre sellado con citrato y sellado con heparina en relación con la duración media del catéter, trombosis del CVC, retirada del catéter, readmisiones relacionadas con el CVC, bacteriemias, infecciones del sitio de salida o mortalidad. La incidencia de hemorragias es menor en tratados con citrato | Calidad baja |
| Sellado con citrato más antimicrobianos frente a heparina. Metaanálisis de ECA encuentran que añadir antimicrobianos al citrato en el sellado no se asocia con diferencias en la duración del CVC o en la retirada de este por disfunción | |
| Añadir gentamicina al citrato se asocia a menor riesgo de bacteriemias e infecciones del sitio de salida | |
| Sellado con heparina frente a activador tisular del plasminógeno. Un ECA que compara heparina 3 días a la semana frente a rt-PA 1 día a la semana y heparina otros 2 días posteriores a la semana, encuentra que la opción con rt-PA se asocia a menor riesgo de malfuncionamiento del CVC y de bacteriemia relacionada con el CVC | |
| Uso de recursos y costes. El ECA de Hemmelgarn et al246 estima los costes medios (en dólares canadienses) de rt-PA y heparina en 1.794 y 195 dólares, respectivamente, y el coste del manejo de las complicaciones asociadas a un mal funcionamiento del CVC y bacteriemia relacionada con el CVC por paciente fue de 156 dólares con rt-PA y 582 dólares con heparina. Por lo tanto, el coste incremental de la atención de pacientes con rt-PA en comparación con la heparina fue de 1.173 dólares por paciente, o 13.956 dólares por episodio de bacteriemia relacionada con el CVC disfuncionante | |
| Valores y preferencias de los pacientes. No se han identificado estudios relevantes relacionados con este aspecto | |
La revisión sistemática con metaanálisis de Zhao et al828 incluyó 13 ensayos controlados aleatorios, que comprendían 1.770 pacientes y 221.064 días de CVC, y comparaba el citrato (solo o con antimicrobianos) frente a la heparina para el sellado del CVC. Los resultados fueron:
- •
Retirada del CVC por disfunción: sin diferencias significativas entre ambos.
- -
Citrato solo frente a heparina: 3 ECA y 21 378 días de catéter (RR: 0,94; IC del 95%, 0,59-1,49; p = 0,78).
- -
Citrato más antimicrobianos frente a heparina: 3 ECA y 143 604 días de catéter (RR: 1,06; IC del 95%, 0,41-2,69; p = 0,91).
- -
- •
Duración media del CVC: sin diferencias significativas. Diferencia de medias 3 ECA (–32,81 días; IC del 95%, –82,91 a 17,29; p = 0,2).
- •
Incidencia de hemorragias: 2 ECA (RR: 0,48; IC del 95%, 0,300,76; p = 0,002 —significativamente menor en los pacientes que recibieron sellado con citrato—).
- •
Trombosis del CVC: sin diferencias significativas. 2 ECA (RR: 1,04; IC del 95%, 0,46-2,34; p = 0,9).
- •
Tratamientos trombolíticos:
- -
Citrato solo frente a heparina: sin diferencias significativas.3 ECA y 55 851 días de catéter (I2: 77%; RR: 1,25; IC del 95%, 0,74-2,11; p = 0,41).
- -
Citrato más gentamicina frente a heparina: 2 ECA con 76.496 días de catéter (RR: 0,62; IC del 95%, 0,38-1,00; p = 0,05).
- -
Citrato más taurolidina frente a heparina: 1 ECA con 150.118 días de catéter (RR: 2,47; IC del 95%, 1,68-3,63; p < 0,00001).
- -
- •
Mortalidad por cualquier causa: sin diferencias significativas. 7 ECA (RR: 0,81; IC del 95%, 0,53-1,23; p = 0,3).
- •
Readmisiones relacionadas con el CVC: sin diferencias significativas. 2 ECA (RR: 0,61; IC del 95%, 0,13-2,74; p = 0,5).
- •
Bacteriemias relacionadas con el CVC: el metaanálisis combinado global encontraba que los sellados con citrato eran mejores que los de heparina: 11 ECA con 217.128 días de catéter (RR: 0,39; IC del 95%, 0,27-0,56; p < 0,001).
Sin embargo, aunque el análisis de subgrupos mostró que los sellados con distintos antimicrobianos eran mejores que la heparina, en el sellado únicamente con citrato la diferencia no era significativa.
- -
Citrato solo frente a heparina: 3 ECA con 56.746 días de catéter (I2: 67%; RR: 0,54; IC del 95%, 0,22-1,30; p = 0,17).
- -
Citrato más gentamicina frente a heparina: 4 ECA con 85.343 días de catéter (RR: 0,25; IC del 95%, 0,13-0,47; p = 0,0001).
- -
Citrato más taurolidina frente a heparina: 3 ECA con 25.370 días de catéter (RR: 0,45; IC del 95%, 0,27-0,77; p = 0,003).
- -
Citrato más azul de metileno más metilparabeno más propilparabeno frente a heparina: 1 ECA con 49.669 días de catéter (RR: 0,29; IC del 95%, 0,12-0,72; p = 0,008).
El análisis desagregado por valores de concentración del citrato mostraba que las concentraciones bajas (1,04-4%) a moderadas (4,6-7%) de sellado con citrato se asociaron con una menor incidencia de esas infecciones (p < 0,001 y p = 0,003, respectivamente), pero los pacientes que recibieron alta concentración (30-46,7%) de citrato no tenían diferencias significativas frente a los sellados con heparina (p = 0,3).
- -
- •
Infecciones del sitio de salida: diferencias no significativas.
- –
Citrato solo frente a heparina: 4 ECA con 59.942 días de catéter (I2: 60%; RR: 0,73; IC del 95%, 0,35-1,53; p = 0,41).
- –
Citrato más gentamicina frente a heparina: 2 ECA con 78.683 días de catéter (RR: 0,57; IC del 95%, 0,20-1,57; p = 0,28).
- –
Citrato más taurolidina frente a heparina: 2 ECA con 21.175 días de catéter (RR: 1,09; IC del 95%, 0,44-2,74; p = 0,85).
- –
Recientemente se han publicado 2 revisiones sistemáticas que analizan el efecto de distintos tipos de sellado en comparación con la heparina. En la primera revisión, que incluye 10 ensayos clínicos y 2 estudios observacionales controlados, comparan el sellado con heparina con otros métodos, incluido el citrato, sin encontrar diferencias en cuanto a la permeabilidad y disfunción del CVC (10 ensayos; RR: 0,89; IC del 95%, 0,56-1,39)830.
Otra revisión 837 mostró resultados similares, aunque se observó una disminución significativa, en el porcentaje de hemorragias al sellar con citrato (ensayos; RR: 0,48; IC del 95%, 0,30-0,75), sin encontrar diferencias en cuanto a mortalidad (3 ensayos; RR: 0,71; IC del 95%, 0,42-1,24). A diferencia de Zhao et al828, esta última revisión no mostró que el sellado con citrato redujera la incidencia de bacteriemia relacionada con el CVC (RR: 0,54; IC del 95%, 0,23-1,29), aunque estos resultados podrían explicarse por el menor número de estudios que considera este análisis (3 ensayos, frente a los 7 ensayos que aportaron datos de bacteriemia en la revisión de Zhao et al)837.
Finalmente, otra revisión sistemática838 analizó 6 ensayos clínicos (3 de los cuales en pacientes de HD) que comparaban el cebado de citrato combinado con el antimicrobiano taurolidina frente a heparina. Al igual que en la revisión de Zhao et al828, la combinación de citrato y taurolidina redujo significativamente el riesgo de bacteriemia relacionada con el CVC (3 ensayos; RR: 0,46; IC del 95%, 0,24-0,89), pero no mostró diferencias en la incidencia de trombosis del CVC (3 ensayos; RR: 2,16; IC del 95%, 0,72-6,74)838.Sellado con heparina frente a activador tisular del plasminógeno
Las revisiones publicadas sobre este tema839,840 localizan un ECA de diseño paralelo249 y 2 de diseño cruzado841,842. En una de las revisiones, Firwana et al840 señalan que estos dos últimos estudios de diseño cruzado reportaban los resultados al final de las dos fases del estudio; por ello se analiza únicamente los resultados del ECA. Este compara heparina 3 días a la semana frente a rt-PA 1 día a la semana y heparina otros 2 días posteriores a la semana y encuentra que la opción con rt-PA se asocia a menor riesgo de malfuncionamiento del CVC y de bacteriemia relacionada con el CVC.De la evidencia a la recomendación
Tras la revisión de la evidencia disponible, que utiliza la heparina como grupo control, en relación con otros tipos de sellado, como el citrato o el rt-PA, no encuentra diferencias entre ellos, por lo que se puede recomendar indistintamente cualquiera de ellos para la disfunción y prevención de la infección.
Diferentes revisiones sistemáticas, basadas en los mismos estudios que los incluidos en la revisión principal evaluada para el desarrollo de la pregunta clínica, han mostrado resultados similares, fundamentalmente centrados en la reducción del riesgo de bacteriemia asociada al catéter y la incidencia de hemorragia del citrato frente a las heparinas.
6.9Infección relacionada con el catéterRecomendacionesR 6.9.1) Ante la sospecha de una bacteriemia relacionada con el catéter venoso central y antes de la administración de antibioterapia empírica, se recomienda extraer dos muestras sanguíneas para hemocultivos de sangre periférica y, si se decide mantener el catéter, realizar una extracción simultánea de sangre a través de las luces del catéter venoso central y de una vena periférica. Para su diagnóstico deberán cultivarse mediante una técnica cuantitativa o se realizará el cálculo de la diferencia del tiempo en la positividad entre ambos
R 6.9.2) Se recomienda la retirada del catéter venoso central en la bacteriema relacionada con el catéter si se trata de un catéter venoso central no tunelizado, existe una infección local complicada (tunelitis), una infección sistémica complicada (shock séptico, persistencia de fiebre o de hemocultivos positivos a las 72h de haber iniciado un tratamiento antibiótico adecuado, infecciones metastásicas tipo endocarditis, tromboflebitis o espondilodiscitis) o el paciente es portador de otro material protésico intravascular (marcapasos, prótesis endovasculares, válvulas, etc.)
R 6.9.3) En los casos de sospecha de bacteriema relacionada con el catéter se recomienda iniciar antibioterapia empírica sistémica de amplio espectro, a la espera de los resultados microbiológicos
NUEVA R 6.9.4) Se recomienda realizar inicialmente el tratamiento simultáneo con antibioterapia sistémica y sellado con antibiótico en las bacteriemias relacionadas con el catéter no complicadas
NUEVA R 6.9.5) Después de la retirada de un catéter venoso central tunelizado infectado, se sugiere que la reimplantación de uno nuevo se realice una vez establecido el tratamiento antibiótico apropiado y tras haber obtenido hemocultivos de control negativos. A ser posible debe colocarse en un lugar anatómico diferente al que ocupó el retirado
NUEVA 6.9.6) Se recomienda no administrar profilaxis antibiótica de manera rutinaria antes de insertar o manipular un catéter venoso central
(•) NUEVA R 6.9.7) Se recomienda no utilizar rutinariamente la profilaxis antibiótica en el sellado del catéter venoso central tunelizado para hemodiálisis
(•) NUEVA R 6.9.8) Se recomienda la retirada del catéter venoso central en bacteriemias relacionadas con el catéter por microorganismos virulentos como Staphylococcus aureus, Pseudomonas spp., Candida spp. o microorganismos multirresistentes.
(•) NUEVA R 6.9.9) En la elección empírica de los antibióticos, se recomienda incluir antimicrobianos con actividad frente a microorganismos grampositivos y gramnegativos, dependiendo de la epidemiología de cada unidad de hemodiálisis, sensibilidad y patrones de resistencia de sus microorganismos habituales, factores de riesgo del paciente y gravedad de la infección
(•) NUEVA R 6.9.10) Se sugiere utilizar vancomicina como primera opción para el tratamiento empírico de microorganismos grampositivos en las unidades de hemodiálisis
(•) NUEVA R 6.9.11) Se sugiere utilizar daptomicina para el tratamiento empírico de la bacteriemia relacionada con el catáter en las unidades de hemodiálisis en que los cultivos de Staphylococcus aureus resistente a meticilina muestren valores de concentración mínima inhibitoria de la vancomicina ≥ 1,5μg/ml, en pacientes con shock séptico o con alergia conocida a la vancomicina
(•) NUEVA R 6.9.12) Se sugiere no realizar de forma rutinaria la detección y el tratamiento antibiótico local o sistémico para la erradicación de Staphylococcus aureus en pacientes portadores nasales
NUEVA R 6.9.13) Cuando la sospecha de bacteriemia relacionada con el catéter se produce durante la sesión de hemodiálisis (o si no es posible obtener hemocultivos por punción de una vena periférica), se sugiere extraer dos muestras sanguíneas, separadas entre sí de 10 a 15min, a través de la línea arterial del circuito extracorpóreo sin necesidad de interrumpir la sesión de hemodiálisis
La infección relacionada con el CVC es la complicación más frecuente y grave de los CVC, asociada a una elevada morbilidad y mortalidad843. La incidencia de bacteriemia relacionada con el CVC es de 2,5 a 5 episodios por 1.000 días de utilización del catéter, lo cual se corresponde con una incidencia de 0,9 a 2 episodios de bacteriemia relacionada con el catéter (BRC) por catéter y año844–847. En pacientes portadores de CVC, el riesgo de presentar una bacteriemia es 10 veces más alto que en pacientes con una FAVn192,848–850. La BRC es de 2 a 3 veces más frecuente en los CVNT que en los CVT192,673. La infección relacionada con los CVC suele ser la causa de su retirada y de complicaciones graves como osteomielitis, endocarditis, tromboflebitis y muerte entre un 5 y un 10% de los pacientes portadores de CVC687,844,851,852. Las infecciones metastásicas graves se presentan más frecuentemente en infecciones producidas por S. aureus, que es uno de los microorganismos más frecuentemente aislados (10-40%)853. Es importante resaltar que estas complicaciones metastásicas pueden no ser evidentes inicialmente y aparecer semanas o incluso meses después del episodio inicial de BRC.
Se definen tres tipos de infecciones asociadas a CVC para HD747,833:
- •
Infección local no complicada. Definida como la existencia de signos inflamatorios limitados a 2cm alrededor del orificio de salida cutáneo, sin extensión superior hacia el manguito del catéter si este fuese tunelizado. Puede estar asociada o no a fiebre y bacteriemia, y acompañarse de exudado purulento a través del orificio de salida cutáneo.
- •
Infección local complicada. Definida como la aparición de signos inflamatorios que se extienden más allá de 2cm del orificio de salida cutáneo y en el trayecto subcutáneo del catéter (tunelitis). Puede estar asociada o no a fiebre y bacteriemia, y acompañarse de exudado purulento a través del orificio de salida cutáneo.
- •
Infección sistémica o bacteriemia relacionada con el catéter. Definida como el aislamiento de un mismo microorganismo en sangre y CVC en ausencia de otro foco de infección. Se considera infección sistémica complicada cuando existe shock séptico, persiste la fiebre y/o los hemocultivos se mantienen positivos a las 48-72h del inicio del tratamiento antibiótico adecuado, existen complicaciones metastásicas (endocarditis, tromboflebitis o espondilodiscitis) o material protésico intravascular.
Las manifestaciones clínicas más sensibles, aunque poco específicas para el diagnóstico de la BRC, son la fiebre y/o los escalofríos854–856, mientras que la presencia de exudado o los signos inflamatorios locales en el orificio de salida cutáneo del CVC son más específicos, pero mucho menos sensibles. De hecho, en la mayoría de casos de BRC no se constata infección del orificio de entrada857. Otras manifestaciones clínicas menos frecuentes son la inestabilidad hemodinámica, alteración del nivel de conciencia, disfunción del CVC y signos o síntomas relacionados con la sepsis. En ocasiones, las propias complicaciones de una bacteriemia (endocarditis, artritis séptica, osteomielitis o abscesos) pueden ser la primera manifestación de una BRC.
La BRC debe sospecharse clínicamente cuando un paciente portador de un CVC de HD presenta un cuadro de fiebre o escalofríos y/o cualquier alteración clínica o hemodinámica sugestiva; dicha sospecha viene reforzada si este episodio se asocia a su manipulación o a signos inflamatorios locales en el punto de inserción o en el túnel subcutáneo del catéter. Se realizará entonces la evaluación del episodio mediante una historia clínica y una exploración física básica, con el objeto de excluir otros posibles focos de infección diferentes al CVC. Dependiendo de los resultados de la valoración inicial, se realizarán exploraciones complementarias analíticas y radiológicas.
El criterio clínico aislado es insuficiente para establecer el diagnóstico de BRC. Por tanto, el diagnóstico de BRC comporta la evaluación clínica y la confirmación microbiológica mediante cultivos de sangre y/o del CVC. Las técnicas diagnósticas de referencia se basan en el cultivo del extremo distal del catéter después de la retirada de este858–862; así, el diagnóstico de BRC se establece con la positividad de dicho cultivo y el aislamiento de este microorganismo en el hemocultivo. En los últimos años se han desarrollado nuevas pruebas diagnósticas, con la finalidad de evitar la retirada injustificada del CVC y el riesgo potencial asociado a la colocación de uno nuevo en otra localización. Asimismo, se considera en la actualidad que no siempre es necesaria la retirada del CVC para un diagnóstico y tratamiento adecuados854,855,863–866.
La técnica de hemocultivos cuantitativos, obtenidos simultáneamente a través del CVC y de la punción directa de una vena periférica (relación del número de unidades formadoras de colonias por mililitro [UFC/ml] de 3:1 a 10:1) se considera indicativa de BRC, con una sensibilidad del 79-94% y una especificidad del 94-100%867–871.
A pesar de su alta especificidad, esta técnica no es un método rutinario en la mayoría de los laboratorios de microbiología debido a su complejidad y coste. Dado que muchos hospitales disponen de aparatos automáticos para la detección del crecimiento microbiano en muestras sanguíneas, se ha propuesto un método alternativo a los hemocultivos cuantitativos que mide la diferencia del tiempo en la positividad de los hemocultivos obtenidos simultáneamente a través del CVC y por venopunción directa. La base de esta técnica radica en que el tiempo de positividad de las muestras sanguíneas tiene relación directa con el número de microorganismos presentes inicialmente en la muestra872, de manera que cuando la positividad de los hemocultivos extraídos a través del CVC se produce al menos 2h antes que la de los obtenidos tras punción de una vena periférica, se considera que existe un tiempo diferencial positivo. El cálculo del tiempo diferencial presenta una sensibilidad del 94% y una especificidad del 91% para el diagnóstico de la BRC en pacientes portadores de un CVC873,874.
Ante la sospecha de una BRC y antes de la administración de antibióticos, se deberán extraer dos hemocultivos por venopunción obtenidos de diferentes localizaciones o separados entre sí de 10 a 15min. Tras la retirada del CVC se procederá al cultivo del segmento distal. En los casos en los que se decida mantenerlo, se realizará una extracción pareada y simultánea de sangre a través de todas las luces del CVC y de la vena periférica.
La confirmación microbiológica de la BRC se establecerá cuando:
- •
Se aísle el mismo microorganismo en el extremo distal del CVC y como mínimo en un hemocultivo obtenido por punción venosa periférica.
- •
Se aísle el mismo microorganismo como mínimo en dos hemocultivos (uno a través de las luces del CVC y otro por punción de una vena periférica) y se cumplan los criterios diagnósticos para hemocultivos cuantitativos o se calcule un tiempo diferencial positivo.
En un número significativo de pacientes de HD no es posible la obtención de muestras sanguíneas de vena periférica por la dificultad de acceder a la trama venosa, debido a AV previos trombosados o a la necesidad de preservarlas para la creación de un AV833,844,875. Cuando no sea posible obtener hemocultivos por punción de una vena periférica, se sugiere extraer dos muestras sanguíneas a través de ambas luces del CVC876–878 o de la línea arterial del circuito extracorpóreo. El diagnóstico de BRC se considerará posible en pacientes sintomáticos, si no existe evidencia de otro foco de infección y los hemocultivos son positivos. Aunque la especificidad y el valor predictivo positivo para el diagnóstico de BRC son mucho mayores en las muestras sanguíneas obtenidas por punción periférica que en las obtenidas a través del CVC, ambas tienen un alto valor predictivo negativo879–881.
Si el microorganismo aislado en un único hemocultivo es un estafilococo coagulasa negativo, será necesario obtener nuevas muestras sanguíneas para comprobar si se trata de una contaminación o de una verdadera BRC.
En los casos en que se retire el CVC por sospecha de BRC, se deberá realizar el cultivo del extremo distal del CVC mediante técnicas cuantitativas o semicuantitativas. Se considerará colonización cuando en el crecimiento se cuantifiquen más de 15UFC/ml (técnica de Maki) o más de 1.000UFC/ml (técnica de Cleri)860–862,881a. Los cultivos de CVC retirados no deberán realizarse sistemáticamente en ausencia de sospecha de infección882.Tratamiento de la infección asociada a catéter
Los microorganismos más frecuentemente aislados en la BRC son los grampositivos. Los estafilococos coagulasa negativos junto a S. aureus constituyen el 40-80% de los casos, por lo que el tratamiento inicial debe ser eficaz frente a estos microorganismos a la espera de la confirmación microbiológica844,863,883,884. La infección por S. aureus se ha asociado a una elevada morbilidad y mortalidad853,885–887.
Las BRC no estafilocócicas son debidas predominantemente a enterococos, corinebacterias y bacilos gramnegativos. La BRC por gramnegativos está aumentando en los últimos años, y en algunos centros puede representar hasta el 30-40%707,844,883.
El tratamiento de la BRC implica, por un lado, el inicio de la terapia antibiótica sistémica y, por otro, la gestión del CVC en relación con su retirada o preservación. Por tanto, una vez iniciado el tratamiento antibiótico tendremos que decidir entre las siguientes opciones:
Retirada inmediata833
- •
Todos los CVNT.
- •
Infección local complicada.
- •
Presencia de shock séptico.
- •
Persistencia de fiebre o bacteriemia 48-72h después de haber iniciado un antibiótico adecuado a la sensibilidad de los microorganismos.
- •
Evidencia de infección metastásica (endocarditis, tromboflebitis supurativa, espondilodiscitis, etc.).
- •
Aislamiento de microorganismos muy virulentos:
- •
S. aureus, Pseudomonas spp., Candida spp. o microorganismos multirresistentes.
Una vez retirado el CVC infectado, la mejor alternativa será colocar un nuevo CVNT, a ser posible en un lugar anatómico diferente. Aunque no disponemos en la actualidad de suficiente evidencia, el GEMAV sugiere que la reimplantación de un nuevo CVT se realice una vez establecido el tratamiento antibiótico apropiado y tras haber obtenido hemocultivos de control negativos. También, si fuese posible, debe colocarse en un lugar anatómico diferente al que ocupó el retirado.Sellado de las luces del catéter con solución antibiótica
En la BRC no complicada puede intentarse el tratamiento conservador manteniendo el CVC en funcionamiento. Experiencias previas, en las que se mantuvo el CVC y se realizó tratamiento antibiótico sistémico por vía intravenosa —i.v.— (en ocasiones a través del propio CVC colonizado), mostraron porcentajes de curación que oscilaron entre el 32 y el 74% junto a un elevado riesgo de recidiva al suspender los antibióticos845,888–891.
Los microorganismos que se desarrollan formando biofilms se establecen de forma universal en todos los catéteres endovasculares, y ocupan tanto la superficie externa (fundamentalmente en CVC de corta duración) como la intraluminal (fundamentalmente en CVC de larga duración)892. Los microorganismos causantes de la infección se localizan en el interior de la biocapa en la superficie interna del catéter, y esto les confiere una resistencia a la acción de los antibióticos y explicaría la dificultad para erradicar la infección de los CVC tratados únicamente con antibióticos i.v.893.
Se ha comprobado que manteniendo la superficie intraluminal del CVC en contacto con una solución antibiótica a altas concentraciones y durante un tiempo prolongado, es posible erradicar los microorganismos utilizando concentraciones de antibiótico al menos 1.000 veces superiores a las de la concentración mínima inhibitoria (CMI)894–897.
Así, la modalidad de tratamiento mediante el sellado de la luz del CVC con una solución antibiótica altamente concentrada se conoce como sellado con antibióticos (SA) o antibiotic lock therapy865 y se considera una buena opción terapéutica del tratamiento de la infección del CVC.
En la revisión sistemática de Aslam et al898, con metaanálisis de estudios observacionales del tratamiento de la BRC del CVT en HD, se obtuvo una proporción similar de curaciones entre el SA y el recambio del CVC a través de una guía (alternativa terapéutica que se explica más adelante), aunque en la BRC por S. aureus se observó un mayor número de éxitos con el recambio del CVC. Los estudios publicados en pacientes en HD tratados mediante SA son en su mayoría descriptivos y muestran porcentajes de éxito que oscilan entre el 44 y el 100%. Se ha constatado que el éxito está relacionado con el tipo de microorganismo implicado, y se han descrito curaciones del 87-100% en pacientes con infecciones por microorganismos gramnegativos, del 75-84% para Staphylococcus epidermidis, del 61% para Enterococcus y de entre el 40 y el 55% para S. aureus853–856,899–901.
El SA consiste en instilar en el interior del catéter una solución concentrada de antimicrobiano, habitualmente con heparina. También se han utilizado otros anticoagulantes como el citrato sódico y EDTA (ácido etilendiamina tetraacético) en las soluciones de SA, con el objeto de prevenir la BRC902. Los antibióticos utilizados para el SA de los CVC han de ser estables desde el punto de vista químico, con actividad antimicrobiana prolongada (aproximadamente 1 semana) y sin que precipiten en su interior. Las concentraciones suelen oscilar entre 1 y 5mg/ml, habitualmente mezcladas con heparina al 1 o al 5% en un volumen suficiente para llenar la luz del catéter741.
El SA se administra rellenando ambas luces del CVC al finalizar cada sesión de HD, en condiciones de máxima asepsia, utilizando una jeringa y aguja diferentes para cada luz del catéter. En función de la organización del centro, la solución de SA se puede preparar en la farmacia o en la unidad de diálisis. El tratamiento con SA se realizará simultáneamente a la administración de la antibioterapia sistémica utilizando preferentemente el mismo antimicrobiano. La duración del tratamiento será la misma que la de los antibióticos sistémicos (habitualmente 2-3 semanas dependiendo de la etiología). Es necesaria una estrecha vigilancia de los pacientes, con el fin de detectar la persistencia de fiebre, hemocultivos positivos a las 48-72h de haber iniciado el tratamiento antibiótico adecuado a la sensibilidad microbiana, aparición de complicaciones sépticas o recidiva de la BRC. En estos casos se recomienda la retirada del CVC.
Existe una notable diversidad en los antimicrobianos elegidos y sus concentraciones a la hora de preparar la solución del sellado (tabla 30).
Soluciones de sellado descritas en la bibliografía y con potencial uso en la práctica clínica
| Microorganismo | Antimicrobiano | Concentración | Observaciones |
|---|---|---|---|
| Estafilococosa | Daptomicina | 5 mg/ml | Diluir en Ringer lactato (calcio) |
| Vancomicina | 2-5 mg/ml | Incompatible con heparina a concentraciones > 5 mg/ml | |
| Teicoplanina | 10 mg/ml | ||
| Enterococosb | Vancomicina + gentamicina | Ambos a 2 mg/ml | |
| Bacilos gramnegativosc | Levofloxacino | 5 mg/ml | Precipita con heparina |
| Amikacina | 10 mg/ml | ||
| Piperacilina-tazobactán | 10 mg/ml | ||
| Candida spp.d | Equinocandina | 5 mg/ml | |
| Anfotericina B liposomal | 1-5 mg/ml | ||
| Otros | Etanol | 70% |
Esta tabla no pretende ser un compendio exhaustivo y tampoco hay ensayos clínicos que proporcionen nivel de evidencia a su uso, por lo que únicamente refleja la opinión de expertos. El sellado antibiótico del catéter es parte necesaria pero no suficiente en el tratamiento. Toda pauta de sellado antibiótico debe ir acompañada de un tratamiento antibiótico sistémico que se prolongará en el tiempo dependiendo del patógeno implicado.
Solo está recomendado hacer tratamiento conservador en el caso de estafilococos coagulasa negativos. En el caso de bacteriemia asociada a catéter por Staphylococcus aureus, se recomienda la retirada del catéter.
bNo hay experiencia suficiente para recomendar tratamiento conservador. Sin embargo, si el paciente está estable y la bacteriemia es no complicada, se puede valorar un tratamiento conservador.
cEn el caso de Pseudomonas aeruginosa y otros bacilos gramnegativos no fermentadores (Acinetobacter spp., Stenotrophomonas spp., etc.), no hay una recomendación clara para realizar tratamiento conservador.
dEn el caso de candidemia asociada a catéter se recomienda retirar el catéter. En caso de que no pueda retirarse o la retirada se posponga, se puede realizar sellado antifúngico de este.
El sellado de los CVC con antisépticos como la taurolidina, el etanol o la combinación de citrato con azul de metilenoparabens o con taurolidina y heparina han mostrado eficacia frente a la biocapa bacteriana y en la profilaxis de la BRC903–907. Estas sustancias tendrían la ventaja de evitar la posible inducción de resistencia a los antibióticos, aunque la experiencia clínica en el tratamiento de la BRC es muy limitada para poder hacer recomendaciones.
El tratamiento de la BRC mediante antibióticos sistémicos solamente, manteniendo el CVC y sin realizar el SA, es insuficiente para la erradicación de los microorganismos en la biocapa y la curación en la mayoría de los casos de BRC898.Recambio del catéter venoso central infectado a través de una guía
El retraso en la retirada de un CVC infectado (cuando no tenga indicación de retirada inmediata o esta no haya sido posible en su momento) y recambio por un nuevo CVC a través de una guía metálica se considera una alternativa aceptable al SA. Esta opción terapéutica tiene como objetivo erradicar definitivamente la biocapa del interior del CVC causante de la infección y sería altamente efectiva en los casos en los que se constata disfunción del CVC infectado.
El recambio del CVC infectado a través de una guía metálica ha obtenido resultados similares de curación, cuando se comparó con la retirada inmediata en diferentes estudios no aleatorizados793,883,888,908.
La sustitución del CVC infectado a través de una guía metálica se planteará solo si los síntomas han desaparecido rápidamente. Aunque no hay un tiempo establecido, el GEMAV considera realizar el recambio del CVC al menos 48-72h tras haber iniciado el tratamiento antibiótico, cuando el paciente se mantenga clínicamente estable y no haya evidencia de infección en el túnel subcutáneo.
En los casos en que tras la mejoría clínica al iniciar los antibióticos se realiza el recambio del CVC, y posteriormente se confirma la positividad de los hemocultivos, parece prudente realizar nuevos hemocultivos para confirmar la resolución de la bacteriemia. Si esta no se ha producido se tendrá que retirar también el nuevo CVC.Tratamiento empírico de las infecciones relacionadas con el catéter747,833,875
El tratamiento empírico inicial en los pacientes en HD con sospecha de BRC debe incluir antibióticos de amplio espectro por vía i.v. para microorganismos grampositivos y gramnegativos. Se sugiere la utilización de vancomicina (o teicoplanina) como primera opción frente a microorganismos grampositivos, debido a la alta prevalencia de S. aureus resistente a meticilina (SARM) en las unidades de HD. La daptomicina se recomienda como primera opción cuando exista una elevada prevalencia de SARM con una CMI frente a vancomicina ≥ 1,5μg/ml o en casos graves con shock séptico o complicaciones metastásicas. Para cubrir los microorganismos gramnegativos asociaremos aminoglucósidos o cefalosporinas de tercera generación. Según la gravedad del paciente y las tasas de resistencia en la unidad se valorará la administración de piperacilina-tazobactam o carbapenemes para ampliar la cobertura frente a gramnegativos.
La combinación de vancomicina o daptomicina y gentamicina o ceftazidima puede ser adecuada en la mayoría de ocasiones, y por sus características farmacocinéticas permite una cómoda dosificación en HD. Las dosis habituales son:
- •
Vancomicina. Dosis inicial de 20mg/kg administrada durante la última hora de la sesión de HD. Se continuará inicialmente con 500mg en las siguientes sesiones, ajustándolo posteriormente por niveles plasmáticos909,910.
- •
Gentamicina. Dosis de 1,5-2mg/kg (se recomienda no sobrepasar los 100mg) administrada después de la sesión de HD, ajustándolo posteriormente por concentraciones plasmáticas.
- •
Cefazolina. Dosis de 1.000-2.000mg administrada después de la sesión de HD.
- •
Ceftazidima. Dosis de 2.000mg administrada después de la sesión de HD.
- •
Daptomicina. Dosis de 8 a 10mg/kg/48h. Se ha sugerido dosificar 6mg/kg despues de la HD o de 7 a 9mg/kg administrados durante los últimos 30min de la sesión de HD (3 veces a la semana), dependiendo de la permeabilidad del dializador911.
La elección del tratamiento antibiótico sistémico específico se desarrolla en la tabla 31.
Recomendaciones para el tratamiento antibiótico etiológico de la infección relacionada con el catéter (simultáneo al tratamiento de sellado si se mantiene el catéter venoso central)
| Pauta de elección | Pauta alternativa | Comentarios | |
|---|---|---|---|
| Tratamiento empírico | |||
| Grampositivos: vancomicina + gramnegativos: gentamicina o cefalosporina de tercera generación | Gram positivos: daptomicina si: shock séptico; complicaciones metastásicas; prótesis; SAMR previo con CMI para vancomicina ≥ 1,5; enterococo previo resistente a vancomicina Gramnegativos: si alergia o según gravedad: piperacilina-tazobactam/carbapenem | Valorar retirar el catéter | |
| Tratamiento antibiótico etiológico | |||
| Staphylococcus aureus sensible a meticilina | Cloxacilina o cefazolina | Daptomicina | Recomendable retirar catéter Duración: 3 semanas, 6-8 semanas si complicaciones metastásicas |
| Staphylococcus aureus resistente a meticilina | Vancomicina si CMI < 1,5 | Daptomicina: SARM previo con CMI para vancomicina ≥ 1,5; aislamiento de enterococo previamente resistente a vancomicina; shock séptico; complicaciones metastásicas; dispositivos endovasculares | Recomendable retirar catéter Duración: 4 semanas, 6-8 semanas si complicaciones metastásicas |
| Staphylococcus coagulasa negativa sensible a meticilina | Cloxacilina o cefazolina | Daptomicina | Duración: 3-5 días si paciente estable y se retira el catéter, 10-14 días si se mantiene el catéter |
| Staphylococcus coagulasa negativa resistente a meticilina | Vancomicina si CMI < 1,5 | Daptomicina: SARM previo con CMI para vancomicina ≥ 1,5; aislamiento de enterococo previamente resistente a vancomicina; shock séptico; complicaciones metastásicas; dispositivos endovasculares | Duración: 3-5 días si paciente estable y se retira el catéter, 10-14 días si se mantiene el catéter |
| Enterobacterias | Ceftriaxona o levofloxacino | Si alergia o gravedad: aminoglucósido/piperacilina-tazobactam/carbapenem | Duración: 4 semanas, 6-8 semanas si complicaciones metastásicas |
| Pseudomonas aeruginosa | Carbapenem o piperacilina-tazobactam o cefepime ± gentamicina | Ceftazidima o levofloxacino + gentamicina | Recomendable retirar catéter Duración: 4-6 semanas, 6-8 semanas si complicaciones metastásicas |
| Candida spp. | Equinocandina hasta conocer la especie Desescalar a fluconazol si Candida albicans o Candida parapsilosis | Anfotericina B liposomal o voriconazol | Recomendable retirar catéter Duración: 2 semanas después de hemocultivos negativos, 6-8 semanas si complicaciones metastásicas |
CMI: concentración mínima inhibitoria; SARM: Staphylococcus aureus resistente a meticilina.
En caso de Staphylococcus lugdunensis habría que actuar igual que en el caso de S. aureus.
En aquellos pacientes en los que se aísle en los hemocultivos S. aureus sensible a meticilina y estén recibiendo tratamiento empírico con vancomicina, deberá sustituirse este antibiótico por cloxacilina o cefazolina. La cefazolina es una buena opción en aquellos pacientes con BRC sensibles a este antibiótico, por la facilidad de su dosificación en HD912,913. La utilización de vancomicina para el tratamiento de infecciones por S. aureus sensible a meticilina puede condicionar fracasos terapeúticos850,914. En bacteriemias causadas por SARM se deberá determinar la CMI para la vancomicina. Si fuese igual o superior a 1,5μg/ml debería sustituirse por un antibiótico alternativo como la daptomicina.
La duración del tratamiento antibiótico dependerá del agente etiológico y de si existe o no complicación de la BRC. Habitualmente la terapia antibiótica se mantendrá durante 2 a 3 semanas en aquellas BRC que no presenten complicaciones y se alargará dependiendo del agente causal o de la aparición de complicaciones (persistencia de hemocultivos positivos, metástasis sépticas, endocarditis etc.).Tratamiento de la infección local asociada al catéter venoso central833
El tratamiento de la infección local no complicada se realizará mediante curas tópicas que incluyan antimicrobianos, basándose en el resultado de los cultivos del orificio cutáneo de salida (mupirocina si S. aureus o azoles tópicos si Candida spp.) y, si no mejora, se iniciará una antibioterapia sistémica, retirando el CVC en caso de persistencia de la infección.
El tratamiento de la infección local complicada (tunelitis) implica siempre la retirada del CVC y tratar con antibioterapia sistémica durante 7-10 días.Complicaciones de la bacteriemia relacionada con el catéter
Las complicaciones que más frecuentemente pueden derivarse de una infección de CVC son la endocarditis infecciosa, la espondilodiscitis y la trombosis séptica. La existencia de una de ellas obliga a la retirada inmediata del CVC. Se deben sospechar ante la persistencia de la bacteriemia después de 72h del inicio del tratamiento antibiótico adecuado, y obliga a prolongarlo hasta las 6-8 semanas.
- •
Ante la sospecha de endocarditis se debe realizar una ecocardiografía transesofágica y repetir si existe alta sospecha, a pesar de haber sido negativo el estudio inicial. La ecografía transtorácica es menos sensible en la detección de pequeñas vegetaciones valvulares915.
- •
Ante la sospecha clínica y analítica de espondilodiscitis, la resonancia magnética de columna es la prueba de imagen inicial por su alta sensibilidad y especificidad851.
- •
Para el diagnóstico de tromboflebitis séptica es necesario demostrar el trombo por estudio radiológico (tomografía computarizada, ecografía u otros). La anticoagulación sistémica con heparina para el tratamiento de las trombosis sépticas podría estar indicada cuando se evidencia progresión del trombo, aunque es una opción controvertida y carece de estudios controlados para su recomendación833.
Los agentes trombolíticos no están indicados como tratamiento coadyuvante de la trombosis séptica.Recomendaciones generales en la prevención de la infección relacionada con el catéter
Se han desarrollado diferentes estrategias para reducir la incidencia de la infección relacionada con el CVC de HD. Estas incluyen estrictas medidas de asepsia en la manipulación del CVC durantes las maniobras de conexión y desconexión del circuito de HD, así como los cuidados del orificio de salida cutáneo del CVC (ver apartado 6.5 “Manipulación del catéter”). Otras como el revestimiento de la superficie de los catéteres con productos anticoagulantes, antisépticos o antibióticos, tienen como objeto minimizar el riesgo de trombosis y de infección. Se han comunicado experiencias que muestran la efectividad de esta estrategia, pero solo en CVNT utilizados en pacientes críticos y períodos limitados. No existen evidencias que apoyen su uso sistemático en población de HD con CVT de larga duración688,916,917.La profilaxis antibiótica antes de la inserción del CVC ha sido analizada en pacientes oncológicos y en poblaciones que utilizaban CVC para nutrición parenteral. En dos ECA se utilizó la teicoplanina como profilaxis observándose, en uno que incluyó 88 pacientes oncohematológicos, una disminución de las infecciones del punto de inserción, tunelitis y bacteriemia por grampositivos918, mientras que en el otro con 65 pacientes no se redujeron las tasas de infección relacionada con el CVC919. En otros dos ECA se administró vancomicina previamente a la inserción del CVC, sin constatarse disminución en la tasa de bacteriemia en 55 pacientes no oncológicos con CVC para nutrición parenteral920 y en 98 oncohematológicos921. En un metaanálisis publicado en 2013 y revisado en 2015 que incluye 11 estudios con 828 pacientes, se analizó la eficacia del uso profiláctico de antibióticos antes de la inserción o utilización de un CVC intravascular para prevenir la bacteriemia por grampositivos922. En 5 estudios de este metaanálisis no se encontraron diferencias en el número de casos de bacteriemia asociada entre un grupo de pacientes en los que se administró vancomicina, teicoplanina o ceftazidima sistémica frente a otro grupo en el que no se administró profilaxis. Por otra parte, la administración profiláctica de glicopéptidos se ha relacionado con la emergencia de microorganismos resistentes, por lo que su uso en profilaxis se desaconseja en muchas guías clínicas923.
Por ello, el GEMAV recomienda no administrar profilaxis antibiótica de manera rutinaria antes de insertar o manipular un CVC.
La administración rutinaria de antimicrobianos intranasales para la descolonización de los pacientes portadores de S. aureus y la utilización rutinaria del SA del CVC como profilaxis de la BRC, se desarrollan en las siguientes preguntas clínicas y tampoco han sido consideradas para su recomendación924.
→ Pregunta clínica XXX ¿Está justificado el uso de profilaxis antibiótica en el sellado del catéter venoso central tunelizado para hemodiálisis?
(Ver ficha de la Pregunta clínica XXX en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| La evidencia proviene de ECA de baja calidad y riesgo de sesgo, que mostraron que el sellado del catéter mediante soluciones con antibióticos y heparina o con antibióticos y citrato es más efectivo que con soluciones de heparina sola para prevenir bacteriemias relacionadas con el catéter | Calidad baja |
| Los autores de la revisión señalan que existe riesgo de sesgo de publicación porque el gráfico de embudo muestra una infrarrepresentación de estudios sin efecto o con efecto negativo. Asimismo señalan que ninguno de esos estudios era doble ciego, lo que plantea un riesgo de sesgo de desempeño por parte de los profesionales, que la ocultación del tratamiento era adecuada solo en cuatro de los ocho estudios y que solo uno de ellos hizo análisis por intención de tratar | |
Se han encontrado varias revisiones sistemáticas que analizan este tema831,832,925–928. Las revisiones solo analizan el riesgo de bacteriemias pero no recogen información sobre otros posibles resultados de interés como la mortalidad, las tasas de supervivencia de los catéteres o los episodios de hospitalización.
Los siguientes apartados están basados en la revisión de Snaterse et al925 por ser la más reciente, dar información separada para CVT y proporcionar un análisis del riesgo de sesgo en la evidencia disponible. La revisión sistemática de Snaterse et al localiza 8 ECA (103.810 pacientes) que analizaron la utilización de soluciones con antibióticos frente a soluciones con heparina para el sellado profiláctico del CVT.
En relación con el riesgo de bacteriemia, al comparar el sellado utilizando solución solo con heparina, encuentran diferencias estadísticamente significativas favorables tanto a la profilaxis antibiótica combinada con heparina como a la combinada con citrato, pero no para antibiótico más EDTA.
Diferencia de riesgo de bacteriemia por cada 1.000 días de catéter:
- •
Antibióticos más heparina frente a heparina: –2,68 (IC del 95%, –2,64 a –1,53) (5 estudios con 108.313 pacientes; I2: 0%. Uno de los estudios era de 4.503 pacientes con CVNT).
- •
Antibióticos más citrato frente a heparina: –2,88 (IC del 95%, –4,34 a –1,41) (3 estudios con 15.036 pacientes; I2:0%).
- •
Antibióticos más EDTA frente a heparina: –0,47 (IC del 95%, –1,40 a 0,45; un estudio con 4.454 pacientes).
Respecto a qué régimen antibiótico puede ser el mejor, señalan que solo había publicados dos estudios con pocos pacientes y que no encontraban diferencias estadísticamente significativas entre soluciones que incluían distintos antibióticos: (citrato-gentamicina, minociclina-EDTA, vancomicinaheparina, vancomicina-ciprofloxacino-heparina).
Señalan además que aparte de los potenciales beneficios en relación con la prevención de bacteriemia deben ser tenidos en cuenta los posibles efectos negativos, tales como los efectos secundarios para los pacientes, el desarrollo de resistencias bacterianas o el coste-efectividad de esas intervenciones.
Señalan también que su revisión apoya la postura de los CDC (Centers for Disease Control and Prevention) de no recomendar el uso sistemático de antibióticos en las soluciones de cebado de los CVC.De la evidencia a la recomendación
La evidencia disponible en relación con la prevención de la BRC mediante el sellado antimicrobiano proviene de ECA de baja calidad y riesgo de sesgo, que junto a los posibles efectos secundarios y resistencia a los antibióticos nos inducen a no recomendar el uso rutinario de la profilaxis antibiótica en el sellado del CVT para HD.
→ Pregunta clínica XXXI La bacteriemia relacionada con el catéter secundaria a infección porStaphylococcus aureus, Pseudomonasspp. oCandidaspp., ¿obliga a la retirada del catéter y, por lo tanto, contraindica el tratamiento mediante la técnicaantibiotic lockpara intentar conservarlo?
(Ver ficha de la Pregunta clinica XXXI en enlaces electronicos)
| Resumen de la evidencia | |
|---|---|
| La evidencia disponible proviene de series clínicas, con un número limitado de pacientes que han sido tratados mediante el sellado con antimicrobianos y antibioterapia sistémica. Las tasas de curación se sitúan alrededor del 50% para la bacteriemia por S. aureus, habiéndose descrito graves complicaciones en casi el 10%. Hay un escaso número de casos descritos en la bibliografía para Pseudomonas spp., con resultados dispares y no hay experiencia para Candida spp. | Calidad baja |
| En pacientes con bacteriemia relacionada con el CVC secundaria a infección por S. aureus, Pseudomonas spp. o Candida spp., tratados con sellado antimicrobiano, no se ha encontrado publicado ningún estudio que compare directamente los resultados de la retirada inmediata del CVC frente al mantenimiento de este | |
| Por todo ello, autores de las mayores series clínicas y la propia guía de la Infectious Disease Society of America (IDSA) recomiendan la retirada del CVC en estos casos | |
La revisión de Saxena y Panhotra929 mostró que la etiología de las bacteriemias por CVC de HD variaba entre el 21,9 y el 60% para S. aureus y entre el 2,3 y el 15,2% para Pseudomonas aeruginosa, sin aportar datos sobre Candida.
En la actualidad se considera que no siempre es necesaria la retirada del CVC infectado para el diagnóstico y tratamiento adecuados. El sellado de la luz del CVC con una solución antibiótica altamente concentrada se conoce como sellado con antimicrobianos o antibiotic lock therapy y se considera una buena opción terapéutica del tratamiento de la infección del CVC, aunque se desconoce si su utilidad y seguridad depende del microorganismo aislado.
Maya930 señala que la mayoría de los casos tratados de bacteriemia asociada a CVC se resuelven sin mayores complicaciones, pero que, dependiendo de la situación clínica del paciente y del microorganismo implicado, hay un alto riesgo, de hasta un 20%, de que los CVC infectados embolicen los microorganismos a sitios alejados, incluyendo válvulas cardíacas, huesos, articulaciones, espacio epidural, tejido subcutáneo u otros.
Esta revisión930 localiza un ECA que compara el sellado antimicrobiano con placebo, asociados ambos al tratamiento antibiótico parenteral, en el tratamiento de la bacteriemia por CVC de larga duración. Incluye 46 pacientes, de los que solo uno tenía infección por S. aureus y ninguno por Pseudomonas spp. o Candida spp. Aunque los tratados con sellado antimicrobiano tenían mejores resultados que los tratados con placebo, las diferencias no eran estadísticamente significativas en relación con el fracaso del tratamiento: ausencia de curación de la bacteriemia en el 33% (7 de 21) de los del grupo de sellado antimicrobiano frente al 57% (13 de 23) del grupo placebo (p = 0,10); bacteriemia recurrente con la misma cepa en 3 de 31 del grupo del sellado antimicrobiano frente a 9 de los 23 tratados con placebo (p = 0,06).
La guía realizada por la IDSA833 señala que los CVC de HD deben ser retirados si hay una bacteriemia complicada por sepsis grave (inestabilidad hemodinámica), osteomielitis, endocarditis, tromboflebitis supurativa o hemocultivos positivos persistentes 72h después de la terapia antibiótica apropiada. En bacteriemia no complicada causada por estafilococos coagulasa negativa o bacilos gramnegativos, plantean que se puede hacer un intento de tratar durante 2 semanas con antibióticos por vía i.v. y con sellado antimicrobiano, sin retirada del CVC. Sin embargo, si el microorganismo implicado es S. aureus, P. aeruginosa u hongos, no recomiendan el SA.Bacteriemia secundaria a infección por Staphylococcus aureus
La revisión de Fitzgibbons et al893 señala que la incidencia de bacteriemias por CVC en pacientes en HD estaría en un rango de entre 7,6 y 14,4 casos por cada 100 días de uso de CVC, y S. aureus sería el patógeno responsable del 56% de los casos. Esta revisión recoge los datos de tres estudios observacionales853,854,893, que muestran que el uso combinado de antibioterapia sistémica y del SA obtenía tasas de conservación del CVC de entre el 40 y el 55% para infecciones por S. aureus.
Fitzgibbons et al893 consideran que la retirada del CVC es la mejor estrategia ante una bacteriemia por S. aureus en pacientes en HD dializados a través de un CVC.
La serie de Fernandez-Hidalgo et al899 incluyó a 115 pacientes con bacteriemia por CVC de larga duración, de los cuales solo 37 eran pacientes en programas de HD. En 20 pacientes, la bacteriemia fue secundaria a S. aureus y el tratamiento combinado con terapia sistémica y SA fracasó en 9 casos (7 con catéter para HD y 2 para quimioterapia).
La serie prospectiva de Maya et al853 analizó a 113 pacientes afectados de bacteriemia por S. aureus secundaria al catéter de HD. Todos fueron tratados mediante antibioterapia sistémica y SA. Se observó curación y se pudo mantener el catéter en el 40,7% de los pacientes (46 de 113), y se retiró en 67 pacientes, en 40 por fiebre persistente y en 27 por bacteriemia recurrente. En un 9,7% de pacientes (11 de 113) se produjeron complicaciones serias de la bacteriemia. Concluyen que la terapia sistémica con SA no es adecuada en el caso de que el microorganismo implicado sea S. aureus.
La serie de Poole et al854 incluía 10 casos de bacteriemia por S. aureus, tratados todos ellos por vía sistémica y por SA. El tratamiento solo tuvo éxito en 4 de los pacientes (40%).
La serie de Joshi y Hart900 incluía 7 casos de bacteriemia por S. aureus, tratados todos ellos por vía sistémica y por SA. En la mayoría de los casos se tuvo que retirar el catéter para curar la infección, independientemente de que se tratase de SARM o de SASM.
La serie de Krishnasami et al855 incluía 2 casos de bacteriemia por S. aureus tratados por vía sistémica y con SA. El tratamiento no logró erradicar la infección en ninguno de los dos casos y requirió la retirada del CVC.
La serie de Capdevila et al864 incluía 2 casos de bacteriemia por S. aureus sensibles a los antibióticos tratados por vía sistémica y por SA. En los dos casos se controló la infección y se mantuvieron los CVC.Bacteriemia secundaria a infección por Pseudomonas
La serie de Fernández-Hidalgo et al899 incluyó a 115 pacientes con bacteriemia por CVC de larga duración, de los cuales solo 37 eran pacientes de HD.
En 5 de los casos la bacteriemia era por Pseudomonas, pero no detallan cuántos eran pacientes en HD. El tratamiento combinado con terapia sistémica y SA fracasó en uno de los casos. La serie de Capdevila et al864 incluía 5 casos de bacteriemia por P. aeruginosa sensible a los antibióticos, tratados por vía sistémica y por SA. En todos los casos se controló la infección y se mantuvieron los CVC.
La serie clínica de Joshi y Hart900 incluía 2 casos de bacteriemia por Pseudomonas tratados por vía sistémica y por SA. En los dos casos el tratamiento no logró erradicar la infección y requirieron retirada del CVC.Bacteriemia secundaria a infección porCandida
No se han encontrado estudios publicados que aporten resultados del SA en casos de candidemia asociada a CVC.
En el caso de candidemia asociada a CVC de HD parece razonable proceder a la retirada del CVC833,899,931.De la evidencia a la recomendación
No se ha encontrado publicado ningún estudio que compare directamente los resultados de la retirada inmediata del CVC frente al SA, en pacientes con bacteriemia relacionada con el catéter secundaria a infección por S. aureus, Pseudomonas spp. o Candida spp.
Series clínicas con un limitado número de pacientes tratados mediante sellado antimicrobiano que intenta mantener el CVC en funcionamiento han mostrado tasas de curación bajas para la BRC secundaria a S. aureus, asociada además a complicaciones graves. Estos hallazgos inducen a pensar que intentar salvar el CVC en BRC dependiendo de la etiología (microorganismos de difícil tratamiento como S. aureus, Pseudomonas spp. o Candida spp.) puede condicionar tasas significativas de fracaso terapéutico y de complicaciones graves.
Por ello sería recomendable la retirada del CVT en los casos en los que se aislaran estos gérmenes.
→ Pregunta clínica XXXII El tratamiento antibiótico empírico para cubrir grampositivos en bacteriemia en portador de catéter venoso central tunelizado en hemodiálisis, cuando se conserva dicho catéter, ¿debe ser de inicio cefazolina (vancomicina si nivel de SARM > 10%) o daptomicina, asociada al tratamiento para gramnegativos?
(Ver ficha de la Pregunta clínica XXXII en enlaces electrónicos)
| Resumen de la evidencia |
|---|
| No se han identificado estudios comparativos entre esas estrategias de tratamiento antibiotico empirico de la BRC de HD |
| La evidencia proviene de guias de organizaciones profesionales, que tienen en cuenta la experiencia en distintos centros sanitarios, que constatan la importancia de adecuar el tratamiento empirico a las condiciones epidemiologicas de las bacteriemias en cada unidad de HD concreta, asi como a la sensibilidad y resistencia de sus germenes habituales |
| El tratamiento empirico implicaria la actuacion antes de conocer los microorganismos implicados, la eleccion del antibiotico dependiendo de la epidemiologia de cada unidad, teniendo en cuenta la sensibilidad y resistencia de sus microorganismos habituales, los factores de riesgo del paciente (la colonizacion previa del paciente por algun microorganismo y/o su estado de inmunidad) y la gravedad de la infeccion |
La guía de la SEIMC (Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica)932 señala que la etiología y el patrón de sensibilidad de las bacteriemias nosocomiales muestran grandes diferencias entre centros, por lo que el conocimiento de la epidemiología local es imprescindible para la selección del tratamiento antimicrobiano empírico. Debido a que la etiología de la BRC en pacientes en HD por S. aureus sensible a meticilina y por SARM es altamente prevalente, considera que la vancomicina es el tratamiento empírico de elección. En caso de sepsis grave o shock séptico, sugiere sustituir la vancomicina por daptomicina y ampliar la cobertura frente a bacilos gramnegativos, incluido P. aeruginosa.
En 2008 se publicó una guía de tratamiento de la infección por SARM933, elaborada por representantes de la SEQ (Sociedad Española de Quimioterapia), la SEMI (Sociedad Española de Medicina Interna), la SEMICYUC (Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias), la AEC (Asociación Española de Cirujanos) y la SEHH (Sociedad Española de Hematología y Hemoterapia).
En esta guía se plantea que el empleo de vancomicina como pauta de tratamiento empírico inicial de una infección grave no es aconsejable cuando exista la posibilidad de que la CMI para la vancomicina sea ≥ 1,5μg/ml. Las situaciones de riesgo podrían ser pacientes que han recibido vancomicina durante el mes previo o infección nosocomial en un centro donde la prevalencia de estas cepas sea superior al 10% de los aislados.
La European Renal Best Practice (ERBP)741 recomienda que:
- •
Las unidades de HD deben registrar todos los detalles respecto a epidemiología de bacteriemias relacionadas con el uso de catéteres, así como todos los episodios de bacteriemia (eventos, organismos causantes con su susceptibilidad y la evolución en la respuesta al tratamiento).
- •
En general, se debe preferir los antibióticos que requieran la administración posdiálisis solamente (vancomicina, teicoplanina, cefazolina, ceftazidima, daptomicina).
- •
Vancomicina o teicoplanina como primera opción para el tratamiento empírico de grampositivos en los lugares donde el SARM es altamente prevalente.
La guía de los NHS (Nottingham University Hospitals)934 recomienda el uso de vancomicina y gentamicina como antibióticos empíricos.
La guía de la IDSA833 recomienda la vancomicina para el tratamiento empírico de las bacteriemias en entornos sanitarios con elevada prevalencia de infecciones por SARM. Para los servicios en los que los cultivos de SARM muestren mayoritariamente valores de CMI de vancomicina > 2μg/ml o si existe alergia a la vancomicina, proponen el uso de daptomicina.
Lock y Mokrzycki670 proponen utilizar la vancomicina o la teicoplanina para el tratamiento empírico debido a la alta prevalencia de SARM en las unidades de HD. En los casos en los que la CMI de la vancomicina sea > 2μg/ml proponen el uso de daptomicina.De la evidencia a la recomendación
Ante la ausencia de estudios comparativos de diferentes estrategias en el tratamiento empírico de la BRC en HD, la evidencia proviene de guías clínicas a expensas de la adecuación del tratamiento empírico a la epidemiología de cada unidad de HD y en concreto a la sensibilidad y resistencia de los gérmenes habituales.
En nuestro entorno, la SEIMC considera que en el paciente en HD es alta la prevalencia de SARM y de estafilococo sensible a meticilina, por lo que la vancomicina se considera el tratamiento de elección, y sugiere, en caso de sepsis grave, sustituirla por daptomicina y ampliar a bacilos gramnegativos, incluida la pseudomona. Paralelamente, la guía multidisciplinar del tratamiento de SARM, en caso de gravedad desaconseja la vancomicina cuando la CMI es ≥ 1,5μg/ml.
En este mismo entorno, en caso de alta prevalencia de SARM para tratamiento empírico de grampositivos, las guías europeas (ERBP) y la guía de la IDSA también recomiendan la vancomicina como primera opción. Esta última también propone la daptomicina en caso de SARM con CMI de la vancomicina > 2μg/ml o en caso de alergia.
Por ello, el GEMAV recomienda en primer lugar cubrir empíricamente grampositivos y gramnegativos en función de la epidemiología de cada unidad de HD, sugiriendo la vancomicina como primera opción para el tratamiento empírico de los microorganismos grampositivos, y utilizar la daptomicina en caso de SARM con CMI ≥ 1,5μg/ml en pacientes con shock séptico o con alergia conocida a la vancomicina.
R 6.9.9) En la eleccion empirica de los antibioticos se recomienda incluir antimicrobianos con actividad frente a microorganismos grampositivos y gramnegativos, dependiendo de la epidemiologia de cada unidad de hemodialisis, sensibilidad y patrones de resistencia de sus microorganismos habituales, factores de riesgo del paciente y gravedad de la infeccion
R 6.9.10) Se sugiere utilizar vancomicina como primera opcion para el tratamiento empirico de microorganismos grampositivos en las unidades de hemodialisis
R 6.9.11) Se sugiere utilizar daptomicina para el tratamiento empirico de la bacteriemia relacionada con el cateter en las unidades de hemodialisis en que los cultivos de Staphylococcus aureus resistente a meticilina muestren valores de concentracion minima inhibitoria de la vancomicina ≥ 1,5 μg/ml, en pacientes con shock septico o con alergia conocida a la vancomicina
→ Pregunta clínica XXXIII La detección y erradicación deStaphylococcus aureusen los portadores nasales, ¿reduce los episodios de bacteriemia relacionada con el catéter?, ¿es coste-efectiva?
(Ver ficha de la Pregunta clínica XXXIII en enlaces electrónicos)
| Resumen de la evidencia | |
|---|---|
| Un metaanálisis de 8 ECA, con solo uno de ellos en pacientes en HD, encuentra que tratar con mupirocina intranasal a los portadores de S. aureus se asocia con una menor tasa de infección nosocomial por S. aureus, pero que se acompaña de un aumento en la tasa de infección causada por microorganismos distintos de S. aureus | Calidad moderada |
| Un ECA que analizó el tratamiento con rifampicina oral frente a ningún tratamiento encontró menor tasa de infecciones, pero también una alta tasa de recurrencia de colonización por S. aureus a los 3 meses y el desarrollo de cepas resistentes a la rifampicina | Calidad moderada |
La evidencia disponible proveniente de ECA aborda exclusivamente resultados relacionados con bacteriemias, sin aportar información sobre mortalidad, hospitalizaciones o resistencias antibacterianas. Se ha encontrado una revisión Cochrane que analiza el impacto del tratamiento local con mupirocina en portadores nasales935 para la prevención de la bacteriemia por S. aureus.Mupirocina nasal
En la revisión Cochrane de Van Rijen et al en 2008935 se analizó la efectividad de la mupirocina nasal en la prevención de infecciones por S. aureus en portadores nasales. Se localizaron 9 ECA con 3.396 pacientes con una gran heterogeneidad clínica entre los pacientes de los distintos estudios: pacientes en HD, en diálisis peritoneal, pacientes quirúrgicos y pacientes no quirúrgicos.Tasa de infección por Staphylococcus aureus
El metaanálisis de los 8 estudios, con 3.374 participantes, que compararon la mupirocina con placebo o con ningún tratamiento, encontró una reducción estadísticamente significativa de infección por S. aureus en los tratados con mupirocina intranasal (RR: 0,55; IC del 95%, 0,43-0,70).Tasa de infección causada por microorganismos distintos de Staphylococcus aureus
El metaanálisis de 3 estudios, con 1.393 pacientes, encuentra una tasa significativamente mayor de infección por microorganismos distintos a S. aureus en los pacientes tratados con mupirocina que en el grupo placebo (RR: 1,38; IC del 95%, 1,121,72).Mortalidad
El metaanálisis de 5 estudios, con 2.161 pacientes, no encontró diferencias estadísticamente significativas entre pacientes tratados con mupirocina o placebo (RR: 0,91; IC del 95%, 0,64-1,31).
El único ECA en pacientes en HD de esta revisión, con 17 pacientes tratados con mupirocina nasal y 18 con placebo tratados 3 veces a la semana durante 9 meses, encuentra menos infecciones en pacientes tratados con mupirocina, pero la diferencia no era estadísticamente significativa (RR: 0,18, IC del 95%, 0,02-1,32); el análisis de la incidencia de bacteriemia no mostró diferencias.Rifampicina oral más bacitracina intranasal
Varias revisiones publicadas localizan un solo ECA en pacientes en HD portadores nasales de S. aureus, que comparaba no tratar frente a tratamiento con 600mg de rifampicina oral 2 veces a la semana, más bacitracina intranasal 4 veces al día durante 1 semana, repetido cada 3 meses936. Encontraron una tasa menor de infecciones en tratados activamente: 2 de 18 (11%) frente a 12 de 26 (46%) (RR: 0,24; IC del 95%, 0,06-0,95; p = 0,02).
Barraclough et al937 mencionan que en ese estudio se identificaron cepas resistentes a la rifampicina, lo que limitó la aplicación de esa intervención. Comentaban que en el estudio analizaban también si el uso de rifampicina durante 1 semana era efectivo en la erradicación del estado de portador y señalan que encontraron una alta tasa de recurrencia de colonización por S. aureus a los 3 meses.De la evidencia a la recomendación
No existe suficiente evidencia para recomendar la detección sistemática y tratamiento con antibiótico local o sistémico para la erradicación de S. aureus en los pacientes en HD.
Método alternativo en el diagnóstico de la bacteriemia relacionada con el catéter venoso central en pacientes en hemodiálisis: extracción de hemocultivos a través de las luces del catéter venoso central o de la línea del circuito extracorpóreo de hemodiálisis
Se debe sospechar una BRC cuando un paciente portador de un CVC en HD presente signos o síntomas de bacteriemia, particularmente en ausencia de otro foco de infección. Tal como se ha comentado previamente, ante dicha sospecha deberán extraerse hemocultivos por punción de una vena periférica y a través de las luces del CVC, o un par de hemocultivos de sangre periférica en dos localizaciones diferentes o de dos muestras separadas por 10-15min.
El diagnóstico definitivo de la bacteriemia precisa uno de los siguientes criterios:
- •
Hemocultivos positivos con el mismo microorganismo en las muestras periféricas y del CVC, con un recuento de colonias 3:1 veces superior en el CVC o un tiempo diferencial de crecimiento mayor a 120min.
- •
Cultivo del mismo microorganismo en el extremo distal del CVC y en al menos un cultivo de sangre periférica.
- •
Cultivos del mismo microorganismo de dos muestras sanguíneas periféricas y ausencia de otro foco de infección.
En la población de pacientes en HD, los criterios diagnósticos de BRC están limitados por diversos motivos. En más del 40% de los pacientes, no es posible obtener muestras sanguíneas para cultivo, ya sea debido a la dificultad de acceso a las venas periféricas o por la necesidad de preservarlas para la creación de una FAVn o una FAVp833,844,875. Asimismo, el tratamiento dialítico se efectúa de forma ambulatoria y, en este contexto, es más difícil conseguir que no existan variaciones significativas en los tiempos de transporte o de temperatura de las muestras sanguíneas hasta su incubación en el laboratorio de microbiología844. En muchas ocasiones, los síntomas o signos de BRC ocurren durante la sesión de HD, cuando la sangre del paciente ya ha circulado a través de las líneas del circuito extracorpóreo y de las luces del CVC. En este escenario, es muy probable que no se mantenga el diferencial cuantitativo de colonias entre las muestras obtenidas mediante punción de una vena periférica y las muestras extraídas del CVC o de la línea del circuito extracorpóreo. Por tanto, la interrupción de la sesión de HD, con las maniobras de desconexión de líneas para la obtención de hemocultivos a través del CVC, podría no estar justificada debido a los riesgos de manipulación y de coagulación del circuito de diálisis, además de la probable pérdida del diferencial del número de colonias en relación con la sangre periférica que nos indicaba si el origen de la bacteriemia es el CVC938.
El protocolo recomendado para la obtención de muestras de hemocultivos en los pacientes de HD portadores de CVC se aplicará cuando la sospecha aparezca en el período interdiálisis, mientras que cuando ocurra durante la sesión de HD, dada la dificultad de la extracción de muestras, el GEMAV considera aceptable la extracción de dos muestras sanguíneas, separadas entre sí por 10-15min, a través de la línea arterial del circuito extracorpóreo sin necesidad de interrumpir la sesión de diálisis. En estos casos y en los que no sea posible obtener hemocultivos por punción de vena periférica, el diagnóstico de BRC se considerará cuando los hemocultivos sean positivos, en pacientes sintomáticos y sin evidencia de un foco alternativo de infección.
7INDICADORES DE CALIDADIntroducciónAunque muchos de los aspectos del tratamiento sustitutivo renal de la enfermedad renal crónica (ERC) estadio 5 han sido estandarizados en guías internacionalmente aceptadas6,10,13–15,30,939,940, la bibliografía demuestra que existen importantes diferencias en el grado de cumplimiento de los estándares propuestos, tanto entre centros como entre los diferentes países941–943.
Uno de los retos actuales es reducir la variabilidad en la asistencia prestada. Aunque algunas diferencias pudieran estar justificadas por las diferentes características demográficas de los pacientes que se dializan en los centros, existen otras que están relacionadas con los diferentes modos de actuación944.
La medición sistemática y planificada de indicadores de calidad ha demostrado que ayuda a mejorar el control sobre los pacientes y los resultados de los tratamientos aplicados, ya que permite conocer al profesional su situación, introducir actividades de mejora y comprobar su efectividad de una forma sistemática y continuada945. La verdadera justificación de intentar conseguir el cumplimiento de estos indicadores es la evidencia, recientemente demostrada, de que la consecución conjunta de algunos de ellos (anemia, dosis de diálisis, metabolismo calciofósforo, albúmina o el tipo de acceso vascular) repercute sobre la supervivencia del paciente, la morbilidad y los costes946,947.
Como ya se ha comentado a lo largo de la guía, la presencia de un catéter venoso central (CVC) para hemodiálisis (HD) en comparación con la fístula arteriovenosa nativa (FAVn) se asocia a mayor morbimortalidad y mayor coste95,630,843,948, por lo que un objetivo de calidad es restringir al máximo la tasa de CVC existente216.
Uno de los factores que sin duda está influyendo en el aumento del porcentaje de CVC en los pacientes en HD es el factor paciente (mayor edad y mayor prevalencia de diabetes mellitus y de comorbilidades cardiovasculares), que provoca contraindicaciones médicas y quirúrgicas para realizar una FAVn216,667,948, pero no es el único. El factor centro es otro de los aspectos que influyen en estos resultados y sobre el cual se puede intervenir y mejorar216. Varios estudios han demostrado diferencias entre distintas unidades de HD en la distribución en pacientes incidentes y prevalentes del tipo de acceso vascular (AV)278,664,949. Estas diferencias dependen de diversos factores: existencia de consulta de ERC avanzada (ERCA) estructurada, implantación de programas de seguimiento del AV, actitud de los distintos servicios implicados, grado de implicación y coordinación entre estos, tiempo de seguimiento nefrológico y existencia de equipo multidisciplinar, entre otros216.
Hay dos puntos clave para la monitorización: la selección y construcción de buenos indicadores y el diseño de planes de control adecuados y eficientes. La definición de indicadores de calidad y del sistema de monitorización de este apartado pretende identificar la existencia de situaciones problemáticas que hay que evaluar o sobre las que hay que intervenir.
Indicadores por apartados1Procedimientos previos a la realización del acceso vascularIndicador 1.1
Porcentaje de pacientes seguidos en la consulta de enfermedad renal crónica avanzada que, cumpliendo criterios de derivación para realizar una fístula arteriovenosa, son remitidos a cirugíaTipo de indicadorIndicador de PROCESO.Definición de términos
Criterios de derivación de FAV. Se sugiere que el momento de la derivación para la creación de una FAV, siempre que el paciente no se niegue, sea cuando la tasa de filtrado glomerular (FG) sea < 15ml/min/1,73 m2 (estándar validado por sexo, edad y superficie corporal) y/o se objetive su descenso progresivo con previsión de entrada en HD en los 6 meses siguientes. Aplicable a pacientes sin contraindicación para realizar FAV (v. apartado 1: “Procedimientos previos a la realización del acceso vascular”).Fundamento
- •
El indicador expresaría la calidad de evaluación de los pacientes seguidos en la consulta de ERCA para determinar si son enviados para la creación de FAV con los criterios consensuados.
- •
Este indicador asume la FAV como primera opción para estos pacientes.
Todos los pacientes en fase prediálisis visitados en la consulta de ERCA.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: pacientes seguidos en la consulta de ERCA que cumplen criterios para la realización de FAV remitidos a cirugía durante un período de 1 año × 100.
- •
Denominador: pacientes seguidos en la consulta de ERCA que cumplen criterios de remisión para la realización de una FAV durante un período de 1 año.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: 90%.
Lista de comprobación. Porcentaje de pacientes seguidos en consulta de ERCA, que cumplen criterios de derivación remitidos a cirugía para valoración.
Si el paciente cumple los criterios 1, 2, 3 y no cumple los criterios 4 y 5 será derivado a valoración por cirugía.
Si el paciente no cumple alguno de los criterios 1, 2 y 3 y cumple alguno de los criterios 4 y 5 no será derivado a cirugía.Excepciones
Pacientes con indicación teórica para remisión de FAV en los que, por otros motivos, se ha considerado que es mejor otra indicación de AV. Estos pacientes se excluirán tanto del numerador como del denominador; ejemplo: paciente que va a recibir trasplante de donante vivo.Comentario
Al no existir ninguna evidencia sobre este indicador, el estándar se ha establecido por consenso del Grupo Multidisciplinar Español del Acceso Vascular (GEMAV).Indicador 1.2
Porcentaje de pacientes con indicación de realización de una fístula arteriovenosa derivados a la consulta de cirugía en los que se realiza la intervención en el período recomendado
Tipo de indicador
Indicador de PROCESO.
Período recomendado para la realización del acceso
- •
Derivación programada: antes de los 3 meses.
- •
Derivación preferente: antes de las 6 semanas tras consulta.
- •
Derivación prioritaria: antes de las 2 semanas.
- •
Derivación urgente: antes de 48h.
Valorar la respuesta del servicio de cirugía en la realización de una FAV.Población a la que se aplica
Pacientes remitidos desde la consulta de ERCA hasta la consulta de cirugía para realización de una FAV y considerados candidatos a realización de FAV.Fuentes de datos
Historias clínicas de los pacientes.Fórmulas
1. Derivación programada.
- •
Numerador: número de pacientes derivados a la consulta de cirugía para realizar una FAV de forma programada a los que se les realiza antes de 3 meses × 100.
- •
Denominador: total de pacientes derivados a la consulta de cirugía para realizar una FAV de forma programada.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: 90%.
Lista de comprobación. Medición continua. Porcentaje de pacientes remitidos de forma programada para valoración, que cumplen criterios de realización de FAV y en los que se realiza cirugía en un período inferior a 3 meses.
Si el paciente cumple alguno de los criterios 1 a 3, el cirujano decidirá si lo considera apto para la realización de un acceso y se tomarán las precauciones necesarias en cada caso.
2. Derivación preferente.
- •
Numerador: número de pacientes derivados a la consulta de cirugía para realizar una FAV de forma preferente a los que se les realiza antes de las 6 semanas × 100.
- •
Denominador: total de pacientes derivados a la consulta de cirugía para realizar una FAV de forma preferente.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: 90%.
Lista de comprobación. Porcentaje de pacientes remitidos de forma preferente para valoración, que cumplen criterios de realización de FAV y en los que se realiza cirugía en un período inferior a las 6 semanas.
Si el paciente cumple alguno de los criterios 1 a 3, el cirujano decidirá si lo considera apto para la realización de un acceso y se tomarán las precauciones necesarias en cada caso.
3. Derivación prioritaria.
- •
Numerador: número de pacientes derivados a la consulta de cirugía para realizar una FAV de forma prioritaria a los que se les realiza antes de 2 semanas × 100.
- •
Denominador: total de pacientes derivados a la consulta de cirugía para realizar una FAV de forma prioritaria.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: 90%.
Lista de comprobación. Porcentaje de pacientes remitidos de forma prioritaria para valoración, que cumplen criterios de realización de FAV y en los que se realiza cirugía en un período inferior a 2 semanas.
Si el paciente cumple alguno de los criterios 1 a 3, el cirujano decidirá si lo considera apto para la realización de un acceso y se tomarán las precauciones necesarias en cada caso.
4. Derivación urgente.
- •
Numerador: número de pacientes derivados a la consulta de cirugía y aceptados para realizar una FAV de forma urgente a los que se les realiza antes de 48h × 100.
- •
Denominador: total de pacientes derivados a la consulta de cirugía para realizar una FAV de forma urgente.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: 90%.
Lista de comprobación. Porcentaje de pacientes remitidos de forma urgente para valoración, que cumplen criterios de realización de FAV y en los que se realiza cirugía en un período inferior a 48h.
Si el paciente cumple alguno de los criterios 1 a 3, el cirujano decidirá si lo considera apto para la realización de un acceso y se tomarán las precauciones necesarias en cada caso.Comentario
Al no existir ninguna evidencia sobre este indicador, el estándar se ha establecido por consenso del GEMAV.
2Creación del acceso vascularIndicador 2.1
Pacientes con fallo precoz de la fístula en los primeros 30 días que siguen a la realización del procedimientoTipo de indicador
Indicador de RESULTADO.Definición de términos
Fallo precoz. El fallo precoz del AV se considera cuando fracasa la permeabilidad en los primeros 30 días tras su construcción.Fundamento
Se asume que el fallo precoz (primeros 30 días) se produce por problemas técnicos de la cirugía o por la selección de vasos inapropiados. No se considera que la hiperplasia intimal tenga una repercusión significativa respecto al fallo de la técnica quirúrgica10.Población a la que se aplica
Pacientes con ERC que han sido sometidos a cirugía para realización de una FAV.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- 1.
FAVn radiocefálica.
- •
Numerador: procedimientos con FAVn radiocefálica trombosada a los 30 días × 100.
- •
Denominador: total de pacientes a los que se les realiza FAVn radiocefálica.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: < 35%.
- •
- 2.
FAVn proximal utilizando la arteria humeral (humeromediana, humerocefálica o humerobasílica y humerohumeral).
- •
Numerador: procedimientos con FAVn proximal trombosada a los 30 días × 100.
- •
Denominador: total de pacientes que a los que se le realiza FAVn proximal.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: < 25%.
- •
- 3.
Fórmula FAV protésica (FAVp).
- •
Numerador: procedimientos con FAVp trombosada a los 30 días × 100.
- •
Denominador: total de pacientes a los que se le realiza FAVp.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: < 15%.
- •
En un reciente metaanálisis94 se ha descrito una frecuencia global de fallo primario del 23%, que se distribuye entre un 28% en FAVn radiocefálicas y un 20% en FAVn a nivel proximal en codo. El porcentaje de fallo primario descrito en FAVp oscila entre un 5 y un 15% dependiendo del tipo y localización de la prótesis en antebrazo y brazo, respectivamente10. Sin embargo, no hay uniformidad en los estudios incluidos con respecto a las variables estudiadas, incluyéndose a menudo el retardo en la maduración dentro del concepto de fallo primario.
Por eso, el GEMAV ha decidido proponer los estándares usando como base el citado metaanálisis, añadiendo un “factor de corrección” en el caso de las FAVn, con el objeto de favorecer su uso con respecto a otros accesos vasculares, coincidiendo en la línea propuesta en otras guías de práctica clínica10.Indicador 2.2
Porcentaje de pacientes en seguimiento en la consulta de enfermedad renal crónica avanzada durante al menos 6 meses y que comienzan la hemodiálisis con fístula arteriovenosa maduraTipo de indicador
Indicador de RESULTADO.Definición de términos
- •
Seguimiento prediálisis en la consulta de ERCA. Pacientes valorados por el equipo multidisciplinar.
- •
Pacientes incidentes. Tipo de AV con el que el paciente comienza la primera sesión de HD.
- •
Fístula madura. FAV, FAVn o FAVp, desarrollada apta para la punción con dos agujas e inicio de tratamiento mediante HD.
Se asume que el AV de elección es la FAV, y que una adecuada valoración clínica permite seleccionar a los pacientes candidatos a realizársela. Aunque no a todos los pacientes se les puede realizar una FAV, es importante que a ningún paciente se le indique un AV alternativo sin que hubiera tenido un seguimiento multidisciplinar previo.Población a la que se aplica
Pacientes con ERC que están siendo evaluados en la consulta de ERCA al menos durante 6 meses.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: pacientes con seguimiento en ERCA un mínimo de 6 meses que comienzan HD con una FAV madura × 100.
- •
Denominador: pacientes con seguimiento en ERCA un mínimo de 6 meses.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: ≥ 75%.
Si bien otras guías, como las de la UK Association13 o las guías Nice939, indican un objetivo del 65% dichas guías o bien no establecen un mínimo de seguimiento prediálisis o el período que establecen es menor (3 meses).
El GEMAV ha establecido por consenso un porcentaje mayor de este estándar y un período de seguimiento más prolongado. Seis meses es tiempo suficiente para que el enfermo incidente pueda efectuar la primera sesión de HD a través de una FAVn o FAVp teniendo en cuenta que, durante este lapso de tiempo prediálisis, puede ser necesaria una intervención de rescate en caso de trombosis o bien una intervención electiva en caso de maduración insuficiente. Por otra parte, el GEMAV considera que, además del perfil demográfico y clínico del enfermo actual con ERC, los factores organizativos condicionan en gran manera el porcentaje de estos enfermos que inician HD mediante FAV. En este sentido, es demostrativo un reciente estudio epidemiológico nacional referido a casi 10.000 pacientes incidentes en HD según datos del Registre de Malalts Renals de Catalunya (RMRC), donde se evidencia que aproximadamente el 50% de los enfermos con ERC iniciaron el tratamiento mediante HD cada año en Catalunya a través de una FAV durante el período 2000-2011667. Según los autores de este estudio, esta tasa podría aumentarse incidiendo sobre diversos aspectos organizativos, ya que: a) si el incremento de la edad y de la comorbilidad del paciente con ERC evidenciado en los últimos años fuera decisivo, el porcentaje de FAV como primer AV tendría que disminuir progresivamente en Catalunya, pero, en cambio, se ha mantenido estable a lo largo del tiempo, y b) durante el primer año de seguimiento en programa de HD, la mayoría de enfermos que iniciaron HD mediante un CVC ya se dializaba mediante una FAV, es decir, hubiera sido técnicamente posible efectuar una FAV en estos enfermos en el período prediálisis667.Indicador 2.3
Porcentaje de fístulas arteriovenosas controladas clínicamente de forma precoz (4 semanas tras su realización)Tipo de indicador
Indicador de PROCESO.Definición de términos
FAVn inmadura. Aquella en la que una vez transcurridas las 4 semanas desde su realización, no cumple los criterios de maduración (v. apartado 3: “Cuidados de la fístula arteriovenosa”).Fundamento
Se estima que entre un 28 y un 53% de las FAV, una vez realizadas, no maduran lo suficiente para su uso en HD. Diversos estudios han demostrado la utilidad del tratamiento electivo de los casos con alteración de la maduración del acceso. La identificación de candidatos a fístula inmadura es importante para garantizar la permeabilidad del AV. Por tanto, tal como se indica en el apartado 5, se recomienda realizar un control clínico a las 4 semanas tras la realización de toda FAV, para detectar las fístulas con retardo o ausencia de maduración y plantear tratamiento precoz si es necesario. Se recomienda la confirmación de la sospecha de las lesiones mediante ecografía Doppler (ED).Población a la que se aplica
FAV de reciente creación.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: FAV realizadas en la unidad de HD o en la consulta de ERCA, que han sido revisadas a las 4 semanas de su realización × 100.
- •
Denominador: todas las FAVn realizadas en la unidad de HD o en la consulta de ERCA.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: 100%.
La mayor parte de los cambios hemodinámicos y morfológicos tras la realización de la FAV se producen durante las primeras 2-4 semanas. A partir de esa fecha, en los casos de FAV inmadura se produce un descenso progresivo del flujo, por ello se recomienda un control clínico en un máximo de 4-6 semanas, para detectar los casos con alteraciones en la maduración del acceso. Un tratamiento precoz de las lesiones subyacentes puede aumentar en un 47% la probabilidad de maduración del acceso, por lo que se recomienda actuar en los casos en que haya indicación520.
La revisión tardía (2-3 meses) impide el diagnóstico y tratamiento precoz. Por ello, la revisión a las 4 semanas tras el acto quirúrgico se considera un indicador de calidad del proceso de atención a la FAV.
Al no disponer de referencias bibliográficas, el estándar se ha establecido por consenso del GEMAV.
3Cuidados de la fístula arteriovenosaIndicador 3.1
Porcentaje de pacientes en los que se lleva un registro gráfico de zonas de punción durante las sesiones de hemodiálisisTipo de indicador
Indicador de PROCESO.Definición de términos
Registro gráfico de zonas de punción. Constará de un esquema de extremidad de la FAV con un dibujo de la FAV y de las zonas de punción.Fundamento
En cada sesión de HD es necesario un examen completo y detallado de la FAV y un registro de las zonas de punción. Para ello es de gran utilidad la existencia de un mapa de la FAV con las zonas de punción en la historia clínica del paciente.Población a la que se aplica
Pacientes prevalentes en HD y FAV funcionante.Fuente de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes en HD en los que se registra las zonas de punción × 100.
- •
Denominador: total de pacientes en HD en los que se está puncionando una FAV.
- •
Unidades: porcentaje.
- •
Periodicidad: trimestral.
- •
Estándar: 100%.
La técnica correcta de punción de la FAV prolonga su vida media. Debe conocerse en cada paciente la técnica de punción utilizada, zonas de reciente punción y problemas encontrados como mecanismo de control de complicaciones.
- •
La existencia de un registro de dicha información permite conocer la situación y mejorar la asistencia prestada a los pacientes.
- •
La existencia de un registro por paciente es un indicador de calidad de la asistencia prestada.
Al no disponer de evidencia, el estándar se ha establecido por consenso del GEMAV.
4Monitorización y vigilancia de la fístula arteriovenosaIndicador 4.1
Porcentaje de pacientes prevalentes con más de 3 meses en programa de hemodiálisis que, a 31 de diciembre del año estudiado, se dializan a través de una fístula arteriovenosa nativaTipo de indicador
Indicador de RESULTADO.Fundamento
Indica el grado de implantación de los programas estructurados de seguimiento de la FAV en cada unidad de HD (v. apartado 4: “Monitorización y vigilancia de la fístula arteriovenosa”).Población a la que se aplica
Pacientes prevalentes que se dializan en la unidad de HD a fecha del 31 de diciembre del año de estudio.Fuentes de datos
- •
Historias clínicas de los pacientes.
- •
Programas informáticos.
- •
Numerador: número de pacientes en programa de HD que se están dializando a través de una FAVn funcionante a 31 de diciembre del año estudiado × 100.
- •
Denominador: número de pacientes con más de 3 meses en programa de HD a 31 de diciembre del año en curso.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: ≥ 75%.
Las diversas guías publicadas hasta la actualidad establecen como objetivo un porcentaje variable, entre un 60 y un 85%, de pacientes prevalentes dializándose a través de una FAVn6,10,13,15,939. En nuestro país, a modo orientativo, los resultados del estudio multicéntrico del grupo de trabajo de gestión de calidad de la S.E.N., publicado en el año 2008, muestran que la mediana del porcentaje de FAVn en los centros de HD es del 50% (percentil 25: 34,5%, y percentil 75: 61,2%)664. En otros estudios, como los de las comunidades de Madrid, Canarias y Cataluña, la tasa de FAVn en el paciente prevalente es del 58,6, 64 y 73,3%, respectivamente278,950,951. Según el estudio DOPPS 5 (2013-2014), este porcentaje es del 65% para el global de España32. Considerando estos antecedentes, el estándar se ha establecido por el GEMAV en un mínimo del 75%.Indicador 4.2
Porcentaje de pacientes prevalentes con más de 3 meses en programa de hemodiálisis que, a 31 de diciembre del año estudiado, se dializan a través de un catéter venoso central tunelizadoTipo de indicador
Indicador de RESULTADO.Fundamento
Indica el grado de implantación de los programas estructurados de seguimiento del AV en las unidades de HD (v. apartado 4: “Monitorización y vigilancia de la fístula arteriovenosa”).Población a la que se aplica
Pacientes prevalentes que se dializan en la unidad de HD a fecha del 31 de diciembre del año en estudio.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes en programa de HD que se están dializando a través de un CVC tunelizado (CVT) a 31 de diciembre del año en estudio × 100.
- •
Denominador: número de pacientes con más de 3 meses en programa de HD a 31 de diciembre del año en curso.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: ≤ 20%.
La mayoría de las guías publicadas hasta la actualidad no establecen como objetivo un porcentaje máximo de pacientes que se deban dializar a través de un CVT13–15,30,939,940, a excepción de las guías KDOQI-2006 y las guías S.E.N. de 2005, que establecen que un máximo de un 10% de pacientes se debía dializar a través de un CVT6,10. Sin embargo, el número de pacientes que se dializa a través de un CVT, en muchos centros es más elevado. A modo de ejemplo, en nuestro país la Sociedad Madrileña de Nefrología aporta, en pacientes prevalentes, un 29,5% de pacientes dializados a través de un CVT278; un estudio publicado en Canarias muestra un 33% de CVT950, y los últimos resultados aportados por el estudio DOPPS 5 muestran un 29% de pacientes con un CVT32. Sin embargo, los datos procedentes de Catalunya cifran en el 14,3% el porcentaje de enfermos prevalentes que se dializan a través de un CVT216. El estándar se ha establecido por consenso del GEMAV en ≤ 20%.Indicador 4.3
Porcentaje de pacientes prevalentes con más de 3 meses en hemodiálisis que, a 31 de diciembre del año en estudio, se dializan a través de una fístula arteriovenosa protésicaTipo de indicador
Indicador de RESULTADO.Fundamento
Indica el grado de implantación de los programas estructurados de seguimiento del AV en cada unidad de HD (v. apartado 4: “Monitorización y vigilancia de la fístula arteriovenosa”).Población a la que se aplica
Todos los pacientes prevalentes que se dializan en la unidad de HD a fecha de 31 de diciembre del año en estudio.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes en programa de HD que se están dializando a través de una FAVp a 31 de diciembre del año en estudio × 100.
- •
Denominador: número de pacientes con más de 3 meses en programa de HD a 31 de diciembre del año en curso.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: no establecido (por complementario).
Las guías clínicas publicadas hasta la actualidad no establecen ningún objetivo de FAVp en los pacientes de HD6,10,13–15,30,939,940. A modo orientativo, el estudio de la Sociedad Madrileña de Nefrología muestra, en pacientes prevalentes, que un 11,9% de estos se dializa a través de una FAVp278, el RMRC 2012 un 4,8% y el estudio DOPPS 5 un 6%32,951. De acuerdo con las recomendaciones hechas previamente en esta guía, cuando en un paciente no pueda realizarse una FAVn, antes de colocar un CVT se debe intentar realizar una FAVp. A igualdad de porcentaje de pacientes en HD con FAVn, se considera mejor práctica clínica la unidad con mayor porcentaje de FAVp frente a CVC. Este indicador es complementario a los dos anteriores para reducir la tasa de CVT en el paciente prevalente en HD. Por todo lo mencionado, el GEMAV considera no establecer ningún estándar para la FAVp.Indicador 4.4
Porcentaje de pacientes que se dializan a través de un catéter venoso central no tunelizado durante más de 2 semanas consecutivasTipo de indicador
Indicador de RESULTADO.Definición de términos
Catéter venoso no tunelizado (CVNT). Tipo de CVC para HD que no está situado en un túnel dentro del tejido subcutáneo ni dispone de un anclaje en él (cuff).Fundamento
Un paciente no debe estar más de 2 semanas dializándose a través de un CVNT por el mayor riesgo de infección, trombosis venosa y estenosis venosa central.Población a la que se aplica
Pacientes prevalentes que se dializan en la unidad de HD a través de un CVNT.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes en programa de HD que se están dializando a través de un CVNT durante más de 2 semanas × 100.
- •
Denominador: número de pacientes en programa de HD que se están dializando a través de un CVNT.
- •
Unidades: porcentaje.
- •
Periodicidad: mensual.
- •
Estándar: < 5%.
Ante la ausencia de evidencia, el estándar se ha establecido por consenso del GEMAV.Indicador 4.5
Tasa anual de trombosis de fístulas arteriovenosas nativasTipo de indicador
Indicador de RESULTADO.Definición de términos
- •
Trombosis. Es la anulación funcional de la FAVn, es decir, el flujo sanguíneo (QA) es de 0ml/min, que se traduce por la desaparición del frémito y del soplo en la exploración física (v. apartado 4: “Monitorización y vigilancia de la fístula arteriovenosa”).
- •
Pacientes/año en riesgo. Número de días que cada paciente está con un determinado tipo de AV a lo largo de 1 año (máximo 365) dividido por 365. Ejemplo: pacientes con FAVn y número de días de diálisis: paciente A, 365 días, paciente B, 200 días y paciente C, 165; la suma es 730 días. Si dividimos 730 entre 365, el número de pacientes/año en riesgo con una FAVn es de 2.
Indica el grado de implantación de los programas estructurados de seguimiento del AV en cada unidad de HD (v. apartado 4: “Monitorización y vigilancia de la fístula arteriovenosa”).Población a la que se aplica
Pacientes prevalentes portadores de FAVn que se dializan en la unidad de HD a lo largo del año de estudio.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de trombosis en FAVn en el año en estudio.
- •
Denominador: número total de pacientes/año en riesgo con FAVn en el año en estudio.
- •
Unidades: tasa.
- •
Periodicidad: anual.
- •
Estándar: < 0,15 trombosis/paciente/año.
Si bien las guías clínicas establecen, en general, una tasa de trombosis máxima de FAVn de 0,256,10,13,15,939, diversas publicaciones de nuestro país muestran una tasa de trombosis mucho más baja: entre 0,03 y 0,10227,272,278,952. Por este motivo, el GEMAV ha considerado que este estándar no está bien dimensionado y ha valorado establecerlo en 0,15.Indicador 4.6
Tasa anual de trombosis de fístulas arteriovenosas protésicasTipo de indicador
Indicador de RESULTADO.Definición de términos
- •
Trombosis. Igual al indicador 4.5.
- •
Pacientes/año en riesgo. Igual al indicador 4.5 aplicado a FAVp.
Indica el grado de implantación de los programas estructurados de seguimiento del AV en cada unidad de HD (v. apartado 4: “Monitorización y vigilancia de la fístula arteriovenosa”).Población a la que se aplica
Pacientes prevalentes portadores de FAVp que se dializan en la unidad de HD a lo largo del año de estudio.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de trombosis en FAVp en el año de estudio.
- •
Denominador: número total de pacientes/año en riesgo con FAVp en el año de estudio.
- •
Unidades: tasa.
- •
Periodicidad: anual.
- •
Estándar: < 0,50 trombosis/paciente/año.
Tal como se indica en el apartado 4, los métodos de vigilancia de segunda generación no son predictivos de trombosis de la FAVp. A pesar de todo, en una serie prospectiva nacional referida a la vigilancia de FAV mediante determinaciones periódicas del QA, la tasa de trombosis de FAVp fue de 0,42 eventos anuales227. Publicaciones previas en nuestro país, como la de la Sociedad Madrileña de Nefrología, muestran datos similares278. Por tanto, el GEMAV ha considerado que este estándar, al igual que establecen otras guías de práctica clínica6,10,13,15,939, está correctamente dimensionado y debe permanecer como < 0,50.Indicador 4.7
Porcentaje de fístulas arteriovenosas que tienen registro de evaluaciones periódicasTipo de indicador
Indicador de PROCESO.Definición de términos
- •
FAV trombosada. Ver definición previa.
- •
Evaluaciones periódicas. Se han seguido los criterios de monitorización y vigilancia según la metodología referida en el apartado 4 para FAVn y FAVp.
La monitorización y vigilancia sistemática de determinados parámetros indicadores del funcionamiento de una FAV, su evaluación periódica y su registro permiten detectar precozmente la disfunción de esta. Esta detección precoz permite la identificación y la corrección electiva de lesiones que permitan reparar la FAV y disminuir el riesgo de trombosis.Población a la que se aplica
Todos los pacientes en HD en el momento de la medición.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de FAV que tienen un registro de monitorización y vigilancia de modo regular durante todo el año × 100.
- •
Denominador: todas las FAV (FAVn y FAVp) prevalentes a lo largo de 1 año.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: > 90%.
El análisis del uso de la monitorización y vigilancia en el paciente en HD periódica, permite evitar la trombosis relacionada con la ausencia del control evolutivo de la estenosis de la FAV.
Al no disponer de referencias bibliográficas, el estándar se ha establecido por consenso del GEMAV siguiendo los criterios de monitorización y vigilancia según la metodología referida en el apartado 4 para FAVn y FAVp.Indicador 4.8
Porcentaje de pacientes incidentes portadores de catéter venoso central, sin contraindicación para la realización de una fístula arteriovenosa, a los que se les realiza una fístula arteriovenosa antes de las 6 semanas desde que se implanta el catéterTipo de indicador
Indicador CENTINELA.Fundamento
Este indicador evalúa la eficacia del equipo multidisciplinar para reducir el tiempo de exposición del paciente en HD al CVC.Población a la que se aplica
Pacientes con ERC que inician HD a través de CVC.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes incidentes sin contraindicación para FAV que inician programa de HD a través de un CVC y se les construye una FAV antes de 6 semanas × 100.
- •
Denominador: número de pacientes incidentes sin contraindicación para FAV que inician el tratamiento de HD mediante CVC.
- •
Unidades: porcentaje.
- •
Periodicidad: mensual.
- •
Estándar: > 90%.
Pacientes con patologías que sugieran la posibilidad de recuperación de función renal y se decida mantener con CVC o que se nieguen a realizarse una FAV.Comentario
Al no disponer de referencias bibliográficas, el estándar se ha establecido por consenso del GEMAV. Se considera que a un paciente que inicia HD con un CVC se le debe realizar una FAV de forma precoz para minimizar el tiempo de exposición al CVC, para lo cual se ha establecido un máximo de 6 semanas.
5Complicaciones de la fístula arteriovenosaIndicador 5.1
Porcentaje de fístulas arteriovenosas trombosadas potencialmente recuperables que se rescatan al añoTipo de indicador
Indicador de RESULTADO.Definición de términos
- •
Rescate de la FAV. Restablecimiento del flujo, tras trombosis, de una FAV potencialmente recuperable mediante trombectomía y/o trombólisis farmacomecánica, y realización tras el procedimiento de al menos una sesión de HD si se encuentran en programa de tratamiento sustitutivo renal (TSR).
- •
FAV trombosada potencialmente recuperable. FAV trombosada que, dadas las características del paciente y/o de la propia FAV, es tributaria de intentar su rescate.
Evaluar el resultado de cirugía y/o radiología vascular en caso de trombosis.Población a la que se aplica
Todos los pacientes prevalentes portadores de FAV que se dializan en la unidad de HD a lo largo del año de estudio o están en la consulta de ERCA.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes con FAV trombosadas potencialmente recuperables, que se repermeabilizan, con restablecimiento del flujo suficiente como para poder ser utilizadas en al menos una sesión de HD si se encuentran en programa de TSR × 100.
- •
Denominador: número de pacientes con FAV trombosadas potencialmente recuperables.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: > 70%.
Un estudio publicado en el año 2013 en nuestro país muestra un porcentaje de FAVp rescatadas del 80%167. El estándar se ha establecido por consenso del GEMAV.Indicador 5.2
Porcentaje de fístulas arteriovenosas nativas con estenosis significativa, no trombosada, reparadas quirúrgicamente que siguen permeables después del añoTipo de indicador
Indicador de RESULTADO.Definición de términos
Estenosis significativa. Reducción de la luz vascular > 50% demostrada mediante ED en FAVn o FAVp con elevado riesgo de trombosis según los criterios expuestos en el apartado 4, es decir, tributaria de tratamiento electivo o preventivo.Fundamento
Valorar la eficacia de la cirugía en el tratamiento de las estenosis significativas de FAVn no trombosadas, en el contexto del manejo multidisciplinar.Población a la que se aplica
Pacientes prevalentes portadores de FAVn que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año en estudio y precisan de reparación quirúrgica por estenosis significativa.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes con una FAVn que sigue permeable después de una reparación quirúrgica por estenosis significativa al año de seguimiento × 100.
- •
Denominador: número de pacientes con una FAVn que presentan una estenosis significativa reparada quirúrgicamente y llevan 1 año de seguimiento.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: > 50% al año.
Las guías KDOQI-2006 y las guías canadienses basadas en el criterio clásico de estenosis significativa sugieren un estándar > 50% al año10,15. El GEMAV, a pesar de utilizar un criterio más restrictivo de estenosis, ha establecido por consenso el mismo estándar.Indicador 5.3
Porcentaje de fístulas arteriovenosas nativas con estenosis significativa, no trombosada, reparadas de forma endovascular que siguen permeables después de 6 mesesTipo de indicador
Indicador de RESULTADO.Definición de términos
Estenosis significativa. Similar al indicador 5.2.Fundamento
Valorar la eficacia del tratamiento endovascular en la reparación de las estenosis significativas de FAVn no trombosadas, en el contexto del manejo multidisciplinar.Población a la que se aplica
Pacientes prevalentes portadores de FAVn que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año en estudio y precisan una reparación endovascular por estenosis significativa.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes con FAVn que sigue permeable tras reparación endovascular por estenosis significativa a los 6 meses de seguimiento × 100.
- •
Denominador: número de pacientes con FAVn que presentan estenosis significativa reparada con técnicas intervencionistas radiológicas y son seguidas durante 6 meses.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: > 50% a los 6 meses.
Las guías KDOQI-2006 y las guías canadienses basadas en el criterio clásico de estenosis significativa sugieren un estándar > 50% a los 6 meses10,15. El GEMAV, a pesar de utilizar un criterio más restrictivo de estenosis, ha establecido por consenso el mismo estándar.Indicador 5.4
Porcentaje de fístulas arteriovenosas nativas trombosadas, reparadas quirúrgicamente, que siguen permeables al añoTipo de indicador
Indicador de RESULTADO.Definición de términos
Trombosis. Similar a los indicadores previos.Fundamento
Valorar la eficacia de la cirugía en el tratamiento de las FAVn trombosadas, en el contexto del manejo multidisciplinar.Población a la que se aplica
Pacientes prevalentes portadores de FAVn que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año de estudio y precisan un rescate quirúrgico después de una trombosis.Fuentes de datosHistorias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes con una FAVn que sigue permeable tras rescate quirúrgico por trombosis al año de seguimiento × 100.
- •
Denominador: número de pacientes con una FAVn que presentan una trombosis rescatada quirúrgicamente y llevan 1 año de seguimiento.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: > 50% al año.
Las guías KDOQI-2006 sugieren un estándar de permeabilidad > 50% al año; las guías canadienses 2006, un 40% al año, y las guías europeas 2007, un 80% al año10,14,15.
El GEMAV ha decidido establecer por consenso una permeabilidad > 50% al año. No obstante hay estudios, como se muestra en el apartado 5272,273, que muestran que la intervención electiva de una FAV disfuncionante aumenta la duración de su permeabilidad respecto a cuando se repara después de una trombosis. Por tanto, aunque el GEMAV ha decidido establecer por consenso una permeabilidad, similar al de otras guías, > 50% al año, es probable que este indicador no esté bien dimensionado.Indicador 5.5
Porcentaje de fístulas arteriovenosas nativas trombosadas, reparadas endovascularmente, que siguen permeables a los 6 mesesTipo de indicador
Indicador de RESULTADO.Definición de términos
Trombosis. Similar a los indicadores previos.Fundamento
Valorar la eficacia del tratamiento endovascular en el tratamiento de las FAVn trombosadas, en el contexto del manejo multidisciplinar.Población a la que se aplica
Pacientes prevalentes portadores de FAVn que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año en estudio y precisan un rescate radiológico después de su trombosis.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes con una FAVn que sigue permeable tras rescate endovascular por trombosis a los 6 meses de seguimiento × 100.
- •
Denominador: número de pacientes con una FAVn que presentan una trombosis rescatada con técnicas intervencionistas radiológicas y llevan 6 meses de seguimiento.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: > 50% a los 6 meses.
Las guías KDOQI-2006 sugieren un estándar de permeabilidad > 50% a los 6 meses; las guías canadienses 2006, un 40% a los 3 meses, y las guías europeas, un 50% al año10,14,15.
El GEMAV ha decidido establecer por consenso una permeabilidad > 50% a los 6 meses.Indicador 5.6
Porcentaje de fístulas arteriovenosas protésicas con estenosis significativa, no trombosada, reparadas quirúrgicamente que siguen permeables después de 1 añoTipo de indicador
Indicador de RESULTADO.Definición de términos
Estenosis significativa. Similar al indicador 5.2.Fundamento
Valorar la eficacia de la cirugía en el tratamiento de las estenosis significativas de FAVp no trombosadas, en el contexto del manejo multidisciplinar.Población a la que se aplica
Pacientes prevalentes portadores de FAVp que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año en estudio y precisan de reparación quirúrgica por presentar una estenosis significativa.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes con FAVp que sigue permeable tras reparación quirúrgica por estenosis significativa tras 1 año de seguimiento × 100.
- •
Denominador: número de pacientes con FAVp que presentan una estenosis significativa reparada quirúrgicamente y llevan 1 año de seguimiento.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: > 50% al año.
Las guías KDOQI-2006 y las guías canadienses basadas en el criterio clásico de estenosis significativa sugieren un estándar > 50% al año10,15.
El GEMAV, a pesar de utilizar un criterio más restrictivo de estenosis, ha establecido por consenso el mismo estándar.Indicador 5.7
Porcentaje de fístulas arteriovenosas protésicas con estenosis significativa, no trombosada, reparadas de forma endovascular que siguen permeables a los 6 mesesTipo de indicador
Indicador de RESULTADO.Definición de términos
Estenosis significativa. Similar al indicador 5.2.Fundamento
Valorar la eficacia del tratamiento endovascular en la reparación de las estenosis significativas de FAVp no trombosadas, en el contexto del manejo multidisciplinar.Población a la que se aplica
Pacientes prevalentes portadores de FAVp que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año de estudio y precisan una reparación endovascular por estenosis significativa.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes con FAVp que sigue permeable tras reparación endovascular por estenosis significativa tras 6 meses de seguimiento × 100.
- •
Denominador: número de pacientes con FAVp que presentan estenosis significativa reparadas con técnicas intervencionistas radiológicas y llevan 6 meses de seguimiento.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: > 50% a los 6 meses.
Las guías KDOQI-2006 y las guías canadienses basadas en el criterio clásico de estenosis significativa sugieren un estándar > 50% a los 6 meses10,15.
El GEMAV, a pesar de utilizar un criterio más restrictivo de estenosis, ha establecido por consenso el mismo estándar.Indicador 5.8
Porcentaje de fístulas arteriovenosas protésicas trombosadas, reparadas quirúrgicamente, que siguen permeables a los 6 mesesTipo de indicador
Indicador de RESULTADO.Definición de términos
Trombosis. Similar a los indicadores previos.Fundamento
Valorar la eficacia de la cirugía en el tratamiento de las FAVp trombosadas.Población a la que se aplica
Pacientes prevalentes portadores de una FAVp que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año de estudio y precisan un rescate quirúrgico después de una trombosis.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes con FAVp que siguen permeables después de un rescate quirúrgico por trombosis a los 6 meses de seguimiento × 100.
- •
Denominador: número de pacientes con FAVp que presentan una trombosis rescatada quirúrgicamente y llevan, al menos, 6 meses de seguimiento.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: > 40% al año o 50% a los 6 meses.
Las guías KDOQI-2006 y las guías canadienses 2006 sugieren un estándar de permeabilidad > 40% al año o 50% a los 6 meses10,15. El GEMAV ha decidido establecer por consenso un indicador similar a dichas guías.Indicador 5.9
Porcentaje de fístulas arteriovenosas protésicas trombosadas, reparadas endovascularmente, que siguen permeables a los 6 mesesTipo de indicador
Indicador de RESULTADO.Definición de términos
Trombosis. Similar a los indicadores previos.Fundamento
Valorar la eficacia del tratamiento endovascular en el tratamiento de las FAVp trombosadas.Población a la que se aplica
Pacientes prevalentes portadores de FAVp que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año en estudio y precisan un rescate radiológico después de su trombosis.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes con una FAVp que sigue permeable tras rescate endovascular por trombosis a los 6 meses de seguimiento × 100.
- •
Denominador: número de pacientes con una FAVp que presentan una trombosis rescatada con técnicas intervencionistas radiológicas y llevan más de 6 meses tras el procedimiento.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: > 50% a los 6 meses.
Las guías KDOQI-2006 sugieren un estándar de permeabilidad > 40% a los 3 meses; las guías canadienses 2006, un 40%, y las guías europeas, > 30%10,14,15.
El GEMAV ha decidido establecer por consenso una permeabilidad > 50% a los 6 mesesIndicador 5.10
Tasa de infecciones de la fístula arteriovenosa nativa
Tipo de indicador
Indicador de RESULTADO.Definición de términos
- •
Infección de FAV. Presencia de signos inflamatorios locales o supuración sobre zona de punción de FAV aislada o asociada a sintomatología general o fiebre, y hemocultivos positivos al mismo microorganismo aislado de exudado recogido en la zona de punción.
- •
Paciente/año en riesgo. Similar al indicador 4.5.
Indica la eficacia del equipo multidisciplinar, especialmente enfermería, respecto a la prevención y manejo de la infección de la FAVn.Población a la que se aplica
Pacientes prevalentes con FAVn que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de pacientes con FAVn que presentan infección de la FAV en el año en estudio.
- •
Denominador: número total de pacientes/año en riesgo con FAVn en el año en estudio.
- •
Unidades: tasa.
- •
Periodicidad: anual.
- •
Estándar: < 0,01 paciente/año en riesgo.
Existe una diversidad de objetivos y de forma de expresión de la infección de la FAVn. Las guías DOQI (2006) establecen como objetivo una infección < 1% en FAVn y < 10% en FAVp10. Gruss et al aportan valores entre el 0,86 y el 8,13%, respectivamente272. Otras publicaciones como la de Stevenson muestran una tasa de infección de forma conjunta para FAVn y FAVp de 2,53 episodios de infección/1.000 días953. Las guías canadienses15 establecen como objetivo una tasa de infección de 0,01 episodios por paciente/año en riesgo para las FAVn y de 0,1 episodio por paciente/año para las FAVp.
El GEMAV ha considerado este último estándar como el más idóneo para evaluar las infecciones en las FAVn.Indicador 5.11
Tasa de infecciones de la fístula arteriovenosas protésicaTipo de indicador
Indicador de RESULTADO.Definición de términos
Infección y paciente/año en riesgo. Similar a indicadores anteriores.Fundamento
Indica la eficacia del equipo multidisciplinar, especialmente enfermería, respecto a la prevención y al manejo de la infección de la FAVp.Población a la que se aplica
Pacientes prevalentes con FAVp que se dializan en la unidad de HD o están en la consulta de ERCA a lo largo del año.Fuentes de datos
Historias clínicas.Fórmula
- •
Numerador: número de pacientes con FAVp que presentan infección en el año en estudio.
- •
Denominador: número total de pacientes/año en riesgo con FAVp en el año de estudio.
- •
Unidades: tasa.
- •
Periodicidad: anual.
- •
Estándar: < 0,1 paciente/año en riesgo.
Comentario similar al indicador 5.10.
6Catéteres venosos centralesIndicador 6.1
Densidad de incidencia de bacteriemia relacionada con el catéter venoso tunelizado (número de bacteriemias relacionadas con el catéter venoso tunelizado/1.000 días de uso del catéter venoso tunelizado)Tipo de indicador
Indicador de RESULTADO.Definición de términos
Bacteriemia. Aislamiento del mismo microorganismo en sangre periférica y en la punta del catéter retirado. Si no se retira el catéter, aislamiento del mismo microorganismo como mínimo en 2 hemocultivos (uno a través de las luces del CVC y el otro por punción de una vena periférica) y se cumplan los criterios diagnósticos para hemocultivos cuantitativos o se calcule un tiempo diferencial positivo.Fundamento
Una tasa elevada de bacteriemia relacionada con el CVT indica un mal cumplimiento con las medidas universales de asepsia.Población a la que se aplica
Pacientes portadores de CVT de la unidad de HD durante el período en estudio.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de bacteriemias relacionadas con el catéter en pacientes portadores de CVT en 1 año × 1.000.
- •
Denominador: número de días totales de CVT en 1 año.
- •
Unidades: densidad de incidencia.
- •
Periodicidad: anual.
- •
Estándar:
- •
Excelente: < 1/1.000 días-catéter.
- •
Bueno: 1-2/1.000 días-catéter.
- •
Razonable: 3-5/1.000 días-catéter.
- •
Malo: 6-7/1.000 días-catéter.
- •
Muy malo: > 7/1.000 días-catéter.
El GEMAV ha considerado este estándar como el más idóneo para clasificar las bacteriemias relacionadas con el CVT954.Exclusiones
Se excluyen las bacteriemias que no se ha demostrado que se encuentran en relación con el CVC o no cumplen criterios de bacteriemia relacionada con el catéter.Indicador 6.2
Porcentaje de catéteres venosos tunelizados con disfunción inmediataTipo de indicador
Indicador de RESULTADO.Definición de términos
Disfunción inmediata del CVT. Media de flujo < 300ml/min o imposibilidad de iniciar una sesión de HD por flujo inadecuado después de haber intentado restaurar la permeabilidad del CVT.Fundamento
Una alta incidencia de CVT disfuncionante en la primera HD tras su colocación indica un mal cumplimiento del protocolo de inserción del CVT. Aun así, la decisión de recambio de catéter será individualizada en función de la capacidad de obtener un índice Kt/V (cantidad de plasma depurado de la urea [K] durante el tiempo de la sesión de HD [t] en relación con el volumen de distribución de la urea [V]) adecuado para la edad y el sexo del paciente.Población a la que se aplica
Pacientes portadores de CVT de la unidad de HD durante el período de estudio.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de CVT con disfunción inmediata a lo largo del período en estudio × 100.
- •
Denominador: número de CVT incidentes que tenga la unidad de HD a lo largo del período en estudio.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: < 2%.
Al no disponer de referencias bibliográficas, el estándar se ha establecido por consenso del GEMAV.Indicador 6.3
Porcentaje de catéteres venosos tunelizados con disfunciónTipo de indicador
Indicador de RESULTADO.Definición de términos
Disfunción inmediata del CVT. Media de flujo < 300ml/min o imposibilidad de iniciar una sesión de HD por flujo inadecuado después de haber intentado restaurar la permeabilidad del CVT.Fundamento
Aunque en la mayoría de las ocasiones, la disfunción de un CVT se debe a una trombosis de este, también puede indicar un desplazamiento de la punta o una mala colocación del CVT. Una alta incidencia de disfunción obliga a investigar las posibles causas relacionadas.Población a la que se aplica
Pacientes portadores de CVT de la unidad de HD durante el período en estudio.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de CVT disfuncionantes durante el período en estudio × 100.
- •
Denominador: número de CVT de la unidad en el período en estudio.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: < 5%.
Las guías KDOQI-2006, aunque utilizan una definición de disfunción distinta, sugieren un porcentaje de disfunción del 5%. En ausencia de otras recomendaciones, el GEMAV ha considerado este estándar como el más idóneo respecto al porcentaje de disfunción del CVT.Indicador 6.4
Porcentaje de complicaciones mayores durante la inserción de un catéter venoso centralTipo de indicador
Indicador de RESULTADO.Definición de términos
Complicaciones mayores. Aparición de neumotórax, hemotórax, hematoma que requiera drenaje, perforación, hemomediastino, embolia aérea o sepsis secundaria al procedimiento de la inserción del CVC.Fundamento
Una alta incidencia de complicaciones mayores relacionadas con la colocación de un CVC indica un mal cumplimiento en la técnica de colocación del CVC.Población a la que se aplica
Todos los pacientes a los que se coloca un CVC.Fuentes de datos
Historias clínicas de los pacientes.Fórmula
- •
Numerador: número de complicaciones en el período estudiado × 100.
- •
Denominador: número de CVC colocados en el período estudiado.
- •
Unidades: porcentaje.
- •
Periodicidad: anual.
- •
Estándar: < 3%.
El porcentaje global de complicaciones mayores aceptado en la implantación guiada por imagen de un CVC es del 3%, y se acepta un 7% de complicaciones totales (mayores y menores)955. En ausencia de otras recomendaciones, el GEMAV ha considerado este estándar como el más idóneo respecto al porcentaje de disfunción del CVT.
AGRADECIMIENTOSQueremos agradecer especialmente el apoyo incondicional de los presidentes de las cinco sociedades científicas involucrados en la elaboración de esta guía, es decir, la Sociedad Española de Nefrología (S.E.N.), la Sociedad Española de Angiología y Cirugía Vascular (SEACV), la Sociedad Española de Radiología Médica (SERAM) y su Sección de Radiología Vascular e Intervencionista (SERAM-SERVEI), la Sociedad Española de Enfermería Nefrológica (SEDEN) y, finalmente, la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y su Grupo de Estudio de la Infección Relacionada con la Asistencia Sanitaria/Grupo de Estudio de la Infección Hospitalaria (GEIRAS/GEIH-SEIMC). En particular, queremos dar las gracias al Dr. Alberto Martínez-Castelao y la Dra. M. Dolores del Pino (S.E.N.), Dr. Francisco S. Lozano Sánchez y al Dr. Luis Javier Álvarez Fernández (SEACV), al Dr. José Luis del Cura (SERAM), la Dra. Teresa Moreno (SERVEI), la Sra. María Jesús Rollán (SEDEN) y al Dr. Miguel Salavert (GEIRAS/GEIH-SEIMC). Estamos en deuda con los miembros del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV) involucrados en esta guía, por el tiempo y el esfuerzo que han dedicado de forma generosa en la revisión de la literatura, participación en las reuniones del GEMAV, redacción de los apartados y discusión fundamentada de los aspectos más controvertidos de la guía que ahora presentamos. Creemos que la perspectiva multidisciplinar de estos profesionales desde sus respectivas sociedades científicas no ha hecho más que enriquecer el contenido de la guía, ya que ha permitido el abordaje de muchos temas conflictivos del acceso vascular desde distintos puntos de vista.
No nos podemos olvidar de la evaluación efectuada por los revisores externos, cuya experiencia nos ha aportado una ayuda inestimable en la elaboración de esta guía.
Por otra parte, es necesario agradecer el apoyo metodológico proporcionado por los investigadores del Centro Cochrane Iberoamericano. Su intervención ha sido decisiva para la formulación correcta de las preguntas clínicas, la síntesis de la evidencia científica y la formulación de recomendaciones de acuerdo a las directrices del sistema GRADE.
No cabe duda de que la experiencia aportada por el Dr. Carlos Quereda Rodríguez-Navarro, coordinador de las Guías de Práctica Clínica de la S.E.N., ha sido de agradecer en el tramo final de la edición de la guía. Sus valiosas indicaciones han sido también de inestimable ayuda.
Finalmente, apreciamos sinceramente las facilidades que hemos recibido siempre por parte del Director y del Editor Jefe de la revista Nefrología, los doctores Mariano Rodríguez Portillo y Roberto Alcázar Arroyo, respectivamente, que han hecho posible la publicación de esta guía.
GLOSARIO| TÉRMINO | ACRÓNIMO | ANGLICISMO | SINÓNIMOS | DEFINICIÓN |
|---|---|---|---|---|
| Acceso vascular | AV | VA | Acceso a la circulación sanguínea para la realización del tratamiento sustitutivo renal mediante hemodiálisis. Puede tratarse de una fístula arteriovenosa nativa, una fístula arteriovenosa protésica o un catéter venoso central | |
| Acceso vascular de recurso | Acceso vascular realizado en ausencia de un adecuado drenaje venoso a aurícula derecha (vena subclavia, tronco braquiocefálico y vena cava superior) | |||
| Aneurisma | Aneurisma verdadero | Dilatación segmentaria de un vaso por encima de su calibre normal | ||
| Angioplastia transluminal percutánea | ATP | PTA | Técnica de dilatación intravascular con balón mediante punción utilizada para el tratamiento de las estenosis vasculares | |
| Arco de la vena cefálica | AVC | CVA | Cayado de la vena cefálica | Segmento terminal de vena cefálica, correspondiente al trayecto entre su posición superficial en el surco deltopectoral hasta la confluencia en el sistema venoso profundo (vena axilar/ subclavia) |
| Bacteriemia relacionada con el catéter venoso central | BRC | CRBSI | Aislamiento de un mismo microorganismo en sangre y catéter en ausencia de otro foco de infección | |
| Balón de angioplastia | Catéter en cuyo extremo distal lleva incorporado un balón que puede ser inflado a una determinada presión, aumentando su volumen y alcanzando un diámetro determinado. La presión a la que alcanza su diámetro se denomina presión de trabajo. La presión necesaria para producir la rotura del balón se denomina presión de rotura | |||
| Balón de angioplastia de alta presión | Balón que una vez alcanzado su diámetro máximo (presión de trabajo), este no aumenta aunque se aumente la presión de inflado. Los materiales con los que son realizados permiten alcanzar altas presiones de rotura (> 24 atmósferas) | |||
| Balón de angioplastia decomplianceosemicompliance | Balón en el que su diámetro viene determinado por la presión a la que se somete, con capacidad de aumentar dicho diámetro según aumenta la presión de inflado (hasta alcanzarse una presión máxima o de rotura) | |||
| Banding | Técnica quirúrgica consistente en la disminución del diámetro de la vena de salida de la fístula arteriovenosa constriñendo (banding) dicha vena mediante un dispositivo externo, con el objeto de reducir el flujo a nivel del acceso vascular | |||
| Catéter venoso central | CVC | CVC | Tipo de acceso vascular compuesto de material sintético de una o dos luces que permite alcanzar las venas centrales o la aurícula derecha a partir de su inserción en una vena, habitualmente la yugular interna o la femoral común | |
| Catéter venoso central no tunelizado | CVNT | Tipo de catéter venoso central que no se sitúa en un túnel subcutáneo hasta su entrada en la vena | ||
| Catéter venoso central tunelizado | CVT | Tipo de catéter venoso central situado en un túnel subcutáneo hasta su entrada en la vena, habitualmente provisto de un sistema de anclaje mediante un manguito (cuff) que permite su fijación al tejido subcutáneo mediante una reacción de fibrosis | ||
| Cebado del catéter venoso central | Catheter lock | Sellado del CVC | Ocupación de la luz o luces del catéter venoso central por una solución de anticoagulante y/o antimicrobiano en el período interdialítico para prevenir la trombosis y/o la infección | |
| Ecografía | US | Técnica de imagen no invasiva que permite la exploración de órganos y tejidos mediante la emisión y recepción de ultrasonidos y su transformación en imágenes | ||
| Ecografía Doppler | ED | DU | Modalidad de ecografía que usa el efecto Doppler para evaluar la dirección y medir la velocidad y el volumen del flujo de los fluidos en ciertas estructuras, especialmente en los vasos sanguíneos | |
| Ecografía Doppler color | EDC | DDU | Modo de ecografía que combina la ecografía bidimensional y el efecto Doppler para ofrecer información de velocidad en el rango de color | |
| Endoprótesis vascular | Endovascular stent Graft; stent graft | Stent recubierto | Conducto endovascular protésico con el soporte externo de un stent |
| TÉRMINO | ACRÓNIMO | ANGLICISMO | SINÓNIMOS | DEFINICIÓN |
|---|---|---|---|---|
| Enfermedad renal crónica avanzada | ERCA | Fase de la enfermedad renal crónica en que la tasa de filtración glomerular es inferior a 30 ml/min/1,73 m2 | ||
| Estenosis | Stenosis | Reducción del diámetro de la luz normal de un vaso | ||
| Estenosis yuxtaanastomótica de la fístula arteriovenosa nativa | Estenosis perianastomótica de la fístula arteriovenosa nativa | Estenosis localizada en un área que comprende desde la zona inmediatamente adyacente a la anastomosis hasta los 5 cm postanastomosis | ||
| Estenosis significativa. Criterios del GEMAV | Disminución de la luz vascular en la fístula arteriovenosa nativa o protésica demostrada mediante ecografía Doppler con alto riesgo de trombosis, es decir, toda disminución de la luz vascular que cumple 2 criterios principales (porcentaje de reducción de la luz vascular > 50% + ratio pico de la velocidad sistólica > 2) y uno de los siguientes criterios adicionales como mínimo: criterio morfológico (diámetro residual < 2 mm) o criterio funcional (flujo sanguíneo del acceso vascular (ml/min) < 500 [fístula arteriovenosa nativa], 600 [fístula arteriovenosa protésica] o decremento de flujo sanguíneo del acceso vascular > 25% si el flujo es < 1.000 ml/min) | |||
| Estenosis significativa. Criterios de la guía KDOQI | Disminución > 50% de la luz vascular de una fístula arteriovenosa nativa o protésica demostrada mediante ecografía Doppler o fistulografía, asociada a una alteración repetida de cualquier parámetro obtenido por los métodos de cribado de primera y/o segunda generación | |||
| Estenosis venosa central | Estenosis localizadas en el sector venoso desde la vena axilar hasta su drenaje en aurícula derecha, y que comprende las venas axilar y subclavia, el tronco braquiocefálico y la vena cava superior. En el territorio de la cava inferior comprendería, además de esta, las venas ilíacas | |||
| Éxito anatómico del tratamiento de una estenosis de la fístula arteriovenosa | Desaparición de la estenosis o persistencia de una estenosis residual inferior al 30% después de la intervención | |||
| Fallo inmediato | Ausencia de permeabilidad de la fístula arteriovenosa en las primeras 72 h tras su construcción | |||
| Fallo precoz | Ausencia de permeabilidad de la fístula arteriovenosa en los primeros 30 días tras su construcción | |||
| Fallo primario | Ausencia de permeabilidad de la fístula arteriovenosa que incluye el fallo inmediato y el precoz | |||
| Fibrinólisis | Tratamiento consistente en la administración intravenosa de fibrinolíticos con el fin de conseguir la lisis del material trombótico intravascular | |||
| Fístula arteriovenosa | FAV | Acceso vascular arteriovenoso | Circuito creado mediante la conexión de una arteria y una vena con el fin de ser utilizado para efectuar la conexión a la hemodiálisis mediante su canulación | |
| Fístula arteriovenosa inmadura | Fístula arteriovenosa que una vez transcurridas entre 4 y 6 semanas desde su realización, no cumple los criterios de maduración | |||
| Fístula arteriovenosa nativa | FAVn | AVF | Fístula arteriovenosa donde la vena sirve como conducto de acceso para la canulación y conexión a hemodiálisis | |
| Fístula arteriovenosa protésica | FAVp | AVG | Fístula arteriovenosa donde entre la arteria y la vena se realiza la interposición de un injerto de material sintético, habitualmente un derivado plástico de politetrafluoroetileno, donde el cuerpo del injerto sirve como conducto de acceso para la canulación y conexión a hemodiálisis | |
| Fístula arteriovenosa utilizable para la hemodiálisis crónica | FUSH (fistula used successfully for hemodialysis) | Fístula arteriovenosa que permite la punción mediante 2 agujas en al menos dos tercios de las sesiones de hemodiálisis durante 1 mes y que permite completar la pauta de hemodiálisis programada | ||
| Fistulografía | Exploración radiológica realizada mediante la administración intravenosa de contraste yodado con el objetivo de explorar la permeabilidad y adecuación de territorio vascular relacionado con la fístula arteriovenosa |
| TÉRMINO | ACRÓNIMO | ANGLICISMO | SINÓNIMOS | DEFINICIÓN |
|---|---|---|---|---|
| Flebografía | Exploración realizada mediante la administración intervenosa de contraste yodado a través de la canalización de una vena periférica que permite el estudio de las venas de los miembros superiores o inferiores y su drenaje hasta cavidades cardíacas | |||
| Flujo de bomba del circuito de hemodiálisis | QB | QB | Volumen de sangre por unidad de tiempo extraído del paciente y que se incorpora al circuito extracorpóreo de hemodiálisis, expresado en ml/min | |
| Flujo de la fístula arteriovenosa | QA | QA | Volumen de sangre por unidad de tiempo que circula a través de la fístula arteriovenosa (expresado en ml/min) | |
| Frémito | Thrill | Vibración palpable del vaso debida a la presencia de un flujo turbulento en este | ||
| Grupo Español Multidisciplinar del Acceso Vascular | GEMAV | Grupo Español Multidisciplinar del Acceso Vascular; formado por representantes de la Sociedad Española de Nefrología (S.E.N.), Sociedad Española de Angiología y Cirugía Vascular (SEACV), Sociedad Española de Radiología Vascular e Intervencionista-Sociedad Española de Radiología Médica (SERVEI-SERAM), Sociedad Española de Enfermería Nefrológica (SEDEN) y Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) | ||
| Hemodiálisis | HD | HD | Tipo de tratamiento sustitutivo renal que permite eliminar del organismo las toxinas urémicas y el exceso de líquido acumulado mediante los procesos de difusión y ultrafiltración de la sangre que se efectúan a nivel del dializador (membrana semipermeable) de la máquina de hemodiálisis | |
| Índice de presión digital | Razón entre la presión digital a nivel de la extremidad estudiada (usualmente medida mediante fotopletismografía) y la presión de la arterial humeral en la extremidad contralateral | |||
| Índice Kt | Kt | Kt | Parámetro de adecuación de hemodiálisis equivalente del aclaramiento de urea (K) proporcionado por biosensores incorporados a algunos monitores de hemodiálisis ajustado al tiempo de la sesión (t) | |
| Índice Kt/V | Kt/V | Kt/V | Parámetro de adecuación de hemodiálisis que determina la cantidad de plasma depurado de la urea (K) durante el tiempo de la sesión de hemodiálisis (t) en relación con el volumen de distribución de la urea (V) | |
| Infección del orificio de salida del catéter venoso central | Signos inflamatorios limitados a 2 cm alrededor del orificio de salida cutáneo, sin extensión al manguito (cuff) del catéter venoso central si este fuese tunelizado. Puede estar asociada o no a fiebre y bacteriemia, y acompañarse de exudado purulento a través del orificio de salida cutáneo. El aislamiento de un germen en el cultivo proporcionará el diagnóstico definitivo, en caso contrario se tratará de un diagnóstico de probabilidad | |||
| Infección del túnel subcutáneo del catéter venoso central tunelizado | Tunelitis | Signos inflamatorios que se extienden más allá de 2 cm del orificio de salida y en el trayecto subcutáneo del catéter venoso central tunelizado. Puede estar asociada o no a fiebre y bacteriemia, y acompañarse de exudado purulento a través del orificio de salida cutáneo. El aislamiento de un germen en el cultivo proporcionará el diagnóstico definitivo. En caso contrario, se tratará de un diagnóstico de probabilidad | ||
| Inflow | Inflow | Segmento de la fístula arteriovenosa nativa que incluye la arteria nutricia, la propia anastomosis y el trayecto inicial de la vena arterializada hasta 5 cm postanastomosis | ||
| Ligadura de la arteria radial distal | DRAL | Distal radial artery ligation | Técnica quirúrgica consistente en la desconexión de la arteria radial distal a la anastomosis arteriovenosa con el fin de evitar el flujo retrógrado por esta | |
| Ligadura de la arteria radial proximal | PRAL | Proximal radial artery ligation | Técnica quirúrgica consistente en la ligadura de la arteria radial proximal adyacente a la anastomosis como método para reducir el flujo en una fistula arteriovenosa radiocefálica | |
| Ligadura parcial mínimamente invasiva asistida de forma endovascular | MILLER | Minimally invasive limited ligation endoluminal- assisted revision | Técnica quirúrgica que consiste en realizar un banding de forma mínimamente invasiva, asistido mediante la introducción percutánea de un balón de angioplastia en la anastomosis arteriovenosa |
| TÉRMINO | ACRÓNIMO | ANGLICISMO | SINÓNIMOS | DEFINICIÓN |
|---|---|---|---|---|
| Maduración de la fístula arteriovenosa | Proceso a través del cual la vena o la prótesis adquiere las características morfológicas y hemodinámicas necesarias para permitir su canulación y uso para la hemodiálisis | |||
| Mapeo vascular | Cartografía vascular | Exploración efectuada mediante una técnica de imagen para valorar las características anatómicas y/o funcionales de los vasos sanguíneos con el propósito de la creación de una fístula arteriovenosa | ||
| Método de punción en área | Area | Punción efectuada en una zona muy circunscrita de la vena arterializada en la fístula arteriovenosa nativa o de la prótesis en la fístula arteriovenosa protésica | ||
| Método de punción en ojal | Buttonhole | Punción efectuada a través del mismo orificio en todas las sesiones de hemodiálisis, tras la creación de un túnel subcutáneo con una aguja estándar y la posterior utilización de una aguja de punta roma | ||
| Método de punción escalonada | Rope-ladder | Método de punción rotatoria | Punción distribuida regularmente a lo largo de toda la longitud de la vena arterializada en la fístula arteriovenosa nativa o de la prótesis en la fístula arteriovenosa protésica | |
| Métodos de cribado de primera generación | First generation screening techniques | Técnicas utilizadas para el diagnóstico precoz de la estenosis significativa de la fístula arteriovenosa que incluyen la monitorización clínica, monitorización de la presión, determinación del porcentaje de recirculación y disminución inexplicable de la adecuación de la hemodiálisis | ||
| Métodos de cribado de segunda generación | Second generation screening techniques | Técnicas de cribado para el diagnóstico precoz de la estenosis significativa que permiten la estimación del flujo sanguíneo de la fístula arteriovenosa de forma directa (ecografía Doppler) o indirecta (métodos dilucionales) | ||
| Métodos de monitorización de la fístula arteriovenosa | Monitoring techniques | Técnicas de cribado para el diagnóstico precoz de la estenosis significativa que no requieren una instrumentación especial e incluyen a todos los métodos de primera generación excepto la determinación de la presión venosa estática | ||
| Métodos de vigilancia de la fístula arteriovenosa | Surveillance techniques | Técnicas de cribado para el diagnóstico precoz de la estenosis significativa que pueden requerir una instrumentación especial e incluyen los dos métodos de segunda generación y la determinación de la presión venosa estática | ||
| Outflow | Outflow | Segmento de la fístula arteriovenosa nativa a nivel de la vena arterializada que incluye la zona de punción y el trayecto venoso posterior hasta su desembocadura en la aurícula derecha | ||
| Permeabilidad primaria (catéter venoso central) | Primary patency | Supervivencia primaria | Período comprendido entre la colocación del catéter y el momento en que requiere la primera intervención para mantener la permeabilidad. Esta incluye el tratamiento fibrinolítico, la trombectomía mecánica o el tratamiento intervencionista de la vaina de fibrina sin retirar el catéter | |
| Permeabilidad primaria (fístula arteriovenosa) | Primary unassisted patency | Supervivencia primaria | Período transcurrido desde la creación de la fístula arteriovenosa (o desde el procedimiento terapéutico realizado, en el caso de la valoración del éxito de un procedimiento) hasta la primera intervención electiva (endovascular o quirúrgica), para mantener o restaurar el flujo sanguíneo o bien hasta el primer episodio de trombosis o hasta alcanzar un evento de censura (muerte, traslado a otra unidad de hemodiálisis, cambio de tratamiento sustitutivo renal —diálisis peritoneal, trasplante renal— y finalización del período de estudio) | |
| Permeabilidad primaria asistida (fístula arteriovenosa) | Post-intervention primary patency; primary assisted patency | Supervivencia primaria asistida | Período transcurrido desde la creación de la fístula arteriovenosa (o desde el procedimiento terapéutico realizado, en el caso de la valoración del éxito de un procedimiento) hasta el primer episodio de trombosis o bien hasta alcanzar un evento de censura (muerte, traslado a otra unidad de hemodiálisis, cambio de tratamiento sustitutivo renal —diálisis peritoneal, trasplante renal— y finalización del período de estudio) | |
| Permeabilidad secundaria (catéter venoso central) | Supervivencia secundaria | Período comprendido entre la colocación del catéter y el momento de su retirada por cualquier motivo, incluyendo el tiempo tras cualquier intervención para mantener la función del catéter |
| TÉRMINO | ACRÓNIMO | ANGLICISMO | SINÓNIMOS | DEFINICIÓN |
|---|---|---|---|---|
| Permeabilidad secundaria (fístula arteriovenosa) | Secondary patency; cumulative survival | Supervivencia secundaria | Período transcurrido desde la creación de la fístula arteriovenosa (o desde el procedimiento terapéutico realizado, en el caso de la valoración del éxito de un procedimiento) hasta el abandono definitivo de la fístula o bien hasta alcanzar un evento de censura (muerte, traslado a otra unidad de hemodiálisis, cambio de tratamiento sustitutivo renal —diálisis peritoneal, trasplante renal—, finalización del período de estudio) | |
| Pico de velocidad sistólica | PVS | PSV | Parámetro ecográfico que corresponde al valor de la velocidad máxima detectada en la curva Doppler del vaso estudiado. Su medida viene dada en cm/s | |
| Politetrafluoroetileno expandido | PTFE | PTFE | Teflón | Polímero sintético fluorado componente principal de determinadas prótesis para el acceso vascular en hemodiálisis |
| Porcentaje de reducción de la urea | PRU | URR | Parámetro de adecuación de hemodiálisis que determina la cantidad de plasma depurado de urea mediante la comparación directa de las concentraciones de urea previas y posteriores a hemodiálisis midiendo su reducción porcentual | |
| Presión intraacceso | PIA | IAP | Presión venosa estática | Estimación de la presión en el interior de la fístula arteriovenosa con la bomba de flujo de sangre del monitor de hemodiálisis detenida (flujo de bomba = 0 ml/min) |
| Presión intraacceso estática equivalente | PIA/PAM | IAP/MAP | Presión itraacceso estática normalizada | Ajuste de la presión intraacceso (PIA) por la presión arterial media (PAM), de forma que el valor de la PIA se expresa de forma equivalente o normalizada mediante el cociente PIA/PAM |
| Presión venosa dinámica | PVD | DVP | Presión necesaria para retornar la sangre dializada al interior del acceso vascular a través de la aguja venosa. Corresponde a la suma de la presión necesaria para vencer la resistencia ejercida por la aguja venosa y la presión existente en el interior de la fístula arteriovenosa | |
| Programa de seguimiento de la fístula arteriovenosa | Proceso de atención al enfermo prevalente en hemodiálisis crónica que se fundamenta en 2 aspectos complementarios: diagnóstico precoz de la estenosis significativa de la fístula arteriovenosa mediante la utilización de diversos métodos o técnicas de cribado de primera y/o segunda generación, y tratamiento correctivo de esta mediante la angioplastia transluminal percutánea y/o la cirugía de forma preventiva para evitar la trombosis de la fístula arteriovenosa | |||
| Prótesis biosintética | Prótesis vascular constituida por la combinación de un componente de material sintético y otro de origen biológico | |||
| Proximalización del aflujo arterial | PAI | Proximal arterial inflow | Técnica quirúrgica consistente en la ligadura de la fístula arteriovenosa a nivel de la anastomosis vascularizando dicha fístula mediante un bypass protésico entre la arteria axilar o humeral proximal y la vena de salida de la fístula arteriovenosa | |
| Seudoaneurisma | Dilatación expandible provocada por sangrado persistente a través de una pérdida de continuidad de la pared de la fístula arteriovenosa | |||
| Recirculación de la fístula arteriovenosa | Porcentaje de sangre ya dializada que tras entrar en la vena por la aguja venosa, entra de nuevo al dializador de la máquina de hemodiálisis a través de la aguja arterial | |||
| Revascularización distal con ligadura del intervalo | DRIL | Distal revascularization interval ligation | Técnica quirúrgica consistente en la ligadura de la arteria distal a la anastomosis de la fístula arteriovenosa con interposición de un bypass desde la arteria proximal a la distal al acceso vascular | |
| Revascularización usando el aflujo distal | RUDI | Revascularization using distal inflow | Técnica quirúrgica consistente en la desconexión quirúrgica de la anastomosis arteriovenosa procediendo seguidamente a su distalización, mediante un bypass retrógrado —protésico o autólogo— desde un tronco arterial distal (arterias radial o cubital) a la vena de salida de la fístula arteriovenosa | |
| Sellado con antibióticos | Antibiotic lock therapy | Exposición de la superficie endoluminal del catéter venoso central, entra las sesiones de hemodiálisis, al contacto de una solución antibiótica a alta concentración, habitualmente asociada a un anticoagulante, y durante un tiempo prolongado | ||
| Síndrome de hipoperfusión distal | SHD | HAIDI | Síndrome de robo | Desarrollo de un cuadro de isquemia en el territorio distal de la extremidad tras la realización de una fístula arteriovenosa |
| TÉRMINO | ACRÓNIMO | ANGLICISMO | SINÓNIMOS | DEFINICIÓN |
|---|---|---|---|---|
| Soplo de la fístula arteriovenosa | Bruit | Es un sonido detectable mediante la auscultación que constituye la manifestación auditiva del frémito | ||
| Stent | Stent | Stent | Dispositivo metálico endovascular colocado con el fin de mantener la permeabilidad de un vaso | |
| Tasa de filtración glomerular | TFG | GFR | Índice de medida de la función renal. Mide el volumen filtrado por el glomérulo renal por unidad de tiempo | |
| Test de Allen | Allen test | Maniobra encaminada a conocer la permeabilidad del arco palmar, con una primera fase de isquemia inducida y una segunda fase de reperfusión de la mano | ||
| Test de hiperemia reactiva | Estudio de los cambios producidos en la onda Doppler a nivel de una arteria tras provocar isquemia en el territorio distal a esta | |||
| Tratamiento sustitutivo renal | TSR | RRT | Terapia utilizada en la enfermedad renal crónica terminal que sustituye la función renal mediante las diversas modalidades de diálisis o el trasplante renal | |
| Trombectomía | Procedimiento terapéutico realizado con el fin de extraer material trombótico intravascular | |||
| Trombólisis | Procedimiento terapéutico realizado con el fin de conseguir la lisis de material trombótico intravascular | |||
| Trombosis completa de la fístula arteriovenosa | AVF thrombosis | Oclusión de la FAV | Ocupación de la totalidad de la luz de la fístula arteriovenosa por material trombótico que impide la circulación sanguínea en su interior e imposibilita su utilización para efectuar el tratamiento de hemodiálisis | |
| Urocinasa | UK | UK | Fármaco con actividad fibrinolítica que se utiliza para el tratamiento de la trombosis intraluminal de los catéteres venosos centrales |
PERFIL PROFESIONAL DE LOS AUTORES DE LA GUÍA
1. Perfil profesional de los coordinadores de la Guía
JOSÉ IBEAS LÓPEZ, MD, PhD
Licenciado en Medicina y Cirugía por la Facultad de Medicina de la Universidad de Alicante y Doctor en Medicina por la Universitat Autònoma de Barcelona. Especialista en nefrología tras su formación como médico interno residente por la Fundación Puigvert-Hospital de San Pablo, Barcelona. Máster Interuniversitario en Medicina Basada en la Evidecia, Universitat Autònoma de Barcelona-Universitat Rovira i Virgili-The Cochrane Collaboration, Barcelona. Actualmente adjunto del Servicio de Nefrología del Hospital Universitari Parc Taulí, Sabadell, Barcelona. Tiene una amplia experiencia en el área del acceso vascular en el terreno asistencial, docente y de investigación, con más de 400 comunicaciones y ponencias en congresos nacionales e internacionales y diversas publicaciones nacionales e internacionales, dirección de tesis doctorales y la concesión de 10 premios. Miembro del Comité Ético de Investigación Clínica del Hospital Universitari Parc Taulí. Ha dirigido numerosos cursos y simposios nacionales e internacionales, destacando la copresidencia del 9th Congress of the Vascular Access Society.
Secretario del Grupo de Trabajo de Acceso Vascular de la Sociedad Española de Nefrología, miembro del Grupo de Trabajo de Acceso Vascular de la Sociedad Catalana de Nefrología, miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV), miembro del Grupo de Trabajo de Nefrología Intervencionista de la Sociedad Española de Nefrología (grupo promotor), miembro de la Junta Directiva de la Vascular Access Society, miembro del Internacional Committee de la American Society of Diagnostic and Interventional Nephrology, miembro del European Vascular Access Guidelines Group de la ERA-EDTA y miembro del grupo elaborador de la Guía de Práctica Clínica sobre Enfermedad Renal Crónica (ERC) del Sistema Nacional de Salud-GuíaSalud.
RAMON ROCA-TEY, MD, PhD
Licenciado en Medicina y Cirugía por la Facultad de Medicina de la Universidad Central de Barcelona y Doctor en Medicina por la Universitat Autònoma de Barcelona (Premio Extraordinario de Doctorado). Especialista en nefrología por su formación como médico interno residente en el Hospital General Universitario de la Ciudad Sanitaria Vall d’Hebron de Barcelona. Actualmente, Adjunto del Servicio de Nefrología del Hospital de Mollet del Vallès, Barcelona. Actividad investigadora centrada en el campo del acceso vascular para hemodiálisis, que se ha traducido en una tesis doctoral, 6 premios, 200 ponencias y comunicaciones en congresos nacionales e internacionales y diversos artículos científicos y capítulos de libros publicados en revistas médicas editadas en nuestro país o en el extranjero.
Coordinador de los grupos de trabajo de acceso vascular para hemodiálisis de las sociedades catalana y española de nefrología, y Coordinador del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV), board member de la Vascular Access Society, miembro del Grupo de Trabajo en Nefrología Diagnóstica e Intervencionista de la Sociedad Española de Nefrología (grupo promotor) y miembro del European Vascular Access Guidelines Group de la ERA-EDTA. Ha participado como revisor externo en la “Vascular Access Clinical Practice Guidelines of the European Society of Surgery” (2016). Ha sido miembro de la Junta Directiva de la Sociedad Catalana de Nefrología (2010-2014). Es Presidente de la Comisión de Investigación e Innovación del Hospital de Mollet del Vallès, Barcelona. Ha participado en la organización de diversos cursos y congresos, entre los que destaca la “Jornada del Acceso Vascular para Hemodiálisis del Vallès Oriental” y el “9th Congress of Vascular Access Society” (Presidente).
2. Perfil profesional de los autores de la Guía
Joaquín Vallespín
Servicio de Angiología y Cirugía Vascular, Parc Taulí Hospital Universitari, Sabadell, Barcelona. Coordinador Quirúrgico del Programa de Acceso Vascular. Secretario de la Sección de Accesos Vasculares de la Sociedad Española de Angiología y Cirugía Vascular. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
Teresa Moreno
Unidad de Radiología Vascular Intervencionista, Servicio de Radiodiagnóstico, Hospital Juan Ramón Jiménez, Huelva. Coordinadora del Grupo de Trabajo Accesos Vasculares de la Sociedad Española de Radiología Vascular e Intervencionista (SERVEI). Miembro de la Junta Directiva –Presidente y Vicepresidente– (2011 a 2015) y de la Comisión Científica de SERVEI (2009 a 2015). Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV) y de la Vascular Access Society (VAS).
Guillermo Moñux
Servicio de Angiología y Cirugía Vascular, Hospital Clínico Universitario San Carlos, Madrid. Profesor Asociado de Cirugía, Universidad Complutense de Madrid. Profesor Asociado de la Universidad Europea de Madrid. Coordinador de la Sección de Accesos Vasculares de la Sociedad Española de Angiología y Cirugía Vascular (SEACV). Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
Anna Martí-Monrós
Enfermera Supervisora del Servicio de Nefrología del Consorcio Hospital General de Valencia. Presidenta de la EDTNA/ERCA (1994-1995), Editora Internacional Journal EDTNA/ERCA (1996-2006). Miembro del European Renal Best Practice Group. Co-chair Vascular Access Guidelines, Profesora del Máster de Nefrología de la Universidad Católica de Valencia. European Product Manager Estudio DOPPS. Miembro Fundador de la SEDEN. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
José Luis del Pozo
Director del Área de Enfermedades Infecciosas y Microbiología de la Clínica Universidad de Navarra. Profesor Titular de Medicina de la Universidad de Navarra. Secretario de la Junta Directiva de GEIRAS/GEIH-SEIMC (Grupo de Estudio de la Infección Nosocomial de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica). Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV)
Enrique Gruss
Unidad de Nefrología, Hospital Universitario Fundación Alcorcón, Alcorcón, Madrid. Profesor Honorífico de la Facultad de Medicina de la Universidad Rey Juan Carlos, Madrid. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV). Miembro del Grupo de Trabajo del Acceso Vascular de la Sociedad Española de Nefrología (S.E.N.)
Manel Ramírez de Arellano
Jefe del Servicio de Nefrología y Director del Ámbito de Atención Médica del Hospital de Terrassa, Consorci Sanitari de Terrassa, Barcelona. Máster en Dirección de Instituciones Sanitarias. Presidente del Comité Multidisciplinar del Acceso Vascular para Hemodiálisis. Miembro del Grupo de Trabajo de Accesos Vasculares de la Sociedad Catalana de Nefrología. Miembro de la Junta Directiva de la Sociedad Catalana de Nefrología. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV). Miembro del Grupo de Trabajo del Acceso Vascular de la Sociedad Española de Nefrología (S.E.N.)
Néstor Fontseré
Servicio de Nefrología y Trasplante Renal, Sección de Diálisis, Hospital Clínic, Barcelona. Coordinador Médico de la Unidad Funcional de Accesos Vasculares (UFAV). Consultor 1. Profesor Colaborador de la Universidad de Barcelona. Miembro Colaborador del Grupo de Investigación de Enfermedades Nefrourológicas y Trasplante Renal (Área 2), Institut d’Investigacions Biomèdiques August Pi i Sunyer (IDIBAPS). Miembro del Grupo de Trabajo de Accesos Vasculares de la Sociedad Catalana de Nefrología. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV). Miembro de la Vascular Access Society (VAS). Miembro del Grupo de Trabajo del Acceso Vascular de la Sociedad Española de Nefrología (S.E.N.)
Dolores Arenas
Jefe del Servicio de Nefrología-Hemodiálisis de Vithas Hospital Internacional Perpetuo, Alicante. Coordinadora del Grupo de Gestión de Calidad de la Sociedad Española de Nefrología. Miembro de la Comisión de Expertos del Manual de Acreditación de las Unidades de Hemodiálisis de la Conselleria de Sanitat de la Comunitat Valenciana. Miembro de la Comisión de Expertos de Estándares y Recomendaciones para la Unidad de Hemodiálisis de la Agencia de Calidad del Sistema Nacional de Salud, Ministerio de Sanidad y Política Social. Profesora Colaboradora en el Máster de Hemodiálisis de la Universidad Complutense de Madrid. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV). Miembro del Grupo de Trabajo del Acceso Vascular de la Sociedad Española de Nefrología (S.E.N.)
José Luis Merino
Sección de Nefrología, Hospital Universitario del Henares, Coslada, Madrid. Miembro del Grupo de Accesos Vasculares de la Sociedad Madrileña de Nefrología. Profesor Colaborador de la Facultad de Medicina de la Universidad Francisco de Vitoria. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV). Miembro del Grupo de Trabajo del Acceso Vascular de la Sociedad Española de Nefrología (S.E.N.)
José García-Revillo
Unidad de Radiología Vascular e Intervencionista, Servicio de Radiodignóstico, Hospital Universitario Reina Sofía de Córdoba. Profesor Asociado de Radiología en la Facultad de Medicina de Córdoba. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
Pilar Caro
Servicio de Nefrología, Unidad de Hemodiálisis, Hospital Ruber Juan Bravo, Madrid. Experto en hemodiálisis en nefrología. Coordinadora del Acceso Vascular. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV). Miembro del Grupo de Trabajo del Acceso Vascular de la Sociedad Española de Nefrología (S.E.N.)
Cristina López-Espada
Facultativo Especialista de Área de Angiología y Cirugía Vascular del Complejo Hospitalario Universitario de Granada. Coordinadora del Grupo de Calidad de la Sociedad Española de Angiología y Cirugía Vascular (SEACV). Miembro del Grupo de Accesos Vasculares de la SEACV. Miembro del Grupo VASCUNET de Registros Europeos de la European Society of Vascular Surgery (ESVS). Experta en Calidad Asistencial y Seguridad del Paciente. Máster en Gestión Clínica y Dirección Médica. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
Antonio Giménez
Director del Servicio de Angiología y Cirugía Vascular, Parc Taulí Hospital Universitari, Sabadell, Barcelona. Asociado Clínico de la Universidad Autónoma de Barcelona. Councillor de la European Society of Vascular Surgery. Expresidente de la Sociedad Catalana de Angiología, Cirugía Vascular y Endovascular, Exvicepresidente de la Sociedad Española de Angiología y Cirugía Vascular. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
Milagros Fernández-Lucas
Servicio de Nefrología, Sección de Hemodiálisis, Hospital Universitario Ramón y Cajal, Madrid. Coordinadora de la Unidad de Atención Integral del Acceso Vascular. Profesora Asociada de la Universidad de Alcalá. Secretaria de la Sociedad Madrileña de Nefrología (SOMANE). Coordinadora del Grupo de Accesos Vasculares de SOMANE. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV). Miembro del Grupo de Trabajo del Acceso Vascular de la Sociedad Española de Nefrología (S.E.N.).
Pablo Valdés
Director de Línea de Radiodiagnóstico, Agencia Sanitaria Costa del Sol. Vicepresidente de la Sociedad Española de Radiología Médica (SERAM).
Fidel Fernández-Quesada
Facultativo Especialista del Área de Angiología y Cirugía Vascular del Complejo Hospitalario Universitario de Granada. Presidente del Capítulo Español de Flebología y Linfología (CEFyL) de la Sociedad Española de Angiología y Cirugía Vascular (SEACV). Máster Universitario en Salud Pública y Gestión Sanitaria. Profesor de Cirugía de la Universidad de Granada. Representante por España en la Unión Internacional de Angiología (UIA). Presidente del Comité de Ética de la Investigación Bioética Provincial de Granada. Vicepresidente del Colegio Oficial de Médicos de Granada. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
Natalia de la Fuente
Servicio de Angiología y Cirugía Vascular, Hospital Galdakao-Usansolo, Bizkaia. Consultora de Accesos Vasculares para Hemodiálisis. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
David Hernán
Director de Enfermería de la Fundación Renal Íñigo Álvarez de Toledo. Profesor Colaborador del Curso Experto en Diálisis de la Universidad Europea de Madrid. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
Patricia Arribas
Hospital Universitario Infanta Leonor. Enfermera Supervisora de la Unidad de Diálisis. Docente de la Sociedad Española de Enfermería Nefrológica (SEDEN). Coordinadora del Grupo de Trabajo de Accesos Vasculares de la Unidad. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
María Dolores Sánchez de la Nieta
Servicio de Nefrología, Hospital General Universitario de Ciudad Real. Profesora Asociada de la Universidad de Medicina de Ciudad Real. Responsable de Formación y Docencia. Tutora de Residentes. Experta en Hemodiálisis en Nefrología por la Universidad Complutense de Madrid. Coordinadora del Acceso Vascular hasta 2009. Responsable del Protocolo de Bacteriemia por CVC. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV). Miembro del Grupo de Trabajo del Acceso Vascular de la Sociedad Española de Nefrología (S.E.N.).
María Teresa Martínez
Hospital General Universitario Gregorio Marañón. Enfermera Asistencial de Nefrología en las Áreas de Hemodiálisis, Trasplante Renal y Unidad de Aféresis Terapéutica. Coordinadora de Accesos Vasculares de la Unidad. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
Ángel Barba
Especialista en Angiología y Cirugía Vascular. Jefe del Servicio de Angiología y Cirugía Vascular del Hospital Galdakao-Usansolo, Bizkaia. Cirujano de referencia para Accesos Vasculares para Hemodiálisis del Igualatorio Médico Quirúrgico (IMQ) de Bizkaia. Medalla de la SEDyT. Director de los Cursos de Accesos Vasculares para Hemodiálisis de Bilbao. Miembro del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV).
SÍNTESIS DE CONFLICTO DE INTERESES POR AUTORES
Ángel Barba
Ninguno.
Anna Martí-Monrós
- •
Honorarios recibidos por participación en conferencias:
- -
NIPRO: Curso buttonhole Congreso SEDEN Valencia 2015.
- -
OTSUKA: Nursing Advisory Board London 2015.
- -
- •
Honorarios por participación como como ponente:
- -
NIPRO: MADIALISIS 2014.
- -
- •
Financiación de programas educativos:
- -
Laboratorio RUIBO 2013, 2014, 2015.
- -
- •
Asesoramiento empresa farmacéutica:
- -
OTSUKA.
- -
RUIBO.
- -
Antonio Giménez
- •
Financiación de programas educativos:
- -
11/2012-11/2013: Covidien Proctor de Dispositivos.
- -
12/2013-(actual): Medtronic Proctor de Dispositivos y responsable del Board de Estudios de Enfermedad Arterial Periférica.
- -
04/2014-(actual): Abbot Supera Stent Proctor.
- -
4 09/2014-(actual): Cardiva Proctor de la Endoprótesis Fenestrada Aórtica de Vascutek.
- -
09/2015-(actual): Jotec Proctor de la Endoprótesis Fenestrada Aórtica de Jotec.
- -
- •
Apoyo financiero para trabajos de investigación.
- -
03/2011-05/2014: Instituto Grifols, S.A. Human plasmaderived fibrin sealant Grifols Haemostasia. Fibrinogen sealant.
- -
10/2012-(actual): Astra Zeneca Ticagrelor Peripheral Arterial Disease (EUCLID).
- -
06/2014-09/2014: BARD Drug eluting balloon Revascularization of limb ischemia.
- -
03/2014-01/2015: SERVIER Daflon 500 Chronic venous insuficiency.
- -
11/2014-(actual): Ivascular Luminor Angioplasty Ballon. Revascularization of limb ischaemia.
- -
11/2015-(actual): BAYER Rivaroxaban in symptomatic peripheral artery disease undergoing lower extremity revascularization procedures.
- -
05/2016-(actual): BARD Drug eluting Ballon Revascularization of limb ischaemia Below the knee arteries.
- -
Cristina López Espada
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
Congreso Nacional de la SEACV durante 3 años seguidos en diferentes localizaciones, las inscripciones y el alojamiento financiados por la empresa Rovi, S.A. (HiborR).
- -
Congreso Nacional de Calidad en Gijón (octubre de 2015), la inscripción financiada por Bama-Geve y el alojamiento por la empresa Medtronic, S.A.
- -
VEITH symposium 2014 en New York, la inscripción y el alojamiento financiados por la empresa GORE, S.A.
- -
- •
Honorarios por participación como ponente:
- -
Curso de Preparación al “European Board de Cirugía Vascular”, junio 2014, durante el Congreso Nacional de la SEACV por la empresa Jotec. GMbH.
- -
David Hernán
Ninguno.
Dolores Arenas
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
2013: Congreso nacional S.E.N.-Amgen.
- -
2014: Congreso nacional S.E.N.-Fresenius.
- -
2015: Congreso Nacional S.E.N.-Shire.
- -
- •
Honorarios por escritura de artículos:
- -
2014: Experiencias Abbot Nutricion-Abbot.
- -
2015: Libro Clinical Findings-Experiencias en Nutrición. Shire Pharma.
- -
- •
Honorarios por participación como ponente:
- -
2014: Charla científica. Amgen.
- -
2014/2015: Charla científica. Magister en Hemodiálisis para Especialistas en Nefrología. Universidad Complutense.
- -
2015: Charla científica sobre gestión de calidad en hemodiálisis. Palex.
- -
- •
Asesoramiento empresa farmacéutica:
- -
2015: Advisory Board Velphoro®. Fresenius.
- -
Enrique Gruss
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
Octubre 2015: Congreso S.E.N. Gambro (viaje, hotel e inscripción).
- -
Mayo 2015: Congreso EDTA. Fresenius (viaje, hotel e inscripción).
- -
Octubre 2014: Congreso S.E.N. Genzyme (hotel e inscripción). Gambro (Viaje).
- -
Septiembre 2013: Congreso Argentina. Abbvie (inscripción). Gambro (hotel).
- -
- •
Honorarios por participación como ponente:
- -
Febrero 2014: Hospital Coslada. Fresenius.
- -
Febrero 2015: Hospital Coslada. Fresenius.
- -
Fidel Fernández
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
En los últimos 5 años soporte de FAES Farma, como Presidente del CEFyL de la SEAC para la asistencia al Congreso Nacional de la Sociedad y de la SEACV (dicha empresa financia los gastos de la junta directiva del CEFyL).
- -
- •
Honorarios por participación como ponente:
- -
Ponente en varios congresos. Servier.
- -
Artículos en una revista editada por Tedec-Meiji y por Servier.
- -
Ponente en un congreso internacional sobre accesos vasculares hablando sobre CVC patrocinado por Bard.
- -
Cursos como profesor y codirector para la SEACV. Estos cursos están patrocinados por Servier, Leo Pharma y Andaru Pharma.
- -
- •
Financiación de programas educativos:
- -
Hace 6 años, participación en el curso de Cáceres sobre Endovascular con modelos porcinos, patrocinado por Gore.
- -
- •
Soporte financiero para trabajos de investigación:
- -
Participación en un ensayo clínico multicéntrico como investigador, patrocinado por Servier.
- -
- •
Asesoramiento empresa farmacéutica:
- -
Consultor para Tedec Meiji, Servier y Cinfa.
- -
Consultor en temas de investigación para una empresa de material textil biocerámico.
- -
Guillermo Moñux
Ninguno.
Joaquín Vallespín
Ninguno.
José García Revillo
Ninguno.
José Ibeas
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
Congreso de la Vascular Access Society of the Americas. 2013, Houston. Asistente. Sanofi.
- -
Honorarios por participación como ponente:
- -
Curso de formación continuada de la Sociedad Catalana de Nefrología en Acceso Vascular. Barcelona 2013. A cargo de la Sociedad.
- -
Reunión de Diálisis de la Sociedad Madrileña de Nefrología, 2013 y 2014. A cargo de la Sociedad.
- -
Simposium Acceso Vascular Hospital Universitario de Alcorcón, 2014, A cargo de la organización.
- -
Curso de Ecografía en Acceso Vascular. Hospital Universitario Río Ortega de Valladolid, 2014. Amgen.
- -
Curso de Acceso Vascular. Hospital Universitario Reina Sofía, Madrid 2014. A cargo de la organización.
- -
Curso de Ecografía para el Acceso Vascular. Hospital Son Espases, Mallorca 2014. Sanofi.
- -
I Jornada Multidisciplinar del Acceso Vascular Vithas, Alicante 2015. A cargo de la organización.
- -
Curso de Ecografía para Enfermería, Mallorca 2015.
- -
Hospital Son Espases. Rubio.
- -
Taller de Ecografía del Acceso Vascular para Hemodiálisis en Nefrología, Valladolid 2014. Amgen.
- -
Congreso Nacional del Grupo Italiano de Acceso Vascular, Sociedad Italiana de Nefrología, Trento 2014. A cargo de la Sociedad.
- -
Nefrología: Reunión de Expertos. Ecografía para el acceso vascular en hemodiálisis, Alicante 2015. Amgen.
- -
Curso de formación continuada de la Sociedad Catalana de Nefrología en Acceso Vascular, 2015. A cargo de la Sociedad.
- -
European Vascular Course, Maastricht 2015. A cargo de la Organización del Congreso.
- -
11th Annual Scientific Meeting of the American Society of Diangostic and Interventional Nephrology, Orlando 2015. A cargo de la la Sociedad.
- -
Cursos Ecografía Hospital del Mar. Ecosoluciones, Barcelona 2015-2016. Esteve.
- -
Congreso de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica, 2015. A cargo de la Sociedad.
- -
Congreso de la Sociedad Española de Radiología Intervencionista, 2015. A cargo de la Sociedad.
- -
Cursos Ecografía Parc Taulí Sabadell Hospital Universitari, Barcelona, 2013-2016. A cargo de la organización.
- -
- •
Asesoramiento empresa farmacéutica:
- -
2013: Vascular Access Advisory Board meeting, París, Covidien.
- -
2014: Vascular Access Advisory Board meeting, Milán, Covidien.
- -
2016: Vascular Access Advisory Board Meeting. Londres, Medtronic.
- -
- •
Acciones o interés commercial en empresas relacionadas con la salud:
- -
Creador del Software NephroCloud®. Copropietario junto con la Fundación Parc Taulí y la empresa Seys.
- -
- •
Financiación de programas educativos o cursos, soporte económico para realización en el Hospital Universitario Parc Taulí de Sabadell, Barcelona, de cursos y simposios:
- -
2013: BARD, Covidien, General Electric.
- -
2014: General Electric, BARD, Covidien, Gore, Mindray, Rubió, Sonosite.
- -
2015: BARD, Covidien, General Electric.
- -
2016: BARD, Covidien, General Electric, Medtronic, Cardiva-anigodynamics, Gore, Toshiba, Mindray.
- -
José Luis del Pozo
- •
Honorarios por participación como ponente:
- -
Sesiones científicas en hospitales organizadas por Pfizer, MSD, Novartis y Gilead.
- -
José Luis Merino
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
Reunión MaDiálisis 2013. Asistente a la reunión. Pfizer.
- -
Congreso VAS 2013. Asistente al congreso. Palex.
- -
Congreso Europeo ERA-EDTA, 2013, Asistencia al congreso. Comunicaciones. Gambro.
- -
Reunión SOMANE 2013. Asistencia al congreso. Comunicaciones. Shire.
- -
Congreso de la S.E.N. 2013. Asistencia al congreso. Gambro.
- -
Renal Week. 2013. Asistencia al congreso. Fresenius.
- -
Reunión MaDiálisis 2014. Asistente a la reunión. Gambro.
- -
Conferencia de HTA y Riñón. 2014. Asistente a la reunión. Menarini.
- -
Congreso Europeo ERA-EDTA, 2014. Asistencia al congreso. Comunicaciones. Gambro.
- -
Reunión SOMANE 2014. Asistencia al congreso. Comunicaciones. Sanofi.
- -
Congreso de la S.E.N. 2014. Asistencia al congreso. Comunicaciones. Palex.
- -
Reunión MaDiálisis 2015. Asistente a la reunión. Shire.
- -
Congreso VAS 2015. Conferencia. Vifor.
- -
Congreso Europeo ERA-EDTA 2015. Asistencia al congreso. Comunicaciones. Fresenius.
- -
Reunión SOMANE 2015. Asistencia al congreso. Comunicaciones. Shire.
- -
- •
Honorarios por participación como ponente:
- -
I Jornadas de Técnicas en Hemodiálisis. Febrero 2014. Ponencias. Nipro.
- -
II Jornadas de Técnicas en Hemodiálisis. Febrero 2015. Ponencias. Palex.
- -
Experiencia clínica con Ferinject. Conferencia. Febrero 2015. Fresenius.
- -
Dislipemia y enfermedad renal crónica. Conferencia. Diciembre 2015. Rovi.
- -
- •
Dotación de material a la unidad:
- -
II Jornadas de Técnicas de Hemodiálisis febrero 2015. Modelo anatómico tronco-cuello para canalizaciones de vías centrales. Nipro.
- -
María Teresa Martínez
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
2013. Bilbao. Congreso nacional SEDEN. Nipro Europe.
- •
Honorarios por participación como ponente:
- -
2015. Valencia. Congreso nacional SEDEN. 3M.
- -
Manel Ramírez de Arellano
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
Jornada HD Domiciliaria. Asistente. Madrid. Palex.
- -
Congreso Europeo EDTA. Asistente. Estambul, 2013. Amgen.
- -
Congreso S.E.N. Asistente. Bilbao, 2013. Fresenius.
- -
Congreso Internacional ISPD. Asistente. Madrid, 2014. Baxter.
- -
Congreso S.E.N. Asistente. Barcelona, 2014. Sanofi.
- -
Congreso Europeo EDTA. Asistente. Londres, 2015. Amgen.
- -
Congreso Nacional S.E.N. Asistente. Valencia, 2015. Otsuka.
- -
- •
Honorarios por participación como ponente:
- -
VIII Jornadas Mediterráneas del Acceso Vascular para HD. Murcia, 2013. A cargo de la organización.
- -
III Curso de Hemodiálisis Crónica. Barcelona, 2013. A cargo de la organización.
- -
I Jornada Multidisciplinar del Acceso Vascular Vithas. Alicante, 2015. A cargo de la organización.
- -
IV Curso de Hemodiálisis Crónica. Barcelona, 2015. A cargo de la organización.
- -
Jornada Científica HD y ERCA. Sitges, 2015 Palex.
- -
María Dolores Sanchez de la Nieta
Ninguno
Milagros Fernández-Lucas
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
XLV Congreso Nacional de Nefrologia, Valencia 2015. Fresenius.
- -
XLIV Congreso Nacional de Nefrologia, Barcelona 2014. Fresenius.
- -
Natalia de la Fuente
- •
Honorarios por participación como ponente:
- -
2014. Primer encuentro vascular-Nefrología. 60.° Congreso de la SEACV. Madrid
- -
Néstor Fontseré
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
Congresos nacionales (Sociedad Española de Nefrologia-S.E.N.), autonómicos (Sociedad Catalana de Nefrologia-SCN) e internacionales (ERA-EDTA, VAS). Fresenius Medical Care y Amgen.
- -
- •
Honorarios por participación como ponente:
- -
Segundo Congreso de la Sociedad Española de Acceso Vascular, Madrid 2015. Boston.
- -
Programa de formación continuada para médicos de Fressenius Medical Care (Nephrocare). Hospital Clínic. Barcelona 2015. Fresenius Medical Care.
- -
Taller Boston teórico-práctico de trombectomía en modelo animal mediante dispositivo Angiojet. Servei d¿Experimentació Animal Vall d¿Hebron-Institut de Recerca (VHIR). Barcelona 2015. Boston.
- -
Máster: Atenció al Malalt Crític i Emergències. “Accesos vasculares en las técnicas de sustitución renal”, 2014. Universidad de Barcelona y Universidad Autónoma de Barcelona. Hospital Clínic de Barcelona. Universidad de Barcelona.
- -
Pràctiques d’Aplicacions Clíniques de l¿Enginyeria-II. P10: “Aplicabilitat dels biosensors de control de sobrecàrrega de volum i seguiment de la disfunció de l¿accés vascular”. Universitat de Barcelona. Centre de Recerca Aplicada Manso. Barcelona 2013.
- -
Pablo Valdés
Ninguno.
Patricia Arribas
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
2013: Congreso nacional SEDEN. Fresenius Medical Care, Bilbao.
- -
- •
Honorarios por participación como ponente:
- -
2015: Congreso nacional SEDEN. 3M, Valencia.
- -
- •
Financiación de programas educativos:
- -
2015. Baxter.
- -
Pilar Caro
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
XLIII Congreso de Nefrología celebrado en Bilbao, 2013. ABBOTT.
- -
8.° Congreso Internacional del acceso vascular, Praga 2013. ABBOTT y Fresenius Medical Care.
- -
XLIV Congreso de Nefrología, Barcelona 2014.
- -
Fresenius Medical Care.
- -
XLV Congreso de la Sociedad Española de Nefrología, Valencia 2015. SANOFI.
- -
Ramon Roca-Tey
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
50 Congress of The European Renal Association-European Dialysis And Transplant Association. Istanbul, Turkey, 2013: Fresenius Medical Care.
- -
XXXI Reunió Anual de la Societat Catalana de Nefrologia. 2015. Hospital de Sant Joan Despí Moisès Broggi (Sant Joan Despí). AMGEN.
- -
XXXII Reunió Anual de la Societat Catalana de Nefrologia. Castelldefels 2016. AMGEN.
- -
- •
Honorarios por participación como ponente:
- -
VII Curso Teórico-Práctico de Ecografía para el Acceso Vascular en Nefrología. Corporació Sanitària Parc Taulí de Sabadell, 2013. A cargo de la organización.
- -
III Curso Teórico Práctico de Actualización en Ecografía y Manejo Muldidisciplinar del Acceso Vascular. Corporació Sanitària Fundació Parc Taulí, Sabadell 2013. A cargo de la organización.
- -
III Curso de Hemodiálisis Crónica. Fundació Puigvert, Barcelona 2013. A cargo de la organización.
- -
Jornada de Accesos Vasculares para Hemodiálisis: Actualización en la disfunción del Acceso Vascular. Hospital de Bellvitge, Barcelona 2013. Covidien.
- -
VIII Curso Teórico-Práctico de Ecografía para el Acceso Vascular en Nefrología. Corporació Sanitària Parc Taulí de Sabadell, 2014. A cargo de la organización.
- -
IV Edition of the Theoretical and Practical Workshop for Update in Ultrasound and Multidisciplinary Approach for Vascular Access. Corporació Sanitària Parc Taulí de Sabadell, 2014. A cargo de la organización.
- -
I Curso Teórico-Práctico de Ecografía para el Acceso Vascular para Enfermería Nefrológica. Corporació Sanitària Parc Taulí de Sabadell, 2014. A cargo de la organización.
- -
IX Curso Teórico-Práctico de Ecografía para el Acceso Vascular en Hemodiálisis. Corporació Sanitària Parc Taulí de Sabadell, 2015. A cargo de la organización.
- -
26 Curso de Formación Continuada (Acceso Vascular) de la Societat Catalana de Nefrologia (SCN). 2015. A cargo de la SCN.
- -
X Curso Teórico-Práctico de Ecografía para el Acceso Vascular en Hemodiálisis. Corporació Sanitària Parc Taulí de Sabadell, 2015. A cargo de la organización.
- -
52st European Renal Association-European Dialysis and Transplant Association Congress (London), Lecture. 2015. A cargo de la Sociedad.
- -
20è Cours Congrès de La Société Française de L’Abord Vasculaire. Montpellier, France, 2015. A cargo de la Sociedad.
- -
Curso “Aula d’Hemodiàlisi 2015” de la SCN, Facultat de Medicina (Campus Casanova) de la Universitat de Barcelona, 2015. A cargo de la Sociedad.
- -
II Curso Teórico-Práctico de Ecografía para el Acceso Vascular para Enfermería Nefrológica. Corporació Sanitària Parc Taulí de Sabadell, 2015. A cargo de la organización.
- -
XI Curso Teórico-Práctico de Ecografía para el Acceso Vascular en Hemodiálisis. Corporació Sanitària Parc Taulí de Sabadell, 2016. A cargo de la organización.
- -
20th European Vascular Access Course. 2016, MECC. Maastricht, The Netherlands. A cargo de la organización.
- -
III Curso Teórico-Práctico de Ecografía para el Acceso Vascular para Enfermería Nefrológica. Corporació Sanitària Parc Taulí de Sabadell, 2015. A cargo de la organización.
- -
V Edition of the Theoretical and Practical Workshop for Update in Ultrasound and Multidisciplinary Approach for Vascular Access. Corporació Sanitària Parc Taulí, 2016. A cargo de la organización.
- -
Proyecto Docente “Imagen en Nefrología”. Promovido por la S.E.N. I Curso de Experto Universitario en Nefrología Diagnóstica e Intervencionista (Modalidad online). Módulo 6: Ecografía del Acceso Vascular: Ecografía de la FAV disfuncionante. Universidad de Alcalá y Hospital Universitario Ramón y Cajal, Madrid 2012.
- -
Proyecto Docente “Imagen en Nefrología”. Promovido por la S.E.N. II Curso de Experto Universitario en Nefrología Diagnóstica e Intervencionista (Modalidad Online).
- -
Módulo 6: Ecografía del Acceso Vascular: Ecografía de la FAV disfuncionante. Universidad de Alcalá y Hospital Universitario Ramón y Cajal, Madrid 2013.
- -
I Máster Universitario en Nefrología Diagnóstica e Intervencionista. Ecografía del Acceso Vascular:
- -
Ecografía de la FAV disfuncionante. Universidad de Alcalá y Hospital Universitario Ramón y Cajal, Madrid 2014.
- -
Teresa Moreno
- •
Financiación de inscripciones a congresos, viajes o alojamiento:
- -
Congreso CIRSE 2016. Lisboa. Cook.
- -
Congreso SEDAV. Madrid 2015. BARD.
- -
I Reunión de mujeres radiólogas. Madrid 2016. Iberoinvesa, Pharma.
- -
Congreso de la SERVEI 2015. Córdoba. A cargo de la propia sociedad.
- -
Congreso SERAM. Madrid 2014. A cargo de la propia sociedad.
- -
Curso teórico-práctico de embolización. Madrid 2014. Covidien.
- -
XII Jornadas de actualización en materiales de embolización. 2014. Terumo.
- -
XIII Congreso de la SERVEI. Santander 2013. A cargo de la propia sociedad.
- -
- •
Honorarios por participación como ponente:
- -
VII Endoescuela vascular intervencionista. Madrid 2014. Hospital Puerta de Hierro. Biotronik.
- -
VIII Endoescuela vascular intervencionista. Madrid 2015. Hospital Puerta de Hierro. Biotronik.
- -
I Curso teórico-práctico de ecografía Doppler. Madrid 2013. Por la Sociedad Española de Ultrasonidos y la Sociedad Española de Radiología Médica (SEUS y SERAM).
- -
II Curso teórico-práctico de ecografía Doppler. Madrid 2015. Por la Sociedad Española de Ultrasonidos y la Sociedad Española de Radiología Médica (SEUS y SERAM).
- -
32 Congreso de la SERAM, Oviedo. Por la propia Sociedad.
- -
9.° Congreso de la Vascular Access Society, Barcelona 2015. Por la propia Sociedad.
- -
I Jornada Multidisciplinar de Acceso Vascular VITHAS. Alicante 2015. Por la propia organización.
- -
XVI Curso de Radiología Vascular e Intervencionista en Modelos Animales. León 2014. Por la SERVEI.
- -
I Curso de ecografía Doppler dúplex del acceso vascular para hemodiálisis. Madrid 2013. Por la SERVEI.
- -
XV Congreso de la Asociación de Radiólogos del Sur. Cádiz 2013. Por la SERAM.
- -
* Los protocolos firmados con los conflictos de interés de coordinadores y autores pueden consultarse en el siguiente enlace electrónico