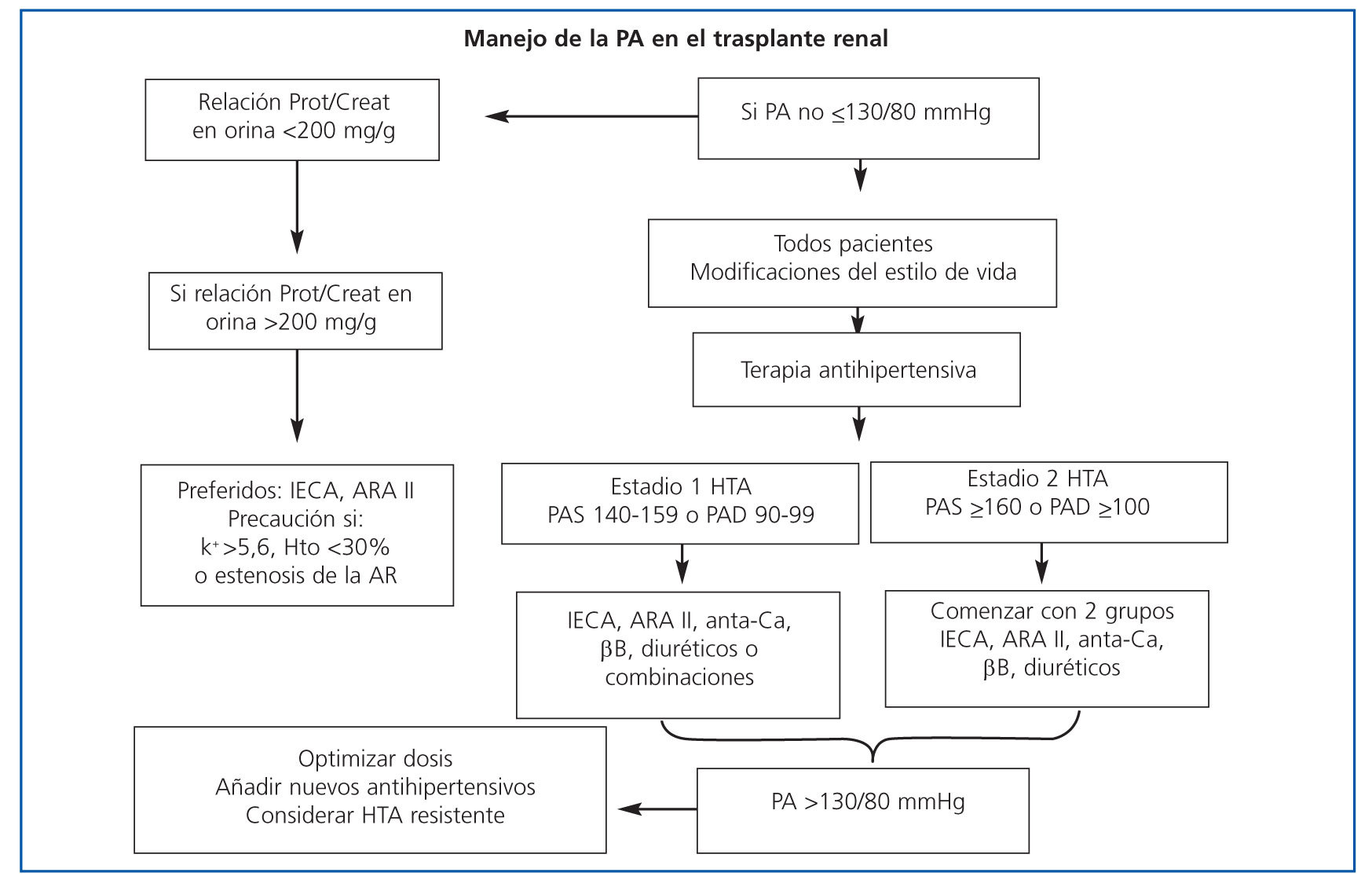
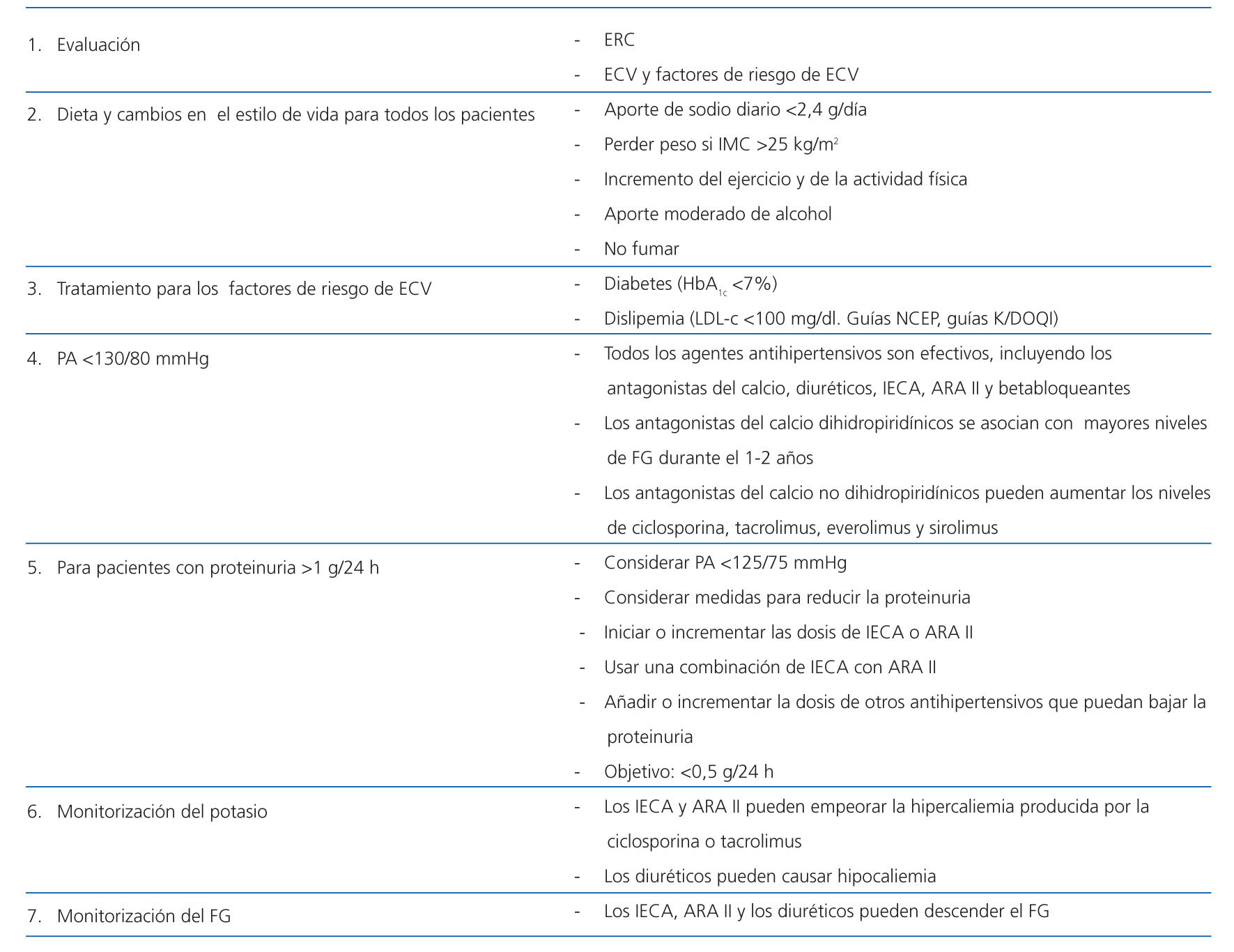
Los factores no inmunológicos que parecen contribuir a la progresión del daño renal y, por consiguiente, a la pérdida de función son, entre otros: la hipertensión arterial (HTA), la proteinuria, la dislipemia, etc. 1. Tratamiento de la HTA: la presión arterial (PA) debe medirse periódicamente en todos los pacientes trasplantados. Igual que se ha descrito en los riñones propios, en los pacientes con trasplante renal, la HTA se muestra como factor de riesgo de progresión del deterioro de la función del injerto. La HTA representa un marcador clínico de la nefropatía crónica del injerto y contribuye a la pérdida del injerto y a la morbimortalidad de estos pacientes (grado de evidencia C). En los pacientes trasplantados renales, las cifras de PA recomendadas son <130/80 mmHg, bajando a niveles de la PA <125/75 mmHg si existe proteinuria >1 g/d. Dado que la HTA y la proteinuria se asocian frecuentemente en el curso de la nefropatía crónica, un abordaje terapéutico conjunto parece más racional cuando ambas situaciones concurren simultáneamente (grado de recomendación C). Para el control de la PA en el receptor de un trasplante renal, es muy importante iniciar medidas higiénicodietéticas junto con el tratamiento médico. Todos los agentes antihipertensivos son efectivos y aún no existe una preferencia clara en ninguna guía, y la mayoría de los pacientes necesitará dos o más fármacos antihipertensivos. Los IECA o ARA II son de elección en los pacientes con proteinuria. Al iniciar tratamiento con IECA o ARA II, o al aumentar dosis, es preciso monitorizar función renal y caliemia a las 1-2 semanas. Además, en los pacientes trasplantados con ERC estadio 4-5 y en tratamiento con IECA o ARA II se debe monitorizar periódicamente la caliemia. 2. Tratamiento de la proteinuria: conocido marcador de daño renal que contribuye a la progresión de la insuficiencia renal. La reducción a cifras <0,5 g/24 horas es el objetivo terapéutico. Tanto los IECA como los ARA II son los fármacos de elección en este tipo de paciente, pero con monitorización cuidadosa de función renal y del potasio, especialmente en el paciente trasplantado con ERC estadio 4-5. 3. Tratamiento de la dislipemia: en todo paciente trasplantado debe realizarse una evaluación periódica del perfil lipídico (colesterol total, HDL-c, LDL-c y triglicéridos). Además del impacto negativo en la enfermedad cardiovascular, la hiperlipemia también se ha relacionado con la nefropatía crónica del injerto. Los pacientes trasplantados deben considerarse de alto riesgo cardiovascular, considerándose el objetivo terapéutico un LDL-c <100 mg/dl (grado de recomendación C). 4. Otras medidas: control de la diabetes mellitus, manteniendo niveles de hemoglobina glucosilada <7%, cese del hábito tabaquico, evitar el sobrepeso, antiagregación individualizada, medidas especialmente destinadas a la protección cardiovascular y, por tanto, también a la protección del injerto renal.
In kidney transplantation patient and graft survival are excellent in short-term and mid-term, although they remain stable in the long-term. The incidence of acute rejection has decreased to 8%-15%. Despite marked progress in understanding immunologic mechanisms involved in transplantation, new tools are required to detect early changes that could affect allograft function allowing us to anticipate histological lesions and providing a more accurate use of immunosuppressive drugs. From an immunologic point of view, efforts should be directed to avoid interstitial fibrosis and tubular atrophy (IF/TA) and to prevent antibody-mediated rejection. The most frequent cause of late graft loss is IF/TA. Improvement in kidney transplant results have been achieved with calcineurin inhibitors -CNI- (cyclosporin and tacrolimus), antiproliferative agents (mycophenolate mofetil and enteric-coated mycophenolic acid) and T-celldepleting antibodies. The combination of tacrolimus + mycophenolate mofetil + steroids has been the gold standard in kidney transplant immunosuppression. An adequate balance in order to maintain the appropiate immune response is essential to the patient to avoid infections or neoplasias as well to prevent rejection. In renal transplant recipients with chronic kidney disease stage 4T in which renal function remains stable, immuno-suppressive drugs can be continued at the usual maintenance doses. As GFR declines, CNI and antiproliferative drugs should be reduced.
INTRODUCCIÓN
Los resultados globales del trasplante renal han dado un giro positivo espectacular en el seguimiento a corto y medio plazo, pero para mejorar los resultados a largo plazo quedan por conocer mecanismos de la respuesta inmune, disponer de una monitorización inmunológica precisa y a tiempo real con unos biomarcadores adecuados, así como poder identificar los perfiles proteómicos y genómicos de la activación inmunológica. Todo ello permitirá definir mejor el tipo, la combinación y la secuencia de los IS más idóneos en el momento adecuado.
¿Cuáles han sido los cambios en los resultados a corto y medio plazo? ¿A qué pueden atribuirse?
En referencia a la primera pregunta, son evidentes los elevados porcentajes de supervivencia al año, tanto del paciente –cercanos al 100%– como del injerto –del orden del 90%– y con elevados porcentajes mantenidos en el tercer y el quinto año1,2.
En un estudio realizado en España3 en el que se incluyeron 3.165 trasplantados renales, con injertos funcionantes a partir del primer año postrasplante, la supervivencia a los diez años del paciente y del injerto fueron del 82 y 70%, respectivamente.
En relación con la segunda cuestión, el impacto favorable en los resultados es atribuible a la introducción de los inmunosupresores inhibidores de la calcineurina (ciclosporina y tacrolimus) y, posteriormente, a su asociación con los inmunosupresores antiproliferativos (micofenolato mofetil y micofenolato sódico) o con los inhibidores de la señal de proliferación (sirolimus y everolimus), anticuerpos policlonales (globulina antitimocítica: rATG) y anticuerpos monoclonales anti-CD25.
Los resultados a más largo plazo se evalúan por la vida media del aloinjerto. La vida media de un injerto es el tiempo transcurrido hasta que un 50% de pacientes que sobreviven al primer año postrasplante siguen vivos con injerto funcionante. La vida media la determinan la tasa de fallecimientos y la pérdida de función del injerto4.
En un análisis entre los años 1995 y 2000 de la base de datos norteamericana SRTR (Scientific Registry of Renal Transplant Recipients)5,6 para determinar la supervivencia real del injerto a largo plazo –en lugar de la proyectada– y tomando como punto de partida el momento del trasplante –en vez de realizar el análisis a partir del primer año postrasplante–, se observó una menor supervivencia del injerto a pesar de existir un menor porcentaje de rechazo agudo y de emplear las pautas inmunosupresoras actuales (ciclosporina, tacrolimus, micofenolato mofetil, inducción con anticuerpos anti-IL-2R, globulina antitimocitíca: rATG).
Un amplio análisis7 pone de relieve que en el estudio de las pendientes del eGFR (filtrado glomerular estimado) a lo largo del seguimiento de los trasplantados renales se mostraban más estables (mejoraban) en los trasplantes realizados en épocas más recientes (durante 1999-2002 en comparación a 1984-1989).
En las últimas dos décadas ha habido una reducción importante en la incidencia de episodios de rechazo agudo en los primeros 3-6 meses postrasplante7, pero los pacientes que lo presentan responden menos al tratamiento y recuperan la normalidad de la función renal en un porcentaje inferior.
Además, es evidente que en la supervivencia a largo plazo influyen: mayor edad de los donantes, los donantes marginales o con criterios expandidos, aumento de edad de los receptores con riesgo cardiovascular asociado y la muerte del paciente con injerto funcionante.
MONITORIZACIÓN DE LA RESPUESTA INMUNOLÓGICA
La respuesta inmune al aloinjerto tiene un carácter sistémico: timo, bazo, ganglios linfáticos, diferentes estirpes celulares, mediadores inflamatorios, citocinas, quimiocinas y otros factores solubles. Esto explica el interés en el desarrollo de marcadores que a través de análisis de sangre –es decir, un procedimiento poco invasivo y susceptible de repetir sin riesgo– permitan reflejar la respuesta inmune, relacionarla con la histopatología, con el grado de función renal y con el tratamiento inmunosupresor4,8-12.
El objetivo ideal en el trasplante consistiría en la detección precoz de los cambios inmunológicos que pueden preceder o indicar la aparición de rechazo y que nos indicarán la pauta inmunosupresora más idónea. En realidad, actualmente la secuencia de acontecimientos es la siguiente: alteración de la función renal, práctica de biopsia renal, actuación terapéutica. La práctica de biopsias iterativas permite anticipar la presencia de lesiones antes de que aparezca la modificación de la función renal13.
En la práctica clínica del trasplante renal, la respuesta inmunitaria mediada por anticuerpos se monitoriza mediante determinación de anticuerpos circulantes y la prueba cruzada frente a los antígenos del donante antes del trasplante.
Apesar de la ausencia de anticuerpos circulantes detectables, un porcentaje relativamente reducido de pacientes presenta episodios de rechazo agudo que se han relacionado con la respuesta inmunitaria mediada por células T, en especial por células T de memoria alorreactivas efectoras antidonante. De manera análoga a la detección pretrasplante de anticuerpos reactivos, la determinación de la frecuencia de células T reactivas frente al donante, medida por la secreción de IFN gamma mediante técnica de ELISPOT (Enzyme-Linked Immunosorbent Spot) realizada inmediatamente antes del trasplante, se puede correlacionar con el riesgo de aparición de rechazo agudo10,12. Constituye una manera de monitorizar la respuesta inmunitaria por células T.
Los hallazgos obtenidos por microchips de ADN han mostrado que los cambios moleculares en el epitelio tubular se presentan antes de que la tubulitis se detecte en las biopsias. En las biopsias con rechazo mediado por anticuerpos se ha encontrado un incremento en la expresión de genes relacionados con la activación de las células endoteliales14.
Por otra parte, se plantea la necesidad de disponer de biomarcadores que permitan distinguir el daño inmunológico del no inmunológico en los sucesivos estadios tras el trasplante renal15,16.
El objetivo de estas técnicas de monitorización es la detección precoz de los cambios inmunológicos antes de que se produzcan lesiones de rechazo. En la figura 1 se indica la secuencia de marcadores potencialmente útiles en el seguimiento del trasplante renal15.
CONSECUENCIAS DE LA RESPUESTA INMUNE SOBRE LA FUNCIÓN DEL INJERTO
Cuando en el postrasplante objetivamos una disfunción del injerto que se traduce en un incremento de la creatinina plasmática o proteinuria, y tras descartar otras posibles causas de alteración de la función renal, pensamos en los factores inmunológicos y, concretamente, en la posibilidad del rechazo, cuyo diagnóstico de confirmación se realiza mediante biopsia renal.
En el diagnóstico diferencial de la disfunción aguda o crónica del injerto, la biopsia renal puede orientar a agentes etiológicos específicos: hipertensión arterial, toxicidad por inhibidores de la calcineurina, infección por poliomavirus, recurrencia de la enfermedad, lesiones de rechazo.
Los dos mecanismos de rechazo reconocidos histológicamente en la clasificación de Banff17 son: rechazo mediado por células T, diagnosticado por el índice de inflamación del intersticio, tubulitis y vasculitis, y el rechazo mediado por anticuerpos, cuyo hallazgo principal es la presencia de C4d en los capilares peritubulares.
La clasificación del rechazo mediado por células T puede resultar difícil cuando se detectan cambios límite con la normalidad. Además, la inflamación intersticial y la tubulitis no son específicas y se encuentran en trasplantes con función renal estable.
La novena Conferencia de Banff, celebrada en La Coruña el año 200717,18 en base a las categorías de Banff 1997 y 2005, actualizó la clasificación y estableció las categorías diagnósticas para biopsias de los injertos renales.
Desde el punto de vista clínico, según la forma y la cronología de presentación, podemos considerar los siguientes tipos de rechazo:
1) Rechazo hiperagudo
Se produce en pacientes hipersensibilizados por anticuerpos citotóxicos preformados HLA, ABO u otros aloanticuerpos frente a los antígenos de la superficie endotelial del donante. Es una situación infrecuente si la prueba cruzada pretrasplante donante/receptor ha resultado negativa. Aparece tras la anastomosis vascular o a las pocas horas, y comporta una afectación vascular con trombosis diseminadas irreversible del injerto. Tiene las características histopatológicas del rechazo mediado por anticuerpos.
2) Rechazo agudo de aparición precoz
Se presenta dentro de los tres primeros meses del trasplante. El rechazo agudo representa uno de los factores negativos más importantes en cuanto al pronóstico para la supervivencia del injerto a largo plazo19-21. Produce lesiones en el injerto en función del tipo, la gravedad y la persistencia.
Según la clasificación actual de Banff, distinguiremos el rechazo agudo mediado por linfocitos T y el rechazo agudo mediado por anticuerpos.
Las lesiones de rechazo agudo mediado por linfocitos T se describen en la categoría 4 de Banff17,18.
El rechazo agudo mediado por anticuerpos aparece en las primeras semanas del trasplante. Desde el punto de vista clínico, no se puede distinguir del rechazo agudo mediado por linfocitos T. Se traduce en un importante y brusco deterioro de la función renal. Los criterios diagnósticos son: 1) C4d + en los capilares peritubulares; 2) presencia de anticuerpos circulantes antidonante; 3) evidencia morfológica de lesiones histológicas agudas: I) similar a necrosis tubular aguda, inflamación mínima; II) inflamación capilar o glomerular o trombosis; III) arterial: arteritis intimal, inflamación transmural17,18.
La presencia de anticuerpos antidonante se ha asociado con rechazo agudo y con un peor pronóstico. La detección en los seis primeros meses postrasplante de C4d en las biopsias del injerto se ha relacionado con una reducción del 50% de la supervivencia del injerto a largo plazo.
En un estudio realizado en España19 con 3.365 trasplantados renales, se constata una reducción en la tasa de rechazo agudo y se analiza la influencia de los inmunosupresores, así como el impacto negativo que el rechazo agudo tiene en la supervivencia del injerto a largo plazo.
3) Rechazo agudo tardío
Es el que se presentaría a partir del tercer mes del trasplante y cuyas características histológicas pueden superponerse a lasantes descritas.
4) Rechazo agudo subclínico
Es el hallazgo de lesiones histológicas de rechazo en ausencia de disfunción renal. Sin tratamiento evoluciona a fibrosis y daño tubulointersticial permanentes. Los pacientes con rechazo subclínico asociado a FI/AT presentan una menor supervivencia del injerto11,22,23.
5) La lesión crónica del injerto
Es la primera causa de la pérdida de injertos a medio y largo plazo. Se produce por causas inmunológicas (antígeno dependientes) y por causas no inmunológicas (antígeno independientes). Se caracteriza por AT progresiva y FI24. Clínicamente, se traduce por pérdida progresiva de función del injerto renal, proteinuria e hipertensión arterial. Su incidencia varía desde un 23% a los cinco años hasta un 60% a los diez años postrasplante25.
Las diferencias alogénicas entre donante y receptor producen una persistencia de infiltrados celulares en el injerto constituidos por células T, células B y macrófagos, acompañados de una respuesta celular proliferativa mediada por quimiocinas, citocinas y factores de crecimiento con inducción de fibrogénesis, aparición de fibrosis y pérdida progresiva e irreversible de la función renal del injerto renal.
Las células epiteliales tubulares representan más del 75% de las células del parénquima renal y su susceptibilidad a la lesión inflamatoria condiciona la función del injerto a largo plazo, debido a que la lesión tubular grave puede ser una importante causa de pérdida de nefronas. Cuando la muerte celular excede la capacidad regenerativa del riñón, el resultado es la pérdida de función y el fallo precoz del injerto25. La lesión de las células epiteliales tubulares se asocia con el desarrollo de fibroblastos y miofibroblastos en el intersticio renal. Debido a la lesión o a la inflamación, las células del epitelio tubular pueden sufrir un cambio de fenotipo a través del proceso de transición de epitelio a mesenquima (EMT). En las biopsias de protocolo a los tres meses se ha encontrado que un 40% expresa marcadores de EMT. Estos injertos habían tenido rechazo y tiempos de isquemia largos26-28.
Otro mecanismo propuesto en la FI/AT27-29 es la aparición de neogénesis linfoide (acúmulos ectópicos de tejido linfoide), que sería una fuente productora de anticuerpos y de lesión renal.
La fibrosis intersticial es consecuencia de un desequilibrio entre la síntesis y la degradación de la matriz extracelular, predominando el incremento de la síntesis en relación con una disminución de la degradación o a la combinación de ambas. La matriz mesangial es una red dinámica de proteínas y proteoglicanos. En el tejido renal se encuentra una mayor expresión de factores profibróticos, como el TGF-beta y el inhibidor tisular de metaloproteinasas26.
Especial importancia tiene el rechazo crónico activo mediado por anticuerpos, que se caracteriza por C4d+, presencia de anticuerpos circulantes antidonante y cambios morfológicos de lesión histológica crónica, tales como: doble contorno glomerular o multilaminación de la membrana basal de los capilares peritubulares, o fibrosis intersticial/atrofia tubular o engrosamiento fibroso de la íntima en las arterias. Se le ha denominado tétrada ABCD (A: alloantibody, B: basement membrane, C: C4d, D: duplication de la membrana basal glomerular)17.
En el rechazo crónico mediado por anticuerpos tendría lugar la siguiente secuencia: 1) producción de anticuerpos antidonante específicos; 2) interacción de los anticuerpos con los aloantígenos, resultando en el depósito de C4d+ en los capilares peritubulares; 3) alteraciones histológicas (glomerulopatía del trasplante, fibrosis); y 4) alteración de la función renal30.
Si consideramos el rechazo como un proceso lineal, la elevación de la creatinina plasmática constituye el último evento30-32.
INMUNOSUPRESIÓN
El objetivo de la inmunosupresión, además de prevenir y tratar el rechazo agudo, es evitar la lesión crónica del injerto, a la vez que minimizar los efectos secundarios de los inmunosupresores.
Las pautas de inmunosupresión actuales se dirigen al bloqueo de la activación, la proliferación y la función de los linfocitos T.
La mayoría de inmunosupresores actuales utilizados en trasplante de mantenimiento no cubre la acción de los linfocitos B8,33.
Los inmunosupresores utilizados actualmente se muestran en la tabla 1.
En los pacientes con riesgo inmunológico (presencia de anticuerpos circulantes, retrasplantes, baja compatibilidad HLA), la inmunosupresión de inducción con globulina antitimocítica (rATG) adquieren especial relevancia.
Con la aprobación de la ciclosporina para su uso en trasplante renal en 1984, se consiguió una disminución significativa del rechazo agudo, con un aumento de la supervivencia del injerto. En la década de 1990 se introducen el tacrolimus y el micofenolato mofetil, resultando en una disminución de las tasas de rechazo agudo y un aumento de la supervivencia a corto y medio plazo del injerto6. En pacientes diagnosticados de nefropatía crónica del trasplante, la asociación de micofenolato mofetil al tratamiento con ciclosporina disminuyó el ritmo de deterioro de la función renal34.
Hay que tener presente que los mejores resultados a cortomedio plazo en trasplante renal se han conseguido en la época de los inhibidores de la calcineurina.
Entre las causas que contribuyen a la patología de causa inmune, sobresale la inmunosupresión subóptima y el incumplimiento terapéutico por parte del paciente.
Las pautas de inmunosupresión referidas al año 2006, recogidas en el registro norteamericano OPTN/SRTR 2007 Annual Report (http://www.ustransplant.org), se muestran en la tabla 2.
Resultados con diferentes pautas de inmunosupresión
En los ensayos clínicos, en general, se consideran como objetivos principales la tasa de rechazo agudo y la supervivencia del injerto y del paciente a corto plazo (6 o 12 meses), mientras que estos mismos objetivos a largo plazo no suelen evaluarse. No obstante, hay que reconocer que estos ensayos han permitido llegar a conocer unas combinaciones de inmunosupresores que permiten alcanzar resultados muy buenos, a la vez que han puesto de relieve sus efectos secundarios, a los cuales conviene prestar atención, en especial infecciones y neoplasias.
La pérdida del injerto está asociada a FI/AT y constituye uno de los retos a evitar. Es evidente que la detección y el tratamiento previo de las lesiones agudas pueden contribuir a limitar la aparición de atrofia tubular y fibrosis intersticial, pero uno de los aspectos futuros a considerar será considerar la actuación terapéutica sobre la fibrogénesis35.
En un estudio prospectivo, multicéntrico, realizado en España con 1.558 trasplantados renales36, los pacientes que recibieron tacrolimus en combinación con micofenolato mofetil y prednisona mostraron a los dos años mejor función renal que los tratados con ciclosporina.
En un análisis a tres años37 de tres combinaciones de inmunosupresores: tacrolimus/sirolimus (grupo A) vs. tacrolimus/micofenolato (grupo B) vs. ciclosporina/sirolimus (grupo C), se observó una menor incidencia de rechazo agudo demostrado por biopsia y una mejor función renal en el grupo B.
Se realizó el interesante estudio ELITE-Symphony38, con seguimiento a un año, constituido por cuatro grupos de pacientes:
A) Ciclosporina, a dosis estándar/micofenolato mofetil/esteroides.
B) Daclizumab/ciclosporina a dosis bajas/micofenolat mofetil/esteroides.
C) Daclizumab/tacrolimus a dosis bajas/micofenolato mofetil/esteroides.
D) Daclizumab/sirolimus a dosis bajas/micofenolato mofetil/esteroides.
Los pacientes del grupo C tenían el mejor aclaramiento de creatinina, la supervivencia más elevada y la menor incidencia de rechazo agudo demostrado por biopsia. Con referencia a la mortalidad, no hubo diferencias significativas entre los grupos.
En un estudio39 realizado analizando los datos del registro norteamericano entre el año 2000 y el 2005, que incluye a 58.131 pacientes y en el que se analiza el régimen inmunosupresor de cinco asociaciones (TAC/MMF, CsA/MMF, TAC/SRL, CsA/SRL y SRL/MMF), se concluye que la tasa de rechazo agudo a los 6 y 12 meses era más elevada con SRL/MMF, y la menor, la registrada con TAC/MMF. La supervivencia a los cinco años era del 73,8% para TAC/MMF, el 71,8% para CsA/MMF, el 68,9% para CsA/SRL, el 67,8% para TAC/SRL y el 57,7% para SRL/MMF (TAC: tacrolimus; MMF: micofenolato mofetil; SRL: sirolimus; CsA: ciclosporina en microemulsión).
El debate entre pautas con esteroides o libres de corticoides desde el inicio del trasplante y el planteamiento en quienes los reciben, entre retirada precoz o tardía, sigue abierto. En algunos ensayos se ha constatado un significativo incremento del rechazo agudo al retirar los corticoides, mientras que en otros ensayos la incidencia de rechazo agudo era similar en el grupo con esteroides comparado con el grupo que no los recibía40,41. En este sentido, los diferentes ensayos sobre retirada de esteroides son poco comparables, debido a que se emplean pautas de inmunosupresión diferentes tanto en inducción como en mantenimiento, así como diferente período de seguimiento postrasplante.
Según datos de OPTN/SRTR 2007, es más prevalente la pauta sin esteroides al alta del paciente, un 23%, que su retirada posterior.
En un estudio de biopsias de protocolo que relaciona los hallazgos histológicos y el tratamiento inmunosupresor utilizado23, se constató que la menor incidencia de rechazo subclínico (16%) la presentaban los tratados con tacrolimus, mientras que en los tratamientos que no recibían inhibidores de la calcineurina se observaba la tasa más elevada (56%). En cambio, la tasa de FI/AT no presentaba diferencias significativas entre los tratados con ciclosporina, tacrolimus o con una pauta sin inhibidores de la calcineurina.
A medida que se incorporaron nuevos y potentes inmunosupresores en diferentes combinaciones, y una vez conseguidos porcentajes muy reducidos de rechazo agudo, diversos grupos de trasplante se plantearon minimizar o suspender los inhibidores de la calcineurina para evitar su nefrotoxicidad y, de esta manera, mejorar la función renal y, en consecuencia, aumentar la supervivencia del injerto40.
En las valoraciones histológicas, no todas las lesiones observadas en la biopsia del injerto pueden atribuirse a nefrotoxicidad. Es muy probable que cambios en el compartimento vascular o tubulointersticial puedan ser atribuidos a la respuesta aloinmune y a un inadecuado control de la misma por inmunosupresión insuficiente.
La disminución o la supresión de los inhibidores de la calcineurina supuso observar un descenso de la creatinina plasmática, traducción de un efecto hemodinámico intrarrenal por eliminación de la vasoconstricción inducida por los inhibidores de la calcineurina, pero en el seguimiento a más largo plazo no queda suficientemente cuantificada la aparición de rechazos subclínicos o de rechazo agudo que incrementaría el daño tisular del injerto, con el consiguiente deterioro funcional26,42.
En pacientes con factores de riesgo para la aparición de fallo renal agudo postrasplante, se han conseguido buenos resultados con la administración pretrasplante de daclizumab y la introducción tardía de tacrolimus41,38.
En una interesante revisión43 que analiza diferentes estudios que incorporan como objetivo la minimización o retirada de los inhibidores de la calcineurina, y en la que se incluyen sólo los estudios que emplean dos o más inmunosupresores en combinación, se analiza su impacto sobre las variables más utilizadas como criterios de valoración: rechazo agudo, función renal, supervivencia del injerto, supervivencia del paciente. Aunque el objetivo de los tratamientos inmunosupresores sin inhibidores de la calcineurina es mejorar la función y la supervivencia del injerto a largo plazo, están limitados por el número reducido de pacientes y el seguimiento a corto plazo.
Para demostrar la hipótesis que la función renal, la histología y la supervivencia son superiores en un régimen inmunosupresor sin inhibidores de la calcineurina, sería preciso un amplio estudio prospectivo, controlado y comparativo. Estudios con un amplio número de pacientes (SRTR y Symphony) evidencian claramente la superioridad de los resultados en los tratamientos inmunosupresores que incorporan inhibidores de la calcineurina.
En la actualidad, podemos decir que en receptores de trasplantes renales de novo los resultados son inferiores cuando no se utilizan inhibidores de la calcineurina. Los efectos de la retirada de ciclosporina en pacientes con disfunción renal tendrían un pronóstico más favorable en un seguimiento a dos años43,44. Sin embargo, en los estudios con función renal estable en los que se retira la ciclosporina, tienen un riesgo elevado de rechazo agudo.
Cuando se consideran las estrategias de minimización o retirada de inhibidores de la calcineurina, es importante valorar los riesgos y beneficios en cada paciente.
Hay que señalar que la inmunosupresión más intensa y acumulada ha generado un mayor número de infecciones oportunistas, aparición de nefropatía por poliomavirus e incremento de neoplasias.
En los pacientes con disfunción crónica avanzada del injerto, la repercusión de la disminución o retirada de inhibidores de la calcineurina probablemente sea significativamente menor que en los pacientes con función renal normal y estable. En un paciente con función normal del injerto, el riesgo de rechazo agudo debe contraponerse al de los posibles beneficios de la supresión o reducción de estos fármacos.
En la actualidad, queda por responder la pregunta: ¿Aquién puede beneficiar o a quién podría suponer un detrimento para el injerto la utilización de un régimen inmunosupresor sin inhibidores de la calcineurina? El desafío actual aún es poder objetivar el mejor tratamiento inmunosupresor para cada paciente.
El objetivo ideal desde el punto de vista inmunológico, conseguidas las reducidas tasas actuales de rechazo agudo, consistiría en poder disponer de marcadores poco invasivos de actividad inmunológica para medir las respuestas celular y por anticuerpos que permitieran anticiparse a las lesiones de rechazo y a la alteración de la función renal, poder validar estos marcadores en estudios con un número amplio de pacientes, con seguimiento a medio y largo plazo, y valorar los factores que influyen en la supervivencia del paciente y del injerto.
INMUNOSUPRESIÓN EN TRASPLANTES CON ENFERMEDAD RENAL CRÓNICA AVANZADA
Consideraremos el estadio (K/DOQI) 4 (filtrado glomerular estimado según MDRD: 15-29 ml/min/1,73 m2). La inmunosupresión en el estadio 5 (filtrado glomerular <15 ml/min/1,73 m2) se expone en otro capítulo.
En el seguimiento del trasplantado renal, cuando se alcanzan estos estadios, hay que admitir que previamente ya se han adoptado las diferentes estrategias posibles en las pautas de inmunosupresión (IS) para evitar el deterioro de la función renal de causa inmunológica. Por lo tanto, lo más importante en estas fases es prevenir las complicaciones derivadas de la insuficiencia renal, evitar toxicidades por los inmunosupresores y tener preparado al paciente para un retrasplante o para iniciar diálisis con el mejor estado clínico y metabólico posibles.
En los pacientes que mantienen el filtrado glomerular estable a lo largo del seguimiento, lo racional es no modificar la pauta de IS que están recibiendo. Si a pesar de mantener inmodificada la IS el filtrado glomerular se va reduciendo: ajustar las concentraciones mínimas de ciclosporina a 100 ng/ml y de tacrolimus a 5 ng/ml con el objetivo de mejorar el componente hemodinámico intrarrenal. En caso de encontrarse previamente en estos valores, reducirlos un 50%.
Si reciben tratamiento asociado con IS antiproliferativos, conviene tener presente que, a medida que se deteriora la función renal, los efectos tóxicos se incrementan, tanto los hematológicos (anemia, leucopenia, trombocitopenia) como los digestivos (náuseas, esofagitis, epigastralgias, diarrea) y la afectación del estado general (astenia marcada). Debido a la insuficiencia renal, los niveles de ácido micofenólico se encuentran con valores superiores a los rangos terapéuticos. La recomendación es reducir a la mitad las dosis de este grupo de fármacos.
No se debe modificar los esteroides.
Figura 1. Manejo de la hipertensión arterial en el paciente trasplantado renal
Tabla 1. Manejo de las dislipemias en el paciente trasplantado renal39
Tabla 2. Resumen de las recomendaciones en los receptores de un trasplante renal