Introducción: El estrés oxidativo es crucial para el desarrollo de arteriosclerosis, principal causa de morbimortalidad en población en prediálisis. Nuestro objetivo fue valorar la oxidación de las principales líneas moleculares y discernir si algún biomarcador tenía mejor comportamiento valorando este estrés. Pacientes y método: Estudio observacional en 32 pacientes con MDRD 22,1 ± 1,08 ml/min. Medimos en linfocitos periféricos: malondialdehído, glutatión oxidado/reducido, 8-oxo-deoxiguanosina nuclear y mitocondrial, superóxido dismutasa, glutatión reductasa, glutatión peroxidasa y catalasa, y en plasma F2 isoprostanos y proteínas carboniladas. Correlacionamos los resultados con función renal y factores comórbidos. Resultados: Todos los biomarcadores tuvieron amplias diferencias significativas cuando se compararon con el grupo control peroxidación lipídica: F2 isoprostanos: 821,89 ± 300,47 ng/ml vs. 270 (95,66)* ng/ml (p <0,000); MDA 0,11 (0,11)* vs. 0,7 ± 0,31 nmol/mg prot (p <0,000). Oxidación proteica: GSSG/GSH: 6,89 ± 1,91 vs. 1,39 ± 0,75 (p <0,000); proteínas carboniladas: 7,41 ± 0,84 vs. 3,63 (1,12)*. Daño material genético: 8-oxo-deoxiguanosina nuclear: 7,88 (2,32)* vs. 2,96 (1,78)* y 8-oxo-dG mitocondrial: 15,73 ± 2,28 vs. 13,85 ± 1.44 (p <0,05). Los valores de las enzimas antioxidantes también obtuvieron amplias diferencias significativas. La molécula 8-oxodeoxiguanosina en DNA nuclear fue la que tuvo una relación significativa con el resto de biomarcadores, con homocisteína (r = 0,305; p <0,05), lipoproteína (a) (r = 0,375; p <0,01), 8-oxo-deoxiguanosina mitocondrial (r = 0,411; p <0,05), GSSG/GSH (r = 0,595; p <0,001) y proteínas carboniladas (r = 0,489; p <0,05), y de forma inversa con las proteínas totales (r = -0,247; p <0,01), GSH (r = -0,648; p <0,000), GRS (r = -0,563; p <0,001) y SOD (-0,497; p <0,000). Ninguno de los parámetros tuvo correlación con la función renal. Tampoco se obtuvieron diferencias significativas con la presencia o no de diabetes o la toma de estatinas. * Mediana (amplitud intercuartil). Conclusión: Existe un elevado estrés oxidativo en los pacientes con enfermedad renal avanzada que probablemente se establezca desde fases tempranas de la enfermedad. Entre todos los parámetros estudiados, la molécula de 8-oxo-dG se comportó como el marcador más idóneo.
INTRODUCCIÓN
La prevalencia de la enfermedad renal crónica (ERC), tanto en España como en el resto del mundo, continúa en aumento en los últimos años, debido probablemente al envejecimiento de la población, a la mayor prevalencia de entidades como la diabetes y la hipertensión arterial y, posiblemente, a la existencia de mejores programas de salud pública que detectan y controlan la nefropatía desde estadios precoces1-3.
Está demostrado que la principal causa de morbimortalidad en los pacientes con ERC es la cardiovascular4,5 y que el estrés oxidativo, junto con un estado inflamatorio subclínico, serían los responsables últimos de la generación y progresión de la placa arteriosclerótica5.
La generación excesiva de sustancias prooxidantes, así como el déficit o la pérdida (en diálisis) de sustancias antioxidantes, son las responsables de generar estrés oxidativo y producir daños moleculares irreversibles. En los pacientes que reciben tratamiento sustitutivo renal pueden estar implicados diferentes factores añadidos que influyan en la generación de este estrés, como la retrofiltración de líquido de diálisis no ultrapuro, con el consiguiente paso de endotoxinas y activación del sistema del complemento, la pérdida de sustancias antioxidantes a través de membranas de alta permeabilidad o la infusión de grandes cantidades de hierro intravenoso, etc.
La existencia de esta relación entre estrés oxidativo y patología cardiovascular en pacientes en hemodiálisis ya ha sido demostrada en diversos estudios6. Sin embargo, la situación en pacientes en prediálisis es diferente, existen menos trabajos y la mayoría estudia una línea molecular aislada, lo que dificulta una visión global de esta alteración.
Hay evidencias de que, en estadios previos de enfermedad, este estrés ya esté aumentado7,8. La población en prediálisis está caracterizada por la confluencia de un gran número de factores de riesgo tradicionales, como hipertensión, dislipemia y diabetes mellitus, que han demostrado ser, por sí solos, factores de riesgo cardiovascular y, por tanto, es de esperar que el estrés oxidativo en esta población esté aumentado. Además, la acumulación de toxinas urémicas contribuirá a aumentar más el disbalance ente las defensas y el ataque oxidante.
Nuestra intención fue valorar la oxidación de las distintas líneas moleculares (proteínas, lípidos y material genético) y discernir si alguna de ellas se comportaría como mejor marcador oxidativo en una población agrupada en un estadio avanzado de enfermedad renal, pero sin la influencia de los posibles factores aportados por las técnicas dialíticas.
PACIENTES Y MÉTODOS
Se trata de un estudio observacional, formado por un grupo de 32 pacientes con diagnóstico previo de ERC estadio 4 y grupo control compuesto por 67 sujetos voluntarios sanos. El grupo de pacientes provenía de las consultas de prediálisis del Servicio de Nefrología del Hospital Clínico de Valencia. Todos los participantes firmaron su consentimiento para formar parte del estudio.
Se incluyeron los pacientes estables clínicamente en los seis meses previos y fueron excluidos del estudio aquéllos con enfermedad neoplásica, sangrado activo, enfermedad inflamatoria o infecciosa activa, y los que habían recibido tratamiento con hierro intravenoso en los tres meses previos.
Se revisaron las historias clínicas de los pacientes, registrando sus datos demográficos, etiología de la enfermedad renal, antecedentes de hipertensión arterial y número de fármacos antihipertensivos que tomaban para su tratamiento, dislipemia, toma de estatinas, diabetes mellitus, cardiopatía isquémica (definida por tener antecedentes de infarto de miocardio, angina o prueba de imagen positiva para isquemia miocárdica), accidente cerebrovascular o enfermedad arterial periférica.
Las muestras de sangre se extrajeron tras 12 horas de ayuno. Se tomaron muestras para hemograma y screening bioquímico, que incluía: urea, creatinina, metabolismo lipídico, proteínas totales, albúmina, homocisteína, lipoproteína a, fibrinógeno y PCR-as (proteína C reactiva de alta sensibilidad).
Para las determinaciones de parámetros de estrés oxidativo se extrajeron mediante vacutainer 14 ml de sangre en tubo con EDTAcomo anticoagulante. Estas muestras fueron inmediatamente centrifugadas, separando suero y plasma.
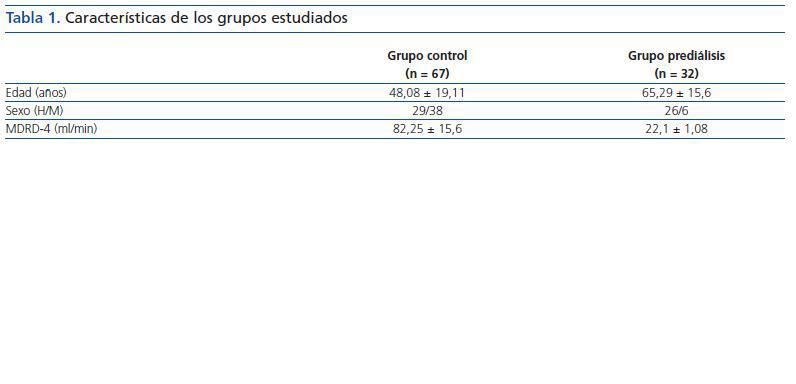
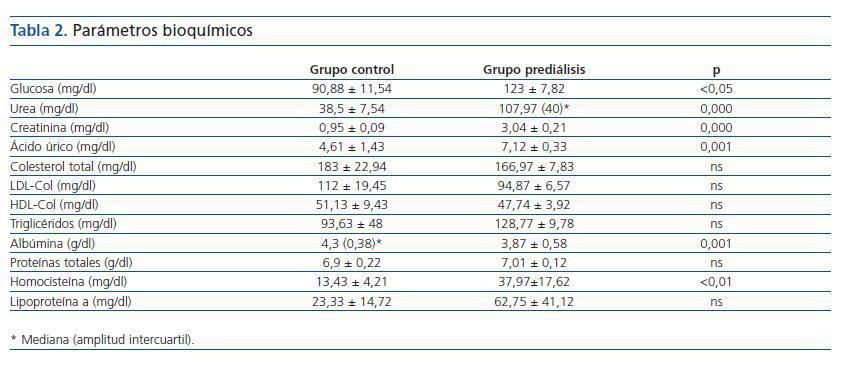
Las características de los grupos estudiados se reflejan en la tabla 1.
El grupo prediálisis lo formaban 26 varones y seis mujeres, con un promedio de edad de 65,29 ± 15,60 años. La nefropatía causal era en 21 casos (65,7%) vascular, en ocho casos (25%) era diabética, en dos casos (6,2%) nefritis túbulointersticial y en un caso (3,1%) poliquistosis renal. El filtrado glomerular estimado (fórmula MDRD) en el momento del estudio fue de 22,09 ± 6,02 ml/min de media.
Procedimientos de laboratorio
Se aislaron las células mononucleares por centrifugación de Ficoll-Hypaque9, seguido de tres lavados con solución salina. Las células mononucleares resuspendidas en medio RPMI 1460 (Sigma) y las lisadas con el tampón de lisis «RNA/DNA Stabilization Reagent for Blood/Bone marrow» (Roche) para la extracción del DNA, se conservaron a -80 ºC hasta su uso.
Aislamiento del DNA nuclear (DNAn) y mitocondrial (DNAmt)
El DNAn se aisló siguiendo el método de Gupta, con la modificación descrita por Muñiz et al 10. en la cual se usa el alcohol cloroformo isoamil (24:1) en lugar del fenol para la eliminación de proteínas. El aislamiento del DNAmt se hizo según el método de Espinosa et al. 11
Estudio del estrés oxidativo
Determinación de parámetros oxidativos
Para el estudio de la peroxidación lipídica se determinaron dos parámetros: en las células mononucleares aisladas, el MDA por cromatrografía líquida de alta resolución, midiéndose la concentración de proteína en cada muestra por el método de Lowry12 para poder referenciar estos parámetros. Los F2 isoprostanos esterificados se cuantificaron en plasma mediante técnica de ELISA (Cayman Chemicals).
Los F2 isoprostanos son productos derivados de la oxidación no enzimática del ácido araquidónico presente en los lípidos de las membranas celulares.
El estrés proteico se estudió mediante la relación GSSH/GSH por cromatografía líquida de alta resolución en células mononucleares, y las proteínas carboniladas en plasma mediante técnica de ELISA de acuerdo con el método de Buss et al. 13
Por último, el análisis del daño oxidativo a nivel del material genético se realizó mediante el estudio de la base modificada 8-oxo-dG tanto en DNA nuclear como en DNA mitocondrial previamente aislados, mediante cromatografía líquida de alta resolución
Productos de defensa antioxidante
La defensa antioxidante se valoró mediante el estudio de la actividad de diversas enzimas que han demostrado tener esta capacidad.
La actividad total de la enzima SOD fue determinada por la método de McCord y Fridowich14 y las actividades de las enzimas Catalasa y GPX y GSR mediante el método de Clairbone y Gunzler15, todos ellos utilizando el ensayo espectrofotométrico.
Análisis estadístico
Las distintas variables numéricas se expresan como media ± desviación estándar y como mediana y rango intercuartil para las variables cuya distribución no era normal (prueba de Kolgomorov-Smirnov). En estas últimas se realizó una transformación logarítmica. Para la comparación de dos muestras independientes se utilizó la T de student con prueba de Levene para la igualdad de varianzas. Para la comparación de variables cualitativas, la Xi cuadrado con la corrección de Yates; y en el caso de menos de cinco observaciones, la prueba de Fischer. Para el estudio de las distintas correlaciones entre las variables, se practicó una correlación bivariada con P de Pearson. Se consideró significativo el valor de p ≤0,05. Se utilizó el programa estadístico SPSS versión 15.0,
DISCUSIÓN
El hallazgo principal del estudio es el aumento significativo de oxidantes en una población en prediálisis a nivel de todas las líneas moleculares estudiadas, así como el déficit de las defensas antioxidantes. De todos los parámetros estudiados, la molécula 8-oxo-dG, marcador de daño nuclear, fue la que mayor número de correlaciones obtuvo con el resto, por lo que creemos que sería el marcador más fiable.
Generalmente, el estudio del estrés oxidativo en población con ERC se ha centrado en la población en diálisis, con la intención fundamental de demostrar el beneficio o no de la técnica en este aspecto. Sin embargo, la población en prediálisis se caracteriza por la confluencia de múltiples factores de riesgo cardiovascular capaces por sí solos de provocar este estrés.
En las últimas dos décadas ha aumentado el interés en descubrir las causas de la elevada morbimortalidad cardiovascular de la población con ERC. Por ello, el estrés oxidativo ha sido objeto de múltiples estudios, en virtud de las pruebas que lo posicionan en el centro de la fisiopatología de la placa de ateroma. Sin embargo, en la población en prediálisis, la mayor parte de los trabajos de los que disponemos se centran en escasos biomarcadores oxidativos, y muchas veces en poblaciones de características heterogéneas. Nuestra intención fue valorar la oxidación de las distintas líneas moleculares (proteínas, lípidos y material genético) y discernir si alguna de ellas se comportaría como mejor marcador oxidativo en una población agrupada en un estadio avanzado de enfermedad renal, pero sin la influencia de los posibles factores aportados por las técnicas dialíticas.
En nuestro caso, se trata de una población donde existe una prevalencia de hipertensión del 100% de los pacientes en mayor o menor grado, y de diabetes superior a un 40%. En cuanto a la dislipemia, aunque el 65% de los enfermos tenía este diagnóstico, un porcentaje del 59,4% recibía tratamiento hipolipemiante con estatinas, por lo que la media de lipoproteínas estaba dentro de un rango normal en el grupo prediálisis.
La peroxidación lipídica se estudió mediante dos parámetros, MDA y F2 isoprostanos plasmáticos. El MDA ha sido uno de los parámetros más estudiados como producto final de la peroxidación lipídica16. Varios autores han encontrado niveles elevados en pacientes con ERC y en HD17. Nosotros también encontramos niveles significativamente elevados en el grupo de ERC. Sin embargo, a pesar de ser un óptimo marcador de estrés oxidativo, el MDA es una molécula de bajo peso molecular e hidrosoluble, por lo que puede sufrir aclaramiento renal o ser dializada. Recientemente, de Vecchi et al. proponen que parte de los niveles de MDA que encontramos elevados en estos pacientes sería atribuible al bajo filtrado glomerular, por lo que parece más idóneo cuantificar la molécula de MDA ligada a macromoléculas que impedirían este aclaramiento18. Por otro lado, la medición de los F2 isoprostanos plasmáticos ha adquirido especial interés en los últimos años por diversos motivos. Se trata de moléculas más estables que otros lípidos oxidados (p. ej. LDL-oxidadas) y que, al ser medidas en plasma en su forma esterificada, no sufren aclaramiento renal o depuración por diálisis19. Se han demostrado niveles elevados de F2 isoprostanos tanto en fumadores20 como en pacientes diabéticos21. Handelman et al. encuentran niveles de F2 isoprosanos elevados en pacientes en hemodiálisis, así como correlación con los niveles de PCR de sus pacientes19.
Recientemente, Cottone et al. han medido F2 isoprostanos en una extensa muestra de 626 pacientes hipertensos en diferentes estadios de ERC, encontrando correlación negativa con el grado de función renal22. Otros autores, como Donousi et al.23, también encuentran esta correlación en una muestra de 87 pacientes en al amplio rango de estadios 1 al 4. Nuestro estudio, sin embargo, no es capaz de encontrar esta relación, quizás porque se trate de una muestra de pacientes más pequeña o también porque todos se encuentren en un estadio muy avanzado de enfermedad renal. De hecho, llama la atención que en el trabajo de Donousi los valores de F2 isoprostanos en el estadio 3 son superiores a los del estadio 4.
En nuestra línea se encuentra el trabajo de Oberg et al.24, donde en una muestra de 60 pacientes, con un filtrado glomerular medio de 27,11 ml/min, tampoco se logra encontrar relación con los niveles de F2 isoprostanos.
Todos estos resultados sugieren la hipótesis de que la peroxidación lipídica tiene lugar en fases tempranas de ERC y que se mantiene en niveles altos durante la progresión de la enfermedad.
El DNA es una estructura molecular especialmente vulnerable al ataque de las especies reactivas de oxígeno, tanto más si consideramos la molécula de DNA mitocondrial. Existen pocos estudios del daño oxidativo del material genético en pacientes con enfermedad renal, y la mayoría lo hacen en pacientes en hemodiálisis25,26. Entre las modificaciones que puede experimentar el DNA inducidas por las especies reactivas de oxígeno, la molécula 8-oxo-2’-deoxiguanosina (8OHdG) es una de las más abundantes. Se sabe que el radical hidroxilo reacciona rápidamente con la base nucleotídica guanosina para dar lugar a la molécula 8-oxo-dG, y que ésta se ha propuesto como un buen marcador de la estimación de la producción de este radical libre. Probablemente, otras especies reactivas de oxígeno intervengan en este proceso, sobre todo en estos pacientes donde existe un marcado déficit de actividad de la enzima catalasa, dando lugar a un aumento en la disponibilidad de H2O2. El daño oxidativo del DNA es capaz de inducir un envejecimiento celular precoz, así como un aumento en la incidencia de cáncer27. Tarng ha demostrado que el contenido de 8-oxo-dG en DNA celular proporciona una medida fiable del daño oxidativo del material genético en leucocitos periféricos en pacientes en hemodiálisis crónica23. Curiosamente, los pacientes en hemodiálisis tienen una incidencia mayor de cáncer que la población general, aunque es cierto que estos pacientes merecen una atención especial, ya que la propia técnica podría influir en el equilibrio oxidativo28. Watanabe et al. midieron 8-oxo-dG en pacientes con insuficiencia renal avanzada (FG promedio: 6,4 ml/min) y encontraron los niveles más elevados en el grupo que presentaba valores más bajos de histidina, un aminoácido que se comportaría como marcador del estado nutricional del individuo. En un grupo de hipertensos, Redón et al. encontraron niveles elevados de 8-oxo-dG tanto nuclear como mitocondrial en células mononucleares periféricas. Este grupo no pudo establecer correlación entre el grado de hipertensión y el aumento de marcadores oxidativos. Los autores piensan que puede ser debido a que en el paciente hipertenso pueden confluir otros factores, como el aumento de la actividad de la angiotensina II o un estado de hiperinsulinemia, que podrían influir en el estrés29. En nuestra población, encontramos un aumento generalizado tanto de 8-oxo-dG nuclear como mitocondrial, con amplias diferencias significativas respecto al grupo control. Del mismo modo que al estudiar la peroxidación lipídica, tampoco encontramos correlación con el deterioro de la función renal. Pensamos que esto puede ser debido a la confluencia de múltiples factores comórbidos en estos pacientes. De hecho, la totalidad eran hipertensos, a parte de que más de un 40% de ellos eran diabéticos y de que estudiamos pacientes en un estadio muy avanzado de la enfermedad renal.
Por último, estudiamos el daño oxidativo sobre las proteínas. Witko-Sarsat et al. identificaron lo que llamaron productos finales de la oxidación proteica avanzada (AOPPs) en virtud de su analogía con los productos finales de la glucosidación avanzada (AGE) en pacientes con ERC en diferentes situaciones: en prediálisis, hemodiálisis y diálisis peritoneal. Los pacientes en prediálisis tenían los niveles más bajos entre los tres grupos, aunque significativamente más elevados que el grupo control de pacientes sanos. En nuestro estudio, la valoración de la oxidación proteica la realizamos con la medición de las proteínas carboniladas. Estas moléculas son un importante marcador de la oxidación proteica y reflejo de la formación de grupos aldehído. Heinecke et al. demostraron que, mediante reacciones oxidativas cediadas por la enzima mieloperoxidasa se podían convertir aminoácidos comunes en aldehídos altamente reactivos30, los cuales se ha demostrado que tienen un papel preponderante en la génesis de la placa ateromatosa31. Este autor incide en la importancia que tienen las reacciones mediadas por la mieloperoxidasa, en la contribución al desarrollo de la placa de arteriosclerosis. Productos derivados de la oxidación mediada por la mieloperoxidasa del aminoácido tirosina, como la ditirosina o la 3-clorotirosina, se han encontrado formando parte de moléculas de LDL-oxidadas y en muestras de arteriosclerosis en humanos32. De hecho, se han relacionado los niveles de mieloperoxidasa leucocitaria con riesgo elevado de sufrir enfermedad coronaria33. Nuestros enfermos presentaban unos valores de proteínas carboniladas significativamente más elevados que en grupo control y, al igual que con el resto de parámetros oxidativos, tampoco hubo correlación con el MDRD, debido probablemente a motivos como un número limitado de pacientes estudiados y a la confluencia de diversos factores prooxidantes. Otros autores sí que han demostrado correlación de productos derivados de la oxidación proteica con el declive de la función renal, siempre con un elevado número de pacientes y considerando todos los estadios de insuficiencia renal34.
El estudio del estrés oxidativo se completó con el análisis de la actividad de las principales enzimas antioxidantes, así como del glutatión. En condiciones normales, la concentración de antioxidantes es bastante superior a la concentración de productos oxidantes, de manera que la generación continua de radicales libres, derivados del metabolismo celular, queda regulada y neutralizada por ellas. Una protección antioxidante eficaz requiere la actuación sincronizada de las tres enzimas estudiadas: superóxido dismutasa, glutatión peroxidasa y catalasa. Encontramos la actividad de las tres enzimas significativamente disminuida en el grupo prediálisis, reflejo del disbalance que existe entre los factores oxidantes y antioxidantes. Moradi et al. han encontrado recientemente un descenso de hasta un 50% en los valores de GPx junto con otras enzimas y moléculas con capacidad antioxidante en una muestra de pacientes en HD, frente a un grupo control. Además, comprueban que una sesión de HD no logra normalizar sus niveles35.
RESULTADOS
Antecedentes de riesgo cardiovascular
Todos los pacientes recibían al menos un fármaco antihipertensivo, un 65% tomaba dos fármacos y un 12,5% tomaba al menos tres fármacos; la diabetes mellitus estaba presente en 13 pacientes (40,6%), dislipemia en 21 pacientes (65,6%) y nueve pacientes (28%) tenían antecedentes de cardiopatía isquémica. Por otro lado, y considerándolo como un factor protector, 19 pacientes (59,4%) tomaban estatinas como tratamiento hipolipemiante.
Bioquímica general
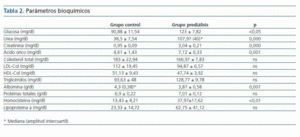
Los valores obtenidos en la bioquímica de los dos grupos y las diferencias estadísticas entre grupo control y prediálisis se reflejan en la tabla 2.
Parámetros inflamatorios
Los valores de PCR y fibrinógeno estaban elevados de manera significativa respecto al grupo control. PCR: 9,76 ± 2,54 mg/dl en grupo prediálisis frente 1,57 ± 1,67 mg/dl en grupo control (p < 0,01) y fibrinógeno: 4,84 ± 0,29 mg/dl en el grupo prediálisis frente 3,55 ± 0,63 mg/dl en el grupo control (p<0,01), con una correlación Significativa entre ambos (r: 0,574; p<0,05) y de la PCR con el valor del ácido úrico (r: 0,398; p<0,05)
Estrés oxidativo
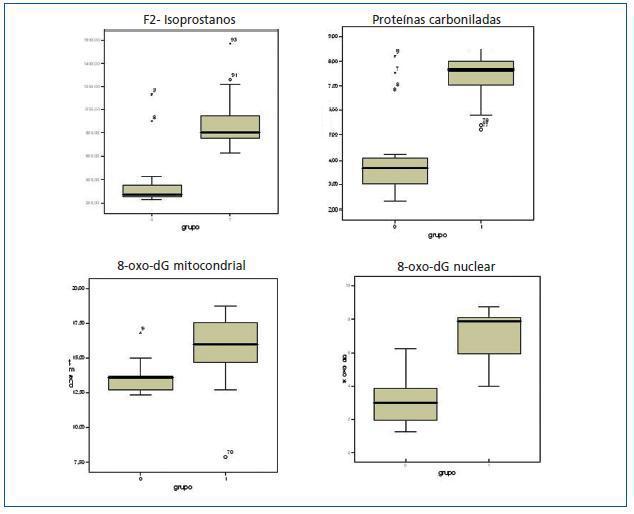
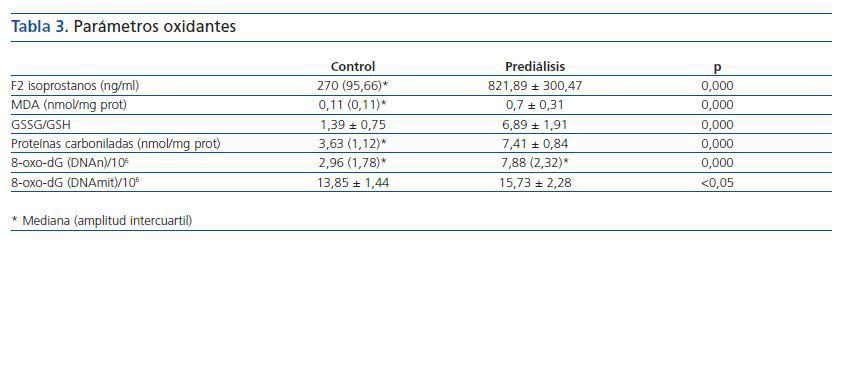
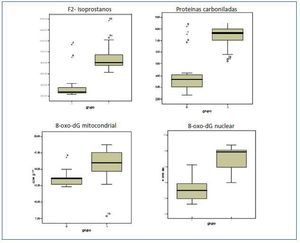
Los valores de los biomarcadores de estrés oxidativo y las diferencias entre ambos grupos se detallan en la tabla 3 y en la figura 1.
Peroxidación lipídica
Obtuvimos diferencias significativas entre el grupo control y prediálisis. Existía una correlación significativa de MDA con HDL-col, (r = 0,406; p<0,05), pero no existíancorrelaciones con otros parámetros de estrés oxidativo.
Oxidación proteica
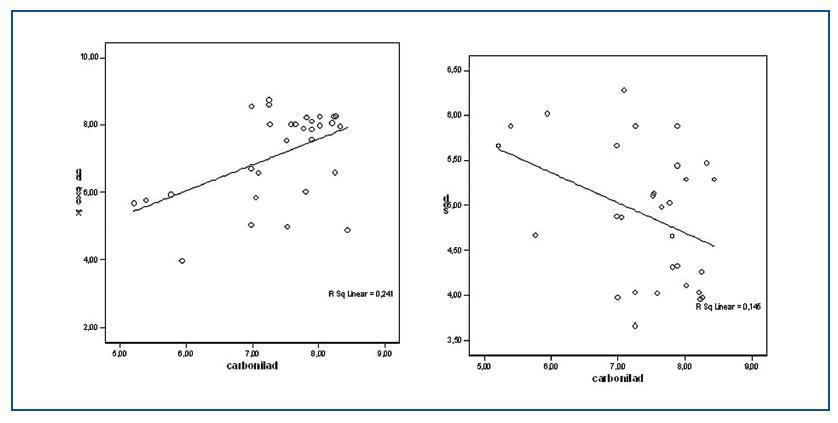
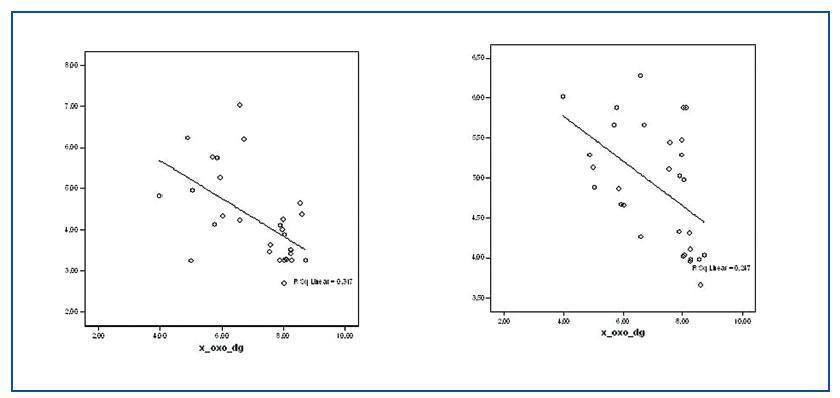
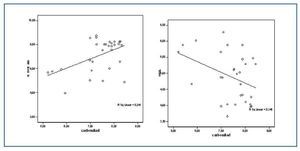
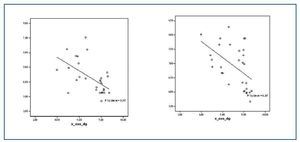
Los valores de las proteínas carboniladas presentaban una correlación positiva con la relación GSSG/GSH (r = 0,505; p<0,05) y con 8-oxo-dG nuclear (r = 0,489; p <0,05) (figura 2) y negativa con las enzimas antioxidantes SOD (r = -0,381; p < 0,05) (figura 2) y GSR (r = -0,405; p <0,05).
Daño oxidativo del material genético
Tanto para los valores de 8-oxo-dG nuclear como mitocondrial existían diferencias significativas entre el grupo de estudio y el grupo control. Los valores de 8-oxo-dG presentaron correlaciones significativas con homocisteína (r = 0,305; p <0,05); lipoproteína (a) (r = 0,375; p <0,01); 8-oxo-dG mitocondrial (r = 0,411; p <0,05); GSSG/GSH (r = 0,595; p <0,001) y con las proteínas carboniladas, como se nombró anteriormente. Asimismo, los valores de 8-oxo-dG tuvieron correlaciones inversas con: proteínas totales (r = -0,247; p <0,01); GSH (r = -0,648; p <0,000) y SOD (-0,497; p <0,000). (figura 3)
Defensas antioxidantes
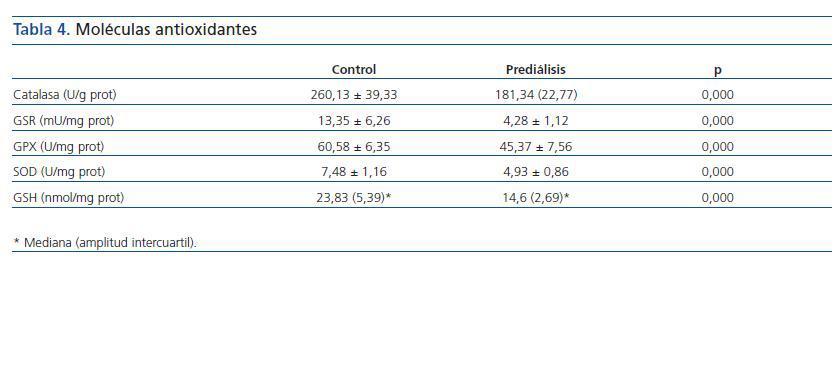
Los valores obtenidos para la actividad de las enzimas antioxidantes para el grupo control y el prediálisis se reflejan en la tabla 4.
La enzima GSR presentaba correlación significativa con: GSH (r = 0,552, p <0,05), SOD (r = 0,396, p < 0,05) y correlación inversa con 8-oxo-dG nuclear (r = -0,563; p <0,001), GSSG/GSH (r =-0,437, p <0,05) y Proteínas Carboniladas (r = -0,405; p <0,05).
La molécula de Glutation se correlacionó de forma inversa significamente con 8-oxo-dG nuclear (r = -0,648, p <0,001), GSSG (r = - 0,612, p <0,001); y Proteínas Carboniladas (r = -0,585, p <0,001).
GPx tuvo las siguientes correlaciones: MDA (r = -0,871, p <0,001) y SOD (r = 0,498, p <0,005)
SOD se correlacionó con: 8-oxo-dG nuclear (r = -0,497, p <0,05), MDA (r = -0,459, p <0,01), GSR (r = 0,396, p <0,03) y proteínas carboniladas.
Relación con la función renal, diabetes mellitus o toma de estatinas
Ninguno de los biomarcadores de estrés oxidativo mostró correlación significativa con MDRD ni con la presencia de diabetes ni la toma de estatinas.
CONCLUSIÓN
A pesar de las limitaciones del estudio, ya que se trata de un estudio observacional y transversal con un número limitado de participantes, hemos observado que existe un importante estrés oxidativo en los pacientes con ERC en estadio avanzado sin diálisis. Estos hallazgos sugieren que la acumulación de oxidantes se inicia desde fases anteriores de insuficiencia renal. De entre todos los parámetros estudiados, la molécula 8-oxo-dG nuclear fue la que se comportó como marcador más fiable.
Figura 2.
Figura 3.
Tabla 1.
Tabla 2.
Tabla 3.
Tabla 4.
Figura 1.