Introducción: La hiperfosfatemia (fósforo sérico ≥ 5,5 mg/dl) es un factor independiente de mortalidad en la población en diálisis. Comparamos el transporte peritoneal de fósforo, creatinina y urea para demostrar diferencias y señalar la relevancia de estos parámetros en el control del fósforo sérico. Material y métodos: Se incluyeron 60 pacientes en diálisis peritoneal y se determinó el índice dializante/plasma de fósforo (D/P P) y creatinina (D/P Cr), el aclaramiento semanal de fósforo (AclP) y creatinina (AclCr), Kt/V de urea semanal y la excreción peritoneal de fósforo (ExP). Resultados: El D/P P fue superior en pacientes con normofosfatemia, comparados con los que presentaron hiperfosfatemia, 0,61 ± 0,13 frente a 0,54 ± 0,10 (p = 0,035). Se observó una adecuada correlación entre el D/P P y el D/P Cr, r = 0,90, p < 0,05, pero una pobre concordancia entre ambos, con un límite inferior de −0,17 (−0,24 a −0,09 IC 95 %) y límite superior de 0,47 (0,39-0,54 IC 95 %) para el D/P Cr respecto al D/P P. El AclP tuvo una adecuada correlación con el D/P P en pacientes con Kt/V ≥ 1,7 (r = 0,384, p = 0,04) y en anúricos (r = 0,392, p = 0,04), pero no con el D/P Cr. Hubo una pobre concordancia del AclCr respecto al AclP con límite inferior de −13,54 l/sem/1,73 m2 SC (−21,68 a −5,4 IC 95 %) y límite superior de 58,98 l/sem/1,73 m2 SC (50,84-67,12 IC 95 %). La ExP total se relacionó con el AclP (r = 0,643, p < 0,05), mientras que no lo hizo con el AclCr (r = 0,222, p = 0,23). Mediante el método CHAID se realizó un árbol de clasificación del transporte de fósforo con base en su D/P, obteniendo 5 nodos (≤ 0,5, 0,51-0,55, 0,56-0,66, 0,67-0,76, > 0,76), mostrando diferencias estadísticamente significativas entre nodos para niveles séricos de fósforo, AclP total y peritoneal, así como Kt/V de urea semanal. Conclusiones: Las mediciones de D/P P y AclP no concuerdan con las mediciones de D/P Cr y AclCr, respectivamente, por lo que su determinación es una herramienta clínica para el control del nivel de fósforo sérico.
Background: Hyperphosphataemia (serum phosphorus ≥5.5mg/dl) is an independent mortality factor for the dialysis population. We compared phosphorus, creatinine and urea peritoneal transport to demonstrate differences and indicate the relevance of these parameters in the control of serum phosphorus. Material and method: We included 60 patients on peritoneal dialysis and determined the dialysate/plasma phosphorus (D/P P) and creatinine (D/P Cr) ratios, weekly creatinine clearance (CrCl) and phosphorus clearance (PCl), weekly Kt/V of urea, and peritoneal phosphorus excretion (PEx). Results: D/P P was higher in patients with normal phosphataemia, compared with those who were hyperphosphataemic 0.61±0.13 versus 0.54±0.10 (p=.035). We observed an adequate correlation between D/P P and D/P Cr, r=0.90, p<.05, but poor concordance between both, with a lower limit of −0.17 (−0.24 to −0.09 95% CI) and an upper limit of 0.47 (0.39-0.54 95% CI) for D/P Cr with respect to D/P P. PCl had an adequate correlation with D/P P in patients with a Kt/V ≥1.7 (r=0.384, p=.04) and in anuric patients (r=0.392, p=.04), but not with D/P Cr. There was poor concordance of the CrCl with respect to PCl with a lower limit of −13.54l/week/1.73m2 BSA (−21.68 to −5.4 95% CI) and an upper limit of 58.98l/week/1.73m2 BSA (50.84-67.12 95% CI). Total PEx was related to PCl (r=0.643, p<.05), while it was not related to CrCl (r=0.222, p=.23). Using the CHAID method, we created a classification tree for phosphorus transport based on its D/P, obtaining 5 nodes (≤0.5, 0.51-0.55, 0.56-0.66, 0.67-0.76, >0.76), with statistically significant differences between nodes for serum phosphorus, total and peritoneal PCl and weekly Kt/V of urea. Conclusions: D/P P and PCl are not concordant with D/P Cr and CrCl respectively and therefore their determination is a clinical tool to control serum phosphorus levels.
INTRODUCCIÓN
La principal causa de muerte en la población con enfermedad renal avanzada es de tipo cardiovascular, siendo la hiperfosfatemia (fósforo sérico > 5,5 mg/dl) un factor de riesgo independiente y que en las diferentes series se presenta en un 30-40 % de la población en terapia sustitutiva, dando como resultado entre otras complicaciones la calcificación de la media de vasos sanguíneos, especialmente en arterias coronarias, que precipita eventos cardiovasculares agudos de consecuencias fatales1-10. Por estos motivos el control del fósforo sérico es imperativo en el manejo de los pacientes con enfermedad renal crónica.
Poca información hay respecto al aclaramiento semanal de fósforo (AclP) y el índice dializante/plasma de fósforo (D/P P). Sedlacek et al. encontraron una alta correlación entre el índice dializante/plasma de creatinina (D/P Cr) y el D/P P, así como sus respectivos aclaramientos, concluyendo que el aclaramiento de ambos solutos está íntimamente ligado, por lo que el principal determinante para el aclaramiento semanal de creatinina (AclCr) y el AclP es el D/P Cr11. En un estudio en pacientes pediátricos en diálisis peritoneal automatizada encontraron una buena correlación entre ambos D/P, pero el AclP se relacionó mejor con el D/P P que con el D/P Cr, concluyendo que el primero es mejor predictor12. Bernardo et al. clasificaron el transporte de fósforo mediante su D/P con base en la clasificación para el transporte de creatinina de Twardowski13 y observaron que la distribución de los pacientes basada en el D/P P en las diferentes categorías era diferente a la presentada para el D/P Cr, sugiriendo que, a pesar de existir correlación entre el D/P P y el D/P Cr, esta última no es una medida suficientemente adecuada para clasificar a los pacientes de acuerdo con el transporte de fósforo14. El presente estudio evalúa la concordancia mediante el método de Bland y Altman15 entre el D/P Cr y el D/P P, así como entre el AclCr y el AclP, con el objetivo de conocer cuánto puede diferir una prueba respecto a otra y así determinar si el D/P Cr y el AclCr pueden seguir siendo subrogados confiables del transporte peritoneal de fósforo. Además, se evalúa el transporte peritoneal de fósforo en una población en diálisis con el fin de destacar el papel que tiene en el control de la fosfatemia más allá de la restricción dietética y el uso de quelantes de fósforo.
MATERIALES Y MÉTODOS
Se realizó un estudio transversal, observacional y comparativo, en el cual se incluyeron 60 pacientes de la consulta externa de diálisis peritoneal. Criterios de inclusión: pacientes mayores de 16 años de edad que se encontraran en terapia sustitutiva de la función renal por al menos un mes mediante diálisis peritoneal continua ambulatoria o diálisis peritoneal nocturna automatizada (DPNA). Criterios de exclusión: haber cursado con peritonitis al momento del estudio, considerándose como la presencia de 100 o más leucocitos por campo en el estudio citológico del líquido de diálisis, que hayan concluido tratamiento antibiótico dentro de los dos meses previos o que cursen o hayan cursado en el mes previo con algún evento médico incapacitante. Para la prueba de equilibrio peritoneal (PEP) fueron criterios de eliminación falla en el ultrafiltrado definida como menor de 400 ml tras la aplicación de una bolsa de 2000 ml al 4,25 % tras 4 horas de estancia en la cavidad peritoneal, problemas mecánicos del catéter definidos como un tiempo de entrada del líquido mayor de 10 minutos y de salida mayor de 30 minutos o presentar un D/P P mayor a la unidad. Para la medición de aclaramiento de solutos fueron criterios de eliminación: modalidad DPNA (motivos ajenos a los intereses de este estudio), peritonitis, que el volumen de efluente del líquido de diálisis de 24 horas fuera menor al infundido y falta de apego a la prescripción de diálisis, lo cual fue confirmado de manera subjetiva a decir del paciente.
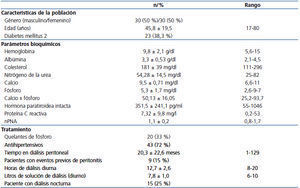
A todos los pacientes se les realizó PEP con una solución al 4,25 % para determinar el D/P P y el D/P Cr. Se realizó citología del líquido de diálisis para descartar proceso infeccioso activo. Se calculó el Kt/V de urea semanal, el AclP y el AclCr semanal expresado en litros por semana ajustado a superficie corporal (l/sem/1,73 m2 SC), todos ellos en sus formas renal, peritoneal y total mediante los métodos estándar16, además del equivalente proteico de aparición del nitrógeno ajustado mediante la fórmula de Randerson17. Las muestras de orina se recolectaron solo para aquellos con una diuresis igual o mayor de 200 ml/día; de no ser así, se consideraron anúricos. El Departamento de Nutrición mediante el cuestionario nutricional de frecuencias del Sistema de Evaluación de Hábitos Nutricionales y Consumo de Nutrimentos18 determinó la ingesta promedio diaria de fósforo.
ANÁLISIS ESTADÍSTICO
Los resultados se expresan como promedios y desviaciones estándar para el caso de variables numéricas o como proporciones para variables categóricas. La comparación de medias entre dos grupos se llevó a cabo con la prueba t de Student para grupos independientes o bien con su alternativa no paramétrica (U-Mann-Whitney), de acuerdo con la distribución de cada variable. La comparación de proporciones se efectuó con la prueba de χ2. La búsqueda de asociación entre dos variables se realizó mediante el coeficiente de correlación de Spearman.
Se efectuó un análisis de concordancia entre dos pruebas (D/P Cr y D/P P; AclCr y AclP) con el método de Bland y Altman. Se construyó una gráfica que muestra la diferencia entre ambos métodos contra su promedio. El 95 % de las diferencias se ubican en dicha gráfica entre dos límites que definen el intervalo de confianza (IC). Se muestran los límites de concordancia con su respectivo IC al 95 %.
Para el caso de comparación de más de dos medias se efectuó la prueba de ANOVA de un factor con test de Bonferroni. Con el fin de segmentar la base de datos de la mejor manera posible en lo que a la variable D/P P se refiere, se empleó un árbol de clasificación tomando el método CHAID (Chi Squared Automatic Interaction Detector) como forma de crecimiento.
Se consideró un valor estadísticamente significativo una p < 0,05. Se empleó el paquete estadístico SPSS versión 15 para Windows.
RESULTADOS
Se incluyeron 60 pacientes, de los cuales fueron eliminados 4 PEP por presentar un D/P P mayor a la unidad y se eliminaron 10 mediciones de aclaramiento de solutos por los siguientes motivos: uno por inadecuada colección de muestras, uno por no requerir diálisis tras recuperación de daño renal agudo, cuatro por volumen de ultrafiltrado de 24 horas menor a la infundida, dos por estar en modalidad de DPNA y dos por no tener una dosis de diálisis estable por mal apego a su prescripción.
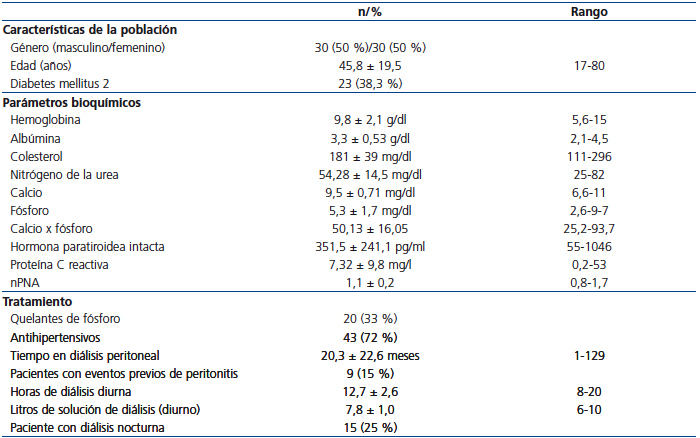
Las características de la población, y los parámetros bioquímicos y de tratamiento pueden observarse en la tabla 1.
Fósforo
El promedio de fósforo sérico en nuestra población fue de 5,3 ± 1,7 mg/dl (2,6-9,7 mg/dl), con 21 (31,3 %) casos de hiperfosfatemia, encontrándose una baja correlación inversa entre los niveles de fósforo y el D/P P, r = −0,273, p = 0,04, y una diferencia estadísticamente significativa en el D/P P en aquellos con normofosfatemia al compararse con los pacientes hiperfosfatémicos, 0,61 ± 0,13 mg/dl frente a 0,54 ± 0,10 mg/dl (p = 0,035). La ingesta de fósforo diaria promedio estimada fue de 1290 ± 472 mg/día (522-2794 mg/día). Se encontró que quienes consumieron una cantidad menor o igual a 1000 mg/día (n = 18, 32 %) tuvieron un fósforo sérico menor de manera significativa cuando se compararon con quienes consumían más de 1000 mg/día (4,8 ± 1,6 mg/dl frente a 5,6 ± 1,7 mg/dl, p = 0,039).
Índice dializante/plasma de fósforo y de creatinina
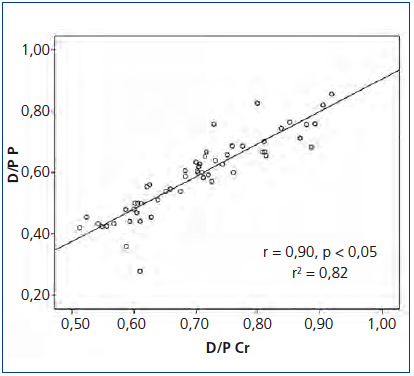
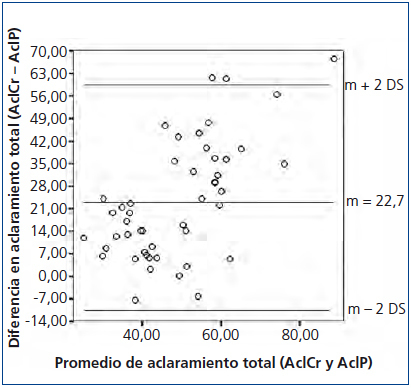
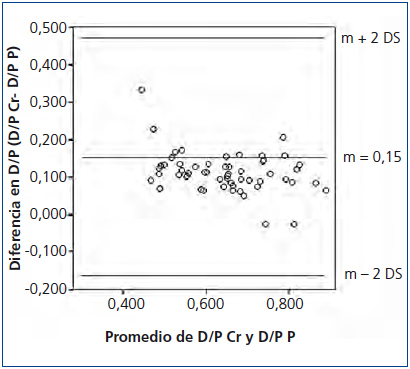
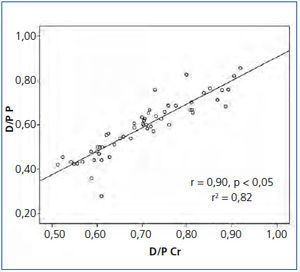
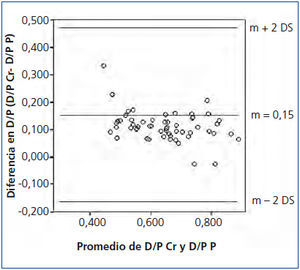
El promedio del D/P Cr para nuestra población fue de 0,70 ± 0,10 (0,51-0,92) y del D/P P de 0,58 ± 0,12 (0,28-0,85), observándose una adecuada correlación entre ambas, con una r = 0,90, p < 0,05 (figura 1). Sin embargo, se observó una pobre concordancia entre ambos métodos con unos límites inferior y superior del D/P Cr respecto al D/P P de −0,17 (−0,21 a −0,13 IC 95 %) y 0,47 (0,35-0,59 IC 95 %), respectivamente (figura 2).
Aclaramiento de fósforo, aclaramiento de creatinina y Kt/V de urea
Se observó una correlación baja entre el AclP y el D/P P (r = 0,33, p = 0,02), así como entre el AclP y el D/P Cr (r = 0,30, p = 0,03). Sin embargo, al realizarse un subanálisis que incluyó solo aquellos con Kt/V de urea ≥ 1,7, se encontró correlación entre el AclP y el D/P P (r = 0,384, p = 0,04), no así entre el AclP y el D/P Cr (r = 0,348, p = 0,06). Se exploró también dicha asociación en pacientes anúricos, donde de igual manera se observó que el AclP se relacionó de manera significativa con el D/P P (r = 0,392, p = 0,04), no así con el D/P Cr (r = 0,358, p = 0,52).
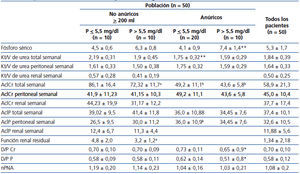
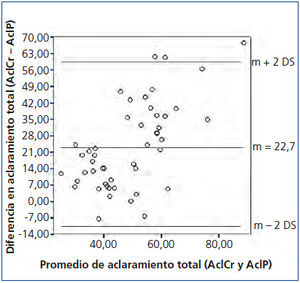
Se buscó asociación entre el Kt/V de urea, el AclCr y el AclP en sus mediciones total, peritoneal y renal, encontrándose lo siguiente: el Kt/V de urea tuvo correlaciones significativas con el AclCr en sus mediciones total, peritoneal y renal (r = 0,68, p < 0,05; r = 0,78, p < 0,05; r = 0,47, p = 0,03, respectivamente); el AclP mostró correlaciones significativas con el AclCr en sus mediciones total, peritoneal y renal (r = 0,45, p < 0,05, r = 0,59, p < 0,05 y r = 0,67, p < 0,05, respectivamente). No obstante, el análisis de concordancia mostró que esta es pobre, con unos límites de concordancia inferior y superior de −13,54 l/sem/1,73 m2 SC (IC 95 % −21,68 a −5,4) y de 58,98 l/sem/1,73 m2 SC (IC 95 % 50,84-67,12), respectivamente, del AclCr total respecto al AclP total (figura 3). Por otro lado, el AclP renal mostró una asociación casi significativa con el Kt/V de urea renal (r = 0,43, p = 0,05), mientras que los AclP total y peritoneal no mostraron asociación significativa con el Kt/V de urea total y peritoneal (r = 0,18, p = 0,31 para ambos).
Aclaramiento de fósforo, niveles séricos de fósforo y función renal residual
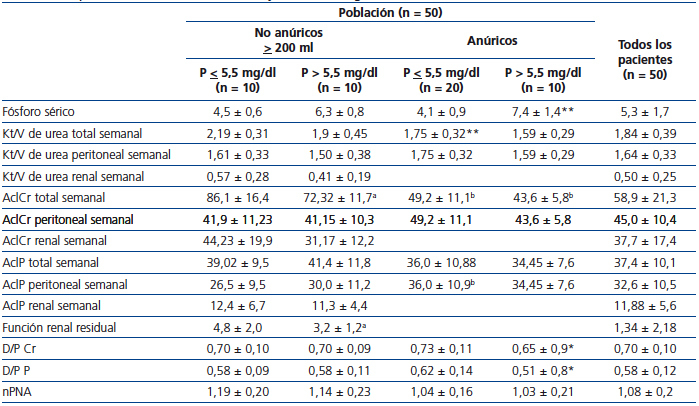
Al dividir los pacientes según la diuresis y subdividir cada grupo en normofosfatemia e hiperfosfatemia (tabla 2), se puede observar que el promedio de fósforo sérico para pacientes anúricos con hiperfosfatemia fue significativamente superior a aquellos con hiperfosfatemia que conservaban diuresis (7,4 ± 1,4 mg/dl frente a 6,3 ± 0,8 mg/dl, p = 0,03). El D/P P fue significativamente menor en los pacientes anúricos con hiperfosfatemia, comparados con quienes tenían niveles de fósforo séricos normales (0,51 ± 0,8 frente a 0,62 ± 0,14, p = 0,006). Aunque el AclP total fue mayor en los pacientes con diuresis, comparados con el subgrupo de pacientes anúricos (40,2 ± 10,4 l/sem/1,73 m2 SC frente a 35,6 ± 9,6 l/sem/1,73 m2 SC, p = 0,12), esta no alcanzó una diferencia estadísticamente significativa. Sin embargo, el AclP peritoneal en anúricos fue significativamente mayor al compararlo con aquellos casos que conservaban diuresis (35,5 ± 9,8 l/sem/1,73m2 SC frente a 28,3 ± 10,25 l/sem/1,73 m2 SC, p = 0,01). La función renal residual fue significativamente menor en quienes tenían hiperfosfatemia, comparados con los normofosfatémicos (3,2 ± 1,2 ml/min frente a 4,8 ± 2,0 ml/min, p = 0,048).
Excreción de fósforo
Se evaluó también la posible asociación entre la excreción total y peritoneal de fósforo con los AclCr y AclP total y peritoneal, encontrándose lo siguiente: la excreción de fósforo total mostró mejor correlación con el AclP total (r = 0,62, p < 0,05) que con el AclCr total (r = 0,360, p < 0,05). La excreción de fósforo peritoneal tuvo también una mejor correlación con el AclP peritoneal (r = 0,687, p < 0,05) en comparación con el AclCr peritoneal (r = 0,466, p < 0,05). Finalmente, en pacientes con un Kt/V de urea ≥ 1,7 la correlación entre el AclP total y la excreción de fósforo total fue significativa (r = 0,643, p < 0,05), no así entre el AclCr total y la excreción de fósforo total (r = 0,222, p = 0,23).
Categorización del transporte de fósforo
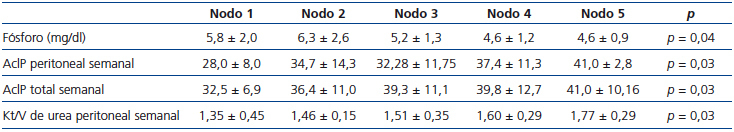
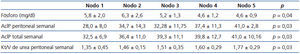
Con base en la distribución del D/P P mediante el método CHAID, se realizó un árbol de clasificación, obteniéndose los siguientes nodos con sus respectivos rangos: nodo 1: ≤ 0,5, nodo 2: 0,51-0,55, nodo 3: 0,56-0,66, nodo 4: 0,67-0,76, nodo 5: > 0,76, encontrándose diferencias estadísticamente significativas entre nodos en cuanto a niveles séricos de fósforo, AclP total y peritoneal, así como Kt/V de urea (tabla 3).
DISCUSIÓN
La remoción de fósforo es resultado de la compleja interacción entre difusión, convección, factores osmóticos y químicos, gradientes eléctricos, así como por transportadores activos de fósforo transmemabrana19,20. Se ha demostrado que la absorción por convección linfática no tiene impacto y que las soluciones con mayor concentración remueven mayor cantidad de fósforo, atribuyéndose al factor convección. Sin embargo, no se ha podido establecer de manera cierta si el ultrafiltrado influye en la remoción21. Messa et al. demostraron en 35 pacientes que la concentración de glucosa era uno de los predictores para remoción de fósforo y este era independiente del volumen de ultrafiltrado22, mientras que Granja et al. calcularon que el 11 % del fósforo removido era debido al ultrafiltrado23.
En nuestra población encontramos que la frecuencia de hiperfosfatemia es del 31,3 %, lo cual es similar a lo comunicado en la literatura7. En estudios previos se encontró adecuada correlación entre D/P Cr y D/P P, así como entre AclCr y AclP, sugiriendo equivalencia entre ellos12,13. En este estudio demostramos que, aunque el D/P Cr y el D/P P muestran adecuada correlación, la concordancia es pobre, puesto que los límites de concordancia son muy amplios, por lo que, al tener una variabilidad tan grande del D/P Cr o el AclCr respecto a los parámetros de fósforo, se tendría un impacto muy importante en el aclaramiento, la excreción y por ende los niveles séricos de fósforo, por lo cual dichas mediciones no pueden considerarse como equivalentes. Por ejemplo, un paciente con un D/P P de 0,4 podría tener un D/P Cr desde 0,16 y hasta 0,94, valores que difieren por mucho del valor del D/P P. Asimismo, un paciente con un AclP de 35 l/sem/1,73 m2 SC podría tener un AclCr desde 13,32 l/sem/1,73 m2 SC y hasta 102,12 l/sem/1,73 m2 SC. Dada la pobre concordancia que existe entre los valores estudiados y que no pueden tomarse como subrogados, proponemos un árbol de clasificación del transporte de fósforo de cinco nodos con base en su D/P P, entre los que se identificaron diferencias estadísticamente significativas entre grupos para el AclP total y peritoneal.
En nuestros resultados se confirma el papel de la diuresis para mantener los niveles de fósforo en valores menores comparados con los anúricos. Es en los anúricos, en quienes el peritoneo tiene el papel exclusivo en la remoción del fósforo, en quienes es especialmente importante la determinación de los indicadores del transporte de fósforo por dos factores: 1) el D/P P es significativamente menor en los pacientes hiperfosfatémicos; 2) el AclP peritoneal es significativamente mayor comparado con los que conservan diuresis (tabla 2).
Las recomendaciones actuales para la prescripción de diálisis peritoneal de acuerdo con las guías clínicas K/DOQI 200624, basadas en los resultados de tres grandes estudios25-27, fijan una meta de Kt/V de urea ≥ 1,7, que no ha logrado reducir la mortalidad en esta población. Por ello, la búsqueda de nuevos marcadores o metas es de suma importancia. Las recomendaciones actuales son mantener el nivel de fósforo en los límites normales28, aunque esto resulta un reto arduo para el paciente y el médico, pues, más allá de la restricción dietética y el uso de quelantes de manera adecuada, el clínico debe conocer el papel que la diálisis ejerce sobre el AclP. Este estudio demuestra la independencia que tiene el transporte de fósforo del mostrado por urea y creatinina y abre una serie de interrogantes como la dosis de AclP necesaria para acercar a los pacientes a las metas de fósforo sérico, si difiere este valor en pacientes con diuresis y anúricos, si el ajuste de la diálisis para lograr una meta establecida de AclP mejora la mortalidad comparado con las metas de Kt/V de urea actuales, o si un D/P P bajo está asociado a mayor mortalidad, entre otras. Por ello deben realizarse estudios para determinar los beneficios de la adecuación de la diálisis peritoneal basados en el D/P P con diferentes dosis de AclP, establecer la morbimortalidad a mediano y largo plazo, y así compararlos con las actuales recomendaciones de diálisis.
CONCLUSIONES
Este estudio demuestra que las mediciones de D/P P y AclP no concuerdan con las de D/P Cr y AclCr, respectivamente, a pesar de tener una adecuada correlación. Por ello, ante el actual desconocimiento del transporte de fósforo en diálisis peritoneal en la práctica clínica, en un grupo de pacientes en el que el control de la fosfatemia es imperativo, es necesario dar continuidad a la investigación de estos indicadores, puesto que son herramientas útiles para el clínico y pueden guiar la prescripción de diálisis en la búsqueda de un mejor control del fósforo sérico.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Características de la población: manejo médico y dialítico
Tabla 2. Transporte de solutos, dosis de diálisis y fosfatemia según uresis residual
Tabla 3. Fósforo y características de aclaramiento entre nodos de transporte
Figura 1. Correlación entre el índice dializante/plasma de creatinina y el índice dializante/plasma de fósforo.
Figura 3. Concordancia entre el aclaramiento de creatinina y el aclaramiento de fósforo.
Figura 2. Concordancia entre el índice dializante/plasma de creatinina y el índice dializante/plasma de fósforo.