Los varones con enfermedad renal crónica cursan a menudo con deficiencia en testosterona. Se desconoce si el déficit de testosterona que acompaña a la pérdida de función renal se asocia con el tipo de tratamiento sustitutivo de la función renal.
MétodosEl estudio de corte transversal incluyó 79 varones prevalentes en diálisis, 43 en hemodiálisis (HD) y 36 en diálisis peritoneal (DP). Con una edad media de 69 años, el 31,6% eran diabéticos. Se evaluaron los niveles de testosterona endógena (inmunoluminiscencia: N 3-10,5ng/ml), marcadores nutricionales/inflamatorios, marcadores de metabolismo óseo mineral, anemia, tipo de técnica y permanencia. La composición corporal fue estimada mediante bioimpedancia vectorial y espectroscópica. Se considera déficit de testosterona cuando los niveles son inferiores a 3ng/ml.
ResultadosLos niveles de testosterona medios fueron 8,81±6,61ng/ml. El 39,5% de los pacientes en HD y el 5,6% de los de DP presentaban déficit de testosterona. Los niveles de testosterona se correlacionaron directamente con el tipo de técnica, HD (rho Spearman 0,366; p < 0,001) y el tiempo de permanencia (Rho −0,412; p=0,036) en el análisis univariante y solo con la técnica de HD en el multivariante. No se encontraron otras correlaciones significativas.
ConclusionesLos niveles circulantes de testosterona en hombres en diálisis se asocian de manera independiente con la técnica de HD. Se puede concluir que, en la reducción de testosterona que acompaña de manera natural a la pérdida de masa muscular e inflamación, se asocia un nuevo factor que es la técnica dialítica. Se necesitan estudios para elucidar si la técnica per se favorece la eliminación de testosterona.
Testosterone deficiency is a prevalent condition in male patients with chronic kidney disease. However, it is not known whether the type of renal replacement therapy has an impact on testosterone deficiency that accompanies loss of renal function.
MethodsThe cross-sectional study enrolled 79 prevalent male patients on dialysis; 43 on haemodialysis (HD) and 36 on peritoneal dialysis (PD). The median age was 69 years and 31.6% were diabetics. Endogenous testosterone levels were measured by immunoluminescence assay (normal range 3–10.5ng/ml), while nutritional/inflammatory markers, bone and mineral metabolism markers, anaemia, type of dialysis technique and time on dialysis were also assessed. Body composition was evaluated by bioimpedance vector analysis and bioimpedance spectroscopy. Testosterone deficiency was defined as levels below 3ng/ml.
ResultsMean testosterone levels were 8.81±6.61ng/ml. Testosterone deficiency affected 39.5% of HD patients and only 5.6% of PD patients. In the univariate analysis, testosterone levels were directly correlated with type of dialysis technique (HD) (Rho Spearman 0.366; P<.001) and time on dialysis (Rho −0.412; P=.036) and only with the HD technique in the multivariate analysis. No other significant correlations were found.
ConclusionsCirculating testosterone levels in men on dialysis were independently associated with HD technique. It can be concluded that a new factor —namely the dialysis technique— may be associated with falling testosterone levels and the associated loss of muscle mass and inflammation. Further studies are needed to establish whether the dialysis technique itself triggers testosterone elimination.
En el déficit de testosterona en los varones están involucrados varios mecanismos entre los que, además de la disminución de la producción de la hormona, se encuentran los relacionados con las alteraciones del eje hipotálamo-hipofisario y los relacionados con la forma de almacenamiento y transporte de la hormona. En el caso de los pacientes mayores con algún tipo de hipogonadismo, hay que considerar situaciones como la desnutrición, ya que, al ser la testosterona transportada en su mayor parte ligada a una proteína y con solo una pequeña parte circulando en forma libre, podrían influir en su déficit. Así mismo, la situación de toxicidad propia de la uremia podría intervenir en su déficit.
En la enfermedad renal crónica (ERC) existe un cierto grado de hipogonadismo y el déficit androgénico se considera una situación común en los pacientes renales. La progresión de la insuficiencia renal lleva a una disfunción sexual progresiva, que no parece corregir el tratamiento con diálisis. Por otro lado, el déficit de testosterona, hormona anabólica que juega un importante papel en la síntesis muscular, se correlaciona con el empeoramiento de la ERC y está inversamente asociado con la disfunción endotelial y la posibilidad de eventos cardiovasculares1. Los bajos niveles de testosterona en los pacientes renales crónicos pueden estar implicados, no solo en la disminución de la libido y en la disfunción eréctil en los varones2, sino en fenómenos de alteraciones cognitivas3, anemia4, disfunción endotelial, enfermedad cardiovascular5 y aumento de la mortalidad6.
El déficit de testosterona agravado por la edad se ha relacionado con el desarrollo de aterosclerosis, que podría acentuarse si existe además daño renal, de forma que se considera que ese déficit hormonal podría estar presente en entre el 26 y el 66% de los pacientes con diferentes grados de lesión de la función renal2. Se desconoce si este déficit asociado a la pérdida de función renal se correlaciona con las características clínicas de pérdida de masa muscular en varones con ERC avanzada. Los trabajos existentes hasta la actualidad se han centrado en el déficit de testosterona en el paciente renal crónico en hemodiálisis (HD) y su relación con la edad, la anemia, frecuencia de eventos cardiovasculares y mortalidad, pero son anecdóticos los estudios sobre los niveles de testosterona en los pacientes en diálisis peritoneal (DP) y la repercusión que el déficit de testosterona puede tener sobre la composición corporal, fuerza muscular y nutrición, en general.
El objeto del estudio que presentamos es la evaluación de los niveles de testosterona en pacientes en DP y HD, analizando la influencia que puedan tener estas técnicas en los niveles de testosterona.
Pacientes y métodosEstudio observacional de cohortes con 79 enfermos varones prevalentes en diálisis, estables durante más de 6 meses, con estancia en HD de 80,4±15 meses y de 32,6±27,7 meses en los pacientes en DP (p<0,001). Un total de 43pacientes con edad de 68,84±13,22 años se trataban con HD y tenían pauta de tratamiento de12 h semanales, ninguno en técnica on line. De ellos, 36pacientes de 60,5±15,6 años de edad (sin diferencia estadística con HD) eran tratados con DP, 13 (36,1%) con DP continua ambulatoria y 23 (63,9%) con técnica automatizada. El 19% de los pacientes en DP y el 41,9% de los tratados con HD eran diabéticos (p=0,03). La adecuación de diálisis se realizó en los pacientes en HD en la sesión de mitad de semana una vez al mes. En los de DP se realizó mediante Kt/v semanal y la función renal residual, mediante el aclaramiento medio de urea y creatinina.
Se excluyeron 4 pacientes que recibían tratamiento hormonal para neoplasia de próstata.
En todos los pacientes se evaluó los niveles de testosterona endógena por inmunoluminiscencia, se consideraron niveles normales entre 3 y 10,5ng/ml. Se consideró déficit de testosterona cuando los niveles eran inferiores a 3ng/ml. Se estudiaron marcadores nutricionales e inflamatorios que incluían albúmina sérica, prealbúmina, tasa de catabolismo proteico (nPNA) y proteína C reactiva. Otros parámetros analíticos estudiados fueron fósforo, hemoglobina, 25OH vit D y hormona paratiroidea (PTHi).
La composición corporal fue estimada mediante bioimpedancia vectorial (BIVA) y por bioimpedancia espectroscópica (BIS). Las mediciones de BIVA se realizaron en los pacientes en HD al final de la sesión de mitad de semana, y en los pacientes en DP a primera hora de la mañana, con el abdomen lleno de líquido de diálisis, empleando una corriente sinusoidal alterna de 800 A a 50 kHz, con una técnica tetrapolar total estándar (EFG Impedance Analyzer; Akern, Florence, Italia). La bioimpedancia fue realizada en condiciones estandarizadas: ambiente tranquilo, con temperatura de 22-24°C, en posición de decúbito supino al final de la sesión de HD en el lado contralateral al acceso vascular en el caso de FAVI, e indistintamente en el caso de los catéteres.
La BIS se realizó con un monitor portable para bioimpedancia total corporal BCM (Fresenius Medical Care D, GmbH). La resistencia y la reactancia se midieron con el BCM a 50 frecuencias diferentes, cubriendo un espectro de frecuencia de 5 a 1.000 kHz. Se determinaron las resistencias intra- y extracelular.
Los parámetros estudiados por bioimpedancia incluyeron el estatus nutricional de masa libre de grasa, masa magra y masa muscular.
El análisis estadístico se realizó con el programa estadístico SPSS 21 (SPSS Inc, Chicago Il, EE. UU.) para Windows. La edad se expresa como mediana. Los datos epidemiológicos se expresan con media±desviación estándar. Se consideró la significación estadística con una p<0,005. Se estableció la normalidad de la muestra con el test de Kolmorogov-Smirnov. Las variables categóricas no paramétricas se evaluaron mediante el test de Chi-cuadrado. Las comparaciones entre los grupos de testosterona se establecieron mediante los test de Student para las variables continuas con distribución normal y de Mann-Whitney para las variables continuas sin distribución normal. Al ser el tamaño muestral pequeño, en cada una de las técnicas de diálisis (HD y DP) se utilizó la correlación de Spearman para establecer la relación entre los niveles de testosterona con parámetros antropométricos, marcadores nutricionales, parámetros de composición corporal, marcadores de metabolismo óseo mineral, marcadores inflamatorios y tiempo de permanencia en cada una de las técnicas. El análisis univariante y multivariante se utilizó para establecer la asociación de independencia entre la testosterona y 2 de las variables dependientes: tiempo en diálisis y técnica de diálisis.
Ya que el valor de la variable proteína C reactiva tiene una distribución no normal, el Ln de la variable fue calculado y usado en el análisis multivariante. Se utilizó la regresión logística binaria con la variable dependiente déficit de testosterona y las variables que resultaron significativas en el análisis univariante.
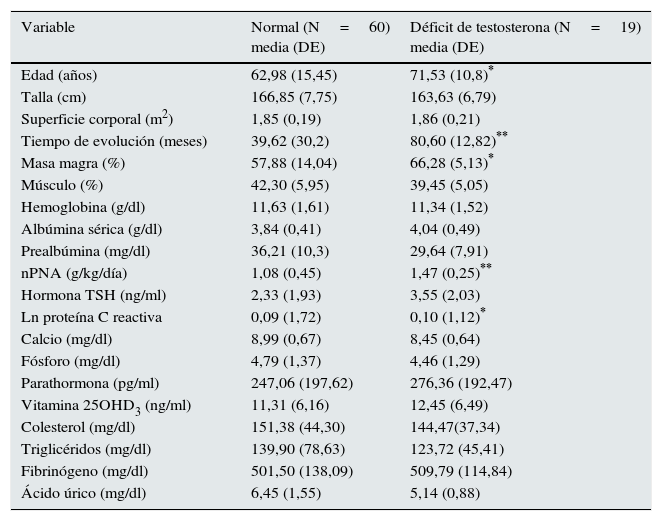
ResultadosDe los pacientes estudiados, 19 (21,4%) evidenciaron déficit de testosterona, de los cuales 17 pertenecían al grupo de HD y 2 al de DP. Los pacientes en HD eran mayores, pero sin diferencia significativa. La descripción de la población estudiada se muestra en la tabla 1. Los niveles de testosterona en DP eran de 10,84±4,67 frente a 7,18±6,7ng/ml en HD (p<0,001). En general, a medida que disminuían los tertiles de testosterona, los pacientes eran mayores, con cifras normales de testosterona los pacientes más jóvenes y con déficit los más añosos (datos no mostrados). Al comparar los valores de testosterona entre pacientes diabéticos y no diabéticos, los primeros mostraban datos inferiores de la hormona (6,58±5,5 vs. 9,9±6,1ng/ml; p=0,024). En la tabla 1 se dan los valores de los parámetros estudiados en el total de pacientes, donde destacan las diferencias en relación con los niveles de testosterona por debajo de 3ng/ml. Las diferencias significativas se aprecian, como era de esperar, con la edad, pero también con el tiempo de evolución en diálisis, aunque sin diferencias estadísticas cuando se separan los pacientes según la técnica de diálisis. La función renal residual no influyó en los niveles de testosterona.
Estadísticos descriptivos de 79 pacientes (HD+DP) estratificados de acuerdo con la presencia de hipogonadismo
| Variable | Normal (N=60) media (DE) | Déficit de testosterona (N=19) media (DE) |
|---|---|---|
| Edad (años) | 62,98 (15,45) | 71,53 (10,8)* |
| Talla (cm) | 166,85 (7,75) | 163,63 (6,79) |
| Superficie corporal (m2) | 1,85 (0,19) | 1,86 (0,21) |
| Tiempo de evolución (meses) | 39,62 (30,2) | 80,60 (12,82)** |
| Masa magra (%) | 57,88 (14,04) | 66,28 (5,13)* |
| Músculo (%) | 42,30 (5,95) | 39,45 (5,05) |
| Hemoglobina (g/dl) | 11,63 (1,61) | 11,34 (1,52) |
| Albúmina sérica (g/dl) | 3,84 (0,41) | 4,04 (0,49) |
| Prealbúmina (mg/dl) | 36,21 (10,3) | 29,64 (7,91) |
| nPNA (g/kg/día) | 1,08 (0,45) | 1,47 (0,25)** |
| Hormona TSH (ng/ml) | 2,33 (1,93) | 3,55 (2,03) |
| Ln proteína C reactiva | 0,09 (1,72) | 0,10 (1,12)* |
| Calcio (mg/dl) | 8,99 (0,67) | 8,45 (0,64) |
| Fósforo (mg/dl) | 4,79 (1,37) | 4,46 (1,29) |
| Parathormona (pg/ml) | 247,06 (197,62) | 276,36 (192,47) |
| Vitamina 25OHD3 (ng/ml) | 11,31 (6,16) | 12,45 (6,49) |
| Colesterol (mg/dl) | 151,38 (44,30) | 144,47(37,34) |
| Triglicéridos (mg/dl) | 139,90 (78,63) | 123,72 (45,41) |
| Fibrinógeno (mg/dl) | 501,50 (138,09) | 509,79 (114,84) |
| Ácido úrico (mg/dl) | 6,45 (1,55) | 5,14 (0,88) |
* p < 0,05; ** P < 0,001.
Los valores de la hemoglobina son similares con normalidad o con testosterona deficitaria. Dentro de los datos analíticos de nutrición solo la prealbúmina mantiene valores más bajos en los pacientes con déficit de testosterona, mientras que la albúmina sérica y el nPNA muestran valores más altos en los pacientes con déficit hormonal. La proteína C reactiva se muestra más alta en los pacientes con normalidad en los valores de testosterona. Este hallazgo se sigue manteniendo solo en los pacientes en HD al separar los enfermos según la técnica de diálisis. El fósforo y el PTHi no parecen modificarse con el déficit de testosterona, y la vitamina D está en niveles bajos en todos los pacientes, con o sin déficit de la hormona. Donde sí se observa diferencia entre los pacientes con niveles normales o deficitarios de testosterona es en los datos obtenidos por bioimpedancia, que reflejan que, con una superficie corporal semejante, los pacientes con déficit de la hormona tienen valores significativamente más altos de masa magra (tabla 1), mientras que en los porcentajes de masa grasa y músculo no hay diferencias. En el análisis por separado por técnicas de diálisis de los mismos datos no se aprecian diferencias en ninguno de los parámetros medidos por bioimpedancia. Tampoco hubo diferencia significativa en los niveles de testosterona entre las 2técnicas de DP (DPCA y DPA) (12,29±4,9 vs. 10,07±4,43 ng/ml). Mediante el test de chi-cuadrado y el test de Fisher se compararon los niveles de testosterona (0 normal/1 déficit) con status diabético y técnicas de diálisis: resultó significativa la técnica de HD (p<0,001). En la regresión logística binaria resultó significativo el tiempo en diálisis (OR: 1,057; IC 95%: 1,004-1,13); la técnica de hemodiálisis (OR: 11,15; IC: 2,355-52,453).
DiscusiónCon las implicaciones que, por todo lo expuesto, el déficit de testosterona puede tener en los pacientes con ERC en diálisis, y la importancia que la disfunción sexual tiene en su calidad de vida7, el estudio de nuestros pacientes varones divididos según la técnica de tratamiento dialítico aprecia que un importante porcentaje de pacientes presentan ese déficit hormonal. Estos datos ya se habían observado en un estudio con pacientes tratados solo con HD8 e incluso en otro trabajo con pacientes en las 2técnicas, pero en el que no se daban niveles comparativos de testosterona entre HD y DP9. Un hallazgo importante de nuestro estudio es que los pacientes en DP tienen niveles de testosterona más altos que en HD, con un porcentaje muy pequeño de pacientes en DP que muestran valores por debajo de la normalidad: por ello, estos resultados son los únicos que parecen mostrar, hasta la fecha, la influencia de una técnica sustitutiva renal implicada en el desarrollo de hipogonadismo. Los factores descritos como clásicos en el déficit de testosterona en la población general, como la edad3 y la diabetes mellitus5, tienen la misma significación en los pacientes con ERC en diálisis, y así se observa también en nuestros resultados. Sin embargo, cuando se compara en nuestros pacientes la edad separando las técnicas de diálisis, no hay diferencia significativa en la edad entre los pacientes con déficit de testosterona o con normalidad de niveles ni en HD ni en DP, ni tampoco respecto a la DM como demuestra el análisis multivariante. Nuestros datos indican que los pacientes con mayor tiempo de evolución en diálisis tienen cifras de testosterona más bajas que los que llevan en diálisis menos tiempo, pero, de nuevo, al comparar el tiempo de evolución de los pacientes separando las técnicas, ni en HD ni en DP hay diferencias en ese parámetro, exista o no déficit de testosterona. De cualquier forma, la pregunta obligada es si la técnica de diálisis puede condicionar una salida de testosterona con el dializado y esa ser la causa más importante en la diferencia encontrada entre HD y DP. No existe en la literatura ningún estudio que haya investigado la pérdida a través de la diálisis con las 2técnicas. Únicamente un trabajo realizado solo con pacientes en HD10 muestra la cantidad de la hormona aclarada en una sesión de 4 h de HD, pero no sabemos si en DP el aclaramiento es diferente: eso podría llevar a los mayores niveles de testosterona hallados en nuestro estudio en estos pacientes. Cabría formular una posible explicación por las mayores pérdidas proteicas que se producen en DP, que podrían justificar una mayor eliminación de la fracción de testosterona unida a proteínas, lo que alteraría la proporción de testosterona ligada a proteínas e incrementaría en estos pacientes la fracción que circula libre.
La relación descrita de déficit de testosterona con el desarrollo de anemia y la menor respuesta de la anemia al tratamiento con factores eritropoyéticos en pacientes en HD2,4,6 no se confirma en nuestros pacientes en diálisis, en los que los niveles de hemoglobina son similares con o sin déficit de testosterona.
Los resultados del estudio de composición corporal encontrados en nuestros pacientes en diálisis con el empleo de bioimpedancia muestran la relación existente entre déficit de testosterona y mayor porcentaje de masa magra que, curiosamente, se acompaña de mayor ingesta proteica e incluso una tendencia a niveles más elevados de albúmina en estos pacientes. Pero sería aventurado afirmar que el déficit de testosterona pudiera influir en un mantenimiento del apetito que condicionara estos hallazgos. En relación con esto, un trabajo reciente11 muestra que el déficit androgénico cuenta en la disminución de la masa magra, pero en los pacientes que recibían testosterona diariamente como suplemento se observaba una reducción de su masa magra. Lógicamente, al analizar alguno de los datos por separado en HD y DP, y al existir solo 2 pacientes con déficit de testosterona en DP, es muy difícil valorar la significación estadística en su comparación. Según nuestros resultados, ni la vitamina D, ni la PTHi parecen tener relación con los niveles de testosterona. Los datos de proteína C reactiva significativamente más altos en los pacientes con niveles normales de testosterona sí parecen relacionados con un grado de inflamación mayor en los pacientes en HD. La inflamación es un hecho común en los pacientes con ERC y, en especial, en los que están en tratamiento sustitutivo con causas multifactoriales, ya que el fenotipo urémico se asocia a un estado de inmunodepresión que afecta tanto a la inmunidad innata como a la adaptativa, cuyo resultado final es la inflamación con aumento de la susceptibilidad a las infecciones. En nuestra serie no hemos podido descartar las causas de la inflamación y no parece que el déficit de testosterona per se sea causa o consecuencia de la inflamación12.
Dada la influencia del déficit de testosterona en los pacientes con ERC —que incluso puede influir en la mortalidad13— y, como se desprende de nuestros resultados, dada la importancia de ese déficit también en los tratados con diálisis, quizá deberíamos pensar en tratar con suplementos hormonales a nuestros pacientes3. Ya existe experiencia del aporte de suplementos de testosterona en pacientes con fallo cardiaco14 y de pacientes en HD10. El tratamiento con testosterona no está exento de riesgos, sobre todo en los más añosos, como son una gran mayoría de nuestros pacientes en diálisis. La toxicidad hepática, el riesgo de cáncer de próstata y la retención de volumen son algunos de ellos y, como hemos comentado en otro sitio15, el empleo de la suplementación de testosterona, aunque es considerado seguro, en pacientes con ERC necesita de mayor evidencia.
La medición de la cantidad de hormona eliminada con DP, no realizada en nuestro estudio, puede ser útil en la evaluación de si esta técnica de diálisis puede colaborar en el mantenimiento de niveles más altos de testosterona, con las implicaciones que ello podría suponer.
Nuestro estudio tiene 2 importantes limitaciones y, por tanto, los resultados deberán ser tomados con cautela. Una es debida al tamaño de la muestra, que es insuficiente para aseverar con rotundidad que la técnica de HD es responsable per se del déficit de testosterona y del tiempo de permanencia en esta técnica y otra es la imposibilidad técnica de determinar los niveles de testosterona en el líquido dializante y en efluente peritoneal.
En conclusión, los pacientes en diálisis presentan un déficit de testosterona que podría estar en relación con alguna de las complicaciones que presentan. Los pacientes en DP presentan en su mayoría niveles normales de la hormona en comparación con los pacientes tratados con HD. Los tratados mediante esta última evidencian un alto riesgo de déficit de testosterona, así como los pacientes que llevan más largo tiempo. Si la diferencia estriba en la cantidad de testosterona liberada con la técnica de diálisis o con algún mecanismo de menor pérdida hormonal relacionado con la naturaleza más fisiológica de la DP es motivo para profundizar la investigación en estos aspectos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.