La anemia es frecuente en los pacientes en hemodiálisis, y su tratamiento con estimulantes de la eritropoyesis (AEE) resulta complejo debido a múltiples factores.
ObjetivosValorar la utilidad del modelo de control de anemia (MCA) en el tratamiento de la anemia en hemodiálisis.
MétodosEl MCA es un software que predice la dosis óptima de darbepoetina y hierro sacarosa para alcanzar niveles de hemoglobina (Hb) y ferritina deseados, emitiendo sugerencias de prescripción. Estudio realizado en clínicas de diálisis de 18 meses de duración en dos fases de intervención (FI) con MCA (FI1, n:213; FI2, n:218) separadas por una fase de control (FC, n:219). El resultado primario fue el porcentaje de Hb en rango y la mediana de dosis de AEE y los resultados secundarios fueron las transfusiones, las hospitalizaciones o los acontecimientos cardiovasculares. Análisis a nivel de clínica y de pacientes valorando la variabilidad de la Hb mediante la desviación estándar (DE) de esta. También se analizaron pacientes con la mayoría de sugerencias confirmadas (grupo MCA cumplidores)
ResultadosEl MCA aumentó el porcentaje de Hb en rango: 80,9% FI2 frente a 72,7% en FC, y redujo el consumo de darbepoetina (FI1: 20 [70]; FC 30 [80] μg, p=0,032) con menor fluctuación de la Hb (0,91±0,49 en FC a 0,82±0,37g/dl en FI2; p<0,05) mejorando en el grupo MCA cumplidores. En cuanto a los resultados secundarios, descendieron con el uso del MCA.
ConclusionesEl MCA ayuda a obtener mejores resultados de anemia en los pacientes en hemodiálisis, minimizando los riesgos del tratamiento con AEE y reduciendo costes.
Anaemia is common in haemodialysis patients and treating it with erythropoiesis-stimulating agents (ESAs) is complex due to many factors.
ObjectivesTo assess the usefulness of the Anaemia Control Model (ACM) in the treatment of anaemia in haemodialysis.
MethodsACM is a software that predicts the optimal dose of darbepoetin and iron sucrose to achieve target haemoglobin (Hb) and ferritin levels, and makes prescription suggestions. Study conducted in dialysis clinics lasting 18months with two intervention phases (IPs) with ACM (IP1, n:213; IP2, n:218) separated by a control phase (CP, n:219). The primary outcome was the percentage of Hb in range and the median dose of ESAs, and the secondary outcomes were transfusion, hospitalisation and cardiovascular events. Clinical and patient analyses were performed. Hb variability was assessed by the standard deviation (SD) of the Hb. We also analysed the patients with most of the suggestions confirmed (ACM compliant group).
ResultsACM increased the percentage of Hb in range: 80.9% in IP2, compared with 72.7% in the CP and reduced the intake of darbepoetin (IP1: 20 [70]; CP 30 [80] μg P=0.032) with less Hb fluctuation (0.91±0.49 in the CP to 0.82±0.37g/dl in IP2, P<0.05), improving in the ACM compliant group. The secondary outcomes decreased with the use of ACM.
ConclusionsACM helps to obtain better anaemia results in haemodialysis patients, minimising the risks of treatment with ESAs and reducing costs.
La presencia de anemia es una de las complicaciones más frecuentes de la enfermedad renal crónica (ERC), siendo su principal causa la deficiencia de eritropoyetina1,2.
El uso de agentes estimulantes de la eritropoyesis (AEE) para corregirla es una práctica ampliamente extendida que ha permitido, desde su inicio, mejorar la calidad de vida de los pacientes y disminuir la necesidad de transfusiones3-5.
Sin embargo, a día de hoy, el manejo de la anemia renal por parte del nefrólogo es todo un desafío, debido a la complejidad del escenario clínico y a la heterogeneidad de la población renal.
A raíz de la evidencia científica publicada en los últimos años en relación con la seguridad cardiovascular de los pacientes tratados con AEE6-10, las guías vigentes, recomiendan utilizar la mínima dosis necesaria para evitar el uso de transfusiones y mantener los niveles de hemoglobina (Hb) entre el estrecho rango terapéutico de 10 y 12g/dl, condición que complica más el escenario2,11,12.
Es conocido que, a pesar del esfuerzo continuo por mantener estos niveles estables, dentro de los márgenes de Hb recomendados la mayoría de los pacientes tratados con AEE experimentan algún grado de fluctuación de los niveles de Hb a lo largo del tiempo13-16.
Esta variabilidad parece no ser despreciable. Ebben et al.15 describen que a lo largo de un seguimiento de 6meses solo un 10% de los pacientes mantenían niveles de Hb entre un rango específico y el 90% restante experimentaban algún grado de fluctuación entre los diferentes rangos establecidos. Fluctuaciones cíclicas de la Hb también fueron descritas en un 90% de los pacientes analizados por Fishbane y Berns17 Aunque controvertido, la variabilidad de la Hb se ha relacionado con peores resultados clínicos, principalmente en pacientes en hemodiálisis15,18-20, existiendo actualmente dudas acerca de su definición, cuantificación18,19,21-23, causas y significado clínico24-30.
Otro problema importante en este escenario son los regímenes de dosis y la resistencia a los AEE. Utilizar la menor dosis necesaria es conveniente para prevenir posibles efectos desfavorables derivados de dosis elevadas como hipertensión arterial, déficit de hierro o eventos trombóticos, y aunque controvertido pero no menos importante, progresión tumoral y de retinopatía diabética16,31. Esta situación no siempre es posible debido a la presencia de resistencia a los AEE presente en aproximadamente el 10 al 20% de los pacientes con ERC avanzada y asociada a diferentes patologías intercurrentes así como a un estado inflamatorio crónico32-34. A día de hoy existe escasez de evidencia científica y ausencia de protocolos clínicos sobre cuál es la estrategia más óptima para tratar la anemia y el déficit de hierro. Algunos autores apuntan a monitorizaciones más frecuentes de Hb para lograr reducir la variabilidad y el consumo de AEE, teniendo en cuenta la pérdida de sangre y los costes que conlleva esta práctica; la evidencia científica actual no es suficiente para formular recomendaciones clínicas35,36.
Según estudios de los últimos años, la utilización de modelos computarizados de anemia basados en algoritmos predictivos podría mejorar el tratamiento de la anemia en pacientes en hemodiálisis37-39.
Recientemente se ha publicado en Kidney International un estudio retrospectivo, internacional, en el que hemos participado, donde se usa un modelo de inteligencia artificial para guiar el tratamiento de la anemia en pacientes en hemodiálisis40. En este estudio, el modelo de control de anemia (MCA) logra aumentar el porcentaje de pacientes con Hb en rango, disminuir considerablemente la variabilidad de la Hb y reducir los costes del tratamiento. A la vista de los excelentes resultados obtenidos pero existiendo cierto grado de discrepancia entre las recomendaciones de MCA y la visión del nefrólogo, decidimos realizar un estudio prospectivo para evaluar el impacto de la aplicación de MCA en nuestra población de pacientes en hemodiálisis.
Pacientes y métodosModelo de control de anemiaMCA es un software concebido como una herramienta de ayuda al clínico en la toma de decisiones en la prescripción de AEE y hierro para el tratamiento de la anemia renal en los pacientes en hemodiálisis. Es un modelo de red neuronal artificial que utiliza datos actualizados e individuales de pacientes y predice valores de Hb en función de estos a través de un algoritmo de prescripción de darbepoetina y hierro. MCA integra datos (a través de un módulo de interfase automático integrado en el sistema de datos clínicos de FMC, EuCliD®) antropométricos como sexo y talla que extrae del momento de admisión, los últimos datos analíticos que incluyen Hb, ferritina, índice de saturación de transferrina (IST), calcio, fósforo, sodio, potasio, leucocitos, proteína C reactiva (PCR), volumen corpuscular medio (VCM), hemoglobina corpuscular media (HCM) y albúmina, datos de la última sesión de diálisis como peso seco, peso prediálisis y Kt/V medido por Online Clearence Monitoring (OCM) y dosis de darbepoetina y hierro utilizadas en los últimos 90días, así también como el cambio de Hb respecto al mes previo.
Cada vez que MCA recoge una entrada de valor de Hb, el programa genera una sugerencia de prescripción de darbepoetina y de hierro sacarosa (Venofer®) en el caso de acompañarse de datos de cinética de hierro. Esta sugerencia es una recomendación que siempre requiere la validación del clínico para ser confirmada o rechazada. Si la sugerencia es rechazada, el clínico debe formular una prescripción diferente e indicar la causa de la no confirmación dentro de unos supuestos clínicos (Anexo). MCA considera temporalmente no elegibles para aplicar el modelo a pacientes en las siguientes situaciones: menores de 18años, admisión en la clínica menor a 90días, transfusión en los últimos 90días o número insuficiente de sesiones de diálisis (al menos 27 de las 39 esperadas), ya sea por hospitalización o por vacaciones.
Diseño del estudio y análisis estadísticoMCA se puso en marcha en las clínicas de diálisis de FMC Services Murcia de Cartagena y San Pedro del Pinatar en junio de 2014. El uso de MCA se interrumpió posteriormente durante 6meses (noviembre de 2014-abril de 2015) y se reanudó en mayo de 2015: el periodo de interrupción se considera la fase de control; por lo tanto, el estudio se llevó a cabo durante un total de 18meses (mayo de 2014-octubre de 2015). El primer período (mayo de 2014-octubre de 2014) se considera la fase de intervención 1, durante la que los nefrólogos utilizan el soporte MCA para el tratamiento de la anemia. El segundo período (noviembre de 2014-abril de 2015) se considera la fase de control, en la que el tratamiento de la anemia se lleva a cabo de manera tradicional sin el soporte MCA, con el método de ensayo-error para obtener cifras de Hb entre 10 y 12g/dl, según protocolo de las clínicas basado en las European Best Practice Guidelines for Anaemia in patients with Chronic Renal Failure41.
En el tercer período (mayo de 2015-octubre de 2015), o fase de intervención 2, los nefrólogos nuevamente utilizan el soporte MCA para el manejo de la anemia.
Durante el estudio se respetó el plan de analíticas preestablecido en ambas clínicas, midiendo Hb mensual y cinética de hierro bimensual (ferritina e IST). Por otro lado, los controles de pureza del agua fueron realizados también según protocolo de FMC, siendo similares en las diferentes fases del estudio y acordes con las recomendaciones de las guías de la Sociedad Española de Nefrología vigentes en ese momento sobre el líquido de diálisis42. Asimismo, tanto en la Clínica de Cartagena como en la de San Pedro del Pinatar se dispone de agua ultrapura para la realización de tratamientos de hemodiafiltración (HDF) online.
Los efectos del uso de MCA fueron evaluados de forma general a nivel de la clínica y a nivel del paciente.
A nivel de la clínica, se incluyeron todos los pacientes mayores de 18años con al menos un tratamiento de hemodiálisis y una determinación de Hb en cada una de las clínicas del estudio durante la fase de control o de intervención. De este modo, 213 pacientes se incluyeron en la fase de intervención1, 219 en la fase de control y 218 en la fase de intervención2. El porcentaje de valores de Hb en rango y la mediana de dosis de AEE administrada (expresada como dosis/paciente/kg/mes o dosis/paciente/mes) fueron el resultado primario. Se consideró Hb en rango a los valores de Hb comprendidos entre 10 y 12g/dl, o >12g/dl en ausencia de tratamiento con AEE (es decir, sin AEE desde al menos 35días antes de la medición).
Los resultados se calcularon para toda la población como una medida del impacto global de MCA. Además, se realizó un subanálisis centrado solo en las sugerencias de MCA confirmadas, es decir, se aislaron las mediciones de Hb y las dosis de fármacos que resultaron de las recomendaciones aceptadas.
El resultado secundario incluyó la necesidad de transfusión y la de hospitalización, la ocurrencia de eventos cardiovasculares o la muerte. Los eventos cardiovasculares se definieron como la presencia de alguna de las siguientes condiciones: muerte o aparición de patología cardiaca o cerebrovascular o ingresos debidos a esta causa.
Estos se identificaron extrayendo las entradas en la historia clínica identificadas por un código ICD-10 comprendido en el intervalo I00-I99, exceptuando los códigos de I80 a I89 relativos a enfermedades de las venas, vasos y nódulos linfáticos.
Para el análisis a nivel de pacientes, dentro de la cohorte definida anteriormente, se seleccionaron solo los pacientes con al menos 5 mediciones de Hb en el centro de diálisis estudiado durante la fase considerada. Este requerimiento fue motivado por la necesidad de tener un número relevante de mediciones de Hb para cada paciente y así poder evaluar la fluctuación de las mismas a lo largo del tiempo: 173 pacientes en la fase de intervención1; 184 pacientes en la fase de control; 188 pacientes en la fase de intervención2. La variabilidad individual de la Hb se estimó mediante la desviación estándar (DE) de la Hb en las tres fases.
Dado que durante las fases de intervención solo una porción de los valores de Hb resultó de las sugerencias aceptadas (no todos los pacientes fueron elegibles temporalmente para MCA), para evaluar de forma más precisa la contribución de MCA consideramos el porcentaje de valores de Hb en rango y el consumo de AEE discriminando cuando las sugerencias de MCA fueron confirmadas, rechazadas o nulas.
Los mismos parámetros se evaluaron también en la subpoblación de pacientes con mayoría de sugerencias aceptadas, es decir, los pacientes en los que la proporción de sugerencias confirmadas fuera al menos 2/3 (∼66%) (grupo MCA cumplidores: n=111 pacientes en la fase de intervención1, n=154 pacientes en la fase de intervención2).
Por último, los resultados primarios fueron analizados separadamente en grupos de pacientes según el acceso vascular (fístula arteriovenosa nativa, protésica o cáteter).
El análisis estadístico se realizó en Matlab®. Para comparar variables de distribución normal se utilizó el t-test, y el test de Wilcoxon para variables de distribución no normal. El test de Fisher se usó para proporciones. Los datos son expresados en media ±desviación estándar (DE) o mediana y rango intercuartílico (RIC) según la variable. Para todos los test, un valor de p<0,05 se consideró estadísticamente significativo.
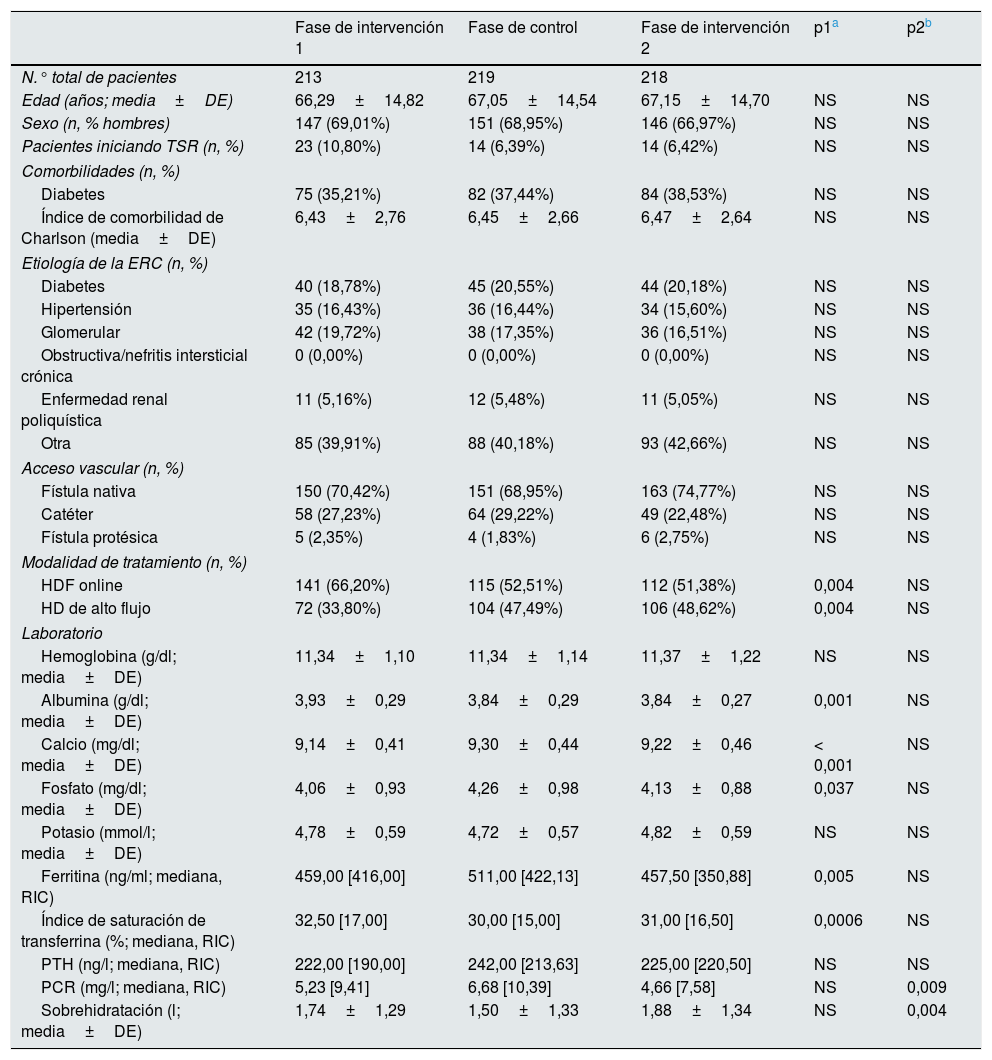
ResultadosResultados a nivel de centro de diálisisLa tabla 1 muestra las características basales de los pacientes con ERC en hemodiálisis que participaron en el estudio.
Características clínicas de la población estudiada en las distintas fases
| Fase de intervención 1 | Fase de control | Fase de intervención 2 | p1a | p2b | |
|---|---|---|---|---|---|
| N.° total de pacientes | 213 | 219 | 218 | ||
| Edad (años; media±DE) | 66,29±14,82 | 67,05±14,54 | 67,15±14,70 | NS | NS |
| Sexo (n, % hombres) | 147 (69,01%) | 151 (68,95%) | 146 (66,97%) | NS | NS |
| Pacientes iniciando TSR (n, %) | 23 (10,80%) | 14 (6,39%) | 14 (6,42%) | NS | NS |
| Comorbilidades (n, %) | |||||
| Diabetes | 75 (35,21%) | 82 (37,44%) | 84 (38,53%) | NS | NS |
| Índice de comorbilidad de Charlson (media±DE) | 6,43±2,76 | 6,45±2,66 | 6,47±2,64 | NS | NS |
| Etiología de la ERC (n, %) | |||||
| Diabetes | 40 (18,78%) | 45 (20,55%) | 44 (20,18%) | NS | NS |
| Hipertensión | 35 (16,43%) | 36 (16,44%) | 34 (15,60%) | NS | NS |
| Glomerular | 42 (19,72%) | 38 (17,35%) | 36 (16,51%) | NS | NS |
| Obstructiva/nefritis intersticial crónica | 0 (0,00%) | 0 (0,00%) | 0 (0,00%) | NS | NS |
| Enfermedad renal poliquística | 11 (5,16%) | 12 (5,48%) | 11 (5,05%) | NS | NS |
| Otra | 85 (39,91%) | 88 (40,18%) | 93 (42,66%) | NS | NS |
| Acceso vascular (n, %) | |||||
| Fístula nativa | 150 (70,42%) | 151 (68,95%) | 163 (74,77%) | NS | NS |
| Catéter | 58 (27,23%) | 64 (29,22%) | 49 (22,48%) | NS | NS |
| Fístula protésica | 5 (2,35%) | 4 (1,83%) | 6 (2,75%) | NS | NS |
| Modalidad de tratamiento (n, %) | |||||
| HDF online | 141 (66,20%) | 115 (52,51%) | 112 (51,38%) | 0,004 | NS |
| HD de alto flujo | 72 (33,80%) | 104 (47,49%) | 106 (48,62%) | 0,004 | NS |
| Laboratorio | |||||
| Hemoglobina (g/dl; media±DE) | 11,34±1,10 | 11,34±1,14 | 11,37±1,22 | NS | NS |
| Albumina (g/dl; media±DE) | 3,93±0,29 | 3,84±0,29 | 3,84±0,27 | 0,001 | NS |
| Calcio (mg/dl; media±DE) | 9,14±0,41 | 9,30±0,44 | 9,22±0,46 | < 0,001 | NS |
| Fosfato (mg/dl; media±DE) | 4,06±0,93 | 4,26±0,98 | 4,13±0,88 | 0,037 | NS |
| Potasio (mmol/l; media±DE) | 4,78±0,59 | 4,72±0,57 | 4,82±0,59 | NS | NS |
| Ferritina (ng/ml; mediana, RIC) | 459,00 [416,00] | 511,00 [422,13] | 457,50 [350,88] | 0,005 | NS |
| Índice de saturación de transferrina (%; mediana, RIC) | 32,50 [17,00] | 30,00 [15,00] | 31,00 [16,50] | 0,0006 | NS |
| PTH (ng/l; mediana, RIC) | 222,00 [190,00] | 242,00 [213,63] | 225,00 [220,50] | NS | NS |
| PCR (mg/l; mediana, RIC) | 5,23 [9,41] | 6,68 [10,39] | 4,66 [7,58] | NS | 0,009 |
| Sobrehidratación (l; media±DE) | 1,74±1,29 | 1,50±1,33 | 1,88±1,34 | NS | 0,004 |
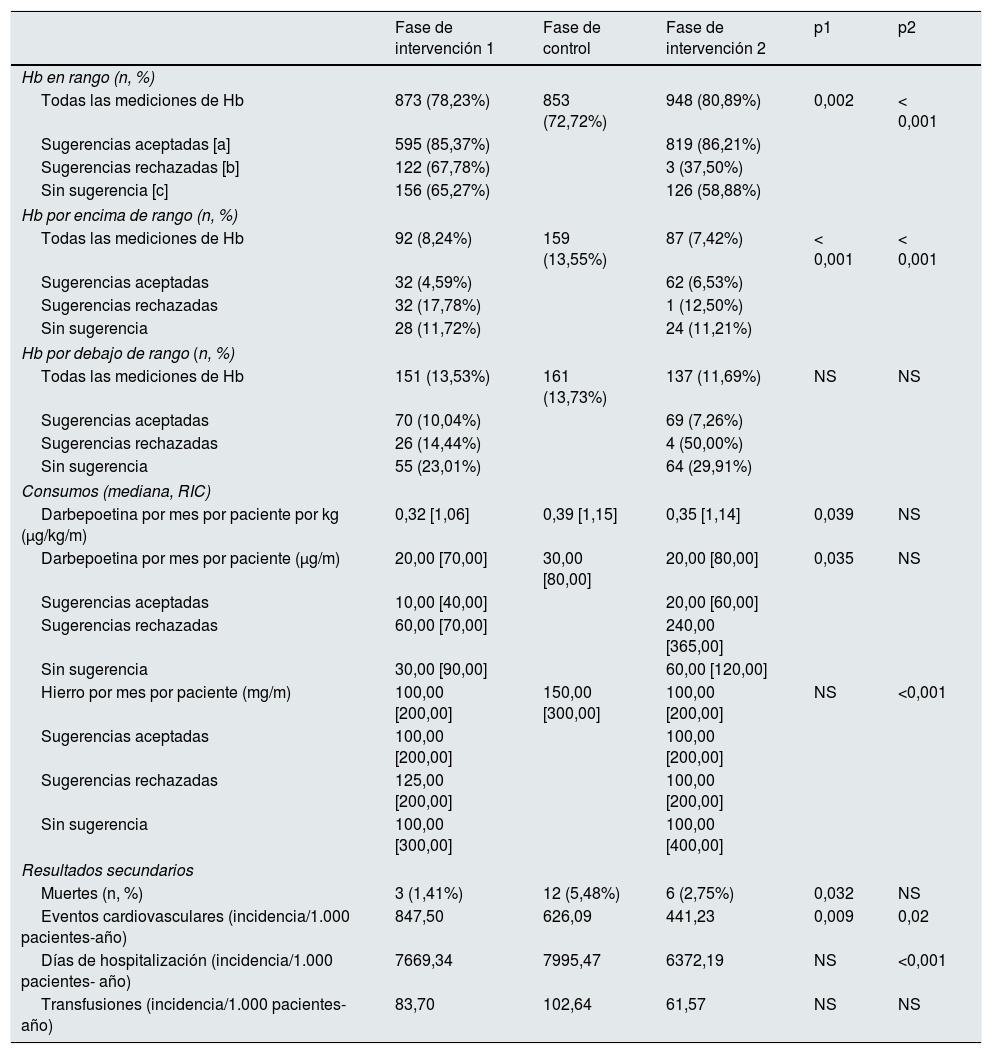
El resultado primario (porcentaje de Hb en rango y consumo de AEE) y el resultado secundario (muertes, hospitalizaciones, eventos cardiovasculares y transfusiones) se presentan en la tabla 2. Durante la fase de control, el consumo mensual de darbepoetina aumentó un 33% en toda la población (de 20μg/mes [70] en la fase de intervención1 a 30μg/mes [80], p=0,032) y se redujo nuevamente en la fase de intervención 2 pero sin llegar a la significación estadística (20μg/mes [80] p=NS), mientras que al mismo tiempo el porcentaje de valores de Hb en rango descendió un 5,5% (de 78,2 a 72,7%, p=0,002) y luego aumentó un 8,2% (de 72,7 a 80,9%, p<0,001) respectivamente con la reintroducción de MCA. Al analizar los resultados de sugerencias aceptadas, los dos parámetros mostraron una mejoría decisiva (85,4% de valores de Hb en rango con una mediana de uso de darbepoetina=10μg/mes [40] en la fase de intervención1 y 86,2% de valores de Hb en rango con una mediana de darbepoetina=20μg/ mes [60] en la fase de intervención2).
Resultados primarios y secundarios a nivel de centro de diálisis
| Fase de intervención 1 | Fase de control | Fase de intervención 2 | p1 | p2 | |
|---|---|---|---|---|---|
| Hb en rango (n, %) | |||||
| Todas las mediciones de Hb | 873 (78,23%) | 853 (72,72%) | 948 (80,89%) | 0,002 | < 0,001 |
| Sugerencias aceptadas [a] | 595 (85,37%) | 819 (86,21%) | |||
| Sugerencias rechazadas [b] | 122 (67,78%) | 3 (37,50%) | |||
| Sin sugerencia [c] | 156 (65,27%) | 126 (58,88%) | |||
| Hb por encima de rango (n, %) | |||||
| Todas las mediciones de Hb | 92 (8,24%) | 159 (13,55%) | 87 (7,42%) | < 0,001 | < 0,001 |
| Sugerencias aceptadas | 32 (4,59%) | 62 (6,53%) | |||
| Sugerencias rechazadas | 32 (17,78%) | 1 (12,50%) | |||
| Sin sugerencia | 28 (11,72%) | 24 (11,21%) | |||
| Hb por debajo de rango (n, %) | |||||
| Todas las mediciones de Hb | 151 (13,53%) | 161 (13,73%) | 137 (11,69%) | NS | NS |
| Sugerencias aceptadas | 70 (10,04%) | 69 (7,26%) | |||
| Sugerencias rechazadas | 26 (14,44%) | 4 (50,00%) | |||
| Sin sugerencia | 55 (23,01%) | 64 (29,91%) | |||
| Consumos (mediana, RIC) | |||||
| Darbepoetina por mes por paciente por kg (μg/kg/m) | 0,32 [1,06] | 0,39 [1,15] | 0,35 [1,14] | 0,039 | NS |
| Darbepoetina por mes por paciente (μg/m) | 20,00 [70,00] | 30,00 [80,00] | 20,00 [80,00] | 0,035 | NS |
| Sugerencias aceptadas | 10,00 [40,00] | 20,00 [60,00] | |||
| Sugerencias rechazadas | 60,00 [70,00] | 240,00 [365,00] | |||
| Sin sugerencia | 30,00 [90,00] | 60,00 [120,00] | |||
| Hierro por mes por paciente (mg/m) | 100,00 [200,00] | 150,00 [300,00] | 100,00 [200,00] | NS | <0,001 |
| Sugerencias aceptadas | 100,00 [200,00] | 100,00 [200,00] | |||
| Sugerencias rechazadas | 125,00 [200,00] | 100,00 [200,00] | |||
| Sin sugerencia | 100,00 [300,00] | 100,00 [400,00] | |||
| Resultados secundarios | |||||
| Muertes (n, %) | 3 (1,41%) | 12 (5,48%) | 6 (2,75%) | 0,032 | NS |
| Eventos cardiovasculares (incidencia/1.000 pacientes-año) | 847,50 | 626,09 | 441,23 | 0,009 | 0,02 |
| Días de hospitalización (incidencia/1.000 pacientes- año) | 7669,34 | 7995,47 | 6372,19 | NS | <0,001 |
| Transfusiones (incidencia/1.000 pacientes-año) | 83,70 | 102,64 | 61,57 | NS | NS |
Fase de intervención 1:
[a] Mediciones de Hb (n = 697) siguiendo las sugerencias que fueron aceptadas por el facultativo.
[b] Mediciones de Hb (n = 180) siguiendo las sugerencias de MCA que fueron rechazadas por el facultativo
[c] Mediciones de Hb (n = 239) que fueron no elegibles por MCA
Fase de intervención 2:
[a] Mediciones de Hb (n = 950) siguiendo las sugerencias de MCA que fueron aceptadas por el facultativo
[b] Mediciones de Hb (n = 8) siguiendo las sugerencias de MCA que fueron rechazadas por el facultativo
[c] Mediciones de Hb (n = 214) que fueron no elegibles por MCA.
El porcentaje de mediciones de Hb por encima de rango fue más elevado durante la fase en la que no se usó MCA en comparación con las fases de intervención (fase intervención1: 8,24%; fase de control: 13,55%, p1<0,001; fase de intervención2: 7,42%, p2<0,001); este efecto fue aún más notable cuando se consideraron solo los resultados de laboratorio derivados de las sugerencias aceptadas de MCA.
El consumo de hierro mensual por paciente también descendió a lo largo de los dos periodos de intervención, pero este descenso solo fue significativo en la fase de intervención2 (fase intervención1: 100mg/m [200], fase de control: 150mg/m [300] p1=NS, fase de intervención2: 100mg/m [200] p2<0,001).
Se observan diferencias analíticas relevantes a lo largo del estudio. A destacar que durante las fases de intervención los pacientes presentan niveles más bajos de PCR (fase de intervención2: 4,66mg/l; fase de control: 6,68mg/l, p=0,009) y de ferritina (fase de intervención1: 459ng/ml; fase de control, 511ng/ml, p=0,005) y niveles más elevados de albúmina (fase de intervención1: 3,93g/dl; fase de control: 3,84g/dl, p=0,001). Además, durante la primer fase de uso de MCA se realizan un número mayor de tratamientos de HDF, no existiendo diferencias significativas en el resto de períodos del estudio (fase de intervención1: 66,2%, p1=0,004; fase de control: 52,51%; fase de intervención2: 51,38% p2=NS).
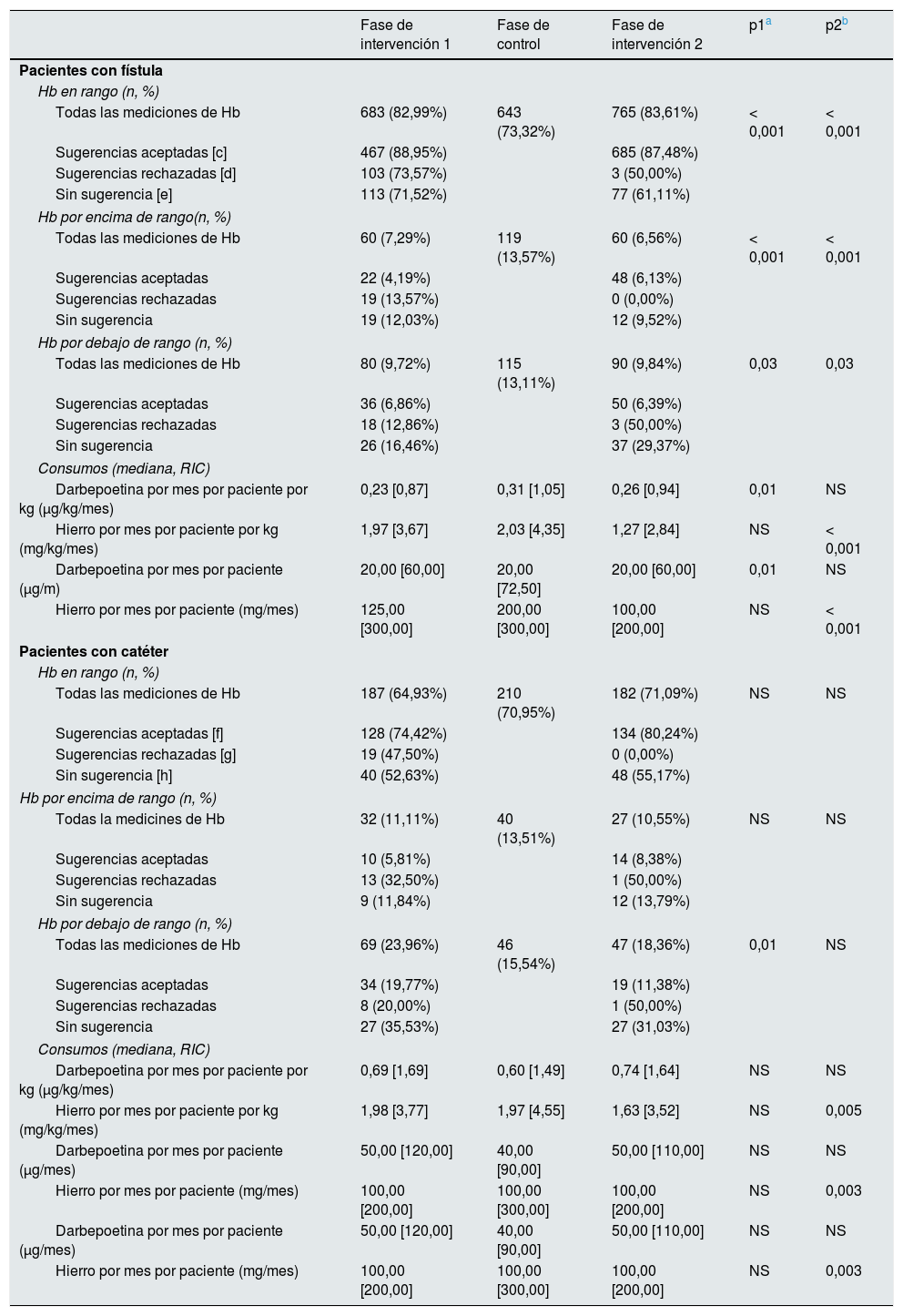
El efecto del acceso vascular en el resultado primario se analizó separadamente. Los resultados se presentan utilizando los mismos indicadores pero divididos en dos categorías: fístula arteriovenosa (FAV) nativa o protésica versus catéter en la tabla 3. Es llamativo que solo en el grupo de pacientes con FAV el consumo de darbepoetina varía a lo largo de las diferentes etapas del estudio; así, aumenta un 34% durante la fase de control y desciende un 16% tras retomar el uso de MCA durante la fase de intervención2. En el grupo de pacientes con catéter, el consumo de darbepoetina no se modificó tras la entrada de MCA y además fue un 30% más elevado comparado con el consumo en el grupo con FAV.
Resultados primarios a nivel centro de diálisis según el acceso vascular
| Fase de intervención 1 | Fase de control | Fase de intervención 2 | p1a | p2b | |
|---|---|---|---|---|---|
| Pacientes con fístula | |||||
| Hb en rango (n, %) | |||||
| Todas las mediciones de Hb | 683 (82,99%) | 643 (73,32%) | 765 (83,61%) | < 0,001 | < 0,001 |
| Sugerencias aceptadas [c] | 467 (88,95%) | 685 (87,48%) | |||
| Sugerencias rechazadas [d] | 103 (73,57%) | 3 (50,00%) | |||
| Sin sugerencia [e] | 113 (71,52%) | 77 (61,11%) | |||
| Hb por encima de rango(n, %) | |||||
| Todas las mediciones de Hb | 60 (7,29%) | 119 (13,57%) | 60 (6,56%) | < 0,001 | < 0,001 |
| Sugerencias aceptadas | 22 (4,19%) | 48 (6,13%) | |||
| Sugerencias rechazadas | 19 (13,57%) | 0 (0,00%) | |||
| Sin sugerencia | 19 (12,03%) | 12 (9,52%) | |||
| Hb por debajo de rango (n, %) | |||||
| Todas las mediciones de Hb | 80 (9,72%) | 115 (13,11%) | 90 (9,84%) | 0,03 | 0,03 |
| Sugerencias aceptadas | 36 (6,86%) | 50 (6,39%) | |||
| Sugerencias rechazadas | 18 (12,86%) | 3 (50,00%) | |||
| Sin sugerencia | 26 (16,46%) | 37 (29,37%) | |||
| Consumos (mediana, RIC) | |||||
| Darbepoetina por mes por paciente por kg (μg/kg/mes) | 0,23 [0,87] | 0,31 [1,05] | 0,26 [0,94] | 0,01 | NS |
| Hierro por mes por paciente por kg (mg/kg/mes) | 1,97 [3,67] | 2,03 [4,35] | 1,27 [2,84] | NS | < 0,001 |
| Darbepoetina por mes por paciente (μg/m) | 20,00 [60,00] | 20,00 [72,50] | 20,00 [60,00] | 0,01 | NS |
| Hierro por mes por paciente (mg/mes) | 125,00 [300,00] | 200,00 [300,00] | 100,00 [200,00] | NS | < 0,001 |
| Pacientes con catéter | |||||
| Hb en rango (n, %) | |||||
| Todas las mediciones de Hb | 187 (64,93%) | 210 (70,95%) | 182 (71,09%) | NS | NS |
| Sugerencias aceptadas [f] | 128 (74,42%) | 134 (80,24%) | |||
| Sugerencias rechazadas [g] | 19 (47,50%) | 0 (0,00%) | |||
| Sin sugerencia [h] | 40 (52,63%) | 48 (55,17%) | |||
| Hb por encima de rango (n, %) | |||||
| Todas la medicines de Hb | 32 (11,11%) | 40 (13,51%) | 27 (10,55%) | NS | NS |
| Sugerencias aceptadas | 10 (5,81%) | 14 (8,38%) | |||
| Sugerencias rechazadas | 13 (32,50%) | 1 (50,00%) | |||
| Sin sugerencia | 9 (11,84%) | 12 (13,79%) | |||
| Hb por debajo de rango (n, %) | |||||
| Todas las mediciones de Hb | 69 (23,96%) | 46 (15,54%) | 47 (18,36%) | 0,01 | NS |
| Sugerencias aceptadas | 34 (19,77%) | 19 (11,38%) | |||
| Sugerencias rechazadas | 8 (20,00%) | 1 (50,00%) | |||
| Sin sugerencia | 27 (35,53%) | 27 (31,03%) | |||
| Consumos (mediana, RIC) | |||||
| Darbepoetina por mes por paciente por kg (μg/kg/mes) | 0,69 [1,69] | 0,60 [1,49] | 0,74 [1,64] | NS | NS |
| Hierro por mes por paciente por kg (mg/kg/mes) | 1,98 [3,77] | 1,97 [4,55] | 1,63 [3,52] | NS | 0,005 |
| Darbepoetina por mes por paciente (μg/mes) | 50,00 [120,00] | 40,00 [90,00] | 50,00 [110,00] | NS | NS |
| Hierro por mes por paciente (mg/mes) | 100,00 [200,00] | 100,00 [300,00] | 100,00 [200,00] | NS | 0,003 |
| Darbepoetina por mes por paciente (μg/mes) | 50,00 [120,00] | 40,00 [90,00] | 50,00 [110,00] | NS | NS |
| Hierro por mes por paciente (mg/mes) | 100,00 [200,00] | 100,00 [300,00] | 100,00 [200,00] | NS | 0,003 |
p2: se refiere a la comparación entre la fase de control y la fase de intervención 2.
FAV. Fase de intervención 1:
[c]Mediciones de Hb (n = 525) siguiendo las sugerencias de anemia que fueron aceptadas por el facultativo.
[d] Mediciones de Hb (n = 140) siguiendo las sugerencias de anemia que fueron rechazadas por el facultativo.
[e] Mediciones de Hb (n = 158) que fueron MCA no elegibles.
FAV. Fase de intervención 2:
[c] Mediciones de Hb (n = 783) siguiendo las sugerencias de anemia que fueron aceptadas por el facultativo.
[d] Mediciones de Hb (n = 6) siguiendo las sugerencias de anemia que fueron rechazadas por el facultativo.
[e] Mediciones de Hb (n = 126) que fueron MCA no elegibles.
Catéter. Fase de intervención 1:
[f] Mediciones de Hb (n = 172) siguiendo las sugerencias de MCA que fueron aceptadas por el facultativo.
[g] Mediciones de Hb (n = 40) siguiendo las sugerencias de MCA que fueron rechazadas por el facultativo.
[h] Mediciones de Hb (n = 76) que fueron MCA no elegibles.
Catéter. Fase de intervención 2:
[f] Mediciones de Hb (n = 167) siguiendo las sugerencias de anemia que fueron aceptadas por el facultativo.
[g] Mediciones de Hb (n = 2) siguiendo las sugerencias de anemia que fueron rechazadas por el facultativo.
[h] Mediciones de Hb (n = 87) que fueron MCA no elegibles.
Respecto a los resultados secundarios, se observa que la incidencia de eventos cardiovasculares mostró un descenso mantenido a lo largo del tiempo que no parece ser dependiente del uso de MCA (fase de intervención1: 847,50/1.000pacientes-año, fase de control: 626,09/1.000pacientes-año, p1=0,009; fase de intervención2: 441,23/1.000pacientes-año, p2=0,002). Respecto al evento muerte, si bien parece ser menor durante las fases de intervención, solo resulta significativo al comparar la fase de intervención1 con la fase de control (fase intervención1: 1,45%; fase de control, 5,48%, p1=0,032; fase intervención2: 2,75%, p2=NS). El número de pacientes que requirieron transfusiones a lo largo del estudio fue similar en los tres períodos.
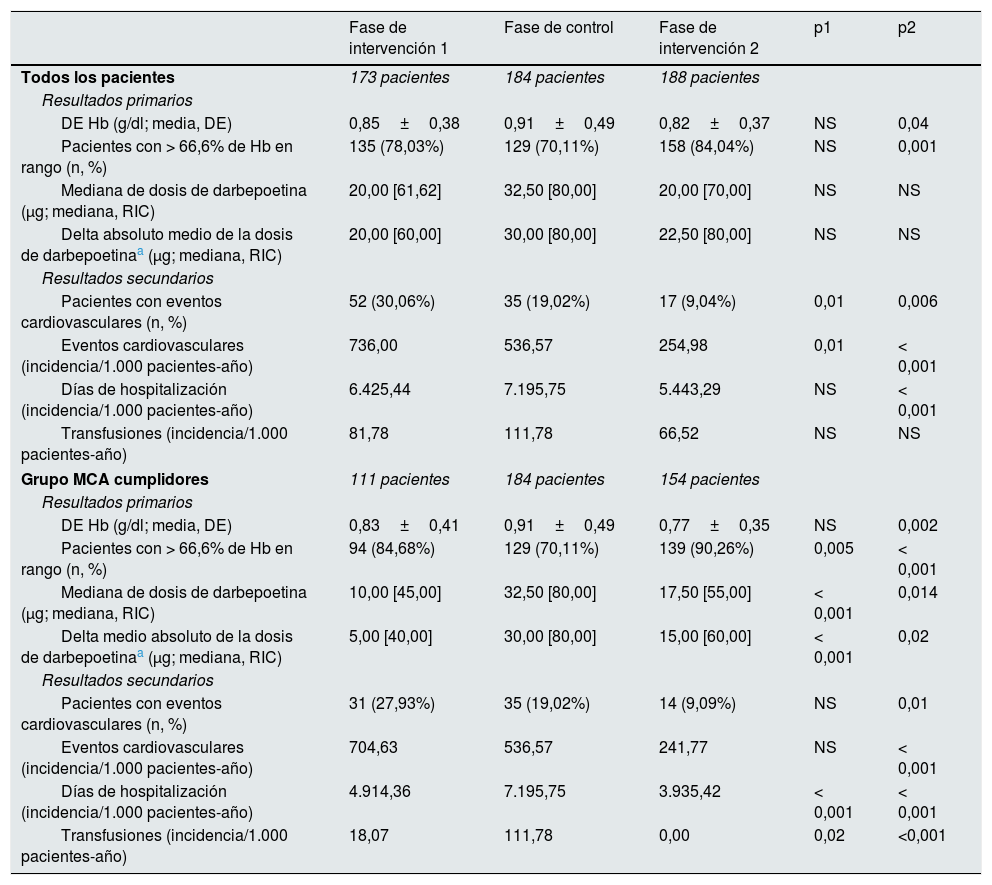
Resultados a nivel de pacientesLa tabla 4 muestra las características de la cohorte de pacientes considerada para el análisis a este nivel (todos los pacientes seleccionados en la fase de intervención1, fase de control y fase de intervención2, así como los pacientes pertenecientes al grupo MCA cumplidores tanto de la fase de intervención1 como2). Tras la entrada de MCA, en la fase de intervención2 se observa un descenso significativo en la fluctuación de la Hb (de 0,91±0,49 a 0,82±0,37g/dl; p=0,04), así como un aumento significativo del porcentaje de pacientes con al menos 2/3 de sus valores de Hb en rango (de 70,1 a 84%; p=0,001).
Resultados primarios y secundarios a nivel paciente y grupo MCA cumplidores
| Fase de intervención 1 | Fase de control | Fase de intervención 2 | p1 | p2 | |
|---|---|---|---|---|---|
| Todos los pacientes | 173 pacientes | 184 pacientes | 188 pacientes | ||
| Resultados primarios | |||||
| DE Hb (g/dl; media, DE) | 0,85±0,38 | 0,91±0,49 | 0,82±0,37 | NS | 0,04 |
| Pacientes con > 66,6% de Hb en rango (n, %) | 135 (78,03%) | 129 (70,11%) | 158 (84,04%) | NS | 0,001 |
| Mediana de dosis de darbepoetina (μg; mediana, RIC) | 20,00 [61,62] | 32,50 [80,00] | 20,00 [70,00] | NS | NS |
| Delta absoluto medio de la dosis de darbepoetinaa (μg; mediana, RIC) | 20,00 [60,00] | 30,00 [80,00] | 22,50 [80,00] | NS | NS |
| Resultados secundarios | |||||
| Pacientes con eventos cardiovasculares (n, %) | 52 (30,06%) | 35 (19,02%) | 17 (9,04%) | 0,01 | 0,006 |
| Eventos cardiovasculares (incidencia/1.000 pacientes-año) | 736,00 | 536,57 | 254,98 | 0,01 | < 0,001 |
| Días de hospitalización (incidencia/1.000 pacientes-año) | 6.425,44 | 7.195,75 | 5.443,29 | NS | < 0,001 |
| Transfusiones (incidencia/1.000 pacientes-año) | 81,78 | 111,78 | 66,52 | NS | NS |
| Grupo MCA cumplidores | 111 pacientes | 184 pacientes | 154 pacientes | ||
| Resultados primarios | |||||
| DE Hb (g/dl; media, DE) | 0,83±0,41 | 0,91±0,49 | 0,77±0,35 | NS | 0,002 |
| Pacientes con > 66,6% de Hb en rango (n, %) | 94 (84,68%) | 129 (70,11%) | 139 (90,26%) | 0,005 | < 0,001 |
| Mediana de dosis de darbepoetina (μg; mediana, RIC) | 10,00 [45,00] | 32,50 [80,00] | 17,50 [55,00] | < 0,001 | 0,014 |
| Delta medio absoluto de la dosis de darbepoetinaa (μg; mediana, RIC) | 5,00 [40,00] | 30,00 [80,00] | 15,00 [60,00] | < 0,001 | 0,02 |
| Resultados secundarios | |||||
| Pacientes con eventos cardiovasculares (n, %) | 31 (27,93%) | 35 (19,02%) | 14 (9,09%) | NS | 0,01 |
| Eventos cardiovasculares (incidencia/1.000 pacientes-año) | 704,63 | 536,57 | 241,77 | NS | < 0,001 |
| Días de hospitalización (incidencia/1.000 pacientes-año) | 4.914,36 | 7.195,75 | 3.935,42 | < 0,001 | < 0,001 |
| Transfusiones (incidencia/1.000 pacientes-año) | 18,07 | 111,78 | 0,00 | 0,02 | <0,001 |
Estos resultados son confirmados y acentuados cuando nos centramos en los resultados del grupo MCA cumplidores. Para estos pacientes, la fluctuación de la Hb en las fases de intervención fue aún menor, pero solo significativa en la fase de intervención2 (0,83=0,41g/dl en la fase de intervención1, p=NS; 0,77±0,35g/dl en la fase de intervención2, p<0,001) y se observa un incremento en el porcentaje de pacientes con la mayoría de valores de Hb en rango (84,7% en la fase de intervención1, p=0,005; 90,3% en la fase de intervención2, p<0,001).
Los resultados secundarios también tendieron a disminuir durante el uso de MCA, particularmente en el grupo MCA cumplidores, en los que se puede ver un descenso significativo de la incidencia de transfusiones y días de hospitalización por 1.000 pacientes-año (aunque esto no se confirme en el análisis global). Por otro lado, los eventos cardiovasculares muestran una tendencia a la baja a lo largo del tiempo que no parece ser dependiente del uso de MCA.
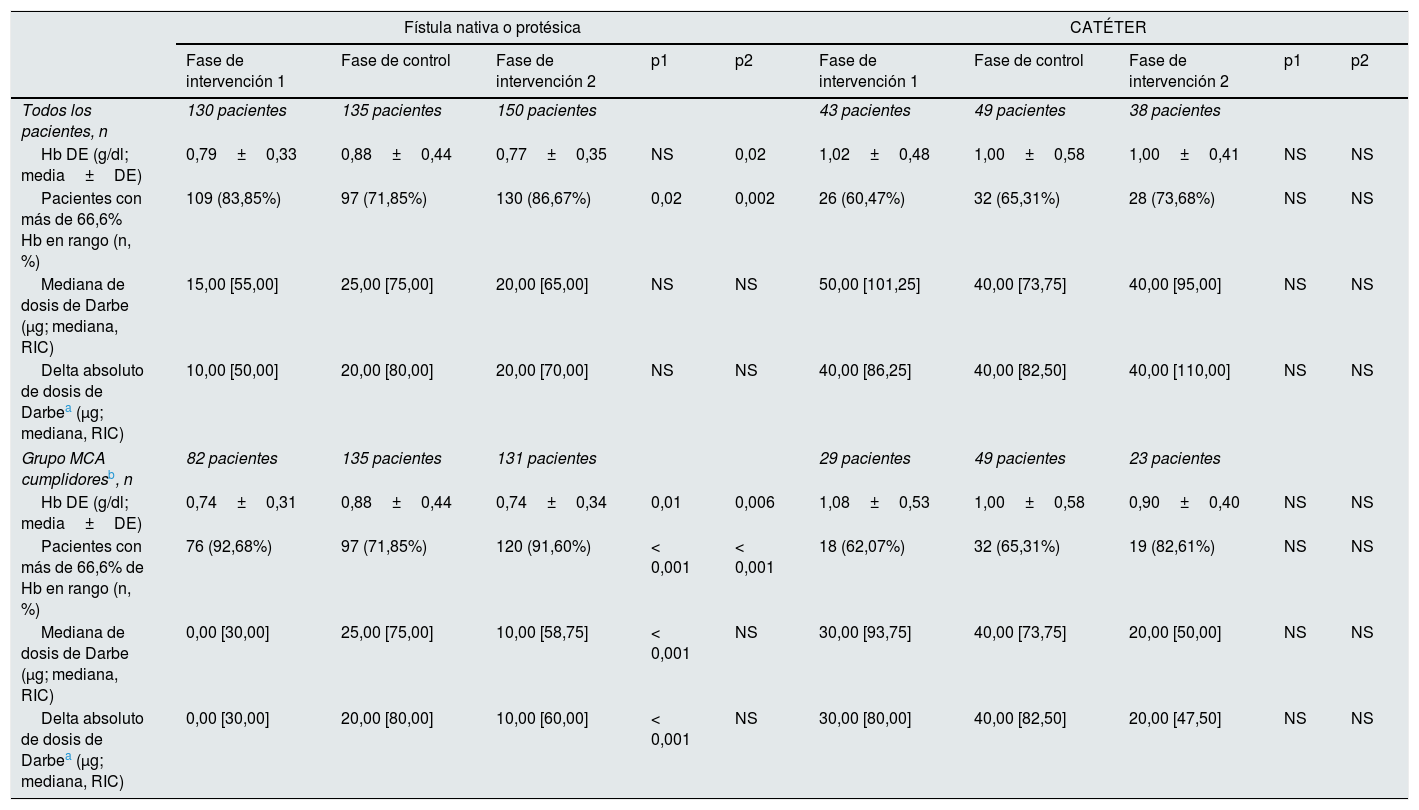
Los resultados primarios según el acceso vascular a nivel paciente se pueden ver en la tabla 5. Los datos se presentan divididos en dos categorías: FAV nativa/protésica versus catéter. En el grupo de pacientes con FAV, durante la fase de intervención2 se aprecia un descenso de la variabilidad de la Hb (0,88±0,44 a 0,77±0,35, p=0,02), así como un incremento del porcentaje de pacientes con Hb en rango (71,85 a 86,67%, p=0,002). Esto resulta más notable en el grupo de sugerencias confirmadas (grupo MCA cumplidores), donde la variabilidad de la Hb se reduce aún más, llegando a 0,74±0,34 en la segunda fase de intervención, mientras que el porcentaje de pacientes con >66,6% de Hb en rango supera el 90% durante las dos fases de intervención. El consumo de darbepoetina fue más elevado durante la fase de control, mientras que se redujo el porcentaje de pacientes con Hb en rango. El grupo de pacientes con catéter mostró un mayor consumo de darbepoetina frente al grupo de FAV, sin sufrir modificaciones significativas a lo largo de las diferentes fases del estudio.
Resultado primario a nivel paciente según acceso vascular
| Fístula nativa o protésica | CATÉTER | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Fase de intervención 1 | Fase de control | Fase de intervención 2 | p1 | p2 | Fase de intervención 1 | Fase de control | Fase de intervención 2 | p1 | p2 | |
| Todos los pacientes, n | 130 pacientes | 135 pacientes | 150 pacientes | 43 pacientes | 49 pacientes | 38 pacientes | ||||
| Hb DE (g/dl; media±DE) | 0,79±0,33 | 0,88±0,44 | 0,77±0,35 | NS | 0,02 | 1,02±0,48 | 1,00±0,58 | 1,00±0,41 | NS | NS |
| Pacientes con más de 66,6% Hb en rango (n, %) | 109 (83,85%) | 97 (71,85%) | 130 (86,67%) | 0,02 | 0,002 | 26 (60,47%) | 32 (65,31%) | 28 (73,68%) | NS | NS |
| Mediana de dosis de Darbe (μg; mediana, RIC) | 15,00 [55,00] | 25,00 [75,00] | 20,00 [65,00] | NS | NS | 50,00 [101,25] | 40,00 [73,75] | 40,00 [95,00] | NS | NS |
| Delta absoluto de dosis de Darbea (μg; mediana, RIC) | 10,00 [50,00] | 20,00 [80,00] | 20,00 [70,00] | NS | NS | 40,00 [86,25] | 40,00 [82,50] | 40,00 [110,00] | NS | NS |
| Grupo MCA cumplidoresb, n | 82 pacientes | 135 pacientes | 131 pacientes | 29 pacientes | 49 pacientes | 23 pacientes | ||||
| Hb DE (g/dl; media±DE) | 0,74±0,31 | 0,88±0,44 | 0,74±0,34 | 0,01 | 0,006 | 1,08±0,53 | 1,00±0,58 | 0,90±0,40 | NS | NS |
| Pacientes con más de 66,6% de Hb en rango (n, %) | 76 (92,68%) | 97 (71,85%) | 120 (91,60%) | < 0,001 | < 0,001 | 18 (62,07%) | 32 (65,31%) | 19 (82,61%) | NS | NS |
| Mediana de dosis de Darbe (μg; mediana, RIC) | 0,00 [30,00] | 25,00 [75,00] | 10,00 [58,75] | < 0,001 | NS | 30,00 [93,75] | 40,00 [73,75] | 20,00 [50,00] | NS | NS |
| Delta absoluto de dosis de Darbea (μg; mediana, RIC) | 0,00 [30,00] | 20,00 [80,00] | 10,00 [60,00] | < 0,001 | NS | 30,00 [80,00] | 40,00 [82,50] | 20,00 [47,50] | NS | NS |
En este estudio prospectivo, llevado a cabo en las clínicas de diálisis de Cartagena y San Pedro del Pinatar, se comparan los resultados de anemia obtenidos durante la implementación de un software de ayuda al nefrólogo para el tratamiento de la anemia en pacientes en hemodiálisis frente a la toma de decisiones mediante el ajuste convencional de ensayo-error.
Analizando los resultados a nivel de centro de diálisis, de forma general se observa un claro empeoramiento de los resultados primarios durante la fase de control, con menor porcentaje de pacientes con Hb en rango cuando no se utiliza el programa, confirmando el efecto positivo de MCA, siendo este efecto más evidente si analizamos los resultados derivados de recomendaciones confirmadas.
Respecto a los resultados a nivel de pacientes, MCA logra un mayor número de pacientes con Hb en rango y una menor variabilidad de la misma, siendo esto más evidente al analizar el grupo MCA cumplidores. Así podemos decir que el ajuste de tratamiento de la anemia con la ayuda de MCA se traduce en un consumo más eficiente de darbepoetina. Al mismo tiempo, existen diferentes factores, derivados de las características de la población, que pudieran influir en los resultados obtenidos. En este sentido podemos remarcar que durante las fases de intervención parece existir un menor estado de inflamación, como se puede ver reflejado en los niveles encontrados de PCR, ferritina y albúmina. Otro factor condicionante de esta situación es el menor número de catéteres observado durante estas fases y las diferencias en la modalidad del TSR con un mayor número de HDF durante la primera fase del estudio. Todos estos factores pueden condicionar mejores resultados de anemia, independientemente de MCA.
La inflamación es un factor de riesgo conocido que se ha involucrado en la variabilidad de la Hb y en un mayor índice de resistencia a la eritropoyetina (IRE)27,34. Tanto Dellanna et al.43 como Mueller et al.44 analizan los datos de una amplia cohorte de pacientes en hemodiálisis, encontrando que menores niveles de PCR se asocian a mejores resultados de anemia, sin hallar diferencias significativas en ferritina, saturación de transferrina o parámetros de diálisis. En la misma línea, Molina et al.34 describen un descenso significativo de los niveles de PCR e IRE con el uso de agua ultrapura en pacientes en hemodiálisis de alto flujo.
Otro factor conocido que puede afectar los resultados en anemia es el estado de hidratación de los pacientes. En el estudio realizado por Castellano et al.45 se observa una reducción del consumo de AEE y del IRE tras corregir la hiperhidratación, medida por bioimpedancia, sin poder discriminar si esta diferencia es debida a hemoconcentración o a disminución de la inflamación asociada a la misma condición de sobrehidratación.
Las diferencias en el estado de hidratación de nuestros pacientes, medido por bioimpedancia (BCM®, FMC), son evidentes. Sin embargo, el grado en el que han podido condicionar hemodilución o hemoconcentración y modificar la dosis de AEE prescrita por el nefrólogo o sugerida por el programa es difícil de ponderar.
Si bien no se puede sacar conclusiones respecto al comportamiento de eventos cardiovasculares, transfusiones y hospitalizaciones durante el estudio, la presencia de un mayor número de días de hospitalización durante la fase de control podría explicar la mayor necesidad de darbepoetina y hierro durante esta fase y haber condicionado, por efecto colateral debido al arrastre de dosis de fármacos, mejores resultados durante la fase de intervención2.
Si comparamos nuestros resultados con los excelentes resultados obtenidos en el reciente estudio de Barbieri et al.40, el uso de MCA en nuestra población consigue un beneficio aún mayor, logrando más de un 80% de pacientes con Hb en rango (76,65% frente al 80,89% en la fase de intervención2) con un menor consumo de darbepoetina y hierro (0,46/1,67mg/kg/mes frente a 0,35/1,34mg/kg/mes). Estas diferencias parecen estar en relación con las características de las poblaciones estudiadas, siendo el principal responsable el mayor número de FAV nativas en nuestro estudio, llegando al 74,7% durante la fase de intervención2 frente al 65,3% en el estudio publicado en el Kidney International.
Es ampliamente conocido que el acceso vascular tiene un gran impacto en los resultados de anemia en los pacientes en hemodiálisis. En concreto, en nuestra población el tener una FAV se asoció a un menor consumo de AEE, menor variabilidad de Hb y mayor número de pacientes con niveles de Hb en rango. Resultados similares han sido descritos por otros autores. Así, Eckardt et al.46 puntualizan que cambios en el acceso vascular y no tener una fístula se asocia con mayor variabilidad de Hb. También el estudio de Lau et al.47 encuentra que, de forma inesperada, el uso de catéteres como acceso vascular en pacientes en hemodiálisis se asocia a un aumento más rápido de Hb, mientras que Pisoni et al.48 describen que la población con catéteres tiene con menor probabilidad niveles de Hb de 11g/dl o más en su análisis del DOPPS.
Si bien el efecto positivo de MCA se puede valorar de forma general en los grupos analizados, nuevamente es mayor en el subgrupo de pacientes con alto porcentaje de sugerencias confirmadas. Sin embargo, el descenso en la dosis de darbepoetina se puede ver solamente en el grupo de pacientes con FAV como acceso vascular. Este hallazgo no va en contra de la validación o precisión de MCA, sino que subraya el efecto deletéreo del uso de catéteres en el consumo de AEE debido a pérdidas de sangre o inflamación, como reportan diferentes autores49,50.
¿Por qué el modelo obtiene tan buenos resultados?Por un lado, podemos decir que el algoritmo ha sido diseñado de tal manera que incorpora datos de farmacocinética y farmacodinamia de darbepoetina con especial enfoque en el tiempo de maduración del eritrocito y su menor supervivencia en situación de insuficiencia renal. Además utiliza datos antropométricos, de laboratorio, de dosis de diálisis y clínicos para elaborar la sugerencia de dosis. Por otro lado, MCA considera que los niveles de Hb actuales están influenciados por las dosis de darbepoetina recibidas en los últimos 3meses y basa sus recomendaciones en las dosis administradas (no en las prescritas) teniendo en cuenta el calendario de administración51. Todo esto en conjunto hace que MCA logre una mayor precisión, minimizando las fluctuaciones y los riesgos de la prescripción humana.
¿Cuál es la actitud del nefrólogo frente a la nueva herramienta?Si centramos nuestra atención en el número de confirmaciones de prescripción a lo largo del estudio, observamos que un número menor de sugerencias son aceptadas durante la primera fase de intervención del estudio. Esto traduce una clara situación de desconfianza por parte del nefrólogo ante los cambios de dosis propuestos por la nueva herramienta, rechazando un gran número de sugerencias y obteniendo peores resultados, mientras que en la segunda fase de intervención la seguridad en el modelo aumenta, lo que se traduce en un mayor número de sugerencias aceptadas, logrando más pacientes con Hb en rango y una menor variabilidad de la misma. Por otro lado, este porcentaje creciente y alto de confirmación nos hace pensar que los nefrólogos no solo confirman los casos sencillos y de mayor estabilidad clínica en cuanto están de acuerdo, sino que hay una muy buena confianza en el programa, lo que se demuestra en la mejora de los resultados a nivel general.
Diferentes algoritmos de predicción han sido utilizados a lo largo de la última década para mejorar el tratamiento de la anemia renal e individualizar la dosis de AEE en pacientes en diálisis, con resultados prometedores. A destacar el estudio prospectivo y multicéntrico publicado por McCarthy et al.52, en donde se describen mejoras en la variabilidad de la Hb y reducción del 40% en la dosis de darbepoetina en una amplia población de pacientes en hemodiálisis al aplicar un sistema biomédico para el tratamiento de la anemia en pacientes tratados con hierro. Aunque los resultados parecen similares a los nuestros, existen diferencias destacables que limitan la comparación, como el uso de mayores dosis de darbepoetina tanto al inicio como al final del estudio y un mayor rango de Hb diana (10-12,9g/dl).
Una de las limitaciones del presente estudio es que, a pesar de tener un diseño prospectivo, la n analizada no es muy grande y el tiempo de seguimiento resulta insuficiente para valorar el impacto de MCA en la morbimortalidad cardiovascular. Por otro lado, dadas las características del programa y la necesidad de tener información detallada y actualizada suficiente, de cada paciente, su validación en pacientes incidentes puede resultar controvertida y difícil de analizar en nuestro estudio (dado el escaso número de pacientes incidentes), lo mismo sucede con hospitalizaciones o vacaciones que resultan en pérdida de seguimiento y de datos suficientes para el programa. Debemos considerar que es probable que un análisis excluyendo hospitalizaciones, pacientes prevalentes y pacientes con FAVI nos hubiera acercado mejor a ver el comportamiento de MCA por sí mismo, aunque hemos intentado aproximarnos a la situación de práctica clínica habitual manteniendo el escenario completo al que se enfrenta el nefrólogo a diario. Otra limitación a tener en cuenta es que el programa solo se ha validado con darbepoetina y en la población en hemodiálisis, no pudiendo utilizarse en otros escenarios clínicos.
En conclusión, en nuestro estudio MCA fue una herramienta eficaz y de ayuda al clínico, logrando mejorar los resultados de anemia en los pacientes en hemodiálisis, minimizando los riesgos del tratamiento con AEE y reduciendo los costes.
Conflicto de interesesC.B., J.I.T. y R.R. son trabajadores de FMC, que ha desarrollado el programa. El resto de autores no presentan conflicto de intereses.