En condiciones de cardiopatía isquémica aguda se recomienda, tanto en las guías americanas como en las europeas, doble antiagregación con ticagrelor o prasugrel y ácido acetilsalicílico junto con estatinas de alta o moderada intensidad1. Se considera que el riesgo de rabdomiólisis con estatinas es de 1/105 pacientes/año2, aunque el de miopatía es de 1/103-104/pacientes/año y se multiplica por 5 si se combinan 2 fármacos3. Exponemos un caso de rabdomiólisis en relación con atorvastatina y ticagrelor.
Mujer de 69 años, con función renal conservada. Diabetes mellitus tipo 2 de larga data, sin retinopatía ni nefropatía diabéticas. Severa isquemia crónica de miembros inferiores. HTA, obesidad mórbida y dislipidemia mixta. Consumidora crónica de AINE. En tratamiento con insulina, ARA II, tiazida e ibuprofeno. Ingresó por SCASEST Killip III por enfermedad de 3 vasos no revascularizable. Tras optimizar tratamiento médico mejoró de forma lenta pese a varias complicaciones infecciosas y un severo síndrome de desacondicionamiento motor. A las 4 semanas, sin traumatismo desencadenante, desarrolló dolor muscular generalizado con cifras de CPK de 27.000U/L. Desde hacía una semana seguía tratamiento con 90mg/día de ticagrelor, omeprazol, paracetamol, 40mg/día de atorvastatina, amlodipino y duloxetina. Serología vírica, perfil tiroideo, ACTH, cortisol, inmunología completa, marcadores tumorales, niveles de paracetamol, vitamina B12 y ácido fólico en sangre, normales. No presentaba clínica de síndrome serotoninérgico ni de insuficiencia suprarrenal aguda. Se suspendieron todos los fármacos y se añadió al tratamiento clopidogrel. Desarrolló insuficiencia cardiaca con fracaso renal oligúrico e hiperpotasemia que requirió 4 sesiones de hemodiálisis aguda. Recuperó rápidamente la función renal y mejoró clínicamente, pero al octavo día tuvo un nuevo síndrome coronario a consecuencia del cual falleció en 48 horas.
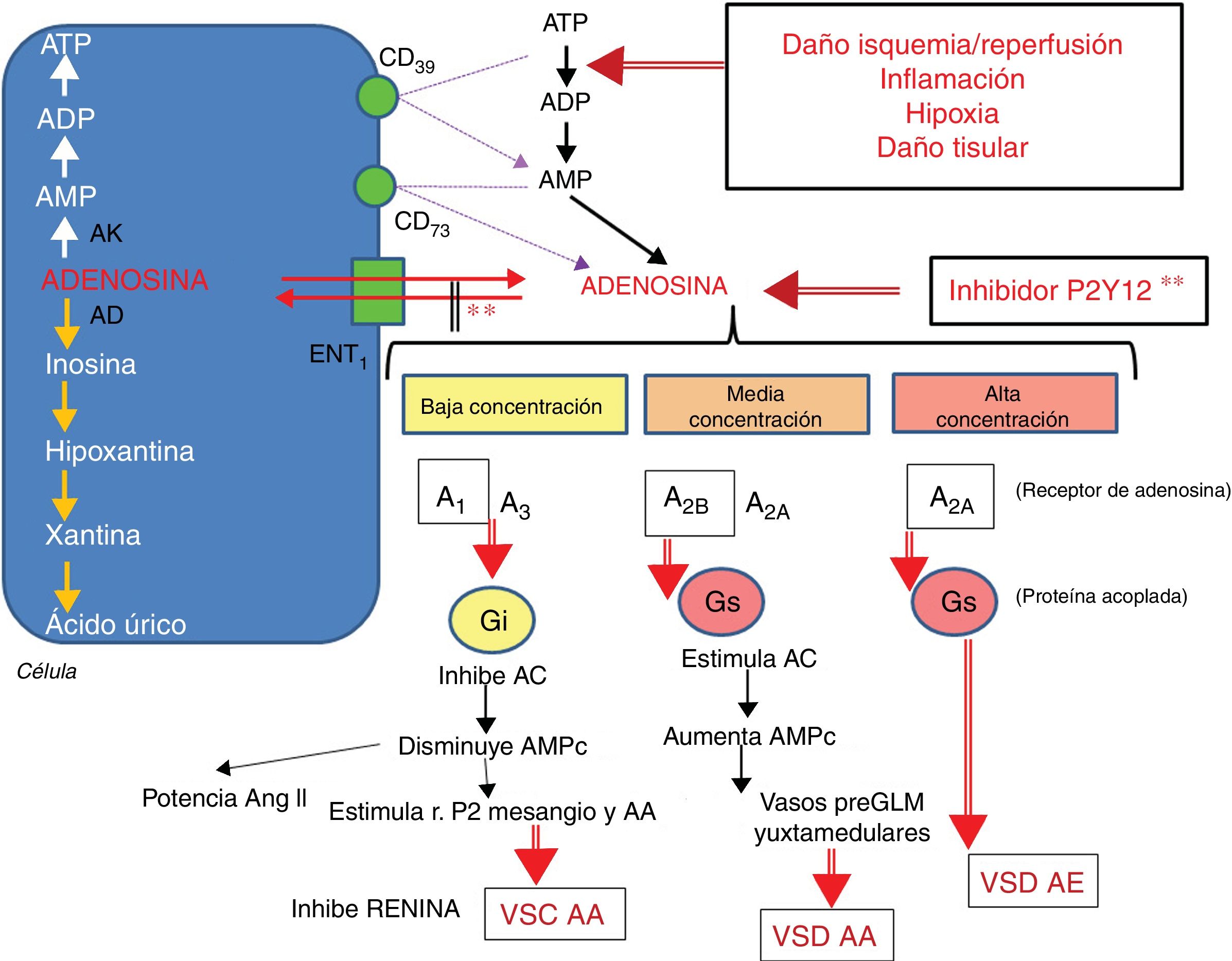
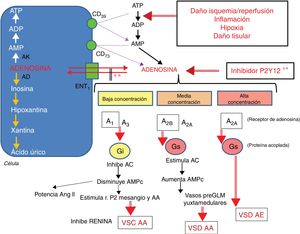
Exponemos el caso de una paciente pluripatológica que padeció una rabdomiólisis grave con insuficiencia renal que precisó tratamiento renal sustitutivo causada probablemente por la interacción entre ticagrelor y atorvastatina (8 puntos en la escala de interacciones de Horn4 y 7 en la de efectos indeseables de Naranjo5). No se trata de una situación inusual. La interacción entre 2 fármacos que causan efectos indeseables graves justifica el 2,8% de ingresos hospitalarios1. Ticagrelor se absorbe de forma lineal con una concentración plasmática máxima entre 1-4 horas y semivida de eliminación de 7 horas para el principio activo y de 9 para su metabolito activo (AR-C124910XX). Se elimina6 en un 58% por heces y en un 27% por orina como metabolito inactivo. Su mecanismo de acción es la inhibición reversible de la agregación plaquetar mediante la inhibición del receptor P2Y12; lo que lleva a cabo mediante la inhibición del transportador celular ENT1, que provoca la disminución de la captación de la adenosina por la célula e induce un aumento de sus niveles en plasma7-12. Según se demostró en el estudio PLATO13(platelet inhibition and patient outcome), disminuye la mortalidad cardiovascular en cardiopatía isquémica aguda en comparación con clopidogrel, lo que se justifica presumiblemente por la prolongación de la acción de atorvastatina, ya que ambas se metabolizan por el citocromo CYP 450 3A4/3A5. La interacción atorvastatina/ticagrelor se considera de riesgo menor1, ya que su administración conjunta solo incrementa 1,4 veces la concentración AUC (área bajo la curva calculada de la máxima concentración en plasma de fármaco en relación con el tiempo). Por ello se considera una combinación razonable y no se recomienda limitar las dosis. ¿Por qué puede haberse dado en este caso la rabdomiólisis? La causa puede ser múltiple. En primer lugar, el posible polimorfismo del CYP 450 3A4/3A5, que pudiera condicionar un aumento de concentración en sangre de la estatina y la conjunción con amlodipino que es un débil inhibidor de CYP3A4 y CYP3A5, que aumenta en un 18% la AUC de atorvastatina8 e induce la acumulación de metabolitos activos de ticagrelor. En segundo lugar, por la acción renal de ticagrelor. El estudio PLATO demostró que inducía aumento de creatinina del 30% en más de un 25% de pacientes, principalmente, los que tenían insuficiencia renal previa, mayores de 75 años y en tratamiento previo con IECA. La adenosina es sintetizada tras ser metabolizada la ADP por las nucleotidasas CD39 y CD73. Sus niveles aumentan en plasma tras estrés celular, isquemia/reperfusión o inflamación. Es rápidamente captada por las células a través de los transportadores ENT y CNT (transportadores equilibrativos y concentrativos de nucleósidos). Ejerce acción vasodilatadora a nivel general, pero a nivel renal su acción depende de su concentración, pudiendo ser vasoconstrictora, esencial en el mecanismo de retroalimentación túbulo glomerular, o vasodilatadora. A baja concentración, estimula el receptor 1 (y en menor medida el 3), que provocan la inhibición de la adenilciclasa, y del AMPc potenciando el efecto de angiotensina ii e induciendo vasoconstricción (VSC) de la arteriola aferente (AA) por medio de la estimulación de los receptores purinérgicos (P2) de las células mesangiales y de la AA e inhibición de la secreción de renina, lo que contribuye a mantener la autorregulación del flujo sanguíneo renal (FSR)11,12. A mayor dosis, se estimula el receptor 2, principalmente el 2B, que se expresa en vasos preglomerulares yuxtamedulares y que aumenta la concentración de AMPc induciendo vasodilatación (VSD) de la AA, lo que incide en una menor eficacia del mecanismo autorregulador. Aún a mayor concentración el efecto predominante es el estímulo de los receptores 2A con VSD de la arteriola eferente (AE), lo que provoca la caída del FSR y de la tasa de filtración glomerular (TFG) (fig. 1). Se sugiere en estos casos sustituir atorvastatina por fluvastatina que se metaboliza por el P459 CYP 2C9 y ticagrelor por clopidogrel. Hay descritos varios casos similares en la literatura6,8,9,14-16 con ticagrelor y diversas estatinas utilizadas a dosis adecuadas. En la mayoría, el cuadro se da tras un tiempo de 1-3 meses de uso de los fármacos. En nuestro caso, tanto el aumento de adenosina por la inhibición del transportador ENT1 como el estímulo por lesión isquémica pudieron inducir daño renal con acumulación de la estatina pese a que las dosis utilizadas fueron correctas, lo que nos obliga a revalorar esta recomendación en situaciones de polimedicación, inestabilidad clínica o especial fragilidad de los pacientes.
Metabolismo de la adenosina y acciones según su concentración.
La adenosina entra y sale de la célula por el transportador ENT1. El ATP se transforma en AMP por la nucleotidasa CD39 y este en adenosina por la nucleotidasa CD73. La isquemia/reperfusión, la inflamación, la hipoxia y el daño tisular acentúan el paso de ATP a ADP. Los inhibidores de la P2Y12 aumentan los niveles de adenosina. La adenosina a baja concentración estimula a sus receptores A1 y en menor medida A3, lo que conduce a la vasoconstricción (VSC) de la arteriola aferente (AA). A media concentración se estimulan los receptores A2B y en menor medida el A2A, lo que conduce a la vasodilatación (VSD) de la AA. A alta concentración se estimula principalmente el receptor A2A y el efecto predominante es el de VSD arteriola eferente (AE).
AC: adenilciclasa; AD: adenosina deaminasa; ADP: Adenosin difosfato; AK: adenosina cinasa; AMP: adenosin monofosfato; ANG II: angiotensina ii;ATP: Adenosin trifosfato; ENT1: transportador equilibrativo de nucleósidos tipo 1; GLM: glomérulo; r.P2: receptor purinérgico tipo 2.
** El inhibidor P2Y12 inhibe el transportador ENT1.
Fuente: modificado de Cattaneo et al.7.
Este artículo no ha sido financiado por ningún organismo.
Conflicto de interesesNo hay conflicto de intereses declarable en sus autores.