A pesar de las recomendaciones de las guías clínicas, el porcentaje de catéteres venosos centrales (CVC) sigue estando por encima de los estándares recomendados. Desconocemos si la utilización creciente de catéteres tiene su origen en factores inevitables o evitables y, en este último caso, estaría en nuestra mano modificar estos resultados.
El objetivo de este estudio ha sido analizar las causas que condicionan el uso de CVC en una población prevalente en hemodiálisis (HD) con el fin de identificar aquellos factores modificables sobre los cuales actuar para conseguir los objetivos de las guías.
MétodosEstudio retrospectivo, descriptivo y observacional en el total de pacientes prevalentes en hemodiálisis crónica pertenecientes a siete centros de hemodiálisis extrahospitalarios de Madrid, Castilla y León y Galicia en un corte transversal realizado en junio 2021 (637 pacientes). Se analizan: edad, sexo, nacionalidad, etiología de la enfermedad renal crónica (ERC), el acceso vascular con el que iniciaron hemodiálisis, el número de fístulas arteriovenosas (FAV) previas fallidas, tiempo desde el inicio de la HD, tiempo desde la colocación del CVC por primera vez, la situación respecto a la cirugía y las causas de ser portador de CVC. En los pacientes cuya causa fue la negativa a realizarse una FAV se preguntó a los pacientes por la causa de la misma mediante interrogatorio dirigido.
ResultadosDe los 637 pacientes estudiados, 255 (40%) eran portadores de CVC, 346 portadores de FAV (54,3%) y 36 (5,7%) llevaban una prótesis. De los 255 pacientes portadores de CVC, 20,4% (52 pacientes) estaba pendiente de realización del acceso vascular (FAV/prótesis), 10,2% (26 pacientes) tenían la FAV realizada pero no se podía utilizar y 69,4% (177 pacientes) no se consideraron candidatos a cirugía (por cirugía vascular (16,9%; 43 pacientes), por nefrología (16,5%, 42 pacientes) y por negativa del paciente (36%; 92 pacientes). La causa más frecuente para la negativa a la FAV fue el miedo y las preferencias de los pacientes. Uno de los factores más importantes asociados al uso de CVC en pacientes prevalentes fue haber iniciado hemodiálisis mediante un CVC. El mayor uso de CVC al inicio de HD se asoció significativamente con tener más de una FAV realizada, o iniciar HD de manera urgente y no haber sido seguido y evaluado en la consulta de ERCA.
ConclusionesExiste un elevado porcentaje de pacientes con CVC por causas modificables que hace necesaria la evaluación sistemática del proceso de creación de FAV para potenciar la planificación, creación y mantenimiento del acceso vascular desde la consulta de ERCA, y alcanzar el objetivo de las guías.
Despite the recommendations of the clinical guidelines, the percentage of central venous catheters (CVC) continues to be above the recommended standards. We do not know whether the increasing use of catheters is due to unavoidable or avoidable factors and, in the latter case, it would be in our power to modify these results.
The aim of this study was to analyze the causes that condition the use of CVC in a prevalent hemodialysis (HD) population in order to identify those modifiable factors on which to act in order to achieve the objectives of the guidelines.
MethodsRetrospective, descriptive and observational study in all prevalent patients on chronic hemodialysis belonging to seven hemodialysis centers in Madrid, Castilla y León and Galicia in a cross-sectional study carried out in June 2021 (637 patients). The following were analyzed: age, sex, nationality, etiology of CKD, the vascular access with which they started hemodialysis, the number of previous failed arteriovenous fistulas (AVF), time since the start of HD, time since the placement of the CVC for the first time, the situation with respect to surgery and the causes of being a CVC carrier. In patients whose cause was refusal to undergo AVF, patients were asked about the cause of the refusal by directed questioning.
ResultsOf the 637 patients studied, 255 (40%) had a CVC, 346 had an AVF (54.3%) and 36 (5.7%) had a prosthesis. Of the 255 patients with CVC, 20.4% (52 patients) were awaiting vascular access (AVF/prosthesis), 10.2% (26 patients) had an AVF but could not be used and 69.4% (177 patients) were not considered candidates for surgery (due to vascular surgery (16.9%; 43 patients), nephrology (16.5%, 42 patients) and patient refusal (36%; 92 patients). The most frequent cause for refusal of AVF was fear and patient preference. One of the most important factors associated with CVC use in prevalent patients was having started hemodialysis with a CVC. The greatest use of CVC at the start of HD was significantly associated with having more than one AVF performed or starting HD urgently and not having been followed up and evaluated in the ACKD consultation.
ConclusionsThere is a high percentage of patients with a central venous catheter due to modifiable causes, which makes it necessary to systematically evaluate the process of creating AVF in order to enhance the planning, creation and maintenance of vascular access from the ACKD clinic, and to achieve the objective of the guidelines.
El incremento del porcentaje de catéteres venosos centrales (CVC) para hemodiálisis (HD) a lo largo de los años no es algo nuevo1, y esta realidad se reproduce en numerosos centros, comunidades y países2-4.
Desde la década de 1990, las guías clínicas han fomentado la colocación de una fístula arteriovenosa (FAV) siempre que sea posible en pacientes en HD5. Las guías españolas del acceso vascular (AV) para HD publicadas en 2017 establecen un estándar < 20% para CVC y > 75% en FAV de pacientes prevalentes6, mientras que las últimas guías Kidney Disease Outcomes Quality Initiative (KDOQI) de AV de 20197, aunque plantean un enfoque centrado en el paciente y en la necesidad de brindar atención más individualizada que incorpore los objetivos y las preferencias del paciente con una adecuada información de las complicaciones asociadas a cada preferencia, al mismo tiempo mantiene las mejores prácticas de calidad y seguridad, teniendo en cuenta las características de cada paciente8-10, en tanto siguen defendiendo el objetivo de menos de 10% de CVC para pacientes prevalentes en HD.
Esto se basa en la mejor supervivencia, menor coste económico y menor número de complicaciones en pacientes portadores de FAV frente a CVC11. A pesar de la amplia aceptación de la FAV como AV de elección, un cuerpo de literatura emergente plantea que la mejor supervivencia del paciente portador de FAV puede deberse a un mejor estado de salud previo12,13.
A pesar de los esfuerzos y de las recomendaciones, la cumplimentación de estos objetivos queda por detrás de las expectativas y los datos muestran que el AV sigue siendo una asignatura pendiente14.
Así, ante esta situación nos planteamos analizar si la utilización creciente de catéteres tiene su origen en factores evitables, como una planificación inadecuada o nuevas preferencias del médico o del paciente o en factores inevitables, como un cambio en las características de la población en hemodiálisis, cada vez más añosa y comórbida y nos preguntamos si los estándares propuestos por las guías son alcanzables o están fuera de nuestra área de control.
El objetivo de este estudio ha sido analizar y reflexionar sobre las causas que condicionan el uso de CVC en una población prevalente en hemodiálisis con el fin de identificar aquellos factores modificables sobre los que actuar para conseguir los objetivos de las guías.
Material y métodosDiseño de estudioEstudio retrospectivo, descriptivo y observacional en el total de pacientes prevalentes en hemodiálisis crónica pertenecientes a siete centros de hemodiálisis extrahospitalarios de las comunidades de Madrid, Castilla y León y Galicia en un corte transversal realizado en junio 2021. La población de estudio la forman los 637 pacientes en hemodiálisis con fecha de 30 de junio de 2021. Los pacientes eran remitidos desde el hospital de referencia al centro de hemodiálisis extrahospitalario –tanto la creación del primer acceso como los sucesivos dependían del servicio de cirugía del hospital de referencia–. Si un paciente llegaba al centro con CVC se evaluaba la situación y se remitía al Servicio de Cirugía Vascular del hospital de referencia, bien directamente o a través del Servicio de Nefrología.
En todos los centros existía un protocolo común de seguimiento y vigilancia del AV con métodos de primera generación diariamente y de segunda generación trimestralmente mediante métodos de cribado dilucionales para calcular la medición periódica del flujo sanguíneo (QA) de la FAV y la ecografía Doppler.
VariablesSe recogieron las siguientes variables: edad, sexo, nacionalidad, centro de diálisis, comunidad autónoma, etiología de la enfermedad renal crónica (ERC), tasa de trombosis de FAV y prótesis, el AV con el que iniciaron HD, el número de FAV previas fallidas, tiempo desde el inicio de la HD, tiempo desde la colocación del CVC por primera vez, la situación respecto a la cirugía y las causas de ser portador de CVC. En los pacientes cuya causa fue la negativa a realizarse una FAV se preguntó a los pacientes por la causa de la misma mediante interrogatorio dirigido.
Análisis estadísticoPara el análisis estadístico se utilizó la prueba χ2 de Pearson para variables categóricas, prueba t de Student (paramétrica) o prueba U de Mann-Whitney (no paramétrica) para variables continuas, o ANOVA de una vía para comparaciones múltiples. La normalidad de la distribución se evaluó mediante la prueba de Kolmogorov-Smirnov. Las variables continuas se informaron como media (desviación estándar) o mediana (rango intercuartílico), según correspondiera. Las variables categóricas se informaron como números (porcentaje). Se estudió la correlación mediante el coeficiente de correlación de Pearson. Todos los valores de p fueron de dos caras. La significación estadística se fijó en p < 0,05.
ResultadosDe los 637 pacientes estudiados, 255 (40%) eran portadores de CVC, 346 portadores de FAV (54,3%) y 36 (5,7%) llevaban una prótesis. La edad media era de 66,4±15,4 años, 65% eran varones y 10% eran de otras nacionalidades distintas a la española. La etiología de la ERC fue de 27,5% nefropatía diabética, 23,1% no filiada, 15,2% glomerular, 8% nefropatía tubulointersticial, 5,7% poliquistosis renal, 11% vascular y 9,4% otros
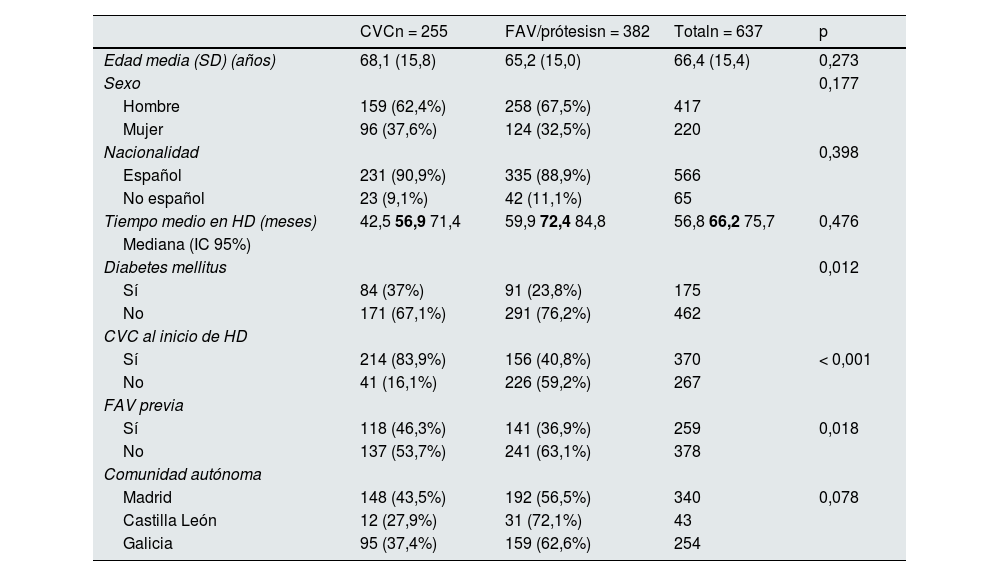
Factores asociados al uso de CVC en prevalentesLas características demográficas y los factores asociados al uso de CVC en pacientes prevalentes se muestran en la tabla 1. Los factores asociados al uso de CVC en pacientes prevalentes fueron la presencia de diabetes mellitus y haber iniciado hemodiálisis mediante un CVC (83,9% de los pacientes prevalentes portadores de CVC vs. 40,8% de los pacientes prevalentes portadores de FAV/prótesis [p<0,001]). No hubo diferencias significativas en cuanto a edad, sexo, nacionalidad, ni tiempo en hemodiálisis entre los pacientes prevalentes portadores de CVC.
Características demográficas y factores asociados al uso de catéteres venosos centrales en pacientes prevalentes
| CVCn = 255 | FAV/prótesisn = 382 | Totaln = 637 | p | |
|---|---|---|---|---|
| Edad media (SD) (años) | 68,1 (15,8) | 65,2 (15,0) | 66,4 (15,4) | 0,273 |
| Sexo | 0,177 | |||
| Hombre | 159 (62,4%) | 258 (67,5%) | 417 | |
| Mujer | 96 (37,6%) | 124 (32,5%) | 220 | |
| Nacionalidad | 0,398 | |||
| Español | 231 (90,9%) | 335 (88,9%) | 566 | |
| No español | 23 (9,1%) | 42 (11,1%) | 65 | |
| Tiempo medio en HD (meses) | 42,5 56,9 71,4 | 59,9 72,4 84,8 | 56,8 66,2 75,7 | 0,476 |
| Mediana (IC 95%) | ||||
| Diabetes mellitus | 0,012 | |||
| Sí | 84 (37%) | 91 (23,8%) | 175 | |
| No | 171 (67,1%) | 291 (76,2%) | 462 | |
| CVC al inicio de HD | ||||
| Sí | 214 (83,9%) | 156 (40,8%) | 370 | < 0,001 |
| No | 41 (16,1%) | 226 (59,2%) | 267 | |
| FAV previa | ||||
| Sí | 118 (46,3%) | 141 (36,9%) | 259 | 0,018 |
| No | 137 (53,7%) | 241 (63,1%) | 378 | |
| Comunidad autónoma | ||||
| Madrid | 148 (43,5%) | 192 (56,5%) | 340 | 0,078 |
| Castilla León | 12 (27,9%) | 31 (72,1%) | 43 | |
| Galicia | 95 (37,4%) | 159 (62,6%) | 254 |
CVC: catéter venoso central; SD: desviación estándar; HD: hemodiálisis; FAV: fístula arteriovenosa; IC 95%: intervalo de confianza de 95%.
Se colocan en redondas las cifras del IC y en negrita la mediana.
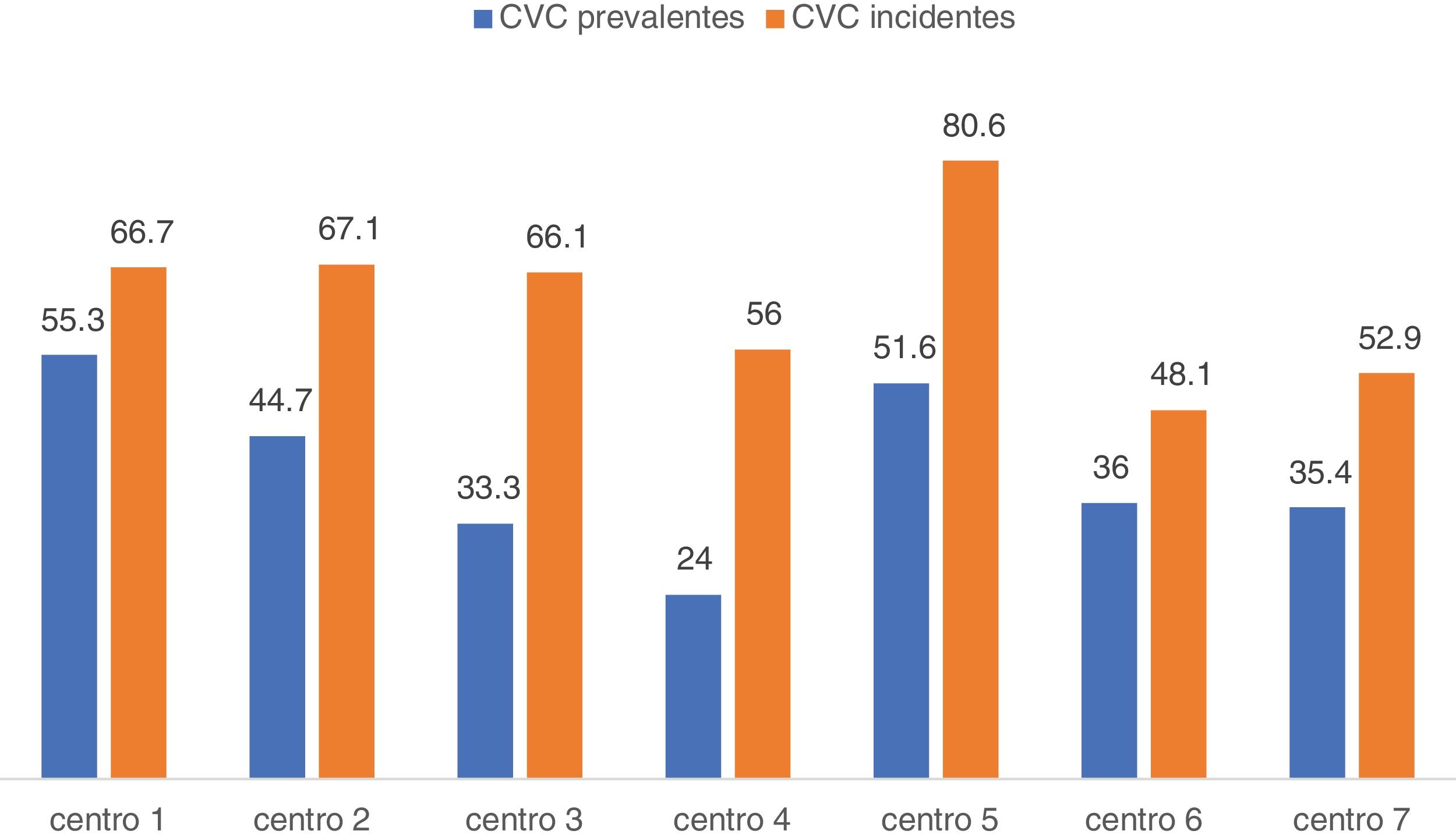
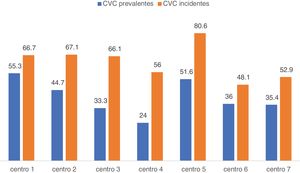
No existían diferencias significativas según comunidades autónomas (tabla 1), pero sí en relación con el hospital de referencia y centro (p = 0,004) (fig. 1). El promedio de trombosis de fístulas autólogas fue 0,04 y el de prótesis 0,22 en los centros. No se encontraron diferencias significativas en la tasa de trombosis ni por centros ni por comunidades autónomas (p = 0,076).
Existía una correlación positiva entre iniciar HD con CVC y el mantener el CVC posteriormente (r: 0,41; p<0,001).
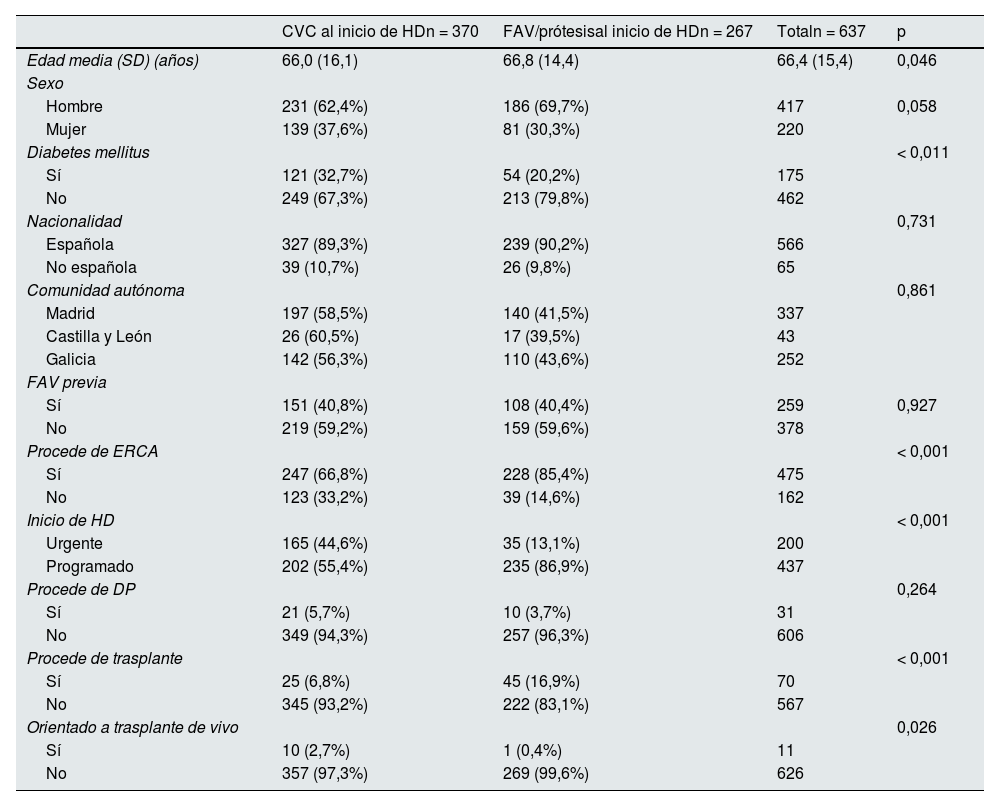
Factores asociados al uso de CVC al inicio de hemodiálisisEl inicio de HD a través de CVC se asoció significativamente con iniciar HD de manera urgente y no haber sido seguido y evaluado en la consulta de ERCA (tabla 2). No hubo diferencias estadísticamente significativas en el uso de CVC entre los pacientes de ERCA que llevaban más de seis meses (149/450; 33,1%) y los que llevaban menos de seis meses (12/25; 48%); p = 0,303. Los pacientes procedentes de trasplante u orientados a trasplante de vivo tenían más riesgo de iniciar HD con CVC.
Factores asociados al uso de catéteres venosos centrales al inicio de HD
| CVC al inicio de HDn = 370 | FAV/prótesisal inicio de HDn = 267 | Totaln = 637 | p | |
|---|---|---|---|---|
| Edad media (SD) (años) | 66,0 (16,1) | 66,8 (14,4) | 66,4 (15,4) | 0,046 |
| Sexo | ||||
| Hombre | 231 (62,4%) | 186 (69,7%) | 417 | 0,058 |
| Mujer | 139 (37,6%) | 81 (30,3%) | 220 | |
| Diabetes mellitus | < 0,011 | |||
| Sí | 121 (32,7%) | 54 (20,2%) | 175 | |
| No | 249 (67,3%) | 213 (79,8%) | 462 | |
| Nacionalidad | 0,731 | |||
| Española | 327 (89,3%) | 239 (90,2%) | 566 | |
| No española | 39 (10,7%) | 26 (9,8%) | 65 | |
| Comunidad autónoma | 0,861 | |||
| Madrid | 197 (58,5%) | 140 (41,5%) | 337 | |
| Castilla y León | 26 (60,5%) | 17 (39,5%) | 43 | |
| Galicia | 142 (56,3%) | 110 (43,6%) | 252 | |
| FAV previa | ||||
| Sí | 151 (40,8%) | 108 (40,4%) | 259 | 0,927 |
| No | 219 (59,2%) | 159 (59,6%) | 378 | |
| Procede de ERCA | < 0,001 | |||
| Sí | 247 (66,8%) | 228 (85,4%) | 475 | |
| No | 123 (33,2%) | 39 (14,6%) | 162 | |
| Inicio de HD | < 0,001 | |||
| Urgente | 165 (44,6%) | 35 (13,1%) | 200 | |
| Programado | 202 (55,4%) | 235 (86,9%) | 437 | |
| Procede de DP | 0,264 | |||
| Sí | 21 (5,7%) | 10 (3,7%) | 31 | |
| No | 349 (94,3%) | 257 (96,3%) | 606 | |
| Procede de trasplante | < 0,001 | |||
| Sí | 25 (6,8%) | 45 (16,9%) | 70 | |
| No | 345 (93,2%) | 222 (83,1%) | 567 | |
| Orientado a trasplante de vivo | 0,026 | |||
| Sí | 10 (2,7%) | 1 (0,4%) | 11 | |
| No | 357 (97,3%) | 269 (99,6%) | 626 |
CVC: catéter venoso central; DP: diálisis peritoneal; SD: desviación estándar; HD: hemodiálisis; FAV: fístula arteriovenosa; ERCA: enfermedad renal crónica avanzada.
En la figura 2 se muestra el flujo de pacientes y los motivos por los que los pacientes son portadores de CVC en el momento del estudio.
Motivos por los que los pacientes son portadores de catéteres venosos centrales (CVC)
AV: acceso vascular; FAV: fístula arteriovenosa; pac: pacientes.
- a)
Pendiente de cirugía por otros motivos que incluyen imposibilidad de realizar cirugía del AV por ingresos, otras cirugías, etc.
- b)
AV no funcionante que incluye: fallo primario (9 pac-3,5%) o trombosis reciente (2 pac-0,78%).
- c)
FAV no puncionable que incluye: en proceso de maduración (8 pac-3,13%); FAV húmero-basílica no puncionable pendiente de superficialización (5 pac-1,96%); fractura del brazo de la FAV que impide su uso (2 pac-0,78%).
- d)
Desestimado por cirugía vascular que incluye: falta de lecho vascular (25 pac -9,8%), cierre de FAV por isquemia (4 pac-1,56%), múltiples trombosis previas (14 pac-5,49%).
- e)
Desestimado por nefrología que incluye: edad y/o comorbilidad (36 pac-14,1%), descanso de diálisis peritoneal (3 pac-1,17%), posible recuperación de función renal (1 pac-0,39%), orientación a trasplante de vivo (2 pac-0,78%).
- f)
Miedo a la realización de la FAV que incluye: miedo a cirugía y punciones por malas experiencias previas (31 pac-12,1%) y miedo a cirugía y punciones sin cirugías previas (27 pac-10,5%).
- g)
Preferencia por el catéter que incluye: estética, comodidad (34 pac-13,3%).
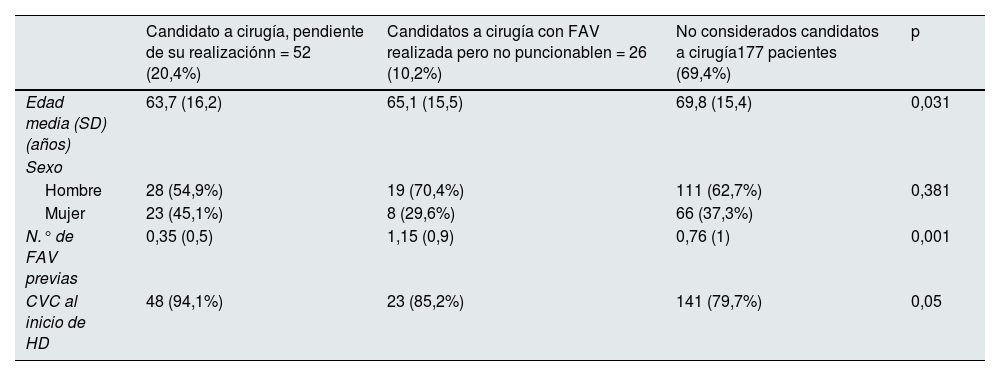
En la tabla 3 se muestran las características demográficas de los diferentes grupos de pacientes prevalentes portadores de CVC.
Características demográficas de los diferentes grupos de pacientes prevalentes portadores de CVC
| Candidato a cirugía, pendiente de su realizaciónn = 52 (20,4%) | Candidatos a cirugía con FAV realizada pero no puncionablen = 26 (10,2%) | No considerados candidatos a cirugía177 pacientes (69,4%) | p | |
|---|---|---|---|---|
| Edad media (SD) (años) | 63,7 (16,2) | 65,1 (15,5) | 69,8 (15,4) | 0,031 |
| Sexo | ||||
| Hombre | 28 (54,9%) | 19 (70,4%) | 111 (62,7%) | 0,381 |
| Mujer | 23 (45,1%) | 8 (29,6%) | 66 (37,3%) | |
| N.° de FAV previas | 0,35 (0,5) | 1,15 (0,9) | 0,76 (1) | 0,001 |
| CVC al inicio de HD | 48 (94,1%) | 23 (85,2%) | 141 (79,7%) | 0,05 |
CVC: catéter venoso central; SD: desviación estándar; HD: hemodiálisis; FAV: fístula arteriovenosa
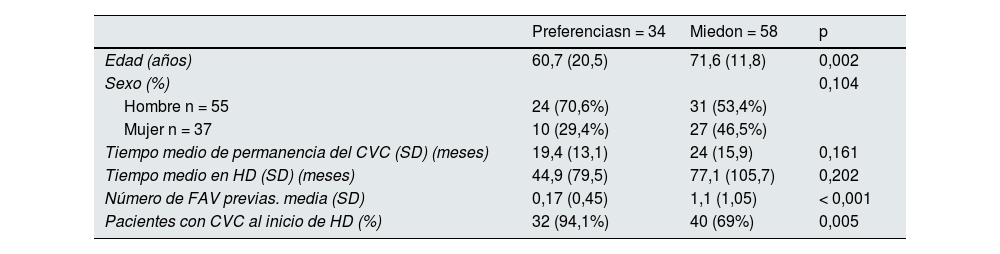
De los 255 pacientes en HD portadores de CVC, 92 (36%) se negaron a realizarse una FAV. Se pueden identificar dos poblaciones: aquellos que tenían miedo a realizarse una FAV bien por las punciones o la cirugía, y aquellos que preferían el CVC ante la FAV por estética o comodidad. La causa más frecuente de miedo se debía a complicaciones previas. En la tabla 4 se muestran las diferencias existentes entre aquellos pacientes que se negaban por miedo y los que se negaban por preferencias. Los pacientes que preferían el CVC eran más jóvenes y 94% había iniciado HD con CVC.
Factores asociados con las causas de negativa del paciente a la creación de FAV (miedo y preferencias)
| Preferenciasn = 34 | Miedon = 58 | p | |
|---|---|---|---|
| Edad (años) | 60,7 (20,5) | 71,6 (11,8) | 0,002 |
| Sexo (%) | 0,104 | ||
| Hombre n = 55 | 24 (70,6%) | 31 (53,4%) | |
| Mujer n = 37 | 10 (29,4%) | 27 (46,5%) | |
| Tiempo medio de permanencia del CVC (SD) (meses) | 19,4 (13,1) | 24 (15,9) | 0,161 |
| Tiempo medio en HD (SD) (meses) | 44,9 (79,5) | 77,1 (105,7) | 0,202 |
| Número de FAV previas. media (SD) | 0,17 (0,45) | 1,1 (1,05) | < 0,001 |
| Pacientes con CVC al inicio de HD (%) | 32 (94,1%) | 40 (69%) | 0,005 |
CVC: catéter venoso central; DE: desviación estándar; HD: hemodiálisis; FAV: fístula arteriovenosa.
El principal hallazgo de este estudio es que, a pesar de las recomendaciones de las guías de práctica clínica6,7, el porcentaje de CVC en las unidades de HD sigue siendo elevado (en nuestro estudio 20% por encima de lo recomendado según las guías [< 25%]), lo que va en consonancia con otras publicaciones similares1–4.
La variabilidad existente entre países y centros2–4, como se muestra también en este estudio, nos plantea la siguiente disyuntiva: ¿existen factores modificables sobre los que podamos intervenir para alcanzar los objetivos propuestos por las guías? O, por el contrario, en la actualidad, y con los nuevos criterios de individualización y la incorporación del paciente de manera activa en la toma de decisiones sobre el AV15, debemos asumir que no es posible la consecución de los objetivos planteados. ¿Podríamos revertir la situación cambiando actuaciones o mejorando procesos? O, por el contrario, ¿deberíamos cambiar estándares y adecuarlos a la realidad?
Diferentes factores pueden estar contribuyendo a la elevada prevalencia de CVC en las unidades: unos dependientes del propio paciente16, otros del equipo quirúrgico17 y otros de factores organizativos e, incluso, factores sobrevenidos en los últimos años como la influencia de la pandemia por COVID en la creación del AV18. Analizar estos factores de una manera reflexiva puede orientarnos hacia qué medidas que podemos implementar para mejorar los resultados del AV, actuando sobre aquellos factores modificables.
En este estudio, factores inevitables dependientes del paciente como la edad, el sexo o la nacionalidad no española no influyeron a nivel general en el mayor uso de CVC en prevalentes y al inicio de HD, aunque el grupo de pacientes que fue desestimado para cirugía tenía una edad superior al resto. La edad por sí sola no es considerada una contraindicación para la realización de FAV, pero es un tema complejo que genera controversias y requiere un equilibrio entre las preferencias del paciente, la probabilidad de que el AV funcione, y las posibles complicaciones en el contexto de la limitada supervivencia del paciente19,20. Aunque puede estar poniendo de manifiesto la dificultad real de realizar una FAV en una población cada vez más envejecida, con más comorbilidad y peor árbol vascular, también está sujeta a subjetividad, tanto del nefrólogo como del cirujano vascular. De hecho, la experiencia e implicación del cirujano vascular no solo influye en los resultados de los AV, sino también en la decisión de desestimar a un paciente para FAV o, incluso, en la negativa del paciente a realizarse una FAV y es un factor modificable21,22. Hay estudios que demuestran la importancia de una mayor formación y educación continua en el AV a residentes, nefrólogos y cirujanos vasculares puede evitar la negativa por parte del paciente a realizar una FAV23-25.
La organización es un factor modificable y al alcance de todos. Se ha demostrado que los diferentes modelos de gestión del AV y la relación entre cirugía vascular y nefrología tiene una enorme influencia en los resultados del AV26. En este estudio, hasta 30% de pacientes, a pesar de ser considerados candidatos a FAV/prótesis, se dializaban a través de un CVC. Dos tercios de ellos eran pacientes que todavía estaban pendientes de cirugía y se encontraban en diferentes momentos del proceso (fig. 1), lo que muestra la necesidad de mejorar la planificación del AV. Además del filtrado glomerular y su progresión6,26, hay que considerar otros factores a la hora de decidir el momento de remisión de un paciente para la creación de una AV, por ejemplo, los tiempos de espera del servicio de cirugía vascular o las características del paciente y su entorno27. La decisión debe individualizarse y se debería derivar a cirugía de manera temprana a pacientes en los que exista riesgo de una maduración más lenta o complicaciones (mujeres, edad avanzada, diabetes mellitus, arteriopatía periférica, tabaquismo u obesidad)28,29, aquellos que van a requerir técnicas más complejas (superficialización)30, los portadores de comorbilidades que supongan riesgo de descenso rápido del filtrado glomerular y pueda derivar de una entrada urgente en HD31 o pacientes en los que por su situación social o familiar tengan riesgo de pérdida de seguimiento en consulta32.
Otro factor evitable que muestra este estudio es el hecho de que la utilización de CVC al inicio de HD se asocia al inicio urgente de HD y no haber tenido seguimiento en la consulta de enfermedad renal crónica avanzada (ERCA)33. Todavía queda un importante reto de detección precoz de la ERC entre la población, de difusión del conocimiento en atención primaria y otras especialidades para que se deriven estos pacientes de manera temprana a nefrología34.
Es de destacar el elevado porcentaje de pacientes hallado en este estudio que se niega a realizarse una FAV (36%), siendo el miedo y las preferencias las causas más importantes. Este miedo se asocia con las elevadas tasas de prevalencia de ansiedad y depresión que afectan a los pacientes en diálisis y que influirán en sus preferencias35. En un estudio a nivel nacional, donde se analizaron las causas más frecuentes de inquietud ante una operación quirúrgica, las causas más importantes fueron: el miedo a lo desconocido, las posibles complicaciones, la afectación a la calidad de vida o el control del dolor36. La comunidad científica considera la FAV como el AV óptimo basándose en su menor tasa de infección, morbimortalidad y costes, sin embargo, los pacientes priorizan la influencia del AV en su calidad de vida y perspectivas futuras37,38. La asociación entre miedo y número de intentos de FAV previos sugiere la necesidad de disminuir experiencias negativas en los pacientes. Es importante la elección del mejor AV y unas manos expertas tanto de cirujanos como enfermería. En la negativa a la creación de una FAV se ha descrito una importante asociación entre la preferencia por un CVC y el hecho de ser o haber sido en algún momento portador del mismo, como también se muestra en este estudio39,40, por lo que otro aspecto modificable para minimizar las negativas es evitar que los pacientes inicien hemodiálisis con un CVC. La elección del AV junto al del tratamiento renal sustitutivo es un proceso que necesita información y tiempo en las consultas de ERCA41. Debemos ser capaces de identificar las barreras que impiden que esta información se haga de forma adecuada y adaptada a cada paciente, basándonos en técnicas específicas de comunicación en situaciones de crisis de salud42.
Por último, la vigilancia adecuada del AV mediante métodos de primera y segunda generación permiten detectar precozmente la estenosis y prevenir la trombosis, y es un factor modificable que puede influir en la tasa de CVC. En este estudio las tasas de trombosis, tanto de FAV como de prótesis, fueron bajas e inferiores a los valores recomendados por las guías del Grupo Español Multidisciplinar del Acceso Vascular (GEMAV)6.
Dentro de las limitaciones de este estudio cabe destacar su carácter retrospectivo y, al tratarse de datos recogidos a la llegada al centro periférico, existe la dificultad de profundizar en datos relativos al proceder dentro de la consulta de ERCA o la consulta de trasplante (filtrado glomerular [FG] al momento del envío, persona que informa y con la que decide el AV, etc.). Sin embargo, este estudio tiene como fortalezas: mostrar resultados de una amplia muestra de pacientes, de diferentes centros, hospitales y comunidades autónomas, lo que ofrece una visión más global que si se trata de un solo centro y permite hacer una reflexión sobre acciones futuras de mejora en relación con el AV.
En conclusión, todavía existen causas modificables que influyen en el elevado porcentaje de pacientes con CVC, lo que hace necesaria una evaluación sistemática para identificar las barreras que dificultan el proceso de creación de FAV. Se necesitan estrategias para potenciar la planificación, creación y mantenimiento del AV desde la consulta de ERCA, con el principal objetivo de que la mayoría de los pacientes puedan realizar HD con el mejor AV posible tras una valoración individualizada por el equipo multidisciplinar, para asegurar que los resultados no son fruto de una mala organización, gestión, variabilidad de criterios o experiencia de los profesionales responsables del AV.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.