Los avances en el conocimiento de los mecanismos que intervienen en el alorreconocimiento y en los elementos efectores de la respuesta inmunitaria, así como de los mecanismos de inmunorregulación, han consolidado el trasplante renal. En este contexto, el sistema principal de histocompatibilidad y la respuesta humoral han adquirido un peso muy importante en el pronóstico del trasplante.
INMUNOBIOLOGÍA DEL TRASPLANTE Sistema principal de histocompatibilidadLos antígenos del complejo mayor de histocompatibilidad (CMH), además de presentar antígenos a los linfocitos T, son los encargados de identificar las células del organismo y diferenciarlas de las extrañas, funcionando como una especie de documento de identidad de cada célula. El elevado polimorfismo genético del CMH permite un gran número de combinaciones de estas moléculas, y la probabilidad de que dos individuos tengan los mismos determinantes antigénicos es extremadamente baja. Los genes que codifican las proteínas que forman este sistema antigénico en el ser humano (antígeno leucocitario humano [human leukocyte antigen, HLA]) están en el cromosoma 6. Los más relevantes codifican dos tipos de antígenos con distinta función biológica: los de clase I (locus A, B y C) y los de clase II (locus DR, DP y DQ). Los antígenos de clase I aparecen en casi todas las células nucleadas del organismo, en tanto que los de clase II se limitan a las células encargadas de la presentación de antígenos: linfocitos B, macrófagos y células dendríticas, principalmente. Las moléculas de clase I se especializan en presentar los péptidos procesados a los linfocitos T CD8, mientras que las de clase II los presentan a los CD4.
La traducción de cada gen del sistema HLA da lugar a una proteína homogénea en la que se intercalan algunas regiones muy variables y polimórficas que reciben el nombre de epítopos y que se comportan como aloantígenos. Cada epítopo o combinación de epítopos es específico de cada alelo, pero algunos alelos de los distintos loci pueden compartir epítopos. Estos motivos compartidos explican las relaciones que tienen entre sí determinadas especificidades (divisiones o splits, grupos de reacción cruzada, antígenos públicos) y deben tenerse en cuenta en la interpretación de los estudios de anticuerpos y en la selección de donantes. Más recientemente se ha descrito la estructura tridimensional de los antígenos HLA y las secuencias aminoacídicas lo que ha permitido definir sus bases estructurales. De este modo, lo que comienza a proponerse actualmente es que más que el polimorfismo a nivel alélico del HLA se consideren los residuos polimórficos de aminoácidos en la superficie del HLA con capacidad inmunogénica y que pueden ser desencadenantes de la respuesta humoral frente al injerto. Es lo que se conoce como eplets, que vienen a ser los epítopos del HLA reconocidos por las regiones determinantes de complementaridad (CDR) de los anticuerpos.
Reconocimiento antigénico y activación de la respuesta inmunitariaSalvo en los casos de gemelos HLA idénticos, en los que las células del injerto son reconocidas como propias, la puesta en contacto del paciente con el injerto activará el sistema inmunitario, que reconocerá a las células extrañas y las destruirá. Esta activación es tanto más intensa cuanto mayor es la disparidad inmunológica de la pareja donante/receptor. La sensibilización previa específica del receptor contra las células del donante puede dar lugar a una destrucción inmediata del injerto (rechazo hiperagudo) a través de mecanismos humorales (anticuerpos anti-HLA) en los que interviene la activación del complemento.
La destrucción de un aloinjerto por el sistema inmunitario del receptor tiene lugar en dos fases bien diferenciadas [1]: una fase inicial en la que se produce el reconocimiento de las células del injerto como extrañas (fase de reconocimiento o fase de inducción de la respuesta) y una segunda fase en la que se produce la activación de los mecanismos de destrucción del injerto (fase efectora).
Las primeras células del receptor que tienen contacto con el injerto son las células presentadoras de antígenos (CPA: células dendríticas, macrófagos y células endoteliales), que adquieren y procesan los aloantígenos del donante ensamblándolos junto con moléculas del CMH del receptor en la superficie celular para su presentación a los linfocitos T del receptor, que los reconoce mediante su receptor de células T (T cell receptor [TCR]). Esta es la señal principal del reconocimiento antigénico por la vía indirecta. Para que se lleve a cabo el proceso de reconocimiento antigénico (señal coestimuladora o segunda señal) se necesita otra señal accesoria, que consiste en la unión de la molécula CD28 del linfocito T con la molécula B7 de la CPA. Además, existe otro tipo de alorreconocimiento por la vía directa, mediante la cual las células T del receptor reconocen directamente los antígenos sin procesar del CMH expresados en la superficie de las CPA del donante. La vía directa parece actuar preferentemente en las fases iniciales del trasplante y sería responsable del rechazo agudo, mientras que la indirecta lo hace en fases más tardías y tendría un papel más relevante en el rechazo crónico [2].
La generación de una señal principal y secundaria correctas induce la síntesis por el linfocito T de interleucina 2 (IL-2) y otras citocinas, así como la expresión del receptor de la IL-2 (IL-2R) en su superficie, lo que permite la expansión clonal de los linfocitos alorreactivos. Según las condiciones locales en que se encuentre el injerto y las sistémicas del receptor, la respuesta aloinmunitaria se dirigirá a un tipo de respuesta T helper (Th) CD4+. Así, las respuestas Th1 y Th17, caracterizadas por la secreción de interferón gamma? (IFN-g) e IL-17, respectivamente, favorecen la respuesta celular citotóxica, mientras que la respuesta Th2, definida por la secreción principalmente de IL-4, facilita el rechazo humoral por aloanticuerpos. No obstante, los mecanismos inflamatorios propios de la respuesta Th1/Th17 también pueden favorecer el rechazo humoral. En el rechazo crónico parece cada vez más relevante el papel de los anticuerpos anti-HLA [3]. Finalmente, se reconoce que existe un balance entre las respuestas efectoras frente al injerto comentadas y las respuestas supresoras y/o reguladoras, como las células T reguladoras, capaces de suprimir la respuesta inmune por diversos mecanismos de acción.
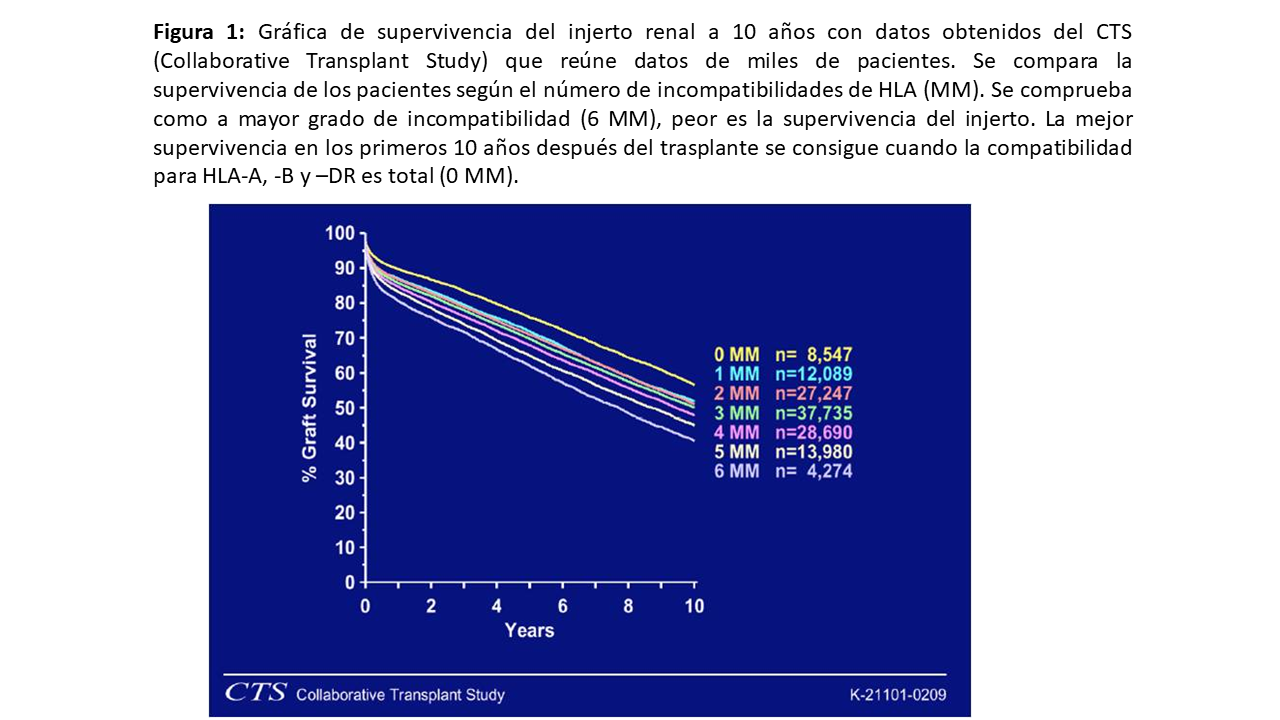
ESTUDIOS INMUNOLÓGICOS DEL DONANTE Y DEL RECEPTOR DEL TRASPLANTE RENAL Tipificación HLAEn el caso del trasplante renal, la determinación de los antígenos HLA en donante y receptor es obligatoria, dada la relación incuestionable entre su compatibilidad y la evolución del injerto con independencia de cualquier otro factor: la supervivencia del injerto a largo plazo disminuye cuanto mayor es el número de incompatibilidades HLA (Figura 1). El tipaje HLA solía determinarse mediante métodos serológicos pero cada día más se imponen los métodos moleculares que permiten una mayor definición a nivel alélico, lo cual cobra especial relevancia en el manejo del rechazo humoral [4].
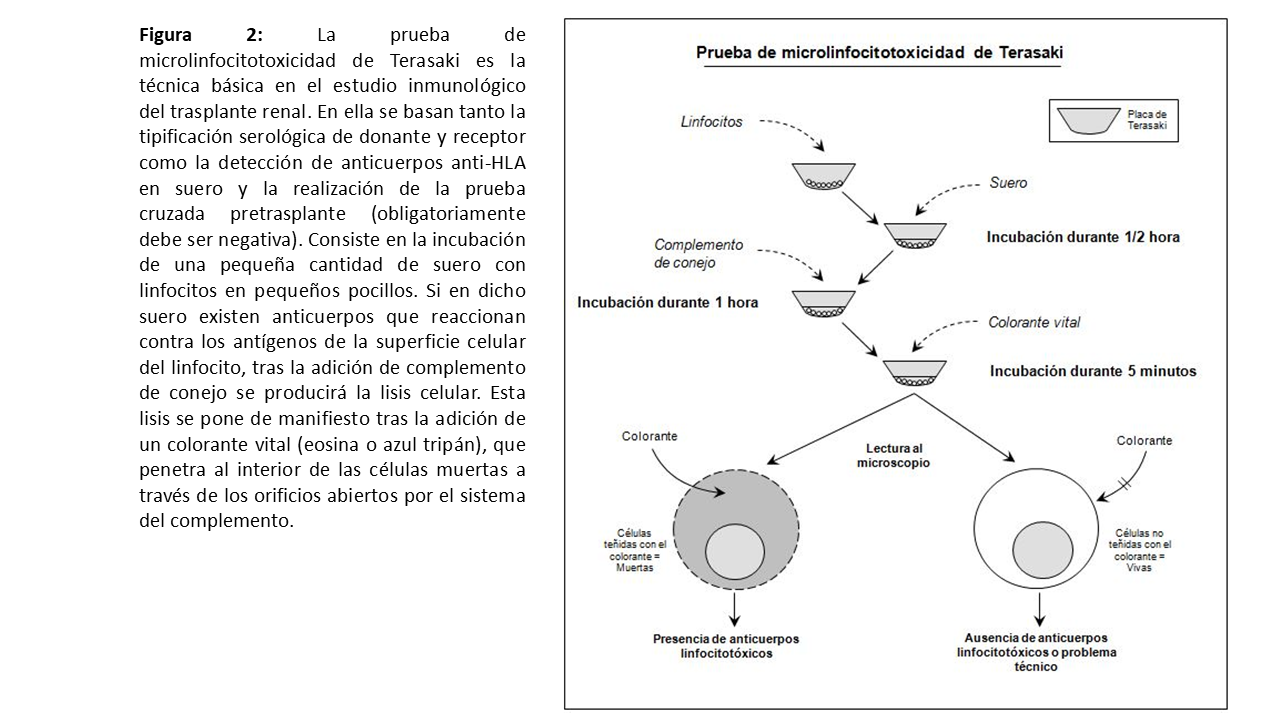
Métodos serológicosLa tipificación por métodos serológicos consiste en la determinación de los alelos del sistema HLA que se expresan en un individuo. Clásicamente se realizaba incubando las células (linfocitos) del receptor con sueros que contenían anticuerpos contra especificidades HLA conocidas. Tras la adición de complemento de conejo, se produce la lisis de las células con aquellos sueros que contengan anticuerpos específicos contra los determinantes antigénicos que expresen en su superficie (prueba de microlinfocitotoxicidad de Terasaki) (Figura 2). Un análisis detallado (utilizando varios sueros) de aquellos que producen lisis celular y de los que no la producen permite averiguar los determinantes antigénicos que muestran las células del individuo. Para estudiar los antígenos de clase II de los locus DR y DQ hay que separar los linfocitos B del resto, puesto que son los únicos que expresan HLA de clase II. La técnica serológica es barata y rápida, pero prácticamente se ha abandonado en la rutina.
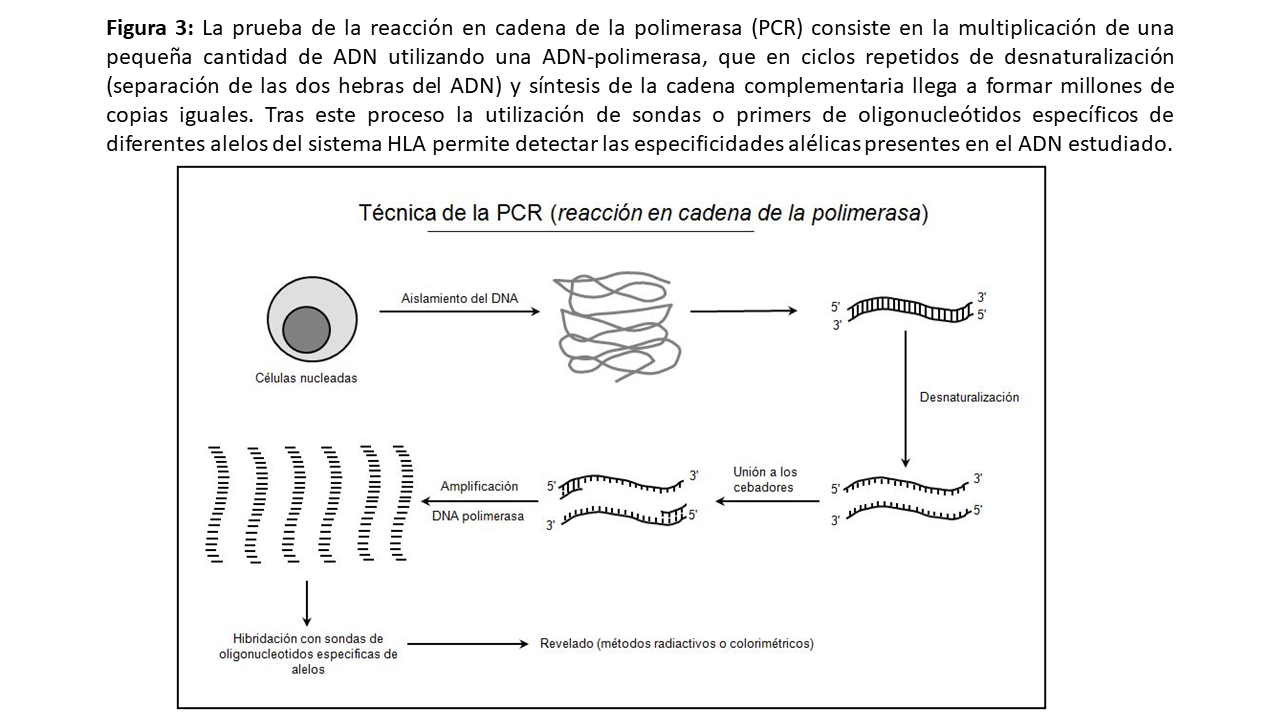
Análisis del ADN (métodos moleculares)Con la metodología de la reacción en cadena de la polimerasa (polymerase chain reaction [PCR]) es posible definir un mayor número de especificidades y con mayor grado de resolución en trasplante que con los métodos serológicos. Aunque hasta la fecha se ha empleado el nivel de resolución equivalente al serológico (2 dígitos: por ejemplo, HLA-A*02), la mayor resolución del tipaje molecular está ganando importancia dado el papel creciente de los anticuerpos anti-HLA en la evolución del injerto renal [5]. Por ello, está prácticamente aceptado aumentar la resolución a 4 dígitos (diferencias de aminoácidos a nivel de alelos), especialmente en el caso de pacientes hipersensibilizados (Figura 3) .
Las técnicas moleculares se centran en los exones polimórficos 2 y 3 del HLA-I y en el exón 2 del HLA-II. Los métodos moleculares se dividen en tres tipos según se basen en sitios de restricción (secuencias reconocidas por los sitios de restricción o PCR-RFLP), en secuencias específicas o en la conformación de la molécula de ácido desoxirribonucléico (ADN). En el caso del trasplante renal, las técnicas más empleadas actualmente son las basadas en secuencias específicas (PCR-SSP y, sobre todo, PCR-SSO). Sus grandes ventajas son su rapidez, sencillez y reproducibilidad. Las basadas en secuenciación, como la NGS (Next Generation Sequencing) que se está introduciendo, se emplean en situaciones complejas de hipersensibilizados y en trasplante de médula ósea [6] [7] [8].
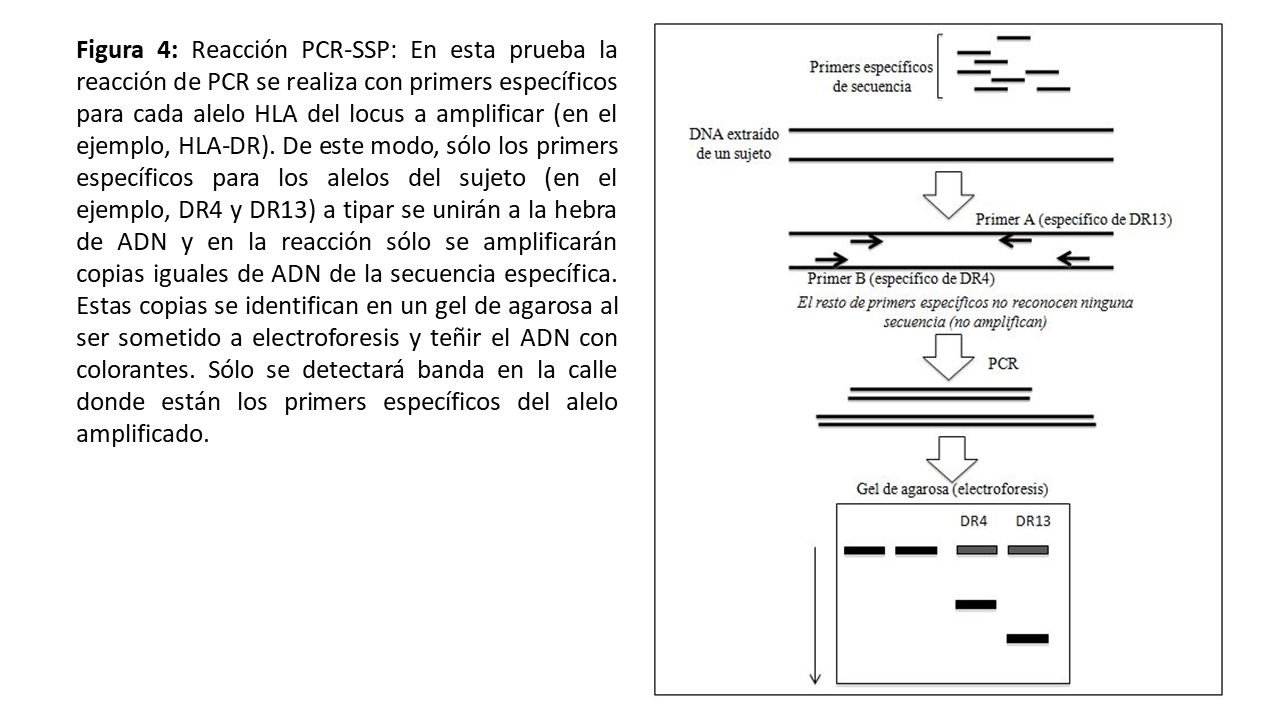
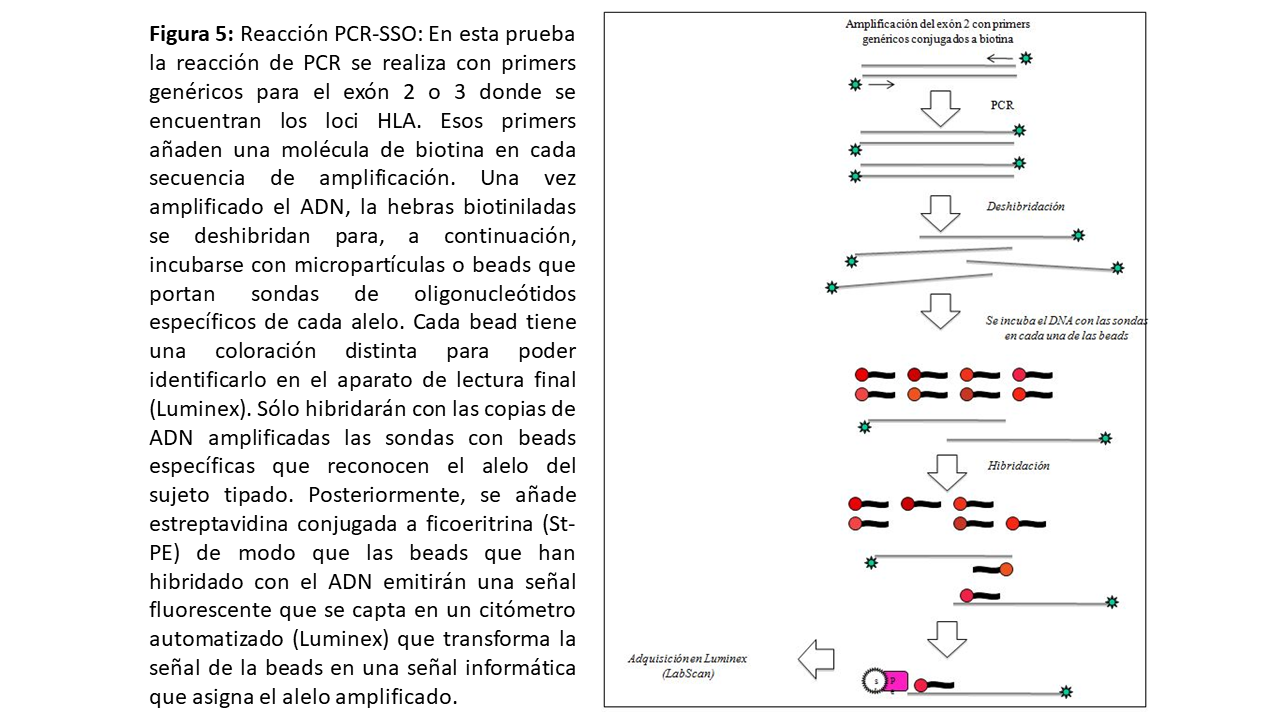
La PCR-SSP (sequence specific priming) utiliza primers que tienen secuencias complementarias de secuencias específicas de las especificidades HLA conocidas. Se pueden emplear múltiples pares de primers de forma independiente con la misma muestra de ADN (Figura 4). Esta técnica se emplea fundamentalmente durante el tipaje realizado en la alarma de trasplante puesto que es rápida y permite trabajar con la muestra individual del donante. La PCR-SSO (sequence specific oligonucleotide) amplifica todo el locus donde se encuentran los exones de HLA-I y HLA-II por PCR. Posteriormente, ese ADN se hibrida con sondas de oligonucleótidos marcadas en un soporte sólido (PCR-SSO directa). En los últimos años se ha adaptado la tecnología Luminex al tipaje HLA. Se trata de una variante de los test de fase sólida (ver más adelante): las microesferas de Luminex llevan fijadas las sondas de ADN características. Tras la amplificación por PCR, el DNA problema se hibrida a una microesfera, y queda marcado con un fluorocromo (Figura 5). Dado que cada microesfera del test tiene un color específico, la combinación del color específico de la esfera y del fluorocromo del DNA permite la lectura mediante un citómetro de flujo, la cual será interpretada por el programa de tipaje [9]. La PCR-SSO se ha adaptado para permitir un tipaje HLA en un tiempo equivalente a la PCR-SSP y actualmente se está implantando también durante las alarma de trasplante.
Compatibilidad HLA entre el donante y el receptorUna vez obtenido el tipaje HLA del donante y del receptor se puede definir el grado de compatibilidad HLA entre ambos. A mayor compatibilidad (número de identidades) menor riesgo de respuesta inmune del receptor contra el órgano [10]. El número de incompatibilidades del donante que se introducen en el receptor con el órgano (antígenos no compatibles) es importante porque definirá el riesgo y el tipo de sensibilización humoral contra el donante en caso de que se produzca.
En general se persigue la compatibilidad en los loci A, B y DR (y está introduciéndose el de C y DQ) a nivel genérico pero no alélico. Las principales razones son:
• Escaso tiempo entre la extracción del órgano y el trasplante para poder hacer un tipaje de mayor resolución.
• El número de pacientes en lista de espera es suficientemente bajo como para conseguir encontrar suficiente número de receptores compatibles a nivel alélico.
• No se ha demostrado hasta ahora que incluir la compatibilidad de otros loci (C, DQ y DP) mejore los resultados a largo plazo
Sin embargo, ante el reconocimiento cada vez más frecuente de especificidades de anticuerpos anti-HLA dirigidos fernte a HLA-C y –DQ, se consideran ya los 5 loci, quedano sólo relegado el locus HLA-DP, por el momento.
En los últimos tiempos cada vez tiene más auge el valorar la compatibilidad por epítopos entre donante y receptor (como se explica más arriba) en lugar de por alelos. Esto nos puede dar una información más fina y precisa sobre el grado de compatibilidad y por tanto hacer una selección donante/receptor más adecuada lo que probablemente pueda tener influencia en los resultados a largo plazo. Sin embargo esto aun no está disponible en la práctica clínica por su complejidad.
Detección de anticuerpos circulantesLos pacientes en lista de espera de trasplante renal deben ser objeto de un estudio periódico (trimestral y ante cualquier evento sensibilizante) para detectar la existencia y, en su caso, las especificidades y la evolución de los títulos de anticuerpos anti-HLA, lo que resulta imprescindible para un correcto manejo de estos pacientes a la hora de realizar el trasplante. La detección y caracterización de anticuerpos aumenta las posibilidades de éxito del trasplante, pero a la vez, cuantos más anticuerpos detectemos (especificidades prohibidas), más se reducen las posibilidades de encontrar un donante compatible. Por tanto, nos movemos en un estrecho equilibrio entre la sensibilidad (que permite detectar el máximo número de anticuerpos en el receptor, y mejorar la supervivencia del injerto) y la especificidad (que permite caracterizar aquellos anticuerpos con verdadera relevancia clínica) [11]. Los nuevos métodos de caracterización de anticuerpos anti-HLA, como Luminex, han introducido cierta confusión a la hora de tomar decisiones clínicas. A continuación se destacan los datos prácticos para la interpretación de estos resultados.
Detección de anticuerpos por citotoxicidadLa detección de anticuerpos se ha realizado tradicionalmente basándose en la prueba de microlinfocitotoxicidad de Terasaki. Debe enfrentarse el suero a un panel de linfocitos representativo de la población general (lo cual supone un mínimo de 20 donantes diferentes, y preferiblemente entre 30 y 50). De esta forma se puede determinar el número de donantes contra el que reacciona el suero, lo que se denomina porcentaje de reactividad contra panel (panel reactive activity [PRA]).
La aparición de anticuerpos anti-HLA es, en la mayoría de los casos, consecuencia de transfusiones sanguíneas (o de derivados), embarazos (o abortos) o, cada día más frecuente, trasplantes previos fracasados. Cuando el suero del receptor reacciona contra más del 50-75% de los linfocitos del panel se considera que el paciente está hiperinmunizado, una situación que marca significativamente el pronóstico de un futuro trasplante. Estos pacientes tienen menos posibilidades de trasplantarse (es decir, de encontrar un donante en el que la prueba cruzada sea negativa), menor supervivencia del injerto en caso de realizarse un trasplante y menor supervivencia del paciente. Dada la importancia de esta situación, se precisa una evaluación periódica del suero de los posibles receptores en busca de estos anticuerpos, así como estudios adicionales tras estímulos antigénicos, fundamentalmente transfusiones sanguíneas (a los 15-30 días de realizarlas). Es importante tener en cuenta que cuando un paciente desarrolla anticuerpos contra un estímulo antigénico, como una transfusión, aunque estos desaparezcan en 1 ó 2 meses seguirá existiendo la memoria inmunológica y por tanto el riesgo será más elevado que el de un paciente que nunca haya desarrollado anticuerpos. De ahí la importancia de determinar anticuerpos siempre tras cualquier estímulo alogénico de los mencionados anteriormente.
El PRA empleado hasta hace pocos años se basaba en la prueba clásica de citotoxicidad. Actualmente, se emplea el PRA calculado (cPRA) en función de los resultados de las especificidades detectadas con el Luminex (ver más adelante). El cPRA se basa en antígenos HLA prohibidos, identificados por la presencia de anticuerpos anti-HLA en el suero de los receptores en lista de espera. Se calcula a partir de las frecuencias de antígenos HLA de la población y representa el porcentaje de los posibles donantes de riñón que expresan al menos uno de los antígenos prohibidos [12].
Además del número de donantes contra el que reacciona un suero, es necesario conocer la máxima dilución a la que siguen actuando dichos anticuerpos, es decir, su título. Cuando un anticuerpo se presenta a títulos altos reacciona no sólo contra el antígeno contra el que va dirigido, sino también contra otros antígenos que muestran cierta similitud a nivel molecular (a nivel de epítopos, lo que se conoce como grupos de reacción cruzada). Sólo cuando desciende el título de anticuerpos y se reducen estas reacciones cruzadas se limita su espectro de reactividad. En esta situación, es posible definir las especificidades antigénicas que deben ser evitados si se pretende realizar un trasplante.
La técnica de linfocitotoxicidad ha sido reemplazada por las técnicas de fase sólida (excepto para la prueba cruzada), que veremos a continuación, las cuales, aunque son sensiblemente más caras permiten una mayor rapidez en la obtención de los resultados y, sobre todo, mayor sensibilidad y mejor caracterización de los anticuerpos presentes en el suero. Aunque se han venido empleando ensayos como el ELISA, sólo se explica aquí la técnica de luminex
Detección de anticuerpos por citometría de flujoEsta técnica detecta la presencia de anticuerpos anti-HLA mediante el uso de anticuerpos frente a inmunoglobulinas humanas conjugados a fluorocromos, sin necesidad de que el complemento se fije. El empleo de fluorescencia hace a esta técnica mucho más sensible que la de la citotoxicidad dependiente de complemento (CDC) clásica. En un principio, este método utilizaba, como en la CDC, un panel de linfocitos T (clase I) y B (clase II). Pero para evitar la dependencia de linfocitos, se han desarrollado sistemas basados en micropartículas de poliestireno que llevan fijadas en su superficie moléculas HLA de clase I o II. Aunque existen métodos con micropartículas para emplear en un citómetro convencional, la tecnología de citometría implantada en los laboratorios de histocompatibilidad desde 2003 es la automatizada del Luminex® por su reproducibilidad y sensibilidad. Se basa en el empleo de una suspensión de 100 micropartículas al mismo tiempo con una mezcla de fluorocromos, que llevan en su superficie moléculas HLA purificadas a partir de líneas celulares linfoblásticas. Los anticuerpos anti-HLA se fijan a la molécula HLA correspondiente y se ponen de manifiesto mediante una inmunoglobulina anti-IgG, marcada con un fluorocromo. Cuando la solución de partículas pasa por el citómetro, los haces de láser revelan por una parte el fluorocromo (señal positiva) y por otra el color de la microesfera al que está asociado (especificidad). El sistema informático asociado interpreta estas señales, emitiendo un resultado de presencia o ausencia de anticuerpos anti-HLA [13]. Existen diversos reactivos Luminex, tanto para el escrutinio de anticuerpos (determinar únicamente si existen anticuerpos contra clase I o contra clase II); como para el estudio de las especificidades (contra qué antígenos concretos van dirigidos). De este modo, en un solo tubo podemos realizar estudios complejos de forma semiautomática.
Una ventaja de la citometría de flujo es que permite cuantificar objetivamente la concentración de los anticuerpos anti-HLA mediante la intensidad media de fluorescencia que alcanza el suero (mean fluorescence intensity [MFI]). Esto, por tanto, sería algo similar (aunque no igual) al título de anticuerpos que se obtiene haciendo diluciones en los estudios clásicos de linfocitotoxicidad. Se supone que cuanto más alto sea el MFI de un anticuerpo, mayores posibilidades de que ese anticuerpo sea dañino para el injerto. Sin embargo, el gran problema en la actualidad es que no existe un criterio común entre los diferentes laboratorios para definir qué nivel de anticuerpos (MFI) es relevante y cual no lo es, de forma que cada laboratorio tiene que establecer su punto de corte de MFI (que puede oscilar entre 500 y 3000 aproximadamente) [14]. En realidad el resultado que aporta Luminex no es dicotómico (negativo/positivo) y depende en gran medida de condiciones del laboratorio. A pesar de este problema aun por resolver, el Luminex se ha convertido hoy en día en el estándar en la mayoría de los laboratorios de histocompatibilidad. En un documento resumen de la metodología Luminex y los parámetros empleados en los laboratorio de Inmunología de España, el punto de corte más frecuentemente empleado para definir una positividad resultó ser de 1500 MFI [15]. En todo caso, la consideración de positividad/negatividad no sólo depende de la MFI, sino también del contexto clínico y del riesgo asumible a sufrir un rechazo mediado por anticuerpos. Más bien, en el caso de un paciente hipersensibilizado, se tiene en cuenta el descenso de las MFI en los tratamiento desensibilizantes pretrasplante.
El Luminex permite conocer de forma muy detallada cuales son las especificidades antigénicas contra las que reacciona el receptor (antígenos prohibidos) y cuales contra las que no reacciona (antígenos permitidos), definiendo muy claramente qué donantes podrían ser compatibles con el receptor a priori, incluso antes de hacer la prueba cruzada [16]. En ocasiones, un nivel elevado de anticuerpos anti-HLA puede dar un resultado negativo de Luminex por el denominado efecto prozona en el que el exceso de anticuerpo anti-HLA impide la formación del complejo con las microesferas con el antígeno HLA en infravaloren el nivel de anticuerpos anti-HLA.
La gran cantidad de información que aporta Luminex, que resulta en la detección de numerosos anticuerpos, puede complicar la selección de donantes [17]. Para solventar esta situación se han desarrollado programas informáticos (p. Ej. HLA Matchmaker) basados en el análisis de los epítopos característicos de cada molécula de HLA (eplets comentados anteriormente), y las características de los anticuerpos detectados por Luminex [18]. Así, podemos precisar el grado de compatibilidad que existe entre los epítopos del donante, los del receptor y las especificidades de los anticuerpos presentes en Luminex, lo cual ayuda a mejorar las búsquedas de donantes para pacientes polisensibilizados [19].
Prueba cruzadaLa prueba cruzada consiste en el análisis de la sensibilización humoral específica del receptor contra el donante. Esta técnica, basada también en la prueba de microlinfocitotoxicidad de Terasaki e instaurada a mediados de la década de 1960, es obligatoria antes de la realización del trasplante. Con ella se consiguió reducir la frecuencia de rechazo hiperagudo hasta valores mínimos.
Prueba cruzada clásica por citotoxicidadEn esencia, esta prueba consiste en la incubación de suero del receptor con linfocitos del donante; si se produce la lisis celular (tras la incubación con complemento de conejo) se interpreta que existen anticuerpos en el suero del receptor específicos contra el donante y un riesgo elevado de rechazo hiperagudo. Esta situación se considera una contraindicación absoluta para la realización del trasplante. Habitualmente la prueba se lleva a cabo con el suero que históricamente haya mostrado una mayor reactividad y con el más reciente, congelados previamente. Cabe la posibilidad de que exista reactividad en sueros recogidos un tiempo atrás, sin que pueda detectarse en sueros más recientes. Esta situación, que se suele definir como prueba cruzada histórica positiva y actual negativa tiene una especial significación y su interpretación es discutida, aunque en general puede aceptarse la realización del trasplante cuando la prueba cruzada con suero actual es negativa y se detecta reactividad en sueros antiguos de más de un año.
La CDC clásica al emplear linfocitos (mayoritariamente linfocitos T que expresan HLA-I pero no HLA-II), pueden no detectar los anticuerpos anti-HLA-II. Para evitarlo, se puede emplear la CDC con linfocitos T (HLA-I) y con linfocitos B (HLA-II) separados previamente mediante aislamiento magnético con anticuerpos.
En ocasiones pueden existir anticuerpos no linfocitotóxicos (que no producen una prueba cruzada positiva) que sean nocivos para el injerto. Esto puede ser debido a la existencia de anticuerpos anti-HLA no reconocidos y/o de baja afinidad, o a la de diferentes anticuerpos no dirigidos contra el sistema HLA, entre los cuales los más importantes son los anticuerpos dirigidos contra el sistema antigénico endotelio-monocítico. Entre estos anticuerpos han adquirido importancia los anticuerpos anti-MICA. MICA codifica en la misma región del cromosoma 6 humano que HLA y también es polimórfico, por lo que funciona como un aloantígeno, capaz de generar una alorrespuesta humoral [20]. Sin embargo, sólo se expresa en células endoteliales, especialmente tras activación, por lo que no se pueden detectar en una prueba cruzada convencional. Los anticuerpos anti-MICA también pueden detectarse por tecnología de Luminex®, aunque su verdadera relevancia no está claramente establecida. A pesar de no existir evidencia suficiente, es posible que el estudio de anticuerpos dirigidos frente a antígenos no-HLA en el suero de pacientes en lista de espera se implemente en la práctica clínica, puesto que se están demostrando especificidades de estos anticuerpos no-HLA relacionados en rechazo (por ejemplo, anticuerpos anti-AT1R, - perlecan, -endotelio, etc.).
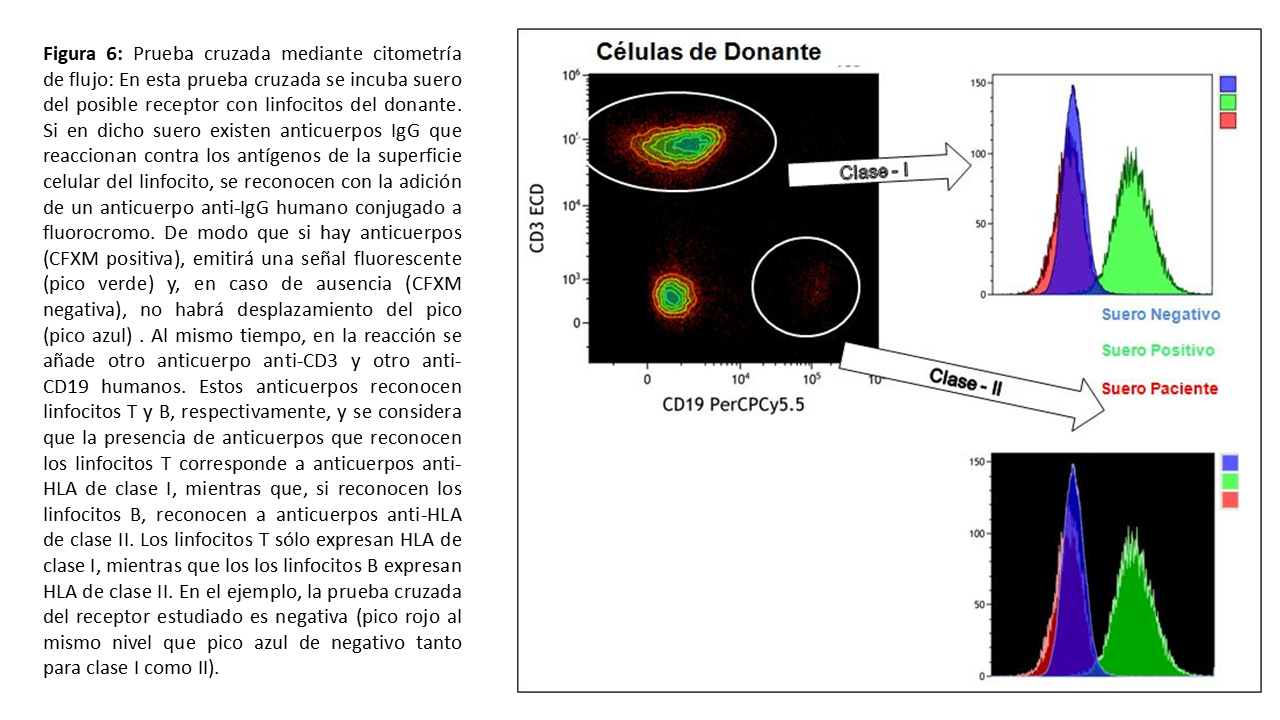
Prueba cruzada por citometría de flujoCuando se sospeche la existencia de anticuerpos anti-HLA a pesar de una prueba cruzada negativa, es posible aumentar la sensibilidad de la técnica aumentando el período de incubación (1 h la primera fase y 2 h la segunda) o bien añadiendo anticuerpos antiinmunoglobulina humana (para detectar aquellos anticuerpos incapaces de activar el complemento). Sin embargo, el método más sensible es la realización de la prueba cruzada por citometría de flujo, capaz de detectar anticuerpos en títulos muy bajos y anticuerpos que no activen el complemento. En esta prueba, se enfrentan los linfocitos del donante con el suero del receptor y, en caso de haber anticuerpos anti-HLA en el suero, se revelan en un citómetro de flujo tras añadir un anticuerpos anti-IgG conjugado a fluorocromo. Se diferencia entre anticuerpos anti-HLA de clase I o de clase II, al combinar la tinción para linfocitos T (clase I) o linfocitos B (clase II). Es un método que reduce la subjetividad y variabilidad de la CDC por complemento, puesto que se mide en función del cambio de canal de fluorescencia (Mean Channel Shift) en el citómetro (Figura 6). Aunque no está claro si los anticuerpos detectados con este método son realmente nocivos, parecen relacionarse con rechazos más frecuentes y más graves, así como con menor supervivencia a medio plazo, sobre todo en aquellos pacientes que perdieron un primer trasplante de forma precoz y en pacientes sensibilizados previamente al trasplante [21]. En estos pacientes de alto riesgo es aconsejable la realización de la prueba cruzada por uno de estos métodos para asegurarse de la ausencia de sensibilización. Y en todo caso, se recomienda realizarla en todo trasplante renal con donante vivo junto con la prueba cruzada con CDC.
Prueba cruzada virtualCuando se hace un análisis detallado de los anticuerpos presentes en un suero con las técnicas de fase sólida se puede predecir si ese suero va a reaccionar contra las células de un determinado donante, una vez conocidos los antígenos HLA del mismo. Si el donante tiene alguno de los antígenos prohibidos definidos en el receptor la prueba cruzada será previsiblemente positiva y esto es lo que se llama prueba cruzada virtual (PCv) positiva [22] [23]. Esto permite ganar tiempo y poder tomar la decisión de si un órgano es válido para un receptor que se encuentre en otra ciudad (o país), sin tener que enviar linfocitos del donante ni hacer la prueba cruzada por citotoxicidad (al menos en la fase inicial). Esta es la base del programa actual de hipersensibilizados coordinado por la Organización Nacional de Trasplantes (ONT), denominado PATHI así como del programa de Donación Renal Cruzada. La experiencia de España en prueba cruzada virtual a nivel Nacional está basada en el Programa de Trasplante Cruzado. Este último programa se fundamenta en un algoritmo matemático que detecta posibles intercambios entre los donantes de parejas donante-receptor incompatible. La selección de las nuevas parejas se basa en el cruce entre el tipaje de los donantes y la ausencia de anticuerpos anti HLA entre los receptores, con grupo compatible. Una vez realizada la prueba cruzada virtual, se establece un score de priorización para no penalizar al grupo sanguíneo O y para facilitar el trasplante al receptor inmunizado. Esta aproximación ha permitido incluso realizar trasplantes cruzados internacionales [24].
Por su parte, en el PATHI cuando un hospital que participa en el plan (o pertenece a un centro de trasplante renal adscrito al programa) tiene un donante en muerte encefálica o, más recientemente un donante en asistolia, que cumple los criterios clínicos establecidos, ofertará uno de sus riñones. Para ello, el coordinador informará al inmunólogo de la existencia de un donante para incluir en el PATHI, con la mayor celeridad posible para que el inmunólogo realice el tipaje del donante y no se retrase el procedimiento.
El inmunólogo responsable en el centro donante o centro de referencia de trasplante renal, una vez realizado el tipaje del donante entrará en la aplicación, buscará la información correspondiente al registro de dicho donante (incluida previamente por el coordinador del centro o por la ONT, en función de la política de trabajo habitual) e introducirá la información correspondiente a los loci HLA establecidos en el programa (HLA-A, -B, -C, -DR, -DQ). Acto seguido, le pedirá a la aplicación que cruce los datos de este donante con el pool de receptores y obtendrá un listado de resultados (tanto en caso afirmativo como negativo). En caso de obtener más de un receptor, elegirá aquel que tenga una mayor puntuación, en base a los criterios decididos en el programa. Tendrá acceso, en todo caso, a toda la información referente a los receptores seleccionados, para una mejor evaluación del resultado.
Es preciso tener en cuenta que debido a la gran sensibilidad de las técnicas de fase sólida es frecuente encontrar casos con PCv positiva en los que luego la PC por CDC sea negativa. En estos casos es difícil tomar la decisión de trasplantar o no. Si la PC por CDC es negativa es casi imposible que se produzca rechazo hiperagudo, pero si la PCv es positiva es probable que acabe produciéndose un rechazo agudo o crónico mediado por anticuerpos por lo que hay que valorar el riesgo en cada paciente, en función de las características de los anticuerpos responsables de esa PCv positiva [25]. En gran medida la causa de esta discordancia entre la PCv y la CDC puede radicar en que el Luminex mide anticuerpos dirigidos frente a moléculas HLA desnaturalizadas y/o recombinantes que no presenta los epítopos conformacionales de las moléculas HLA intactas.
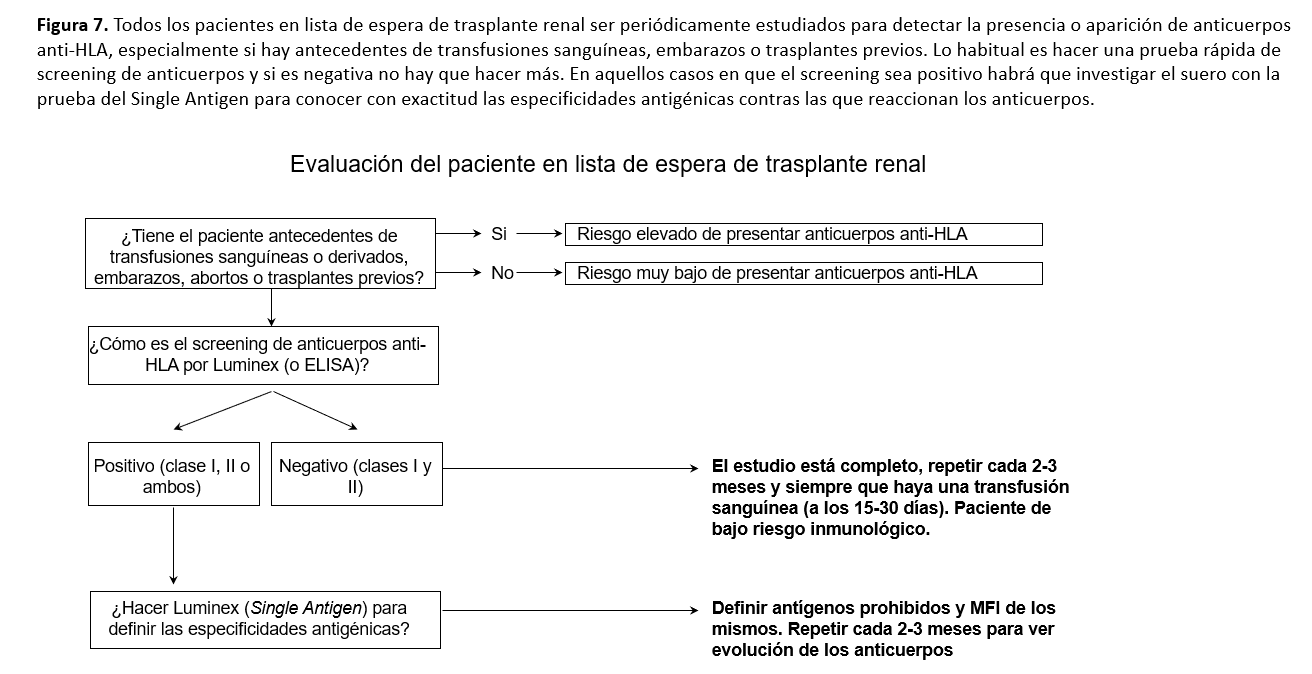
EVALUACIÓN DEL PACIENTE EN LISTA DE ESPERA DE TRASPLANTE RENALLa (Figura 7) resume los pasos que hay que seguir en la evaluación del paciente en lista de espera de trasplante renal con respecto a los anticuerpos anti-HLA. Los pacientes que no tengan antecedentes de transfusiones, embarazos o trasplantes tendrán un riesgo muy bajo de desarrollar anticuerpos anti-HLA, pero en cualquier caso deberán tener al menos una determinación de anticuerpos antes del trasplante (al menos en los tres meses anteriores). Aquellos con eventos inmunizadores previos tienen riesgo de haber desarrollado anticuerpos. La prueba de escrutinio por Luminex permitirá saber de forma rápida y relativamente barata si existen o no; en caso de que sea negativa no hay, en principio, que hacer más estudios y se deberá repetir periódicamente. En los pacientes con prueba de cribado positiva es preciso hacer la prueba de Single Antigen para determinar las especificidades contra las que van dirigidos los anticuerpos y poder definir los antígenos prohibidos y los antígenos permitidos, que deberán quedar reflejados en la ficha de la lista de espera del paciente. Estas determinaciones se deben repetir aproximadamente cada 3 meses mientras el paciente esté en lista de espera y siempre a los 15-30 días de un evento sensibilizante [26].
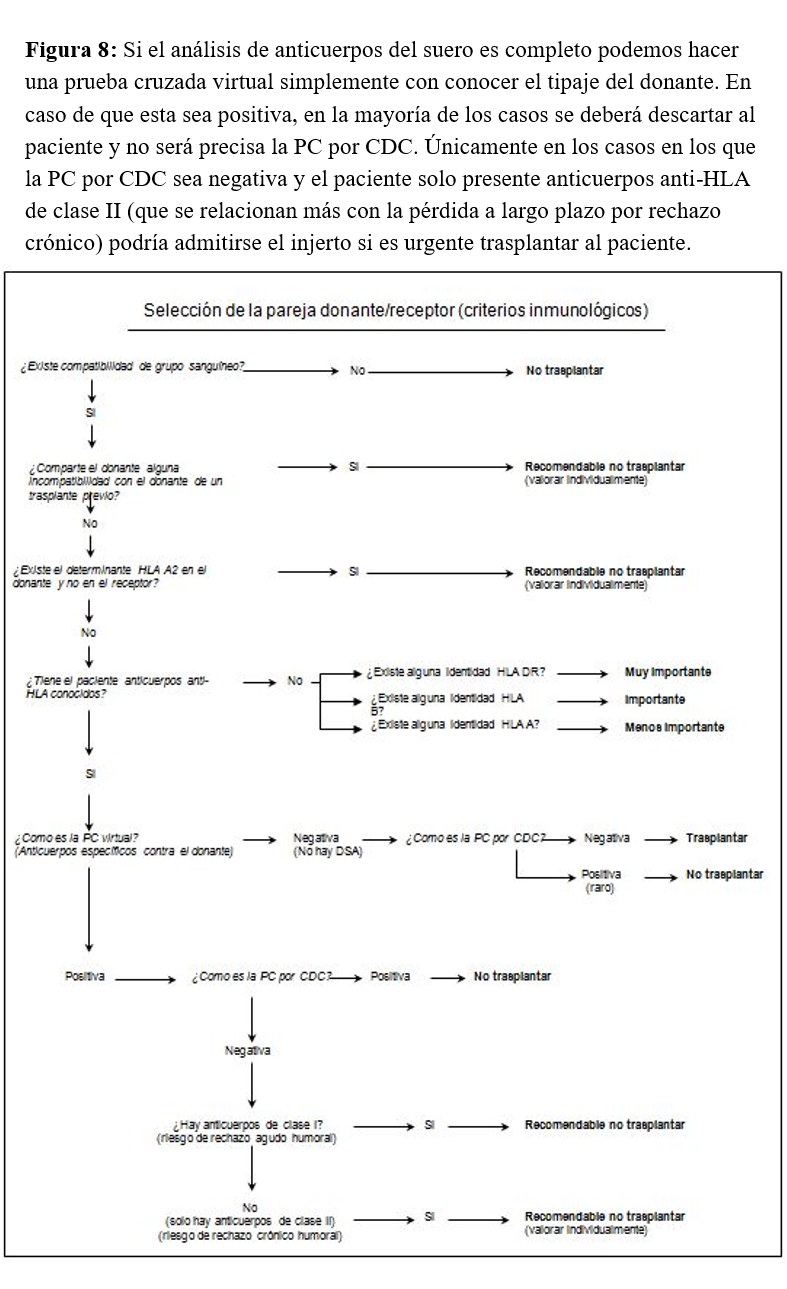
CRITERIOS DE SELECCIÓN DE LA PAREJA DONANTE/RECEPTORLa selección del receptor adecuado es un proceso complejo en el que se tienen en cuenta factores inmunológicos y no inmunológicos (edad, tiempo en diálisis, trastornos asociados, etc.). El aspecto inmunológico es de suma importancia, especialmente en pacientes hiperinmunizados y retrasplantados, sobre todo aquellos que perdieron un primer injerto de forma precoz por rechazo agudo. En la (Figura 8) se muestra un algoritmo orientativo de aquellos factores que es preciso tener en cuenta durante este proceso y de su importancia.
Existen dos factores que son prácticamente condición imprescindible para la realización del trasplante: la compatibilidad (preferiblemente identidad) de grupo sanguíneo y la negatividad de la PC por CDC. Aunque la PC sea negativa en aquellos pacientes que hayan perdido un trasplante previo, se recomienda no utilizar donantes que compartan incompatibilidades con el primer trasplante, ya que existe la posibilidad de sensibilización previa contra alguno de estos antígenos que no haya sido detectada en los estudios previos de anticuerpos ni por la prueba cruzada.
Los pacientes hiperinmunizados o con trasplantes previos son dos grupos de receptores de alto riesgo inmunológico. En ellos la posibilidad de rechazo grave (hiperagudo, acelerado o agudo), bien por anticuerpos preformados o por memoria inmunológica, es alta, y es muy importante encontrar donantes con elevada compatibilidad HLA. Estos son los pacientes que se incluyen en programas de intercambio como el PATHI. El trasplante de vivo puede ser una opción para estos pacientes cuando hay un donante emparentado con alta compatibilidad HLA, o bien aplicando tratamientos desensibilizantes. Actualmente, se ha impulsado la opción de donación renal cruzada no sólo para pacientes hipersensibilizados, sino también para aquellos con incompatibilidad de grupo sanguíneo.
La existencia de compatibilidad HLA es un factor que influye sensiblemente en la supervivencia del injerto a medio y largo plazo en todo tipo de receptores. Este efecto es independiente del tipo de inmunosupresión utilizado. Sin embargo, no es homogéneo para los diferentes loci del sistema HLA. Así, la existencia de compatibilidad en el locus DR ha demostrado la mayor influencia en dicho parámetro, seguido de la compatibilidad en el locus B. La compatibilidad en el locus A prácticamente no influye en la supervivencia del injerto (aunque puede tener importancia a la hora de evaluar el riesgo de sensibilización tras la pérdida del injerto, como ya se comentó). Hay que intentar conseguir una elevada compatibilidad en el locus DR y secundariamente en el B. En los últimos años, con las nuevas metodologías, han aparecido evidencias acerca de la importancia del locus DP y DQ en la supervivencia del injerto y el pronóstico del trasplante renal [27].
SEGUIMIENTO POSTRASPLANTETras el trasplante renal, la aparición de anticuerpos anti-HLA específicos contra alguno de los antígenos del donante (anticuerpos específicos de donante [DSA]) es uno de los criterios, junto con los datos histológicos de la biopsia renal, para el diagnóstico del rechazo mediado por anticuerpos o rechazo humoral (agudo o crónico), una situación que se diagnostica cada vez con más frecuencia, por lo que dichos anticuerpos deben buscarse específicamente en los pacientes en los que se sospeche este diagnóstico. Las técnicas de fase sólida permiten obtener los resultados de manera rápida, lo que resulta esencial para tomar decisiones terapéuticas. Aunque no está claramente definida la indicación de buscar sistemáticamente la aparición de anticuerpos anti-HLA en pacientes trasplantados en fase estable, si que parece clara su conveniencia en pacientes con aparición reciente de proteinuria o deterioro progresivo de la función renal y también en aquellos pacientes en los que se haga un cambio terapéutico que implique riesgo de disminución de la inmunosupresión, como ocurre tras la retirada de esteroides o tras la conversión a un imTOR [28] [29] [30].
En los últimos años ha adquirido importancia la presencia de anticuerpos anti-HLA fijadores de complemento y los métodos comerciales son capaces de determinar si los anticuerpos fijan C1q o C3 [31]. La presencia de estos anticuerpos parecen asociarse a peor función y supervivencia del injerto renal [32]. De forma paralela, también se han implicado las subclases IgG3 e IgG1 de estos anticuerpos por fijar complemento de forma más efectiva, aunque hasta el momento no existen métodos comerciales validados para su medición [33].
Además de los anticuerpos anti-HLA, otros aloanticuerpos han sido investigados como responsables del rechazo mediado por anticuerpos. Muchos de ellos son de antígenos expresados por células endoteliales y no linfocitos (MICA, AT1R, anticuerpos anti-endoteliales, GSTT, etc.). No obstante, aún no existe evidencia suficiente, ni los métodos han sido validados, para implantar su uso en la rutina de monitorización del trasplante [34]. Su empleo se limita más bien a aquellos casos de sospecha de rechazo mediado por anticuerpos en los que no se detecta la presencia de anticuerpos anti-HLA en suero [35].